Method Article
בידוד ותרבית של מקרופאגים שמקורם במח עצם מעכברים
In This Article
Summary
הפרוטוקול הנוכחי מתאר את הבידוד והתרבית של מקרופאגים שמקורם במח עצם מעכברים.
Abstract
למקרופאגים יש תפקידים משפיעים חשובים בהומאוסטזיס ובדלקת. תאים אלה נמצאים בכל רקמה בגוף ויש להם יכולת חשובה לשנות את הפרופיל שלהם בהתאם לגירויים הקיימים במיקרו-סביבה. ציטוקינים יכולים להשפיע עמוקות על הפיזיולוגיה של המקרופאגים, במיוחד IFN-γ ואינטרלוקין 4, ולייצר סוגי M1 ו-M2 בהתאמה. בגלל הרבגוניות של תאים אלה, ייצור אוכלוסייה של מקרופאגים שמקורם במח עצם יכול להיות צעד בסיסי במודלים ניסיוניים רבים של ביולוגיה של התא. מטרת פרוטוקול זה היא לסייע לחוקרים בבידוד ובתרבית של מקרופאגים שמקורם באבות מח עצם. אבות מח עצם מעכברי C57BL/6 נטולי פתוגן הופכים למקרופאגים עם חשיפה לגורם מגרה מושבת מקרופאגים (M-CSF) אשר, בפרוטוקול זה, מתקבל מהסופרנאטנט של שושלת הפיברובלסטים L-929. לאחר הדגירה, מקרופאגים בוגרים זמינים לשימוש מהיוםה-7 עד היוםה-10 . בעל חיים בודד יכול להיות המקור של בערך 2 x 107 מקרופאגים. לכן, זהו פרוטוקול אידיאלי להשגת כמויות גדולות של מקרופאגים ראשוניים באמצעות שיטות בסיסיות של תרבית תאים.
Introduction
מונוציטים ומקרופאגים הם פאגוציטים חד-גרעיניים שניתן להפיק מאבות במוח העצם. מחקרים אחרונים דיווחו כי מקורם של מקרופאגים גם באבות אריתרו-מיאלואידים שמקורם בשק חלמון1. ללא קשר לגזירה שלהם, לויקוציטים אלה יש פונקציות השפעה חשובות בהומאוסטזיס ודלקת 2,3. מונוציטים הם תאים מדם היקפי שיכולים להתמיין עוד יותר למקרופאגים ברקמה 2,4, ואילו מקרופאגים הם תאים הטרוגניים המציגים פנוטיפים ותפקודים המווסתים על ידי חשיפה מקומית של גורמי גדילה וציטוקינים5. מאחר שהמקרופאגים מראים מגוון תפקודי כזה, הם נחקרו במודלים רבים של מחלות. כך הפכה תרבית המקרופאגים לכלי חשוב להבנת הפיזיולוגיה שלהם ותפקידם במחלות שונות. מח העצם הוא מקור חשוב לתאי אב, כולל אבות מקרופאגים, שניתן לבודד ולהכפיל, מה שמגדיל באופן אקספוננציאלי את מספר המקרופאגים המתקבלים. בנוסף, מקרופאגים שמקורם במח עצם חשובים במיוחד כדי למנוע את ההשפעות הנוצרות על ידי מיקרו-סביבה של רקמות, שכן מקרופאגים משנים את הפנוטיפ שלהם בתגובה לגירויים שונים ברקמות 6,7. אבות מח עצם הופכים למקרופאגים עם חשיפה לגורם מגרה מושבת מקרופאגים (M-CSF)8. לא ניתן להבדיל בין מקרופאגים שמקורם במח עצם לבין מקרופאגים שמקורם במונוציטים על ידי סמנים ביוכימיים ברקמות. תאים אלה מייצגים אוכלוסייה הומוגנית מאוד של תאים ראשוניים, שבמובנים רבים אחרים דומים למקרופאגים פריטוניאליים 6,9.
בגלל מערך התפקודים התאיים ההטרוגניים שלהם, מקרופאגים נחקרו זה מכבר ביסודיות על ידי חוקרים. תאים אלה יכולים לשמש במודלים ניסיוניים שונים, כולל מחלות זיהומיות ודלקתיות, כפי שהם מופיעים בתהליכים אלה10,11. הם יכולים גם להיות שימושיים לחקר קיטוב המקרופאגים בתגובה לגירויים מיקרו-סביבתיים שונים12,13. לפיכך, פרוטוקול פשוט ואמין מסופק כאן לצורך קבלת מספר גבוה של מקרופאגים ראשוניים ממח עצם עכבר.
Protocol
פרוטוקול זה בוצע בהתאם למועצה הלאומית לפיקוח על ניסויים בבעלי חיים (Concea) ובאישור ועדת האתיקה והשימוש בבעלי חיים (CEUA). עכברי C57BL/6 נרכשו מחברת Biotério Central של האוניברסיטה הפדרלית של מינאס ז'ראיס (UFMG), בלו הוריזונטה, ברזיל. יש להשתמש בציוד מגן אישי (PPE) כגון מעילי מעבדה, כפפות והגנה על העיניים בכל השלבים המתוארים בפרוטוקול זה.
1. הכנת פיברובלסט L-929 שושלת סופרנאטנט כמקור ל-M-CSF
- הפשיר תאי שושלת פיברובלסטים L-929 (American Type Culture Collection Certified Cell Line-ATCC CCL1) והתחל את תהליך התרבית באופן מיידי כדי לשמר את הכדאיות.
- בארון בטיחות ביולוגית של זרימה למינרית, באמצעות פיפטה של 1,000 מיקרוליטר, מעבירים את תאי השושלת הפיברובלסטית L-929 מהבקבוקון לצינור צנטריפוגה סטרילי בנפח 50 מ"ל.
- השתמש פיפטה סרולוגית כדי להוסיף 50 מ"ל של מלוחים סטריליים חוצצים פוספט (PBS), ללא סידן ומגנזיום.
- צנטריפוגה ב 300 x גרם, 4 ° C למשך 10 דקות. השליכו את הסופרנטנט.
- יש להשהות מחדש את הגלולה ב-20 מ"ל של Dulbecco′s Medium-F12 בתוספת 10% נסיוב בקר עוברי (FBS) ו-1 מ"ל פניצילין/סטרפטומיצין (P/S) (DMEM/F12-10) באמצעות פיפטה סרולוגית.
- העבר את התאים המרחפים מחדש לצלוחית תרבית תאים T75.
- יש לדגור באינקובטור של 37°C, 5% CO2 עד למפגש מלא.
הערה: בעת מניפולציה של הצלוחית, היזהר להימנע מהרטבת הכיסוי בתמיסה, מכיוון שזה יכול להיות מקור לזיהום. כדי להשיג כמות נוחה של supernatant, יש צורך לשכפל את התאים לאחר שהם מכסים את פני השטח המלא של בקבוק תרבית התא. תאי L-929 מעוכבים על ידי מגע. תמיסת טריפסין/אתילאנדיאמין טטראצטית חמה (EDTA), DMEM/F12-10 ו-PBS סטרילי עד 37°C כדי להתחיל את הרחבת תרבית התא, כמתואר בשלבים הבאים. - ברגע שמגיעים למפגש מלא, השליכו את הסופרנאטנט מבקבוק תרבית התא, בתוך ארון הבטיחות הביולוגית של הזרימה הלמינרית.
- לשטוף את בקבוק תרבית התא עם 20 מ"ל של PBS סטרילי באמצעות פיפטה סרולוגית ולהשליך את התמיסה.
- הוסף 10 מ"ל של טריפסין/EDTA (0.05% תמיסה) לבקבוק תרבית התאים המכיל את התאים המודבקים.
- מעבירים את בקבוק תרבית התאים מזרימה למינרית לאינקובטורCO2 של 37°C, 5% CO ודוגרים למשך 3 דקות.
- נערו את בקבוק תרבית התאים כדי לנתק את התאים מפני השטח של בקבוק התרבית והשתמשו במיקרוסקופ כדי לוודא שכל התאים נותקו.
- נטרל את פעולת הטריפסין/EDTA (תמיסת 0.05%) עם 10 מ"ל של מדיום DMEM/F12-10.
- מעבירים את התמיסה באמצעות פיפטה סרולוגית לצינור צנטריפוגה סטרילי בנפח 50 מ"ל.
- צנטריפוגה ב 300 x גרם ב 4 ° C במשך 10 דקות. השליכו את הסופרנטנט.
- להשהות את הגלולה ב 10 מ"ל של DMEM / F12-10 בינוני.
- הוסף 1 מ"ל של תרחיף התא לבקבוק תרבית תאים T175 (תרבית 1:10).
- חזור על ההליך כדי להשיג עשר צלוחיות תרבית תאים T175.
- הוסף 50 מ"ל של DMEM/F12-10 לכל בקבוק תרבית תאים.
- יש לדגור באינקובטור של 37°C, 5% CO2 עד למפגש מלא.
הערה: שלבים אלה מבטיחים 500 מ"ל של תא L-929 supernatant. ביום 5, לאחר שהתאים כיסו את משטח הבקבוק של תרבית תאי T175, הסופרנאטנט יועשר עבור M-CSF ויש לאסוף אותו14. - הסר את בקבוק תרבית התאים מהאינקובטור ביום 5 לאחר עיכוב מגע.
- מעבירים את המדיום לצינור צנטריפוגה סטרילי בנפח 50 מ"ל.
- צנטריפוגה ב-3,200 x גרם, ב-4°C למשך 10 דקות.
- אוספים את הסופרנאטנט המועשר ב-M-CSF ומעבירים את התמיסה לצינור צנטריפוגה סטרילי בנפח 50 מ"ל. יש לאחסן במקפיא בטמפרטורה של -20°C.
הערה: צנטריפוגה חשובה ביותר לסילוק תאים ופסולת מהסופרנאטנטים. - סופרנאטנט L-929 הוא מקור נוח וזול לגורם מגרה מושבת מקרופאגים (M-CSF) ובדרך כלל מכיל 5 עד 10 ננוגרם/מ"ל של M-CSF8. סופרנאטנטים אלה מכילים גם כמויות זעירות של ציטוקינים אחרים וגורמי גדילה, אך אין להם השפעה עמוקה על הפיזיולוגיה של המקרופאגים15. עם זאת, ניתן לרכוש M-CSF מטוהר ולהשתמש בו כחלופה לסופרנאטנטים L-929 בריכוזים של 1 עד 2 ננוגרם/מ"ל8.
2. הסרת עצם הירך והטיביה
- המשך עם המתת חסד של עכבר זכר מסוג C57BL-6 בן 8 שבועות על ידי פריקת צוואר הרחם לאחר חנק פחמן דו חמצני, בהתאם להחלטה נורמטיבית מספר 18 של המועצה הלאומית לניסויים בבעלי חיים (Concea) ובאישור ועדת האתיקה והשימוש בבעלי חיים (CEUA).
- השרו את העכבר בתמיסת אתנול 70% והשתמשו במספריים סטריליים כדי לבצע חתך של 1 ס"מ לאורך הבטן.
- יש להסיר את העור עד לחשיפה מלאה של שריר הרגליים האחוריות.
- הסר את הרגליים האחוריות בגובה הירך, נזהר לא לשבור את עצם הירך ואת השוקה.
- שים את הרגליים האחוריות בצינור צנטריפוגה חרוטי עם תמיסת אתנול 70%.
הערה: השתמש תמיד בעכברים ללא פתוגנים. הקפד לאסוף את שתי הרגליים כדי להשיג מספר גדול יותר של תאים. שלב 2 מבוצע בסביבה לא סטרילית (benchtop). לכן, חשוב להסיר את עצם הירך ואת השוקה בזהירות כך שהם יישארו שלמים כדי למנוע זיהום חיידקי. השלבים הנותרים של הליך זה מתבצעים בארון בטיחות ביולוגית זרימה למינרית. זמן החשיפה של הרגליים לתמיסת אתנול 70% צריך להיות מוגבל ל -10 דקות. אם הזמן ארוך יותר, אבות מח עצם יכולים להיות מושפעים.
3. להשיג אבות מח עצם מן לומן של השוקה ואת עצם הירך
- הסר את הרגליים מתמיסת אתנול 70% והעבר אותן ל- PBS סטרילי.
- שימוש במלקחיים ומגבוני חיטוי להסרת כל השרירים והפאשיה. העצם צריכה להיות נקייה לאחר שלב זה.
- השתמש בלהב אזמל כירורגי סטרילי כדי לחתוך את אפיפיזה העצם בשני הקצוות כדי לחשוף את מח העצם.
- מלאו מזרק 20 מ"ל ב-10 מ"ל PBS סטרילי בתוספת תמיסת 2% פניצילין/סטרפטומיצין וחברו מחט 26 גרם.
- החזיקו את העצם באמצעות מלקחיים אנטומיים ביד אחת, והשתמשו ביד השנייה כדי להחדיר את המחט לחלל העצם. היזהר לא למחוץ את העצם עם המלקחיים.
- שטפו את החלק הפנימי של העצם עם PBS ואספו את מח העצם בצינור צנטריפוגה חרוטי סטרילי. לאחר שלב זה, חלל העצם צריך להיראות לבן.
- צנטריפוגה את התאים שנאספו במשך 10 דקות ב 300 x גרם ב 4 ° C.
- השליכו את הסופרנאטנט והשהו מחדש את גלולת התא ב-1 מ"ל של DMEM/F12-10.
- הומוגניזציה ולהוסיף עוד 9 מ"ל של מדיום DMEM/F12-10 כדי להביא את התאים עד סך של 10 מ"ל.
4. תרבות מקרופאגים
- הוסף 1 מ"ל של אבות התא לכל אחד מכלי פטרי פלסטיק עגולים בגודל 100 מ"מ x 20 מ"מ (סה"כ 10 כלים), ופיזר את התאים על פני הצלחות עם פיפטה כדי לקבל פיזור אחיד. אין להשתמש במנות שטופלו בתרבית רקמות.
- הוסף 9 מ"ל של DMEM/F12-10 בתוספת 20% של תא L-929 supernatant לכל מנה.
- דגירה באינקובטור 37°C, 5% CO2 .
- ביוםהשלישי , יש להוסיף 10 מ"ל של מדיום DMEM/F12-10 בתוספת 20% מהסופרנאטנט של תאי L-929 לכל מנה. בדרך זו, לצלחות התרבית יש כעת סך של 20 מ"ל של מדיום תרבית, מספיק לצמיחת התאים עד סוף הבשלתם.
הערות: אין להשתמש במנות שטופלו בתרבית רקמה מכיוון שמקרופאגים, כתאי דבק טבעיים המסומנים באינטראקציות חזקות עם משטחים, לא יתנתקו בקלות מהתבשיל מאוחר יותר. בדרך כלל, ניתן לזרוע אבות תאים מעכבר אחד (שתי עצמות הירך) ב-10 צלחות תרבית. אבות התא יהפכו למקרופאגים, בהם ניתן להשתמש מיום הדגירה 7 עד 10. אישור ההתבגרות מזוהה על ידי שינויים במורפולוגיה של המקרופאגים. מקרופאגים בוגרים דבקים ומראים מורפולוגיה הטרוגנית, המוסברת על ידי פליטת פסאודופודיה לכיוונים שונים. דוגמאות לתאים בוגרים אלה מוצגות בתוצאות המייצגות.
5. קצירת מקרופאגים
- השליכו את הסופרנאטנטים מכל מנות התרבות.
- לשטוף כל צלחת תרבית עם 10 מ"ל של חם (37 ° C) סטרילי Mg2+ ו Ca2+ PBS חינם.
- השליכו את התמיסה מכל מנה.
- תמיסת דיסוציאציה של תאים לא אנזימטיים מחממים מראש ל-37°C ומוסיפים 3 מ"ל לכל מנה. יש לדגור במשך 10 דקות באינקובטור של 37°C, 5% CO2 . השתמשו במיקרוסקופ הפוך כדי לדמיין אם המקרופאגים מתנתקים מכלי התרבית.
הערה: השימוש בצלחות פלסטיק שאינן מטופלות בתרבית רקמה אמור לאפשר דיסוציאציה קלה של תאים ולהימנע מהצורך לגרד את התאים מהצלחת. - שטפו את הכלים באמצעות פיפטה סרולוגית עם תמיסת הדיסוציאציה התאית הלא אנזימטית שוב ושוב, תוך ביצוע תנועות מעגליות כדי לאשר שכל המקרופאגים מנותקים מהמנה.
- אוספים את התמיסה של כל מנות התרבות יחד לצינור צנטריפוגה חרוטי של 50 מ"ל.
- הוסיפו 10 מ"ל של PBS סטרילי שחומם מראש לצלחות התרבית הריקות והמשיכו כמו בשלב 5.4. הליך זה הוא חזרה על שלב 5.4 ומתכוון להבטיח שכל המקרופאגים נאספים.
- צנטריפוגה ב 300 x גרם, 4 ° C למשך 10 דקות.
- השליכו את הסופרנאטנט והשעו מחדש את הגלולה עם 1 מ"ל DMEM/F12-10. הומוגניזציה לאט ובזהירות למעלה ולמטה באמצעות פיפטה כדי למנוע נזק לתאים.
- הכינו aliquot של 10 μL של תמיסת מקרופאגים מדוללים עם 10 μL של Trypan Blue כדי לספור את התאים באמצעות המוציטומטר.
הערה: ביום 7, כל מנה תפיק בערך 2 x 106 מקרופאגים. משמעות הדבר היא כי עכבר אחד יכול לייצר בערך 2 x 107 מקרופאגים ראשוניים כאשר נקצר בעשר צלחות. מכיוון ש-M-CSF מניע רק את הבשלת המקרופאגים, ההליך מבטיח אוכלוסיית תאים שהיא למעשה רק מקרופאגים וללא לויקוציטים מזהמים אחרים16.
תוצאות
מקרופאגים הם תאים גדולים ודבקים בעלי מאפיינים פיזיולוגיים מיוחדים. הם מראים מגוון של מצגות מורפולוגיות בתרבית בגלל היכולת להיצמד לזכוכית ולפלסטיק, והמורפולוגיה המתפשטת האופיינית שלהם קשורה לפליטה של שלוחות ציטופלזמיות (איור 1). ברגע שאבות מח העצם נחשפים ל-M-CSF מסופרנאטנט תאי L-929 ומתחילים את הטרנספורמציה למקרופאגים בוגרים, הם נדבקים לצלחת פטרי.
איור 2 מראה את הקינטיקה של הטרנספורמציה של אבות מח עצם למקרופאגים בוגרים. ביום 3 מופיעים כמה מקרופאגים לא בשלים, רובם מראים מורפולוגיה טיפוסית של צורה עגולה עם מעט הטלות של קרום (איור 3). למרות שהם משתנים לאורך כל התהליך, 7 ימים נדרשים בדרך כלל כדי להשיג מספר מספיק ובשלות כדי להבטיח יעילות מקסימלית של הפרוטוקול הנוכחי.
בנוסף, מקרופאגים הם פאגוציטים (מאקרו = גדול; פאגוס = לאכול) המסוגלים לבצע פאגוציטים של כמויות גדולות של חלקיקים אנטיגניים או לא אנטיגניים. באופן פנוטיפי, הם מאופיינים על ידי ביטוי של מולקולות פני השטח F4/80 ו CD11b. ניתוח לפי ציטומטריית זרימה מראה שהמקרופאגים המתקבלים באמצעות הפרוטוקול הנוכחי מייצגים אוכלוסייה הומוגנית במונחים של גודל וגרעיניות (איור 4). יתר על כן, 100% מהאוכלוסייה ביטאו F4/80 ו- CD11b, ויצרו אוכלוסייה אחת מוגדרת היטב של תאים. חוץ מזה, ניתוח של פגוציטוזה של טפילי לישמניה עיקריים הראה יכולת עצומה לפאגוציטוזה, מה שמוכיח שהם מקרופאגים בוגרים ומובחנים היטב (איור 5).
הנתונים המיקרוסקופיים המוצגים בעבודה זו התקבלו באמצעות מיקרוסקופ פלואורסצנטי וניגוד פאזה במרכז לרכישה ועיבוד של תמונות (CAPI-ICB/UFMG).

איור 1: תרבית של מקרופאגים שמקורם באבות מח עצם, שמראה מורפולוגיות שונות בזמן שהם נצמדים לצלחת, ביום ה-5. מקרופאגים פולטים שלוחות ציטופלזמיות ארוכות המאפשרות להם לנוע ולבצע פאגוציטים. הבהירות והניגודיות הותאמו לאחר רכישת תמונות באמצעות מסנן 20x של ניגודיות הפרעה דיפרנציאלית (DIC). בר = 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: קינטיקה של טרנספורמציה מאבות מח עצם למקרופאגים בוגרים ביום 1, 3, 5 ו-7. הבהירות והניגודיות הותאמו לאחר רכישת תמונות באמצעות מסנן DIC 20x. בר = 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
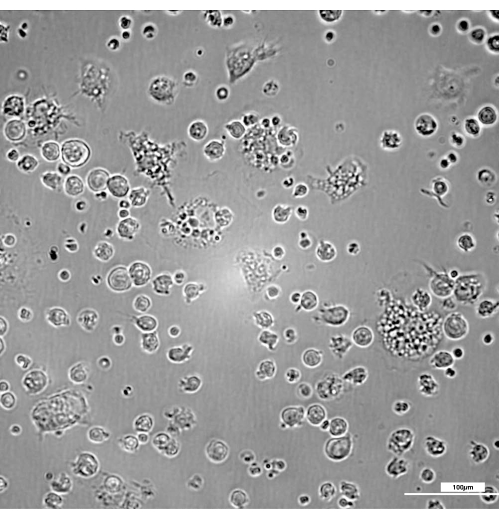
איור 3: נוכחות של מקרופאגים לא בוגרים שנצמדים קלות ביום 3 עם מורפולוגיה טיפוסית בצורת עיגול עם מעט הטלות של ממברנה. הבהירות והניגודיות הותאמו לאחר רכישת תמונות באמצעות מסנן DIC 20x. בר = 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: ניתוח ציטומטריית זרימה של מקרופאגים שמקורם במח עצם. המקרופאגים נותקו מצלחות הכלים (חשפנית תאים) ונצבעו ב-anti-F4/80 FITC ו-anti-CD11b PE-Cy7. (A) היבט התאים בהתבסס על גודל וגרעיניות (FSC x SSC). (B) הביטוי של סמני תאים F4/80 ו-CD11b. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
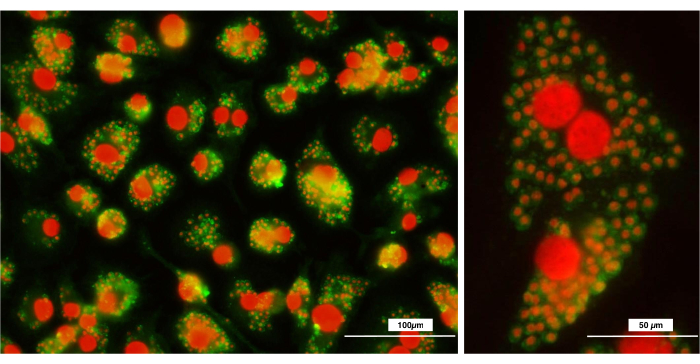
איור 5: ניתוח מיקרוסקופיה פלואורסצנטית לאחר פגוציטוזה של טפילי לישמניה עיקריים . המקרופאגים נותקו מהלוחות ונזרעו על כיסויי זכוכית עגולים, אליהם נוספו טפילי לישמניה גדולים . האיור מראה את הטפילים הפאגוציטוזים בתוך המקרופאגים. טפילי לישמניה עיקריים הוכתמו בנוגדנים FITC נגד לישמניה וגרעיני תאים (מקרופאגים ולישמניה מז'ור) הוכתמו בפרופידיום יודיד. (א) פי 20; (ב) פי 40. בר = 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
יצירת אוכלוסייה של מקרופאגים שמקורם במח עצם היא צעד בסיסי במודלים ניסיוניים רבים של ביולוגיה של התא, במיוחד כאשר חשוב להשיג אוכלוסייה הומוגנית של תאים ראשוניים. כאמור, אבות התא יכולים להפוך למקרופאגים רק בנוכחות M-CSF. סופרנאטנטים של תאי L-929 יכולים לשמש כמקור העיקרי של M-CSF. מלבד העלות, אין בעיה להשתמש רקומביננטי M-CSF עצמו 8,17. ישנן עדויות לכך שמקרופאגים רקומביננטיים מסוג M-CSF מפגינים אחידות טובה יותר בתרבית; עם זאת, שימוש בסופרנאטנט r-M-CSF או L-929 אינו עושה הבדל משמעותי בביטוי הגנים של סמני מקרופאגים עיקריים ובייצור ציטוקינים15.
תאי אב של מח עצם רגישים מאוד. כדי למנוע זיהום, השימוש במכסה מנוע בטיחות ביולוגית למינרי נקי הוא חיוני. בשלבים הראשונים של פרוטוקול זה, הסרת שריר מפני השטח של העצם מייצרת שאריות שיכולות להיות מקור לזיהום. מומלץ לנקות את מכסה המנוע לפני חיתוך אפיפיזה של העצם וחשיפת מח העצם. ברגע שהאבות יוצאים מחלל העצם, חשוב לזכור לטפל בתאים אלה בזהירות כדי לשמור על סטריליות ויכולת קיום אופטימלית.
עכברי C57BL/6 משמשים בפרוטוקול זה, אך עכברי BALB/C מתאימים באותה מידה. עכברים בגילאי 6-10 שבועות מומלצים לקצירת אוכלוסייה טובה של מקרופאגים שמקורם במח עצם, עם הערכה של 2 x 107 תאים לעכבר. עכברים צעירים יותר מספקים בדרך כלל מספר דומה של תאים, אך עצם הירך הקטנה יותר עשויה להציב אתגרים מסוימים להליך הבידוד. בדרך כלל איננו רואים שונות רבה בין תנובת המקרופאגים מזנים שונים של עכברי בר במחקרים הקודמים שלנו, אך אנו מכירים בכך שזנים מסוימים של עכברי נוקאאוט עשויים להציג שונות מסוימת ביבול 6,8.
הפרוטוקול הנוכחי מתאר דרך אמינה לרכישת מושבת מקרופאגים ראשונית באמצעות L-929 supernatant, טכניקה אשר כבר מבוססת היטב בשימוש על ידי חוקרים במשך שנים רבות18,19. ביחס לשיטות קיימות אחרות, הליך זה מצטיין במספר התאים וההומוגניות של האוכלוסייה, במיוחד בהשוואה למקרופאגים פריטוניאליים. לעתים קרובות מספר המקרופאגים תושבי הצפק אינו מספיק, מכיוון שמיליוני תאים נדרשים בדרך כלל לכל בדיקה, ומקרופאגים הם רק חלק קטן שנמצא בשטיפת הצפק 8,20. שטיפת הצפק מספקת גם סוגי תאים אחרים, כגון לימפוציטים ותאים דנדריטיים, מה שהופך את זה בלתי אפשרי למנוע אינטראקציה ולקבל תרבית של מקרופאגים unstimulated. מאז הצפק יש microenvironment הרבה יותר מורכב מאשר במבחנה, שונות יכולה להיות חיסרון עבור יישומים מסוימים 6,21.
Disclosures
המחברים מצהירים כי אין להם ניגודי עניינים.
Acknowledgements
עבודה זו נתמכה על ידי מענקים מ- Fundação de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG), דרך Rede de Pesquisa em Doenças Infecciosas Humanas e Animais do Estado de Minas Gerais (RED-00313-16) ו- Rede Mineira de Engenharia de Tecidos e Terapia Celular - REMETTEC (RED-00570-16), והמועצה הלאומית הברזילאית לפיתוח מדעי וטכנולוגי (CNPq).
Materials
| Name | Company | Catalog Number | Comments |
| 20-cc syringe | DESCARPACK | SI100S4G | Sterile syringe |
| 26-G needles | BD | 497AQDKT7 | Sterile needles |
| 50-ml conical centrifuge tube | SARSTEDT | 62547254 | Plastic conical tubes suitable for centrifugation |
| 70% ethanol solution | EMFAL | 490 | Ethanol solution for esterilization |
| Anatomical dissection forceps | 3B SCIENTIFIC | W1670 | Maintain in sterile beaker containing 70% ethanol solution |
| C57Bl/6 wild type mouse | Purchased from Biotério Central at Federal University of Minas Gerais | Not applicable | Mice must be specific-pathogen-free, age between 6 and 10 weeks. Mice need be accommodated at least one week earlier for recovering from the stress of transportation |
| Cell culture flask T175 | GREINER | C7481-50EA | T-175 flask, canted neck, surface area 75 cm2, with filter cap, DNase free, RNase free |
| Cell culture flask T75 | GREINER | C7231-120EA | T-75 flask, canted neck, surface area 75 cm2, with filter cap, DNase free, RNase free |
| Disinfecting or baby Wipes? | CLOROX | Not applicable | It helps cleaning the bone |
| Distilled Water | GIBCO | 15230 | Sterile distilled water |
| DMEM/F12-10 | Not applicable | Not applicable | Add 10 mL of Fetal Bovine Serum (FBS) and 1 mL of Penicillin/ Streptomycin (P/S) to DMEM/F12 (q.s.p. 100 mL) |
| DMEM/F12-10 + supernatant of L-929 cells | Not applicable | Not applicable | Add 20% of supernatant of L929 cells culture on DMEM/F-12-10 |
| Dulbecco′s Modified Eagle′s Medium - F12 (DMEM/F12) | GIBCO | 12500096 | DMEM: F-12 Medium contains 2.5 mM L-glutamine, 15 mM HEPES, 0.5 mM sodium pyruvate, and 1200 mg/L sodium bicarbonate.Resuspend powder to 1 liter of distilled water and add 3,7 g of sodium bicarbonate. Adjust pH to 7,2 and filter with 0,22 µM. Storage at 2 - 8 °C freezer |
| Fetal Bovine Serum, certified, heat inactivated, United States (FBS) | GIBCO | 10082147 | Enrichment for DMEM-F12 |
| Hemocytometer | SIGMA-ALDRICH | Z359629 | Used to count macrophages at microscopy |
| L-929 cells | SIGMA-ALDRICH | ATCC # CCL-1 | L-929 is a lineage of mouse fibroblast cells used as a source of macrophage colony stimulating factor (M-CSF) |
| Nikon TI eclipse | NIKON | Not applicable | Nikon TI Eclipse is a fluorescence and phase contrast microscope |
| Non-enzymatic cell dissociation solution | CELLSTRIPER (CORNING) | 25-056-CI | Non-enzimatic cell dissociation solution remove macrophages from the plate without damaging them |
| Non-treated round culture dishes 100 × 20–mm | CORNING | CLS430591 | Do not use tissue culture treated petri dishes or any tissue culture treated plate |
| P3199 Penicillin G Potassium Salt | USBIOLOGICAL | 113-98-4 | Antibiotics |
| Penicillin and streptomycin (P/S) solution | Use 0,26 grams of penicillin and 0,40 grams of streptomycin. Mix with 40 mL of sterile PBS. Inside a horizontal laminar flow cabinet, use a 0,22 µM filter and store aliquots of 1.0 mL in 1.5 ml microfuge tubes in the freezer (-20°C) | ||
| Phosphate Buffered Saline free from Calcium and Magnesium (PBS) | MEDIATECH | 21-040-CM | Sterile |
| S7975 Streptomycin Sulfate, 650-850U/mg | USBIOLOGICAL | 3810-74-0 | Antibiotics |
| Serological pipettes of 10mL or 25 mL | SARSTEDT | 861254001 | Serological pipettes is used volumes higher than 1 mL |
| Sodium Bicarbonate | SIGMA-ALDRICH | 144-55-8 | pH correction for DMEM-F12 |
| Software Nis Elements Viewer | NIKON | Not applicable | NIS-Elements Viewer is a free standalone program to view image files and datasets |
| Sterile PBS and 2% of P/S solution | LABORCRIN | 590338 | Add 1 mL of P/S in 40 mL of sterile PBS |
| Straight iris scissors | KATENA | Not applicable | Maintain in sterile beaker containing 70% ethanol solution |
| Supernatant of L-929 cells | Not applicable | Not applicable | L-929 is a lineage of mouse fibroblast cells used as a source of macrophage colony stimulating factor (M-CSF). L-929 supernatant was obtain from the protocol |
| Surgical Scalpel Blade No.24 Stainless Steel | SWANN-MORTON | 311 | Used for exposing epiphysis from bones |
| Trypan Blue Solution, 0.4% | GIBCO | 15250061 | Trypan Blue Solution, 0.4%, is routinely used as a cell stain to assess cell viability using the dye exclusion test |
| Trypsin/EDTA solution 0,05% | GIBCO | 25300-062 | Used to dissociate cells from culture bottle |
| Water for Injection (WFI) for Cell Culture | GIBCO | A12873 | Sterile and endotoxin-free water |
References
- Gomez Perdiguero, E., et al. Tissue-resident macrophages originate from yolk-sac-derived erythro-myeloid progenitors. Nature. 518 (7540), 547-551 (2015).
- van Furth, R., Cohn, Z. A. The origin and kinetics of mononuclear phagocytes. The Journal of Experimental Medicine. 128 (3), 415-435 (1968).
- Wynn, T. A., Chawla, A., Pollard, J. W. Macrophage biology in development, homeostasis and disease. Nature. 496 (7446), 445-455 (2013).
- Medzhitov, R. Origin and physiological roles of inflammation. Nature. 454 (7203), 428-435 (2008).
- Shapouri-Moghaddam, A., et al. Macrophage plasticity, polarization, and function in health and disease. Journal of Cellular Physiology. 233 (9), 6425-6440 (2018).
- Davies, J. Q., Gordon, S. Isolation and culture of murine macrophages. Methods in Molecular Biology. 290, 91-103 (2005).
- Jin, X., Kruth, H. S. Culture of macrophage colony-stimulating factor differentiated human monocyte-derived macrophages. Journal of Visualized Experiments. (112), e54244 (2016).
- Gonçalves, R., Mosser, D. M. The isolation and characterization of murine macrophages. Current Protocols in Immunology. 111 (1), 1-16 (2015).
- Varol, C., Mildner, A., Jung, S. Macrophages: development and tissue specialization. Annual Review of Immunology. 33, 643-675 (2015).
- Andrés, V., Pello, O. M., Silvestre-Roig, C. Macrophage proliferation and apoptosis in atherosclerosis. Current Opinion in Lipidology. 23 (5), 429-438 (2012).
- Pineda-Torra, I., Gage, M., de Juan, A., Pello, O. M. Isolation, culture, and polarization of murine bone marrow-derived and peritoneal macrophages. Methods in Molecular Biology. 1339, 101-109 (2015).
- Edwards, J. P., Zhang, X., Frauwirth, K. A., Mosser, D. M. Biochemical and functional characterization of three activated macrophage populations. Journal of Leukocyte Biology. 80 (6), 1298-1307 (2006).
- Hamczyk, M. R., Villa-Bellosta, R., Andrés, V. In vitro macrophage phagocytosis assay. Methods in Molecular Biology. 1339, 235-246 (2015).
- Hosoe, S., et al. Induction of tumoricidal macrophages from bone marrow cells of normal mice or mice bearing a colony-stimulating-factor-producing tumor. Cancer Immunology, Immunotherapy. 28 (2), 116-122 (1989).
- Rice, H. M., et al. rM-CSF efficiently replaces L929 in generating mouse and rat bone marrow-derived macrophages for in vitro functional studies of immunity to intracellular bacteria. Journal of Immunological Methods. 477, 112693 (2020).
- Boltz-Nitulescu, G., et al. Differentiation of rat bone marrow cells into macrophages under the influence of mouse L929 cell supernatant. Journal of Leukocyte Biology. 41 (1), 83-91 (1987).
- Weischenfeldt, J., Porse, B. Bone marrow-derived macrophages (BMM): isolation and applications. Cold Spring Harbor Protocols. 2008 (12), (2008).
- Austin, P. E., Mcculloch, E. A., Till, J. E. Characterization of the factor in L-cell conditioned medium capable of stimulating colony formation by mouse marrow cells in culture. Journal of Cellular Physiology. 77 (2), 121-134 (1971).
- Stanley, E. R. Macrophage colony-stimulating factor (CSF-1). Encyclopedia of Immunology. 116 (1983), 1650-1654 (1998).
- Bou Ghosn, E. E., et al. Two physically, functionally, and developmentally distinct peritoneal macrophage subsets. Proceedings of the National Academy of Sciences. 107 (6), 2568-2573 (2010).
- Ray, A., Dittel, B. N. Isolation of mouse peritoneal cavity cells. Journal of Visualized Experiments. (35), e1488 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved