Method Article
Screening della cardiotossicità ad alto rendimento utilizzando monostrati di cardiomiociti pluripotenti indotti da cellule staminali umane mature
In questo articolo
Riepilogo
I cardiomiociti derivati da cellule staminali pluripotenti indotte dall'uomo (hiPSC-CM) offrono un'alternativa all'uso di animali per lo screening preclinico della cardiotossicità. Una limitazione all'adozione diffusa di hiPSC-CMs nello screening preclinico della tossicità è il fenotipo immaturo e fetale delle cellule. Qui sono presentati protocolli per la maturazione robusta e rapida delle hiPSC-CM.
Abstract
I cardiomiociti derivati da cellule staminali indotte umane (hiPSC-CM) sono utilizzati per sostituire e ridurre la dipendenza da animali e cellule animali per i test di cardiotossicità preclinica. Nei formati monostrato bidimensionali, le hiPSC-CM ricapitolano la struttura e la funzione delle cellule muscolari cardiache umane adulte quando coltivate su una matrice extracellulare ottimale (ECM). Una ECM (matrice extracellulare che induce la maturazione-inducendo la maturazione (MECM) derivata da cellule staminali perinatali umane matura la struttura, la funzione e lo stato metabolico dell'hiPSC-CM in 7 giorni dopo la placcatura.
Anche i monostrati maturi di hiPSC-CM rispondono come previsto a farmaci clinicamente rilevanti, con un rischio noto di causare aritmie e cardiotossicità. La maturazione dei monostrati hiPSC-CM è stata un ostacolo all'adozione diffusa di queste preziose celle per la scienza normativa e lo screening di sicurezza, fino ad ora. Questo articolo presenta metodi convalidati per la placcatura, la maturazione e la fenotipizzazione funzionale ad alto rendimento della funzione elettrofisiologica e contrattile hiPSC-CM. Questi metodi si applicano ai cardiomiociti purificati disponibili in commercio, nonché ai cardiomiociti derivati da cellule staminali generati internamente utilizzando protocolli di differenziazione altamente efficienti e specifici per camera.
La funzione elettrofisiologica ad alto rendimento viene misurata utilizzando coloranti sensibili alla tensione (VSD; emissione: 488 nm), fluorofori sensibili al calcio (CSF) o sensori di calcio geneticamente codificati (GCaMP6). Un dispositivo di mappatura ottica ad alta produttività viene utilizzato per le registrazioni ottiche di ciascun parametro funzionale e un software dedicato personalizzato viene utilizzato per l'analisi dei dati elettrofisiologici. I protocolli MECM sono applicati per lo screening dei farmaci utilizzando un inotropo positivo (isoprenalina) e bloccanti specifici del gene umano Ether-a-go-go-related (hERG). Queste risorse consentiranno ad altri ricercatori di utilizzare con successo hiPSC-CM maturi per lo screening preclinico della cardiotossicità ad alto rendimento, i test di efficacia dei farmaci cardiaci e la ricerca cardiovascolare.
Introduzione
I cardiomiociti derivati da cellule staminali pluripotenti indotte umane (hiPSC-CM) sono stati convalidati su scala internazionale e sono disponibili per lo screening cardiotossicologico in vitro 1. Gli hiPSC-CM altamente puri possono essere generati in numero virtualmente illimitato, crioconservati e scongelati. Dopo la riplaccatura, si rianimano e iniziano a contrarsi con un ritmo che ricorda il cuore umano 2,3. Sorprendentemente, i singoli hiPSC-CM si accoppiano tra loro e formano sincizia funzionale che batte come un singolo tessuto. Al giorno d'oggi, le hiPSC sono abitualmente derivate da campioni di sangue dei pazienti, quindi qualsiasi persona può essere rappresentata utilizzando saggi di screening della cardiotossicità hiPSC-CM in vitro 4,5. Ciò crea l'opportunità di eseguire "Clinical Trials in a Dish", con una rappresentanza significativa di diverse popolazioni6.
Un vantaggio critico rispetto agli attuali approcci di screening della cardiotossicità su animali e cellule animali è che gli hiPSC-CM utilizzano l'intero genoma umano e offrono un sistema in vitro con somiglianze genetiche con il cuore umano. Ciò è particolarmente interessante per la farmacogenomica e la medicina personalizzata: si prevede che l'uso di hiPSC-CM per lo sviluppo di farmaci e altre terapie fornisca prescrizioni di farmaci più accurate, precise e sicure. Infatti, i saggi monostrato bidimensionali (2D) hiPSC-CM hanno dimostrato di essere predittivi della cardiotossicità dei farmaci, utilizzando un pannello di farmaci clinicamente usati con un rischio noto di causare aritmie 1,7,8,9. Nonostante il vasto potenziale delle hiPSC-CM e la promessa di semplificare e rendere lo sviluppo di farmaci più economico, c'è stata una riluttanza a utilizzare questi nuovi saggi10,11,12.
Fino ad ora, uno dei principali limiti dell'adozione diffusa e dell'accettazione dei test di screening hiPSC-CM è il loro aspetto immaturo, simile al feto, così come la loro funzione. La questione critica della maturazione dell'hiPSC-CM è stata rivista e dibattuta nella letteratura scientifica fino alla nausea13,14,15,16. Allo stesso modo, sono stati impiegati molti approcci per promuovere la maturazione dell'hiPSC-CM, comprese le manipolazioni della matrice extracellulare (ECM) nei monostrati 2D e lo sviluppo di tessuti cardiaci ingegnerizzati 3D (EHT)17,18. Al momento, c'è una convinzione diffusa che l'uso di EHT 3D fornirà una maturazione superiore rispetto agli approcci basati su monostrato 2D. Tuttavia, i monostrati 2D offrono una maggiore efficienza nell'utilizzo delle celle e un maggiore successo nella placcatura rispetto agli EHT 3D; Gli EHT 3D utilizzano un numero maggiore di celle e spesso richiedono l'inclusione di altri tipi di cellule che possono confondere i risultati. Pertanto, in questo articolo, l'attenzione si concentra sull'utilizzo di un metodo semplice per maturare hiPSC-CM coltivati come monostrati 2D di cellule accoppiate elettricamente e meccanicamente.
La maturazione avanzata di hiPSC-CM può essere ottenuta in monostrati 2D utilizzando un ECM. I monostrati 2D di hiPSC-CMs possono essere maturati utilizzando un coprislip morbido e flessibile in polidimetilsilossano, rivestito con matrice di membrana basale secreta da una cellula di sarcoma di topo Engelbreth-Holm-Swarm (ECM di topo). Nel 2016, i rapporti hanno mostrato che le hiPSC-CM coltivate su questa condizione di ECM morbida sono maturate funzionalmente, mostrando velocità di conduzione del potenziale d'azione vicino ai valori cardiaci adulti (~ 50 cm / s)18. Inoltre, questi hiPSC-CM maturi hanno mostrato molte altre caratteristiche elettrofisiologiche che ricordano il cuore adulto, tra cui il potenziale di membrana a riposo iperpolarizzato e l'espressione di Kir2.1. Più recentemente, i rapporti hanno identificato un rivestimento ECM derivato da cellule staminali perinatali umane che promuove la maturazione strutturale di 2D hiPSC-CMs19. Qui vengono presentati metodi facili da usare per sviluppare strutturalmente i monostrati 2D hiPSC-CM per l'uso in schermi elettrofisiologici ad alta produttività. Inoltre, forniamo la validazione di uno strumento di mappatura ottica per l'acquisizione e l'analisi automatizzata della funzione elettrofisiologica monostrato 2D hiPSC-CM, utilizzando coloranti sensibili alla tensione (VSD) e sonde e proteine sensibili al calcio.
Protocollo
L'utilizzo di hiPSC in questo protocollo è stato approvato dal Comitato HPSCRO dell'Università del Michigan (Human Pluripotent Stem Cell Oversight Committee). Vedere la tabella dei materiali per un elenco di materiali e attrezzature. Vedi Tabella 1 per i supporti e le loro composizioni.
1. Scongelamento e placcatura di hiPSC-CM crioconservate disponibili in commercio per la maturazione su una matrice extracellulare che induce maturazione (MECM)
- Riscaldare tutti i reagenti a temperatura ambiente e reidratare le piastre MECM con la soluzione salina bilanciata di Hank (HBSS) o soluzione salina tamponata fosfato (PBS) contenente calcio e magnesio, per 1 ora prima della placcatura cardiomiocitaria (200 μL di tampone per pozzetto di una piastra a 96 pozzetti).
- Lavare le piastre MECM 2x con HBSS o PBS contenenti calcio e magnesio per 1 ora prima della placcatura cardiomiocitaria (200 μL di tampone per pozzetto di una piastra a 96 pozzetti) e mantenere i pozzetti idratati.
- Preparare un bagno d'acqua a 37 °C.
- Rimuovere i tubi cardiomiocitari dal serbatoio di azoto liquido, trasferire i tubi in ghiaccio secco e aprire leggermente i tappi del tubo per rilasciare la pressione.
NOTA: Rilasciare la pressione nei tubi è estremamente importante! Se si accumula troppa pressione all'interno dei tubi, potrebbero esplodere. - Richiudere i tappi del tubo e metterli a bagnomaria per scongelare per 4 minuti.
NOTA: Lasciare che si scongelano completamente, per evitare danni alle cellule dovuti a scongelamento parziale. - Dopo che le cellule si sono scongelate, spruzzare i tubi con etanolo al 70% prima di aprire. Trasferire le celle in tubi conici da 15 mL con una pipetta da 1 mL. Gocciolare lentamente 8 ml di terreno di placcatura, agitando il tubo ogni volta che viene aggiunto 1 ml, per consentire alle cellule di adattarsi ai cambiamenti di osmolarità.
- Lavare il crioviale con 1 mL di terreno di placcatura utilizzando una pipetta di vetro da 1 mL. Quindi, gocciolare lentamente il lavaggio nel tubo conico da 15 ml.
- Centrifugare i tubi a ~300 × g per 5 min. Aspirare il surnatante e risospendere il pellet in 1 mL di terreno galvanico. Rimuovere un'aliquota ed eseguire il conteggio delle cellule vive con un emocitometro. Aggiungere ulteriore mezzo di placcatura per ottenere 7,5 × 105 celle/ml.
NOTA: Sono necessari circa 10 ml di sospensione cellulare per preparare 96 pozzetti. - Erogare 100 μL di sospensione cellulare per pozzetto di una piastra a 96 pozzetti rivestita in MECM utilizzando una pipetta multicanale.
NOTA: Assicurarsi di evitare la precipitazione cellulare e ottenere una densità cellulare uniforme in tutti i pozzetti durante la placcatura. - Incubare le cellule a 37 °C, 5% CO2 per 2 giorni prima di cambiare il terreno in mezzo di mantenimento (200 μL/pozzetto). Cambiare il mezzo di manutenzione il giorno 5 dopo lo scongelamento. Eseguire i saggi EP il giorno 7 o successivo, come descritto in precedenza 8,9. Cambiare il terreno a giorni alterni quando si opta per l'estensione della coltura cellulare.
2. differenziazione diretta da hiPSC cardiaca e purificazione hiPSC-CM
- Soluzione calda di acido etilendiamminotetraacetico (EDTA) disponibile in commercio, HBSS senza calcio e magnesio (HBSS --) e piastre a 6 pozzetti rivestite con matrice di membrana basale solubilizzata secreta da una cellula di sarcoma di topo Engelbreth-Holm-Swarm (ECM di topo) a temperatura ambiente.
- Marcare le colonie differenziate mediante microscopia a contrasto di fase e aspirare/ablare. Lavare ogni pozzetto con 1 mL di HBSS--. Eseguire due lavaggi in pozzetti contenenti >10 punti di differenziazione.
- Aspirare l'HBSS e aggiungere 1 mL di soluzione EDTA a ciascun pozzetto. Incubare le piastre per un massimo di 5 minuti a 37 °C. Controlla le piastre dopo 3 minuti e cerca colonie bianche traslucide e visibili.
- Aspirare la soluzione EDTA e aggiungere 1 mL in un singolo pozzetto. Rimuovere le cellule con 2 mL di mezzo hiPSC pipettando ripetutamente la sospensione su e giù, utilizzando una pipetta di vetro da 10 mL per staccare tutte le cellule staminali dal pozzetto e trasferire la sospensione cellulare in un tubo di raccolta. Ripetere l'aspirazione e lo spostamento con i pozzi successivi.
NOTA: rimuovere le colonie difficili da sollevare con la punta della pipetta di vetro. - Contare le cellule staminali e regolare il volume sulla piastra 8,0 × 105 celle/pozzetto. Coltura delle cellule su terreno hiPSC (2 ml/pozzetto) fino a quando le cellule staminali raggiungono il 90% di confluenza (questa volta è indicato d'ora in poi come D0).
- Preparare 2 ml di terreno di differenziazione basale integrato con 4 μM di CHIR99021.
- Su D0, lavare ogni pozzetto di una piastra a 6 pozzetti di cellule staminali con 1 mL di HBSS per pozzetto. Sostituire l'HBSS con un mezzo di differenziazione basale integrato con 4 μM di CHIR99021.
- Su D1, non fare nulla.
- Su D2, preparare il terreno di differenziazione basale integrato con 4 μM di IWP4.
- Sostituire il mezzo con 2 ml di terreno di differenziazione basale integrato con IWP4 per pozzetto.
- Su D3, non fare nulla per una differenziazione ventricolare-specifica. Per una differenziazione atriale-specifica, aspirare il mezzo e aggiungere 2 ml di mezzo basale integrato con 4 μM di soluzione di IWP4 e 1 μM di acido retinoico (RA) per pozzetto.
- Su D4, aspirare il mezzo e aggiungere 2 ml di mezzo basale per pozzetto per la differenziazione ventricolare. Per una differenziazione atriale, aspirare il mezzo e aggiungere 2 ml di mezzo basale integrato con una soluzione RA da 1 μM per pozzetto.
- Su D5, non fare nulla.
- Su D6, aspirare il mezzo e aggiungere 2 ml di mezzo basale per pozzetto (sia per differenziazione atriale che ventricolare).
- Su D7, non fare nulla.
- Su D8, aspirare il mezzo e aggiungere 2 ml di terreno di mantenimento dei cardiomiociti. Cambiare il mezzo a giorni alterni fino alla separazione cellulare o seguire un piano di esposizione cronica ai farmaci.
3. purificazione hiPSC-CM tramite MACS (selezione cellulare attivata magneticamente)
- Aspirare il terreno di coltura cellulare e lavare ogni pozzetto con 1 mL di HBSS--. Dissociare le cellule aggiungendo 1 mL di tripsina/EDTA allo 0,25% e incubando a 37 °C, 5% CO2 per 10 minuti. Risospendere e singolarizzare le cellule in ciascun pozzetto con 2 ml di terreno di placcatura per inattivare la tripsina/EDTA.
- Raccogliere le cellule dai sei pozzetti in un tubo conico da 50 ml con un filtro da 70 μm. Quindi, lavare il colino con 3 ml di terreno di placcatura. Contare le celle.
- Centrifugare la sospensione a ~300 × g per 5 min. Aspirare il surnatante e lavare le celle con 20 ml di tampone di separazione MACS ghiacciato. Quindi, centrifugare di nuovo a ~300 × g per 5 minuti.
- Risospendere il pellet in 80 μL di tampone di separazione MACS freddo per 5 × 106 celle. Aggiungere 20 μL di cocktail freddo di deplezione non cardiomiocitaria (umano) per 5 × 106 cellule. Mescolare delicatamente la sospensione cellulare e incubare su ghiaccio per 10 minuti.
- Lavare il campione aggiungendo 4 ml di tampone di separazione MACS freddo per 5 × 106 celle. Centrifugare il campione a ~300 × g per 5 minuti e aspirare il surnatante.
- Risospendere il pellet in 80 μL di tampone di separazione MACS freddo per 5 × 106 celle. Aggiungere 20 μL di microsfere anti-biotina fredde per 5 × 106 cellule. Mescolare delicatamente la sospensione cellulare e incubare per 10 minuti su ghiaccio.
- Durante l'incubazione dei campioni, posizionare le colonne di esaurimento positivo (dotate dei filtri di pre-separazione da 30 μm) sul separatore MACS e posizionare i tubi di raccolta da 15 ml etichettati sotto le colonne. È necessaria una colonna ogni 5 × 106 celle.
- Innesca ogni colonna con 3 ml di buffer di separazione MACS freddo. Mescolare la sospensione cellulare trattata con anticorpi con 2 ml di tampone di separazione MACS per 5 × 106 cellule e aggiungere alla colonna.
NOTA: Non centrifugare! La centrifugazione in questa fase ha effetti dannosi sulla resa dei cardiomiociti. - Aggiungere 2 mL di tampone di separazione MACS a ciascuna colonna e raccogliere il flowthrough fino a raccogliere 12 mL di sospensione cardiomiocitaria flowthrough.
NOTA: Non lasciare mai asciugare completamente le colonne. - Centrifugare i cardiomiociti a ~300 × g per 5 minuti, scartare il surnatante e sospendere i cardiomiociti in 1 ml di terreno di placcatura.
- Contare le celle per determinare la concentrazione, regolare il volume alla densità di semina desiderata e placcare le celle. Placcare i cardiomiociti purificati sulle piastre MECM a 96 pozzetti, come descritto sopra nei punti 1.9-1.11 (7,5 × 105 cellule/pozzetto).
4. Mappatura ottica mediante coloranti sensibili alla tensione (VSD) e fluorofori sensibili al calcio (CSF)
- Preparare la quantità appropriata di VSD in HBSS con calcio e magnesio, aggiungendo 1 μL di colorante VSD per mL di HBSS e 10 μL di adiuvante di carico per mL di HBSS.
NOTA: In genere, una piastra a 96 pozzetti richiede 10 ml di soluzione VSD. - In alternativa, preparare HBSS con calcio e magnesio integrati con 5 μM di CSF. Aspirare il mezzo di mantenimento dei cardiomiociti e sostituirlo con 100 μL di VSD o CSF per pozzetto di una piastra a 96 pozzetti. Incubare le cellule per 30 minuti nell'incubatore di coltura cellulare.
- Rimuovere i coloranti e sostituirli con il mezzo di analisi o HBSS. Equilibrate a 37 °C per l'acquisizione della mappatura ottica dei dati di base con un dispositivo di mappatura ottica ad alta produttività.
- Trattare le cellule con farmaci per test di esposizione acuta o mappare le cellule che sono state cronicamente esposte a farmaci di interesse.
- Per i test di cardiotossicità in piastre a 96 pozzetti, utilizzare quattro dosi di un composto con almeno sei pozzetti per dose. Utilizzare dosi comprese tra il basso e al di sopra della concentrazione plasmatica terapeutica efficace, compresa una dose della concentrazione plasmatica terapeutica efficace clinica.
- Diluire i farmaci in dimetilsolfossido, conservarli come soluzioni madre a -20 °C e quindi diluirli in HBSS alle concentrazioni desiderate.
- Effettuare misurazioni elettrofisiologiche al basale prima dell'applicazione del farmaco, come descritto nel paragrafo 5. Una volta che i farmaci sono stati applicati, effettuare registrazioni elettrofisiologiche almeno 30 minuti dopo per gli studi cronici. Vedere le sezioni seguenti per le procedure di acquisizione e analisi dei dati di mappatura ottica.
5. Mappatura ottica mediante indicatore di calcio geneticamente codificato (GECI)
- Piastre disponibili in commercio o hiPSC-CM purificate con MACS, come descritto sopra, utilizzando piastre a 96 pozzetti rivestite in MECM per realizzare hiPSC-CM mature. Per formare monostrati confluenti, piastra 7,5 × 104 CM per pozzetto di ogni piastra da 96 pozzetti. Utilizzare il mezzo di placcatura.
- Dopo 48 ore in mezzo di placcatura, passare al mezzo di mantenimento dei cardiomiociti.
- Il giorno 4 dopo lo scongelamento e la riplaccatura, aggiungere adenovirus ricombinante per esprimere GCaMP6m (AdGCaMP6m) alle cellule a una molteplicità di infezione (MOI) = 5. Aggiungere il virus utilizzando il mezzo di analisi CM.
NOTA: Qui, gli esperimenti che utilizzano GCaMP6m sono stati eseguiti in cardiomiociti iCell2 da un fornitore commerciale. - Il giorno 5, rimuovere il terreno adGCaMP6m e sostituirlo con un nuovo RPMI + B27 (mezzo di mantenimento dei cardiomiociti).
- Il giorno 7, osservare le CM utilizzando la microscopia o l'imager di mappatura ottica, per visualizzare le contrazioni spontanee e i corrispondenti transitori di calcio.
- Il giorno 7 o successivo, per lo screening dei farmaci, trasferire direttamente le piastre a 96 pozzetti di monostrati hiPSC-CM maturi che esprimono GCaMP6m all'imager di mappatura ottica dall'incubatore per l'acquisizione dei dati di base.
- Dopo l'acquisizione dei dati elettrofisiologici, restituire le piastre delle CM all'incubatore di coltura tissutale, per le misurazioni su un successivo punto temporale.
- Dopo le registrazioni di base, applicare i farmaci, utilizzando almeno quattro dosi di ciascun farmaco e almeno sei pozzetti per dose. Equilibrare i farmaci sulle cellule per almeno 30 minuti prima della raccolta dei dati. Riscaldare la temperatura del pozzo a ~37 °C prima e durante l'acquisizione dei dati.
- Dopo le registrazioni basali di un'intera piastra, aggiungere isoproterenolo (500 nM) a ciascun pozzetto per consentire dati di risposta al farmaco affidabili. Quantificare gli effetti dell'isoproterenolo sulla frequenza di battito monostrato, sull'ampiezza della contrazione (ampiezza transitoria del calcio) e sulla durata dei transitori di calcio (vedere Figura 6), come descritto nel paragrafo 5.
6. Acquisizione di dati cartografici ottici e analisi
- Assicurarsi che la fotocamera, il transilluminatore e il riscaldatore del dispositivo di mappatura ottica siano accesi.
- Aprire il software di acquisizione e determinare la posizione di salvataggio dei file.
- Aprire il cassetto anteriore e posizionare la piastra sul riscaldatore a piastre.
- Acquisisci una cornice scura facendo clic sul pulsante Cornice scura .
- Selezionare Durata (10-30 s) e Frequenza fotogrammi di acquisizione (ad esempio, 100 fps; 250 fps per una risoluzione temporale più elevata) e fare clic su Avvia acquisizione.
- Aprire il software di analisi e, nella scheda Importa/Filtro , selezionare Cerca un singolo file o Affianca multiplo per ricostruire una lastra.
- Selezionare Modalità parametro (APD o CaTD), immettere Distanza per pixel e utilizzare la Creazione guidata pozzo per determinare la posizione dei pozzi nell'immagine. Fare clic su Elabora salvataggio per passare alla scheda successiva.
- Apri la scheda ROI (regioni di interesse) e scegli di disegnare i ROI manualmente, automaticamente o non utilizzare affatto i ROI, che considererebbero quindi l'intero pozzo per l'analisi. Dopo aver selezionato i ROI, fare clic sul pulsante Elabora/Salva per passare al passaggio successivo. Seleziona Nascondi pozzetti e Mostra solo caselle filtrate per visualizzare i ROI.
- Apri la scheda Analisi e, nella parte in alto a destra dello schermo, seleziona ciascun pozzo o ROI per confermare l'accuratezza del rilevamento automatico dei battiti. Aggiungete o rimuovete battute dalle tracce premendo Aggiungi battuta/Salva battute oppure selezionando una battuta individuale e premendo Canc sulla tastiera.
- Facoltativamente, utilizzare la funzione Mappe di calore medie per creare mappe di calore dei parametri selezionati per la piastra.
- Fare clic sul pulsante Grafico spazio-temporale nella scheda Analisi per visualizzare i dati per ciascun pozzo o il ROI. Dopo esserti assicurato che il rilevamento dei battiti sia accurato, vai alla scheda Esporta e seleziona Formato file. Premere Esporta e creare una cartella in cui esportare i dati. Procedere all'apertura dei file di dati ed eseguire la routine di analisi statistica scelta.
NOTA: i file .xlxs sono preferiti in quanto tutti i parametri vengono esportati in un unico file; Altri formati (.csv o TSV) generano un file per parametro.
Risultati
Maturazione hiPSC-CM caratterizzata da contrasto di fase e imaging confocale immunofluorescente
La tempistica per la maturazione mediata da ECM di hiPSC-CM disponibili in commercio utilizzando piastre a 96 pozzetti rivestite MECM è presentata nella Figura 1A. Questi dati vengono raccolti utilizzando cardiomiociti disponibili in commercio che arrivano in laboratorio come fiale crioconservate di cellule. Ogni flaconcino contiene >5 × 106 cardiomiociti vitali. Le cellule sono pure al ~ 98% e rigorosamente testate per il controllo di qualità (il certificato di analisi è fornito con ogni fiala). L'elevato numero di CM consente di scongelare e placcare i CM su diverse combinazioni ECM utilizzando lo stesso lotto di celle. Nella Figura 1, gli hiPSC-CM sono placcati su piastre rivestite ECM o MECM per mouse. Gli hiPSC-CM placcati sul MECM maturano e diventano strutturalmente distinti dallo stesso lotto di hiPSC-CM riplaccati sul topo ECM. Vale a dire, le cellule mature diventano a forma di bastoncello, mentre le cellule immature mantengono una forma circolare. Questo può essere visto nell'imaging a contrasto di fase e dopo la colorazione dei miofilamenti cardiaci (Figura 1B; troponina I [TnI], rosso). Una convalida più ampia della maturazione strutturale delle hiPSC-CM è presentata nella Figura 2. Un ampio campo visivo (obiettivo 20x) di CM colorate con anticorpi α-actina mostra la forma tipica delle cellule coltivate su ciascuna condizione di ECM. α-actina è una proteina strutturale critica disposta con spaziatura regolare nei miofilamenti cardiaci. Coerentemente con la colorazione TnI nella Figura 1, la colorazione con α-actina indica ulteriormente la maturazione delle hiPSC-CM coltivate sulla MECM. Oltre a promuovere un fenotipo maturo a forma di bastoncello, il MECM induce anche una maggiore organizzazione del sarcomero (60x immagini). Il contenuto e l'attività mitocondriale sono anche distinti tra le cellule coltivate sul topo ECM e la MECM (Figura 2B). Il contenuto mitocondriale hiPSC-CM fetale-immaturo è limitato allo spazio perinucleare, con pochi mitocondri trovati nel citosol. Al contrario, il contenuto mitocondriale maturo di hiPSC-CMs è distribuito in tutta la cellula. La valutazione mitocondriale utilizza un protocollo stabilito19.
Differenziazione diretta da hiPSC cardiaca e specifica della camera cardiaca
Qui è fornito un protocollo per la produzione interna e la maturazione di hiPSC-CM purificati e specifici della camera (Figura 3A). Ciò si basa su una relazione precedentemente pubblicata20. Vengono presentate procedure dettagliate per la purificazione hiPSC-CM utilizzando un kit MACS (Magnet-Activated Cell Sorting) disponibile in commercio. Abbiamo recentemente convalidato l'uso della purificazione MACS e mostrato i vantaggi dell'utilizzo di MACS rispetto alla purificazione hiPSC-CM a base metabolica; tipicamente, la purezza di hiPSC-CM superiore al 95% è prevista21. È importante sottolineare che se il contenuto iniziale di CM è <50%, la purificazione MACS può raggiungere solo ~ 85%. In questi casi, l'arricchimento di CM può essere necessario in seguito all'esaurimento di non-CM. Se il contenuto iniziale di CM dalla differenziazione è >50%, l'esaurimento dei non-CM dalla popolazione cellulare utilizzando il kit MACS può raggiungere una purezza >95%; in questo caso, l'ulteriore arricchimento o la selezione positiva dei CM non è necessaria. Gli hiPSC-CM specifici della camera possono anche essere maturati utilizzando piastre a 96 pozzetti rivestite in MECM, come descritto sopra e mostrato in Figura 1 e Figura 2. Ci si deve aspettare che le cellule atrial-specifiche (hiPSC-ACM) abbiano un tasso di battito spontaneo significativamente più veloce e una durata del potenziale d'azione più breve 80 (APD80) rispetto alle cellule ventricolari specifiche (hiPSC-VCM). Questi sono dati elettrofisiologici tipici per i potenziali d'azione registrati utilizzando VSD e il sistema di mappatura ottica (Figura 3B-D).
Mappatura ottica elettrofisiologica cardiaca ad alta produttività
Il rigore scientifico è notevolmente aumentato per qualsiasi test se può essere eseguito in modo ad alto rendimento. I dati dello screening cardiotossicologico sono presentati in Figura 4, Figura 5, Figura 6 e Figura 7, che mostrano lo screening elettrofisiologico ad alta produttività utilizzando monostrati maturi hiPSC-CM in una piastra a 96 pozzetti. Le mappe di calore dell'intera piastra per parametri come APD80 (Figura 4A) rivelano la riproducibilità di un dato parametro all'interno di una piastra da pozzo a pozzo. Inoltre, le mappe di calore a piastra intera forniscono un rapido esame di eventuali valori anomali nel set di dati. Ad esempio, nel pozzo E4 della piastra presentata in Figura 4A, è chiaro che questo pozzo ha un valore APD80 molto maggiore, indicato dal pozzo che appare giallo, mentre gli altri pozzetti sono indaco-blu. I potenziali d'azione tipici dei monostrati 2D hiPSC-CM maturi (Figura 4B) ricordano la morfologia del potenziale d'azione dei cardiomiociti adulti isolati e testati in coltura. Inoltre, un tipico ritmo spontaneo del potenziale d'azione è mostrato nella Figura 4C. I dati nella Figura 4C sono un grafico spazio-temporale della riga A, colonne 1-12. La linea bianca sulla mappa delle lastre nella Figura 4A lo rappresenta. Ogni lampo fluorescente luminoso nel tempo in ogni pozzetto rappresenta una singola attivazione spontanea. La Figura 5 e la Figura 6 mostrano l'utilità dell'utilizzo dell'indicatore di calcio geneticamente codificato GCaMP6m (GECI) per misurare i transitori intracellulari di calcio; La Figura 6 mostra anche la risposta attesa all'isoproterenolo, il classico inotropo cardiaco positivo. In risposta all'isoproterenolo, l'attivazione dei recettori β1-adrenergici causa cronotropia positiva (Figura 6A), inotropia positiva (Figura 6B) e lusitropia positiva (Figura 6C). Queste risposte all'isoproterenolo indicano la significativa maturazione dei recettori β1-adrenergici hiPSC-CM e delle cascate di segnalazione intracellulare.
Nella Figura 7, viene mostrata la risposta hiPSC-CM ai bloccanti dei canali umani del gene correlato all'etere (hERG), utilizzando la fluorescenza del calcio GCaMP6m per monitorare il ritmo e fungere da marcatore surrogato per la contrattilità. E-4031 è un bloccante dei canali specifico per hERG, che rallenta la frequenza del battito spontaneo e aumenta la durata dei transitori di calcio (CaTD80) e la triangolazione (triangolazione CaT). La Figura 7A mostra il rilevamento delle prime depolarizzazioni post-depolarizzazioni causate dal blocco del canale E-4031 hERG. Sono stati testati anche altri bloccanti dei canali hERG, tra cui domperidone, vandetanib e sotalolo, e i risultati sono mostrati nella Figura 7E-G. Questi composti e dosi sono stati selezionati sulla base del recente studio di validazione hiPSC-CM 1,7,9.
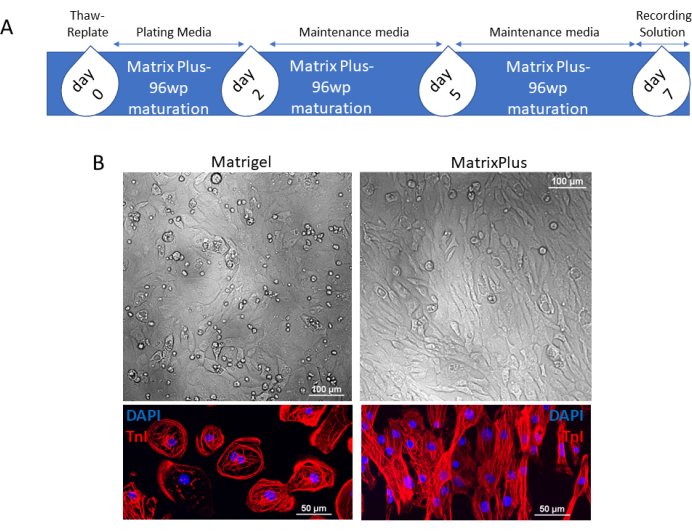
Figura 1: Timeline per la rapida maturazione di hiPSC-CM crioconservate disponibili in commercio o di altre fonti . (A) I cardiomiociti scongelati sospesi nel mezzo di placcatura vengono applicati al MECM il giorno 0. Il giorno 2, il mezzo viene sostituito con il mezzo di manutenzione e il mezzo esaurito viene cambiato il giorno 5. Le cellule vengono coltivate per altri 2 giorni e il giorno 7, la sincizia matura delle hiPSC-CM può essere caricata con soluzione di registrazione per applicazioni a valle o coltivata per periodi più lunghi. (B) La fase di contrasto della sincizia dei cardiomiociti placcati sulla ECM del topo o sulla MECM mostra che i cardiomiociti placcati sulla ECM del topo hanno una maggiore circolarità rispetto ai cardiomiociti placcati sulla MECM; inoltre, l'immunocolorazione per TnI indica che i cardiomiociti placcati sulla ECM murina mantengono una morfologia di simmetria radiale e sarcomeri disorganizzati in contrasto con gli hiPSC-CM dolicomorfi e ben strutturati placcati sulla MECM. Barre della scala = 100 μm (B, superiore); 50 μm (B, inferiore). Abbreviazioni: hiPSC-CMs = cardiomiociti derivati da cellule staminali pluripotenti indotte dall'uomo; ECM = matrice extracellulare; MECM = ECM che induce la maturazione; 96wp = piastra a 96 pozzetti; DAPI = 4',6-diamidino-2-fenilindolo; TnI = troponina I. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: Confronto dell'organizzazione del sarcomero di hiPSC-CMs placcati su un topo ECM o un MECM. (A) HiPSC-CMs di topo coltivato ECM immunocolorato contro α-actinina indicano morfologia radiale, con una minore densità di sarcomeri dispersi attraverso il cardiomiocita in contrasto con hiPSC-CMs dallo stesso lotto placcato sulla matrice e che presenta morfologia a forma di bastoncello (20x). (60x) L'osservazione delle hiPSC-CM con microscopia confocale mostra che le hiPSC-CM coltivate su una ECM murina hanno una morfologia a simmetria radiale, con una distribuzione perimetrale più densa dei sarcomeri e una bassa densità di sarcomeri radiali in contrasto con le hiPSC-CM dello stesso lotto che sono state coltivate sul MECM. Presentano una distribuzione omogenea dei sarcomeri organizzati lungo l'asse più lungo delle cellule. Barre della scala = 100 μm (superiore); 50 μm (inferiore). (B) La colorazione di hiPSC-CMs coltivate sul topo ECM o MECM con un colorante mitocondriale che colora i mitocondri con alto potenziale transmembrana mostra una minore intensità di colorazione nei cardiomiociti coltivati sul topo ECM rispetto alla MECM. Inoltre, le hiPSC-CM coltivate sulla MECM hanno mitocondri distribuiti omogeneamente nei cardiomiociti, in contrasto con le hiPSC-CM coltivate sulla ECM murina che presentano un accumulo perinucleare di mitocondri. Barre della scala = 200 μm. Abbreviazioni: hiPSC-CMs = cardiomiociti derivati da cellule staminali pluripotenti indotte dall'uomo; ECM = matrice extracellulare; MECM = ECM che induce la maturazione; DAPI = 4',6-diamidino-2-fenilindolo. Fare clic qui per visualizzare una versione ingrandita di questa figura.
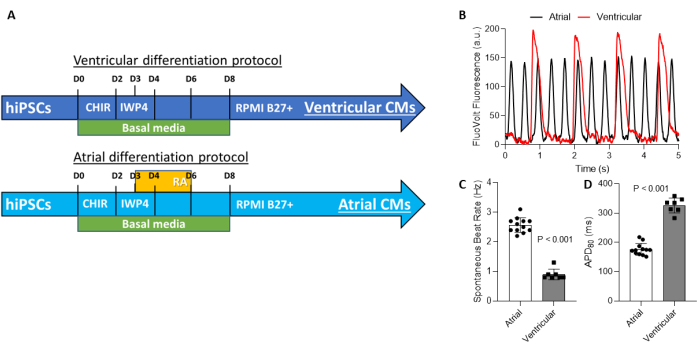
Figura 3: Produzione di cardiomiociti camera-specifici. (A) I protocolli per la produzione di cardiomiociti camera-specifici condividono identica manipolazione della via di segnalazione Wnt, con la stimolazione della segnalazione Wnt mediante inibizione di GSK3 dal giorno 0 al giorno 2 e l'inibizione di questa via tra il giorno 2 e il giorno 4. La specifica della camera si ottiene con l'attivazione della via dell'acido retinoico e la manipolazione della segnalazione Wnt tra i giorni 3 e 6. (B) Come risultato della specifica della camera, i cardiomiociti atriali presentano un tasso più rapido di depolarizzazione spontanea rispetto ai cardiomiociti ventricolari. (C) Le hiPSC-CM ventricolari hanno tassi di battito più lenti rispetto alle hiPSC-CM atriali; pertanto, la durata del potenziale d'azione all'80% della ripolarizzazione è più breve negli hiPSC-ACM rispetto agli hiPSC-VCM. Abbreviazioni: hiPSC-CMs = cardiomiociti derivati da cellule staminali pluripotenti indotte dall'uomo; hiPSC-ACM = cardiomiociti atriali derivati da cellule staminali pluripotenti indotte dall'uomo; hiPSC-VCM = cardiomiociti ventricolari derivati da cellule staminali pluripotenti indotte dall'uomo. Fare clic qui per visualizzare una versione ingrandita di questa figura.
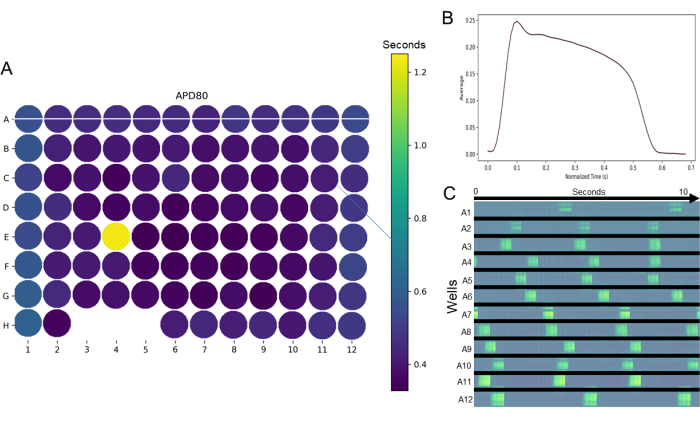
Figura 4: Mappatura ottica acquisita con un dispositivo di mappatura ottica e analizzata con Pulse. (A) Esempio di mappa termica per l'osservazione olistica dei parametri valutati in una piastra a 96 pozzetti dopo la filtrazione del film e la determinazione delle regioni di interesse in piastre a 96 pozzetti, mappati con il dispositivo di mappatura ottica. In questo esempio, una mappa di calore APD80% che indica un pozzo anomalo (E4) e pozzi che non sono riusciti a produrre dati (pozzi H3, 4 e 5). (B) Inoltre, l'interfaccia user-friendly consente di tracciare facilmente la morfologia del potenziale d'azione medio dai pozzi selezionati. (C) Sono disponibili ulteriori strumenti di visualizzazione dei dati; in questo esempio, un grafico spazio-temporale generato dalla linea orizzontale che attraversa i pozzetti sulla riga A (pannello A) mostra l'attivazione attraverso una sezione orizzontale di ciascun pozzetto (linea bianca attraverso la riga A) per un periodo di 10 s. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Sequenza temporale per la mappatura dei cambiamenti transitori intracellulari del calcio con un indicatore di calcio codificato geneticamente. Il giorno 4 dopo la placcatura dei cardiomiociti disponibili in commercio in una piastra a 96 pozzetti rivestita di MECM, come indicato nella Figura 1A, le cellule devono essere trasdotte con 5 MOI di virus nel mezzo di saggio CM durante la notte. Il terreno viene sostituito con il mezzo di mantenimento CDI fino al giorno 6 e cambiato in mezzo di mantenimento CDI senza rosso fenolo tra i giorni 7 e 11 per consentire un monitoraggio rapido o continuo dei cambiamenti transitori intracellulari del calcio con Nautilus. (B) le hiPSC-CMs trasdotte con AdGCaMP6f valutate con mappatura ottica nei giorni 7, 9 e 10 dopo il disgelo indicano la presenza di cambiamenti di fluorescenza intracellulari intracellulari mediati dal calcio, che consentono la mappatura ottica giornaliera della stessa piastra per lunghi periodi di tempo senza la necessità di riapplicare coloranti sensibili al calcio. Abbreviazioni: GECI = indicatore di calcio geneticamente codificato; CM = cardiomiocita; MOI = molteplicità dell'infezione; 96wp = piastra a 96 pozzetti; BSA = albumina sierica bovina. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 6: Utilizzo rapido e semplice delle mappe di calore per il confronto visivo dei dati acquisiti dalla sincizia funzionale matura di hiPSC-CM con Nautilus e analizzati con Pulse. (A) Gli hiPSC-CM trattati con isoproterenolo mostrano un aumento della frequenza di battimento, come osservato dall'ispezione delle mappe di calore e confermato con il t-test accoppiato. (B) Allo stesso modo, la mappatura delle cellule prima e dopo il trattamento con isoproterenolo mostra l'effetto inotropo della stimolazione β-adrenergica mediante confronto visivo delle mappe di calore e con t-test accoppiato. (C) Infine, l'utilizzo di mappe di calore per il confronto visivo dei dati mostra lusitropia, un altro effetto canonico della stimolazione β-adrenergica, confermato con il test t accoppiato (p < 0,0001). L'assenza di un cerchio indica un fallimento nell'acquisizione/analisi dei dati per quel pozzo specifico. Abbreviazioni: hiPSC-CMs = cardiomiociti derivati da cellule staminali pluripotenti indotte dall'uomo; ISO = isoproterenolo. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 7: Validazione del test di screening della cardiotossicità GECI utilizzando bloccanti dei canali hERG. (A) Tracce rappresentative spontanee di flusso di calcio dai pozzetti basali in HBSS e in presenza di 500 nM E-4031. (B-D) Quantificazione degli effetti basali e +E-4031 rispettivamente sulla frequenza di battimento, sulla durata transitoria del calcio 80 (CaTD80) e sulla triangolazione transitoria del calcio (triangolazione CaT). *,** indica una differenza significativa; test t spaiato; p < 0,01; n = 8 in ciascun gruppo. (E) Rilevazione GECI di un altro bloccante hERG, domperidone. (F) Rilevazione GECI del blocco hERG indotto da vandetanib. (G) Rilevazione GECI del blocco di hERG mediante alte dosi di sotalolo. Abbreviazioni: GECI = indicatore di calcio geneticamente codificato; hERG = gene umano correlato all'etere a go. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Tabella 1: I supporti e le loro composizioni Clicca qui per scaricare questa tabella.
Discussione
Esistono diversi approcci allo screening della cardiotossicità in vitro utilizzando hiPSC-CMs. Un recente documento "Best Practices" sull'uso di hiPSC-CMs ha presentato i vari saggi in vitro , le loro letture primarie e, soprattutto, la granularità di ciascun test per quantificare la funzione elettrofisiologica cardiaca umana20. Oltre all'utilizzo di elettrodi perforanti a membrana, la misura più diretta della funzione elettrofisiologica cardiaca umana è fornita dai VSD. Le letture dei saggi VSD consentono la visualizzazione diretta e la quantificazione dei parametri elettrofisiologici critici, tra cui la durata del potenziale d'azione, la velocità di propagazione del potenziale d'azione, la corsa del potenziale d'azione, la triangolazione del potenziale d'azione, la frequenza di battito, la regolarità del battito e le eterogeneità della durata del potenziale d'azione. Allo stesso modo, le sonde sensibili al calcio offrono informazioni sul ritmo, la velocità e la durata degli eventi monostrato hiPSC-CM. Le misurazioni dei transitori di calcio hiPSC-CM effettuate utilizzando sonde fluorescenti forniscono anche informazioni sulla contrattilità e sulla resistenza contrattile di ciascuna contrazione. Questo articolo fornisce metodi per l'uso di hiPSC-CM maturi (piastre a 96 pozzetti) in VSD ad alta produttività e saggi di misurazione transitori di calcio. Oltre ai metodi per la mappatura ottica, viene presentato un software per l'analisi dei dati EP ad alta produttività.
I metodi qui descritti rappresentano un progresso significativo per lo screening della cardiotossicità e i campi della scienza regolatoria. Qui, abbiamo presentato metodi per la rapida maturazione e la registrazione elettrofisiologica di monostrati 2D hiPSC-CM in piastre di screening ad alta produttività (piastre a 96 pozzetti). La rapida maturazione con un MECM (7 giorni) mostrato qui è un importante progresso rispetto agli approcci precedenti che richiedono la maturazione in 30-100 giorni22,23. Rispetto ad altri ECM, che richiedono un'applicazione manuale per ogni esperimento, le piastre MECM sono preverniciate con ECM e arrivano in laboratorio pronte all'uso. Questo aspetto del MECM lo rende più facile da usare, meno variabile e più efficiente rispetto all'utilizzo di altri rivestimenti ECM. È importante sottolineare che questo approccio può essere utilizzato sia per hiPSC-CM crioconservati e disponibili in commercio che per hiPSC-CM "fatti in casa", che possono essere specifici della camera. A causa della distinta struttura a forma di bastoncello delle hiPSC-CM mature (Figura 1 e Figura 2), è importante sottolineare che è necessario un numero maggiore di cellule per la formazione di monostrato confluente qui, rispetto ai protocolli che utilizzano altri ECM. In particolare, quando si utilizza ECM di topo (le cellule hanno un fenotipo di pancake a diffusione continua), impiattiamo 50.000 hiPSC-CM per pozzetto, ma quando si utilizza MECM, impiattiamo 75.000 hiPSC-CM per pozzetto. Il numero di CM per pozzetto può anche essere ridotto se le cellule devono essere utilizzate per l'analisi di una singola cella, come patch clamp o qualsiasi altra tecnica di imaging che richieda singole cellule.
Gli hiPSC-CM disponibili in commercio offrono vantaggi per la scienza regolatoria grazie all'ampia caratterizzazione di queste cellule da parte degli sforzi internazionali guidati dalla Food and Drug Administration (FDA). Tuttavia, le cellule disponibili in commercio sono una miscela di hiPSC-CM nodali, atriali e ventricolari, che forniscono informazioni di tossicità altamente rilevanti ma mancano delle caratteristiche specifiche della camera che imitano il cuore umano. Le hiPSC-CM camera-specifiche ricreano le ben note differenze elettrofisiologiche tra cardiomiociti atriali e ventricolari e forniscono un saggio in vitro per lo sviluppo di terapie antiaritmiche camera-specifiche (Figura 3B-D). Ad esempio, i farmaci specifici per la fibrillazione atriale possono ora essere testati e sviluppati utilizzando monostrati hiPSC-ACM placcati in piastre a 96 pozzetti per una raccolta dati robusta e rigorosa. Allo stesso modo, durante lo screening per determinare se un composto causa torsioni di punta (TdP), un'aritmia ventricolare ad alto rischio, è ottimale non avere cellule atriali e linfonodali che "contaminano" i monostrati cardiaci ventricolari. Pertanto, sebbene gli sforzi di convalida hiPSC-CM guidati dalla FDA fino ad oggi si siano concentrati sull'utilizzo di CM disponibili in commercio, è probabile che le future raccomandazioni scientifiche normative si rivolgeranno all'uso di cellule specifiche della camera per rendere lo screening di tossicità ancora più predittivo della condizione cardiaca umana. I metodi qui descritti si basano su relazioni precedenti e forniscono un approccio robusto per la generazione di cardiomiociti camera-specifici derivati da cellule staminali pluripotenti21.
Una grande differenza tra questi protocolli e quelli tipicamente utilizzati sul campo è l'approccio di purificazione utilizzato. La maggior parte dei laboratori che generano hiPSC-CMs nei propri laboratori si basano sulla selezione metabolica-mediata dei cardiomiociti22. Qui, ci affidiamo all'utilizzo di MACS per purificare le CM hiPSC, utilizzando un approccio di elaborazione cellulare clinicamente approvato che produce CM con fenotipi23 più sani. L'approccio di sfida metabolica è efficace, ma utilizza una formulazione media che simula l'ischemia miocardica24. Quando si utilizza la purificazione MACS di hiPSC-CMs, è importante utilizzare il cocktail di deplezione non-CM, che si rivolge ai non-CM per la deplezione magnetica dalla popolazione cellulare. L'uso dell'approccio di deplezione non-CM riduce al minimo lo sforzo di taglio che i CM sperimentano nella colonna magnetica ed è preferito all'etichettatura magnetica diretta della popolazione CM. L'utilizzo della purificazione MACS di celle specifiche della camera consentirà ad altri laboratori di generare CM sani per la ricerca e i test di tossicità.
Divulgazioni
TJH è consulente e consulente scientifico di StemBioSys, Inc. TB è un dipendente di StemBioSys, Inc. AMR e JC sono ex consulenti di StemBioSys, Inc. TJH, TB, AMR e JC sono azionisti di StemBioSys, Inc.
Riconoscimenti
Questo lavoro è stato sostenuto dalle sovvenzioni NIH HL148068-04 e R44ES027703-02 (TJH).
Materiali
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin EDTA | Gibco | 25200-056 | |
| 0.5 mg/mL BSA (7.5 µmol/L) | Millipore Sigma | A3294 | |
| 2.9788 g/500 mL HEPES (25 mmol/L) | Millipore Sigma | H4034 | |
| AdGCaMP6m | Vector biolabs | 1909 | |
| Albumin human | Sigma | A9731-1G | |
| alpha actinin antibody | ThermoFisher | MA1-22863 | |
| B27 | Gibco | 17504-044 | |
| Blebbistatin | Sigma | B0560 | |
| CalBryte 520AM | AAT Bioquest | 20650 | |
| CELLvo MatrixPlus 96wp | StemBiosys | N/A | https://www.stembiosys.com/products/cellvo-matrix-plus |
| CHIR99021 | LC Laboratories | c-6556 | |
| Clear Assay medium (fluorobrite) | ThermoFisher | A1896701 | For adenovirus transduction |
| DAPI | ThermoFisher | 62248 | |
| DMEM:F12 | Gibco | 11330-032 | |
| FBS (Fetal Bovine Serum) | Sigma | F4135-500ML | |
| FluoVolt | ThermoFisher | F10488 | |
| HBSS | Gibco | 14025-092 | |
| iCell CM maintenance media | FUJIFILM/Cellular Dynamics | M1003 | |
| iCell2 CMs | FUJIFILM | 1434 | |
| Incucyte Zoom | Sartorius | ||
| iPS DF19-9-11T.H | WiCell | ||
| Isoproterenol | MilliporeSigma | CAS-51-30-9 | |
| IWP4 | Tocris | 5214 | |
| L-ascorbic acid 2-phosphate sesquimagnesium salt hydrate | Sigma | A8960-5g | |
| L-glutamine | Gibco | A2916801 | |
| LS columns | Miltenyii Biotec | 130-042-401 | |
| MACS Buffer (autoMACS Running Buffer) | Miltenyii Biotec | 130-091-221 | |
| Matrigel | Corning | 354234 | |
| MitoTracker Red | ThermoFisher | M7512 | |
| Nautilus HTS Optical Mapping | CuriBio | https://www.curibio.com/products-overview | |
| Nikon A1R Confocal Microscope | Nikon | ||
| nonessential amino acids | Gibco | 11140-050 | |
| pre-separation filter | Miltenyii Biotec | 130-041-407 | |
| PSC-Derived Cardiomyocyte Isolation Kit, human | Miltenyii Biotec | 130-110-188 | |
| Pulse | CuriBio | https://www.curibio.com/products-overview | |
| Quadro MACS separator (Magnet) | Miltenyii Biotec | 130-091-051 | |
| Retinoic acid | Sigma | R2625 | |
| RPMI 1640 | Gibco | 11875-093 | |
| RPMI 1640 (+HEPES, +L-Glutamine) | Gibco | 22400-089 | |
| StemMACS iPS-Brew XF | Miltenyii Biotec | 130-107-086 | |
| TnI antibody (pan TnI) | Millipore Sigma | MAB1691 | |
| Versene (ethylenediaminetetraacetic acid - EDTA solution) | Gibco | 15040-066 | |
| Y-27632 dihydrochloride | Tocris | 1254 | |
| β-mercaptoethanol | Gibco | 21985023 |
Riferimenti
- Blinova, K., et al. International multisite study of human-induced pluripotent stem cell-derived cardiomyocytes for drug proarrhythmic potential assessment. Cell Reports. 24 (13), 3582-3592 (2018).
- Ma, J., et al. High purity human-induced pluripotent stem cell-derived cardiomyocytes: electrophysiological properties of action potentials and ionic currents. American Journal of Physiology. Heart and Circulatory Physiology. 301 (5), 2006-2017 (2011).
- Lee, P., et al. Simultaneous voltage and calcium mapping of genetically purified human induced pluripotent stem cell-derived cardiac myocyte monolayers. Circulation Research. 110 (12), 1556-1563 (2012).
- Fermini, B., Coyne, S. T., Coyne, K. P. Clinical trials in a dish: a perspective on the coming revolution in drug development. SLAS Discovery. 23 (8), 765-776 (2018).
- Strauss, D. G., Blinova, K. Clinical trials in a dish. Trends in Pharmacological Sciences. 38 (1), 4-7 (2017).
- Blinova, K., et al. Clinical trial in a dish: personalized stem cell-derived cardiomyocyte assay compared with clinical trial results for two QT-prolonging drugs. Clinical and Translational Science. 12 (6), 687-697 (2019).
- Blinova,, et al. Comprehensive translational assessment of human-induced pluripotent stem cell derived cardiomyocytes for evaluating drug-induced arrhythmias. Toxicological Sciences. 155 (1), 234-247 (2017).
- da Rocha, A. M., et al. hiPSC-CM monolayer maturation state determines drug responsiveness in high throughput pro-arrhythmia screen. Scientific Reports. 7 (1), 13834(2017).
- da Rocha, A. M., Creech, J., Thonn, E., Mironov, S., Herron, T. J. Detection of drug-induced Torsades de Pointes arrhythmia mechanisms using hiPSC-CM syncytial monolayers in a high-throughput screening voltage sensitive dye assay. Toxicological Sciences. 173 (2), 402-415 (2020).
- Knollmann, B. C. Induced pluripotent stem cell-derived cardiomyocytes: boutique science or valuable arrhythmia model. Circulation Research. 112 (6), 969-976 (2013).
- Lam, C. K., Wu, J. C. Disease modelling and drug discovery for hypertrophic cardiomyopathy using pluripotent stem cells: how far have we come. European Heart Journal. 39 (43), 3893-3895 (2018).
- Jiang, Y., Park, P., Hong, S. M., Ban, K. Maturation of cardiomyocytes derived from human pluripotent stem cells: current strategies and limitations. Molecules and Cells. 41 (7), 613-621 (2018).
- Ahmed, R. E., Anzai, T., Chanthra, N., Uosaki, H. A brief review of current maturation methods for human induced pluripotent stem cells-derived cardiomyocytes. Frontiers in Cell and Developmental Biology. 8, 178(2020).
- Guo, Y., Pu, W. T. Cardiomyocyte maturation: new phase in development. Circulation Research. 126 (8), 1086-1106 (2020).
- Yang, X., Pabon, L., Murry, C. E. Engineering adolescence:maturation of human pluripotent stem cell-derived cardiomyocytes. Circulation Research. 114 (3), 511-523 (2014).
- Karbassi, E., et al. Cardiomyocyte maturation: advances in knowledge and implications for regenerative medicine. Nature Reviews Cardiology. 17 (6), 341-359 (2020).
- Nunes, S. S., et al. Biowire: a platform for maturation of human pluripotent stem cell-derived cardiomyocytes. Nature Methods. 10 (8), 781-787 (2013).
- Herron, T. J., et al. Extracellular matrix-mediated maturation of human pluripotent stem cell-derived cardiac monolayer structure and electrophysiological function. Circulation. Arrhythmia and Electrophysiology. 9 (4), 003638(2016).
- Block, T., et al. Human perinatal stem cell derived extracellular matrix enables rapid maturation of hiPSC-CM structural and functional phenotypes. Scientific Reports. 10 (1), 19071(2020).
- Gintant, G., et al. Repolarization studies using human stem cell-derived cardiomyocytes: Validation studies and best practice recommendations. Regulatory Toxicology and Pharmacology. 117, 104756(2020).
- Cyganek, L., et al. Deep phenotyping of human induced pluripotent stem cell-derived atrial and ventricular cardiomyocytes. JCI Insight. 3 (12), 99941(2018).
- Tohyama, S., et al. Distinct metabolic flow enables large-scale purification of mouse and human pluripotent stem cell-derived cardiomyocytes. Cell Stem Cell. 12 (1), 127-137 (2013).
- Davis, J., et al. In vitro model of ischemic heart failure using human induced pluripotent stem cell-derived cardiomyocytes. JCI Insight. 6 (10), 134368(2021).
- Diaz, R. J., Wilson, G. J. Studying ischemic preconditioning in isolated cardiomyocyte models. Cardiovascular Research. 70 (2), 286-296 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon