Method Article
使用成熟的人诱导多能干细胞来源心肌细胞单层进行高通量心脏毒性筛选
摘要
人诱导多能干细胞来源的心肌细胞(hiPSC-CMs)为使用动物进行临床前心脏毒性筛查提供了一种替代方案。hiPSC-CMs在临床前毒性筛查中广泛采用的一个限制是细胞的不成熟,胎儿样表型。这里介绍的是用于hiPSC-CMs稳健和快速成熟的方案。
摘要
人诱导干细胞来源的心肌细胞(hiPSC-CMs)用于替代和减少对动物和动物细胞的依赖,以进行临床前心脏毒性测试。在二维单层形式中,hiPSC-CMs概括了在最佳细胞外基质(ECM)上培养的成人心肌细胞的结构和功能。人围产期干细胞衍生的ECM(成熟诱导细胞外基质-MECM)在铺板后7天内使hiPSC-CM结构、功能和代谢状态成熟。
成熟的hiPSC-CM单层对临床相关药物也有预期的反应,已知有引起心律失常和心脏毒性的风险。到目前为止,hiPSC-CM单层的成熟是这些有价值的细胞广泛用于监管科学和安全筛选的障碍。本文介绍了用于hiPSC-CM电生理和收缩功能的电镀、成熟和高通量功能表型的验证方法。这些方法适用于市售纯化的心肌细胞,以及使用高效的腔室特异性分化方案在内部生成的干细胞来源的心肌细胞。
使用电压敏感染料 (VSD;发射波长:488 nm)、钙敏感荧光团 (CSF) 或基因编码钙传感器 (GCaMP6) 测量高通量电生理功能。高通量光学映射设备用于每个功能参数的光学记录,并使用定制的专用软件进行电生理数据分析。MECM方案用于使用正性肌力药物(异丙肾上腺素)和人乙醚相关基因(hERG)通道特异性阻断剂进行药物筛查。这些资源将使其他研究人员能够成功地利用成熟的hiPSC-CMs进行高通量,临床前心脏毒性筛查,心脏药物疗效测试和心血管研究。
引言
人诱导多能干细胞来源的心肌细胞(hiPSC-CMs)已在国际范围内得到验证,可用于体外心脏毒性筛查1。高纯度的hiPSC-CMs可以产生几乎无限的数量,冷冻保存和解冻。重新镀层后,它们也会复活并开始以让人联想到人类心脏的节奏收缩2,3。值得注意的是,单个hiPSC-CMs相互偶联并形成功能性合胞体,作为单个组织跳动。如今,hiPSCs通常来自患者的血液样本,因此任何人都可以使用体外hiPSC-CM心脏毒性筛查测定4,5来代表。这为进行"培养皿中的临床试验"创造了机会,来自不同人群的重要代表性6.
与现有的动物和动物细胞心脏毒性筛选方法相比,一个关键优势是hiPSC-CMs利用完整的人类基因组,并提供与人类心脏具有遗传相似性的体外系统。这对于药物基因组学和个性化医疗特别有吸引力 - 使用hiPSC-CMs进行药物和其他治疗开发预计将提供更准确,精确和安全的药物处方。事实上,二维(2D)hiPSC-CM单层测定已被证明可以预测药物的心脏毒性,使用一组临床使用的药物,已知有引起心律失常的风险1,7,8,9。尽管hiPSC-CMs具有巨大的潜力,并且有望简化和降低药物开发成本,但人们一直不愿意使用这些新型检测方法10,11,12。
到目前为止,广泛采用和接受hiPSC-CM筛查测定的一个主要限制是它们不成熟的胎儿外观以及它们的功能。hiPSC-CM成熟的关键问题已经在科学文献中进行了回顾和辩论,并进行了恶心13,14,15,16。同样,已经采用了许多方法来促进hiPSC-CM成熟,包括2D单层中的细胞外基质(ECM)操作和3D工程心脏组织(EHT)的开发17,18。目前,人们普遍认为,相对于基于2D单层的方法,使用3D EHT将提供更高的成熟度。然而,与 3D EHT 相比,2D 单层提供了更高的细胞利用效率,并提高了电镀成功率;3D EHT利用更多的细胞,并且通常需要包含可能混淆结果的其他细胞类型。因此,在本文中,重点是使用一种简单的方法来成熟培养为电和机械耦合细胞的2D单层的hiPSC-CMs。
先进的hiPSC-CM成熟可以使用ECM在2D单层中实现。hiPSC-CMs的2D单层可以使用柔软,灵活的聚二甲基硅氧烷盖玻片成熟,该盖玻片涂有由Engelbreth-Holm-Swarm小鼠肉瘤细胞(小鼠ECM)分泌的基底膜基质。2016年,报告显示,在这种软ECM条件下培养的hiPSC-CMs在功能上成熟,显示出接近成人心脏值(~50 cm / s)的动作电位传导速度18。此外,这些成熟的hiPSC-CMs显示出许多其他让人联想到成人心脏的电生理特征,包括超极化静息膜电位和K ir2.1的表达。最近,报告发现了一种人类围产期干细胞衍生的ECM涂层,可促进2D hiPSC-CMs19的结构成熟。在这里,提出了结构成熟的2D hiPSC-CM单层的易于使用的方法,用于高通量电生理筛选。此外,我们还使用电压敏感染料(VSD)和钙敏感探针和蛋白质,提供用于自动采集和分析2D hiPSC-CM单层电生理功能的光学映射仪器的验证。
研究方案
该协议中的hiPSC使用已获得密歇根大学HPSCO委员会(人类多能干细胞监督委员会)的批准。有关材料和设备的列表,请参阅 材料表 。有关培养基及其组成,请参见 表1 。
1. 解冻和接种市售冷冻保存的 hiPSC-CM,以便在诱导成熟的细胞外基质 (MECM) 上成熟
- 将所有试剂加热至室温,并在心肌细胞接种前用含有钙和镁的Hank平衡盐溶液(HBSS)或磷酸盐缓冲盐水(PBS)对MECM板进行再水化1小时(96孔板每孔200μL缓冲液)。
- 在心肌细胞接种前,用含有钙和镁的HBSS或PBS洗涤MECM板2小时(96孔板每孔200μL缓冲液),并保持孔水分。
- 准备37°C水浴。
- 从液氮罐中取出心肌细胞管,将管转移到干冰中,然后稍微打开管盖以释放压力。
注意:释放管中的 压力非常重要! 如果管内压力过大,它们可能会爆炸。 - 重新密封管盖并将其放入水浴中解冻4分钟。
注意:让它们完全解冻,以避免由于部分解冻而损坏细胞。 - 细胞解冻后,在打开前用70%乙醇喷洒试管。用 1 mL 移液器将细胞转移到 15 mL 锥形管中。缓慢滴入 8 mL 电镀介质,每次加入 1 mL 时搅拌试管,以使细胞适应渗透压的变化。
- 使用 1 mL 玻璃移液管用 1 mL 电镀介质清洗冷冻管。然后,将洗涤液慢慢滴入 15 mL 锥形管中。
- 将试管以~300 ×g 离心5分钟。吸出上清液并将沉淀重悬于1mL电镀介质中。取出等分试样并用血细胞计数器进行活细胞计数。加入额外的电镀介质以获得 7.5 × 105 个细胞/mL。
注意:制备96孔大约需要10 mL细胞悬液。 - 使用多通道移液器在MECM包被的96孔板的每孔中分配100μL细胞悬液。
注意:确保避免细胞沉淀,并在电镀时在所有孔中获得均匀的细胞密度。 - 将细胞在37°C,5%CO2 下孵育2天,然后将培养基更换为维持培养基(200μL /孔)。解冻后第 5 天更换维持培养基。在第 7 天或更晚进行 EP 测定,如前所述8,9。选择延长细胞培养物时,每隔一天更换一次培养基。
2. hiPSC心脏定向分化和hiPSC-CM纯化
- 温热的 1x 市售乙二胺四乙酸 (EDTA) 溶液、不含钙和镁的 HBSS (HBSS--) 和涂有由 Engelbreth-Holm-Swarm 小鼠肉瘤细胞(小鼠 ECM) 分泌的溶解基底膜基质的 6 孔板至室温。
- 通过相差显微镜和吸液/消融标记分化的菌落。用 1 mL HBSS 洗涤每个孔--.在含有>10个分化点的孔中进行两次洗涤。
- 吸出HBSS,并向每个孔中加入1mL的EDTA溶液。将板在37°C孵育长达5分钟。 3分钟后检查平板,寻找半透明的白色可见菌落。
- 吸出EDTA溶液并向单个孔中加入1 mL。使用 10 mL 玻璃移液管将所有干细胞从孔中分离出来,通过反复上下移液悬浮液,用 2 mL hiPSC 培养基去除细胞,并将细胞悬液转移到收集管中。重复抽吸并移位与后续孔。
注意:用玻璃移液器的尖端移开难以提起的菌落。 - 计数干细胞并将体积调节至板8.0×105 细胞/孔。在hiPSC培养基(2 mL /孔)上培养细胞,直到干细胞达到90%汇合(此时从现在开始称为D0)。
- 制备 2 mL 基础分化培养基,补充有 4 μM CHIR99021。
- 在D0上,每孔用1mL HBSS洗涤6孔干细胞板的每个孔。用补充有4μMCHIR99021的基础分化培养基代替HBSS。
- 在 D1 上,不执行任何操作。
- 在D2上,制备补充有4μMIWP4的基础分化培养基。
- 用每孔 2 mL 补充 IWP4 的基础分化培养基替换培养基。
- 在 D3 上,不对心室特异性分化执行任何操作。对于心房特异性分化,吸出培养基,每孔加入 2 mL 基础培养基,补充 4 μM IWP4 和 1 μM 视黄酸 (RA) 溶液。
- 在D4上,吸出培养基,每孔加入2 mL基础培养基以进行心室分化。对于心房分化,吸出培养基并每孔加入 2 mL 基础培养基,补充有 1 μM RA 溶液。
- 在 D5 上,什么都不做。
- 在D6上,吸出培养基,每孔加入2mL基础培养基(用于心房和心室分化)。
- 在 D7 上,什么都不做。
- 在D8上,吸出培养基并加入2mL心肌细胞维持培养基。每隔一天更换培养基,直到细胞分离,或遵循慢性药物暴露计划。
3. 通过MACS(磁性激活细胞分选) 纯 化hiPSC-CM
- 吸出细胞培养基并用 1 mL HBSS 洗涤每个孔--.通过加入 1 mL 0.25% 胰蛋白酶/EDTA 并在 37 °C、5% CO2 下孵育 10 分钟来解离细胞。用 2 mL 电镀培养基重悬并奇异化每个孔中的细胞以灭活胰蛋白酶/EDTA。
- 将六个孔中的细胞收集到带有 70 μm 过滤器的 50 mL 锥形管中。然后,用 3 mL 电镀介质清洗过滤器。计数细胞。
- 将悬浮液以~300× g 离心5分钟。吸出上清液并用 20 mL 冰冷的 MACS 分离缓冲液洗涤细胞。然后,再次以~300 ×g 离心5分钟。
- 将沉淀重悬于每 5 × 106 个细胞的 80 μL 冷 MACS 分离缓冲液中。每 5 × 106 个细胞添加 20 μL 冷非心肌细胞消耗鸡尾酒(人)。轻轻混合细胞悬液并在冰上孵育10分钟。
- 通过每 5 × 106 个细胞添加 4 mL 冷 MACS 分离缓冲液来洗涤样品。将样品以~300 ×g 离心5分钟并吸出上清液。
- 将沉淀重悬于每 5 × 106 个细胞的 80 μL 冷 MACS 分离缓冲液中。每 5 × 106 个细胞添加 20 μL 冷抗生素生物素微珠。轻轻混合细胞悬液并在冰上孵育10分钟。
- 在样品孵育时,将阳性去除柱(装有30 μm预分离过滤器)放在MACS分离器上,并将标记的15 mL收集管放置在柱下方。每 5 × 10个 6 个单元格需要一列。
- 每根色谱柱均加入 3 mL 冷 MACS 分离缓冲液。将抗体处理的细胞悬液与每 5 × 106 个细胞 2 mL MACS 分离缓冲液混合,并添加到色谱柱中。
注意:请勿离心!该步骤的离心对心肌细胞产量有不利影响。 - 向每根色谱柱中加入 2 mL MACS 分离缓冲液,并收集流出物,直到收集 12 mL 流通型心肌细胞悬浮液。
注意:切勿让色谱柱完全干燥。 - 将心肌细胞以~300× g 离心5分钟,弃去上清液,并将心肌细胞悬浮在1mL电镀培养基中。
- 计数细胞以确定浓度,将体积调整到所需的接种密度,然后将细胞铺板。将纯化的心肌细胞铺在MECM 96孔板上,如上述步骤1.9-1.11(7.5×105 细胞/孔)中所述。
4. 使用电压敏感染料 (VSD) 和钙敏感荧光团 (CSF) 进行光学映射
- 通过每毫升 HBSS 添加 1 μL VSD 染料和每 mL HBSS 添加 10 μL 上样佐剂,在 HBSS 中用钙和镁制备适量的 VSD。
注意:通常,96孔板需要10 mL的VSD溶液。 - 或者,用补充有5μM脑脊液的钙和镁制备HBSS。吸出心肌细胞维持培养基,并在 96 孔板中每孔用 100 μL 室间隔缺损或脑脊液替换。将细胞在细胞培养箱中孵育30分钟。
- 除去染料并用测定培养基或HBSS替换。在37°C下平衡,以使用高通量光学映射设备获取基线数据光学映射。
- 用药物处理细胞进行急性暴露测试,或绘制长期暴露于目标药物的细胞图谱。
- 对于 96 孔板的心脏毒性测试,请使用四剂化合物,每剂至少六孔。使用从低于到高于有效治疗血浆浓度的剂量,包括临床有效治疗血浆浓度的剂量。
- 将药物稀释在二甲基亚砜中,将其作为储备溶液储存在-20°C,然后在HBSS中稀释至所需浓度。
- 在药物应用之前进行基线电生理学测量,如第 5 节所述。一旦应用药物,至少30分钟后进行电生理学记录以进行慢性研究。有关光学映射数据采集和分析过程,请参阅以下部分。
5. 使用基因编码钙指示剂 (GECI) 进行光学映射
- 如上所述,市售或MACS纯化的hiPSC-CMs板,使用MECM包被的96孔板制备成熟的hiPSC-CM。为了形成融合的单层,每个96孔板的每孔板7.5×104 CM。使用电镀介质。
- 在电镀培养基中48小时后,切换到心肌细胞维持培养基。
- 在解冻和重新铺板后的第4天,以感染多重(MOI)= 5向细胞添加用于表达GCaMP6m(AdGCaMP6m)的重组腺病毒。使用CM测定培养基添加病毒。
注意:在这里,使用GCaMP6m的实验是在商业供应商的iCell2 心肌细胞中进行的。 - 在第5天,取出adGCaMP6m培养基并用新鲜的RPMI+B27(心肌细胞维持培养基)替换。
- 在第7天,使用显微镜或光学映射成像仪观察CM,以可视化自发收缩和相应的钙瞬变。
- 在第7天或更晚,对于药物筛选,将表达GCaMP6m的成熟hiPSC-CM单层的96孔板直接从培养箱转移到光学映射成像仪以进行基线数据采集。
- 电生理学数据采集后,将CM的板返回组织培养箱,以便在随后的时间点进行测量。
- 基线记录后,应用药物,每种药物至少使用四剂,每剂至少六口。在数据收集之前平衡细胞上的药物至少30分钟。在采集数据之前和期间将孔温加热至~37°C。
- 在整个板的基线记录之后,向每个孔中加入异丙肾上腺素(500nM),以获得可靠的药物反应数据。量化异丙肾上腺素对单层搏动率、收缩幅度(钙瞬态振幅)和钙瞬时持续时间(见 图 6)的影响,如第 5 节所述。
6. 光学测绘数据的获取和分析
- 确保光学映射设备相机、透射仪和板加热器已打开。
- 打开采集软件并确定文件保存位置。
- 打开前抽屉,将板放在板加热器上。
- 通过单击暗框按钮获取暗 框 。
- 选择 持续时间 (10-30 秒)和 帧速率 采集(例如,100 fps;250 fps 以获得更高的时间分辨率),然后单击 开始采集。
- 打开分析软件,在"导入/过滤器"选项卡中,选择"浏览单个文件"或"平铺多个"以重建板。
- 选择 参数模式 (APD 或 CaTD),输入 每像素距离,然后使用 孔向导 确定孔在图像中的位置。单击 "处理保存 "以移动到下一个选项卡。
- 打开 ROI (感兴趣区域)选项卡,然后选择 手动、 自动或 根本不使用ROI绘制ROI,然后考虑整个井进行分析。选择 ROI 后,单击 "处理/保存 "按钮转到下一步。选中 隐藏井 和 仅显示筛选 框以可视化投资回报率。
- 打开"分析"选项卡,然后在屏幕的右上角选择每个孔或ROI以确认自动节拍检测的准确性。通过按添加节拍/保存节拍,或选择单个节拍并按键盘上的 Delete 键,在轨迹中添加或删除节拍。
- 或者,使用平均热图功能为板的选定参数创建 热图 。
- 单击"分析"选项卡中的"时空图"按钮,可视化每个孔或ROI的数据。确保节拍检测准确后,继续 出口 选项卡并选择文件格式。按导出并为要导出的数据创建一个文件夹。继续打开数据文件并运行所选的统计分析例程。
注意:首选 .xlxs 文件,因为所有参数都导出到单个文件中;其他格式(.csv 或 .tsv)为每个参数生成一个文件。
结果
以相衬和免疫荧光共聚焦成像为特征的hiPSC-CM成熟
使用MECM包被的96孔板对市售hiPSC-CMs进行ECM介导的成熟时间表如图 1A所示。这些数据是使用市售的心肌细胞收集的,这些心肌细胞作为冷冻保存的细胞瓶到达实验室。每个小瓶含有>5×106 活心肌细胞。细胞纯度为~98%,并经过严格的质量控制测试(每个小瓶均提供分析证书)。大量的CM能够使用同一批次的细胞解冻和接种到不同的ECM组合上。 在图1中,hiPSC-CM接种在小鼠ECM或MECM包被的平板上。接种在MECM上的hiPSC-CMs成熟,在结构上与重新铺在小鼠ECM上的同一批hiPSC-CMs不同。也就是说,成熟细胞变成杆状,而未成熟的细胞保持圆形。这可以在相衬成像和心脏肌丝染色时看到(图1B;肌钙蛋白I [TnI],红色)。 图 2 显示了对 hiPSC-CM 结构成熟的更广泛验证。用α-肌动蛋白抗体染色的CM的大视场(20倍物镜)显示了在每个ECM条件下培养的细胞的典型形状。α-肌动蛋白是一种关键的结构蛋白,在心脏肌丝中以规则的间距排列。与 图1中的TnI染色一致,α-肌动蛋白染色进一步表明在MECM上培养的hiPSC-CMs的成熟。除了促进杆状成熟表型外,MECM还诱导更大的肌节组织(60x图像)。在小鼠ECM和MECM上培养的细胞之间的线粒体含量和活性也不同(图2B)。胎儿未成熟的hiPSC-CM线粒体含量仅限于核周空间,在细胞质中发现的线粒体很少。相反,成熟的hiPSC-CMs线粒体含量分布在整个细胞中。线粒体评估使用既定的方案19.
hiPSC 心脏定向分化和心腔规格
这里提供的是用于内部生产和成熟纯化的腔室特异性hiPSC-CMs的方案(图3A)。这是基于先前发表的报告20。本文介绍了使用市售的磁激活细胞分选(MACS)试剂盒进行hiPSC-CM纯化的详细程序。我们最近验证了MACS纯化的使用,并展示了与基于代谢的hiPSC-CM纯化相比,使用MACS的好处;通常,hiPSC-CM纯度预计高于95%21。需要指出的是,如果初始CM含量为<50%,MACS纯化可能仅达到~85%。在这些情况下,在非CM耗尽后,可能需要CM富集。如果分化的初始CM含量为>50%,则使用MACS试剂盒从细胞群中去除非CM可以达到>95%的纯度;在这种情况下,不需要进一步富集或正向选择CM。腔室特异性hiPSC-CMs也可以使用MECM包被的96孔板成熟,如上所述,如图1和图2所示。应该预期,心房特异性细胞(hiPSC-ACM)具有明显更快的自发搏搏率和更短的动作电位持续时间80(APD80)比心室特异性细胞(hiPSC-VCM)。这些是使用VSD和光学映射系统记录的动作电位的典型电生理数据(图3B-D)。
高通量心脏电生理光学映射
如果可以以高通量方式进行任何测定,则科学严谨性将大大提高。心脏毒性筛选数据如图4、图5、图6和图7所示,显示了在96孔板中使用成熟的hiPSC-CM单层进行高通量电生理筛选。APD80等参数的全板热图(图4A)揭示了板内给定参数从孔到孔的重现性。此外,全板热图可以快速检查数据集中的任何异常值。例如,在图4A所示板的E4孔中,很明显该孔具有更大的APD80值,由显示为黄色的孔表示,而其他孔为靛蓝色。成熟 2D hiPSC-CM 单层的典型动作电位(图 4B)让人联想到在培养中分离和测试的成人心肌细胞的动作电位形态。此外,典型的动作电位自发节律如图4C所示。图 4C 中的数据是第 A 行第 1-12 列的时空图。图4A中板块图上的白线描述了这一点。每个孔中随时间推移的每次明亮荧光闪光都代表一次自发激活。图5和图6显示了使用GCaMP6m基因编码钙指示剂(GECI)测量细胞内钙瞬变的效用;图6还显示了对异丙肾上腺素(经典心脏阳性正性肌力药物)的预期反应。响应于异丙肾上腺素,β1-肾上腺素能受体的激活引起正变时性(图6A),正性肌力(图6B)和正光性(图6C)。这些对异丙肾上腺素的反应表明hiPSC-CM β1-肾上腺素能受体和细胞内信号级联反应的显着成熟。
在图7中,显示了hiPSC-CM对人Ether-a-go-go相关基因(hERG)通道阻滞剂的反应,使用GCaMP6m钙荧光来监测节律并作为收缩力的替代标记物。E-4031 是一种 hERG 特异性通道阻滞剂,可减慢自发搏动率并增加钙瞬时持续时间 (CaTD80) 和三角测量(CaT 三角测量)。图7A显示了由E-4031 hERG通道阻塞引起的早期去极化后检测。还测试了其他hERG通道阻滞剂,包括多潘立酮,凡德他尼和索他洛尔,结果如图7E-G所示。这些化合物和剂量是根据最近的hiPSC-CM验证研究1,7,9选择的。
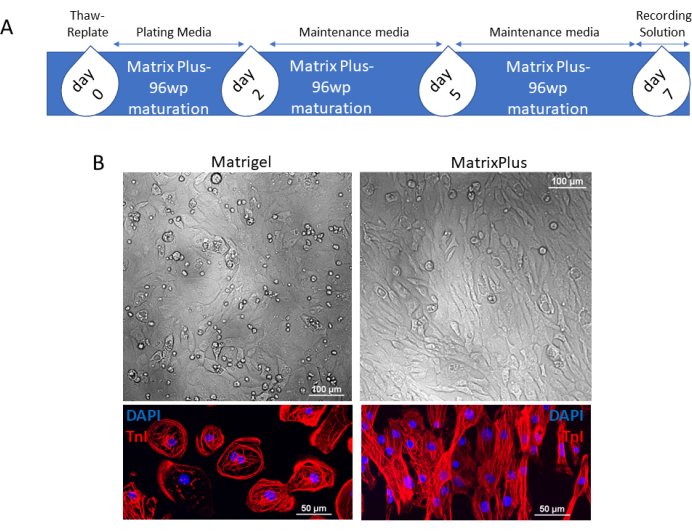
图1:市售或其他来源冷冻保存的hiPSC-CMs快速成熟的时间表 。 (A)悬浮在电镀培养基中的解冻心肌细胞在第0天施用于MECM。在第 2 天,用维持培养基替换培养基,在第 5 天更换用过的培养基。将细胞再培养2天,在第7天,hiPSC-CMs的成熟合胞体可以加载记录溶液用于下游应用或培养更长时间。(B)接种在小鼠ECM或MECM上的心肌细胞合胞体的对比阶段表明,与接种在MECM上的心肌细胞相比,接种在小鼠ECM上的心肌细胞具有更大的圆度;此外,TnI的免疫染色表明,与接种在MECM上的多形性和结构良好的hiPSC-CMs相比,接种在小鼠ECM上的心肌细胞保持径向对称形态和无组织的肌节。比例尺 = 100 μm(B,上部);50微米(B,下)。缩写:hiPSC-CMs = 人诱导的多能干细胞来源的心肌细胞;ECM = 细胞外基质;MECM = 诱导成熟的 ECM;96wp = 96孔板;DAPI = 4',6-二脒基-2-苯基吲哚;TnI = 肌钙蛋白 I. 请点击此处查看此图的大图。

图 2:接种在小鼠 ECM 或 MECM 上的 hiPSC-CM 的肌节组织比较。 (A) 针对 α-肌动蛋白免疫染色的小鼠 ECM 培养的 hiPSC-CMs 表明径向形态,与来自同一批次接种在基质上的 hiPSC-CM 相比,通过心肌细胞分散的肌节密度较低并呈现杆状形态 (20x)。(60x)用共聚焦显微镜观察hiPSC-CMs表明,与在MECM上培养的同一批次的hiPSC-CMs相比,在小鼠ECM上培养的hiPSC-CMs具有径向对称形态,肌节的周周分布更密集,径向肌节密度低。它们呈现沿细胞较长轴组织的肌节的均匀分布。比例尺 = 100 μm(上部);50 微米(下)。(B)用线粒体染料对在小鼠ECM或MECM上培养的hiPSC-CMs进行染色,该线粒体染料对具有高跨膜电位的线粒体进行染色,与MECM相比,在小鼠ECM上培养的心肌细胞的染色强度较低。此外,在MECM上培养的hiPSC-CMs具有均匀分布在心肌细胞中的线粒体,而培养在小鼠ECM上的hiPSC-CMs呈现线粒体的核周积累。比例尺 = 200 μm。缩写:hiPSC-CMs = 人诱导的多能干细胞来源的心肌细胞;ECM = 细胞外基质;MECM = 诱导成熟的 ECM;DAPI = 4',6-二脒基-2-苯基吲哚。请点击此处查看此图的大图。
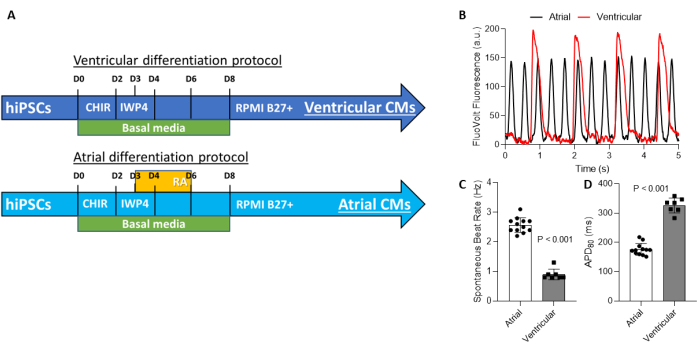
图3:腔室特异性心肌细胞的产生 。 (A)产生腔室特异性心肌细胞的方案具有相同的Wnt信号通路操作,从第0天到第2天通过抑制GSK3来刺激Wnt信号传导,并且在第2天和第4天之间抑制该途径。在第 3 天和第 6 天之间通过激活视黄酸途径和 Wnt 信号传导操作来实现腔室规格。(B)由于腔室规格,与心室心肌细胞相比,心房心肌细胞表现出更快的自发去极化速率。(C)与心房hiPSC-CMs相比,心室hiPSC-CMs的搏动率较慢;因此,与hiPSC-VCM相比,hiPSC-ACMs在80%复极化时的动作电位持续时间更短。缩写:hiPSC-CMs = 人诱导的多能干细胞来源的心肌细胞;hiPSC-ACM = 心房人诱导的多能干细胞来源的心肌细胞;hiPSC-VCM = 心室人诱导的多能干细胞衍生心肌细胞。 请点击此处查看此图的大图。
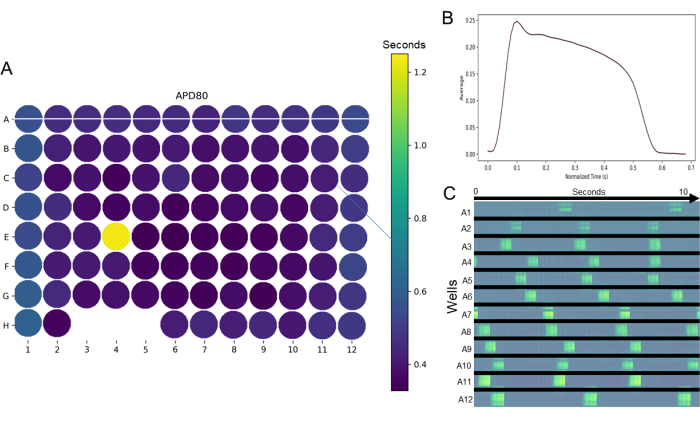
图 4:使用光学映射设备获取并使用 Pulse 分析的光学映射。 (A)热图示例,用于在电影过滤后对96孔板中评估的参数进行整体观察,并确定96孔板中感兴趣区域,使用光学映射设备映射。在此示例中,APD80% 热图指示异常值井 (E4) 和未能生成数据的井(井 H3、4 和 5)。(B)此外,用户友好的界面允许从所选孔轻松绘制平均动作电位形态。(C) 其他数据可视化工具可用;在本例中,从穿过A行(图A)上的水平线生成的时空图显示了在10 s的时间内每个孔的水平部分( A行上的白线)的激活。 请点击此处查看此图的大图。

图 5:使用基因编码钙指示剂绘制细胞内钙瞬时变化的时间表。 如图 1A所示,在将市售心肌细胞接种在MECM包被的96孔板中的第4天,细胞应在CM测定培养基中用5 MOI病毒转导过夜。用CDI维持培养基替换培养基直到第6天,并在第7天和第11天之间更换为不含酚红的CDI维持培养基,以便及时或连续监测Nautilus的细胞内钙瞬时变化。(B)在解冻后第7、9和10天用光学映射评估的AdGCaMP6f转导的hiPSC-CMs表明存在稳定的细胞内钙介导的荧光变化,允许在较长时间内对同一板进行每日光学映射,而无需重新应用钙敏感染料。缩写:GECI =基因编码钙指示剂;CM = 心肌细胞;MOI = 感染的多重性;96wp = 96孔板;BSA = 牛血清白蛋白。 请点击此处查看此图的大图。

图 6:快速轻松地利用热图直观地比较从 hiPSC-CM 与 Nautilus 的成熟功能合胞体获得的数据,并使用 Pulse 进行分析。 (A)用异丙肾上腺素处理的hiPSC-CMs显示出搏动率增加,如热图检查观察到的那样,并通过配对t检验证实。(B)同样,异丙肾上腺素治疗前后的细胞图谱通过热图的视觉比较和配对t检验显示β-肾上腺素能刺激的正性肌力作用。(C)最后,利用热图对数据进行视觉比较显示,β-肾上腺素能刺激的另一个典型效应,经配对t检验证实(p < 0.0001)。没有圆圈表示该特定井的数据采集/分析失败。缩写:hiPSC-CMs = 人诱导的多能干细胞来源的心肌细胞;ISO = 异丙肾上腺素。请点击此处查看此图的大图。

图 7:使用 hERG 通道阻滞剂验证 GECI 心脏毒性筛查测定。 (A)来自HBSS基线孔和存在500 nM E-4031的代表性自发钙通量痕迹。(乙-四)分别量化基线和+E-4031对搏动率、钙瞬时持续时间80(CaTD80)和钙瞬时三角测量(CaT三角测量)的影响。*,** 表示显著差异;不配对 t 检验; p < 0.01;每组 n = 8。(E)GECI检测另一种hERG阻滞剂多潘立酮。(F)凡德他尼诱导的hERG阻滞的GECI检测。(G)通过高剂量索他洛尔检测hERG阻滞的GECI。缩写:GECI =基因编码钙指示剂;hERG = 人类 Ether-a-go-go-related 基因。 请点击此处查看此图的大图。
表1:培养基及其组成 请点击此处下载此表格。
讨论
有几种不同的方法可以使用hiPSC-CMs进行 体外 心脏毒性筛查。最近一篇关于使用 hiPSC-CMs 的"最佳实践"论文介绍了各种 体外 测定、其主要读数,以及重要的是,每种测定的粒度以量化人类心脏电生理功能20。除了使用穿膜电极外,VSDs还提供了人类心脏电生理功能的最直接测量。 VSD检测读数能够直接可视化和量化关键电生理参数,包括动作电位持续时间、动作电位传播速度、动作电位上冲程、动作电位三角测量、搏动率、搏动规律性和动作电位持续时间异质性。同样,钙敏感探针提供有关hiPSC-CM单层节律、速率和事件持续时间的信息。使用荧光探针进行的hiPSC-CM钙瞬时测量还可以提供有关每次收缩的收缩力和收缩强度的信息。本文提供了在高通量VSD和钙瞬时测量测定中使用成熟的hiPSC-CM(96孔板)的方法。除了光学映射方法外,还介绍了用于高通量EP数据分析的软件。
这里概述的方法对于心脏毒性筛查和监管科学领域来说是一个重大进展。在这里,我们提出了在高通量筛选板(96孔板)中快速成熟和电生理记录2D hiPSC-CM单层的方法。使用此处所示的MECM(7天)快速成熟是以前要求成熟在30-100天内发生的方法的重大进步22,23。与其他需要手动应用每个实验的ECM相比,MECM板预涂有ECM,并到达实验室即可使用。MECM的这一方面使其比其他ECM涂层更易于使用,变化更少,效率更高。重要的是,这种方法既可用于冷冻保存的市售hiPSC-CMs,也可用于"自制"hiPSC-CM,后者可以是腔室特异性的。由于成熟hiPSC-CMs独特的杆状结构(图1 和 图2),重要的是要指出,与利用其他ECM的方案相比,这里需要更多的细胞来形成融合单层。值得注意的是,当使用小鼠ECM(细胞具有连续扩散的煎饼表型)时,我们每孔板50,000个hiPSC-CM,但是当使用MECM时,我们每孔板75,000个hiPSC-CM。如果细胞用于单细胞分析,例如膜片钳或任何其他需要单细胞的成像技术,也可以减少每孔的CM数量。
市售hiPSC-CMs为监管科学提供了优势,因为美国食品和药物管理局(FDA)领导的国际努力对这些细胞进行了广泛的表征。然而,市售细胞是淋巴结、心房和心室hiPSC-CM的混合物,它们提供高度相关的毒性信息,但缺乏模仿人类心脏的腔室特异性特征。腔特异性hiPSC-CMs重现了心房和心室心肌细胞之间众所周知的电生理差异,并为开发腔室特异性抗心律失常疗法提供了体外测定(图3B-D)。例如,现在可以使用接种在96孔板中的hiPSC-ACM单层进行测试和开发心房颤动特异性药物,以进行稳健而严格的数据收集。同样,在筛查以确定化合物是否引起尖端扭转型室性心动过速(TdP)(一种高风险室性心律失常)时,最好不要让心房和淋巴结细胞"污染"心室心脏单层。因此,尽管迄今为止由FDA领导的hiPSC-CM验证工作集中在使用市售CMs上,但未来的监管科学建议很可能会转向使用腔室特异性细胞,以使毒性筛查更能预测人类心脏病。这里概述的方法基于以前的报告,并为产生来自多能干细胞的腔室特异性心肌细胞提供了一种可靠的方法21。
这些方案与现场常用方案之间的主要区别在于所使用的纯化方法。大多数在自己的实验室中产生hiPSC-CM的实验室依赖于代谢介导的心肌细胞选择22。在这里,我们依靠使用MACS纯化hiPSC-CMs,使用临床批准的细胞处理方法,产生具有更健康表型的CMs23。代谢激发方法是有效的,但使用模拟心肌缺血的培养基配方24.当利用 macs 纯化 hiPSC-CM 时,重要的是利用非 CM 去除混合物,该混合物针对非 CM 从细胞群中去除磁耗。使用非CM耗尽方法可最大程度地减少CM在磁柱中遇到的剪切应力,并且优于CM群的直接磁性标记。使用MACS纯化腔室特异性细胞将使其他实验室能够产生健康的CM用于研究和毒性测试。
披露声明
TB 是 StemBioSys, Inc. 的员工,AMR 和 JC 是 StemBioSys, Inc. 的前顾问,TJH、TB、AMR 和 JC 是 StemBioSys, Inc. 的股东。
致谢
这项工作得到了NIH拨款HL148068-04和R44ES027703-02(TJH)的支持。
材料
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin EDTA | Gibco | 25200-056 | |
| 0.5 mg/mL BSA (7.5 µmol/L) | Millipore Sigma | A3294 | |
| 2.9788 g/500 mL HEPES (25 mmol/L) | Millipore Sigma | H4034 | |
| AdGCaMP6m | Vector biolabs | 1909 | |
| Albumin human | Sigma | A9731-1G | |
| alpha actinin antibody | ThermoFisher | MA1-22863 | |
| B27 | Gibco | 17504-044 | |
| Blebbistatin | Sigma | B0560 | |
| CalBryte 520AM | AAT Bioquest | 20650 | |
| CELLvo MatrixPlus 96wp | StemBiosys | N/A | https://www.stembiosys.com/products/cellvo-matrix-plus |
| CHIR99021 | LC Laboratories | c-6556 | |
| Clear Assay medium (fluorobrite) | ThermoFisher | A1896701 | For adenovirus transduction |
| DAPI | ThermoFisher | 62248 | |
| DMEM:F12 | Gibco | 11330-032 | |
| FBS (Fetal Bovine Serum) | Sigma | F4135-500ML | |
| FluoVolt | ThermoFisher | F10488 | |
| HBSS | Gibco | 14025-092 | |
| iCell CM maintenance media | FUJIFILM/Cellular Dynamics | M1003 | |
| iCell2 CMs | FUJIFILM | 1434 | |
| Incucyte Zoom | Sartorius | ||
| iPS DF19-9-11T.H | WiCell | ||
| Isoproterenol | MilliporeSigma | CAS-51-30-9 | |
| IWP4 | Tocris | 5214 | |
| L-ascorbic acid 2-phosphate sesquimagnesium salt hydrate | Sigma | A8960-5g | |
| L-glutamine | Gibco | A2916801 | |
| LS columns | Miltenyii Biotec | 130-042-401 | |
| MACS Buffer (autoMACS Running Buffer) | Miltenyii Biotec | 130-091-221 | |
| Matrigel | Corning | 354234 | |
| MitoTracker Red | ThermoFisher | M7512 | |
| Nautilus HTS Optical Mapping | CuriBio | https://www.curibio.com/products-overview | |
| Nikon A1R Confocal Microscope | Nikon | ||
| nonessential amino acids | Gibco | 11140-050 | |
| pre-separation filter | Miltenyii Biotec | 130-041-407 | |
| PSC-Derived Cardiomyocyte Isolation Kit, human | Miltenyii Biotec | 130-110-188 | |
| Pulse | CuriBio | https://www.curibio.com/products-overview | |
| Quadro MACS separator (Magnet) | Miltenyii Biotec | 130-091-051 | |
| Retinoic acid | Sigma | R2625 | |
| RPMI 1640 | Gibco | 11875-093 | |
| RPMI 1640 (+HEPES, +L-Glutamine) | Gibco | 22400-089 | |
| StemMACS iPS-Brew XF | Miltenyii Biotec | 130-107-086 | |
| TnI antibody (pan TnI) | Millipore Sigma | MAB1691 | |
| Versene (ethylenediaminetetraacetic acid - EDTA solution) | Gibco | 15040-066 | |
| Y-27632 dihydrochloride | Tocris | 1254 | |
| β-mercaptoethanol | Gibco | 21985023 |
参考文献
- Blinova, K., et al. International multisite study of human-induced pluripotent stem cell-derived cardiomyocytes for drug proarrhythmic potential assessment. Cell Reports. 24 (13), 3582-3592 (2018).
- Ma, J., et al. High purity human-induced pluripotent stem cell-derived cardiomyocytes: electrophysiological properties of action potentials and ionic currents. American Journal of Physiology. Heart and Circulatory Physiology. 301 (5), 2006-2017 (2011).
- Lee, P., et al. Simultaneous voltage and calcium mapping of genetically purified human induced pluripotent stem cell-derived cardiac myocyte monolayers. Circulation Research. 110 (12), 1556-1563 (2012).
- Fermini, B., Coyne, S. T., Coyne, K. P. Clinical trials in a dish: a perspective on the coming revolution in drug development. SLAS Discovery. 23 (8), 765-776 (2018).
- Strauss, D. G., Blinova, K. Clinical trials in a dish. Trends in Pharmacological Sciences. 38 (1), 4-7 (2017).
- Blinova, K., et al. Clinical trial in a dish: personalized stem cell-derived cardiomyocyte assay compared with clinical trial results for two QT-prolonging drugs. Clinical and Translational Science. 12 (6), 687-697 (2019).
- Blinova,, et al. Comprehensive translational assessment of human-induced pluripotent stem cell derived cardiomyocytes for evaluating drug-induced arrhythmias. Toxicological Sciences. 155 (1), 234-247 (2017).
- da Rocha, A. M., et al. hiPSC-CM monolayer maturation state determines drug responsiveness in high throughput pro-arrhythmia screen. Scientific Reports. 7 (1), 13834(2017).
- da Rocha, A. M., Creech, J., Thonn, E., Mironov, S., Herron, T. J. Detection of drug-induced Torsades de Pointes arrhythmia mechanisms using hiPSC-CM syncytial monolayers in a high-throughput screening voltage sensitive dye assay. Toxicological Sciences. 173 (2), 402-415 (2020).
- Knollmann, B. C. Induced pluripotent stem cell-derived cardiomyocytes: boutique science or valuable arrhythmia model. Circulation Research. 112 (6), 969-976 (2013).
- Lam, C. K., Wu, J. C. Disease modelling and drug discovery for hypertrophic cardiomyopathy using pluripotent stem cells: how far have we come. European Heart Journal. 39 (43), 3893-3895 (2018).
- Jiang, Y., Park, P., Hong, S. M., Ban, K. Maturation of cardiomyocytes derived from human pluripotent stem cells: current strategies and limitations. Molecules and Cells. 41 (7), 613-621 (2018).
- Ahmed, R. E., Anzai, T., Chanthra, N., Uosaki, H. A brief review of current maturation methods for human induced pluripotent stem cells-derived cardiomyocytes. Frontiers in Cell and Developmental Biology. 8, 178(2020).
- Guo, Y., Pu, W. T. Cardiomyocyte maturation: new phase in development. Circulation Research. 126 (8), 1086-1106 (2020).
- Yang, X., Pabon, L., Murry, C. E. Engineering adolescence:maturation of human pluripotent stem cell-derived cardiomyocytes. Circulation Research. 114 (3), 511-523 (2014).
- Karbassi, E., et al. Cardiomyocyte maturation: advances in knowledge and implications for regenerative medicine. Nature Reviews Cardiology. 17 (6), 341-359 (2020).
- Nunes, S. S., et al. Biowire: a platform for maturation of human pluripotent stem cell-derived cardiomyocytes. Nature Methods. 10 (8), 781-787 (2013).
- Herron, T. J., et al. Extracellular matrix-mediated maturation of human pluripotent stem cell-derived cardiac monolayer structure and electrophysiological function. Circulation. Arrhythmia and Electrophysiology. 9 (4), 003638(2016).
- Block, T., et al. Human perinatal stem cell derived extracellular matrix enables rapid maturation of hiPSC-CM structural and functional phenotypes. Scientific Reports. 10 (1), 19071(2020).
- Gintant, G., et al. Repolarization studies using human stem cell-derived cardiomyocytes: Validation studies and best practice recommendations. Regulatory Toxicology and Pharmacology. 117, 104756(2020).
- Cyganek, L., et al. Deep phenotyping of human induced pluripotent stem cell-derived atrial and ventricular cardiomyocytes. JCI Insight. 3 (12), 99941(2018).
- Tohyama, S., et al. Distinct metabolic flow enables large-scale purification of mouse and human pluripotent stem cell-derived cardiomyocytes. Cell Stem Cell. 12 (1), 127-137 (2013).
- Davis, J., et al. In vitro model of ischemic heart failure using human induced pluripotent stem cell-derived cardiomyocytes. JCI Insight. 6 (10), 134368(2021).
- Diaz, R. J., Wilson, G. J. Studying ischemic preconditioning in isolated cardiomyocyte models. Cardiovascular Research. 70 (2), 286-296 (2006).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。