Method Article
Hochdurchsatz-Kardiotoxizitäts-Screening unter Verwendung von reifen, humaninduzierten pluripotenten Stammzell-Kardiomyozyten-Monoschichten
In diesem Artikel
Zusammenfassung
Humane induzierte pluripotente Stammzell-abgeleitete Kardiomyozyten (hiPSC-CMs) bieten eine Alternative zur Verwendung von Tieren für das präklinische Kardiotoxizitäts-Screening. Eine Einschränkung für die weit verbreitete Einführung von hiPSC-CMs im präklinischen Toxizitätsscreening ist der unreife, fetale Phänotyp der Zellen. Hier werden Protokolle für eine robuste und schnelle Reifung von hiPSC-CMs vorgestellt.
Zusammenfassung
Aus humanen Stammzellen gewonnene Kardiomyozyten (hiPSC-CMs) werden verwendet, um die Abhängigkeit von Tieren und tierischen Zellen für präklinische Kardiotoxizitätstests zu ersetzen und zu verringern. In zweidimensionalen Monolayer-Formaten rekapitulieren hiPSC-CMs die Struktur und Funktion der adulten menschlichen Herzmuskelzellen, wenn sie auf einer optimalen extrazellulären Matrix (EZM) kultiviert werden. Eine aus humanen perinatalen Stammzellen gewonnene EZM (Maturation-inducing extracellular matrix-MECM) reift die hiPSC-CM-Struktur, -Funktion und den Stoffwechselzustand innerhalb von 7 Tagen nach der Plattierung.
Reife hiPSC-CM-Monoschichten sprechen auch auf klinisch relevante Medikamente erwartungsgemäß an, wobei ein bekanntes Risiko besteht, Herzrhythmusstörungen und Kardiotoxizität zu verursachen. Die Reifung von hiPSC-CM-Monoschichten war bisher ein Hindernis für die breite Akzeptanz dieser wertvollen Zellen für die regulatorische Wissenschaft und das Sicherheitsscreening. In diesem Artikel werden validierte Methoden für das Platting, die Reifung und die funktionelle Phänotypisierung der elektrophysiologischen und kontraktilen Funktion von hiPSC-CM vorgestellt. Diese Methoden gelten sowohl für kommerziell erhältliche gereinigte Kardiomyozyten als auch für aus Stammzellen gewonnene Kardiomyozyten, die intern mit hocheffizienten, kammerspezifischen Differenzierungsprotokollen erzeugt werden.
Die elektrophysiologische Funktion im Hochdurchsatz wird entweder mit spannungsempfindlichen Farbstoffen (VSDs; Emission: 488 nm), kalziumempfindlichen Fluorophoren (CSFs) oder genetisch kodierten Kalziumsensoren (GCaMP6) gemessen. Ein optisches Hochdurchsatz-Kartierungsgerät wird für die optische Aufzeichnung jedes Funktionsparameters verwendet, und eine spezielle Software wird für die elektrophysiologische Datenanalyse verwendet. MECM-Protokolle werden für das Medikationsscreening unter Verwendung eines positiven inotropen (Isoprenalin) und humanen Ether-a-go-go-related gene (hERG)-Kanal-spezifischen Blockers angewendet. Diese Ressourcen werden es anderen Prüfärzten ermöglichen, ausgereifte hiPSC-CMs erfolgreich für Hochdurchsatz, präklinisches Kardiotoxizitätsscreening, Wirksamkeitstests von Herzmedikamenten und kardiovaskuläre Forschung einzusetzen.
Einleitung
Humane induzierte pluripotente Stammzell-abgeleitete Kardiomyozyten (hiPSC-CMs) wurden auf internationaler Ebene validiert und stehen für ein In-vitro-Kardiotoxizitäts-Screening zur Verfügung 1. Hochreine hiPSC-CMs können in nahezu unbegrenzter Anzahl erzeugt, kryokonserviert und aufgetaut werden. Nach dem Umplattieren reanimieren sie sich ebenfalls und beginnen sich mit einem Rhythmus zusammenzuziehen, der an das menschliche Herz erinnert 2,3. Bemerkenswert ist, dass einzelne hiPSC-CMs aneinander koppeln und funktionelle Synzytien bilden, die als ein einziges Gewebe schlagen. Heutzutage werden hiPS-Zellen routinemäßig aus Blutproben von Patienten gewonnen, so dass jede Person mit In-vitro-hiPSC-CM-Screening-Assays für die Kardiotoxizität dargestellt werden kann 4,5. Dies schafft die Möglichkeit, "klinische Studien in einer Schale" durchzuführen, bei denen verschiedene Populationen signifikant vertreten sind6.
Ein entscheidender Vorteil gegenüber bestehenden Screening-Ansätzen für die Kardiotoxizität von Tieren und tierischen Zellen besteht darin, dass hiPSC-CMs das gesamte menschliche Genom nutzen und ein In-vitro-System mit genetischen Ähnlichkeiten zum menschlichen Herzen bieten. Dies ist besonders attraktiv für die Pharmakogenomik und die personalisierte Medizin - die Verwendung von hiPSC-CMs für die Entwicklung von Medikamenten und anderen Therapien soll genauere, präzisere und sicherere Medikamentenverschreibungen ermöglichen. In der Tat haben sich zweidimensionale (2D) hiPSC-CM-Monolayer-Assays als prädiktiv für die Kardiotoxizität von Medikamenten erwiesen, wobei eine Reihe von klinisch eingesetzten Medikamenten mit einem bekannten Risiko für die Entstehung von Herzrhythmusstörungen verwendetwird 1,7,8,9. Trotz des enormen Potenzials von hiPSC-CMs und des Versprechens, die Arzneimittelentwicklung zu rationalisieren und billiger zu machen, gab es eine Zurückhaltung bei der Verwendung dieser neuartigen Assays10,11,12.
Bisher ist eine wesentliche Einschränkung der weit verbreiteten Einführung und Akzeptanz von hiPSC-CM-Screening-Assays ihr unreifes, fetales Aussehen sowie ihre Funktion. Die kritische Frage der hiPSC-CM-Reifung wurde in der wissenschaftlichen Literatur bis zum Überdruss diskutiert 13,14,15,16. Ebenso wurden viele Ansätze eingesetzt, um die hiPSC-CM-Reifung zu fördern, darunter Manipulationen der extrazellulären Matrix (EZM) in 2D-Monoschichten und die Entwicklung von 3D-manipuliertem Herzgewebe (EHTs)17,18. Derzeit herrscht die weit verbreitete Überzeugung, dass die Verwendung von 3D-EHTs im Vergleich zu 2D-Monolayer-basierten Ansätzen eine bessere Reifung bieten wird. 2D-Monolagen bieten jedoch im Vergleich zu 3D-EHTs eine höhere Effizienz der Zellnutzung und einen höheren Erfolg bei der Beschichtung. 3D-EHTs verwenden eine größere Anzahl von Zellen und erfordern oft die Einbeziehung anderer Zelltypen, die die Ergebnisse verfälschen können. Daher liegt der Fokus in diesem Artikel auf der Verwendung einer einfachen Methode zur Reifung von hiPSC-CMs, die als 2D-Monolagen aus elektrisch und mechanisch gekoppelten Zellen kultiviert werden.
Eine fortgeschrittene hiPSC-CM-Reifung kann in 2D-Monolagen mit einem ECM erreicht werden. Die 2D-Monoschichten von hiPSC-CMs können mit Hilfe eines weichen, flexiblen Polydimethylsiloxan-Deckglases gereift werden, das mit einer Basalmembranmatrix beschichtet ist, die von einer Engelbreth-Holm-Schwarm-Maussarkomzelle (Maus-EZM) sezerniert wird. Im Jahr 2016 zeigten Berichte, dass hiPSC-CMs, die unter dieser weichen EZM-Erkrankung kultiviert wurden, funktionell reiften und Aktionspotential-Leitungsgeschwindigkeiten in der Nähe von Herzwerten bei Erwachsenen (~50 cm/s) aufwiesen18. Darüber hinaus zeigten diese reifen hiPSC-CMs viele andere elektrophysiologische Eigenschaften, die an das adulte Herz erinnern, einschließlich des hyperpolarisierten Ruhemembranpotentials und der Expression von Kir2.1. In jüngerer Zeit wurde in Berichten eine aus humanen perinatalen Stammzellen gewonnene EZM-Beschichtung identifiziert, die die strukturelle Reifung von 2D-hiPSC-CMs fördert19. Hier werden einfach anzuwendende Methoden vorgestellt, um strukturell ausgereifte 2D-hiPSC-CM-Monolagen für den Einsatz in elektrophysiologischen Hochdurchsatz-Screens zu entwickeln. Darüber hinaus bieten wir die Validierung eines optischen Mapping-Instruments für die automatisierte Erfassung und Analyse der elektrophysiologischen Funktion von 2D-hiPSC-CM-Monolayern unter Verwendung spannungsempfindlicher Farbstoffe (VSDs) und kalziumsensitiver Sonden und Proteine an.
Protokoll
Die Verwendung von hiPSC in diesem Protokoll wurde vom HPSCRO-Komitee der Universität Michigan (Human Pluripotent Stem Cell Oversight Committee) genehmigt. In der Materialtabelle finden Sie eine Liste der Materialien und Geräte. Siehe Tabelle 1 für Medien und ihre Zusammensetzungen.
1. Auftauen und Plattieren kommerziell erhältlicher kryokonservierter hiPSC-CMs zur Reifung auf einer reifungsinduzierenden extrazellulären Matrix (MECM)
- Erwärmen Sie alle Reagenzien auf Raumtemperatur und rehydrieren Sie die MECM-Platten mit Hanks balancierter Salzlösung (HBSS) oder phosphatgepufferter Kochsalzlösung (PBS), die Kalzium und Magnesium enthält, für 1 Stunde vor der Kardiomyozytenbeschichtung (200 μl Puffer pro Vertiefung einer 96-Well-Platte).
- Waschen Sie die MECM-Platten 2x mit kalzium- und magnesiumhaltigem HBSS oder PBS für 1 h vor der Kardiomyozytenbeschichtung (200 μl Puffer pro Vertiefung einer 96-Well-Platte) und halten Sie die Wells hydratisiert.
- Bereiten Sie ein 37 °C warmes Wasserbad vor.
- Entfernen Sie die Kardiomyozytenröhrchen aus dem Flüssigstickstofftank, legen Sie die Röhrchen auf Trockeneis und öffnen Sie die Röhrchenkappen leicht, um den Druck abzulassen.
HINWEIS: Das Ablassen des Drucks in den Schläuchen ist äußerst wichtig! Wenn sich in den Rohren zu viel Druck aufbaut, können sie explodieren. - Verschließen Sie die Tubenkappen wieder und legen Sie sie zum Auftauen für 4 Minuten in das Wasserbad.
Anmerkungen: Lassen Sie sie vollständig auftauen, um Zellschäden durch teilweises Auftauen zu vermeiden. - Nachdem die Zellen aufgetaut sind, besprühen Sie die Röhrchen vor dem Öffnen mit 70%igem Ethanol. Übertragen Sie die Zellen mit einer 1-ml-Pipette in konische 15-ml-Röhrchen. Träufeln Sie langsam 8 ml Beschichtungsmedium ab und bewegen Sie das Röhrchen jedes Mal, wenn 1 ml hinzugefügt wird, damit sich die Zellen an Änderungen der Osmolarität anpassen können.
- Waschen Sie das Kryomaterial mit 1 ml Beschichtungsmedium und einer 1-ml-Glaspipette. Anschließend die Wäsche langsam in das konische 15-ml-Röhrchen tropfen.
- Zentrifugieren Sie die Röhrchen bei ~300 × g für 5 Minuten. Saugen Sie den Überstand ab und resuspendieren Sie das Pellet in 1 ml Beschichtungsmedium. Entfernen Sie ein Aliquot und führen Sie die Lebendzellzählung mit einem Hämozytometer durch. Fügen Sie zusätzliches Beschichtungsmedium hinzu, um 7,5 × 105 Zellen/ml zu erhalten.
HINWEIS: Für die Aufbereitung von 96 Wells sind ca. 10 ml Zellsuspension erforderlich. - Dosieren Sie 100 μl Zellsuspension pro Well einer MECM-beschichteten 96-Well-Platte mit einer Mehrkanalpipette.
HINWEIS: Achten Sie darauf, eine Zellausfällung zu vermeiden und während der Beschichtung eine gleichmäßige Zelldichte in allen Vertiefungen zu erzielen. - Inkubieren Sie die Zellen 2 Tage lang bei 37 °C, 5 % CO2, bevor das Medium in ein Erhaltungsmedium (200 μL/Well) umgestellt wird. Wechseln Sie das Pflegemedium am 5. Tag nach dem Auftauen. Führen Sie EP-Assays an Tag 7 oder später durch, wie zuvor beschrieben 8,9. Wechseln Sie das Medium jeden zweiten Tag, wenn Sie sich für die Erweiterung der Zellkultur entscheiden.
2. herzgesteuerte HiPSC-Differenzierung und hiPSC-CM-Aufreinigung
- Erwärmen Sie 1x kommerziell erhältliche Ethylendiamintetraessigsäure (EDTA)-Lösung, HBSS ohne Calcium und Magnesium (HBSS--) und 6-Well-Platten, die mit einer solubilisierten Basalmembranmatrix beschichtet sind, die von einer Engelbreth-Holm-Swarm-Maussarkomzelle (Maus-ECM) sezerniert wird, auf Raumtemperatur.
- Markieren Sie die differenzierten Kolonien durch Phasenkontrastmikroskopie und aspirieren/abtragen. Waschen Sie jede Vertiefung mit 1 ml HBSS--. Führen Sie zwei Waschgänge in Vertiefungen durch, die >10 Differenzierungspunkte enthalten.
- Saugen Sie das HBSS ab und geben Sie 1 ml EDTA-Lösung in jede Vertiefung. Die Platten bis zu 5 min bei 37 °C inkubieren. Überprüfen Sie die Platten nach 3 Minuten und suchen Sie nach durchscheinenden weißen, sichtbaren Kolonien.
- Saugen Sie die EDTA-Lösung an und geben Sie 1 ml in eine einzelne Vertiefung. Entfernen Sie die Zellen mit 2 ml hiPSC-Medium, indem Sie die Suspension wiederholt auf und ab pipettieren, wobei Sie eine 10-ml-Glaspipette verwenden, um alle Stammzellen aus der Vertiefung zu lösen, und übertragen Sie die Zellsuspension in ein Sammelröhrchen. Wiederholen Sie das Absaugen und Lösen mit nachfolgenden Vertiefungen.
Anmerkungen: Schwer anzuhebende Kolonien mit der Spitze der Glaspipette entfernen. - Zählen Sie die Stammzellen und stellen Sie das Volumen auf Platte 8,0 × 105 Zellen/Well ein. Kultivieren Sie die Zellen auf hiPSC-Medium (2 ml/Well), bis die Stammzellen eine Konfluenz von 90% erreicht haben (dieses Mal wird von nun an als D0 bezeichnet).
- Bereiten Sie 2 ml Basaldifferenzierungsmedium vor, ergänzt mit 4 μM CHIR99021.
- Waschen Sie auf D0 jede Vertiefung einer 6-Well-Platte mit Stammzellen mit 1 ml HBSS pro Well. Ersetzen Sie das HBSS durch ein basales Differenzierungsmedium, das mit 4 μM CHIR99021 ergänzt wird.
- Tun Sie auf D1 nichts.
- Auf D2 wird ein basales Differenzierungsmedium hergestellt, das mit 4 μM IWP4 ergänzt wird.
- Ersetzen Sie das Medium durch 2 ml IWP4-supplementiertes Basaldifferenzierungsmedium pro Well.
- Tun Sie an D3 nichts für eine ventrikuläre Differenzierung. Für eine atrialspezifische Differenzierung wird das Medium abgesaugt und 2 ml Basalmedium, ergänzt mit 4 μM IWP4 und 1 μM Retinsäure (RA)-Lösung, pro Well hinzugefügt.
- Auf D4 saugen Sie das Medium ab und fügen Sie 2 ml Basalmedium pro Vertiefung hinzu, um die ventrikuläre Differenzierung zu gewährleisten. Für eine Vorhofdifferenzierung saugen Sie das Medium ab und fügen Sie 2 ml Basalmedium hinzu, das mit 1 μM RA-Lösung pro Well angereichert ist.
- Tun Sie auf D5 nichts.
- Auf D6 saugen Sie das Medium an und fügen Sie 2 ml Basalmedium pro Vertiefung hinzu (sowohl für die atriale als auch für die ventrikuläre Differenzierung).
- Tun Sie auf D7 nichts.
- Auf D8 saugen Sie das Medium an und fügen Sie 2 ml Kardiomyozyten-Erhaltungsmedium hinzu. Wechseln Sie das Medium jeden zweiten Tag bis zur Zelltrennung oder befolgen Sie einen chronischen Drogenexpositionsplan.
3. hiPSC-CM-Aufreinigung mittels MACS (magnetisch aktivierte Zellsortierung)
- Saugen Sie das Zellkulturmedium ab und waschen Sie es mit jeweils 1 ml HBSS aus--. Dissoziieren Sie die Zellen durch Zugabe von 1 ml 0,25% Trypsin/EDTA und Inkubation bei 37 °C, 5% CO2 für 10 min. Resuspendieren und singularisieren Sie die Zellen in jeder Vertiefung mit 2 ml Beschichtungsmedium, um das Trypsin/EDTA zu inaktivieren.
- Sammeln Sie die Zellen aus den sechs Vertiefungen in einem konischen 50-ml-Röhrchen mit einem 70-μm-Sieb. Waschen Sie dann das Sieb mit 3 ml Beschichtungsmedium. Zählen Sie die Zellen.
- Zentrifugieren Sie die Suspension bei ~300 × g für 5 Minuten. Saugen Sie den Überstand ab und waschen Sie die Zellen mit 20 ml eiskaltem MACS-Trennpuffer. Dann erneut bei ~300 × g für 5 min zentrifugieren.
- Resuspendieren Sie das Pellet in 80 μl kaltem MACS-Trennpuffer pro 5 × 106 Zellen . Fügen Sie 20 μl kalten Cocktail zur Depletion von Nicht-Kardiomyozyten (Mensch) pro 5 × 106 Zellen hinzu. Mischen Sie die Zellsuspension vorsichtig und inkubieren Sie sie 10 Minuten lang auf Eis.
- Waschen Sie die Probe, indem Sie 4 ml kalten MACS-Trennpuffer pro 5 × 106 Zellen hinzufügen. Zentrifugieren Sie die Probe bei ~300 × g für 5 min und saugen Sie den Überstand ab.
- Resuspendieren Sie das Pellet in 80 μl kaltem MACS-Trennpuffer pro 5 × 106 Zellen . Fügen Sie 20 μl kalte Antibiotin-Mikrokügelchen pro 5 × 106 Zellen hinzu. Mischen Sie die Zellsuspension vorsichtig und inkubieren Sie sie 10 Minuten lang auf Eis.
- Platzieren Sie während der Inkubation der Proben die Säulen mit positiver Depletion (ausgestattet mit den 30-μm-Vorseparationsfiltern) auf dem MACS-Separator und platzieren Sie die beschrifteten 15-ml-Sammelröhrchen unter den Säulen. Pro 5 × 106 Zellen wird eine Spalte benötigt.
- Jede Säule wird mit 3 ml kaltem MACS-Trennpuffer grundiert. Mischen Sie die mit Antikörpern behandelte Zellsuspension mit 2 ml MACS-Trennpuffer pro 5 × 106 Zellen und geben Sie sie in die Säule.
HINWEIS: Nicht zentrifugieren! Die Zentrifugation in diesem Schritt wirkt sich nachteilig auf die Ausbeute der Kardiomyozyten aus. - Geben Sie 2 ml MACS-Trennpuffer in jede Säule und sammeln Sie den Durchfluss, bis 12 ml Durchfluss-Kardiomyozyten-Suspension gesammelt sind.
Anmerkungen: Lassen Sie die Säulen niemals vollständig trocknen. - Zentrifugieren Sie die Kardiomyozyten bei ~300 × g für 5 Minuten, verwerfen Sie den Überstand und suspendieren Sie die Kardiomyozyten in 1 ml Beschichtungsmedium.
- Zählen Sie die Zellen, um die Konzentration zu bestimmen, stellen Sie das Volumen auf die gewünschte Aussaatdichte ein und legen Sie die Zellen auf eine Platte. Die gereinigten Kardiomyozyten werden auf die MECM 96-Well-Platten gelegt, wie oben in den Schritten 1.9-1.11 beschrieben (7,5 × 105 Zellen/Well).
4. Optisches Mapping mit spannungsempfindlichen Farbstoffen (VSDs) und kalziumempfindlichen Fluorophoren (CSFs)
- Bereiten Sie die entsprechende Menge VSD in HBSS mit Calcium und Magnesium vor, indem Sie 1 μl VSD-Farbstoff pro ml HBSS und 10 μl Beladungsadjuvans pro ml HBSS hinzufügen.
Anmerkungen: In der Regel erfordert eine 96-Well-Platte 10 ml VSD-Lösung. - Alternativ kann HBSS mit Calcium und Magnesium zubereitet werden, ergänzt mit 5 μM Liquor. Das Kardiomyozyten-Erhaltungsmedium wird abgesaugt und durch 100 μl VSD oder Liquor pro Well einer 96-Well-Platte ersetzt. Inkubieren Sie die Zellen für 30 min im Zellkultur-Inkubator.
- Entfernen Sie die Farbstoffe und ersetzen Sie sie durch Assaymedium oder HBSS. Äquilibrat bei 37 °C für die Erfassung der optischen Kartierung von Basisdaten mit einem optischen Kartierungsgerät mit hohem Durchsatz.
- Behandeln Sie die Zellen mit Medikamenten für akute Expositionstests oder kartieren Sie die Zellen, die chronisch den interessierenden Medikamenten ausgesetzt waren.
- Verwenden Sie für Kardiotoxizitätstests in 96-Well-Platten vier Dosen einer Verbindung mit mindestens sechs Wells pro Dosis. Verwenden Sie Dosen, die von unterhalb bis oberhalb der effektiven therapeutischen Plasmakonzentration reichen, einschließlich einer Dosis der klinisch wirksamen therapeutischen Plasmakonzentration.
- Verdünnen Sie die Arzneimittel in Dimethylsulfoxid, lagern Sie sie als Stammlösungen bei -20 °C und verdünnen Sie sie dann in HBSS auf die gewünschten Konzentrationen.
- Führen Sie vor der Anwendung des Arzneimittels grundlegende elektrophysiologische Messungen durch, wie in Abschnitt 5 beschrieben. Sobald die Medikamente aufgetragen wurden, machen Sie mindestens 30 Minuten später elektrophysiologische Aufzeichnungen für chronische Untersuchungen. In den folgenden Abschnitten finden Sie Informationen zur optischen Datenerfassung und -analyse.
5. Optische Kartierung mittels genetisch kodiertem Calciumindikator (GECI)
- Plattenkommerziell erhältliche oder MACS-gereinigte hiPSC-CMs, wie oben beschrieben, unter Verwendung von MECM-beschichteten 96-Well-Platten zur Herstellung reifer hiPSC-CMs. Um konfluente Monoschichten zu bilden, Platte 7,5 × 104 CMs pro Vertiefung jeder 96-Well-Platte. Verwenden Sie Beschichtungsmedium.
- Nach 48 h im Beschichtungsmedium auf Kardiomyozyten-Erhaltungsmedium umstellen.
- An Tag 4 nach dem Auftauen und erneuten Auftauen wird rekombinantes Adenovirus zur Expression von GCaMP6m (AdGCaMP6m) zu den Zellen bei einer Multiplizität der Infektion (MOI) = 5 hinzugefügt. Fügen Sie das Virus mit einem CM-Assay-Medium hinzu.
HINWEIS: Hier wurden Experimente mit GCaMP6m in iCell 2-Kardiomyozyten eines kommerziellen Anbieters durchgeführt. - Entfernen Sie an Tag 5 das adGCaMP6m-Medium und ersetzen Sie es durch frisches RPMI+B27 (Kardiomyozyten-Erhaltungsmedium).
- Beobachten Sie an Tag 7 die CMs mit Hilfe der Mikroskopie oder des optischen Mapping-Imagers, um spontane Kontraktionen und entsprechende Kalziumtransienten zu visualisieren.
- An Tag 7 oder später werden für das Medikationsscreening 96-Well-Platten mit reifen hiPSC-CM-Monolagen, die GCaMP6m exprimieren, direkt aus dem Inkubator in den optischen Mapping-Imager übertragen, um die Baseline-Datenerfassung zu erfassen.
- Nach der elektrophysiologischen Datenerfassung werden die Platten der CMs zur Messung zu einem späteren Zeitpunkt in den Inkubator für Gewebekulturen zurückgebracht.
- Wenden Sie die Medikamente nach den Baseline-Aufzeichnungen mit mindestens vier Dosen jedes Medikaments und mindestens sechs Vertiefungen pro Dosis an. Bringen Sie die Medikamente vor der Datenerfassung mindestens 30 Minuten lang auf die Zellen. Erwärmen Sie die Well-Temperatur vor und während der Datenerfassung auf ~37 °C.
- Nach den Baseline-Aufzeichnungen einer gesamten Platte wird Isoproterenol (500 nM) zu jeder Vertiefung hinzugefügt, um robuste Daten zum Ansprechen auf das Arzneimittel zu erhalten. Quantifizieren Sie die Auswirkungen von Isoproterenol auf die Monolagen-Schwebungsrate, die Kontraktionsamplitude (transiente Calciumamplitude) und die transiente Calciumdauer (siehe Abbildung 6), wie in Abschnitt 5 beschrieben.
6. Erfassung optischer Kartierungsdaten und Analyse
- Stellen Sie sicher, dass die Kamera, der Transilluminator und die Plattenheizung des optischen Kartierungsgeräts eingeschaltet sind.
- Öffnen Sie die Erfassungssoftware und bestimmen Sie den Speicherort der Datei.
- Öffnen Sie die vordere Schublade und positionieren Sie die Platte auf der Plattenheizung.
- Erfassen Sie einen Dark Frame, indem Sie auf die Schaltfläche Dark Frame klicken.
- Wählen Sie Dauer (10-30 s) und Bildrate der Aufnahme (z. B. 100 fps; 250 fps für eine höhere zeitliche Auflösung) und klicken Sie auf Aufnahme starten.
- Öffnen Sie die Analysesoftware, und wählen Sie auf der Registerkarte Importieren/Filtern entweder Nach einer einzelnen Datei suchen oder Mehrere kacheln , um eine Platte zu rekonstruieren.
- Wählen Sie Parametermodus (APD oder CaTD), geben Sie Abstand pro Pixel ein und verwenden Sie den Well-Assistenten , um die Position der Wells im Bild zu bestimmen. Klicken Sie auf Speichern verarbeiten , um zur nächsten Registerkarte zu wechseln.
- Öffnen Sie die Registerkarte ROIs (Regions of Interest) und wählen Sie, ob Sie die ROIs manuell, automatisch oder überhaupt keine ROIs verwenden zeichnen möchten, wodurch dann der gesamte Brunnen für die Analyse berücksichtigt wird. Nachdem Sie die ROIs ausgewählt haben, klicken Sie auf die Schaltfläche Verarbeiten/Speichern, um zum nächsten Schritt zu gelangen. Aktivieren Sie die Kontrollkästchen Vertiefungen ausblenden und Nur gefilterte anzeigen, um die ROIs zu visualisieren.
- Öffnen Sie die Registerkarte " Analyse" und wählen Sie oben rechts auf dem Bildschirm jedes Well oder jeden ROI aus, um die Genauigkeit der automatischen Beat-Erkennung zu bestätigen. Füge Beats zu den Spuren hinzu oder entferne sie , indem du auf "Beat hinzufügen" bzw. "Beats speichern" drückst oder indem du einen einzelnen Beat auswählst und die Entf-Taste auf der Tastatur drückst.
- Optional können Sie die Funktion "Durchschnittliche Heatmaps" verwenden, um Heatmaps ausgewählter Parameter für die Platte zu erstellen.
- Klicken Sie auf die Schaltfläche Zeit-Raum-Diagramm auf der Registerkarte Analyse , um die Daten für jedes Bohrloch oder den ROI zu visualisieren. Nachdem Sie sich vergewissert haben, dass die Beat-Erkennung korrekt ist, fahren Sie mit der Registerkarte Exportieren fort und wählen Sie Dateiformat. Klicken Sie auf Exportieren und erstellen Sie einen Ordner, in den die Daten exportiert werden sollen. Fahren Sie mit dem Öffnen der Datendateien fort und führen Sie die ausgewählte statistische Analyseroutine aus.
HINWEIS: .xlxs-Dateien werden bevorzugt, da alle Parameter in eine einzige Datei exportiert werden. Andere Formate (.csv oder .tsv) generieren eine Datei pro Parameter.
Ergebnisse
hiPSC-CM-Reifung durch Phasenkontrast und konfokale Immunfluoreszenzbildgebung
Der Zeitplan für die ECM-vermittelte Reifung kommerziell erhältlicher hiPSC-CMs unter Verwendung von MECM-beschichteten 96-Well-Platten ist in Abbildung 1A dargestellt. Diese Daten werden mit kommerziell erhältlichen Kardiomyozyten gesammelt, die als kryokonservierte Zellfläschchen ins Labor kommen. Jede Durchstechflasche enthält >5 × 106 lebensfähige Kardiomyozyten. Die Zellen sind ~98% rein und werden zur Qualitätskontrolle streng getestet (Analysezertifikat wird jedem Fläschchen beigefügt). Die hohe Anzahl von CMs ermöglicht das Auftauen und Plattieren der CMs auf verschiedenen ECM-Kombinationen mit derselben Charge von Zellen. In Abbildung 1 sind hiPSC-CMs entweder auf Maus-ECM- oder MECM-beschichteten Platten plattiert. Die hiPSC-CMs, die auf dem MECM plattiert werden, reifen und unterscheiden sich strukturell von der gleichen Charge von hiPSC-CMs, die auf dem Maus-ECM neu plattiert wurden. Reife Zellen werden nämlich stäbchenförmig, während unreife Zellen eine kreisförmige Form behalten. Dies zeigt sich in der Phasenkontrastbildgebung und bei der Färbung der kardialen Myofilamente (Abbildung 1B; Troponin I [TnI], rot). Eine umfassendere Validierung der strukturellen Reifung von hiPSC-CMs ist in Abbildung 2 dargestellt. Ein großes Sichtfeld (20-faches Objektiv) von CMs, die mit α-Aktinin-Antikörpern gefärbt wurden, zeigt die typische Form der Zellen, die unter jeder EZM-Bedingung kultiviert wurden. α-Actinin ist ein wichtiges Strukturprotein, das in regelmäßigen Abständen in den kardialen Myofilamenten angeordnet ist. In Übereinstimmung mit der TnI-Färbung in Abbildung 1 zeigt die α-Actinin-Färbung außerdem die Reifung von hiPSC-CMs an, die auf dem MECM kultiviert wurden. Neben der Förderung eines stäbchenförmigen, reifen Phänotyps induziert das MECM auch eine größere Sarkomerorganisation (60x Bilder). Mitochondrialer Inhalt und Aktivität unterscheiden sich auch zwischen Zellen, die auf der Maus-ECM und dem MECM kultiviert wurden (Abbildung 2B). Der fetale unreife hiPSC-CM-Mitochondriengehalt ist auf den perinukleären Raum beschränkt, wobei nur wenige Mitochondrien im Zytosol zu finden sind. Im Gegensatz dazu ist der mitochondriale Inhalt reifer hiPSC-CMs in der Zelle verteilt. Die mitochondriale Bewertung erfolgt nach einem etablierten Protokoll19.
herzgesteuerte Differenzierung und Herzkammerspezifikation hiPSC
Hier finden Sie ein Protokoll für die hauseigene Herstellung und Reifung von gereinigten, kammerspezifischen hiPSC-CMs (Abbildung 3A). Dies geht aus einem bereits veröffentlichten Bericht20 hervor. Vorgestellt werden detaillierte Verfahren zur hiPSC-CM-Aufreinigung unter Verwendung eines kommerziell erhältlichen, magnetaktivierten Zellsortierkits (MACS). Wir haben kürzlich die Verwendung der MACS-Aufreinigung validiert und die Vorteile der Verwendung von MACS im Vergleich zur metabolischen hiPSC-CM-Aufreinigung gezeigt. In der Regel wird eine hiPSC-CM-Reinheit von über 95 % erwartet21. Es ist wichtig darauf hinzuweisen, dass, wenn der anfängliche CM-Gehalt <50 % beträgt, die MACS-Reinigung nur ~85 % erreichen kann. In diesen Fällen kann eine CM-Anreicherung erforderlich sein, nachdem die Nicht-CMs erschöpft sind. Wenn der anfängliche CM-Gehalt aus der Differenzierung >50 % beträgt, kann die Depletion von Nicht-CMs aus der Zellpopulation mit dem MACS-Kit eine Reinheit von >95 % erreichen. in diesem Fall ist die weitere Anreicherung oder positive Selektion von CMs nicht erforderlich. Die kammerspezifischen hiPSC-CMs können auch mit MECM-beschichteten 96-Well-Platten gereift werden, wie oben beschrieben und in Abbildung 1 und Abbildung 2 dargestellt. Es ist zu erwarten, dass die atrial-spezifischen Zellen (hiPSC-ACM) eine signifikant schnellere spontane Schlagrate und eine kürzere Aktionspotentialdauer 80 (APD80) aufweisen als die ventrikulären spezifischen Zellen (hiPSC-VCM). Dabei handelt es sich um typische elektrophysiologische Daten für Aktionspotentiale, die mit VSDs und dem optischen Mapping-System aufgezeichnet wurden (Abbildung 3B-D).
Herzphysiologisches elektrophysiologisches optisches Mapping mit hohem Durchsatz
Die wissenschaftliche Genauigkeit wird bei jedem Assay drastisch erhöht, wenn er mit einem Hochdurchsatz durchgeführt werden kann. Die Daten zum Kardiotoxizitäts-Screening sind in den Abbildungen 4, 5, 6 und 7 dargestellt und zeigen ein elektrophysiologisches Hochdurchsatz-Screening mit reifen hiPSC-CM-Monoschichten in einer 96-Well-Platte. Heatmaps für ganze Platten für Parameter wie APD80 (Abbildung 4A) zeigen die Reproduzierbarkeit eines bestimmten Parameters innerhalb einer Platte von Well zu Well. Darüber hinaus bieten Heatmaps für ganze Platten eine schnelle Untersuchung von Ausreißern im Datensatz. Zum Beispiel ist in Bohrloch E4 der in Abbildung 4A dargestellten Platte klar, dass dieses Bohrloch einen viel höheren APD80-Wert aufweist, was durch das gelb erscheinende Bohrloch angezeigt wird, während die anderen Vertiefungen indigoblau sind. Typische Aktionspotentiale reifer 2D-hiPSC-CM-Monolagen (Abbildung 4B) erinnern an die Aktionspotentialmorphologie adulter Kardiomyozyten, die in Kultur isoliert und getestet wurden. Darüber hinaus ist ein typischer spontaner Rhythmus des Aktionspotentials in Abbildung 4C dargestellt. Bei den Daten in Abbildung 4C handelt es sich um ein Zeit-Raum-Diagramm von Zeile A, Spalten 1 bis 12. Die weiße Linie quer über die Plattenkarte in Abbildung 4A veranschaulicht dies. Jeder helle fluoreszierende Blitz im Laufe der Zeit in jeder Vertiefung stellt eine einzelne spontane Aktivierung dar. Abbildung 5 und Abbildung 6 zeigen den Nutzen der Verwendung des genetisch kodierten GCaMP6m-Kalziumindikators (GECI) zur Messung intrazellulärer Kalziumtransienten. Abbildung 6 zeigt auch das erwartete Ansprechen auf Isoproterenol, das klassische kardiale positive Inotrop. Als Reaktion auf Isoproterenol bewirkt die Aktivierung der β1-adrenergen Rezeptoren eine positive Chronotropie (Abbildung 6A), eine positive Inotropie (Abbildung 6B) und eine positive Lusitropie (Abbildung 6C). Diese Reaktionen auf Isoproterenol deuten auf eine signifikante Reifung von hiPSC-CM β1-adrenergen Rezeptoren und intrazellulären Signalkaskaden hin.
In Abbildung 7 ist die hiPSC-CM-Antwort auf humane Ether-a-go-go-related gene (hERG)-Kanalblocker unter Verwendung der GCaMP6m-Kalziumfluoreszenz zur Überwachung des Rhythmus und als Surrogatmarker für die Kontraktilität dargestellt. E-4031 ist ein hERG-spezifischer Kanalblocker, der die spontane Schlagrate verlangsamt und die transiente Calciumdauer (CaTD80) und Triangulation (CaT-Triangulation) erhöht. Abbildung 7A zeigt die Detektion von frühen Nachdepolarisationen, die durch die Blockade des E-4031 hERG-Kanals verursacht werden. Andere hERG-Kanalblocker, einschließlich Domperidon, Vandetanib und Sotalol, wurden ebenfalls getestet, und die Ergebnisse sind in Abbildung 7E-G dargestellt. Diese Verbindungen und Dosen wurden auf der Grundlage der kürzlich durchgeführten hiPSC-CM-Validierungsstudie 1,7,9 ausgewählt.
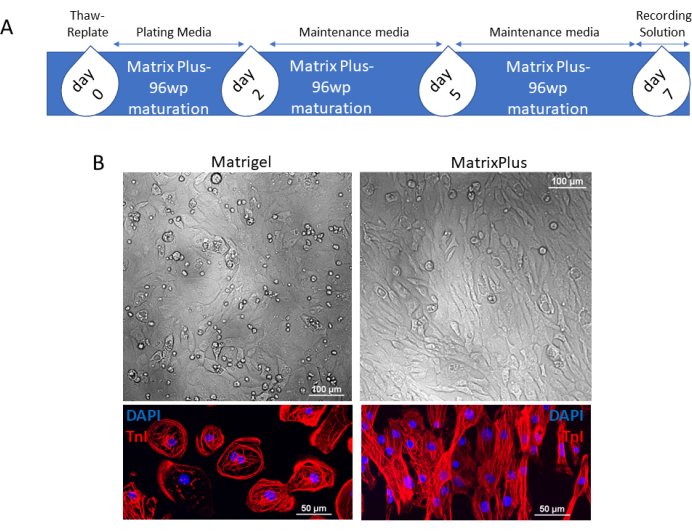
Abbildung 1: Zeitleiste für die schnelle Reifung von kommerziell erhältlichen oder aus anderen Quellen stammenden kryokonservierten hiPSC-CMs . (A) Aufgetaute Kardiomyozyten, die in Beschichtungsmedium suspendiert sind, werden an Tag 0 auf das MECM appliziert. An Tag 2 wird das Medium durch Wartungsmedium ersetzt, und das verbrauchte Medium wird an Tag 5 gewechselt. Die Zellen werden für weitere 2 Tage kultiviert, und an Tag 7 können die reifen Synzytien der hiPSC-CMs mit einer Aufzeichnungslösung für nachgeschaltete Anwendungen beladen oder für längere Zeiträume kultiviert werden. (B) Die Kontrastphase der Synzytien von Kardiomyozyten, die auf der Maus-EZM oder der MECM plattiert sind, zeigen, dass Kardiomyozyten, die auf der Maus-ECM plattiert sind, eine größere Zirkularität aufweisen als Kardiomyozyten, die auf der MECM plattiert sind; Darüber hinaus zeigt die Immunfärbung für TnI, dass Kardiomyozyten, die auf der Maus-EZM plattiert wurden, eine radiale Symmetriemorphologie und unorganisierte Sarkomere aufweisen, im Gegensatz zu dolichomorphen und gut strukturierten hiPSC-CMs, die auf dem MECM plattiert sind. Maßstabsbalken = 100 μm (B, oben); 50 μm (B, unten). Abkürzungen: hiPSC-CMs = humane induzierte pluripotente Stammzell-abgeleitete Kardiomyozyten; EZM = extrazelluläre Matrix; MECM = reifungsinduzierende ECM; 96wp = 96-Well-Platte; DAPI = 4',6-Diamidino-2-phenylindol; TnI = Troponin I. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Vergleich der Sarkomerorganisation von hiPSC-CMs, die auf einer Maus-ECM oder einem MECM plattiert wurden. (A) Maus-EZM-kultivierte hiPSC-CMs, die immungefärbt gegen α-Actinin sind, weisen auf eine radiale Morphologie hin, wobei eine geringere Dichte von Sarkomeren durch die Kardiomyozyten verteilt ist, im Gegensatz zu hiPSC-CMs aus derselben Charge, die auf der Matrix plattiert sind und eine stäbchenförmige Morphologie aufweisen (20x). (60x) Die Beobachtung von hiPSC-CMs mit konfokaler Mikroskopie zeigt, dass hiPSC-CMs, die auf einer Maus-ECM kultiviert wurden, eine radiale Symmetriemorphologie aufweisen, mit einer dichteren perimetralen Verteilung von Sarkomeren und einer geringen Dichte von radialen Sarkomeren im Gegensatz zu hiPSC-CMs aus derselben Charge, die auf dem MECM kultiviert wurden. Sie weisen eine homogene Verteilung von Sarkomeren auf, die entlang der längeren Achse der Zellen organisiert sind. Maßstabsbalken = 100 μm (oben); 50 μm (niedriger). (B) Die Färbung von hiPSC-CMs, die auf der Maus-EZM oder dem MECM kultiviert wurden, mit einem mitochondrialen Farbstoff, der Mitochondrien mit hohem Transmembranpotential färbt, zeigt eine geringere Intensität der Färbung in Kardiomyozyten, die auf der Maus-EZM kultiviert wurden, im Vergleich zur MECM. Darüber hinaus haben hiPSC-CMs, die auf dem MECM kultiviert wurden, Mitochondrien homogen in den Kardiomyozyten verteilt, im Gegensatz zu hiPSC-CMs, die auf dem Maus-ECM kultiviert wurden und eine perinukleäre Akkumulation von Mitochondrien aufweisen. Maßstabsbalken = 200 μm. Abkürzungen: hiPSC-CMs = humane induzierte pluripotente Stammzell-abgeleitete Kardiomyozyten; EZM = extrazelluläre Matrix; MECM = reifungsinduzierende ECM; DAPI = 4',6-Diamidino-2-phenylindol. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
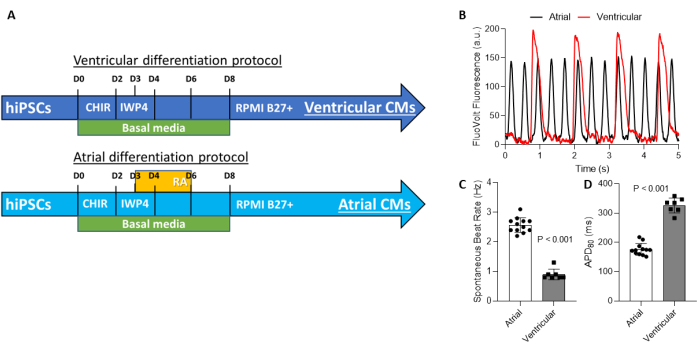
Abbildung 3: Produktion kammerspezifischer Kardiomyozyten. (A) Protokolle zur Produktion kammerspezifischer Kardiomyozyten weisen eine identische Manipulation des Wnt-Signalwegs auf, wobei die Stimulation des Wnt-Signalwegs durch Hemmung von GSK3 von Tag 0 bis 2 und die Hemmung dieses Signalwegs zwischen Tag 2 und 4 erfolgt. Die Kammerspezifikation wird durch die Aktivierung des Retinsäure-Signalwegs und die Manipulation des Wnt-Signalwegs zwischen dem 3. und 6. Tag erreicht. (B) Aufgrund der Kammerspezifikation weisen atriale Kardiomyozyten im Vergleich zu ventrikulären Kardiomyozyten eine schnellere spontane Depolarisationsrate auf. (C) Ventrikuläre hiPSC-CMs haben im Vergleich zu atrialen hiPSC-CMs langsamere Schlagraten; Daher ist die Dauer des Aktionspotentials bei 80% der Repolarisation bei hiPSC-ACMs im Vergleich zu hiPSC-VCMs kürzer. Abkürzungen: hiPSC-CMs = humane induzierte pluripotente Stammzell-abgeleitete Kardiomyozyten; hiPSC-ACM = atriale humane induzierte pluripotente Stammzell-Kardiomyozyten; hiPSC-VCM = ventrikuläre humane induzierte pluripotente Stammzell-abgeleitete Kardiomyozyten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
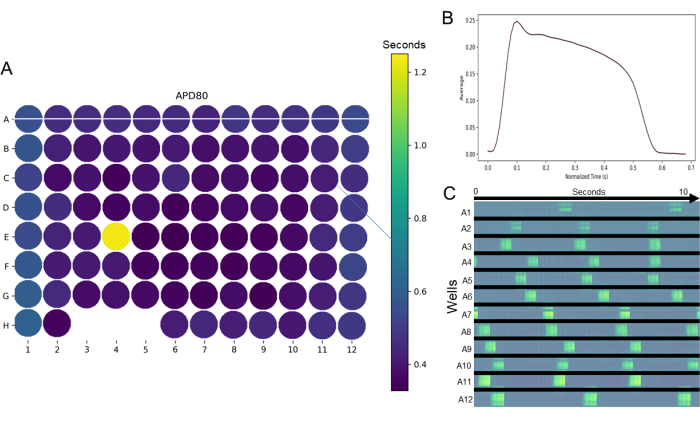
Abbildung 4: Optisches Mapping, das mit einem optischen Mapping-Gerät aufgenommen und mit Pulse analysiert wurde. (A) Beispiel einer Heatmap für die ganzheitliche Betrachtung von Parametern, die in einer 96-Well-Platte nach der Filmfiltration und der Bestimmung von Regions of Interest in 96-Well-Platten bewertet wurden, kartiert mit dem optischen Kartierungsgerät. In diesem Beispiel handelt es sich um eine APD80%-Heatmap, die ein Ausreißer-Well (E4) und Wells anzeigt, die keine Daten erzeugen konnten (Wells H3, 4 und 5). (B) Darüber hinaus ermöglicht die benutzerfreundliche Oberfläche eine einfache Darstellung der Morphologie des durchschnittlichen Aktionspotentials aus den ausgewählten Bohrlöchern. (C) Zusätzliche Datenvisualisierungstools sind verfügbar; In diesem Beispiel zeigt ein Zeit-Raum-Diagramm, das aus der horizontalen Linie generiert wird, die die Vertiefungen in Zeile A (Feld A) kreuzt, die Aktivierung über einen horizontalen Abschnitt jedes Vertiefungsbereichs (weiße Linie über Reihe A) über einen Zeitraum von 10 s. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Zeitleiste für die Kartierung intrazellulärer transienter Kalziumveränderungen mit einem genetisch kodierten Kalziumindikator. An Tag 4 nach der Beschichtung kommerziell erhältlicher Kardiomyozyten in einer MECM-beschichteten 96-Well-Platte, wie in Abbildung 1A dargestellt, sollten die Zellen über Nacht mit 5 MOI des Virus in CM-Assaymedium transduziert werden. Das Medium wird bis zum 6. Tag durch CDI-Erhaltungsmedium ersetzt und zwischen den Tagen 7 und 11 auf ein CDI-Erhaltungsmedium ohne Phenolrot umgestellt, um eine sofortige oder kontinuierliche Überwachung der intrazellulären transienten Kalziumveränderungen mit Nautilus zu ermöglichen. (B) hiPSC-CMs, die mit AdGCaMP6f transduziert wurden und mit optischem Mapping an den Tagen 7, 9 und 10 nach dem Auftauen bewertet wurden, weisen auf das Vorhandensein stabiler, intrazellulärer Calcium-vermittelter Fluoreszenzveränderungen hin, die eine tägliche optische Kartierung derselben Platte über einen längeren Zeitraum ermöglichen, ohne dass eine erneute Anwendung von kalziumsensitiven Farbstoffen erforderlich ist. Abkürzungen: GECI = genetisch kodierter Calcium-Indikator; CM = Kardiomyozyten; MOI = Vielzahl der Infektionen; 96wp = 96-Well-Platte; BSA = Rinderserumalbumin. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 6: Schnelle und einfache Verwendung von Heatmaps für den visuellen Vergleich von Daten, die aus reifen funktionellen Synzytien von hiPSC-CMs mit Nautilus gewonnen und mit Pulse analysiert wurden. (A) hiPSC-CMs, die mit Isoproterenol behandelt wurden, zeigen einen Anstieg der Schlagrate, wie bei der Inspektion von Heatmaps beobachtet und mit einem gepaarten t-Test bestätigt wurde. (B) In ähnlicher Weise zeigt die Kartierung von Zellen vor und nach der Isoproterenol-Behandlung die inotrope Wirkung der β-adrenergen Stimulation durch visuellen Vergleich von Heatmaps und mit gepaartem t-Test. (C) Schließlich zeigt die Verwendung von Heatmaps für den visuellen Vergleich der Daten Lusitropie, einen weiteren kanonischen Effekt der β-adrenergen Stimulation, der mit einem gepaarten t-Test bestätigt wurde (p < 0,0001). Das Fehlen eines Kreises weist auf einen Fehler bei der Datenerfassung/-analyse für diese bestimmte Bohrung hin. Abkürzungen: hiPSC-CMs = humane induzierte pluripotente Stammzell-abgeleitete Kardiomyozyten; ISO = Isoproterenol. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 7: Validierung des GECI-Kardiotoxizitäts-Screening-Assays mit hERG-Kanalblockern. (A) Repräsentative Spuren des spontanen Calciumflusses aus Baseline-Wells in HBSS und in Gegenwart von 500 nM E-4031. (B-D) Quantifizierung der Ausgangs- und +E-4031-Effekte auf die Schlagrate, die transiente Calciumdauer 80 (CaTD80) bzw. die transiente Calciumtriangulation (CaT-Triangulation). *,** steht für einen signifikanten Unterschied; ungepaarter t-Test; p < 0,01; n = 8 in jeder Gruppe. (E) GECI-Nachweis eines weiteren hERG-Blockers, Domperidon. (F) GECI-Nachweis eines durch Vandetanib induzierten hERG-Blocks. (G) GECI-Nachweis des hERG-Blocks durch hohe Dosis Sotalol. Abkürzungen: GECI = genetisch kodierter Calcium-Indikator; hERG = menschliches Ether-a-go-go-verwandtes Gen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Tabelle 1: Medien und ihre Zusammensetzung Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Es gibt verschiedene Ansätze für das In-vitro-Kardiotoxizitätsscreening mit hiPSC-CMs . In einem kürzlich veröffentlichten "Best Practices"-Artikel über die Verwendung von hiPSC-CMs wurden die verschiedenen In-vitro-Assays , ihre primären Messwerte und vor allem die Granularität jedes Assays zur Quantifizierung der elektrophysiologischen Funktion des menschlichen Herzensvorgestellt 20. Neben der Verwendung von Membran-Piercing-Elektroden liefern VSDs das direkteste Maß für die elektrophysiologische Funktion des menschlichen Herzens. VSD-Assay-Auslesungen ermöglichen die direkte Visualisierung und Quantifizierung kritischer elektrophysiologischer Parameter, einschließlich der Dauer des Aktionspotentials, der Ausbreitungsgeschwindigkeit des Aktionspotentials, des Aufschlags des Aktionspotentials, der Triangulation des Aktionspotentials, der Schwebungsrate, der Regelmäßigkeit der Schwebung und der Heterogenitäten der Dauer des Aktionspotentials. In ähnlicher Weise liefern kalziumsensitive Sonden Informationen über den Rhythmus, die Rate und die Ereignisdauer von hiPSC-CM-Monolagen. hiPSC-CM-Kalziumtransientenmessungen, die mit Fluoreszenzsonden durchgeführt werden, geben auch Aufschluss über die Kontraktilität und Kontraktionsstärke jeder Kontraktion. In diesem Artikel werden Methoden für den Einsatz von reifen hiPSC-CMs (96-Well-Platten) in Hochdurchsatz-VSD- und Calcium-Transienten-Messassays vorgestellt. Neben Methoden zur optischen Kartierung wird auch Software für die Hochdurchsatz-EP-Datenanalyse vorgestellt.
Die hier beschriebenen Methoden sind ein bedeutender Fortschritt für das Kardiotoxizitäts-Screening und die regulatorischen Wissenschaften. In dieser Arbeit haben wir Methoden zur schnellen Reifung und elektrophysiologischen Erfassung von 2D-hiPSC-CM-Monolagen in Hochdurchsatz-Screening-Platten (96-Well-Platten) vorgestellt. Die hier gezeigte schnelle Reifung mit einem MECM (7 Tage) ist ein großer Fortschritt gegenüber früheren Ansätzen, bei denen die Reifung über 30-100 Tage erfolgen muss22,23. Im Vergleich zu anderen ECMs, die für jedes Experiment manuell aufgetragen werden müssen, sind MECM-Platten mit ECM vorbeschichtet und kommen gebrauchsfertig im Labor an. Dieser Aspekt des MECM macht es einfacher, weniger variabel und effizienter als die Verwendung anderer ECM-Beschichtungen. Wichtig ist, dass dieser Ansatz sowohl für kryokonservierte, kommerziell erhältliche hiPSC-CMs als auch für "hausgemachte" hiPSC-CMs, die kammerspezifisch sein können, verwendet werden kann. Aufgrund der ausgeprägten, stäbchenförmigen Struktur reifer hiPSC-CMs (Abbildung 1 und Abbildung 2) ist es wichtig darauf hinzuweisen, dass hier eine größere Anzahl von Zellen für die konfluente Monolagenbildung erforderlich ist als bei Protokollen, die andere EZMs verwenden. Bemerkenswert ist, dass wir bei der Verwendung von Maus-ECM (Zellen haben einen sich kontinuierlich ausbreitenden Pancake-Phänotyp) 50.000 hiPSC-CMs pro Well plattieren, aber bei der Verwendung von MECM 75.000 hiPSC-CMs pro Well. Die Anzahl der CMs pro Well kann auch reduziert werden, wenn die Zellen für Einzelzellanalysen verwendet werden sollen, wie z. B. Patch-Clamps oder andere bildgebende Verfahren, die Einzelzellen erfordern.
Kommerziell erhältliche hiPSC-CMs bieten Vorteile für die regulatorische Wissenschaft, da diese Zellen durch internationale Bemühungen der Food and Drug Administration (FDA) umfassend charakterisiert werden. Bei den kommerziell erhältlichen Zellen handelt es sich jedoch um eine Mischung aus nodalen, atrialen und ventrikulären hiPSC-CMs, die hochrelevante Toxizitätsinformationen liefern, denen jedoch die kammerspezifischen Merkmale fehlen, die das menschliche Herz nachahmen. Kammerspezifische hiPSC-CMs bilden die bekannten elektrophysiologischen Unterschiede zwischen atrialen und ventrikulären Kardiomyozyten nach und stellen einen In-vitro-Assay für die Entwicklung kammerspezifischer antiarrhythmischer Therapien dar (Abbildung 3B-D). Zum Beispiel können jetzt Vorhofflimmer-spezifische Medikamente getestet und entwickelt werden, indem hiPSC-ACM-Monoschichten verwendet werden, die in 96-Well-Platten plattiert sind, um eine robuste und rigorose Datenerfassung zu ermöglichen. Ebenso ist es beim Screening, ob eine Verbindung Torsades de Pointes (TdP), eine Hochrisiko-ventrikuläre Arrhythmie, verursacht, optimal, keine Vorhof- und Knotenzellen zu haben, die ventrikuläre Herzmonoschichten "kontaminieren". Obwohl sich die bisher von der FDA geleiteten hiPSC-CM-Validierungsbemühungen auf die Verwendung kommerziell erhältlicher CMs konzentriert haben, ist es daher wahrscheinlich, dass sich zukünftige regulatorische wissenschaftliche Empfehlungen auf die Verwendung kammerspezifischer Zellen konzentrieren werden, um das Toxizitätsscreening noch prädiktiver für die menschliche Herzerkrankung zu machen. Die hier beschriebenen Methoden basieren auf früheren Berichten und bieten einen robusten Ansatz für die Generierung kammerspezifischer Kardiomyozyten, die aus pluripotenten Stammzellen gewonnen werden21.
Ein wesentlicher Unterschied zwischen diesen Protokollen und denen, die typischerweise in der Praxis verwendet werden, ist der verwendete Reinigungsansatz. Die Mehrzahl der Labore, die hiPSC-CMs in ihren eigenen Laboren erzeugen, verlassen sich auf metabolisch vermittelte Selektion von Kardiomyozyten22. Hier stützen wir uns auf die Verwendung von MACS zur Aufreinigung von hiPSC-CMs, wobei wir einen klinisch zugelassenen Zellverarbeitungsansatz verwenden, der CMs mit gesünderen Phänotypen produziert23. Der metabolische Challenge-Ansatz ist effektiv, verwendet jedoch eine Medienformulierung, die eine Myokardischämie simuliert24. Bei der MACS-Aufreinigung von hiPSC-CMs ist es wichtig, den Non-CM-Depletionscocktail zu verwenden, der auf Nicht-CMs für die magnetische Depletion aus der Zellpopulation abzielt. Die Verwendung des Nicht-CM-Verarmungsansatzes minimiert die Scherspannung, die die CMs in der magnetischen Säule erfahren, und wird der direkten magnetischen Markierung der CM-Population vorgezogen. Die MACS-Aufreinigung kammerspezifischer Zellen wird es anderen Laboren ermöglichen, gesunde CMs für die Forschung und Toxizitätstests zu generieren.
Offenlegungen
TJH ist Berater und wissenschaftlicher Berater von StemBioSys, Inc. TB ist ein Mitarbeiter von StemBioSys, Inc. AMR und JC sind ehemalige Berater von StemBioSys, Inc. TJH, TB, AMR und JC sind Aktionäre von StemBioSys, Inc.
Danksagungen
Diese Arbeit wurde durch die NIH-Zuschüsse HL148068-04 und R44ES027703-02 (TJH) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin EDTA | Gibco | 25200-056 | |
| 0.5 mg/mL BSA (7.5 µmol/L) | Millipore Sigma | A3294 | |
| 2.9788 g/500 mL HEPES (25 mmol/L) | Millipore Sigma | H4034 | |
| AdGCaMP6m | Vector biolabs | 1909 | |
| Albumin human | Sigma | A9731-1G | |
| alpha actinin antibody | ThermoFisher | MA1-22863 | |
| B27 | Gibco | 17504-044 | |
| Blebbistatin | Sigma | B0560 | |
| CalBryte 520AM | AAT Bioquest | 20650 | |
| CELLvo MatrixPlus 96wp | StemBiosys | N/A | https://www.stembiosys.com/products/cellvo-matrix-plus |
| CHIR99021 | LC Laboratories | c-6556 | |
| Clear Assay medium (fluorobrite) | ThermoFisher | A1896701 | For adenovirus transduction |
| DAPI | ThermoFisher | 62248 | |
| DMEM:F12 | Gibco | 11330-032 | |
| FBS (Fetal Bovine Serum) | Sigma | F4135-500ML | |
| FluoVolt | ThermoFisher | F10488 | |
| HBSS | Gibco | 14025-092 | |
| iCell CM maintenance media | FUJIFILM/Cellular Dynamics | M1003 | |
| iCell2 CMs | FUJIFILM | 1434 | |
| Incucyte Zoom | Sartorius | ||
| iPS DF19-9-11T.H | WiCell | ||
| Isoproterenol | MilliporeSigma | CAS-51-30-9 | |
| IWP4 | Tocris | 5214 | |
| L-ascorbic acid 2-phosphate sesquimagnesium salt hydrate | Sigma | A8960-5g | |
| L-glutamine | Gibco | A2916801 | |
| LS columns | Miltenyii Biotec | 130-042-401 | |
| MACS Buffer (autoMACS Running Buffer) | Miltenyii Biotec | 130-091-221 | |
| Matrigel | Corning | 354234 | |
| MitoTracker Red | ThermoFisher | M7512 | |
| Nautilus HTS Optical Mapping | CuriBio | https://www.curibio.com/products-overview | |
| Nikon A1R Confocal Microscope | Nikon | ||
| nonessential amino acids | Gibco | 11140-050 | |
| pre-separation filter | Miltenyii Biotec | 130-041-407 | |
| PSC-Derived Cardiomyocyte Isolation Kit, human | Miltenyii Biotec | 130-110-188 | |
| Pulse | CuriBio | https://www.curibio.com/products-overview | |
| Quadro MACS separator (Magnet) | Miltenyii Biotec | 130-091-051 | |
| Retinoic acid | Sigma | R2625 | |
| RPMI 1640 | Gibco | 11875-093 | |
| RPMI 1640 (+HEPES, +L-Glutamine) | Gibco | 22400-089 | |
| StemMACS iPS-Brew XF | Miltenyii Biotec | 130-107-086 | |
| TnI antibody (pan TnI) | Millipore Sigma | MAB1691 | |
| Versene (ethylenediaminetetraacetic acid - EDTA solution) | Gibco | 15040-066 | |
| Y-27632 dihydrochloride | Tocris | 1254 | |
| β-mercaptoethanol | Gibco | 21985023 |
Referenzen
- Blinova, K., et al. International multisite study of human-induced pluripotent stem cell-derived cardiomyocytes for drug proarrhythmic potential assessment. Cell Reports. 24 (13), 3582-3592 (2018).
- Ma, J., et al. High purity human-induced pluripotent stem cell-derived cardiomyocytes: electrophysiological properties of action potentials and ionic currents. American Journal of Physiology. Heart and Circulatory Physiology. 301 (5), 2006-2017 (2011).
- Lee, P., et al. Simultaneous voltage and calcium mapping of genetically purified human induced pluripotent stem cell-derived cardiac myocyte monolayers. Circulation Research. 110 (12), 1556-1563 (2012).
- Fermini, B., Coyne, S. T., Coyne, K. P. Clinical trials in a dish: a perspective on the coming revolution in drug development. SLAS Discovery. 23 (8), 765-776 (2018).
- Strauss, D. G., Blinova, K. Clinical trials in a dish. Trends in Pharmacological Sciences. 38 (1), 4-7 (2017).
- Blinova, K., et al. Clinical trial in a dish: personalized stem cell-derived cardiomyocyte assay compared with clinical trial results for two QT-prolonging drugs. Clinical and Translational Science. 12 (6), 687-697 (2019).
- Blinova,, et al. Comprehensive translational assessment of human-induced pluripotent stem cell derived cardiomyocytes for evaluating drug-induced arrhythmias. Toxicological Sciences. 155 (1), 234-247 (2017).
- da Rocha, A. M., et al. hiPSC-CM monolayer maturation state determines drug responsiveness in high throughput pro-arrhythmia screen. Scientific Reports. 7 (1), 13834(2017).
- da Rocha, A. M., Creech, J., Thonn, E., Mironov, S., Herron, T. J. Detection of drug-induced Torsades de Pointes arrhythmia mechanisms using hiPSC-CM syncytial monolayers in a high-throughput screening voltage sensitive dye assay. Toxicological Sciences. 173 (2), 402-415 (2020).
- Knollmann, B. C. Induced pluripotent stem cell-derived cardiomyocytes: boutique science or valuable arrhythmia model. Circulation Research. 112 (6), 969-976 (2013).
- Lam, C. K., Wu, J. C. Disease modelling and drug discovery for hypertrophic cardiomyopathy using pluripotent stem cells: how far have we come. European Heart Journal. 39 (43), 3893-3895 (2018).
- Jiang, Y., Park, P., Hong, S. M., Ban, K. Maturation of cardiomyocytes derived from human pluripotent stem cells: current strategies and limitations. Molecules and Cells. 41 (7), 613-621 (2018).
- Ahmed, R. E., Anzai, T., Chanthra, N., Uosaki, H. A brief review of current maturation methods for human induced pluripotent stem cells-derived cardiomyocytes. Frontiers in Cell and Developmental Biology. 8, 178(2020).
- Guo, Y., Pu, W. T. Cardiomyocyte maturation: new phase in development. Circulation Research. 126 (8), 1086-1106 (2020).
- Yang, X., Pabon, L., Murry, C. E. Engineering adolescence:maturation of human pluripotent stem cell-derived cardiomyocytes. Circulation Research. 114 (3), 511-523 (2014).
- Karbassi, E., et al. Cardiomyocyte maturation: advances in knowledge and implications for regenerative medicine. Nature Reviews Cardiology. 17 (6), 341-359 (2020).
- Nunes, S. S., et al. Biowire: a platform for maturation of human pluripotent stem cell-derived cardiomyocytes. Nature Methods. 10 (8), 781-787 (2013).
- Herron, T. J., et al. Extracellular matrix-mediated maturation of human pluripotent stem cell-derived cardiac monolayer structure and electrophysiological function. Circulation. Arrhythmia and Electrophysiology. 9 (4), 003638(2016).
- Block, T., et al. Human perinatal stem cell derived extracellular matrix enables rapid maturation of hiPSC-CM structural and functional phenotypes. Scientific Reports. 10 (1), 19071(2020).
- Gintant, G., et al. Repolarization studies using human stem cell-derived cardiomyocytes: Validation studies and best practice recommendations. Regulatory Toxicology and Pharmacology. 117, 104756(2020).
- Cyganek, L., et al. Deep phenotyping of human induced pluripotent stem cell-derived atrial and ventricular cardiomyocytes. JCI Insight. 3 (12), 99941(2018).
- Tohyama, S., et al. Distinct metabolic flow enables large-scale purification of mouse and human pluripotent stem cell-derived cardiomyocytes. Cell Stem Cell. 12 (1), 127-137 (2013).
- Davis, J., et al. In vitro model of ischemic heart failure using human induced pluripotent stem cell-derived cardiomyocytes. JCI Insight. 6 (10), 134368(2021).
- Diaz, R. J., Wilson, G. J. Studying ischemic preconditioning in isolated cardiomyocyte models. Cardiovascular Research. 70 (2), 286-296 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten