Method Article
Modifica chimica del residuo di triptofano in un dominio N Ricombinante Ca2+-ATPasi per lo studio del triptofano-ANS FRET
In questo articolo
Riepilogo
ANS si lega al dominio N ricombinante Ca2+-ATPasi. Gli spettri di fluorescenza mostrano un modello simile a FRET all'eccitazione ad una lunghezza d'onda di 295 nm. La modifica chimica mediata da NBS di Trp spegne la fluorescenza del dominio N, che porta all'assenza di trasferimento di energia (FRET) tra il residuo Trp e ANS.
Abstract
Il reticolo sarco/endoplasmatico Ca2+-ATPasi (SERCA) è un'ATPasi di tipo P che è stata cristallizzata in varie conformazioni. Informazioni funzionali dettagliate possono tuttavia essere ottenute da domini ricombinanti isolati. Il dominio di legame nucleotidico ricombinante (Trp552Leu e Tyr587Trp) ingegnerizzato (dominio N) mostra una tempra di fluorescenza al legame del ligando. Un fluoroforo estrinseco, vale a dire 8-anilino-1-naftalene solfonato (ANS), si lega al sito di legame nucleotidico tramite interazioni elettrostatiche e idrofobiche con residui di Arg, His, Ala, Leu e Phe. Il legame ANS è evidenziato dall'aumento dell'intensità di fluorescenza quando eccitato ad una lunghezza d'onda (λ) di 370 nm. Tuttavia, quando eccitato a λ di 295 nm, l'aumento dell'intensità della fluorescenza sembra essere accoppiato alla tempra della fluorescenza intrinseca del dominio N. Gli spettri di fluorescenza mostrano un modello simile al trasferimento di energia di risonanza di Föster (FRET), suggerendo così la presenza di una coppia Trp-ANS FRET, che sembra essere supportata dalla breve distanza (~ 20 Å) tra Tyr587Trp e ANS. Questo studio descrive un'analisi della coppia Trp-ANS FRET mediante modificazione chimica Trp (e tempra a fluorescenza) mediata da N-bromosuccinimide (NBS). Nel dominio N chimicamente modificato, la fluorescenza ANS aumentava quando eccitata a λ di 295 nm, simile a quando eccitata a λ di 370 nm. Quindi, la modifica chimica mediata da NBS del residuo Trp può essere utilizzata per sondare l'assenza di FRET tra Trp e ANS. In assenza di fluorescenza Trp, non si dovrebbe osservare un aumento della fluorescenza ANS. La modifica chimica dei residui di Trp nelle proteine da parte di NBS può essere utile per esaminare FRET tra residui di Trp che sono vicini all'ANS legato. Questo test sarà probabilmente utile anche quando si utilizzano altri fluorofori.
Introduzione
Il trasferimento di energia di risonanza di Föster (FRET) è diventato una tecnica standard per determinare la distanza tra le strutture molecolari dopo il legame o l'interazione negli studi di struttura e funzione delle proteine1,2,3,4. Nelle ATPasi di tipo P, FRET è stato utilizzato per studiare la struttura e la funzione del reticolo sarco-endoplasmatico Ca2+-ATPasi (SERCA)2,5,6,7,8, ad esempio, le fluttuazioni strutturali durante il ciclo catalitico sono state analizzate nell'intera proteina da FRET7.
I donatori di FRET sono diversi e vanno da piccole molecole fluorescenti (estrinseche) a proteine fluorescenti9,10. I residui di triptofano (Trp) (dovuti alla loro fluorescenza) sono utili per identificare i cambiamenti strutturali nelle sequenze di aminoacidi proteici11,12. L'intensità di fluorescenza del Trp dipende sostanzialmente dalla polarità dell'ambientecircostante13,14. Il legame del ligando di solito genera riarrangiamenti strutturali inproteine/enzimi 15,16. Se Trp è presente o situato vicino al sito di legame proteico, le fluttuazioni strutturali influenzano frequentemente il grado di esposizione di Trp ai mezzi acquosi13,14; quindi, il cambiamento di polarità provoca l'tempra dell'intensità di fluorescenza Trp13,14. Quindi, la proprietà fluorescente di Trp è utile per eseguire studi di legame del ligando per gli enzimi. Altri fenomeni fisici possono anche portare alla tempra di fluorescenza Trp17,18,19,20, ad esempio, FRET e cambiamenti nella polarità media. Il trasferimento di energia dallo stato eccitato di Trp a un fluoroforo ha anche potenziali applicazioni, ad esempio la determinazione dell'affinità di piccoli ligandi nelle proteine21. Infatti, Trp è stato utilizzato principalmente come donatore di fluorescenza negli studi FRET nelle proteine22,23,24, ad esempio, negli studi FRET sul terbio (Tb3 +),un residuo Trp viene utilizzato frequentemente come antenna per il trasferimento di energia a Tb3 +25,26,27. Trp mostra vari vantaggi rispetto ad altri donatori di FRET a causa del suo carattere costitutivo intrinseco nella struttura proteica, che elimina la necessità di processi preparativi che possono influenzare la funzione / struttura della proteina24studiata. Pertanto, l'identificazione dei decadimenti radiativi (trasferimento di energia e cambiamenti nella polarità media indotti da riarrangiamenti strutturali proteici) è importante per trarre conclusioni accurate sul legame del ligando negli studi strutturali sulle proteine13,14,19,28.
Negli studi strutturali sulle proteine, un fluoroforo estrinseco, vale a dire 8-anilino-1-naftalene solfonato (ANS), è stato utilizzato principalmente in esperimenti relativi al ripiegamento / dispiegamento delle proteine28,29. ANS si lega a proteine/enzimi allo stato nativo, solitamente nei siti di legame dei substrati31,32,33; un aumento della resa quantistica di fluorescenza ANS (ΦF) (vale a dire, un aumento dell'intensità di fluorescenza) è indotto dall'eccitante proteina a λ = 370 nm quando si verificano interazioni adeguate di ANS con Arg e i suoi residui in tasche idrofobiche34,35,36,37. In vari studi, è stata segnalata la presenza di FRET (quando eccitante a λ entro 280-295 nm) tra residui di Trp (donatori) e ANS (accettore), che si basa su quanto segue: 1) sovrapposizione dello spettro di emissione di fluorescenza di Trp e spettro di eccitazione di ANS, 2) identificazione di una distanza adeguata tra uno o più residui di Trp e ANS per il trasferimento di energia, 3) elevata resa quantistica ANS quando legata in sacche proteiche, e 4) pattern FRET caratteristico negli spettri di fluorescenza della proteina in presenza di ANS3,17,27,37,38.
Recentemente, il legame del ligando al dominio di legame nucleotidico (dominio N) in SERCA e altre ATPasi di tipo P sono stati studiati utilizzando N-domini N ricombinanti ingegnerizzati40,41,42,43,44,45,46. L'ingegneria molecolare del dominio N SERCA è stata utilizzata per spostare l'unico residuo Trp (Trp552Leu) in una struttura più dinamica (Tyr587Trp) che è vicina al sito di legame nucleotidico, dove le variazioni di fluorescenza (tempra) possono essere utilizzate per monitorare i cambiamenti strutturali sul legame del ligando34. I risultati sperimentali hanno dimostrato che ANS si lega (come ATP) al sito di legame nucleotidico nel ricombinante purificato SERCA N-domain34. È interessante notare che la fluorescenza ANS aumenta quando si lega al dominio N all'eccitazione a un λ di 295 nm, mentre la fluorescenza intrinseca del dominio N diminuiscedi 34, producendo così un modello FRET che suggerisce la formazione di una coppia Trp-ANS FRET.
L'uso di NBS è stato proposto per determinare il contenuto di residui di Trp nelle proteine47 mediante il saggio di assorbanza di proteine modificate. NBS modifica il gruppo indolo altamente assorbente di Trp al meno assorbenteossindolo 47,48. Ciò si traduce nella perdita (spegnimento) della proprietà fluorescente Trp40. Quindi, la modifica chimica mediata da NBS dei residui di Trp può essere utilizzata come saggio per definire il ruolo di Trp (come donatore) quando si ipotizza FRET.
Questo protocollo descrive la modifica chimica dell'unico residuo di Trp da parte di NBS nel dominio N ricombinante ingegnerizzato di SERCA come modello proteico. I risultati sperimentali dimostrano che l'intensità di fluorescenza ANS aumenta ancora nel dominio N34modificato chimicamente NBS, che manca di fluorescenza intrinseca. Pertanto, il saggio è utile per dimostrare l'assenza di FRET tra il residuo Trp e ANS quando legato al dominio N34,40,49. Quindi, questo test (modifica chimica NBS di Trp) è utile per dimostrare la presenza della coppia Trp-ANS FRET nelle proteine.
Protocollo
1. Determinazione (in silico) dell'interazione ANS e SERCA N-dominio
- Generare una struttura tridimensionale (3D) della proteina (SERCA N-domain) mediante modellazione molecolare utilizzando il software di modellazione proteica preferito50.
- Identificare i residui di amminoacidi che formano il sito di legame nucleotidico utilizzando il software di struttura molecolarepreferito 51e determinare la presenza di residui di Arg e Lys35; questi sono necessari per il legame ANS e per aumentare l'intensità di fluorescenza (resa quantistica).
- Eseguire l'attracco molecolare (utilizzando il software di docking preferito)52,53,54 per determinare le interazioni di ATP, isotiocianato di fluoresceina (FITC) (che forma un legame covalente con Lys515 che etichetta il sito di legame nucleotidico) e ANS con residui di amminoacidi nel sito di legame nucleotidico ( Figura1).
- Calcolare la distanza molecolare (Å) tra il residuo Trp e l'ANS legato utilizzando lo strumento di misurazione nel software preferito.
- Eseguire simulazioni di dinamica molecolare del complesso ANS-N-dominio per determinare la stabilità dell'interazione52,54. Quindi, eseguire gli esperimenti in vitro quando la stabilità del complesso è stata confermata.
2. Espressione e purificazione del dominio N ricombinante
- Sintetizzare il gene che codifica per il dominio N40.
- Progettare e costruire il plasmide che contiene il gene sintetico che codifica per il dominio N40.
- Esprimere e purificare mediante cromatografia di affinità (Ni-NTA), il dominio N ricombinante ingegnerizzato. Eseguire una SDS-PAGE della proteina purificata per determinarne la purezza (Figura 2)40.
- Determinare la concentrazione proteica studiando l'assorbanza a λ di 280 nm con il coefficiente di estinzione del dominio N (ε= 11.960 M-1·cm-1)40.
3. Monitorare la formazione del complesso ANS-N-dominio in base alle variazioni di intensità di fluorescenza ANS e N-dominio.
- Preparare una soluzione stock ANS in N,N-dimetilformammide.
- Pesare una piccola quantità (1-5 mg) di ANS e scioglierla in 1 mL del volume finale di N,N-dimetilformammide, ad esempio 3,2 mg (concentrazione finale di 10,69 mM).
- Preparare una soluzione stock acquosa ANS da 100 μM utilizzando la soluzione ANS in N,N-dimetilformammide, ad esempio, aggiungere 9,4 μL della soluzione ANS da 10,69 mM a 990,6 μL di tampone fosfato da 50 mM con pH 8,0 per ottenere un volume finale di 1 mL.
- Mescolare le soluzioni vorticosamente 3 - 5 volte per 15 s.
NOTA: nell'esperimento seguente, utilizzare solo la soluzione stock acquosa ANS. Preparare al fresco la soluzione stock acquosa ANS prima di iniziare gli esperimenti.
- Preparare la soluzione stock NBS in N,N-dimetilformammide.
- Pesare una piccola quantità (1-5 mg) di NBS e scioglierla in 1 mL di N,N-dimetilformammide, ad esempio 5,3 mg in 1 mL (29,78 mM di concentrazione finale).
- Preparare una soluzione stock acquosa NBS da 1 mM utilizzando la soluzione NBS in N,N-dimetilformammide, ad esempio, aggiungere 3,36 μL della soluzione NBS da 29,78 mM a 96,64 μL di tampone fosfato da 50 mM con pH 8,0 per ottenere un volume finale di 0,1 mL.
- Mescolare le soluzioni vorticosamente 3 - 5 volte per 15 s.
NOTA: Preparare nuovamente la soluzione stock acquosa NBS prima di iniziare gli esperimenti.
- Titolare il dominio N con ANS e registrare gli spettri di fluorescenza per eccitazione a λ=295 nm a 25 °C.
- Ottenere la linea di base dello spettro di fluorescenza.
- Posizionare 1 mL di tampone fosfato da 50 mM con pH 8,0 in una cuvetta di quarzo a fluorescenza da 1 mL.
- Posizionare la cella nella camera cellulare termo-dichiarata (25 °C) dello spettrofluorometro e impostare l'eccitazione λ su 295 nm.
- Registrare lo spettro di fluorescenza (305 - 550 nm).
NOTA: Lo spettro di fluorescenza del tampone fosfato da 50 mM con pH 8,0, che funge da campione in bianco, viene sottratto da tutti gli spettri di fluorescenza ottenuti.
- Ottenere lo spettro di fluorescenza intrinseco del dominio N.
- Posizionare 900 μL di tampone fosfato da 50 mM con pH 8,0 in una cuvetta di quarzo a fluorescenza.
- Aggiungere 100 μL di sospensione di N-dominio (10 μM) per ottenere una concentrazione finale di 1 μM N-dominio in un volume finale di 1 mL.
- Omogeneizzare delicatamente utilizzando una micropipetta 20 volte per garantire l'omogeneità della soluzione.
NOTA: La proteina deve essere purificata di fresco per ottenere spettri di fluorescenza intrinseca di alta qualità, ad esempio, il dominio N ricombinante purificato può essere utilizzato solo per una settimana dopo la purificazione. - Posizionare la cella nella camera cellulare termo-dichiarata (25 °C) dello spettrofluorometro e impostare l'eccitazione λ su 295 nm.
- Registrare lo spettro di fluorescenza intrinseca del dominio N (305-550 nm).
- Aggiungere ANS e ottenere lo spettro di fluorescenza per eccitazione a λ=295 nm.
- Aggiungere un'aliquota di 2 μL di soluzione acquosa acquosa di 100 μM al dominio N sospeso (1 μM) per ottenere una concentrazione finale di ANS di 0,2 μM.
- Omogeneizzare delicatamente utilizzando una micropipetta 20 volte per garantire l'omogeneità della soluzione.
- Posizionare la cella nella camera cellulare termostudente (25 °C) dello spettrofluorometro e impostare l'eccitazione λ su 295 nm.
- Registrare lo spettro di fluorescenza (305-550 nm).
- Ripetere le aggiunte ANS e gli spettri di fluorescenza registrando sopra la relazione molare 1:1 ANS:N-dominio.
- Sottrarre lo spettro vuoto da ogni spettro utilizzando un software adatto.
- Traccia tutti gli spettri in un unico grafico.
- Determinare se gli spettri formano un modello simile a FRET. Gli spettri di fluorescenza del dominio ANS-N formano un modello simile a FRET (Figura 3A).
- Ottenere la linea di base dello spettro di fluorescenza.
4. Titolazione a fluorescenza intrinseca N-dominio mediante modificazione chimica Trp con NBS.
- Ripetere i passaggi 3.3.1 e 3.3.2.
- Aggiungere un'aliquota di 1 μL di 1 mM NBS soluzione acquosa allo S-dominio N sospeso (1 μM) per ottenere una concentrazione finale di 1 μM NBS.
- Omogeneizzare delicatamente utilizzando una micropipetta 20 volte per garantire l'omogeneità della soluzione.
- Posizionare la cella nella camera cellulare termostudente (25 °C) dello spettrofluorometro e impostare l'eccitazione λ su 295 nm.
- Registrare lo spettro di fluorescenza (305-550 nm) (Figura 3B).
- Ripetere l'addizione NBS e la registrazione degli spettri di fluorescenza fino a quando non si osserva una minima tempra intrinseca di fluorescenza del dominio N40. Nel dominio N, questo di solito si verifica ad un rapporto molare di 5-6 NBS / N-dominio40.
NOTA: NBS spegne rapidamente (<5 s) la fluorescenza intrinseca del dominio N; si osserva una diminuzione dell'intensità di fluorescenza. Procedere immediatamente al passaggio successivo, poiché NBS può anche reagire con altri residui di amminoacidi47. - Sottrarre lo spettro vuoto da ogni spettro utilizzando un software adatto.
- Tracciare tutti gli spettri in un unico grafico (Figura 3B).
5. Titolare il dominio N modificato da NBS con ANS registrando spettri di fluorescenza a 25 °C.
- Eseguire il passaggio 3.3.3 utilizzando il dominio N modificato NBS generato nel passaggio 4.
- Sottrarre lo spettro vuoto da ogni spettro utilizzando un software adatto.
- Tracciare tutti gli spettri in un unico grafico (Figura 3C).
- Gli spettri di fluorescenza generati (Figura 3C) supportano o confutano il verificarsi di FRET, cioè quando si verifica FRET, la fluorescenza ANS non aumenta e viceversa.
6. Evidenza del legame di ANS al dominio N chimicamente modificato mediante eccitazione a λ=370 nm.
- Eseguire il passaggio 3.3.3 utilizzando il dominio N modificato NBS generato nel passaggio 4, ma modificando l'eccitazione λ in 370 nm.
- Sottrarre lo spettro vuoto da ogni spettro utilizzando un software adatto.
- Tracciare tutti gli spettri in un unico grafico (Figura 3D).
- Confermare il legame ANS al dominio N osservando l'aumento dell'intensità di fluorescenza ANS. Il legame ANS al dominio N mostra un aumento della fluorescenza quando eccitato a λ=370 nm (Figura 3D). Come controllo, lo spettro di fluorescenza di ANS (da solo) in tampone fosfato 50 mM con pH 8,0 è stato ottenuto eccitante a λ di 295 e 370 nm (Figura 4, non mostrato in video).
NOTA: La relazione stechiometrica di NBS:Trp necessaria per la modifica chimica dipende dal grado di interramento dei residui di Trp nella proteina in studio46,47,55,56. Pertanto, si raccomanda di determinare in anticipo il rapporto molare NBS:proteina/(Trp).
Risultati
L'attracco molecolare mostra il legame di ANS al sito di legame nucleotidico del dominio N tramite interazioni elettrostatiche e idrofobiche (Figura 1). La distanza molecolare (20 Å) tra il residuo di Trp e ANS (legato al sito di legame nucleotidico) supporta la presenza di FRET (Figura 1). Il dominio N ricombinante progettato (ingegnerizzato) è stato ottenuto ad alta purezza mediante cromatografia ad affinità (Figura 2) ed era adatto per esperimenti di fluorescenza. Gli spettri di fluorescenza del complesso ANS-N-domain mostravano un pattern simile a FRET all'eccitazione a λ=295 nm (Figura 3A). La modifica chimica del residuo Trp da parte di NBS ha portato alla tempra della fluorescenza intrinseca del dominio N (Figura 3B). Nel dominio N modificato chimicamente NBS, i risultati sperimentali dimostrano che la fluorescenza ANS è aumentata con l'eccitazione a λ=295 nm (Figura 3C), simile a quella osservata nel dominio N non modificato (Figura 3A). Pertanto, l'eccitazione diretta di ANS a λ = 295 nm fornisce la maggior parte dell'energia per la fluorescenza ANS (Figura 3C), come suggerito in precedenza28. Il legame di ANS al dominio N chimicamente modificato è evidenziato da un aumento della sua fluorescenza quando eccitato a λ= 370 nm (Figura 3D). Pertanto, FRET non si verifica tra il residuo Trp e ANS che è legato al sito di legame nucleotidico.
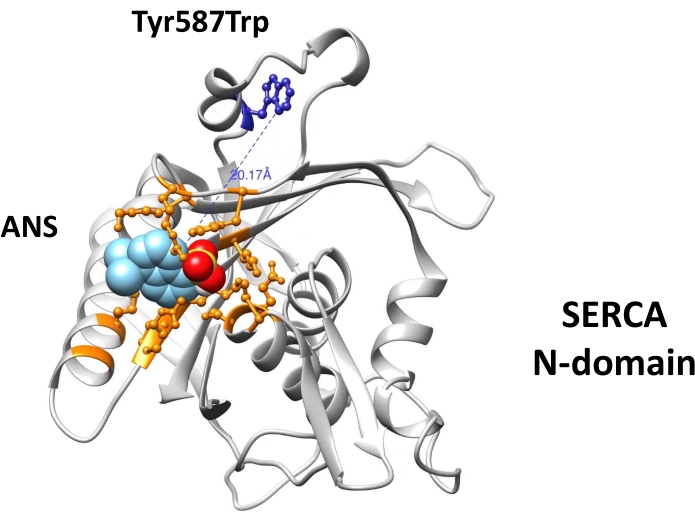
Figura 1: Attracco molecolare di ANS al sito di legame nucleotidico del dominio N-Ca2+-ATPasi. L'attracco molecolare ANS è stato eseguito utilizzando il software AutoDock Vina (http://vina.scripps.edu/) e un modello 3D generato del dominio N40. Il dominio N ingegnerizzato contiene le mutazioni Trp552Leu e Tyr587Trp (mostrate in blu). I residui di amminoacidi che formano il sito di legame nucleotidico sono rappresentati come palline e bastoncini ed evidenziati in arancione. Questa figura è stata modificata con il permesso di Springer Nature: Springer, Journal of Fluorescence. Diritto d'autore (2020)34. Fare clic qui per visualizzare una versione più grande di questa figura.
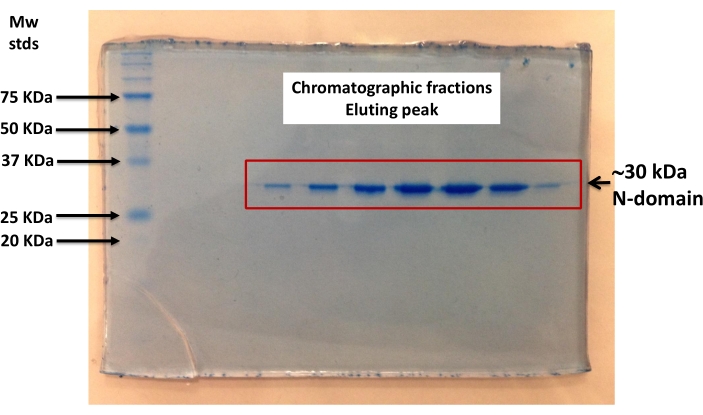
Figura 2: SDS−PAGE del ricombinante ingegnerizzato Ca2+-ATPasi N-dominio. Il dominio N è stato sottoposto a purificazione di affinità utilizzando una colonna cromatografica. Le frazioni che corrispondevano ai picchi di assorbimento (a λ=280 nm) sono state sottoposte a SDS−PAGE e visualizzate mediante colorazione blu di Coomassie. Il ~30 kDa His-tagged N-domain è formato da 27 kDa di N-domain Ca2+-ATPase e 3 kDa di poly-His tag. La purezza del dominio Ca2+-ATPasi N- è stata determinata per essere ≥95% mediante densitometria utilizzando il software ImageJ (https://imagej.nih.gov/ij/download.html). Fare clic qui per visualizzare una versione più grande di questa figura.
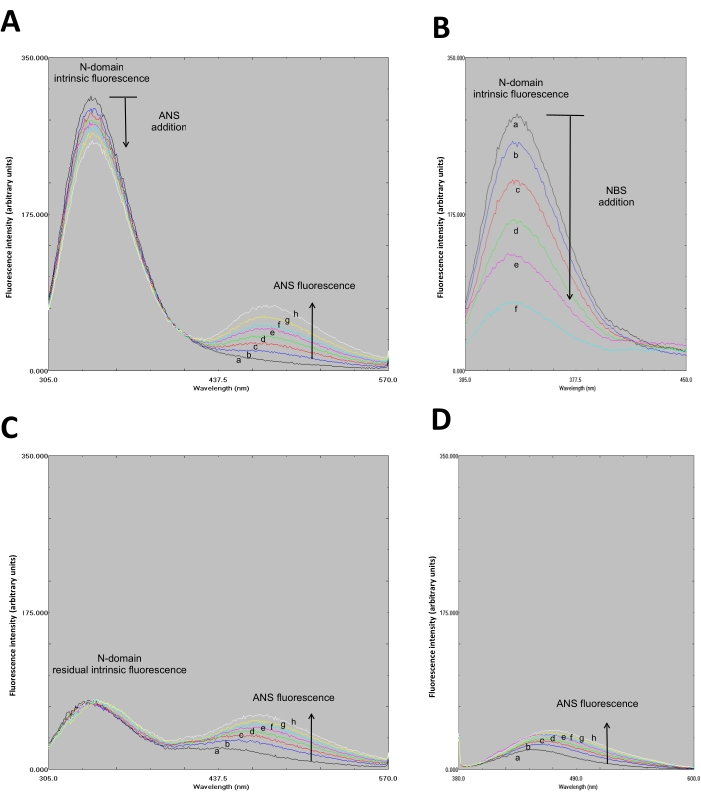
Figura 3: La modifica chimica mediata da NBS del residuo Trp nel dominio N smentisce FRET tra Trp e ANS che è legato al sito di legame nucleotidico. A. Modello FRET del complesso ANS-N-dominio all'eccitazione a λ=295 nm. ANS è stato aggiunto (concentrazione finale in μM: Spettri a, 0; b, 0,2; c, 0,4; d, 0,6; e, 0,8; f, 1,0; g, 1,2; e h, 1,4) al dominio N sospeso (1 μM). B. Tempra fluorescente del dominio N da parte di NBS (concentrazione NBS in μM: a, 0; b, 1; c, 2; d, 3; e, 4; e f, 6). NBS media la modifica chimica del residuo Trp. La fluorescenza intrinseca del dominio N è stata osservata dopo l'eccitazione a λ=295 nm. C. Spettri di fluorescenza di ANS che è legato al dominio N chimicamente modificato dopo eccitazione a λ = 295 nm. Le condizioni sperimentali sono come in A. Le figure A, B e C sono state modificate con il permesso di Springer Nature: Springer, Journal of Fluorescence. Diritto d'autore (2020)34. D. Spettri di fluorescenza di ANS che è legato al dominio N chimicamente modificato dopo eccitazione a λ = 370 nm. Il dominio N è stato sospeso in 1 ml di tampone fosfato da 50 mM (pH 8,0) e aliquote di NBS, e ANS è stato aggiunto di conseguenza, come descritto in A (ANS) e B (NBS). Fare clic qui per visualizzare una versione più grande di questa figura.
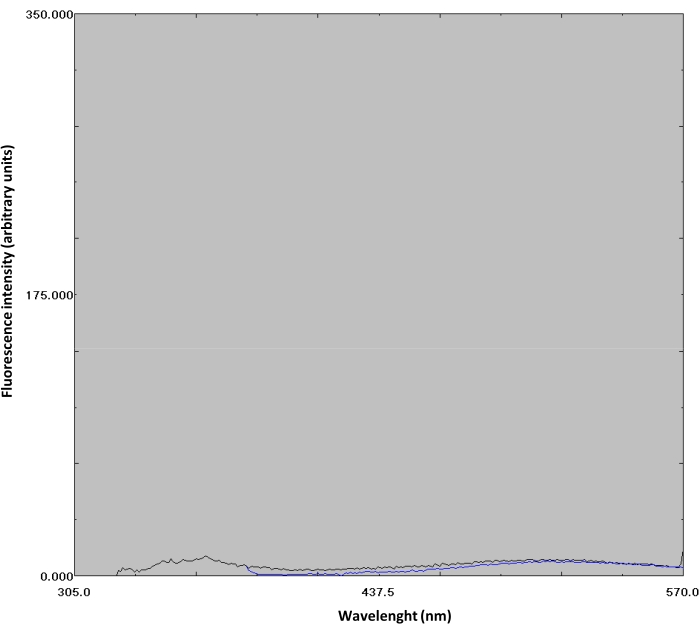
Figura 4: Spettri difluorescenza ANS. ANS (1,4 μM) in tampone fosfato 50 mM con pH 8,0 è stato eccitato a λ di 295 e 370 nm; gli spettri sono presentati rispettivamente in nero e blu. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Gli spettri di fluorescenza del complesso ANS-N-domain mostrano un pattern simile a FRET quando eccitati ad un λ di 295 nm, mentre la distanza molecolare (20 Å) tra il residuo Trp e ANS sembra supportare l'insorgenza di FRET (Figura 1). La modifica chimica Trp da parte di NBS si traduce in un dominio N meno fluorescente (Figura 3B, Spettro f); quindi, il trasferimento di energia non è possibile. Gli spettri di fluorescenza ANS sono simili a quelli del dominio N non modificato quando eccitati ad un λ di 295 nm (Figura 3A e C).
Pertanto, l'eccitazione diretta di ANS a un λ di 295 nm è la principale fonte di fluorescenza ANS quando è legata al sito di legame ATP (Figura 3C), che è in accordo con il meccanismo che è stato proposto da altri autori28. Pertanto, FRET dal residuo Trp all'ANS legato non si verifica nel complesso N-dominio-ANS. Tuttavia, la modifica chimica mediata da NBS dei residui di Trp in altre proteine supporta FRET tra Trp e ANS, ad esempio, negli enzimi xilosio reduttasi di Neurospora crassa49, la subunità α di F1-ATPasi dai mitocondri di lievito58e termolisina59.
Il test funzionerebbe bene in proteine/enzimi con tasche idrofobiche (siti di legame) che contengono residui di His e Arg, in quanto questi contribuiscono alla stabilizzazione dell'interazione ANS. Inoltre, tali proteine dovrebbero idealmente contenere un unico residuo di Trp che si trova sulla superficie della proteina, vale a dire, accessibile per la reazione rapida con NBS40,41,49.
In alternativa, per analizzare la coppia Trp-ANS FRET nelle proteine, la modifica chimica dei suoi residui mediante acetilazione e succinilazione può essere utilizzata per ostacolare l'interazione ANS nel sito di legame proteina/enzima60. La delezione del residuo di Trp per mutazione è un'altra strategia per analizzare FRET. Tuttavia, questo potrebbe richiedere molto tempo e i costrutti potrebbero presentare differenze strutturali, influenzando così il legame del ligando61. Allo stesso modo, la mutazione di Arg e dei suoi residui nel sito di legame del ligando può generare cambiamenti strutturali imprevisti, rendendo così la proteina mutata inadatta per gli esperimenti62.
Per quanto riguarda il residuo Trp, l'esecuzione del test di modifica chimica NBS sarebbe limitata nei seguenti casi: 1) se il residuo Trp è sepolto in profondità nel nucleo di una proteina ben piegata e compatta; poiché la parte NBS non sarebbe in grado di accedere al residuo Trp a causa dell'assenza di grandi cavità41,48,63,2) se i residui di Trp si trovano in strutture incorporate in membrana (transmembrana α-elica), poiché il carattere acquoso di NBS gli impedirà di entrare nel mezzo idrofobo32,56,64,3) se la struttura proteica contiene più residui di Trp; poiché le variazioni nell'accessibilità e nell'ambiente fisico-chimico possono essere grandi, rendendo così difficile l'assegnazione di un cambiamento del segnale di fluorescenza a un residuo Trp32,41,56, 4) se il legame ANS alle proteine è dovuto principalmente all'interazione idrofobica, poiché l'aumento della fluorescenza ANS è dovuto principalmente alle interazioni elettrostatiche32,65,66,67ed e) se statico la tempra di Trp si verifica, ad esempio, in presenza di ossigeno68.
La modifica chimica mediata da NBS dei residui di Trp sembra essere un saggio rapido e facile per studiare FRET tra Trp e ANS che è legato a proteine / enzimi. Altri reagenti che modificano il Trp possono essere utilizzati al posto di NBS, ad esempio idrossi-5-nitrobenzyl bromuro (HNB)69,70. Infine, il saggio può essere applicabile alla rilevazione di coppie FRET proposte di Trp con altri flurofori21.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti.
Riconoscimenti
Questo lavoro è stato parzialmente finanziato dal numero di sovvenzione FAI-UASLP C19-FAI-05-89.89 e dal numero di sovvenzione CONACYT 316463 (Apoyos a la Ciencia de Frontera: Fortalecimiento y Mantenimiento de Infraestructuras de Investigación de Uso Común y Capacitación Técnica 2021). Gli autori ringraziano l'assistenza tecnica di Julian E. Mata-Morales in edizione video.
Materiali
| Name | Company | Catalog Number | Comments |
| Acrylamide | Bio-Rad | 1610107 | SDS-PAGE |
| Ammonium persulfate | Bio-Rad | 1610700 | SDS-PAGE |
| 8-Anilino-1-naphthalenesulfonic acid | Sigma-Aldrich | A1028 | Fluorophore |
| Bis-acrylamide | Bio-Rad | 1610125 | SDS-PAGE |
| N-Bromosuccinimide | Sigma-Aldrich | B81255 | Chemical modification |
| N,N-dimethylformamide | J.T. Baker | 9213-12 | Stock solution preparation |
| Fluorescein isothiocyanate | Sigma-Aldrich | F7250 | Chemical fluorescence label |
| Fluorescence cuvette | Hellma | Z801291 | Fluorescence assay |
| Fluorescence Spectrofluorometer | Shimadzu | RF 5301PC | Fluorescence assay |
| HisTrap™ FF | GE Healtcare | 11-0004-59 | Protein purification |
| IPTG, Dioxane free | American Bionalytical | AB00841-00010 | Protein expression |
| Imidazole | Sigma-Aldrich | I5513-25G | Protein purification |
| LB media | Fisher Scientific | 10000713 | Cell culture |
| Pipetman L P10L | Gilson | FA10002M | Fluorescence assay |
| Pipetman L P100L | Gilson | FA10004M | Fluorescence assay |
| Pipetman L P200L | Gilson | FA10005M | Fluorescence assay |
| Pipetman L P1000L | Gilson | FA10006M | Fluorescence assay |
| Pipetman L P5000L | Gilson | FA10007 | Fluorescence assay |
| Precision plus std | Bio-Rad | 1610374 | SDS-PAGE |
| Sodium dodecyl sulphate | Bio-Rad | 1610302 | SDS-PAGE |
| Sodium phosphate dibasic | J.T. Baker | 3828-19 | Buffer preparation |
| Sodium phosphate monobasic | J.T. Baker | 3818-01 | Buffer preparation |
| Syringe filter 0.2 um | Millipore | GVWP04700 | Solution filtration |
| Temed | Bio-Rad | 1610801 | SDS-PAGE |
| Tris | Bio-Rad | 1610719 | SDS-PAGE |
Riferimenti
- Munishkina, L. A., Fink, A. L. Fluorescence as a method to reveal structures and membrane-interactions of amyloidogenic proteins. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1768 (8), 1862-1885 (2007).
- Dong, X., Thomas, D. D. Time-resolved FRET reveals the structural mechanism of SERCA-PLB regulation. Biochemical and Biophysical Research Communications. 449 (2), 196-201 (2014).
- Szilvay, G. R., Blenner, M. A., Shur, O., Cropek, D. M., Banta, S. A FRET-based method for probing the conformational behavior of an intrinsically disordered repeat domain from Bordetella pertussis adenylate cyclase. Biochemistry. 48 (47), 11273-11282 (2009).
- Sun, Y., Wallrabe, H., Booker, C. F., Day, R. N., Periasamy, A. Three-color spectral FRET microscopy localizes three interacting proteins in living cells. Biophysical Journal. 99 (4), 1274-1283 (2010).
- Cornea, R. L., et al. High-throughput FRET assay yields allosteric SERCA activators. Journal of Biomolecular Screening. 18 (1), 97-107 (2013).
- Gruber, S. J., et al. Discovery of enzyme modulators via high-throughput time-resolved FRET in living cells. Journal of Biomolecular Screening. 19 (2), 215-222 (2014).
- Dyla, M., et al. Dynamics of P-type ATPase transport revealed by single-molecule FRET. Nature. 551 (7680), 346-351 (2017).
- Corradi, G. R., Adamo, H. P. Intramolecular fluorescence resonance energy transfer between fused autofluorescent proteins reveals rearrangements of the N- and C-terminal segments of the plasma membrane Ca2+ pump involved in the activation. The Journal of Biological Chemistry. 282 (49), 35440-35448 (2007).
- Piston, D. W., Kremers, G. -. J. Fluorescent protein FRET: The good, the bad and the ugly. Trends in Biochemical Sciences. 32 (9), 407-414 (2007).
- Ma, L., Yang, F., Zheng, J. Application of fluorescence resonance energy transfer in protein studies. Journal of Molecular Structure. 1077, 87-100 (2014).
- Chen, Y., Barkley, M. D. Toward understanding tryptophan fluorescence in proteins. Biochemistry. 37 (28), 9976-9982 (1998).
- Zelent, B., et al. Tryptophan fluorescence yields and lifetimes as a probe of conformational changes in human glucokinase. Journal of Fluorescence. 27 (5), 1621-1631 (2017).
- Callis, P. R. Binding phenomena and fluorescence quenching. I: Descriptive quantum principles of fluorescence quenching using a supermolecule approach. Journal of Molecular Structure. 1077, 14-21 (2014).
- Callis, P. R. Binding phenomena and fluorescence quenching. II: Photophysics of aromatic residues and dependence of fluorescence spectra on protein conformation. Journal of Molecular Structure. 1077, 22-29 (2014).
- Agarwal, P. K., Geist, A., Gorin, A. Protein dynamics and enzymatic catalysis: Investigating the peptidyl-prolyl cis-trans isomerization activity of cyclophilin A. Biochemistry. 43 (33), 10605-10618 (2004).
- Deng, H., Zhadin, N., Callender, R. Dynamics of protein ligand binding on multiple time scales: NADH binding to lactate dehydrogenase. Biochemistry. 40 (13), 3767-3773 (2001).
- van de Weert, M. Fluorescence quenching to study protein-ligand binding: common errors. Journal of fluorescence. 20 (2), 625-629 (2010).
- van de Weert, M., Stella, L. Fluorescence quenching and ligand binding: A critical discussion of a popular methodology. Journal of Molecular Structure. 998 (1-3), 144-150 (2011).
- Stella, L., van de Weert, M., Burrows, H. D., Fausto, R. Fluorescence spectroscopy and binding: Getting it right. Journal of Molecular Structure. 1077, 1-3 (2014).
- Credi, A., Prodi, L. Inner filter effects and other traps in quantitative spectrofluorimetric measurements: Origins and methods of correction. Journal of Molecular Structure. 1077, 30-39 (2014).
- Lee, M. M., Peterson, B. R. Quantification of small molecule-protein interactions using FRET between tryptophan and the pacific blue fluorophore. ACS Omega. 1 (6), 1266-1276 (2016).
- Zhang, Y., et al. Comparison of FÖrster-resonance-energy-transfer acceptors for tryptophan and tyrosine residues in native proteins as donors. Journal of Fluorescence. 23 (1), 147-157 (2013).
- Xie, Y., Maxson, T., Tor, Y. Fluorescent ribonucleoside as a FRET acceptor for tryptophan in native proteins. Journal of the American Chemical Society. 132 (34), 11896-11897 (2010).
- Ghisaidoobe, A. B. T. T., Chung, S. J. Intrinsic tryptophan fluorescence in the detection and analysis of proteins: A focus on Förster resonance energy transfer techniques. International Journal of Molecular Sciences. 15 (12), 22518-22538 (2014).
- Goryashchenko, A. S., et al. Genetically encoded FRET-sensor based on terbium chelate and red fluorescent protein for detection of caspase-3 activity. International Journal of Molecular Sciences. 16 (7), 16642-16654 (2015).
- Arslanbaeva, L. R., et al. Induction-resonance energy transfer between the terbium-binding peptide and the red fluorescent proteins DsRed2 and TagRFP. Biophysics. 56 (3), 381-386 (2011).
- Di Gennaro, A. K., Gurevich, L., Skovsen, E., Overgaard, M. T., Fojan, P. Study of the tryptophan-terbium FRET pair coupled to silver nanoprisms for biosensing applications. Physical Chemistry Chemical Physics. 15 (22), 8838-8844 (2013).
- Hawe, A., Poole, R., Jiskoot, W. Misconceptions over Förster resonance energy transfer between proteins and ANS/bis-ANS: Direct excitation dominates dye fluorescence. Analytical Biochemistry. 401 (1), 99-106 (2010).
- Ghosh, U., Das, M., Dasgupta, D. Association of fluorescent probes 1-anilinonaphthalene-8-sulfonate and 4,4´-dianilino-1,1´-binaphthyl-5,5´-disulfonic acid with T7 RNA polymerase. Biopolymers. 72 (4), 249-255 (2003).
- Vreuls, C., et al. Guanidinium chloride denaturation of the dimeric Bacillus licheniformis BlaI repressor highlights an independent domain unfolding pathway. The Biochemical Journal. 384, 179-190 (2004).
- Möller, M., Denicola, A. Study of protein-ligand binding by fluorescence. Biochemistry and Molecular Biology Education. 30 (5), 309-312 (2002).
- Chang, L., Wen, E., Hung, J., Chang, C. Energy transfer from tryptophan residues of proteins to 8-anilinonaphthalene-1-sulfonate. Journal of Protein Chemistry. 13 (7), 635-640 (1994).
- Togashi, D. M., Ryder, A. G. A fluorescence analysis of ANS bound to bovine serum albumin: Binding properties revisited by using energy transfer. Journal of Fluorescence. 18 (2), 519-526 (2008).
- Dela Cruz-Torres, V., Cataño, Y., Olivo-Rodríguez, M., Sampedro, J. G. ANS interacts with the Ca2+-ATPase nucleotide binding site. Journal of Fluorescence. 30 (3), 483-496 (2020).
- Gasymov, O. K., Glasgow, B. J. ANS fluorescence: Potential to augment the identification of the external binding sites of proteins. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1774 (3), 403-411 (2007).
- Matulis, D., Lovrien, R. 1-anilino-8-naphthalene sulfonate anion-protein binding depends primarily on ion pair formation. Biophysical Journal. 74 (1), 422-429 (1998).
- Samukange, V., Yasukawa, K., Inouye, K. Interaction of 8-anilinonaphthalene 1-sulphonate (ANS) and human matrix metalloproteinase 7 (MMP-7) as examined by MMP-7 activity and ANS fluorescence. Journal of Biochemistry. 151 (5), 533-540 (2012).
- Qin, J., et al. Selective and sensitive homogenous assay of serum albumin with 1-anilinonaphthalene-8-sulphonate as a biosensor. Analytica Chimica Acta. 829, 60-67 (2014).
- Malik, A., Kundu, J., Karmakar, S., Lai, S., Chowdhury, P. K. Interaction of ANS with human serum albumin under confinement: Important insights and relevance. Journal of Luminescence. 167, 316-326 (2015).
- Páez-Pérez, E. D., De La Cruz-Torres, V., Sampedro, J. G. Nucleotide binding in an engineered recombinant Ca2+-ATPase N-domain. Biochemistry. 55 (49), 6751-6765 (2016).
- Sampedro, J. G., Nájera, H., Uribe-Carvajal, S., Ruiz-Granados, Y. G. Mapping the ATP binding site in the plasma membrane H+-ATPase from Kluyveromyces lactis. Journal of fluorescence. 24 (6), 1849-1859 (2014).
- Abu-Abed, M., Millet, O., MacLennan, D. H., Ikura, M. Probing nucleotide-binding effects on backbone dynamics and folding of the nucleotide-binding domain of the sarcoplasmic/endoplasmic-reticulum Ca2+-ATPase. The Biochemical Journal. 379, 235-242 (2004).
- Abu-Abed, M., Mal, T. K., Kainosho, M., MacLennan, D. H., Ikura, M. Characterization of the ATP-binding domain of the sarco(endo)plasmic reticulum Ca2+-ATPase: probing nucleotide binding by multidimensional NMR. Biochemistry. 41 (4), 1156-1164 (2002).
- Sazinsky, M. H., Mandal, A. K., Argüello, J. M., Rosenzweig, A. C. Structure of the ATP binding domain from the Archaeoglobus fulgidus Cu+-ATPase. Journal of Biological Chemistry. 281 (16), 11161-11166 (2006).
- Liu, L., et al. Crystallization and preliminary X-ray studies of the N-domain of the Wilson disease associated protein. Acta Crystallographica Section F: Structural Biology and Crystallization Communications. 65 (6), 621-624 (2009).
- Banci, L., et al. The binding mode of ATP revealed by the solution structure of the N-domain of human ATP7A. Journal of Biological Chemistry. 285 (4), 2537-2544 (2010).
- Spande, T. F., Witkop, B. Determination of the tryptophan content of proteins with N-bromosuccinimide. Methods in Enzymology. 11, 498-506 (1967).
- Spande, T. F., Green, N. M., Witkop, B. The Reactivity toward N-bromosuccinimide of tryptophan in enzymes, zymogens, and inhibited enzymes. Biochemistry. 5 (6), 1926-1933 (1966).
- Rawat, U. B., Rao, M. B. Purification, kinetic characterization and involvement of tryptophan residue at the NADPH binding site of xylose reductase from Neurospora crassa. Biochimica et Biophysica Acta (BBA) - Protein Structure and Molecular Enzymology. 1293 (2), 222-230 (1996).
- Zaki, M. J., Bystroff, C. . Protein Structure Prediction. , (2008).
- Wang, Z., et al. Comprehensive evaluation of ten docking programs on a diverse set of protein-ligand complexes: The prediction accuracy of sampling power and scoring power. Physical Chemistry Chemical Physics. 18 (18), 12964-12975 (2016).
- Pagadala, N. S., Syed, K., Tuszynski, J. Software for molecular docking: A review. Biophysical Reviews. , 91-102 (2017).
- Dolatkhah, Z., Javanshir, S., Sadr, A. S., Hosseini, J., Sardari, S. Synthesis, Molecular Docking, Molecular Dynamics Studies, and Biological Evaluation of 4 H -Chromone-1,2,3,4-tetrahydropyrimidine-5-carboxylate Derivatives as Potential Antileukemic Agents. Journal of Chemical Information and Modeling. 57 (6), 1246-1257 (2017).
- Forli, S., et al. Computational protein-ligand docking and virtual drug screening with the AutoDock suite. Nature Protocols. 11 (5), 905-919 (2016).
- Lindahl, E. R. Molecular dynamics simulations. Molecular Modeling of Proteins. Methods in Molecular Biology. 443, 3-23 (2008).
- Turk, T., Maček, P., Gubenšek, F. The role of tryptophan in structural and functional properties of equinatoxin II. Biochimica et Biophysica Acta (BBA)/Protein Structure and Molecular. 1119 (1), 1-4 (1992).
- Peterman, B. F., Laidler, K. J. Study of reactivity of tryptophan residues in serum albumins and lysozyme by N-bromosuccinamide fluorescence quenching. Archives of Biochemistry and Biophysics. 199 (1), 158-164 (1980).
- Divita, G., Goody, R. S., Gautheron, D. C., Di Pietro, A. Structural mapping of catalytic site with respect to α-subunit and noncatalytic site in yeast mitochondrial F1-ATPase using fluorescence resonance energy transfer. Journal of Biological Chemistry. 268 (18), 13178-13186 (1993).
- Horrocks, W. D., Holmquist, B., Vallee, B. L. Energy transfer between terbium (III) and cobalt (II) in thermolysin: a new class of metal-metal distance probes. Proceedings of the National Academy of Sciences of the United States of America. 72 (12), 4764-4768 (1975).
- Chakraborty, J., Das, N., Halder, U. C. Unfolding diminishes fluorescence resonance energy transfer (FRET) of lysine modified β-lactoglobulin: Relevance towards anti-HIV binding. Journal of Photochemistry and Photobiology B: Biology. 102 (1), 1-10 (2011).
- Sirangelo, I., Malmo, C., Casillo, M., Irace, G. Resolution of Tryptophan-ANS Fluorescence Energy Transfer in Apomyoglobin by Site-directed Mutagenesis. Photochemistry and Photobiology. 76 (4), 381-384 (2007).
- Ribeiro, A. J. M., Tyzack, J. D., Borkakoti, N., Holliday, G. L., Thornton, J. M. A global analysis of function and conservation of catalytic residues in enzymes. Journal of Biological Chemistry. 295 (2), 314-324 (2020).
- Eftink, M. R., Ghiron, C. A. Exposure of tryptophanyl residues in proteins. Quantitative determination by fluorescence quenching studies. Biochemistry. 15 (3), 672-680 (1976).
- Eftink, M. R., Ghiron, C. A. Fluorescence quenching of indole and model micelle systems. The Journal of Physical Chemistry. 80 (5), 486-493 (1976).
- Kinsley, N., Sayed, Y., Mosebi, S., Armstrong, R. N., Dirr, H. W. Characterization of the binding of 8-anilinonaphthalene sulfonate to rat class Mu GST M1-1. Biophysical Chemistry. 137 (2-3), 100-104 (2008).
- Mohsenifar, A., et al. A study of the oxidation-induced conformational and functional changes in neuroserpin. Iranian Biomedical Journal. 11 (1), 41-46 (2007).
- Gonzalez, W. G., Miksovska, J. Application of ANS fluorescent probes to identify hydrophobic sites on the surface of DREAM. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1844 (9), 1472-1480 (2014).
- Eftink, M. R., Ghiron, C. A. Fluorescence quenching studies with proteins. Analytical Biochemistry. 114 (2), 199-227 (1981).
- Poulos, T. L., Price, P. A. The identification of a tryptophan residue essential to the catalytic activity of bovine pancreatic deoxyribonuclease. The Journal of biological chemistry. 246 (12), 4041-4045 (1971).
- Hu, J. -. J., He, P. -. Y., Li, Y. -. M. Chemical modifications of tryptophan residues in peptides and proteins. Journal of Peptide Science An Official Publication of the European Peptide Society. 27 (1), 3286 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon