Method Article
Chemische Modifikation des Tryptophan-Rückstands in einer rekombinantenCa2+-ATPase-N-Domäne zur Untersuchung von Tryptophan-ANS FRET
In diesem Artikel
Zusammenfassung
ANS bindet an die ca2+-ATPase rekombinante N-Domäne. Fluoreszenzspektren zeigen bei Anregung bei einer Wellenlänge von 295 nm ein FRET-ähnliches Muster. NBS-vermittelte chemische Modifikation von Trp löscht die Fluoreszenz der N-Domäne, was zum Fehlen eines Energietransfers (FRET) zwischen dem Trp-Rückstand und ANS führt.
Zusammenfassung
Das sarko-/endoplasmatische Retikulum Ca2+-ATPase (SERCA) ist eine P-Typ-ATPase, die in verschiedenen Konformationen kristallisiert wurde. Detaillierte funktionelle Informationen können jedoch aus isolierten rekombinanten Domänen gewonnen werden. Die entwickelte (Trp552Leu und Tyr587Trp) rekombinante Nukleotidbindungsdomäne (N-Domäne) zeigt eine Fluoreszenzabschreckung bei ligandenbindung. Ein extrinsisches Fluorophor, nämlich 8-Anilino-1-naphthalinsulfonat (ANS), bindet über elektrostatische und hydrophobe Wechselwirkungen mit Arg-, His-, Ala-, Leu- und Phe-Rückständen an die Nukleotidbindungsstelle. Die ANS-Bindung wird durch die Zunahme der Fluoreszenzintensität bei Einer Anregung bei einer Wellenlänge (λ) von 370 nm nachgewiesen. Bei einer Anregung bei λ von 295 nm scheint die Zunahme der Fluoreszenzintensität jedoch an das Abschrecken der intrinsischen N-Domänenfluoreszenz gekoppelt zu sein. Fluoreszenzspektren zeigen ein Föster-Resonanzenergieübertragungsmuster (FRET)-ähnliches Muster, was auf das Vorhandensein eines Trp-ANS FRET-Paares hindeutet, das durch die kurze Entfernung (~20 Å) zwischen Tyr587Trp und ANS unterstützt zu werden scheint. Diese Studie beschreibt eine Analyse des Trp-ANS FRET-Paares durch chemische Trp-Modifikation (und Fluoreszenzabschreckung), die durch N-Bromosuccinimid (NBS) vermittelt wird. In der chemisch modifizierten N-Domäne erhöhte sich die ANS-Fluoreszenz bei einer Anregung bei einem λ von 295 nm, ähnlich wie bei einer Anregung bei einem λ von 370 nm. Daher kann die NBS-vermittelte chemische Modifikation des Trp-Rückstands verwendet werden, um das Fehlen von FRET zwischen Trp und ANS zu untersuchen. In Abwesenheit von Trp-Fluoreszenz sollte man keinen Anstieg der ANS-Fluoreszenz beobachten. Die chemische Modifikation von Trp-Rückständen in Proteinen durch NBS kann nützlich sein, um FRET zwischen Trp-Rückständen zu untersuchen, die sich in der Nähe des gebundenen ANS befinden. Dieser Assay wird wahrscheinlich auch bei der Verwendung anderer Fluorophore nützlich sein.
Einleitung
Föster-Resonanz-Energietransfer (FRET) ist zu einer Standardtechnik zur Bestimmung des Abstands zwischen molekularen Strukturen nach Bindung oder Interaktion in Proteinstruktur- und Funktionsstudien1,2,3,4geworden. In P-Typ ATPasen wurde FRET verwendet, um die Struktur und Funktion des sarko-endoplasmatischen RetikulumsCa2+-ATPase (SERCA)2,5,6,7,8zu untersuchen, z. B. wurden strukturelle Fluktuationen während des katalytischen Zyklus im gesamten Protein mit FRET7analysiert.
FRET-Donatoren sind vielfältig und reichen von kleinen fluoreszierenden (extrinsischen) Molekülen bis hin zu fluoreszierenden Proteinen9,10. Tryptophan (Trp)-Rückstände (aufgrund ihrer Fluoreszenz) sind nützlich, um strukturelle Veränderungen in Proteinaminosäuresequenzen zu identifizieren11,12. Die Fluoreszenzintensität von Trp hängt wesentlich von der Polarität seiner Umgebung ab13,14. Die Ligandenbindung erzeugt in der Regel strukturelle Umlagerungen in Proteinen/Enzymen15,16. Wenn Trp an oder in der Nähe der Proteinbindungsstelle vorhanden ist, beeinflussen strukturelle Schwankungen häufig den Grad der Trp-Exposition gegenüber wässrigen Medien13,14; somit führt die Änderung der Polarität zum Abschrecken der Trp-Fluoreszenzintensität13,14. Daher ist die fluoreszierende Eigenschaft von Trp nützlich für die Durchführung von Ligandenbindungsstudien für Enzyme. Andere physikalische Phänomene können auch zu Trp-Fluoreszenzabschreckung17,18,19,20, z. B. FRET und Änderungen der mittleren Polarität führen. Auch der Energietransfer vom angeregten Zustand von Trp auf ein Fluorophor hat Anwendungsmöglichkeiten, z. B. die Affinitätsbestimmung kleiner Liganden in Proteinen21. Tatsächlich wurde Trp in erster Linie als Fluoreszenzdonor in FRET-Studien in Proteinen22,23,24verwendet, z. B. in Terbium (Tb3+) FRET-Studien wird ein Trp-Rückstand häufig als Antenne zur Energieübertragung auf Tb3+25,26,27verwendet. Trp zeigt verschiedene Vorteile gegenüber anderen FRET-Spendern aufgrund seines inhärenten konstitutiven Charakters in der Proteinstruktur, wodurch die Notwendigkeit präparativer Prozesse, die die Funktion / Struktur des untersuchten Proteins beeinflussen können, eliminiertwird 24. Daher ist die Identifizierung von Strahlungszerfällen (Energietransfer und Veränderungen der mittleren Polarität, die durch proteinstrukturelle Umlagerungen induziert werden) wichtig, um genaue Rückschlüsse auf die Ligandenbindung in Proteinstrukturstudien zu ziehen13,14,19,28.
In Proteinstrukturstudien wurde ein extrinsisches Fluorophor, nämlich 8-Anilino-1-naphthalinsulfonat (ANS), hauptsächlich in Experimenten im Zusammenhang mit der Proteinfaltung / -entfaltungverwendet 28,29. ANS bindet an Proteine/Enzyme im nativen Zustand, meist an den Bindungsstellen der Substrate31,32,33; eine Erhöhung der ANS-Fluoreszenzquantenausbeute (ΦF) (nämlich eine Erhöhung der Fluoreszenzintensität) wird durch Anregen des Proteins bei λ=370 nm induziert, wenn geeignete Wechselwirkungen von ANS mit Arg und His-Rückständen in hydrophoben Taschen auftreten34,35,36,37. In verschiedenen Studien wurde das Auftreten von FRET (bei Anregung bei λ innerhalb von 280-295 nm) zwischen Trp-Rückständen (Spendern) und ANS (Akzeptor) berichtet, das auf Folgendem basiert: 1) Überlappung des Fluoreszenzemissionsspektrums von Trp und des Anregungsspektrums von ANS, 2) Identifizierung eines geeigneten Abstands zwischen einem oder mehreren Trp-Resten und ANS für die Energieübertragung, 3) hohe ANS-Quantenausbeute bei Bindung in Proteintaschen und 4) charakteristisches FRET-Muster in den Fluoreszenzspektren des Proteins in Gegenwart von ANS3,17,27,37,38.
Kürzlich wurde die Ligandenbindung an die Nukleotidbindungsdomäne (N-Domäne) in SERCA und anderen P-Typ-ATPasen unter Verwendung von technisch hergestellten rekombinanten N-Domänen40,41,42,43,44,45,46untersucht. Molecular Engineering der SERCA N-Domäne wurde verwendet, um den einzigen Trp-Rückstand (Trp552Leu) in eine dynamischere Struktur (Tyr587Trp) zu bewegen, die sich in der Nähe der Nukleotidbindungsstelle befindet, wo Fluoreszenzvariationen (Quenching) verwendet werden können, um strukturelle Veränderungen bei Ligandenbindung zu überwachen34. Experimentelle Ergebnisse haben gezeigt, dass ANS (als ATP) an die Nukleotidbindungsstelle in der gereinigten rekombinanten SERCA N-Domäne34bindet. Interessanterweise nimmt die ANS-Fluoreszenz bei der Bindung an die N-Domäne bei Anregung bei einem λ von 295 nm zu, während die intrinsische Fluoreszenz der N-Domäneum 34abnimmt, wodurch ein FRET-Muster erzeugt wird, das auf die Bildung eines Trp-ANS-FRET-Paares hindeutet.
Die Verwendung von NBS wurde vorgeschlagen, um den Gehalt an Trp-Rückständen in Proteinen47 durch Absorptionstest modifizierter Proteine zu bestimmen. NBS modifiziert die hochabsorbierende Indolgruppe von Trp zum weniger saugfähigen Oxindol47,48. Daraus ergibt sich der Verlust (Abschrecken) der Trp-Fluoreszenzeigenschaft40. Daher kann die NBS-vermittelte chemische Modifikation von Trp-Rückständen als Assay verwendet werden, um die Rolle von Trp (als Spender) zu definieren, wenn FRET hypothetisch ist.
Dieses Protokoll beschreibt die chemische Modifikation des einzigen Trp-Rückstands durch NBS in der technisch rekombinanten N-Domäne von SERCA als Proteinmodell. Experimentelle Ergebnisse zeigen, dass die ANS-Fluoreszenzintensität in der chemisch NBS-modifizierten N-Domäne34,der eine intrinsische Fluoreszenz fehlt, noch zunimmt. Daher ist der Assay nützlich, um das Fehlen von FRET zwischen dem Trp-Rückstand und ANS nachzuweisen, wenn es an die N-Domäne34,40,49gebunden ist . Daher ist dieser Assay (NBS chemische Modifikation von Trp) nützlich, um das Vorhandensein des Trp-ANS FRET-Paares in Proteinen nachzuweisen.
Protokoll
1. Bestimmung (in silico) der ANS- und SERCA-N-Domänen-Interaktion
- Generieren Sie eine dreidimensionale (3D) Struktur des Proteins (SERCA N-Domäne) durch molekulare Modellierung mit der bevorzugten Proteinmodellierungssoftware50.
- Identifizieren Sie die Aminosäurereste, die die Nukleotidbindungsstelle bilden, mit der bevorzugten Molekularstruktursoftware51und bestimmen Sie das Vorhandensein von Arg- und Lys-Rückständen35; diese werden für die ANS-Bindung und zur Erhöhung der Fluoreszenzintensität (Quantenausbeute) benötigt.
- Führen Sie molekulares Andocken (mit der bevorzugten Docking-Software)52,53,54 durch, um die Wechselwirkungen von ATP, Fluoresceinisothiocyanat (FITC) (das eine kovalente Bindung mit Lys515 bildet, das die Nukleotidbindungsstelle markiert) und ANS mit Aminosäureresten in der Nukleotidbindungsstelle zu bestimmen ( Abbildung1).
- Berechnen Sie den molekularen Abstand (Å) zwischen Trp-Rückstand und gebundenem ANS mit dem Messwerkzeug in der bevorzugten Software.
- Durchführung einer molekulardynamischen Simulation des ANS-N-Domänenkomplexes, um die Stabilität der Wechselwirkung zu bestimmen52,54. Führen Sie dann die In-vitro-Experimente durch, wenn die Stabilität des Komplexes bestätigt wurde.
2. Expression und Reinigung der rekombinanten N-Domäne
- Synthetisieren Sie das Gen, das für die N-Domäne40kodiert.
- Entwerfen und konstruieren Sie das Plasmid, das das synthetische Gen enthält, das für die N-Domäne40 kodiert.
- Express und Reinigung durch Affinitätschromatographie (Ni-NTA), die entwickelte rekombinante N-Domäne. Führen Sie eine SDS-PAGE des gereinigten Proteins durch, um die Reinheit zu bestimmen (Abbildung 2)40.
- Bestimmen Sie die Proteinkonzentration durch Untersuchung der Absorption bei λ von 280 nm mit dem N-Domänen-Extinktionskoeffizienten (ε= 11.960 M-1·cm-1)40.
3. Überwachen Sie die Bildung des ANS-N-Domänenkomplexes basierend auf ANS- und N-Domänen-Fluoreszenzintensitätsänderungen.
- Bereiten Sie eine ANS-Stammlösung in N,N-Dimethylformamid vor.
- Wiegen Sie eine kleine Menge (1-5 mg) ANS und lösen Sie es in 1 ml des Endvolumens von N,N-Dimethylformamid, z. B. 3,2 mg (10,69 mM Endkonzentration).
- Eine 100 μM ANS wässrige Stammlösung unter Verwendung der ANS-Lösung in N,N-Dimethylformamid herstellen, z. B. 9,4 μL der 10,69 mM ANS-Lösung zu 990,6 μL 50 mM Phosphatpuffer mit pH 8,0 hinzufügen, um ein Endvolumen von 1 ml zu erhalten.
- Mischen Sie die Lösungen durch Vortexing 3 - 5 mal für 15 s.
HINWEIS: Verwenden Sie im folgenden Experiment nur die ANS-wässrige Stammlösung. Bereiten Sie die wässrige ANS-Stammlösung frisch vor, bevor Sie mit den Experimenten beginnen.
- Bereiten Sie die NBS-Stammlösung in N,N-Dimethylformamid vor.
- Wiegen Sie eine kleine Menge (1-5 mg) NBS und lösen Sie es in 1 ml N,N-Dimethylformamid, z. B. 5,3 mg in 1 ml (29,78 mM Endkonzentration).
- Eine 1 mM NBS wässrige Stammlösung unter Verwendung der NBS-Lösung in N,N-Dimethylformamid herstellen, z. B. 3,36 μL der 29,78 mM NBS-Lösung zu 96,64 μL 50 mM Phosphatpuffer mit pH 8,0 hinzufügen, um ein Endvolumen von 0,1 ml zu erhalten.
- Mischen Sie die Lösungen durch Vortexing 3 - 5 mal für 15 s.
HINWEIS: Bereiten Sie die nbS-wässrige Stammlösung frisch vor, bevor Sie mit den Experimenten beginnen.
- Titrieren Sie die N-Domäne mit ANS und zeichnen Sie die Fluoreszenzspektren durch Anregung bei λ=295 nm bei 25 °C auf.
- Erhalten Sie die Ausgangslinie des Fluoreszenzspektrums.
- 1 ml 50 mM Phosphatpuffer mit pH 8,0 in eine 1 mL Fluoreszenzquarzküvette geben.
- Positionieren Sie die Zelle in der thermo-angegebenen Zellkammer (25 °C) des Spektrofluorometers und stellen Sie die Anregung λ auf 295 nm ein.
- Zeichnen Sie das Fluoreszenzspektrum auf (305 - 550 nm).
HINWEIS: Das Fluoreszenzspektrum des 50 mM Phosphatpuffers mit pH 8,0, der als Blindprobe dient, wird von allen erhaltenen Fluoreszenzspektren abgezogen.
- Erhalten Sie das intrinsische Fluoreszenzspektrum der N-Domäne.
- 900 μL 50 mM Phosphatpuffer mit pH 8,0 in eine Fluoreszenzquarzküvette geben.
- Fügen Sie 100 μL N-Domänen-Suspension (10 μM) hinzu, um eine 1 μM N-Domänen-Endkonzentration in einem Endvolumen von 1 ml zu erhalten.
- Vorsichtig homogenisieren Sie mit einer Mikropipette 20 Mal, um die Homogenität der Lösung zu gewährleisten.
HINWEIS: Das Protein sollte frisch gereinigt werden, um hochwertige intrinsische Fluoreszenzspektren zu erhalten, z. B. darf die gereinigte rekombinante N-Domäne nur eine Woche nach der Reinigung verwendet werden. - Positionieren Sie die Zelle in der thermo-angegebenen Zellkammer (25 °C) des Spektrofluorometers und stellen Sie die Anregung λ auf 295 nm ein.
- Erfassen Sie das intrinsische Fluoreszenzspektrum der N-Domäne (305-550 nm).
- Fügen Sie ANS hinzu und erhalten Sie das Fluoreszenzspektrum durch Anregung bei λ = 295 nm.
- Der suspendierten N-Domäne (1 μM) wird ein 2 μL Aliquot von 100 μM ANS wässriger Stammlösung hinzugefügt, um eine ANS-Endkonzentration von 0,2 μM zu erhalten.
- Vorsichtig homogenisieren Sie mit einer Mikropipette 20 Mal, um die Homogenität der Lösung zu gewährleisten.
- Positionieren Sie die Zelle in der thermostabilen Zellkammer (25 °C) des Spektrofluorometers und stellen Sie die Anregung λ auf 295 nm ein.
- Zeichnen Sie das Fluoreszenzspektrum auf (305-550 nm).
- Wiederholen Sie die ANS-Additionen und Fluoreszenzspektren, die über der 1:1-Molarenbeziehung ANS:N-Domäne aufgezeichnet wurden.
- Subtrahieren Sie das Leerespektrum von jedem Spektrum mit geeigneter Software.
- Zeichnen Sie alle Spektren in einem einzigen Diagramm auf.
- Bestimmen Sie, ob die Spektren ein FRET-ähnliches Muster bilden. Die ANS-N-Domänen-Fluoreszenzspektren bilden ein FRET-ähnliches Muster (Abbildung 3A).
- Erhalten Sie die Ausgangslinie des Fluoreszenzspektrums.
4. N-Domäne intrinsische Fluoreszenztitration durch Trp chemische Modifikation mit NBS.
- Wiederholen Sie die Schritte 3.3.1 und 3.3.2.
- Der suspendierten N-Domäne (1 μM) wird ein 1 μL Aliquot von 1 mM NBS wässriger Stammlösung hinzugefügt, um eine Endkonzentration von 1 μM NBS zu erhalten.
- Vorsichtig homogenisieren, indem Sie eine Mikropipette 20 Mal verwenden, um die Homogenität der Lösung zu gewährleisten.
- Positionieren Sie die Zelle in der thermostabilen Zellkammer (25 °C) des Spektrofluorometers und stellen Sie die Anregung λ auf 295 nm ein.
- Zeichnen Sie das Fluoreszenzspektrum (305-550 nm) auf (Abbildung 3B).
- Wiederholen Sie die Aufzeichnung der NBS-Addition und der Fluoreszenzspektren, bis eine minimale N-Domänen-intrinsische Fluoreszenzabschreckung beobachtet wird40. In der N-Domäne geschieht dies normalerweise bei einem molaren Verhältnis von 5-6 NBS/N-Domäne40.
HINWEIS: NBS löscht schnell (<5 s) die intrinsische Fluoreszenz der N-Domäne; eine Abnahme der Fluoreszenzintensität wird beobachtet. Fahren Sie sofort mit dem nächsten Schritt fort, da NBS auch mit anderen Aminosäureresten reagieren kann47. - Subtrahieren Sie das Leerespektrum von jedem Spektrum mit geeigneter Software.
- Zeichnen Sie alle Spektren in einem einzigen Diagramm auf (Abbildung 3B).
5. Titrieren Sie die NBS-modifizierte N-Domäne mit ANS, indem Sie Fluoreszenzspektren bei 25 °C aufzeichnen.
- Führen Sie Schritt 3.3.3 mit der NBS-modifizierten N-Domäne aus, die in Schritt 4 generiert wurde.
- Subtrahieren Sie das Leerespektrum von jedem Spektrum mit geeigneter Software.
- Zeichnen Sie alle Spektren in einem einzigen Diagramm auf (Abbildung 3C).
- Die erzeugten Fluoreszenzspektren (Abbildung 3C) unterstützen oder widerlegen das Auftreten von FRET, d.h. wenn FRET auftritt, steigt die ANS-Fluoreszenz nicht an und umgekehrt.
6. Nachweis der ANS-Bindung an die chemisch modifizierte N-Domäne durch Anregung bei λ=370 nm.
- Führen Sie Schritt 3.3.3 mit der NBS-modifizierten N-Domäne aus, die in Schritt 4 generiert wurde, ändern Sie jedoch die Anregung λ auf 370 nm.
- Subtrahieren Sie das Leerespektrum von jedem Spektrum mit geeigneter Software.
- Zeichnen Sie alle Spektren in einem einzigen Diagramm auf (Abbildung 3D).
- Bestätigen Sie die ANS-Bindung an die N-Domäne, indem Sie die Zunahme der ANS-Fluoreszenzintensität beobachten. Die ANS-Bindung an die N-Domäne zeigt einen Fluoreszenzanstieg, wenn sie bei λ=370 nm angeregt wird (Abbildung 3D). Als Kontrolle wurde das Fluoreszenzspektrum von ANS (allein) in 50 mM Phosphatpuffer mit pH 8,0 bei λ von 295 und 370 nm anregend erhalten(Abbildung 4,nicht im Video gezeigt).
HINWEIS: Die stöchiometrische Beziehung von NBS:Trp, die für die chemische Modifikation erforderlich ist, hängt vom Grad der Vergrabenung der Trp-Rückstände in dem untersuchten Protein46,47,55,56ab . Daher empfiehlt es sich, das Molverhältnis NBS:Protein/(Trp) vorher zu bestimmen.
Ergebnisse
Molekulares Andocken zeigt die Bindung von ANS an die Nukleotidbindungsstelle der N-Domäne über elektrostatische sowie hydrophobe Wechselwirkungen (Abbildung 1). Der molekulare Abstand (20 Å) zwischen dem Trp-Rückstand und ANS (gebunden an die Nukleotidbindungsstelle) unterstützt das Auftreten von FRET (Abbildung 1). Die entworfene (engineered) rekombinante N-Domäne wurde bei hoher Reinheit durch Affinitätschromatographie (Abbildung 2) erhalten und war für Fluoreszenzexperimente geeignet. Fluoreszenzspektren des ANS-N-Domänenkomplexes zeigten bei Anregung bei λ=295 nm ein FRET-ähnliches Muster (Abbildung 3A). Die chemische Modifikation des Trp-Rückstands durch NBS führte zum Abschrecken der intrinsischen Fluoreszenz der N-Domäne (Abbildung 3B). In der chemisch NBS-modifizierten N-Domäne zeigen die experimentellen Ergebnisse, dass die ANS-Fluoreszenz bei Anregung bei λ=295 nm (Abbildung 3C) ähnlich wie in der nicht modifizierten N-Domäne (Abbildung 3A) zunahm. Daher liefert die direkte Anregung von ANS bei λ=295 nm die meiste Energie für die ANS-Fluoreszenz (Abbildung 3C), wie zuvor vorgeschlagen28. Die ANS-Bindung an die chemisch modifizierte N-Domäne wird durch eine Erhöhung ihrer Fluoreszenz bei Anregung bei λ=370 nm nachgewiesen (Abbildung 3D). Daher tritt FRET nicht zwischen dem Trp-Rückstand und ANS auf, das an die Nukleotidbindungsstelle gebunden ist.
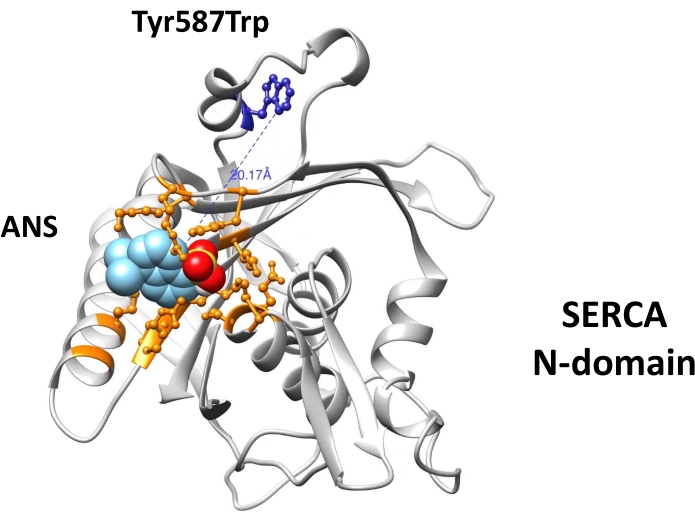
Abbildung 1: Molekulares Andocken von ANS an die Nukleotidbindungsstelle der Ca2+-ATPase N-Domäne. Das molekulare ANS-Docking wurde mit der AutoDock Vina-Software (http://vina.scripps.edu/) und einem generierten 3D-Modell der N-Domäne40durchgeführt. Die manipulierte N-Domäne enthält die Mutationen Trp552Leu und Tyr587Trp (blau dargestellt). Aminosäurereste, die die Nukleotidbindungsstelle bilden, werden als Kugeln und Stöcke dargestellt und orange hervorgehoben. Diese Zahl wurde mit Genehmigung von Springer Nature: Springer, Journal of Fluorescencegeändert. Urheberrecht (2020)34. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
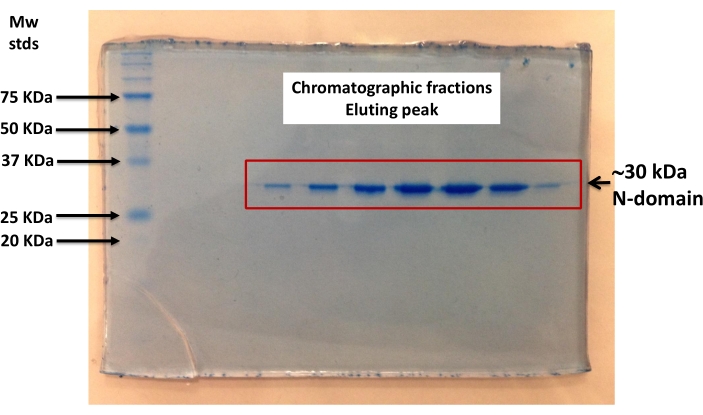
Abbildung 2: SDS−PAGE der entwickelten rekombinanten Ca2+-ATPase N-Domäne. Die N-Domäne wurde einer Affinitätsreinigung mit einer chromatographischen Säule unterzogen. Fraktionen, die Absorptionspeaks (bei λ=280 nm) entsprachen, wurden SDS−PAGE unterzogen und durch Coomassie-Blaufärbung visualisiert. Die ~30 kDa His-tagged N-Domäne wird gebildet durch 27 kDa der N-Domäne Ca2+-ATPase und 3 kDa des Poly-His-Tags. Die Reinheit der Ca2+-ATPase N-Domäne wurde durch Densitometrie mit der ImageJ-Software (https://imagej.nih.gov/ij/download.html) auf ≥95% bestimmt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
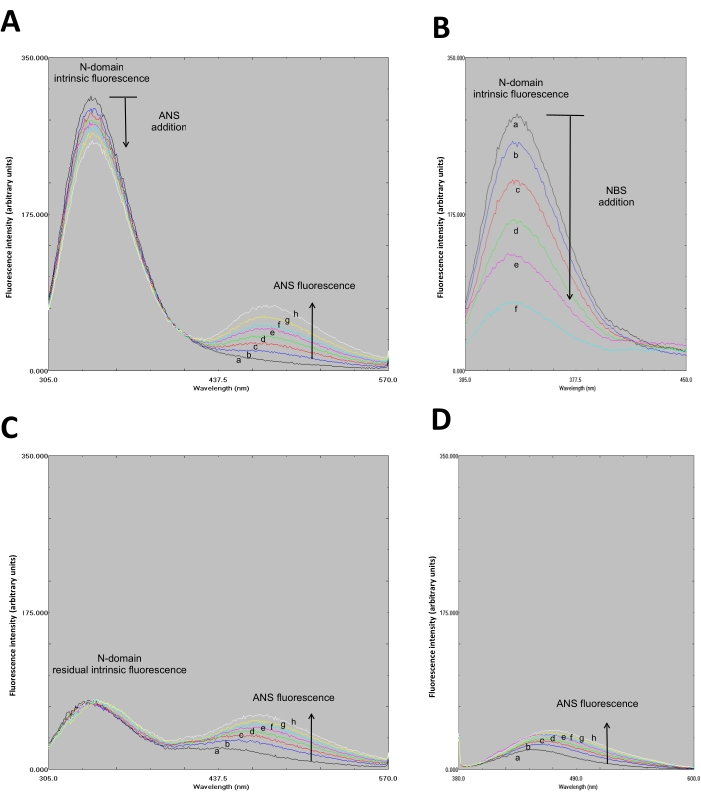
Abbildung 3: NBS-vermittelte chemische Modifikation des Trp-Rückstands in der N-Domäne widerlegt FRET zwischen Trp und ANS, das an die Nukleotidbindungsstelle gebunden ist. A. FRET-Muster des ANS-N-Domänenkomplexes bei Anregung bei λ=295 nm. ANS wurde der suspendierten N-Domäne (1 μM) zugesetzt (Endkonzentration in μM: Spektren a, 0; b, 0,2; c, 0,4; d, 0,6; e, 0,8; f, 1,0; g, 1,2; und h, 1,4). B. Fluoreszenzabschreckung der N-Domäne durch NBS (NBS-Konzentration in μM: a, 0; b, 1; c, 2; d, 3; e, 4; und f, 6). NBS vermittelt chemische Modifikation des Trp-Rückstands. Die intrinsische N-Domänenfluoreszenz wurde bei Anregung bei λ=295 nm beobachtet. C. (EN) Fluoreszenzspektren von ANS, die bei Anregung bei λ=295 nm an die chemisch modifizierte N-Domäne gebunden sind. Die experimentellen Bedingungen sind wie in A. Die Abbildungen A, B und C wurden mit Genehmigung von Springer Nature: Springer, Journal of Fluorescence geändert. Urheberrecht (2020)34. D. Fluoreszenzspektren von ANS, die bei Anregung bei λ=370 nm an die chemisch modifizierte N-Domäne gebunden sind. Die N-Domäne wurde in 1 ml 50 mM Phosphatpuffer (pH 8,0) und Aliquoten von NBS suspendiert, und ANS wurde entsprechend hinzugefügt, wie in A (ANS) und B (NBS) beschrieben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Abbildung 4: ANS-Fluoreszenzspektren. ANS (1,4 μM) in 50 mM Phosphatpuffer mit pH 8,0 wurde bei λ von 295 und 370 nm angeregt; die Spektren sind in Schwarz bzw. Blau dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Fluoreszenzspektren des ANS-N-Domänenkomplexes zeigen ein FRET-ähnliches Muster, wenn sie bei einem λ von 295 nm angeregt werden, während der molekulare Abstand (20 Å) zwischen dem Trp-Rückstand und ANS das Auftreten von FRET zu unterstützen scheint (Abbildung 1). Die chemische Modifikation von Trp durch NBS führt zu einer weniger fluoreszierenden N-Domäne (Abbildung 3B, Spektrum f); daher ist eine Energieübertragung nicht möglich. Die ANS-Fluoreszenzspektren ähneln denen der nicht modifizierten N-Domäne, wenn sie bei einem λ von 295 nm angeregt werden (Abbildung 3A und C).
Daher ist die direkte Anregung von ANS bei einem λ von 295 nm die Hauptquelle der ANS-Fluoreszenz, wenn sie an die ATP-Bindungsstelle gebunden ist (Abbildung 3C), was mit dem von anderen Autoren vorgeschlagenen Mechanismus28übereinstimmen. Daher kommt FRET vom Trp-Rückstand zum gebundenen ANS im N-Domänen-ANS-Komplex nicht vor. Dennoch unterstützt die NBS-vermittelte chemische Modifikation von Trp-Rückständen in anderen Proteinen FRET zwischen Trp und ANS, z. B. in den Enzymen Xylosereduktase aus Neurospora crassa49, der α-Untereinheit von F1-ATPase aus Hefe-Mitochondrien58und Thermolysin59.
Der Assay würde in Proteinen/Enzymen mit hydrophoben Taschen (Bindungsstellen), die His- und Arg-Rückstände enthalten, gut funktionieren, da diese zur Stabilisierung der ANS-Interaktion beitragen. Zusätzlich sollten solche Proteine idealerweise einen einzigen Trp-Rückstand enthalten, der sich an der Proteinoberfläche befindet, nämlich für eine schnelle Reaktion mit NBS40,41,49zugänglich ist.
Alternativ kann zur Analyse des Trp-ANS FRET-Paares in Proteinen die chemische Modifikation seiner Rückstände durch Acetylierung und Prägnylierung verwendet werden, um die ANS-Interaktion in der Protein/Enzym-Bindungsstelle60zu behindern. Die Deletion des Trp-Rückstands durch Mutation ist eine weitere Strategie zur Analyse von FRET. Dies kann jedoch zeitaufwendig sein, und die Konstrukte können strukturelle Unterschiede aufweisen, wodurch sich die Ligandenbindung61auswirkt. In ähnlicher Weise kann die Mutation von Arg und seinen Rückständen an der Ligandenbindungsstelle unvorhergesehene strukturelle Veränderungen hervorrufen, wodurch das mutierte Protein für Experimente ungeeignet wird62.
In Bezug auf den Trp-Rückstand wäre die Leistung des NBS-chemischen Modifikationstests in den folgenden Fällen begrenzt: 1) wenn der Trp-Rückstand tief im Kern eines gut gefalteten und kompakten Proteins vergraben ist; da der NBS-Teil aufgrund des Fehlens großer Hohlräume nicht auf den Trp-Rückstand zugreifen könnte41,48,63, 2) wenn sich Trp-Rückstände in einer membraneingebetteten Struktur (Transmembran α-Helix) befinden, da der wässrige Charakter von NBSverhindert,dass es in das hydrophobe Medium gelangt32,56,64, 3) wenn die Proteinstruktur mehrere Trp-Rückstände enthält; da die Variationen in der Zugänglichkeit und physikalisch-chemischen Umgebung groß sein können, was die Zuordnung einer Fluoreszenzsignaländerung zu einem Trp-Rückstand erschwert32,41,56, 4), wenn die ANS-Bindung an Proteine hauptsächlich auf hydrophobe Wechselwirkung zurückzuführen ist, da der ANS-Fluoreszenzanstieg hauptsächlich auf elektrostatische Wechselwirkungen zurückzuführen ist32,65,66,67und e) wenn statisch Das Abschrecken von Trp erfolgt z. B. in Gegenwart von Sauerstoff68.
NbS-vermittelte chemische Modifikation von Trp-Rückständen scheint ein schneller und einfacher Assay für die Untersuchung von FRET zwischen Trp und ANS zu sein, der an Proteine / Enzyme gebunden ist. Anstelle von NBS können andere Trp-modifizierende Reagenzien verwendet werden, z. B. Hydroxy-5-nitrobenzylbromid (HNB)69,70. Schließlich kann der Assay auf den Nachweis vorgeschlagener FRET-Paare von Trp mit anderen Flurophoren anwendbar sein21.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden finanziellen Interessen haben.
Danksagungen
Diese Arbeit wurde teilweise durch die FAI-UASLP-Fördernummer C19-FAI-05-89.89 und die CONACYT-Zuschussnummer 316463 (Apoyos a la Ciencia de Frontera: Fortalecimiento y Mantenimiento de Infraestructuras de Investigación de Uso Común y Capacitación Técnica 2021)finanziert. Die Autoren danken der technischen Unterstützung von Julian E. Mata-Morales in der Videoausgabe.
Materialien
| Name | Company | Catalog Number | Comments |
| Acrylamide | Bio-Rad | 1610107 | SDS-PAGE |
| Ammonium persulfate | Bio-Rad | 1610700 | SDS-PAGE |
| 8-Anilino-1-naphthalenesulfonic acid | Sigma-Aldrich | A1028 | Fluorophore |
| Bis-acrylamide | Bio-Rad | 1610125 | SDS-PAGE |
| N-Bromosuccinimide | Sigma-Aldrich | B81255 | Chemical modification |
| N,N-dimethylformamide | J.T. Baker | 9213-12 | Stock solution preparation |
| Fluorescein isothiocyanate | Sigma-Aldrich | F7250 | Chemical fluorescence label |
| Fluorescence cuvette | Hellma | Z801291 | Fluorescence assay |
| Fluorescence Spectrofluorometer | Shimadzu | RF 5301PC | Fluorescence assay |
| HisTrap™ FF | GE Healtcare | 11-0004-59 | Protein purification |
| IPTG, Dioxane free | American Bionalytical | AB00841-00010 | Protein expression |
| Imidazole | Sigma-Aldrich | I5513-25G | Protein purification |
| LB media | Fisher Scientific | 10000713 | Cell culture |
| Pipetman L P10L | Gilson | FA10002M | Fluorescence assay |
| Pipetman L P100L | Gilson | FA10004M | Fluorescence assay |
| Pipetman L P200L | Gilson | FA10005M | Fluorescence assay |
| Pipetman L P1000L | Gilson | FA10006M | Fluorescence assay |
| Pipetman L P5000L | Gilson | FA10007 | Fluorescence assay |
| Precision plus std | Bio-Rad | 1610374 | SDS-PAGE |
| Sodium dodecyl sulphate | Bio-Rad | 1610302 | SDS-PAGE |
| Sodium phosphate dibasic | J.T. Baker | 3828-19 | Buffer preparation |
| Sodium phosphate monobasic | J.T. Baker | 3818-01 | Buffer preparation |
| Syringe filter 0.2 um | Millipore | GVWP04700 | Solution filtration |
| Temed | Bio-Rad | 1610801 | SDS-PAGE |
| Tris | Bio-Rad | 1610719 | SDS-PAGE |
Referenzen
- Munishkina, L. A., Fink, A. L. Fluorescence as a method to reveal structures and membrane-interactions of amyloidogenic proteins. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1768 (8), 1862-1885 (2007).
- Dong, X., Thomas, D. D. Time-resolved FRET reveals the structural mechanism of SERCA-PLB regulation. Biochemical and Biophysical Research Communications. 449 (2), 196-201 (2014).
- Szilvay, G. R., Blenner, M. A., Shur, O., Cropek, D. M., Banta, S. A FRET-based method for probing the conformational behavior of an intrinsically disordered repeat domain from Bordetella pertussis adenylate cyclase. Biochemistry. 48 (47), 11273-11282 (2009).
- Sun, Y., Wallrabe, H., Booker, C. F., Day, R. N., Periasamy, A. Three-color spectral FRET microscopy localizes three interacting proteins in living cells. Biophysical Journal. 99 (4), 1274-1283 (2010).
- Cornea, R. L., et al. High-throughput FRET assay yields allosteric SERCA activators. Journal of Biomolecular Screening. 18 (1), 97-107 (2013).
- Gruber, S. J., et al. Discovery of enzyme modulators via high-throughput time-resolved FRET in living cells. Journal of Biomolecular Screening. 19 (2), 215-222 (2014).
- Dyla, M., et al. Dynamics of P-type ATPase transport revealed by single-molecule FRET. Nature. 551 (7680), 346-351 (2017).
- Corradi, G. R., Adamo, H. P. Intramolecular fluorescence resonance energy transfer between fused autofluorescent proteins reveals rearrangements of the N- and C-terminal segments of the plasma membrane Ca2+ pump involved in the activation. The Journal of Biological Chemistry. 282 (49), 35440-35448 (2007).
- Piston, D. W., Kremers, G. -. J. Fluorescent protein FRET: The good, the bad and the ugly. Trends in Biochemical Sciences. 32 (9), 407-414 (2007).
- Ma, L., Yang, F., Zheng, J. Application of fluorescence resonance energy transfer in protein studies. Journal of Molecular Structure. 1077, 87-100 (2014).
- Chen, Y., Barkley, M. D. Toward understanding tryptophan fluorescence in proteins. Biochemistry. 37 (28), 9976-9982 (1998).
- Zelent, B., et al. Tryptophan fluorescence yields and lifetimes as a probe of conformational changes in human glucokinase. Journal of Fluorescence. 27 (5), 1621-1631 (2017).
- Callis, P. R. Binding phenomena and fluorescence quenching. I: Descriptive quantum principles of fluorescence quenching using a supermolecule approach. Journal of Molecular Structure. 1077, 14-21 (2014).
- Callis, P. R. Binding phenomena and fluorescence quenching. II: Photophysics of aromatic residues and dependence of fluorescence spectra on protein conformation. Journal of Molecular Structure. 1077, 22-29 (2014).
- Agarwal, P. K., Geist, A., Gorin, A. Protein dynamics and enzymatic catalysis: Investigating the peptidyl-prolyl cis-trans isomerization activity of cyclophilin A. Biochemistry. 43 (33), 10605-10618 (2004).
- Deng, H., Zhadin, N., Callender, R. Dynamics of protein ligand binding on multiple time scales: NADH binding to lactate dehydrogenase. Biochemistry. 40 (13), 3767-3773 (2001).
- van de Weert, M. Fluorescence quenching to study protein-ligand binding: common errors. Journal of fluorescence. 20 (2), 625-629 (2010).
- van de Weert, M., Stella, L. Fluorescence quenching and ligand binding: A critical discussion of a popular methodology. Journal of Molecular Structure. 998 (1-3), 144-150 (2011).
- Stella, L., van de Weert, M., Burrows, H. D., Fausto, R. Fluorescence spectroscopy and binding: Getting it right. Journal of Molecular Structure. 1077, 1-3 (2014).
- Credi, A., Prodi, L. Inner filter effects and other traps in quantitative spectrofluorimetric measurements: Origins and methods of correction. Journal of Molecular Structure. 1077, 30-39 (2014).
- Lee, M. M., Peterson, B. R. Quantification of small molecule-protein interactions using FRET between tryptophan and the pacific blue fluorophore. ACS Omega. 1 (6), 1266-1276 (2016).
- Zhang, Y., et al. Comparison of FÖrster-resonance-energy-transfer acceptors for tryptophan and tyrosine residues in native proteins as donors. Journal of Fluorescence. 23 (1), 147-157 (2013).
- Xie, Y., Maxson, T., Tor, Y. Fluorescent ribonucleoside as a FRET acceptor for tryptophan in native proteins. Journal of the American Chemical Society. 132 (34), 11896-11897 (2010).
- Ghisaidoobe, A. B. T. T., Chung, S. J. Intrinsic tryptophan fluorescence in the detection and analysis of proteins: A focus on Förster resonance energy transfer techniques. International Journal of Molecular Sciences. 15 (12), 22518-22538 (2014).
- Goryashchenko, A. S., et al. Genetically encoded FRET-sensor based on terbium chelate and red fluorescent protein for detection of caspase-3 activity. International Journal of Molecular Sciences. 16 (7), 16642-16654 (2015).
- Arslanbaeva, L. R., et al. Induction-resonance energy transfer between the terbium-binding peptide and the red fluorescent proteins DsRed2 and TagRFP. Biophysics. 56 (3), 381-386 (2011).
- Di Gennaro, A. K., Gurevich, L., Skovsen, E., Overgaard, M. T., Fojan, P. Study of the tryptophan-terbium FRET pair coupled to silver nanoprisms for biosensing applications. Physical Chemistry Chemical Physics. 15 (22), 8838-8844 (2013).
- Hawe, A., Poole, R., Jiskoot, W. Misconceptions over Förster resonance energy transfer between proteins and ANS/bis-ANS: Direct excitation dominates dye fluorescence. Analytical Biochemistry. 401 (1), 99-106 (2010).
- Ghosh, U., Das, M., Dasgupta, D. Association of fluorescent probes 1-anilinonaphthalene-8-sulfonate and 4,4´-dianilino-1,1´-binaphthyl-5,5´-disulfonic acid with T7 RNA polymerase. Biopolymers. 72 (4), 249-255 (2003).
- Vreuls, C., et al. Guanidinium chloride denaturation of the dimeric Bacillus licheniformis BlaI repressor highlights an independent domain unfolding pathway. The Biochemical Journal. 384, 179-190 (2004).
- Möller, M., Denicola, A. Study of protein-ligand binding by fluorescence. Biochemistry and Molecular Biology Education. 30 (5), 309-312 (2002).
- Chang, L., Wen, E., Hung, J., Chang, C. Energy transfer from tryptophan residues of proteins to 8-anilinonaphthalene-1-sulfonate. Journal of Protein Chemistry. 13 (7), 635-640 (1994).
- Togashi, D. M., Ryder, A. G. A fluorescence analysis of ANS bound to bovine serum albumin: Binding properties revisited by using energy transfer. Journal of Fluorescence. 18 (2), 519-526 (2008).
- Dela Cruz-Torres, V., Cataño, Y., Olivo-Rodríguez, M., Sampedro, J. G. ANS interacts with the Ca2+-ATPase nucleotide binding site. Journal of Fluorescence. 30 (3), 483-496 (2020).
- Gasymov, O. K., Glasgow, B. J. ANS fluorescence: Potential to augment the identification of the external binding sites of proteins. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1774 (3), 403-411 (2007).
- Matulis, D., Lovrien, R. 1-anilino-8-naphthalene sulfonate anion-protein binding depends primarily on ion pair formation. Biophysical Journal. 74 (1), 422-429 (1998).
- Samukange, V., Yasukawa, K., Inouye, K. Interaction of 8-anilinonaphthalene 1-sulphonate (ANS) and human matrix metalloproteinase 7 (MMP-7) as examined by MMP-7 activity and ANS fluorescence. Journal of Biochemistry. 151 (5), 533-540 (2012).
- Qin, J., et al. Selective and sensitive homogenous assay of serum albumin with 1-anilinonaphthalene-8-sulphonate as a biosensor. Analytica Chimica Acta. 829, 60-67 (2014).
- Malik, A., Kundu, J., Karmakar, S., Lai, S., Chowdhury, P. K. Interaction of ANS with human serum albumin under confinement: Important insights and relevance. Journal of Luminescence. 167, 316-326 (2015).
- Páez-Pérez, E. D., De La Cruz-Torres, V., Sampedro, J. G. Nucleotide binding in an engineered recombinant Ca2+-ATPase N-domain. Biochemistry. 55 (49), 6751-6765 (2016).
- Sampedro, J. G., Nájera, H., Uribe-Carvajal, S., Ruiz-Granados, Y. G. Mapping the ATP binding site in the plasma membrane H+-ATPase from Kluyveromyces lactis. Journal of fluorescence. 24 (6), 1849-1859 (2014).
- Abu-Abed, M., Millet, O., MacLennan, D. H., Ikura, M. Probing nucleotide-binding effects on backbone dynamics and folding of the nucleotide-binding domain of the sarcoplasmic/endoplasmic-reticulum Ca2+-ATPase. The Biochemical Journal. 379, 235-242 (2004).
- Abu-Abed, M., Mal, T. K., Kainosho, M., MacLennan, D. H., Ikura, M. Characterization of the ATP-binding domain of the sarco(endo)plasmic reticulum Ca2+-ATPase: probing nucleotide binding by multidimensional NMR. Biochemistry. 41 (4), 1156-1164 (2002).
- Sazinsky, M. H., Mandal, A. K., Argüello, J. M., Rosenzweig, A. C. Structure of the ATP binding domain from the Archaeoglobus fulgidus Cu+-ATPase. Journal of Biological Chemistry. 281 (16), 11161-11166 (2006).
- Liu, L., et al. Crystallization and preliminary X-ray studies of the N-domain of the Wilson disease associated protein. Acta Crystallographica Section F: Structural Biology and Crystallization Communications. 65 (6), 621-624 (2009).
- Banci, L., et al. The binding mode of ATP revealed by the solution structure of the N-domain of human ATP7A. Journal of Biological Chemistry. 285 (4), 2537-2544 (2010).
- Spande, T. F., Witkop, B. Determination of the tryptophan content of proteins with N-bromosuccinimide. Methods in Enzymology. 11, 498-506 (1967).
- Spande, T. F., Green, N. M., Witkop, B. The Reactivity toward N-bromosuccinimide of tryptophan in enzymes, zymogens, and inhibited enzymes. Biochemistry. 5 (6), 1926-1933 (1966).
- Rawat, U. B., Rao, M. B. Purification, kinetic characterization and involvement of tryptophan residue at the NADPH binding site of xylose reductase from Neurospora crassa. Biochimica et Biophysica Acta (BBA) - Protein Structure and Molecular Enzymology. 1293 (2), 222-230 (1996).
- Zaki, M. J., Bystroff, C. . Protein Structure Prediction. , (2008).
- Wang, Z., et al. Comprehensive evaluation of ten docking programs on a diverse set of protein-ligand complexes: The prediction accuracy of sampling power and scoring power. Physical Chemistry Chemical Physics. 18 (18), 12964-12975 (2016).
- Pagadala, N. S., Syed, K., Tuszynski, J. Software for molecular docking: A review. Biophysical Reviews. , 91-102 (2017).
- Dolatkhah, Z., Javanshir, S., Sadr, A. S., Hosseini, J., Sardari, S. Synthesis, Molecular Docking, Molecular Dynamics Studies, and Biological Evaluation of 4 H -Chromone-1,2,3,4-tetrahydropyrimidine-5-carboxylate Derivatives as Potential Antileukemic Agents. Journal of Chemical Information and Modeling. 57 (6), 1246-1257 (2017).
- Forli, S., et al. Computational protein-ligand docking and virtual drug screening with the AutoDock suite. Nature Protocols. 11 (5), 905-919 (2016).
- Lindahl, E. R. Molecular dynamics simulations. Molecular Modeling of Proteins. Methods in Molecular Biology. 443, 3-23 (2008).
- Turk, T., Maček, P., Gubenšek, F. The role of tryptophan in structural and functional properties of equinatoxin II. Biochimica et Biophysica Acta (BBA)/Protein Structure and Molecular. 1119 (1), 1-4 (1992).
- Peterman, B. F., Laidler, K. J. Study of reactivity of tryptophan residues in serum albumins and lysozyme by N-bromosuccinamide fluorescence quenching. Archives of Biochemistry and Biophysics. 199 (1), 158-164 (1980).
- Divita, G., Goody, R. S., Gautheron, D. C., Di Pietro, A. Structural mapping of catalytic site with respect to α-subunit and noncatalytic site in yeast mitochondrial F1-ATPase using fluorescence resonance energy transfer. Journal of Biological Chemistry. 268 (18), 13178-13186 (1993).
- Horrocks, W. D., Holmquist, B., Vallee, B. L. Energy transfer between terbium (III) and cobalt (II) in thermolysin: a new class of metal-metal distance probes. Proceedings of the National Academy of Sciences of the United States of America. 72 (12), 4764-4768 (1975).
- Chakraborty, J., Das, N., Halder, U. C. Unfolding diminishes fluorescence resonance energy transfer (FRET) of lysine modified β-lactoglobulin: Relevance towards anti-HIV binding. Journal of Photochemistry and Photobiology B: Biology. 102 (1), 1-10 (2011).
- Sirangelo, I., Malmo, C., Casillo, M., Irace, G. Resolution of Tryptophan-ANS Fluorescence Energy Transfer in Apomyoglobin by Site-directed Mutagenesis. Photochemistry and Photobiology. 76 (4), 381-384 (2007).
- Ribeiro, A. J. M., Tyzack, J. D., Borkakoti, N., Holliday, G. L., Thornton, J. M. A global analysis of function and conservation of catalytic residues in enzymes. Journal of Biological Chemistry. 295 (2), 314-324 (2020).
- Eftink, M. R., Ghiron, C. A. Exposure of tryptophanyl residues in proteins. Quantitative determination by fluorescence quenching studies. Biochemistry. 15 (3), 672-680 (1976).
- Eftink, M. R., Ghiron, C. A. Fluorescence quenching of indole and model micelle systems. The Journal of Physical Chemistry. 80 (5), 486-493 (1976).
- Kinsley, N., Sayed, Y., Mosebi, S., Armstrong, R. N., Dirr, H. W. Characterization of the binding of 8-anilinonaphthalene sulfonate to rat class Mu GST M1-1. Biophysical Chemistry. 137 (2-3), 100-104 (2008).
- Mohsenifar, A., et al. A study of the oxidation-induced conformational and functional changes in neuroserpin. Iranian Biomedical Journal. 11 (1), 41-46 (2007).
- Gonzalez, W. G., Miksovska, J. Application of ANS fluorescent probes to identify hydrophobic sites on the surface of DREAM. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1844 (9), 1472-1480 (2014).
- Eftink, M. R., Ghiron, C. A. Fluorescence quenching studies with proteins. Analytical Biochemistry. 114 (2), 199-227 (1981).
- Poulos, T. L., Price, P. A. The identification of a tryptophan residue essential to the catalytic activity of bovine pancreatic deoxyribonuclease. The Journal of biological chemistry. 246 (12), 4041-4045 (1971).
- Hu, J. -. J., He, P. -. Y., Li, Y. -. M. Chemical modifications of tryptophan residues in peptides and proteins. Journal of Peptide Science An Official Publication of the European Peptide Society. 27 (1), 3286 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten