Method Article
التعديل الكيميائي لبقايا التربتوفان في Ca2+-ATPase N-domain لدراسة تريبتوفان-ANS FRET
In This Article
Summary
ANS يربط Ca2 +-ATPase recombinant N-المجال. عرض أطياف مضان نمط مثل FRET عند الإثارة في الطول الموجي من 295 نانومتر. ويروي التعديل الكيميائي الذي يتوسط فيه المكتب الوطني للإحصاء في Trp مضان المجال N، مما يؤدي إلى عدم وجود نقل للطاقة (FRET) بين بقايا Trp و ANS.
Abstract
الساركو / إندوبالازميك ريتيكولم Ca2 +- ATPase (SERCA) هو ATPase من نوع P الذي تم بلورته في تشكيلات مختلفة. ومع ذلك، يمكن الحصول على معلومات وظيفية مفصلة من مجالات منعزلة مؤتلفة. يعرض المجال الهندسي (Trp552Leu و Tyr587Trp) النطاق الملتصق بالنيوكليوتيدات المؤتلف (N-domain) إخمادا مضانا عند الربط بين الليجاند. وفلوروفوري extrinsic، وهي 8-anilino-1-النفثالين السلفونات (ANS)، يرتبط إلى موقع الربط النيوكليوتيدات عن طريق التفاعلات الكهربائية والمائية مع آرغ، له، علاء، ليو، وبقايا في. ويتضح الربط ANS من خلال زيادة في كثافة الفلورسينس عندما متحمس في الطول الموجي (λ) من 370 نانومتر. ومع ذلك، عندما متحمس في λ من 295 نانومتر، ويبدو أن الزيادة في كثافة مضان أن يقترن إرواء الفلورية الجوهرية N-المجال. عرض الطيف الفلورية Föster نقل الطاقة الرنين (FRET) نمط مثل, مما يشير إلى وجود زوج Trp-ANS FRET, الذي يبدو أن تكون مدعومة مسافة قصيرة (~ 20 Å) بين Tyr587Trp و ANS. تصف هذه الدراسة تحليلا لزوج Trp-ANS FRET عن طريق التعديل الكيميائي Trp (وإرواء الفلورسينس) الذي يتم بوساطة N-bromosuccinimide (NBS). في N-المجال المعدل كيميائيا, زيادة مضان ANS عندما متحمس في λ من 295 نانومتر, على غرار عندما متحمس في λ من 370 نانومتر. ومن ثم، يمكن استخدام التعديل الكيميائي بوساطة NBS لبقايا Trp للتحقيق في عدم وجود FRET بين Trp و ANS. في غياب ترب مضان، لا ينبغي للمرء أن يلاحظ زيادة في مضان ANS. التعديل الكيميائي لمخلفات Trp في البروتينات من قبل NBS قد يكون مفيدا لفحص FRET بين بقايا Trp القريبة من ANS المقيدة. ومن المرجح أن يكون هذا المقايسة مفيدا أيضا عند استخدام الفلوروفوريس الأخرى.
Introduction
أصبح نقل الطاقة الرنين Föster (FRET) تقنية قياسية لتحديد المسافة بين الهياكل الجزيئية بعد الربط أو التفاعل في بنية البروتين ودراسات الوظائف1و2و3و4. في P-نوع ATPases، وقد استخدمت FRET للتحقيق في هيكل ووظيفة من reticulum الساركو-endoplasmic Ca2+-ATPase (SERCA)2،5،6،7،8، على سبيل المثال ، تم تحليل التقلبات الهيكلية خلال دورة الحفاز في البروتين كله من قبل FRET7.
FRET الجهات المانحة متنوعة، وتتراوح من جزيئات الفلورسنت الصغيرة (extrinsic) إلى البروتينات الفلورية9،10. التربتوفان (Trp) بقايا (بسبب مضانها) مفيدة لتحديد التغيرات الهيكلية في تسلسل البروتين الأحماض الأمينية11,12. كثافة الفلورية من TRP يعتمد إلى حد كبير على قطبية البيئة المحيطة بها13،14. الربط ليغاند يولد عادة إعادة ترتيب الهيكلية في البروتينات / الانزيمات15،16. إذا كان Trp موجودا في موقع ربط البروتين أو يقع بالقرب منه ، فإن التقلبات الهيكلية تؤثر بشكل متكرر على درجة تعرض Trp لوسائل الإعلام المائية13و14؛ وهكذا، فإن التغيير في القطبية يؤدي إلى إخماد كثافة ترب مضان13،14. وبالتالي ، فإن خاصية الفلورسنت في Trp مفيدة لإجراء دراسات الربط ليغاند للإنزيمات. الظواهر الفيزيائية الأخرى قد تؤدي أيضا إلى ترب مضان إخماد17،18،19،20، على سبيل المثال ، FRET والتغيرات في قطبية المتوسطة. نقل الطاقة من حالة متحمس من Trp إلى الفلوروفور أيضا تطبيقات محتملة، على سبيل المثال، تحديد تقارب ليغاندس الصغيرة في البروتينات21. في الواقع، وقد استخدمت في المقام الأول Trp كمتبرع مضان في دراسات FRET في البروتينات22،23،24، على سبيل المثال ، في تيربيوم (السل3 +) دراسات FRET ، يتم استخدام بقايا TRP في كثير من الأحيان كهوائي لنقل الطاقة إلى السل3 + 25،26،27. TRP يعرض مزايا مختلفة على غيرها من الجهات المانحة FRET نظرا لطبيعة التأسيسية المتأصلة في بنية البروتين، مما يلغي الحاجة إلى العمليات التحضيرية التي قد تؤثر على وظيفة / هيكل البروتيندرس 24. وهكذا، فإن تحديد التسوس الإشعاعي (نقل الطاقة والتغيرات في قطبية المتوسطة التي تسببها إعادة ترتيب البروتين الهيكلية) مهم لاستخلاص استنتاجات دقيقة بشأن الربط ليغاند في الدراسات الهيكلية البروتين13،14،19،28.
في الدراسات الهيكلية البروتين, وقد استخدمت في المقام الأول الفلوروفوري extrinsic, وهي, 8-anilino-1-النفثالين السلفونات (ANS), في التجارب المتعلقة طي البروتين / تتكشف28,29. ANS يربط إلى البروتينات / الانزيمات في الدولة الأصلية, عادة في مواقع ملزمة من الركائز31,32,33; زيادة في ANS مضان الكم العائد (ΦF) (أي زيادة في كثافة مضان) هو الناجم عن إثارة البروتين في λ= 370 نانومتر عندما التفاعلات المناسبة من ANS مع آرغ ومخلفات له في جيوب مسعور تحدث34,35,36,37. في دراسات مختلفة، تم الإبلاغ عن حدوث FRET (عندما تكون مثيرة في λ داخل 280-295 نانومتر) بين بقايا Trp (الجهات المانحة) و ANS (المقبول)، والذي يستند إلى ما يلي: 1) تداخل طيف الانبعاثات الفلورية من Trp وطيف الإثارة من ANS، 2) تحديد مسافة مناسبة بين واحد أو أكثر من بقايا TRP (ق) و ANS لنقل الطاقة، 3) عالية ANS الكم العائد عند ربط في جيوب البروتين، و 4) نمط FRET مميزة في أطياف مضان البروتين في وجود ANS3،17،27،37،38.
مؤخرا، تم التحقيق في الربط ليغاند إلى المجال الربط النيوكليوتيدات (N-المجال) في SERCA وغيرها من ATPases P-نوع باستخدام المهندسة المؤتلف N-المجالات40،41،42،43،44،45،46. وقد استخدمت الهندسة الجزيئية للمجال N SERCA لنقل بقايا Trp الوحيد (Trp552Leu) إلى بنية أكثر ديناميكية (Tyr587Trp) التي هي قريبة من موقع الربط النيوكليوتيدات، حيث يمكن استخدام الاختلافات الفلورية (إخماد) لرصد التغيرات الهيكلية على الربط ليغاند34. وقد أظهرت النتائج التجريبية أن ANS يربط (كما ATP) إلى موقع الربط النيوكليوتيدات في المنقى المؤتلف SERCA N-المجال34. ومن المثير للاهتمام، وفلورسينس ANS يزيد على ملزمة للمجال N عند الإثارة في λ من 295 نانومتر، في حين أن الفلورسينس الجوهرية للمجال N يقلل34،وبالتالي إنتاج نمط FRET التي تشير إلى تشكيل زوج Trp-ANS FRET.
وقد اقترح استخدام الاستراتيجيات وخطط العمل الوطنية لتحديد محتوى مخلفات الطورب في البروتينات47 عن طريق فحص امتصاص البروتينات المعدلة. NBS يعدل مجموعة النعال امتصاص للغاية من Trp إلى أقل امتصاصoxindole47,48. وهذا يؤدي إلى فقدان (إخماد) من الخصائص الفلورسنت Trp40. ومن ثم، يمكن استخدام التعديل الكيميائي بوساطة NBS لمخلفات Trp كقايس لتحديد دور Trp (كمتبرع) عندما يفترض FRET.
يصف هذا البروتوكول التعديل الكيميائي لبقايا Trp الوحيدة من قبل NBS في المجال N المؤتلف المهندس من SERCA كنموذج بروتين. النتائج التجريبية تثبت أن كثافة مضان ANS لا تزال تزيد في NBS المعدلة كيميائيا N-المجال34, التي تفتقر إلى الفلورية الجوهرية. ولذلك ، فإن المقايسة مفيدة لإظهار عدم وجود FRET بين بقايا Trp و ANS عند ربطها بالمجال N34و40و49. وبالتالي، فإن هذا المقايسة (NBS التعديل الكيميائي من Trp) مفيد في إثبات وجود زوج Trp-ANS FRET في البروتينات.
Protocol
1. تحديد(في silico)من ANS وSERCA N-المجال التفاعل
- توليد ثلاثي الأبعاد (3D) هيكل البروتين (SERCA N-المجال) عن طريق النمذجة الجزيئية باستخدام البروتين المفضل النمذجة البرمجيات50.
- تحديد بقايا الأحماض الأمينية التي تشكل موقع الربط النيوكليوتيدات باستخدام برنامج التركيب الجزيئي المفضل51، وتحديد وجود بقايا آرغ و ليس35؛ هذه مطلوبة لربط ANS وزيادة كثافة الفلورسينس (العائد الكمي).
- إجراء الالتحام الجزيئي (باستخدام برنامج الالتحام المفضل)52،53،54 لتحديد تفاعلات ATP ، الفلورسين ايزوثيوسيانات (FITC) (الذي يشكل رابطة التكافؤ مع Lys515 وضع العلامات على موقع ربط النيوكليوتيدات) ، و ANS مع بقايا الأحماض الأمينية في موقع الربط النيوكليوتيدات(الشكل 1).
- حساب المسافة الجزيئية (Å) بين بقايا Trp و ANS ملزمة باستخدام أداة القياس في البرنامج المفضل.
- أداء محاكاة الديناميات الجزيئية لمجمع ANS-N-domain لتحديد استقرار التفاعل52،54. ثم، إجراء التجارب في المختبر عندما تم تأكيد استقرار المجمع.
2. التعبير وتنقية من المجال N المؤتلف
- توليف الترميز الجيني لN-المجال40.
- تصميم وبناء البلازميد الذي يحتوي على الجين الاصطناعية التي رموزلN-المجال 40.
- التعبير والتنقية عن طريق الكروماتوغرافيا تقارب (ني-NTA)، المهندسة المؤتلف N-المجال. تنفيذ SDS-PAGE من البروتين المنقى لتحديد نقاء (الشكل 2)40.
- تحديد تركيز البروتين من خلال دراسة امتصاص في λ من 280 نانومتر مع معامل انقراض N-المجال (ε = 11,960 M-1·cm-1)40.
3. رصد تشكيل مجمع ANS-N-المجال على أساس ANS وN-المجال التغيرات كثافة الفلورسينس.
- إعداد حل الأسهم ANS في N،N- ثنائي ميثيلفورماميد.
- تزن كمية صغيرة (1-5 ملغ) من ANS، وحله في 1 مل من الحجم النهائي من N،N-dimethylformamide، على سبيل المثال، 3.2 ملغ (10.69 mM التركيز النهائي).
- إعداد محلول مخزون مائي 100 ميكرومتر ANS باستخدام حل ANS في N،N-dimethylformamide ، على سبيل المثال ، أضف 9.4 ميكرولتر من محلول ANS 10.69 mM إلى 990.6 ميكرولتر من 50 mM الفوسفات العازلة مع درجة الحموضة 8.0 للحصول على حجم نهائي قدره 1 مل.
- خلط الحلول عن طريق دوامة 3-5 مرات لمدة 15 ق.
ملاحظة: في التجربة التالية، استخدم حل المخزون المائي ANS فقط. إعداد حديثا حل الأسهم المائية ANS قبل بدء التجارب.
- إعداد NBS الأسهم الحل في N،ن- ثنائي ميثيلفورماميد.
- تزن كمية صغيرة (1-5 ملغ) من NBS, ويذوب في 1 مل من N,N-dimethylformamide, على سبيل المثال, 5.3 ملغ في 1 مل (29.78 mM التركيز النهائي).
- إعداد 1 mM NBS محلول الأسهم المائية باستخدام حل NBS في N,N-dimethylformamide, على سبيل المثال, إضافة 3.36 ميكرولتر من 29.78 م م حل NBS إلى 96.64 ميكرولتر من 50 متر فوسفات العازلة مع درجة الحموضة 8.0 للحصول على حجم نهائي 0.1 مل.
- خلط الحلول عن طريق دوامة 3-5 مرات لمدة 15 ق.
ملاحظة: إعداد حل المخزون المائي NBS قبل بدء التجارب.
- يتجدد المجال N مع ANS، وتسجيل أطياف الفلورسينس عن طريق الإثارة في λ= 295 نانومتر عند 25 درجة مئوية.
- الحصول على خط الأساس الطيف الفلوري.
- ضع 1 مل من 50 متر فوسفات عازل مع pH 8.0 في 1 مل من الكوارتز الفلوري cuvette.
- ضع الخلية في غرفة الخلية الحرارية (25 درجة مئوية) من مقياس الطيف وحدد الإثارة إلى 295 نانومتر.
- سجل الطيف الفلوري (305 - 550 نانومتر).
ملاحظة: يتم طرح الطيف الفلوري لحاجز الفوسفات 50 mM مع الرقم القياسي 8.0، والذي يعمل كعينة فارغة، من جميع أطياف الفلورسينس التي تم الحصول عليها.
- الحصول على الطيف الفلوري الجوهري للمجال N.
- ضع 900 ميكرولتر من 50 متر فوسفات عازلة مع درجة الحموضة 8.0 في كوفيت كوارتز مضان.
- إضافة 100 ميكرولتر من N-المجال (10 ميكرومتر) تعليق للحصول على تركيز نهائي 1 ميكرومتر N-المجال في حجم نهائي 1 مل.
- تجانس بلطف باستخدام micropipette 20 مرات لضمان تجانس الحل.
ملاحظة: يجب تنقية البروتين حديثا للحصول على أطياف مضان جوهرية عالية الجودة ، على سبيل المثال ، لا يمكن استخدام نطاق N المؤتلف المنقى إلا لمدة أسبوع بعد تنقيته. - ضع الخلية في غرفة الخلية الحرارية (25 درجة مئوية) من مقياس الطيف وحدد الإثارة إلى 295 نانومتر.
- سجل الطيف الفلوري الجوهري من N-domain (305-550 نانومتر).
- إضافة ANS، والحصول على الطيف مضان عن طريق الإثارة في λ = 295 نانومتر.
- إضافة 2 ميكرولتر aliquot من 100 ميكرومتر ANS محلول الأسهم المائية إلى تعليق N-المجال (1 ميكرومتر) للحصول على تركيز نهائي 0.2 ميكرومتر ANS.
- تجانس بلطف باستخدام micropipette 20 مرات لضمان تجانس الحل.
- ضع الخلية في غرفة الخلية المستقرة بالحرارة (25 درجة مئوية) من مقياس الطيف وحدد الإثارة λ إلى 295 نانومتر.
- سجل الطيف الفلوري (305-550 نانومتر).
- كرر إضافات ANS وأطياف الفلورسينس تسجيل فوق 1:1 علاقة الضرس ANS:N-المجال.
- طرح الطيف الفارغ من كل طيف باستخدام برامج مناسبة.
- رسم جميع الأطياف في رسم بياني واحد.
- تحديد ما إذا كانت الأطياف تشكل نمطا شبيها ب FRET. تشكل أطياف الفلورسينس ANS-N-domain نمطا شبيها ب FRET(الشكل 3A).
- الحصول على خط الأساس الطيف الفلوري.
4. N-المجال الجوهرية الفلورسينس المعايرة عن طريق TRP التعديل الكيميائي مع NBS.
- كرر الخطوتين 3.3.1 و3.3.2.
- إضافة 1 ميكرولتر aliquot من 1 mM NBS محلول الأسهم المائية إلى تعليق N-المجال (1 ميكرومتر) للحصول على تركيز نهائي من 1 μM NBS.
- تجانس بلطف باستخدام micropipette 20 مرات لضمان تجانس الحل.
- ضع الخلية في غرفة الخلية المستقرة بالحرارة (25 درجة مئوية) من مقياس الطيف وحدد الإثارة λ إلى 295 نانومتر.
- سجل الطيف الفلوري (305-550 نانومتر)(الشكل 3B).
- كرر إضافة NBS وتسجيل أطياف الفلورسينس حتى يتم ملاحظة الحد الأدنى من إخماد الفلورية الجوهرية N-domain40. في المجال N، يحدث هذا عادة بنسبة ضرس من 5-6 NBS/N-المجال40.
ملاحظة: NBS يطفئ بسرعة (<5 s) الفلورسينس الجوهري للمجال N; لوحظ انخفاض في كثافة الفلورسينس. المضي قدما على الفور إلى الخطوة التالية، كما قد NBS أيضا تتفاعل مع غيرها من بقايا الأحماض الأمينية47. - طرح الطيف الفارغ من كل طيف باستخدام برامج مناسبة.
- رسم جميع الأطياف في رسم بياني واحد (الشكل 3B).
5. ي titrate NBS المعدلة ن المجال مع ANS عن طريق تسجيل أطياف مضان في 25 درجة مئوية.
- تنفيذ الخطوة 3.3.3 باستخدام NBS تعديل N-المجال الذي تم إنشاؤه في الخطوة 4.
- طرح الطيف الفارغ من كل طيف باستخدام برامج مناسبة.
- رسم جميع الأطياف في رسم بياني واحد (الشكل 3C).
- تدعم أطياف الفلورسينس المتولدة(الشكل 3C)أو تدحض حدوث FRET ، أي عندما يحدث FRET ، لا تزيد فلورة ANS والعكس بالعكس.
6. دليل على ANS ملزمة إلى N-المجال المعدل كيميائيا عن طريق الإثارة في λ= 370 نانومتر.
- تنفيذ الخطوة 3.3.3 باستخدام NBS تعديل N-المجال الذي تم إنشاؤه في الخطوة 4 ولكن تغيير λ الإثارة إلى 370 نانومتر.
- طرح الطيف الفارغ من كل طيف باستخدام برامج مناسبة.
- رسم جميع الأطياف في رسم بياني واحد (الشكل 3D).
- تأكيد ربط ANS للمجال N من خلال ملاحظة الزيادة في كثافة مضان ANS. ANS ملزمة للمجال N يظهر زيادة مضان عندما متحمس في λ = 370 نانومتر (الشكل 3D). كتحكم، تم الحصول على الطيف الفلوري من ANS (وحدها) في 50 متر فوسفات عازلة مع الرقم الحموضة 8.0 مثيرة في λ من 295 و 370 نانومتر (الشكل 4، لا يظهر في الفيديو).
ملاحظة: علاقة stoichiometric من NBS:Trp المطلوب للتعديل الكيميائي يعتمد على درجة دفن بقايا (ق) TRP في البروتين تحتالدراسة 46،47،55،56. لذلك، فمن المستحسن لتحديد نسبة الضرس NBS:protein/(Trp) مسبقا.
النتائج
يظهر الالتحام الجزيئي ربط ANS بموقع الربط بالنيوكليوتيدات في المجال N عبر التفاعلات الكهروستاتيكية وكذلك التفاعلات الكارهة للماء(الشكل 1). المسافة الجزيئية (20 Å) بين بقايا Trp و ANS (ملزمة بموقع الربط النيوكليوتيدات) يدعم حدوث FRET (الشكل 1). تم الحصول على تصميم (هندسي) المؤتلف N-المجال في نقاء عالية من قبل الكروماتوغرافيا تقارب (الشكل 2) وكان مناسبا للتجارب مضان. عرض أطياف مضان من مجمع ANS-N-المجال نمط مثل FRET عند الإثارة في λ = 295 نانومتر(الشكل 3A). التعديل الكيميائي لبقايا TRP من قبل NBS أدى إلى إخماد الفلورسينس الجوهرية للمجال N(الشكل 3B). في N-المجال N المعدل كيميائيا NBS, النتائج التجريبية تثبت أن ANS الفلورية زادت عند الإثارة في λ= 295 نانومتر (الشكل 3C), مماثلة لتلك التي لوحظت في غير المعدلة N-المجال (الشكل 3A). لذلك، الإثارة المباشرة من ANS في λ = 295 نانومتر يوفر معظم الطاقة لفلورسينس ANS(الشكل 3C)،كما اقترح سابقا28. ويتضح ربط ANS إلى N-المجال المعدل كيميائيا من خلال زيادة في مضان عندما متحمس في λ = 370 نانومتر(الشكل 3D). لذلك، لا يحدث FRET بين بقايا Trp و ANS التي ترتبط بموقع الربط النيوكليوتيدات.
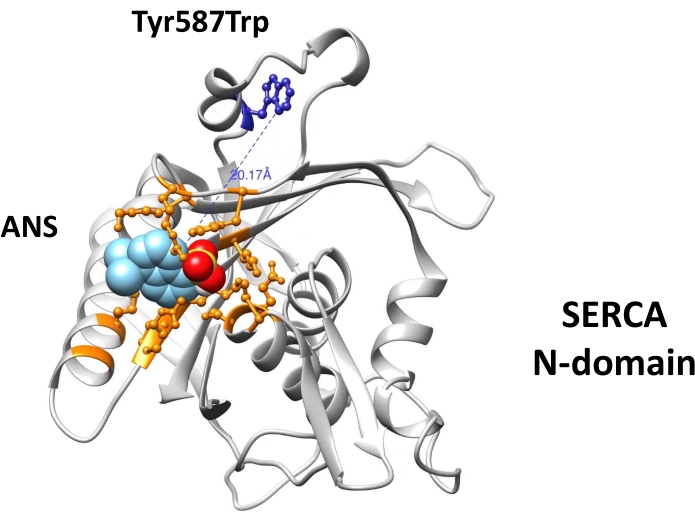
الشكل 1: الالتحام الجزيئي لل ANS إلى موقع الربط النيوكليوتيدات من Ca2 +- ATPase N-domain. تم تنفيذ الالتحام الجزيئي ANS باستخدام برنامج AutoDock Vina (http://vina.scripps.edu/) ونموذج ثلاثي الأبعاد تم إنشاؤه من N-domain40. يحتوي المجال N المهندس على طفرات Trp552Leu و Tyr587Trp (موضحة باللون الأزرق). يتم تمثيل بقايا الأحماض الأمينية التي تشكل موقع ربط النيوكليوتيدات ككرات وعصي ويتم تسليط الضوء عليها باللون البرتقالي. وقد تم تعديل هذا الرقم بإذن من سبرينغر الطبيعة : سبرينغر ، مجلة فلورسينس. حقوق الطبع والنشر (2020)34. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
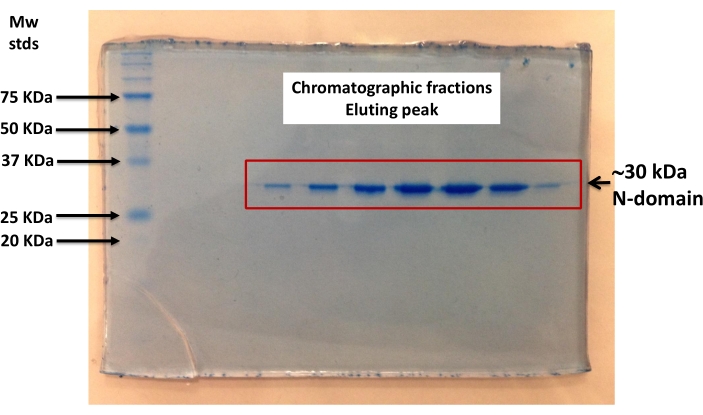
الشكل 2: SDS-PAGE من هندسة المؤتلف Ca2 +- ATPase N-المجال. تعرض المجال N لتنقية التقارب باستخدام عمود كروماتوغرافي. تعرضت الكسور التي تتوافق مع الامتصاص (عند λ= 280 نانومتر) إلى قمم SDS−PAGE وتصورها تلطيخ Coomassie الأزرق. و ~ 30 kDa له الموسومة ن المجال يتم تشكيلها من قبل 27 kDa من N - المجال Ca2 +- ATPase و 3 kDa من بولي له العلامة. تم تحديد نقاء نطاق Ca2 +- ATPase N - ليكون ≥95٪ حسب قياس الكثافة باستخدام برنامج ImageJ (https://imagej.nih.gov/ij/download.html). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
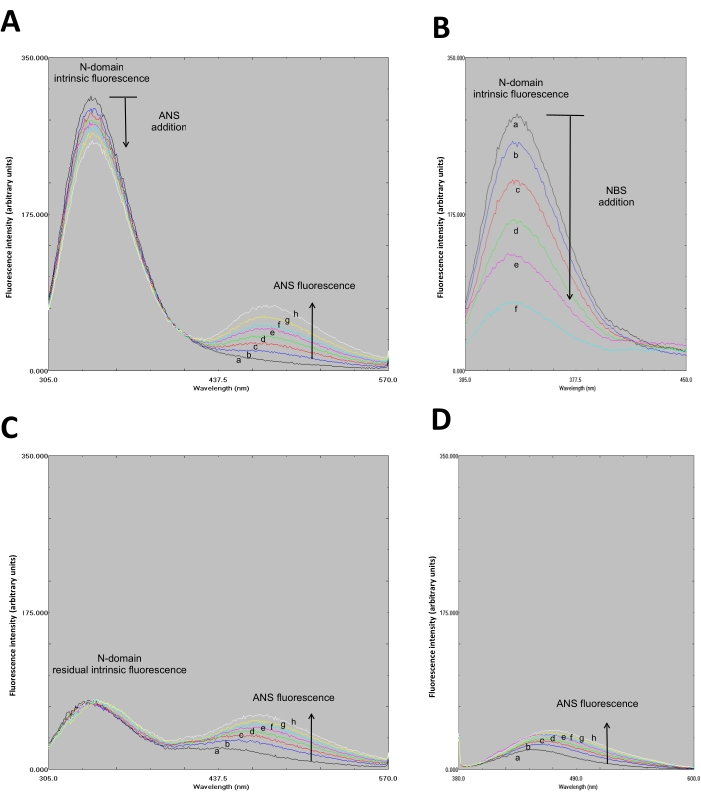
الشكل 3: تعديل المواد الكيميائية NBS بوساطة من بقايا Trp في مجال N يدحض FRET بين Trp و ANS التي لا بد أن موقع الربط النيوكليوتيدات. A. نمط FRET من مجمع ANS-N-المجال عند الإثارة في λ= 295 نانومتر. وأضيفت ال ANS (التركيز النهائي في ميكرومتر: أطياف a، 0؛ b، 0.2؛ c، 0.4؛ d، 0.6؛ e، 0.8؛ f، 1.0؛ g، 1.2؛ و h، 1.4) إلى نطاق N المعلق (1 ميكرومتر). باء - ال 20 في المائ يتوسط إخماد المجال N من قبل NBS (تركيز NBS في μM: a, 0; b, 1; c, 2; d, 3; e, 4; و, 6). لوحظ تفلور جوهري من نطاق N عند الإثارة عند λ= 295 نانومتر. جيم - الدوائر التي لا يمكن أن أطياف مفلورة من ANS التي لا بد أن N-المجال المعدل كيميائيا عند الإثارة في λ= 295 نانومتر. الشروط التجريبية كما في A. تم تعديل الأرقام A و B و C بإذن من سبرينغر نيتشر: سبرينغر، مجلة فلورسينس. حقوق الطبع والنشر (2020)34. د- أطياف مفلورة من ANS التي لا بد أن N-المجال المعدل كيميائيا عند الإثارة في λ = 370 نانومتر. تم تعليق المجال N في 1 مل من 50 متر فوسفات عازلة (pH 8.0) وaliquots من NBS، وأضيفت ANS وفقا لذلك، كما هو موضح في A (ANS) و B (NBS). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
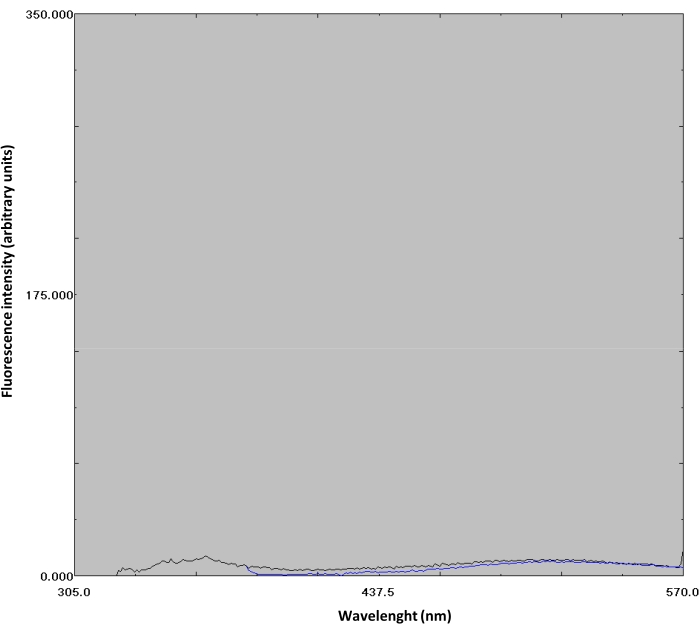
الشكل 4: أطياف مضان ANS. ANS (1.4 ميكرومتر) في 50 متر فوسفات عازلة مع درجة الحموضة 8.0 كان متحمسا في λ من 295 و 370 نانومتر; يتم عرض الأطياف باللونين الأسود والأزرق، على التوالي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
عرض أطياف مضان من مجمع ANS-N-المجال نمط مثل FRET عندما متحمس في λ من 295 نانومتر, في حين أن المسافة الجزيئية (20 Å) بين بقايا Trp و ANS يبدو لدعم حدوث FRET (الشكل 1). TRP التعديل الكيميائي من قبل النتائج NBS في أقل الفلورسنت N-المجال (الشكل 3B, الطيف و); وبالتالي، نقل الطاقة غير ممكن. وأطياف الفلورسينس ANS مماثلة لتلك التي من N-المجال غير المعدلة عندما متحمس في λ من 295 نانومتر (الشكل 3A و C).
لذلك، الإثارة المباشرة من ANS في λ من 295 نانومتر هو المصدر الرئيسي للفلورسينس ANS عندما يكون ملزما لموقع الربط ATP (الشكل 3C)، وهو ما يتفق مع الآلية التي اقترحها المؤلفون الآخرون28. لذلك، FRET من بقايا Trp إلى ANS منضم لا يحدث في مجمع N-المجال-ANS. ومع ذلك، فإن التعديل الكيميائي بوساطة NBS لمخلفات Trp في البروتينات الأخرى يدعم FRET بين Trp و ANS، على سبيل المثال، في إنزيمات xylose reductase من Neurospora crassa49، α subunit من F1-ATPase من الميتوكوندريا الخميرة58، والليسينالحراري 59.
ومن شأن الفحص أداء جيدا في البروتينات / الانزيمات مع جيوب الكارهة للماء (مواقع ملزمة) التي تحتوي على بقايا له وArge، وهذه تسهم في استقرار التفاعل ANS. بالإضافة إلى ذلك، يجب أن تحتوي هذه البروتينات بشكل مثالي على بقايا Trp الوحيدة الموجودة على سطح البروتين، وهي يمكن الوصول إليها للرد السريع مع NBS40،41،49.
بدلا من ذلك، لتحليل الزوج Trp-ANS FRET في البروتينات، يمكن استخدام التعديل الكيميائي لمخلفاته عن طريق الأسيتيل والتسجيل لعرقلة تفاعل ANS في موقع ربط البروتين / الإنزيم60. حذف بقايا TRP عن طريق الطفرة هو استراتيجية أخرى لتحليل FRET. ومع ذلك، قد يستغرق ذلك وقتا طويلا، وقد تظهر الإنشاءات اختلافات هيكلية، مما يؤثر على الربط الرابط61. وبالمثل، قد تولد طفرة آرغ ومخلفاته في موقع الربط ليغاند تغييرات هيكلية غير متوقعة، مما يجعل البروتين المتحول غير مناسب للتجارب62.
وفيما يتعلق ببقايا الطورب، فإن أداء المقايسة التعديلية الكيميائية NBS سيكون محدودا في الحالات التالية: 1) إذا دفنت بقايا الطورب بعمق في قلب بروتين مطوي ومدمج بشكل جيد؛ (2) إذا تم دفن بقايا الطورب بعمق في قلب بروتين مطوي ومدمج بشكل جيد؛ (2) إذا كان من الممكن أن يكون الترسبات الكيميائية في الترسبات الكيميائية في الرواسب الكيميائية في الطورب( 20000- 2001) محدودا في الحالات التالية: 1) إذا كانت بقايا الطورب مدفونة بعمق في قلب بروتين مطوي ومدمج بشكل جيد؛ (2) إذا كان من الممكن أن يكون الترسبات في الرواسب الكيميائية من نوع TRP. منذ NBS moiety لن تكون قادرة على الوصول إلى بقايا TRP بسبب عدم وجود تجاويف كبيرة41،48،63، 2) إذا كان موجودا بقايا TRP في هياكل غشاء جزءا لا يتجزأ (transmemb 22- α الحلزون)، حيث أن الطابع المائي ل NBS سيمنعها من دخول الوسط الكاره للماء32و56و64و3) إذا كان هيكل البروتين يحتوي على بقايا متعددة من التررب؛ كما قد تكون الاختلافات في إمكانية الوصول والبيئة الفيزيائية الكيميائية كبيرة، مما يجعل من الصعب تعيين تغيير إشارة مضان إلى بقايا Trp32،41،56، 4) إذا كان ANS ملزمة للبروتينات ويرجع ذلك أساسا إلى التفاعل الكاره للماء، كما أن زيادة الفلورسينس ANS يرجع أساسا إلى التفاعلات الكهربائيةالساكنة 32،65،66،67،و ه) إذا كان لا يطرأ أي تفاعلات ثابتة يروي من TRP يحدث، على سبيل المثال، في وجود الأكسجين68.
NBS بوساطة التعديل الكيميائي لمخلفات Trp يبدو أن الفحص السريع والسهل لدراسة FRET بين TRP و ANS التي لا بد أن البروتينات / الانزيمات. ويمكن استخدام الكواشف الأخرى Trp تعديل بدلا من NBS، على سبيل المثال، هيدروكسي-5-نيتربنزيل بروميد (HNB)69،70. وأخيرا، قد ينطبق المقايسة على الكشف عن أزواج FRET المقترحة من Trp مع فلوروبهورسأخرى 21.
Disclosures
ويعلن أصحاب البلاغ أنه ليس لديهم مصالح مالية متنافسة.
Acknowledgements
تم تمويل هذا العمل جزئيا من قبل FAI-UASLP رقم المنحة C19-FAI-05-89.89 ورقم منحة كوناسيت 316463 (أبويوس أ لا سينسيا دي فرونتيرا: Fortalecimiento y Mantenimiento de Infraestructuras de Investigación de Uso Común y Capacitación Técnica 2021). يشكر المؤلفون المساعدة التقنية التي يقدمها جوليان ماتا موراليس في طبعة الفيديو.
Materials
| Name | Company | Catalog Number | Comments |
| Acrylamide | Bio-Rad | 1610107 | SDS-PAGE |
| Ammonium persulfate | Bio-Rad | 1610700 | SDS-PAGE |
| 8-Anilino-1-naphthalenesulfonic acid | Sigma-Aldrich | A1028 | Fluorophore |
| Bis-acrylamide | Bio-Rad | 1610125 | SDS-PAGE |
| N-Bromosuccinimide | Sigma-Aldrich | B81255 | Chemical modification |
| N,N-dimethylformamide | J.T. Baker | 9213-12 | Stock solution preparation |
| Fluorescein isothiocyanate | Sigma-Aldrich | F7250 | Chemical fluorescence label |
| Fluorescence cuvette | Hellma | Z801291 | Fluorescence assay |
| Fluorescence Spectrofluorometer | Shimadzu | RF 5301PC | Fluorescence assay |
| HisTrap™ FF | GE Healtcare | 11-0004-59 | Protein purification |
| IPTG, Dioxane free | American Bionalytical | AB00841-00010 | Protein expression |
| Imidazole | Sigma-Aldrich | I5513-25G | Protein purification |
| LB media | Fisher Scientific | 10000713 | Cell culture |
| Pipetman L P10L | Gilson | FA10002M | Fluorescence assay |
| Pipetman L P100L | Gilson | FA10004M | Fluorescence assay |
| Pipetman L P200L | Gilson | FA10005M | Fluorescence assay |
| Pipetman L P1000L | Gilson | FA10006M | Fluorescence assay |
| Pipetman L P5000L | Gilson | FA10007 | Fluorescence assay |
| Precision plus std | Bio-Rad | 1610374 | SDS-PAGE |
| Sodium dodecyl sulphate | Bio-Rad | 1610302 | SDS-PAGE |
| Sodium phosphate dibasic | J.T. Baker | 3828-19 | Buffer preparation |
| Sodium phosphate monobasic | J.T. Baker | 3818-01 | Buffer preparation |
| Syringe filter 0.2 um | Millipore | GVWP04700 | Solution filtration |
| Temed | Bio-Rad | 1610801 | SDS-PAGE |
| Tris | Bio-Rad | 1610719 | SDS-PAGE |
References
- Munishkina, L. A., Fink, A. L. Fluorescence as a method to reveal structures and membrane-interactions of amyloidogenic proteins. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1768 (8), 1862-1885 (2007).
- Dong, X., Thomas, D. D. Time-resolved FRET reveals the structural mechanism of SERCA-PLB regulation. Biochemical and Biophysical Research Communications. 449 (2), 196-201 (2014).
- Szilvay, G. R., Blenner, M. A., Shur, O., Cropek, D. M., Banta, S. A FRET-based method for probing the conformational behavior of an intrinsically disordered repeat domain from Bordetella pertussis adenylate cyclase. Biochemistry. 48 (47), 11273-11282 (2009).
- Sun, Y., Wallrabe, H., Booker, C. F., Day, R. N., Periasamy, A. Three-color spectral FRET microscopy localizes three interacting proteins in living cells. Biophysical Journal. 99 (4), 1274-1283 (2010).
- Cornea, R. L., et al. High-throughput FRET assay yields allosteric SERCA activators. Journal of Biomolecular Screening. 18 (1), 97-107 (2013).
- Gruber, S. J., et al. Discovery of enzyme modulators via high-throughput time-resolved FRET in living cells. Journal of Biomolecular Screening. 19 (2), 215-222 (2014).
- Dyla, M., et al. Dynamics of P-type ATPase transport revealed by single-molecule FRET. Nature. 551 (7680), 346-351 (2017).
- Corradi, G. R., Adamo, H. P. Intramolecular fluorescence resonance energy transfer between fused autofluorescent proteins reveals rearrangements of the N- and C-terminal segments of the plasma membrane Ca2+ pump involved in the activation. The Journal of Biological Chemistry. 282 (49), 35440-35448 (2007).
- Piston, D. W., Kremers, G. -. J. Fluorescent protein FRET: The good, the bad and the ugly. Trends in Biochemical Sciences. 32 (9), 407-414 (2007).
- Ma, L., Yang, F., Zheng, J. Application of fluorescence resonance energy transfer in protein studies. Journal of Molecular Structure. 1077, 87-100 (2014).
- Chen, Y., Barkley, M. D. Toward understanding tryptophan fluorescence in proteins. Biochemistry. 37 (28), 9976-9982 (1998).
- Zelent, B., et al. Tryptophan fluorescence yields and lifetimes as a probe of conformational changes in human glucokinase. Journal of Fluorescence. 27 (5), 1621-1631 (2017).
- Callis, P. R. Binding phenomena and fluorescence quenching. I: Descriptive quantum principles of fluorescence quenching using a supermolecule approach. Journal of Molecular Structure. 1077, 14-21 (2014).
- Callis, P. R. Binding phenomena and fluorescence quenching. II: Photophysics of aromatic residues and dependence of fluorescence spectra on protein conformation. Journal of Molecular Structure. 1077, 22-29 (2014).
- Agarwal, P. K., Geist, A., Gorin, A. Protein dynamics and enzymatic catalysis: Investigating the peptidyl-prolyl cis-trans isomerization activity of cyclophilin A. Biochemistry. 43 (33), 10605-10618 (2004).
- Deng, H., Zhadin, N., Callender, R. Dynamics of protein ligand binding on multiple time scales: NADH binding to lactate dehydrogenase. Biochemistry. 40 (13), 3767-3773 (2001).
- van de Weert, M. Fluorescence quenching to study protein-ligand binding: common errors. Journal of fluorescence. 20 (2), 625-629 (2010).
- van de Weert, M., Stella, L. Fluorescence quenching and ligand binding: A critical discussion of a popular methodology. Journal of Molecular Structure. 998 (1-3), 144-150 (2011).
- Stella, L., van de Weert, M., Burrows, H. D., Fausto, R. Fluorescence spectroscopy and binding: Getting it right. Journal of Molecular Structure. 1077, 1-3 (2014).
- Credi, A., Prodi, L. Inner filter effects and other traps in quantitative spectrofluorimetric measurements: Origins and methods of correction. Journal of Molecular Structure. 1077, 30-39 (2014).
- Lee, M. M., Peterson, B. R. Quantification of small molecule-protein interactions using FRET between tryptophan and the pacific blue fluorophore. ACS Omega. 1 (6), 1266-1276 (2016).
- Zhang, Y., et al. Comparison of FÖrster-resonance-energy-transfer acceptors for tryptophan and tyrosine residues in native proteins as donors. Journal of Fluorescence. 23 (1), 147-157 (2013).
- Xie, Y., Maxson, T., Tor, Y. Fluorescent ribonucleoside as a FRET acceptor for tryptophan in native proteins. Journal of the American Chemical Society. 132 (34), 11896-11897 (2010).
- Ghisaidoobe, A. B. T. T., Chung, S. J. Intrinsic tryptophan fluorescence in the detection and analysis of proteins: A focus on Förster resonance energy transfer techniques. International Journal of Molecular Sciences. 15 (12), 22518-22538 (2014).
- Goryashchenko, A. S., et al. Genetically encoded FRET-sensor based on terbium chelate and red fluorescent protein for detection of caspase-3 activity. International Journal of Molecular Sciences. 16 (7), 16642-16654 (2015).
- Arslanbaeva, L. R., et al. Induction-resonance energy transfer between the terbium-binding peptide and the red fluorescent proteins DsRed2 and TagRFP. Biophysics. 56 (3), 381-386 (2011).
- Di Gennaro, A. K., Gurevich, L., Skovsen, E., Overgaard, M. T., Fojan, P. Study of the tryptophan-terbium FRET pair coupled to silver nanoprisms for biosensing applications. Physical Chemistry Chemical Physics. 15 (22), 8838-8844 (2013).
- Hawe, A., Poole, R., Jiskoot, W. Misconceptions over Förster resonance energy transfer between proteins and ANS/bis-ANS: Direct excitation dominates dye fluorescence. Analytical Biochemistry. 401 (1), 99-106 (2010).
- Ghosh, U., Das, M., Dasgupta, D. Association of fluorescent probes 1-anilinonaphthalene-8-sulfonate and 4,4´-dianilino-1,1´-binaphthyl-5,5´-disulfonic acid with T7 RNA polymerase. Biopolymers. 72 (4), 249-255 (2003).
- Vreuls, C., et al. Guanidinium chloride denaturation of the dimeric Bacillus licheniformis BlaI repressor highlights an independent domain unfolding pathway. The Biochemical Journal. 384, 179-190 (2004).
- Möller, M., Denicola, A. Study of protein-ligand binding by fluorescence. Biochemistry and Molecular Biology Education. 30 (5), 309-312 (2002).
- Chang, L., Wen, E., Hung, J., Chang, C. Energy transfer from tryptophan residues of proteins to 8-anilinonaphthalene-1-sulfonate. Journal of Protein Chemistry. 13 (7), 635-640 (1994).
- Togashi, D. M., Ryder, A. G. A fluorescence analysis of ANS bound to bovine serum albumin: Binding properties revisited by using energy transfer. Journal of Fluorescence. 18 (2), 519-526 (2008).
- Dela Cruz-Torres, V., Cataño, Y., Olivo-Rodríguez, M., Sampedro, J. G. ANS interacts with the Ca2+-ATPase nucleotide binding site. Journal of Fluorescence. 30 (3), 483-496 (2020).
- Gasymov, O. K., Glasgow, B. J. ANS fluorescence: Potential to augment the identification of the external binding sites of proteins. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1774 (3), 403-411 (2007).
- Matulis, D., Lovrien, R. 1-anilino-8-naphthalene sulfonate anion-protein binding depends primarily on ion pair formation. Biophysical Journal. 74 (1), 422-429 (1998).
- Samukange, V., Yasukawa, K., Inouye, K. Interaction of 8-anilinonaphthalene 1-sulphonate (ANS) and human matrix metalloproteinase 7 (MMP-7) as examined by MMP-7 activity and ANS fluorescence. Journal of Biochemistry. 151 (5), 533-540 (2012).
- Qin, J., et al. Selective and sensitive homogenous assay of serum albumin with 1-anilinonaphthalene-8-sulphonate as a biosensor. Analytica Chimica Acta. 829, 60-67 (2014).
- Malik, A., Kundu, J., Karmakar, S., Lai, S., Chowdhury, P. K. Interaction of ANS with human serum albumin under confinement: Important insights and relevance. Journal of Luminescence. 167, 316-326 (2015).
- Páez-Pérez, E. D., De La Cruz-Torres, V., Sampedro, J. G. Nucleotide binding in an engineered recombinant Ca2+-ATPase N-domain. Biochemistry. 55 (49), 6751-6765 (2016).
- Sampedro, J. G., Nájera, H., Uribe-Carvajal, S., Ruiz-Granados, Y. G. Mapping the ATP binding site in the plasma membrane H+-ATPase from Kluyveromyces lactis. Journal of fluorescence. 24 (6), 1849-1859 (2014).
- Abu-Abed, M., Millet, O., MacLennan, D. H., Ikura, M. Probing nucleotide-binding effects on backbone dynamics and folding of the nucleotide-binding domain of the sarcoplasmic/endoplasmic-reticulum Ca2+-ATPase. The Biochemical Journal. 379, 235-242 (2004).
- Abu-Abed, M., Mal, T. K., Kainosho, M., MacLennan, D. H., Ikura, M. Characterization of the ATP-binding domain of the sarco(endo)plasmic reticulum Ca2+-ATPase: probing nucleotide binding by multidimensional NMR. Biochemistry. 41 (4), 1156-1164 (2002).
- Sazinsky, M. H., Mandal, A. K., Argüello, J. M., Rosenzweig, A. C. Structure of the ATP binding domain from the Archaeoglobus fulgidus Cu+-ATPase. Journal of Biological Chemistry. 281 (16), 11161-11166 (2006).
- Liu, L., et al. Crystallization and preliminary X-ray studies of the N-domain of the Wilson disease associated protein. Acta Crystallographica Section F: Structural Biology and Crystallization Communications. 65 (6), 621-624 (2009).
- Banci, L., et al. The binding mode of ATP revealed by the solution structure of the N-domain of human ATP7A. Journal of Biological Chemistry. 285 (4), 2537-2544 (2010).
- Spande, T. F., Witkop, B. Determination of the tryptophan content of proteins with N-bromosuccinimide. Methods in Enzymology. 11, 498-506 (1967).
- Spande, T. F., Green, N. M., Witkop, B. The Reactivity toward N-bromosuccinimide of tryptophan in enzymes, zymogens, and inhibited enzymes. Biochemistry. 5 (6), 1926-1933 (1966).
- Rawat, U. B., Rao, M. B. Purification, kinetic characterization and involvement of tryptophan residue at the NADPH binding site of xylose reductase from Neurospora crassa. Biochimica et Biophysica Acta (BBA) - Protein Structure and Molecular Enzymology. 1293 (2), 222-230 (1996).
- Zaki, M. J., Bystroff, C. . Protein Structure Prediction. , (2008).
- Wang, Z., et al. Comprehensive evaluation of ten docking programs on a diverse set of protein-ligand complexes: The prediction accuracy of sampling power and scoring power. Physical Chemistry Chemical Physics. 18 (18), 12964-12975 (2016).
- Pagadala, N. S., Syed, K., Tuszynski, J. Software for molecular docking: A review. Biophysical Reviews. , 91-102 (2017).
- Dolatkhah, Z., Javanshir, S., Sadr, A. S., Hosseini, J., Sardari, S. Synthesis, Molecular Docking, Molecular Dynamics Studies, and Biological Evaluation of 4 H -Chromone-1,2,3,4-tetrahydropyrimidine-5-carboxylate Derivatives as Potential Antileukemic Agents. Journal of Chemical Information and Modeling. 57 (6), 1246-1257 (2017).
- Forli, S., et al. Computational protein-ligand docking and virtual drug screening with the AutoDock suite. Nature Protocols. 11 (5), 905-919 (2016).
- Lindahl, E. R. Molecular dynamics simulations. Molecular Modeling of Proteins. Methods in Molecular Biology. 443, 3-23 (2008).
- Turk, T., Maček, P., Gubenšek, F. The role of tryptophan in structural and functional properties of equinatoxin II. Biochimica et Biophysica Acta (BBA)/Protein Structure and Molecular. 1119 (1), 1-4 (1992).
- Peterman, B. F., Laidler, K. J. Study of reactivity of tryptophan residues in serum albumins and lysozyme by N-bromosuccinamide fluorescence quenching. Archives of Biochemistry and Biophysics. 199 (1), 158-164 (1980).
- Divita, G., Goody, R. S., Gautheron, D. C., Di Pietro, A. Structural mapping of catalytic site with respect to α-subunit and noncatalytic site in yeast mitochondrial F1-ATPase using fluorescence resonance energy transfer. Journal of Biological Chemistry. 268 (18), 13178-13186 (1993).
- Horrocks, W. D., Holmquist, B., Vallee, B. L. Energy transfer between terbium (III) and cobalt (II) in thermolysin: a new class of metal-metal distance probes. Proceedings of the National Academy of Sciences of the United States of America. 72 (12), 4764-4768 (1975).
- Chakraborty, J., Das, N., Halder, U. C. Unfolding diminishes fluorescence resonance energy transfer (FRET) of lysine modified β-lactoglobulin: Relevance towards anti-HIV binding. Journal of Photochemistry and Photobiology B: Biology. 102 (1), 1-10 (2011).
- Sirangelo, I., Malmo, C., Casillo, M., Irace, G. Resolution of Tryptophan-ANS Fluorescence Energy Transfer in Apomyoglobin by Site-directed Mutagenesis. Photochemistry and Photobiology. 76 (4), 381-384 (2007).
- Ribeiro, A. J. M., Tyzack, J. D., Borkakoti, N., Holliday, G. L., Thornton, J. M. A global analysis of function and conservation of catalytic residues in enzymes. Journal of Biological Chemistry. 295 (2), 314-324 (2020).
- Eftink, M. R., Ghiron, C. A. Exposure of tryptophanyl residues in proteins. Quantitative determination by fluorescence quenching studies. Biochemistry. 15 (3), 672-680 (1976).
- Eftink, M. R., Ghiron, C. A. Fluorescence quenching of indole and model micelle systems. The Journal of Physical Chemistry. 80 (5), 486-493 (1976).
- Kinsley, N., Sayed, Y., Mosebi, S., Armstrong, R. N., Dirr, H. W. Characterization of the binding of 8-anilinonaphthalene sulfonate to rat class Mu GST M1-1. Biophysical Chemistry. 137 (2-3), 100-104 (2008).
- Mohsenifar, A., et al. A study of the oxidation-induced conformational and functional changes in neuroserpin. Iranian Biomedical Journal. 11 (1), 41-46 (2007).
- Gonzalez, W. G., Miksovska, J. Application of ANS fluorescent probes to identify hydrophobic sites on the surface of DREAM. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1844 (9), 1472-1480 (2014).
- Eftink, M. R., Ghiron, C. A. Fluorescence quenching studies with proteins. Analytical Biochemistry. 114 (2), 199-227 (1981).
- Poulos, T. L., Price, P. A. The identification of a tryptophan residue essential to the catalytic activity of bovine pancreatic deoxyribonuclease. The Journal of biological chemistry. 246 (12), 4041-4045 (1971).
- Hu, J. -. J., He, P. -. Y., Li, Y. -. M. Chemical modifications of tryptophan residues in peptides and proteins. Journal of Peptide Science An Official Publication of the European Peptide Society. 27 (1), 3286 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved