Method Article
Risposta cardiaca alla stimolazione β-adrenergica determinata dall'analisi del ciclo pressione-volume
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui descriviamo un'analisi del ciclo pressione-volume cardiaco sotto dosi crescenti di isoproterenolo infuso per via endovenosa per determinare la funzione cardiaca intrinseca e la riserva β-adrenergica nei topi. Utilizziamo un approccio a cassa aperta modificato per le misurazioni del ciclo pressione-volume, in cui includiamo la ventilazione con pressione positiva di fine espirazione.
Abstract
La determinazione della funzione cardiaca è una robusta analisi endpoint in modelli animali di malattie cardiovascolari al fine di caratterizzare gli effetti di trattamenti specifici sul cuore. A causa della fattibilità delle manipolazioni genetiche, il topo è diventato il modello animale di mammifero più comune per studiare la funzione cardiaca e cercare nuovi potenziali bersagli terapeutici. Qui descriviamo un protocollo per determinare la funzione cardiaca in vivo utilizzando misurazioni e analisi del ciclo pressione-volume durante le condizioni basali e sotto stimolazione β-adrenergica mediante infusione endovenosa di concentrazioni crescenti di isoproterenolo. Forniamo un protocollo raffinato che include il supporto di ventilazione tenendo conto della pressione positiva di fine espirazione per migliorare gli effetti negativi durante le misurazioni a torace aperto e una potente analgesia (Buprenorfina) per evitare stress miocardico incontrollabile evocato dal dolore durante la procedura. Nel complesso, la descrizione dettagliata della procedura e la discussione sulle possibili insidie consentono un'analisi del ciclo pressione-volume altamente standardizzata e riproducibile, riducendo l'esclusione degli animali dalla coorte sperimentale prevenendo possibili pregiudizi metodologici.
Introduzione
Le malattie cardiovascolari in genere influenzano la funzione cardiaca. Questo numero sottolinea l'importanza di valutare in vivo la funzione cardiaca dettagliata nei modelli di malattie animali. La sperimentazione animale è circondata da una cornice dei tre principi guida rs (3R) (Riduci/ Raffina / Sostituisci). In caso di comprensione di patologie complesse che coinvolgono risposte sistemiche (cioè malattie cardiovascolari) all'attuale livello di sviluppo, l'opzione principale è quella di perfezionare i metodi disponibili. La raffinazione porterà anche a una riduzione del numero di animali richiesto a causa della minore variabilità, il che migliora la potenza dell'analisi e delle conclusioni. Inoltre, la combinazione di misurazioni della contrattilità cardiaca con modelli animali di malattie cardiache comprese quelle indotte dalla stimolazione neuroumorale o dal sovraccarico di pressione come il banding aortico, che imita ad esempio i livelli alterati di catecolamina / β-adrenergici1,2,3,4, fornisce un metodo potente per gli studi pre-clinici. Tenendo conto che il metodo basato su catetere rimane l'approccio più utilizzato per la valutazione approfondita della contrattilità cardiaca5, abbiamo mirato a presentare qui una misurazione raffinata della funzione cardiaca in vivo nei topi mediante misurazioni del ciclo pressione-volume (PVL) durante la stimolazione β-adrenergica basata su precedenti esperienze, inclusa la valutazione di parametri specifici di questo approccio6, 7.
Per determinare i parametri emodinamici cardiaci sono disponibili approcci che includono tecniche di imaging o basate su catetere. Entrambe le opzioni sono accompagnate da vantaggi e svantaggi che devono essere attentamente considerati per la rispettiva domanda scientifica. Gli approcci di imaging includono l'ecocardiografia e la risonanza magnetica (MRI); entrambi sono stati utilizzati con successo nei topi. Le misurazioni ecocardiografiche comportano elevati costi iniziali da una sonda ad alta velocità necessaria per l'alta frequenza cardiaca dei topi; è un approccio non invasivo relativamente semplice, ma è variabile tra gli operatori che idealmente dovrebbero essere esperti nel riconoscere e visualizzare le strutture cardiache. Inoltre, non è possibile eseguire direttamente misurazioni della pressione e i calcoli sono ottenuti dalla combinazione di grandezze dimensionali e misurazioni del flusso. D'altra parte, ha il vantaggio che diverse misurazioni possono essere eseguite sullo stesso animale e la funzione cardiaca può essere monitorata ad esempio durante la progressione della malattia. Per quanto riguarda la misurazione del volume, la risonanza magnetica è la procedura gold standard, ma simile all'ecocardiografia, non sono possibili misurazioni dirette della pressione e si possono ottenere solo parametri dipendenti dal precarico8. Fattori limitanti sono anche la disponibilità, lo sforzo di analisi e i costi operativi. Qui i metodi basati su catetere per misurare la funzione cardiaca sono una buona alternativa che consente inoltre il monitoraggio diretto della pressione intracardiaca e la determinazione di parametri di contrattilità indipendenti dal carico come il lavoro di ictus reclutabile precarico (PRSW)9. Tuttavia, i volumi ventricolari misurati da un catetere di pressione-conduttanza (attraverso la determinazione della conducibilità) sono inferiori a quelli della risonanza magnetica, ma le differenze di gruppo sono mantenute nello stesso intervallo10. Per determinare valori di volume affidabili è necessaria la calibrazione corrispondente, che è un passaggio critico durante le misurazioni PVL. Combina misure ex vivo della conducibilità del sangue in cuvette calibrate in volume (conversione della conduttanza in volume) con l'analisi in vivo per la conduttanza parallela del miocardio durante l'iniezione in bolo della soluzione salina ipertonica11,12. Oltre a ciò, il posizionamento del catetere all'interno del ventricolo e il corretto orientamento degli elettrodi lungo l'asse longitudinale del ventricolo sono fondamentali per la capacità di rilevamento del campo elettrico circostante prodotto da loro. Ancora con le ridotte dimensioni del cuore di topo è possibile evitare artefatti prodotti da cambiamenti nell'orientamento intraventricolare del catetere, anche nei ventricoli dilatati5,10,ma gli artefatti possono evolvere sotto stimolazione β-adrenergica6,13. Oltre ai metodi di conduttanza, lo sviluppo del metodo basato sull'ammissione sembrava evitare le fasi di calibrazione, ma qui i valori di volume sono piuttosto sovrastimati14,15.
Poiché il topo è uno dei modelli pre-clinici più importanti nella ricerca cardiovascolare e la β-riserva adrenergica del cuore è di interesse centrale nella fisiologia e patologia cardiaca, presentiamo qui un protocollo raffinato per determinare la funzione cardiaca in vivo nei topi mediante misurazioni PVL durante la stimolazione β-adrenergica.
Protocollo
Tutti gli esperimenti sugli animali sono stati approvati ed eseguiti secondo i regolamenti del Consiglio regionale di Karlsruhe e dell'Università di Heidelberg (AZ 35-9185.82/A-2/15, AZ 35-9185.82/A-18/15, AZ 35-9185.81/G131/15, AZ 35-9185.81/G121/17) conformi alle linee guida della direttiva 2010/63/UE del Parlamento europeo sulla protezione degli animali utilizzati a fini scientifici. I dati mostrati in questo protocollo sono derivati da topi maschi wild type C57Bl6/N (17 ± 1,4 settimane di età). I topi sono stati mantenuti in condizioni specifiche prive di agenti patogeni presso la struttura per animali (IBF) della Facoltà di Medicina di Heidelberg. I topi sono stati alloggiati in un ciclo luce-buio di 12 ore, con un'umidità relativa tra il 56-60%, un cambio d'aria 15 volte all'ora e una temperatura ambiente di 22 ° C + / - 2 ° C. Erano tenuti in gabbie convenzionali di tipo II o di tipo II a lungo dotate di lettiera per animali e carte veline come arricchimento. Il cibo autoclavato standard e l'acqua autoclavata erano disponibili per consumare ad libitum.
1. Preparazione di strumenti e soluzioni farmacologiche
- Catetere venoso centrale: tagliare il micro tubo (diametro esterno di 0,6 mm) in tubi catetere lunghi ~ 20 cm. Utilizzare una pinza per tirare un'estremità del tubo sulla punta di una cannula calibro 23. Tagliare l'altra estremità del tubo in diagonale per creare una punta affilata che può perforare la vena femorale.
- Tubo endotracheale: per un tubo di intubazione tagliare una cannula di venipuntura di 20 cm di lunghezza per rimuovere l'attacco della siringa.
- Se il tubo di intubazione non si adatta perfettamente alla connessione del ventilatore, avvolgere il parafilm sull'estremità del tubo in cui è collegato il dispositivo di ventilazione. La connessione deve essere stabile e sigillata dall'ispessimento (Figura 1A). Accorciare il perno di guida in metallo della cannula venipuntura-20 gauge a 2,7 cm e usarlo come ausilio per l'intubazione. Anche gli approcci raffinati per l'intubazione, comprese le fibre leggere per facilitare la visualizzazione della trachea, sono ben descritti, ad esempio da Das e collaboratori16.
- Miscela anestetica utilizzata per l'intubazione: miscelare 200 μL di eparina (1000 UI/mL) con 50 μL di NaCl allo 0,9% e 750 μL di etomidato da 2 mg/mL di etomidato da un prodotto a base di emulsione olio-in-acqua. Utilizzare 7 μL/g di peso corporeo (BW) per ogni topo (0,1 mg/kg di buprenorfina BW 10 mg/kg di etomidato BW).
- Rilassante muscolare: Sciogliere 100 mg di Pancuronio-bromuro in 100 ml di NaCl allo 0,9%. Utilizzare 1,0 μL/g di peso corporeo (1 mg/kg di peso corporeo) per ciascun topo.
- Soluzioni di isoproterenolo: Sciogliere 100 mg di isoproterenolo in 100 mL di NaCl allo 0,9% (1 μg/μL). Preparare le seguenti diluizioni (Tabella 1) e trasferire ciascuna in una siringa da 1 mL.
- Per ottenere la diluizione 1, diluire il brodo 1:1.8. Per ottenere la diluizione 2, diluire il brodo 1:6. Per ottenere la diluizione 3, diluire la diluizione 1 in 1:10. Infine, ottenere la diluizione 4 con una diluizione 1:10 della diluizione 2.
- NaCl ipertonico al 15% (p/v): Sciogliere 1,5 g di NaCl allo 0,9% in 10 ml di H2O a doppio distillato. Filtrare la soluzione con un filtro a siringa per pori da 0,45 μm.
- Preparazione di soluzione di albumina al 12,5% (p/v): Sciogliere 1,25 g di albumina sierica bovina in 10 ml di NaCl allo 0,9%. Incubare la soluzione a 37 °C per 30 min. Raffreddare a temperatura ambiente e filtrare la soluzione con un filtro a siringa per pori da 0,45 μm.
- Preparazione della configurazione: Prima accendere la piastra riscaldante e impostarla a 39-40 °C. Posizionare una siringa riempita con soluzione salina sulla piastra riscaldante e trasferire il catetere PVL (Pressure-Volume Loop) nella siringa. Pre-incubare il catetere per almeno 30 minuti prima dell'uso per la stabilizzazione. La configurazione che utilizziamo è costituita da un catetere di conduttanza da 1,4 F, un'unità di controllo e il software corrispondente, ed è descritta graficamente nella Figura 1B e i riferimenti del fornitore sono elencati nella Tabella dei materiali.
2. Anestesia
- Iniettare buprenorfina (0,1 mg/kg di peso corporeo per via intraperitoneale) 30 minuti prima dell'intubazione.
- Posizionare il mouse in una camera di vetro acrilica pre-satura con isoflurano al 2,5% e preriscaldata con una piastra riscaldante posta sulla base della camera.
- Non appena il topo dorme (mancanza di riflessi), iniettare la miscela anestetica (7 ml/kg di peso corporeo) contenente 10 mg/kg di etomidato ed eparina (1.200 UI/kg di peso corporeo) per via intraperitoneale.
3. Ventilazione
- Trasferire l'animale sulla piattaforma di intubazione (Figura 1C) 3-4 minuti dopo l'iniezione di anestetico. Il topo pende dai denti con la vista dorsale rivolta verso l'operatore.
- Sollevare delicatamente la lingua con una pinza. Per identificare la glottide, sollevare leggermente la mascella inferiore del mouse con una seconda pinza.
- Inserire con attenzione il tubo endotracheale (Figura 1A) nella trachea e rimuovere l'asta guida.
- Trasferire l'animale sulla piastra riscaldante, posizionarlo sul retro e collegare il tubo di intubazione al respiratore del piccolo animale.
- Regolare la frequenza respiratoria a 53,5 x (peso corporeo in grammi)-0,26 [min-1], come descritto da altri12e i volumi di marea alle pressioni inspiratorie di picco di 11 ± 1 cmH2O. Stabilire un PEEP di 2 cmH2O.
- Fissare con attenzione le estremità del mouse sulla piastra riscaldante con strisce adesive e applicare un unguento per gli occhi su entrambi gli occhi per evitare secchezza.
- Inserire una sonda di temperatura rettale e mantenere la temperatura corporea interna a 37 ± 0,2 °C.
- Installare un ECG a 1 derivazione e monitorare la frequenza cardiaca on-line come indicatore per la profondità e la stabilità dell'anestesia.
- In assenza di riflessi interdigitali, iniettare 1 mg/kg di peso corporeo del rilassante muscolare pancuronio-bromuro per via intraperitoneale. Ciò previene gli artefatti respiratori durante le misurazioni PVL.
4. Chirurgia
- Raccomandazioni generali
- Durante l'intervento chirurgico, ventilare con ~ 1,5-2% di isoflurano vaporizzato con O2. La concentrazione di isoflurano può anche dipendere da variabili come il ceppo di topo, il sesso, l'età e il peso degli animali, ma deve essere determinata individualmente e sperimentalmente e i valori qui sono di riferimento per il ceppo di topo C57BL6 / N. È importante sottolineare che il ventilatore è collegato a un sistema di estrazione per impedire all'operatore di inalare isoflurano.
- Utilizzare un ingrandimento compreso tra 1,5-4x dallo stereomicroscopio per le procedure chirurgiche.
NOTA: Fare riferimento alle linee guida istituzionali / locali sulla preparazione dell'animale per interventi chirurgici di non sopravvivenza.
- Cannulazione femorale
- Risciacquare l'arto posteriore con etanolo al 70%, incidere la regione inguinale sinistra ed esporre la vena femorale sinistra.
- Esplodere l'arteria epigastrica e la vena con una cauterizzazione.
- Ligate la vena femorale con una sutura posta distale all'accesso del catetere.
- Passare una sutura sotto la vena femorale e preparare un nodo cranico del sito di puntura. Perforare la vena femorale con il microtubo preparato (vedere punto 1.1) attaccato a una siringa da 1 mL.
- Legare il nodo per fissare il tubo all'interno della nave.
- Contrastare la perdita di liquidi mediante infusione di NaCl allo 0,9% integrato con albumina al 12,5% ad una velocità di infusione di 15 μL/min con una pompa automatica a siringa. Inoltre, mantenere umido il tessuto esposto utilizzando nacl preriscaldato allo 0,9%.
- Thoracotomy
- Risciacquare il torace con il 70% di etanolo.
- Incidere la pelle appena sotto il processo xifoide e separare senza mezzi termini i muscoli pettorali dalla parete toracica con una pinza o una cauterizzazione.
- Sollevare il processo xifoide con una pinza, quindi tagliare la parete toracica muovendosi lateralmente su entrambi i lati con una cauterizzazione fino a quando il diaframma è completamente visibile dal basso.
- Incidere il diaframma da sotto ed esporre l'apice cardiaco. Quindi rimuovere con cura il pericardio con una pinza.
- Eseguire una costotomia limitata sul lato sinistro come descritto in precedenza6.
- Passare una sutura sotto la vena cavale inferiore per eseguire la riduzione del precarico durante le fasi successive.
- Forare delicatamente l'apice cardiaco con una cannula calibro 25 (massima 4 mm). Rimuovere la cannula e inserire il catetere fotovoltaico fino a quando tutti gli elettrodi sono all'interno del ventricolo.
- Regolare la posizione del catetere con movimenti delicati e giri fino a ottenere anelli di forma rettangolare (Figura 2A).
- Mantenere sempre umido tutto il tessuto esposto utilizzando NaCl 0,9% preriscaldato.
5. Misurazioni
- Raccomandazioni generali
- Durante le misurazioni, ventilare con ~ 1,5-2% di isoflurano vaporizzato con 100% O2.
- Eseguire 2 misurazioni al basale e 2 occlusioni della vena cava in ogni fase del protocollo dose-risposta.
NOTA: È importante che dopo la prima e la seconda occlusione della vena cava, sia i valori di pressione che quelli di volume ritornino ai valori dello stato stazionario come prima della prima occlusione. Questa osservazione è necessaria per riconoscere uno spostamento della posizione del catetere dovuto a riduzioni seriali del volume intraventricolare. Se si verificasse uno spostamento della posizione del catetere, in particolare i valori di volume verrebbero spostati.
- Eseguire un'analisi on-line dei parametri (frequenza cardiaca, volume ictus, dP/dtmax)e attendere l'ottenimento della funzione cardiaca allo stato stazionario. Per l'intervallo di parametri previsto con l'impostazione qui utilizzata nei mouse C57Bl6/N, fare riferimento ai risultati pubblicati6.
- Arrestare il respiratore in posizione espiratoria finale e registrare i parametri basali. Dopo 3-5 secondi ridurre il precarico cardiaco sollevando la sutura sotto la vena cavale inferiore con una pinza per ottenere parametri indipendenti dal precarico (Figura 2B). Accendere il ventilatore. Attendere almeno 30 secondi per la seconda occlusione fino a quando i parametri emodinamici non saranno stabilizzati.
- Dopo aver ottenuto le misurazioni in condizioni basali procedere alla dose-risposta di isoproterenolo passando alle siringhe preparate. Qui la velocità di infusione rimane invariata al fine di evitare modifiche del precarico cardiaco. Fare attenzione a non infondere bolle d'aria quando si cambia la siringa.
- Attendere almeno 2 minuti fino a quando non si ottiene una nuova funzione cardiaca allo stato stazionario, quindi arrestare nuovamente il respiratore in posizione espiratoria finale e registrare i parametri basali. Dopo 3-5 secondi ridurre il precarico cardiaco sollevando la sutura sotto la vena cavale inferiore al fine di ottenere parametri indipendenti dal precarico.
- Attendere almeno 30 secondi per la seconda occlusione. Successivamente passare alla siringa preparata con la successiva concentrazione di isoproterenolo e ripetere le registrazioni dei parametri indipendenti dal basale e dal precarico.
NOTA: Artefatti come il picco di pressione sistolica terminale (ESPS, Figura 2C)possono verificarsi durante l'aumento del dosaggio di isoproterenolo, che deriva dall'intrappolamento del catetere. Gli artefatti che si verificano prima dell'inizio dei parametri basali possono essere facilmente corretti tramite il riposizionamento del catetere.
6. Calibrazione
NOTA: le procedure di calibrazione possono variare a seconda del sistema PVL utilizzato.
- Calibrazione della conduttanza parallela
- Collegare una siringa contenente una soluzione di NaCl al 15% alla cannula femorale dopo l'ultima misurazione dalla dose-risposta isoproterenolica. Infondere con attenzione 5 μL della soluzione ipertonica rimanente nel tubo fino a quando PVL non si sposta leggermente a destra durante la visualizzazione in linea. Quindi attendere che i loop tornino allo stato stazionario.
- Arrestare il respiratore alla fine dell'espirazione e iniettare un bolo di 10 μL di NaCl al 15% entro 2-3 secondi. Controlla se i PVL si allargano ampiamente e vengono spostati a destra durante la visualizzazione online.
- Calibrazione della conduttanza al volume
- Attendere 5 minuti, niente di meno, in modo che il bolo salino ipertonico sia completamente diluito. Successivamente rimuovere il catetere e prelevare almeno 600 μL di sangue dal ventricolo sinistro del cuore pulsante utilizzando una siringa da 1 mL e una cannula calibro 21. In questo momento l'animale viene eutanasia in anestesia profonda e analgesia da sanguinamento massiccio, interrompendo la ventilazione e la rimozione del cuore.
- Trasferire il sangue nella cuvetta di calibrazione preriscaldata (a bagnomaria a 37 °C) con cilindri di volume noto. Posizionare il catetere fotovoltaico centralmente in ogni cilindro e registrare la conduttanza. Calcolando una curva standard per ogni animale, le unità di conduttanza possono essere convertite in valori di volume assoluti.
7. Analisi
- Dopo aver ottenuto con successo le misurazioni PVL in condizioni basali e la stimolazione isoproterenolica, visualizzare, digitalizzare, calcolare ed estrarre i parametri che caratterizzano la funzione cardiaca (come PRSW, dP / dt, pressione e volume diastolica terminale, pressione e volume sistolica finale, costante di rilassamento Tau, tra gli altri) utilizzando un software di analisi PVL appropriato. Ulteriori analisi statistiche e rappresentazioni grafiche possono essere eseguite con software di analisi standard.
- Analisi dei parametri indipendenti dal precarico
NOTA: Per questo passaggio è fondamentale standardizzare la procedura.- Selezionare i primi 5-6 PVL che mostrano il precarico decrescente in tutte le misurazioni per l'analisi dei parametri indipendenti dal precarico (Figura 2D). Un numero costante di PVL selezionati per l'analisi durante la riduzione del precarico ridurrà la variabilità tra le misurazioni dei parametri ottenuti.
- Calcolare il valore medio delle due misurazioni in ogni fase del protocollo.
Risultati
La misurazione del volume-loop di pressione (PVL) è un potente strumento per analizzare la farmacodinamica cardiaca dei farmaci e per indagare il fenotipo cardiaco di modelli murini geneticamente modificati in condizioni normali e patologiche. Il protocollo consente la valutazione della riserva cardiaca β-adrenergica nel modello murino adulto. Qui descriviamo un metodo a torace aperto in anestesia isoflurano combinato con buprenorfina (analgesico) e pancuronio (rilassante muscolare), che si concentra sulla risposta cardiaca alla stimolazione β-adrenergica infondendo concentrazioni di isoproterenolo attraverso un catetere venoso femorale. Alcuni dati rappresentativi mostrati in questo protocollo sono derivati da topi maschi adulti di tipo C57Bl6/N (Figura 3 e Tabella 2). Come indicatore della variabilità di alcuni importanti parametri misurati dalla nostra analisi PVL abbiamo eseguito un'analisi di potenza (α probabilità di errore di 0,05 e potenza di 0,8) utilizzando i risultati del gruppo WT e il software G*Power disponibile gratuitamente17. Nella Tabella 3 sono rappresentate le dimensioni dell'effetto calcolate e le dimensioni del campione richieste per la frequenza cardiaca, prSW, volume dell'ictus, la costante di rilassamento Tau, dP/ dtmax e dP / dtmin assumendo variazioni comprese tra il 10% e il 30% per ciascun parametro inferiore a 0, 0,825 e 8,25 ng / min isoproterenolo.
L'analisi grafica delle relazioni pressione-volume viene effettuata tracciando il volume (μL) sull'Y e la pressione (mmHg) sull'asse X. Se il catetere è posizionato correttamente all'interno del ventricolo, un ciclo cardiaco completo è rappresentato da un PVL di forma rettangolare (Figura 2A e Figura 3A). In breve, la sistole inizia con una fase di contrazione isovolumetrica (caratterizzata da dP/dtmax), durante la quale entrambe le valvole cardiache sono chiuse (bordo verticale destro). Quando la pressione ventricolare supera la pressione aortica, la valvola aortica si apre e il sangue viene pompato nell'aorta durante la fase di espulsione (orizzontale superiore). Successivamente, quando la pressione aortica supera la pressione ventricolare, la valvola aortica si chiude e inizia la diastole. Durante il rilassamento isovolumetrico (caratterizzato dai parametri dP/dtmin e Tau) la pressione ventricolare scende fino a quando la pressione atriale supera la pressione ventricolare e la valvola mitrale si apre (bordo verticale sinistro). Ora il riempimento diastolico passivo, caratterizzato dalla relazione pressione-volume end-diastolico (EDPVR), avviene fino all'inizio del ciclo cardiaco successivo (orizzontale inferiore) (Figura 2A-B).
L'analisi PVL fornisce informazioni dettagliate sulla funzione cardiaca poiché è in grado di determinare la funzione cardiaca indipendentemente dal precarico cardiaco. Pertanto, è stato descritto come il gold standard per determinare la funzione cardiaca in configurazioni sperimentali5. Nel protocollo descritto utilizzando topi C57Bl6/N, abbiamo valutato la risposta all'isoproterenolo prodotta su parametri generali della funzione cardiaca come frequenza cardiaca, gittata cardiaca, volume dell'ictus e lavoro dell'ictus. Un effetto significativo dell'isoproterenolo su ciascun parametro è osservato nella risposta alla dose in diverse concentrazioni di isoproterenolo (Figura 3B). I parametri di contrattilità cardiaca come PRSW e dP/dtmax hanno mostrato l'aumento atteso della dose-risposta sotto infusione di isoproterenolo (Figura 3A-B). D'altra parte, è stata registrata una riduzione dei parametri diastolici (costante di rilassamento Tau e dP/dtmin)con aumento delle concentrazioni di isoproterenolo (Figura 3C) come previsto da un effetto lusitropico positivo prodotto dalle catecolamine nel cuore sano. Ulteriori parametri da quelli mostrati nella Figura 3 (cioè pressione e volume sistolica finale, pressione e volume diastolica finale, pressione massima, tra gli altri) sono ottenuti anche dall'analisi PVL e possono anche essere analizzati a seconda della domanda scientifica, del modello genetico o patologico e delle osservazioni ottenute. Valori aggiuntivi e dettagliati per i parametri più comuni della funzione cardiaca in PVL su ogni passaggio durante la stimolazione β-adrenergica incrementale, incluso il punto temporale di calibrazione per la conduttanza parallela con soluzione salina ipertonica che influenza fortemente i parametri del volume cardiaco, ma anche l'inotropia cardiaca e il rilassamento, sono stati precedentemente riportati1,6.

Figura 1. Anestesia e configurazione del loop pressione-volume. (A) Cannula di venipuntura-cannula calibro 20 adattata per l'intubazione del topo. (B) Diagramma che mostra l'organizzazione e il collegamento dei diversi componenti della configurazione di misurazione pressione-volume utilizzata, compresa la direzione del flusso del gas anestetico. (C) Piattaforma di intubazione utilizzata per appendere i topi per un'intubazione rapida e sicura. Le viti (i) su entrambi i lati all'estremità del filo sospeso (ii) sono incluse per stringere la minaccia a seconda del peso del mouse. La freccia indica una possibilità di connessione per l'esposizione all'isoflurano. Temp.: Temperatura; ECG: Elettrocardiogramma; MinPexp: Pressione espiratoria minima; MaxPexp: Pressione espiratoria massima; PV: Pressione-volume. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2. Analisi rappresentativa pressione-volume. (A) Registrazioni esemplari di pressione-volume in cui vengono mostrati i parametri analizzati durante la misurazione basale e vengono rappresentati i principali eventi durante il ciclo cardiaco. (B) I parametri ESPVR, EDPVR e PRSW sono rappresentati durante la riduzione del precarico. (C) Vengono presentati picchi di pressione sistolica terminale durante le misurazioni basali (pannello superiore) o durante la manovra di occlusione (pannello inferiore) entrambi sotto stimolazione isoproterenolica. LV: Ventricolare sinistro; dP/dtmin: Minimo dP/dt; dP/dtmax: Massimo dP/dt; Ves: Volume sistolico finale; Ved: Volume diastolico finale; ESPVR: Relazione pressione-volume sistolica finale; PRSW: Preload lavoro di ictus reclutabile; EDPVR: Relazione pressione-volume diastolica terminale. La figura è stata adattata dal supplemento del nostro precedente lavoro 20196. Fare clic qui per visualizzare una versione più grande di questa figura.
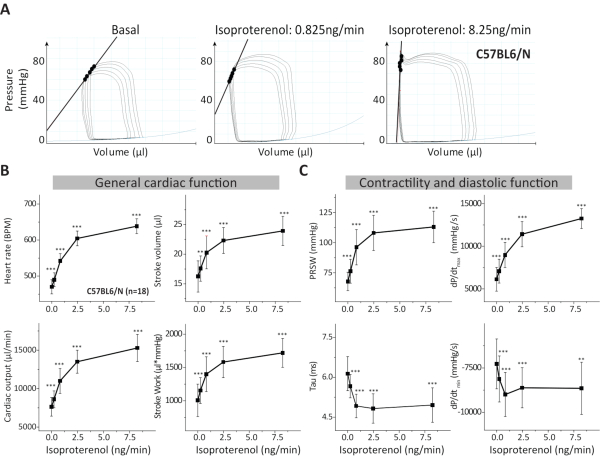
Figura 3. Analisi di misurazioni PVL in topi C57BL6/N. (A) PVL rappresentativi durante l'occlusione della vena cavale inferiore da topi di controllo C57BL6/N e sottoposti a concentrazioni crescenti di isoproterenolo. (B) La funzione cardiaca generale durante le condizioni basali e durante l'isoproterenolo è descritta dall'analisi della frequenza cardiaca, della gittata cardiaca, del volume dell'ictus e del lavoro di ictus. (C) Sono stati analizzati parametri aggiuntivi per valutare la contrattilità cardiaca e la funzione diastolica come prSW, la costante di rilassamento Tau (equazione di Weiss18)e il dP/dt massimo e minimo. I dati sono presentati come deviazione media ± standard. BPM: Battiti al minuto; PRSW: Preload lavoro di ictus reclutabile; n: numero di topi. **p < 0,01: valori p dal t-test dello studente accoppiato contro la condizione basale (isoproterenolo = 0 ng/min). Fare clic qui per visualizzare una versione più grande di questa figura.
| Isoproterenolo | Concentrazione (pg/μL) | Velocità di infusione (μL/min) | Dosi (ng/min) |
| Ceppo | 1000 | ||
| Diluizione 1 | 550 | 15 | 8.25 |
| Diluizione 2 | 165 | 15 | 2.475 |
| Diluizione 3 | 55 | 15 | 0.825 |
| Diluizione 4 | 16.5 | 15 | 0.2475 |
Tabella 1. Diluizione dell'isoproterenolo per aumentare la stimolazione β-adrenergica. Fare clic qui per scaricare questa tabella.
| Isoproterenolo (ng/min) | |||||
| 0 | 0.2475 | 0.825 | 2.475 | 8.25 | |
| Parametri e volumi globali | |||||
| Frequenza cardiaca (bpm) | 470 ± 19,6 | 490 ± 19,3 | 542 ± 20,6 | 605 ± 20,5 | 638 ± 20,5 |
| Volume corsa (μl) | 16.2 ± 2.6 | 17.6 ± 2.1 | 20.3 ± 2.8 | 22.3 ± 2.2 | 23,9 ± 2,5 |
| Gittata cardiaca (μl/min) | 7627 ± 1210 | 8609 ± 1097 | 11000 ± 1616 | 13502 ± 1494 | 15291 ± 1761 |
| Volume sistolico finale (μl) | 13 ± 3.1 | 10.5 ± 3.5 | 4.81 ± 2.3 | 1,94 ± 1,9 | 1.5 ± 1.7 |
| Volume diastolico terminale (μl) | 27,4 ± 3 | 26.6 ± 3.0 | 24.1 ± 3.1 | 23.8 ± 2.6 | 24,8 ± 2,7 |
| Pressione media (mmHg) | 27.4 ± 2.2 | 28.6 ± 2.2 | 29.2 ± 1.9 | 29,7 ± 1,9 | 30,5 ± 1,9 |
| Elastanza arteriosa (mmHg/μl) | 4.44 ± 0.6 | 4,18 ± 0,7 | 3.46 ± 0.5 | 2,78 ± 0,9 | 2,91 ± 1 |
| Parametri sistolici | |||||
| Precarico Lavoro di ictus reclutabile | 67,8 ± 7,62 | 76,3 ± 9,85 | 96,1 ± 14,62 | 108 ± 14.56 | 113 ± 13.02 |
| ESPVR · | 4.96 ± 1.29 | 5.15 ± 1.16 | 7.2 ± 2.28 | 17,3 ± 42,04 | 40 ± 107,55 |
| Frazione di eiezione (%) | 52.59 ± 9.57 | 60,9 ± 9,94 | 80.23 ± 8.65 | 92.16 ± 7.2 | 94.18 ± 6.15 |
| Corsa lavoro (mmHg x μl) | 1007 ± 244.26 | 1153 ± 193 | 1399 ± 261 | 1582 ± 234 | 1720 ± 216 |
| Massimo dP/dt (mmHg/s) | 6128,7 ± 1398,39 | 7087 ± 1401 | 8982,4 ± 1481 | 11422 ± 1477 | 13256 ± 1165 |
| Minimo dV/dt (μl/s) | - 523 ± 105.58 | - 613 ± 102 | - 835 ± 151 | - 1103 ± 165 | - 1273 ± 177 |
| Pressione sistolica terminale (mmHg) | 70,8 ± 6,98 | 72,5 ± 7,42 | 69 ± 6.28 | 61,2 ± 17,36 | 68,2 ± 19,72 |
| Potenza massima (mmHg x μl/s) | 3009 ± 955.31 | 3541 ± 1188 | 4185 ± 1058 | 4272 ± 959 | 4918 ± 1418 |
| Parametri diastolici | |||||
| EDPVR | 1 ± 0,93 | 1,23 ± 0,88 | 1,5 ± 0,86 | 1,87 ± 0,92 | 1,96 ± 0,99 |
| Tau (ms, equazione diWeiss) | 6,14 ± 0,64 | 5,67 ± 0,44 | 4,92 ± 0,44 | 4,83 ± 0,55 | 4,96 ± 0,65 |
| Minimo dP/dt (mmHg/s) | - 7272 ± 1403 | - 8119 ± 1295 | - 8998 ± 1240 | - 8618 ± 1129 | - 8648 ± 1468 |
| Pressione diastolica terminale (mmHg) | 5.29 ± 1.01 | 5.74 ± 1.07 | 5,6 ± 1,51 | 5.37 ± 1.13 | 5.76 ± 1.15 |
| Massimo dV/dt (μl/s) | 765 ± 174 | 817 ± 178 | 972 ± 156 | 1158 ± 163 | 1264 ± 153 |
Tabella 2. Analisi di misurazioni PVL in topi C57BL6/N. Parametri PVL della funzione cardiaca durante le condizioni basali e durante l'infusione di isoproterenolo. I dati sono presentati come deviazione standard media ± da 18 topi adulti maschi. PV: Volume di pressione; BPM: Battiti al minuto; ESPVR: Pendenza della relazione PV sistolica terminale, calcolo insufficiente a bassi volumi intra-ventricolari (2.475 e 8.25 ng/min isoproterenolo); EDPVR: End-diastolic PV-Relationship, regressione esponenziale (coefficiente alfa). Fare clic qui per scaricare questa tabella.
| Delta (%) | Dimensione dell'effetto | Dimensione del campione per gruppo | ||||
| Isoproterenolo ng/min | Isoproterenolo ng/min | |||||
| 0 | 0.825 | 8.25 | 0 | 0.825 | 8.25 | |
| Frequenza cardiaca | ||||||
| 10 | 2.4 | 2.6 | 3.1 | 4 | 4 | 3 |
| 15 | 3.6 | 3.9 | 4.6 | 3 | 3 | 3 |
| 20 | 4.8 | 5.3 | 6.2 | 3 | 3 | 3 |
| 25 | 6.0 | 6.6 | 7.8 | 3 | 3 | 3 |
| 30 | 7.2 | 7.9 | 9.3 | 3 | 3 | 3 |
| Volume della corsa | ||||||
| 10 | 0.6 | 0.7 | 1.0 | 42 | 30 | 18 |
| 15 | 0.9 | 1.1 | 1.5 | 20 | 15 | 9 |
| 20 | 1.2 | 1.5 | 2.0 | 12 | 9 | 6 |
| 25 | 1.5 | 1.8 | 2.4 | 8 | 6 | 4 |
| 30 | 1.8 | 2.2 | 2.9 | 6 | 5 | 4 |
| Precarico lavoro di corsa reclutabile | ||||||
| 10 | 0.9 | 0.7 | 0.9 | 21 | 38 | 22 |
| 15 | 1.3 | 1.0 | 1.3 | 10 | 18 | 11 |
| 20 | 1.8 | 1.3 | 1.7 | 7 | 11 | 7 |
| 25 | 2.2 | 1.6 | 2.2 | 5 | 7 | 5 |
| 30 | 2.7 | 2.0 | 2.6 | 4 | 6 | 4 |
| dP/dtmax | ||||||
| 10 | 0.4 | 0.6 | 1.1 | 83 | 44 | 14 |
| 15 | 0.7 | 0.9 | 1.7 | 38 | 20 | 7 |
| 20 | 0.9 | 1.2 | 2.3 | 22 | 12 | 5 |
| 25 | 1.1 | 1.5 | 2.8 | 15 | 8 | 4 |
| 30 | 1.3 | 1.8 | 3.4 | 11 | 6 | 3 |
| Tau | ||||||
| 10 | 1.0 | 1.1 | 0.8 | 19 | 14 | 28 |
| 15 | 1.4 | 1.7 | 1.2 | 9 | 7 | 13 |
| 20 | 1.9 | 2.2 | 1.5 | 6 | 5 | 8 |
| 25 | 2.4 | 2.8 | 1.9 | 4 | 4 | 6 |
| 30 | 2.9 | 3.4 | 2.3 | 4 | 3 | 5 |
| dP/dtmin | ||||||
| 10 | 0.5 | 0.7 | 0.6 | 60 | 31 | 47 |
| 15 | 0.8 | 1.1 | 0.9 | 27 | 15 | 22 |
| 20 | 1.0 | 1.4 | 1.2 | 16 | 9 | 13 |
| 25 | 1.3 | 1.8 | 1.5 | 11 | 6 | 9 |
| 30 | 1.6 | 2.2 | 1.8 | 8 | 5 | 7 |
| Relazione pressione-volume sistolica terminale | ||||||
| 10 | 0.4 | 0.3 | 0.04 | > 100 | > 100 | > 100 |
| 15 | 0.6 | 0.5 | 0.06 | 48 | 73 | > 100 |
| 20 | 0.8 | 0.6 | 0.07 | 28 | 41 | > 100 |
| 25 | 1.0 | 0.8 | 0.09 | 19 | 27 | > 100 |
| 30 | 1.2 | 1.0 | 0.11 | 13 | 19 | > 100 |
| Volume diastolico terminale | ||||||
| 10 | 0.9 | 0.8 | 0.9 | 20 | 27 | 20 |
| 15 | 1.4 | 1.2 | 1.4 | 10 | 13 | 10 |
| 20 | 1.8 | 1.6 | 1.8 | 6 | 8 | 6 |
| 25 | 2.3 | 2.0 | 2.3 | 5 | 6 | 5 |
| 30 | 2.8 | 2.4 | 2.8 | 4 | 5 | 4 |
Tabella 3. Dimensione stimata dell'effetto e dimensione del campione richiesta per i parametri selezionati in base ai valori osservati nei topi maschi C57BL6/N. Delta descrive un'ipotetica differenza nel parametro tra un controllo (cioè wild type) e un gruppo di trattamento. La dimensione dell'effetto e la dimensione del campione richiesta per gruppo vengono calcolate utilizzando i dati di controllo (deviazione media e standard), l'errore alfa (0,05) e la potenza (0,8) tramite G*Power 19. I valori in grassetto (sfondi verdi nella versione online della tabella) indicano una dimensione dell'effetto soglia suggerita (1≤) e la dimensione del campione per ciascun parametro su ciascuna dose di isoproterenolo. dP/dtmin: Minimo dP/dt; dP/dtmax: Massimo dP/dt. Fare clic qui per scaricare questa tabella.
Discussione
Qui, forniamo un protocollo per analizzare la funzione cardiaca in vivo nei topi sotto stimolazione β-adrenergica crescente. La procedura può essere utilizzata per affrontare sia i parametri basali della funzione cardiaca che la riserva adrenergica (ad esempio, inotropia e cronotropia) nei topi geneticamente modificati o su interventi. Il vantaggio più importante delle misurazioni del ciclo pressione-volume (PVL) rispetto ad altri mezzi per determinare la funzione cardiaca è l'analisi della funzione cardiaca intrinseca e indipendente dal carico. Tutti gli altri metodi (ad esempio, risonanza magnetica ed ecocardiografia) possono solo valutare i parametri dipendenti dal carico della funzione cardiaca e in particolare la contrattilità cardiaca non può essere determinata in modo affidabile. Ciò rende le misurazioni PVL il gold standard per le misurazioni end-point di analisi approfondita della funzione cardiaca5. Tuttavia, i metodi citati prima consentono l'analisi sequenziale della funzione cardiaca, portandoli in primo piano per le osservazioni longitudinali (ad esempio, durante la progressione della malattia). Inoltre, i volumi intraventricolari, e successivamente il volume dell'ictus e altri parametri derivati, possono essere sottostimati nelle misurazioni PVL rispetto alla risonanza magnetica nei topi20.
Ci sono quattro passaggi critici durante il protocollo che sono cruciali per ottenere dati PVL validi: 1) Intubazione, 2) posizionamento del catetere venoso femorale, 3) posizionamento del catetere di pressione-conduttanza e 4) il regime periprocedurale. L'intubazione non invasiva dei topi richiede una certa esperienza ed è complicata quando si utilizza l'isoflurano poiché il periodo di tempo per l'intubazione è stretto (20 - 40 s). Pertanto, dopo l'intubazione, il corretto posizionamento del tubo deve essere attentamente controllato esaminando i movimenti del torace murino quando si altera la frequenza respiratoria dei ventilatori. Per allargare la finestra per l'intubazione, abbiamo qui descritto l'uso concomitante dell'ipnotico etomidato a breve durata d'azione. Inoltre, le fibre leggere per facilitare la visualizzazione della glottide sono disponibili16. Il corretto posizionamento del catetere venoso femorale è essenziale per l'applicazione dell'isoproterenolo durante le fasi successive. Durante questa fase, l'embolia aerea può danneggiare gravemente gli animali inducendo l'embolia polmonare. Il corretto posizionamento del catetere femorale può essere inizialmente controllato da un'attenta aspirazione di sangue venoso. Quando il corretto posizionamento del catetere è incerto durante le fasi successive, è possibile esaminare il volume diastolico finale, che dovrebbe aumentare in risposta al minimo bolo quando si visualizza PVL on-line. Contrariamente alla maggior parte degli altri ricercatori, qui descriviamo la cannulazione della vena femorale, mentre altri hanno spesso usato la vena giugulare come vaso bersaglio per l'accesso venoso centrale12,21. Questo approccio ha il vantaggio di non manipolare vicino al nervo vagale, come fatto nell'approccio toracico vicino quando la carotide è preparata, e quindi assumiamo che la potenziale stimolazione del sistema parasimpatico semplicemente toccando / danneggiando il nervo sia evitata. Il corretto posizionamento del catetere fotovoltaico all'interno del ventricolo è fondamentale per ottenere dati significativi soprattutto per quanto riguarda i parametri di volume. Quando gli elettrodi non sono completamente all'interno del ventricolo o il catetere non è posizionato correttamente lungo l'asse longitudinale del ventricolo, i parametri di volume sono altamente sottovalutati. Inoltre, il contatto tra l'endocardio e il trasduttore di pressione provoca picchi di pressione sistolica finale che non devono essere tollerati durante le misurazioni al basale6. Infine, il regime periprocedurale che include la profondità dell'anestesia e la gestione dei fluidi ha un impatto significativo sull'affidabilità dei dati PVL nei topi. Il sottodosaggio o il sovradosaggio anestetico possono entrambi influenzare gravemente i parametri emodinamici, il più delle volte con conseguente riduzione della funzione cardiaca. La perdita di liquidi, dovuta principalmente alla perdita di sangue e all'evaporazione, deve essere contrastata con l'infusione costante di soluzioni idonee come il 12,5% di albumina disciolta nello 0,9% di NaCl, che consigliamo. Essendo che l'approccio è molto invasivo, non meno importante è l'inclusione di un potente analgesico come la buprenorfina per ridurre al minimo le influenze sulle funzioni cardiovascolari evocate da un insufficiente evitamento del dolore. Iniettiamo il farmaco analgesico prima dell'intubazione. È importante eseguire l'iniezione ~ 30 minuti prima di iniziare l'intera procedura, soprattutto se l'operatore è esperto, e quindi veloce, al fine di raggiungere un adeguato effetto analgesico evitando qualsiasi dolore durante la fase di indagine. Inoltre, quando si lavora con modelli obesi probabilmente dovrebbero essere prese in considerazione dosi più elevate a causa dell'elevata lipofilia di questa sostanza. Infine, questo protocollo può anche essere modificato nel determinare la risposta ad altri stimoli catecolaminergici come la dobutamina o l'epinefrina; come ad esempio fatto da Calligaris e colleghi22 che hanno descritto l'analisi della pressione intraventricolare durante la stimolazione della dobutamina.
Per quanto riguarda la registrazione e l'analisi delle misurazioni PVL ci sono diversi passaggi che devono essere considerati. In primo luogo, è di enorme importanza analizzare costantemente le registrazioni PVL attraverso un set di dati sperimentali. Gli artefatti respiratori che si evolvono a causa dell'alternanza della pressione polmonare con conseguente alternanza del precarico cardiaco durante la ventilazione meccanica devono essere evitati spegnendo il ventilatore durante le registrazioni. Per eliminare ulteriormente gli artefatti respiratori, si consiglia di utilizzare il rilassante muscolare pancuronio al fine di prevenire le contrazioni del diaframma che si osservano frequentemente durante l'anestesia isoflurano. Inoltre, rende possibile interrompere la ventilazione alla fine della scadenza e analizzare tutti i loop selezionati, a differenza di altri protocolli che raccomandano di selezionare 8-10 loop e quindi identificare 5-6 loop di fine espiratorio che vengono successivamente analizzati23. È importante sottolineare che i periodi di apnea devono essere mantenuti brevi per evitare l'ipoventilazione con conseguente ipercapnia e acidosi respiratoria. Per migliorare l'ossigenazione e prevenire la formazione di atelettasia, abbiamo precedentemente esaminato l'uso della ventilazione PEEP durante le misurazioni PVL nei topi6. Quando si selezionano i loop per l'analisi dei dati indipendenti dal precarico, selezionare i primi 5-6 loop che mostrano un volume diastolico finale decrescente ed evitare di includere loop in cui solo la pressione è in calo, ma il volume è costante. Inoltre, i battiti extra non dovrebbero essere inclusi nell'analisi, in quanto influenzano in modo cruciale i parametri PVL. Sorprendentemente, il più delle volte i battiti aritmici si verificano a causa del contatto tra la sutura di occlusione e il cuore murino. La calibrazione per la conduttanza parallela tramite infusione di soluzione salina ipertonica ha un enorme impatto sui parametri della funzione cardiaca e dovrebbe, a nostra conoscenza, essere eseguita alla fine di un esperimento6. In particolare, a causa del suo impatto sulla funzione cardiaca, la calibrazione per la conduttanza parallela viene eseguita solo una volta durante il protocollo. Tuttavia, la conduttanza parallela cambia leggermente durante il protocollo, a causa di cambiamenti nella forma dei ventricoli dopo la stimolazione adrenergica. Sono disponibili sistemi di ammissione per valutazioni PVL nei topi che non hanno bisogno di calibrazioni saline e possono calcolare dinamicamente la conduttanza parallela durante le registrazioni PVL. Tuttavia, l'accuratezza di questo metodo è ancora in discussione5,8,24,25.
Abbiamo determinato dalle nostre osservazioni che quando si utilizza questo protocollo in topi maschi selvatici sani adulti (cioè C57Bl6 / N), la pressione sistolica è compresa tra 70 mmHg e 90 mmHg al basale e tra 80 e 100 mmHg durante la massima stimolazione con l'isoprotereno agonista β-adrenorecettore. Allo stesso modo, il volume dell'ictus è stato osservato nell'intervallo da 13 μL a 20 μL al basale e tra 20 μL e 35 μL durante la stimolazione massima. La frequenza cardiaca era di circa 450-520 battiti al minuto al basale e può superare di gran lunga i 650 battiti al minuto durante la massima stimolazione. Per quanto riguarda la contrattilità cardiaca indipendente dal precarico, il lavoro di precarico precaricabile più robusto (PRSW) è stato considerato adeguato tra 60 mmHg e 80 mmHg al basale e tra 100 mmHg e 140 mmHg durante la stimolazione massima. Se i parametri basali divergono significativamente da quelli normalmente ottenuti, o quando la funzione cardiaca reagisce in modo inappropriato alla stimolazione β-adrenergica, devono essere prese in considerazione le complicanze (ad es. perdita di sangue non osservata, calo/aumento della temperatura corporea o anestetico sovra/sotto dose).
Inoltre, alcuni artefatti possono sorgere durante le misurazioni PVL nei topi. L'artefatto più comune è il picco di pressione sistolico terminale (ESPS, Figura 2C), che deriva dall'intrappolamento del catetere ed è facilmente rettificabile riposizionando il catetere prima delle misurazioni basali a 0 ng / min isoproterenolo. Le misurazioni non dovrebbero iniziare prima che gli ESPS siano debellati in condizioni basali al fine di ottenere dati significativi, poiché l'ESPS può influenzare diversi parametri della funzione cardiaca6. Tuttavia, quando un ESPS si verifica durante la stimolazione incrementale con isoproterenolo a causa di una morfologia ventricolare alterata nelle misurazioni non influenzate al basale, questo non è rettificabile, poiché il riposizionamento del catetere altererebbe la conduttanza parallela durante il protocollo dose-risposta. Bisogna esaminarlo da vicino, poiché, allo stesso modo quelli al basale, questi ESPS hanno dimostrato di alterare significativamente i parametri della funzione cardiaca non solo attraverso una pressione massima significativamente aumentata13,26, ma anche attraverso il rilevamento di volume ridotto6.
I valori rappresentativi per i parametri emodinamici ottenuti dalle misurazioni PVL in condizioni basali e durante la stimolazione incrementale con isoproterenolo nei topi variano ampiamente con diversi approcci metodologici e in diversi ceppi di topo27,28. Oltre a ciò, si dovrebbe essere consapevoli del fatto che i fenotipi di topi geneticamente modificati possono anche essere limitati a background genetici distinti. Metodologicamente, ci sono due approcci fondamentali per eseguire l'analisi pressione-volume nei topi. Ogni metodo ha i suoi (dis)vantaggi e il metodo di scelta dipende spesso dalle esperienze del laboratorio e dei suoi investigatori. Qui ci concentriamo sulla procedura a torace aperto, in cui il catetere viene posizionato tramite una puntura sull'apice. Questo approccio ha il progresso del posizionamento del catetere sotto la visione che consente un posizionamento preciso del catetere, un predittore essenziale per la registrazione di dati significativi della funzione cardiaca nei topi. Ciò è particolarmente vero per la registrazione dei parametri di volume nella gamma di microlitri. Al contrario, un aspetto critico di questo approccio è la perdita di pressioni intra-toraciche fisiologiche, con conseguente collasso dei polmoni e formazione di atelettasia e una maggiore perdita di liquidi corporei. Tuttavia, utilizzando la ventilazione positiva a pressione espiratoria terminale (PEEP), descriviamo qui una strategia che ha dimostrato di contrastare il danno polmonare durante la PVL a torace aperto nei topi6. Il secondo approccio sperimentale consiste nell'inserire il catetere attraverso l'arteria carotide e poi retrogradamente attraverso la valvola aortica. Utilizzando questa tecnica, le pressioni intra-toraciche possono essere mantenute piuttosto normali, sebbene sia ancora necessaria la ventilazione meccanica, il che indebolisce questo vantaggio. Inoltre, l'approccio a torace chiuso limita le possibilità degli investigatori per un posizionamento preciso del catetere. Inoltre, i cateteri fotovoltaici utilizzati nei topi hanno diametri che vanno da 1 a 1,4 francesi (da 0,33 mm a 0,47 mm), il che implica un'ostruzione significativa del tratto di deflusso murino quando si utilizza l'approccio a torace chiuso, poiché le aorte dei topi adulti hanno tipicamente diametri compresi tra 0,8 mm e 1,2 mm29,30. Per quanto riguarda l'uso di PVL nei modelli di insufficienza cardiaca, l'approccio open-chest è di particolare importanza per i modelli di costrizione aortica trasversale, in cui la costrizione si trova tra l'arteria innominata e l'arteria carotide sinistra. Qui il catetere non può essere posizionato attraverso l'arteria carotide. D'altra parte, l'approccio a torace chiuso è di interesse per i ricercatori che studiano modelli murini di ventricoli dilatati, come dopo l'induzione dell'infarto miocardico, dove la puntura dell'apice non è fattibile.
Divulgazioni
Non è necessario dichiarare alcun conflitto di interessi.
Riconoscimenti
Siamo grati a Manuela Ritzal, Hans-Peter Gensheimer, Christin Richter e al team dell'Interfakultäre Biomedizinische Forschungseinrichtung (IBF) dell'Università di Heidelberg per l'assistenza tecnica esperta.
Questo lavoro è stato sostenuto dal DZHK (Centro tedesco per la ricerca cardiovascolare), dal BMBF (Ministero tedesco dell'istruzione e della ricerca), da un fondo federale per l'innovazione del Baden-Württemberg e dalla Deutsche Forschungsgemeinschaft (DFG, German Research Foundation) Project-ID 239283807 - TRR 152, FOR 2289 e dal Collaborative Research Center (SFB) 1118.
Materiali
| Name | Company | Catalog Number | Comments |
| 1.4F SPR-839 catheter | Millar Instruments, USA | 840-8111 | |
| 1 ml syringes | Beckton Dickinson, USA | REF303172 | |
| Bio Amplifier | ADInstruments, USA | FE231 | |
| Bridge-Amplifier | ADInstruments, USA | FE221 | |
| Bovine Serum Albumin | Roth, Germany | 8076.2 | |
| Buprenorphine hydrochloride | Bayer, Germany | 4007221026402 | |
| Calibration cuvette | Millar, USA | 910-1049 | |
| Differential pressure transducer MPX | Hugo Sachs Elektronik- Harvard Apparatus, Germany | Type 39912 | |
| Dumont Forceps #5/45 | Fine Science tools Inc. | 11251-35 | |
| Dumont Forceps #7B | Fine Science tools Inc. | 11270-20 | |
| Graefe Forceps | Fine Science tools Inc. | 11051-10 | |
| GraphPad Prism | GraphPad Software | Ver. 8.3.0 | |
| EcoLab-PE-Micotube | Smiths, USA | 004/310/168-1 | |
| Etomidate Lipuro | Braun, Germany | 2064006 | |
| Excel | Microsoft | ||
| Heparin | Ratiopharm, Germany | R26881 | |
| Hot plate and control unit | Labotec, Germany | Hot Plate 062 | |
| Isofluran | Baxter, Germany | HDG9623 | |
| Isofluran Vaporizer | Abbot | Vapor 19.3 | |
| Isoprenalinhydrochloride | Sigma-Aldrich, USA | I5627 | |
| Fine Bore Polythene tubing 0.61 mm OD, 0.28 mm ID | Smiths Medical International Ltd, UK | Ref. 800/100/100 | |
| MiniVent ventilator for mice | Hugo Sachs Elektronik- Harvard Apparatus, Germany | Type 845 | |
| MPVS Ultra PVL System | Millar Instruments, USA | ||
| NaCl | AppliChem, Germany | A3597 | |
| NaCl 0.9% isotonic | Braun, Germany | 2350748 | |
| Pancuronium-bromide | Sigma-Aldrich, USA | BCBQ8230V | |
| Perfusor 11 Plus | Harvard Apparatus | Nr. 70-2209 | |
| Powerlab 4/35 control unit | ADInstruments, USA | PL3504 | |
| Rechargeable cautery-Set | Faromed, Germany | 09-605 | |
| Scissors | Fine Science tools Inc. | 140094-11 | |
| Software LabChart 7 Pro | ADInstruments, USA | LabChart 7.3 Pro | |
| Standard mouse food | LASvendi GmbH, Germany | Rod18 | |
| Stereo microscope | Zeiss, Germany | Stemi 508 | |
| Surgical suture 8/0 | Suprama, Germany | Ch.B.03120X | |
| Venipuncture-cannula Venflon Pro Safty 20-gauge | Beckton Dickinson, USA | 393224 | |
| Vessel Cannulation Forceps | Fine Science tools Inc. | 00574-11 | |
| Water bath | Thermo Fisher Scientific, USA | ||
| Syringe filter (Filtropur S 0.45) | Sarstedt, Germany | Ref. 83.1826 |
Riferimenti
- Bacmeister, L., et al. Inflammation and fibrosis in murine models of heart failure. Basic Research in Cardiology. 114 (3), 19 (2019).
- Hartupee, J., Mann, D. L. Neurohormonal activation in heart failure with reduced ejection fraction. Nature Reviews Cardiology. 14 (1), 30-38 (2017).
- Hasenfuss, G. Animal models of human cardiovascular disease, heart failure and hypertrophy. Cardiovascular Research. 39 (1), 60-76 (1998).
- Lefkowitz, R. J., Rockman, H. A., Koch, W. J. Catecholamines, cardiac beta-adrenergic receptors, and heart failure. Circulation. 101 (14), 1634-1637 (2000).
- Cingolani, O. H. K. Pressure-volume relation analysis of mouse ventricular function. The American Journal of Physiology-Heart and Circulatory Physiology. 301, 2198-2206 (2011).
- Bacmeister, L., et al. Assessment of PEEP-Ventilation and the Time Point of Parallel-Conductance Determination for Pressure-Volume Analysis Under beta-Adrenergic Stimulation in Mice. Frontiers in Cardiovascular Medicine. 6, 36 (2019).
- Segin, S., et al. Cardiomyocyte-Specific Deletion of Orai1 Reveals Its Protective Role in Angiotensin-II-Induced Pathological Cardiac Remodeling. Cells. 9 (5), (2020).
- Clark, J. E., Marber, M. S. Advancements in pressure-volume catheter technology - stress remodelling after infarction. Experimental Physiology. 98 (3), 614-621 (2013).
- Glower, D. D., et al. Linearity of the Frank-Starling relationship in the intact heart: the concept of preload recruitable stroke work. Circulation. 71 (5), 994-1009 (1985).
- Winter, E. M., et al. Left ventricular function in the post-infarct failing mouse heart by magnetic resonance imaging and conductance catheter: a comparative analysis. Acta Physiologica. 194 (2), 111-122 (2008).
- Krenz, M. Conductance, admittance, and hypertonic saline: should we take ventricular volume measurements with a grain of salt. Journal of Applied Physiology. 107 (6), 1683-1684 (2009).
- Pacher, P., Nagayama, T., Mukhopadhyay, P., Batkai, S., Kass, D. A. Measurement of cardiac function using pressure-volume conductance catheter technique in mice and rats. Nature Protocols. 3 (9), 1422-1434 (2008).
- Wei, A. E., Maslov, M. Y., Pezone, M. J., Edelman, E. R., Lovich, M. A. Use of pressure-volume conductance catheters in real-time cardiovascular experimentation. Heart, Lung and Circulation. 23 (11), 1059-1069 (2014).
- van Hout, G. P., et al. Admittance-based Pressure-Volume Loops versus gold standard cardiac magnetic resonance imaging in a porcine model of myocardial infarction. Physiological Reports. 2 (4), 00287 (2014).
- Wei, C. L., Shih, M. H. Calibration Capacity of the Conductance-to-Volume Conversion Equations for the Mouse Conductance Catheter Measurement System. IEEE Transactions on Biomedical Engineering. 56 (6), 1627-1634 (2009).
- Das, S., MacDonald, K., Chang, H. Y., Mitzner, W. A simple method of mouse lung intubation. Journal of Visualized Experiments. (73), e50318 (2013).
- Faul, F., Erdfelder, E., Lang, A. G., Buchner, A. G*Power 3: a flexible statistical power analysis program for the social, behavioral, and biomedical sciences. Behavior Research Methods. 39 (2), 175-191 (2007).
- Weiss, J. L., Frederiksen, J. W., Weisfeldt, M. L. Hemodynamic determinants of the time-course of fall in canine left ventricular pressure. Journal of Clinical Investigation. 58 (3), 751-760 (1976).
- Faul, F., Erdfelder, E., Lang, A. G., Buchner, A. G*Power 3: a flexible statistical power analysis program for the social, behavioral, and biomedical sciences. Behavioral Research Methods. 39 (2), 175-191 (2007).
- Jacoby, C., et al. Direct comparison of magnetic resonance imaging and conductance microcatheter in the evaluation of left ventricular function in mice. Basic Research in Cardiology. 101 (1), 87-95 (2006).
- Georgakopoulos, D., Kass, D. A. Estimation of parallel conductance by dual-frequency conductance catheter in mice. The American Journal of Physiology-Heart and Circulatory Physiology. 279 (1), 443-450 (2000).
- Calligaris, S. D., Ricca, M., Conget, P. Cardiac stress test induced by dobutamine and monitored by cardiac catheterization in mice. Journal of Visualized Experiments. (72), e50050 (2013).
- Abraham, D., Mao, L. Cardiac Pressure-Volume Loop Analysis Using Conductance Catheters in Mice. Journal of Visualized Experiments. (103), e52942 (2015).
- Pearce, J. A., Porterfield, J. E., Larson, E. R., Valvano, J. W., Feldman, M. D. Accuracy considerations in catheter based estimation of left ventricular volume. Conference proceedings - IEEE engineering in medicine and biology society. 2010, 3556-3558 (2010).
- Nielsen, J. M., et al. Left ventricular volume measurement in mice by conductance catheter: evaluation and optimization of calibration. The American Journal of Physiology-Heart and Circulatory Physiology. 293 (1), 534-540 (2007).
- Townsend, D. Measuring Pressure Volume Loops in the Mouse. Journal of Visualized Experiments. (111), e53810 (2016).
- Barnabei, M. S., Palpant, N. J., Metzger, J. M. Influence of genetic background on ex vivo and in vivo cardiac function in several commonly used inbred mouse strains. Physiological Genomics. 42 (2), 103-113 (2010).
- Oosterlinck, W., Vanderper, A., Flameng, W., Herijgers, P. Glucose tolerance and left ventricular pressure-volume relationships in frequently used mouse strains. Journal of Biomedicine and Biotechnology. 2011, 281312 (2011).
- Guo, X., Kono, Y., Mattrey, R., Kassab, G. S. Morphometry and strain distribution of the C57BL/6 mouse aorta. The American Journal of Physiology-Heart and Circulatory Physiology. 283 (5), 1829-1837 (2002).
- Weiss, R. M., Ohashi, M., Miller, J. D., Young, S. G., Heistad, D. D. Calcific aortic valve stenosis in old hypercholesterolemic mice. Circulation. 114 (19), 2065-2069 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon