Method Article
Réponse cardiaque à la stimulation β-adrénergique déterminée par l’analyse de la boucle pression-volume
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous décrivons ici une analyse de la boucle pression-volume cardiaque sous des doses croissantes d’isoprotérénol perfusé par voie intraveineuse pour déterminer la fonction cardiaque intrinsèque et la réserve β-adrénergique chez la souris. Nous utilisons une approche à poitrine ouverte modifiée pour les mesures de boucle pression-volume, dans laquelle nous incluons la ventilation avec une pression expiratoire positive.
Résumé
La détermination de la fonction cardiaque est une analyse de critères d’évaluation robuste dans des modèles animaux de maladies cardiovasculaires afin de caractériser les effets de traitements spécifiques sur le cœur. En raison de la faisabilité des manipulations génétiques, la souris est devenue le modèle animal mammifère le plus courant pour étudier la fonction cardiaque et rechercher de nouvelles cibles thérapeutiques potentielles. Nous décrivons ici un protocole pour déterminer la fonction cardiaque in vivo en utilisant des mesures et des analyses de boucle pression-volume dans des conditions basales et sous stimulation β-adrénergique par perfusion intraveineuse de concentrations croissantes d’isoprotérénol. Nous fournissons un protocole affiné comprenant un support de ventilation prenant en compte la pression expiratoire finale positive pour améliorer les effets négatifs lors des mesures thoraciques ouvertes, et une analgésie puissante (buprénorphine) pour éviter un stress myocardique incontrôlable évoqué par la douleur pendant la procédure. Ensemble, la description détaillée de la procédure et la discussion sur les pièges possibles permettent une analyse hautement standardisée et reproductible de la boucle pression-volume, réduisant l’exclusion des animaux de la cohorte expérimentale en prévenant d’éventuels biais méthodologiques.
Introduction
Les maladies cardiovasculaires affectent généralement la fonction cardiaque. Ce numéro souligne l’importance d’évaluer in vivo la fonction cardiaque détaillée dans les modèles de maladies animales. L’expérimentation animale est entourée d’un cadre des trois principes directeurs Rs (3R) (Réduire/Affiner/Remplacer). En cas de compréhension de pathologies complexes impliquant des réponses systémiques (c’est-à-dire des maladies cardiovasculaires) au niveau de développement actuel, l’option principale consiste à affiner les méthodes disponibles. Le raffinage entraînera également une réduction du nombre d’animaux requis en raison de moins de variabilité, ce qui améliorera la puissance de l’analyse et des conclusions. En outre, la combinaison de mesures de contractilité cardiaque avec des modèles animaux de maladies cardiaques, y compris ceux induits par la stimulation neurohumorale ou par une surcharge de pression comme la bande aortique, qui imite par exemple les niveaux altérés de catécholamine / β-adrénergiques1,2,3,4,fournit une méthode puissante pour les études précliniques. Compte tenu du fait que la méthode par cathéter reste l’approche la plus largement utilisée pour l’évaluation approfondie de la contractilité cardiaque5,nous avons cherché à présenter ici une mesure affinée de la fonction cardiaque in vivo chez la souris par des mesures de boucle pression-volume (PVL) lors d’une stimulation β-adrénergique basée sur l’expérience antérieure incluant l’évaluation de paramètres spécifiques de cette approche6, 7.
Pour déterminer les paramètres hémodynamiques cardiaques, des approches comprenant des techniques d’imagerie ou de cathéter sont disponibles. Les deux options s’accompagnent d’avantages et d’inconvénients qui doivent être soigneusement pris en compte pour la question scientifique respective. Les approches d’imagerie comprennent l’échocardiographie et l’imagerie par résonance magnétique (IRM); les deux ont été utilisés avec succès chez la souris. Les mesures échocardiographiques impliquent des coûts initiaux élevés d’une sonde à grande vitesse nécessaire à la fréquence cardiaque élevée des souris; il s’agit d’une approche non invasive relativement simple, mais elle est variable parmi les opérateurs qui, idéalement, devraient être expérimentés dans la reconnaissance et la visualisation des structures cardiaques. De plus, aucune mesure de pression ne peut être effectuée directement et les calculs sont obtenus à partir d’une combinaison de grandeurs de taille et de mesures de débit. D’autre part, il présente l’avantage que plusieurs mesures peuvent être effectuées sur le même animal et que la fonction cardiaque peut être surveillée par exemple pendant la progression de la maladie. En ce qui concerne la mesure du volume, l’IRM est la procédure de référence, mais comme pour l’échocardiographie, aucune mesure de pression directe n’est possible et seuls les paramètres dépendants de la précharge peuvent être obtenus8. Les facteurs limitatifs sont également la disponibilité, l’effort d’analyse et les coûts d’exploitation. Ici, les méthodes basées sur des cathéters pour mesurer la fonction cardiaque sont une bonne alternative qui permet en outre la surveillance directe de la pression intracardiaque et la détermination de paramètres de contractilité indépendants de la charge comme le travail d’AVC recrutable précharge (PRSW)9. Cependant, les volumes ventriculaires mesurés par un cathéter pression-conductance (par détermination de la conductivité) sont plus petits que ceux de l’IRM mais les différences de groupe sont maintenues dans la même plage10. Afin de déterminer des valeurs de volume fiables, l’étalonnage correspondant est nécessaire, ce qui est une étape critique lors des mesures PVL. Il combine des mesures ex vivo de la conductivité sanguine dans des cuvettes étalonnées en volume (conversion de la conductance en volume) avec l’analyse in vivo de la conductance parallèle du myocarde lors de l’injection en bolus de la solution saline hypertonique11,12. Au-delà de cela, le positionnement du cathéter à l’intérieur du ventricule et l’orientation correcte des électrodes le long de l’axe longitudinal du ventricule sont essentiels pour la capacité de détection du champ électrique environnant produit par celles-ci. Toujours avec la taille réduite du cœur de la souris, il est possible d’éviter les artefacts produits par les changements d’orientation intraventriculaire du cathéter, même dans les ventricules dilatés5,10, mais les artefacts peuvent évoluer sous stimulation β-adrénergique6,13. En plus des méthodes de conductance, le développement de la méthode basée sur l’admission semblait éviter les étapes d’étalonnage, mais ici les valeurs de volume sont plutôt surestimées14,15.
Étant donné que la souris est l’un des modèles précliniques les plus importants de la recherche cardiovasculaire et que la réserve β-adrénergique du cœur est d’un intérêt central en physiologie et pathologie cardiaques, nous présentons ici un protocole affiné pour déterminer la fonction cardiaque in vivo chez la souris par des mesures PVL lors de la stimulation β-adrénergique.
Protocole
Toutes les expériences sur les animaux ont été approuvées et réalisées conformément aux règlements du Conseil régional de Karlsruhe et de l’Université de Heidelberg (AZ 35-9185.82/A-2/15, AZ 35-9185.82/A-18/15, AZ 35-9185.81/G131/15, AZ 35-9185.81/G121/17) conformément aux directives de la directive 2010/63/UE du Parlement européen sur la protection des animaux utilisés à des fins scientifiques. Les données présentées dans ce protocole proviennent de souris mâles sauvages de type C57Bl6/N (âgées de 17 ± 1,4 semaine). Les souris ont été maintenues dans des conditions spécifiques exemptes d’agents pathogènes à l’animalerie (IBF) de la faculté de médecine de Heidelberg. Les souris ont été logées dans un cycle lumière-obscurité de 12 heures, avec une humidité relative comprise entre 56 et 60%, un changement d’air 15 fois par heure et une température ambiante de 22 ° C + / - 2 ° C. Ils étaient conservés dans des cages conventionnelles de type II ou de type II, longtemps munies de litière pour animaux et de papiers de soie comme enrichissement. Des aliments autoclavés standard et de l’eau autoclavée étaient disponibles pour être consommés ad libitum.
1. Préparation d’instruments et de solutions médicamenteuses
- Cathéter veineux central: Coupez le microtube (diamètre extérieur de 0,6 mm) en tubes de cathéter d’environ 20 cm de long. Utilisez une pince pour tirer une extrémité du tube sur l’extrémité d’une canule de calibre 23. Coupez l’autre extrémité du tube en diagonale pour créer une pointe pointue qui peut percer la veine fémorale.
- Tube endotrachéal: Pour un tube d’intubation, coupez une canule de ponction veineuse de calibre 20 de 3 cm de long pour retirer la fixation de la seringue.
- Si le tube d’intubation ne s’adapte pas parfaitement au raccord du ventilateur, enroulez le parafilm sur l’extrémité du tube où le dispositif de ventilation est connecté. La connexion doit être stable et scellée par l’épaississement (Figure 1A). Raccourcissez la broche de guidage métallique de la canule de ponction veineuse de calibre 20 à 2,7 cm et utilisez-la comme aide à l’intubation. Des approches affinées pour l’intubation, y compris des fibres légères pour faciliter la visualisation de la trachée, sont également bien décrites, par exemple par Das et ses collaborateurs16.
- Mélange anesthésique utilisé pour l’intubation : Mélanger 200 μL d’héparine (1000 UI/mL) avec 50 μL de NaCl à 0,9 % et 750 μL d’étomidate de 2 mg/mL provenant d’un produit à base d’émulsion huile-dans-eau. Utiliser 7 μL/g de poids corporel (PSB) pour chaque souris (0,1 mg/kg de buprénorphine p.c. 10 mg/kg d’étomidate de p.c.).
- Relaxant musculaire : Dissoudre 100 mg de bromure de pancuronium dans 100 mL de NaCl à 0,9 %. Utiliser 1,0 μL/g de poids corporel (1 mg/kg p.c.) pour chaque souris.
- Solutions d’isoprotérénol : Dissoudre 100 mg d’isoprotérénol dans 100 mL de NaCl à 0,9 % (1 μg/μL). Préparer les dilutions suivantes (Tableau 1) et transférer chacune dans une seringue de 1 mL.
- Pour obtenir la dilution 1, diluer le stock 1:1.8. Pour obtenir la dilution 2, diluer le stock 1:6. Pour obtenir la dilution 3, diluer la dilution 1 en 1:10. Enfin, obtenir la dilution 4 par une dilution 1:10 de la dilution 2.
- NaCl hypertonique à 15 % (p/v) : Dissoudre 1,5 g de NaCl à 0,9 % dans 10 mL deH2O double distillé. Filtrer la solution à l’aide d’un filtre à seringue à pores de 0,45 μm.
- Préparation d’une solution d’albumine à 12,5 % (p/v) : Dissoudre 1,25 g d’albumine sérique bovine dans 10 mL de NaCl à 0,9 %. Incuber la solution à 37 °C pendant 30 min. Refroidir à température ambiante et filtrer la solution avec un filtre à seringue à pores de 0,45 μm.
- Préparation de l’installation: Allumez d’abord la plaque chauffante et réglez-la à 39-40 ° C. Placez une seringue remplie de solution saline sur le coussin chauffant et transférez le cathéter à boucle pression-volume (PVL) dans la seringue. Pré-incuber le cathéter pendant au moins 30 minutes avant utilisation pour la stabilisation. La configuration que nous utilisons se compose d’un cathéter de conductance de pression de 1,4 F, d’une unité de commande et du logiciel correspondant, et elle est décrite graphiquement sur la figure 1B et les références du fournisseur sont répertoriées dans la table des matériaux.
2. Anesthésie
- Injecter de la buprénorphine (0,1 mg/kg p.C. par voie intrapéritonéale) 30 min avant l’intubation.
- Placez la souris dans une chambre en verre acrylique pré-saturée de 2,5% d’isoflurane et préchauffée avec un coussin chauffant placé à la base de la chambre.
- Dès que la souris dort (absence de réflexe), injecter le mélange anesthésique (7 mL/kg p.c.) contenant 10 mg/kg d’étomidate et de l’héparine (1 200 UI/kg p.c.) par voie intrapéritonéale.
3. Ventilation
- Transférer l’animal sur la plate-forme d’intubation (Figure 1C) 3-4 minutes après l’injection anesthésique. La souris est suspendue aux dents avec la vue dorsale face à l’opérateur.
- Soulevez doucement la langue avec une pince. Pour identifier la glotte, soulevez légèrement la mâchoire inférieure de la souris avec une deuxième pince.
- Insérez soigneusement le tube endotrachéal (Figure 1A) dans la trachée et retirez la tige guide.
- Transférez l’animal sur la plaque chauffante, placez-le à l’arrière et connectez le tube d’intubation au respirateur pour petit animal.
- Ajuster la fréquence respiratoire à 53,5 x (poids corporel en grammes)-0,26 [min-1], comme décrit par d’autres12, et les volumes courants aux pressions inspiratoires maximales de 11 ± 1 cmH2O. Établissez un PEEP de 2 cmH2O.
- Fixez soigneusement les extrémités de la souris sur la plaque chauffante avec des bandes adhésives et appliquez une pommade pour les yeux sur les deux yeux pour éviter la sécheresse.
- Insérez une sonde de température rectale et maintenez la température corporelle centrale à 37 ± 0,2 °C.
- Installez un ECG à 1 dérivation et surveillez la fréquence cardiaque en ligne comme indicateur de la profondeur et de la stabilité de l’anesthésie.
- En l’absence de réflexes interdigitaux, injecter 1 mg/kg de poids corporel du relaxant musculaire pancuronium-bromure par voie intrapéritonéale. Cela empêche les artefacts respiratoires lors des mesures PVL.
4. Chirurgie
- Recommandations générales
- Pendant la chirurgie, ventiler avec ~ 1,5-2% d’isoflurane vaporisé avec O2. La concentration d’isoflurane peut également dépendre de variables telles que la souche de souris, le sexe, l’âge et le poids des animaux, mais elle doit être déterminée individuellement et expérimentalement et les valeurs ici sont des références pour la souche de souris C57BL6 / N. Il est important de noter que le ventilateur est connecté à un système d’extraction pour empêcher l’opérateur d’inhaler de l’isoflurane.
- Utilisez un grossissement entre 1,5 et 4x du stéréomicroscope pour les interventions chirurgicales.
REMARQUE : Se référer aux directives institutionnelles/locales sur la préparation de l’animal pour les chirurgies non liées à la survie.
- Canulation fémorale
- Rincez le membre postérieur avec de l’éthanol à 70%, incissez la région inguinale gauche et exposez la veine fémorale gauche.
- Souffler l’artère épigastrique et la veine avec une cautérisation.
- Ligaturez la veine fémorale avec une suture placée distale à l’accès au cathéter.
- Passez une suture sous la veine fémorale et préparez un nœud crânien du site de ponction. Perforez la veine fémorale avec le microtube préparé (voir étape 1.1) attaché à une seringue de 1 mL.
- Attachez le nœud pour fixer le tube à l’intérieur du récipient.
- Contrer la perte de liquide par la perfusion de NaCl à 0,9% complété par 12,5% d’albumine à un débit de perfusion de 15 μL / min avec une pompe à seringue automatique. De plus, gardez les tissus exposés humides en utilisant du NaCl préchauffé à 0,9%.
- Thoracotomie
- Rincez le thorax avec de l’éthanol à 70%.
- Inciser la peau juste en dessous du processus xyphoïde et séparer brutalement les muscles pectoraux de la paroi thoracique avec une pince ou une cautérisation.
- Soulevez le processus xyphoïde avec une pince, puis coupez à travers la paroi thoracique en se déplaçant latéralement des deux côtés avec une cautérisation jusqu’à ce que le diaphragme soit entièrement visible par en dessous.
- Inciser le diaphragme par le dessous et exposer l’apex cardiaque. Ensuite, retirez soigneusement le péricarde avec une pince.
- Effectuez une costotomie limitée sur le côté gauche comme décrit précédemment6.
- Passez une suture sous la veine cavale inférieure pour effectuer une réduction de la précharge au cours des étapes ultérieures.
- Perforez doucement l’apex cardiaque avec une canule de calibre 25 (maximum 4 mm). Retirez la canule et insérez le cathéter PV jusqu’à ce que toutes les électrodes soient dans le ventricule.
- Ajuster la position du cathéter par des mouvements doux et des virages jusqu’à ce que des boucles de forme rectangulaire soient obtenues (Figure 2A).
- Gardez toujours tous les tissus exposés humides en utilisant du NaCl préchauffé à 0,9%.
5. Mesures
- Recommandations générales
- Pendant les mesures, ventilez avec ~ 1,5-2% d’isoflurane vaporisé avec 100% O2.
- Effectuer 2 mesures de base ainsi que 2 occlusions de la veine cave à chaque étape du protocole dose-réponse.
REMARQUE: Il est important qu’après la première et la deuxième occlusion de la veine cave, les valeurs de pression et de volume reviennent aux valeurs à l’état d’équilibre comme avant la première occlusion. Cette observation est nécessaire pour reconnaître un changement de position du cathéter dû à des réductions en série du volume intraventriculaire. Si un changement de position du cathéter était le cas, les valeurs de volume en particulier seraient décalées.
- Effectuer une analyse en ligne des paramètres (fréquence cardiaque, volume de l’AVC, dP/dtmax)et attendre que la fonction cardiaque à l’état d’équilibre soit obtenue. Pour la plage de paramètres attendue avec le paramètre utilisé ici chez les souris C57Bl6/N, veuillez vous référer aux résultats publiés6.
- Arrêtez le respirateur en position expiratoire et enregistrez les paramètres de base. Après 3 à 5 secondes, réduire la précharge cardiaque en soulevant la suture sous la veine cavale inférieure avec une pince afin d’obtenir des paramètres indépendants de la précharge(Figure 2B). Allumez le ventilateur. Attendez au moins 30 secondes pour la deuxième occlusion jusqu’à ce que les paramètres hémodynamiques soient stabilisés.
- Après avoir obtenu les mesures dans des conditions basales, procédez à la dose-réponse de l’isoprotérénol en passant aux seringues préparées. Ici, le débit de perfusion reste inchangé afin d’éviter des modifications de la précharge cardiaque. Veillez à ne pas infuser de bulles d’air lors du changement de seringue.
- Attendez au moins 2 minutes jusqu’à ce qu’une nouvelle fonction cardiaque à l’état d’équilibre soit obtenue, puis arrêtez à nouveau le respirateur en position expiratoire et enregistrez les paramètres de base. Après 3 à 5 secondes, réduire la précharge cardiaque en soulevant la suture sous la veine cavale inférieure afin d’obtenir des paramètres indépendants de la précharge.
- Attendez au moins 30 secondes pour la deuxième occlusion. Ensuite, passez à la seringue préparée avec la prochaine concentration d’isoprotérénol et répétez les enregistrements des paramètres indépendants de la ligne de base et de la précharge.
REMARQUE: Des artefacts tels que le pic de pression systolique terminale (ESPS, Figure 2C)peuvent se produire lors de l’augmentation de la dose d’isoprotérénol, qui résulte du piégeage du cathéter. Les artefacts qui se produisent avant le début des paramètres basaux peuvent être facilement corrigés via le repositionnement du cathéter.
6. Étalonnage
REMARQUE: Les procédures d’étalonnage peuvent varier en fonction du système PVL utilisé.
- Étalonnage de conductance parallèle
- Connectez une seringue contenant une solution de NaCl à 15 % à la canule fémorale après la dernière mesure de la dose-réponse à l’isoprotérénol. Infuser soigneusement 5 μL de la solution hypertonique restant dans le tube jusqu’à ce que le PVL se déplace légèrement vers la droite pendant la visualisation en ligne. Attendez ensuite que les boucles reviennent à l’état d’équilibre.
- Arrêtez le respirateur à la fin de l’expiration et injectez un bolus de 10 μL de NaCl à 15 % en 2 à 3 secondes. Vérifiez si les PVL s’élargissent largement et sont déplacés vers la droite lors de la visualisation en ligne.
- Calibrage de la conductance au volume
- Attendez 5 min, pas moins, pour que le bolus salin hypertonique soit complètement dilué. Ensuite, retirez le cathéter et prélevez au moins 600 μL de sang du ventricule gauche du cœur battant à l’aide d’une seringue de 1 mL et d’une canule de calibre 21. À ce stade, l’animal est euthanasié sous anesthésie profonde et analgésie par saignement massif, en arrêtant la ventilation et l’ablation du cœur.
- Transférer le sang dans la cuvette d’étalonnage préchauffée (au bain-marie à 37 °C) avec des cylindres de volume connu. Placez le cathéter PV au centre de chaque cylindre et enregistrez la conductance. En calculant une courbe standard pour chaque animal, les unités de conductance peuvent être converties en valeurs de volume absolu.
7. Analyse
- Après des mesures PVL réussies dans des conditions basales et une stimulation isoprotérénol, visualisez, numérisez, calculez et extrayez les paramètres caractérisant la fonction cardiaque (comme PRSW, dP / dt, pression et volume diastoliques finaux, pression et volume systoliques finaux, constante de relaxation Tau, entre autres) à l’aide d’un logiciel d’analyse PVL approprié. D’autres analyses statistiques et représentations graphiques peuvent être effectuées avec un logiciel d’analyse standard.
- Analyse des paramètres indépendants de la précharge
REMARQUE: Pour cette étape, il est crucial de normaliser la procédure.- Sélectionnez les 5 à 6 premiers PVL montrant une précharge décroissante dans toutes les mesures pour l’analyse des paramètres indépendants de la précharge(Figure 2D). Un nombre constant de PVL sélectionnés pour l’analyse lors de la réduction de la précharge diminuera la variabilité entre les mesures des paramètres obtenus.
- Calculez la valeur moyenne des deux mesures à chaque étape du protocole.
Résultats
La mesure de la boucle volumique de pression (PVL) est un outil puissant pour analyser la pharmacodynamique cardiaque des médicaments et pour étudier le phénotype cardiaque de modèles murins génétiquement modifiés dans des conditions normales et pathologiques. Le protocole permet l’évaluation de la réserve cardiaque β-adrénergique dans le modèle murin adulte. Nous décrivons ici une méthode à poitrine ouverte sous anesthésie isoflurane combinée à la buprénorphine (analgésique) et au pancuronium (relaxant musculaire), qui se concentre sur la réponse cardiaque à la stimulation β-adrénergique en infusant des concentrations d’isoprotérénol à travers un cathéter veineux fémoral. Certaines données représentatives présentées dans ce protocole proviennent de souris mâles adultes de type sauvage C57Bl6/N(figure 3 et tableau 2). Comme indicateur de la variabilité de certains paramètres importants mesurés par notre analyse PVL, nous avons effectué une analyse de puissance (α probabilité d’erreur de 0,05 et puissance de 0,8) en utilisant les résultats du groupe WT et le logiciel G*Power disponible gratuitement17. Le tableau 3 illustre les tailles d’effet calculées et les tailles d’échantillon requises pour la fréquence cardiaque, le PRSW, le volume de l’AVC, la constante de relaxation Tau, dP/dtmax et dP/dtmin en supposant des changements compris entre 10 % et 30 % pour chaque paramètre inférieur à 0, 0,825 et 8,25 ng/min d’isoprotérénol.
L’analyse graphique des relations pression-volume se fait en traçant le volume (μL) sur l’axe Y et la pression (mmHg) sur l’axe X. Si le cathéter est correctement placé dans le ventricule, un cycle cardiaque complet est représenté par un PVL de forme rectangulaire(Figure 2A et Figure 3A). En peu de temps, la systole commence par une phase de contraction isovolumétrique (caractérisée par dP/dtmax),au cours de laquelle les deux valves cardiaques sont fermées (bord vertical droit). Lorsque la pression ventriculaire dépasse la pression aortique, la valve aortique s’ouvre et le sang est pompé dans l’aorte pendant la phase d’éjection (horizontale supérieure). Par la suite, lorsque la pression aortique dépasse la pression ventriculaire, la valve aortique se ferme et la diastole commence. Pendant la relaxation isovolumétrique (caractérisée par les paramètres dP/dtmin et Tau), la pression ventriculaire diminue jusqu’à ce que la pression auriculaire dépasse la pression ventriculaire et que la valve mitrale s’ouvre (bord vertical gauche). Maintenant, le remplissage diastolique passif, caractérisé par la relation pression-volume diastolique terminal (EDPVR), a lieu jusqu’au début du cycle cardiaque suivant (horizontale inférieure)(Figure 2A-B).
L’analyse PVL fournit des informations détaillées sur la fonction cardiaque car elle est capable de déterminer la fonction cardiaque indépendamment de la précharge cardiaque. Ainsi, il a été décrit comme l’étalon-or pour déterminer la fonction cardiaque dans les configurations expérimentales5. Dans le protocole décrit utilisant des souris C57Bl6/ N, nous avons évalué la réponse à l’isoprotérénol produite sur des paramètres généraux de la fonction cardiaque tels que la fréquence cardiaque, le débit cardiaque, le volume de l’AVC et le travail de l’AVC. Un effet significatif de l’isoprotérénol sur chaque paramètre est observé dans la réponse posologique sous différentes concentrations d’isoprotérénol (Figure 3B). Les paramètres de contractilité cardiaque comme le PRSW et le dP/dtmax ont montré l’augmentation attendue de la dose-réponse sous perfusion d’isoprotérénol(Figure 3A-B). D’autre part, une réduction des paramètres diastoliques (constante de relaxation Tau et dP/dtmin)avec des concentrations croissantes d’isoprotérénol a été enregistrée (Figure 3C) comme étant attendue d’un effet lusitropique positif produit par les catécholamines dans le cœur sain. D’autres paramètres de ceux présentés à la figure 3 (c.-à-d. la pression et le volume systoliques finaux, la pression et le volume diastoliques finaux, la pression maximale, entre autres) sont également obtenus à partir de l’analyse PVL et peuvent également être analysés en fonction de la question scientifique, du modèle génétique ou pathologique et des observations obtenues. Des valeurs supplémentaires et détaillées pour les paramètres les plus courants de la fonction cardiaque dans le PVL à chaque étape lors de la stimulation incrémentielle β-adrénergique, y compris le point de temps d’étalonnage pour la conductance parallèle avec une solution saline hypertonique qui influence fortement les paramètres de volume cardiaque, mais aussi l’inotropie cardiaque et la relaxation, ont déjà été rapportées1,6.

Graphique 1. Anesthésie et configuration de la boucle pression-volume. (A) Canule de ponction veineuse de calibre 20 adaptée à l’intubation de souris. (B) Schéma montrant l’organisation et la connexion des différents composants de la configuration de mesure pression-volume utilisée, y compris la direction d’écoulement du gaz anesthésique. (C) Plate-forme d’intubation utilisée pour suspendre les souris pour une intubation rapide et sûre. Des vis (i) des deux côtés à l’extrémité du fil suspendu (ii) sont incluses pour resserrer la menace en fonction du poids de la souris. La flèche indique une possibilité de connexion pour l’exposition à l’isoflurane. Temp.: Température; ECG: Électrocardiogramme; MinPexp: Pression expiratoire minimale; MaxPexp: Pression expiratoire maximale; PV: Pression-volume. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Graphique 2. Analyse pression-volume représentative. (A) Enregistrements de pression et de volume exemplaires où les paramètres analysés pendant la mesure basale sont montrés et les principaux événements au cours du cycle cardiaque sont représentés. (B) Les paramètres ESPVR, EDPVR et PRSW sont représentés lors de la réduction de la précharge. (C) Des pics de pression systoliques finaux pendant les mesures basales (panneau supérieur) ou pendant la manœuvre d’occlusion (panneau inférieur) sous stimulation isoprotérénol sont présentés. LV: Ventriculaire gauche; dP/dtmin: Minimum dP/dt ; dP/dtmax: Maximum dP/dt ; Ves: Volume systolique final; Ved: Volume diastolique final; ESPVR: Relation pression-volume systolique final; PRSW : Précharger le travail recrutable sur l’AVC; EDPVR : Relation pression-volume diastolique terminal. La figure a été adaptée du supplément de notre travail précédent 20196. Veuillez cliquer ici pour voir une version agrandie de cette figure.
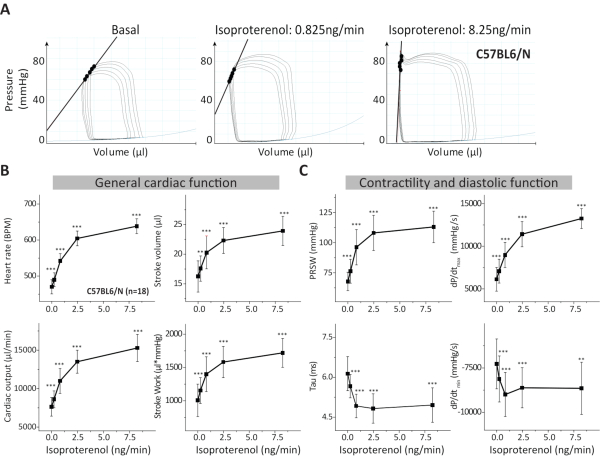
Graphique 3. Analyse des mesures PVL chez des souris C57BL6/N. (A) PVL représentatifs lors de l’occlusion de la veine cavale inférieure de souris témoins C57BL6/N et soumises à des concentrations croissantes d’isoprotérénol. (B) La fonction cardiaque générale dans les conditions basales et pendant l’isoprotérénol est décrite par l’analyse de la fréquence cardiaque, du débit cardiaque, du volume de l’AVC et du travail de l’AVC. (C) Des paramètres supplémentaires ont été analysés pour évaluer la contractilité cardiaque et la fonction diastolique comme prSW, la constante de relaxation Tau (équation de Weiss18) et le dP / dt maximal et minimal. Les données sont présentées comme une moyenne ± un écart-type. BPM: Battements par minute; PRSW : Précharger le travail recrutable sur l’AVC; n : nombre de souris. **p < 0,01 : valeurs de p du test t apparié par rapport à l’état basal (isoprotérénol = 0 ng/min). Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Isoprotérénol | Concentration (pg/μL) | Débit de perfusion (μL/min) | Doses (ng/min) |
| Stock | 1000 | ||
| Dilution 1 | 550 | 15 | 8.25 |
| Dilution 2 | 165 | 15 | 2.475 |
| Dilution 3 | 55 | 15 | 0.825 |
| Dilution 4 | 16.5 | 15 | 0.2475 |
Tableau 1. Dilution de l’isoprotérénol pour augmenter la stimulation β-adrénergique. Veuillez cliquer ici pour télécharger ce tableau.
| Isoprotérénol (ng/min) | |||||
| 0 | 0.2475 | 0.825 | 2.475 | 8.25 | |
| Paramètres globaux et volumes | |||||
| Fréquence cardiaque (bpm) | 470 ± 19,6 | 490 ± 19,3 | 542 ± 20,6 | 605 ± 20,5 | 638 ± 20,5 |
| Volume de course (μl) | 16,2 ± 2,6 | 17,6 ± 2,1 | 20,3 ± 2,8 | 22.3 ± 2.2 | 23,9 ± 2,5 |
| Débit cardiaque (μl/min) | 7627 ± 1210 | 8609 ± 1097 | 11000 ± 1616 | 13502 ± 1494 | 15291 ± 1761 |
| Volume systolique final (μl) | 13 ± 3.1 | 10,5 ± 3,5 | 4,81 ± 2,3 | 1,94 ± 1,9 | 1,5 ± 1,7 |
| Volume diastolique final (μl) | 27,4 ± 3 | 26,6 ± 3,0 | 24.1 ± 3.1 | 23,8 ± 2,6 | 24,8 ± 2,7 |
| Pression moyenne (mmHg) | 27,4 ± 2,2 | 28,6 ± 2,2 | 29,2 ± 1,9 | 29,7 ± 1,9 | 30,5 ± 1,9 |
| Élastance artérielle (mmHg/μl) | 4,44 ± 0,6 | 4,18 ± 0,7 | 3,46 ± 0,5 | 2,78 ± 0,9 | 2,91 ± 1 |
| Paramètres systoliques | |||||
| Précharger le travail d’AVC recrutable | 67,8 ± 7,62 | 76,3 ± 9,85 | 96,1 ± 14,62 | 108 ± 14,56 | 113 ± 13,02 |
| ESPVR | 4,96 ± 1,29 | 5,15 ± 1,16 | 7,2 ± 2,28 | 17,3 ± 42,04 | 40 ± 107,55 |
| Fraction d’éjection (%) | 52,59 ± 9,57 | 60,9 ± 9,94 | 80,23 ± 8,65 | 92,16 ± 7,2 | 94,18 ± 6,15 |
| Travail de course (mmHg x μl) | 1007 ± 244,26 | 1153 ± 193 | 1399 ± 261 | 1582 ± 234 | 1720 ± 216 |
| DP/dt maximum (mmHg/s) | 6128,7 ± 1398,39 | 7087 ± 1401 | 8982,4 ± 1481 | 11422 ± 1477 | 13256 ± 1165 |
| Minimum dV/dt (μl/s) | - 523 ± 105,58 | - 613 ± 102 | - 835 ± 151 | - 1103 ± 165 | - 1273 ± 177 |
| Pression systolique finale (mmHg) | 70,8 ± 6,98 | 72,5 ± 7,42 | 69 ± 6,28 | 61,2 ± 17,36 | 68,2 ± 19,72 |
| Puissance maximale (mmHg x μl/s) | 3009 ± 955,31 | 3541 ± 1188 | 4185 ± 1058 | 4272 ± 959 | 4918 ± 1418 |
| Paramètres diastoliques | |||||
| EDPVR | 1 ± 0,93 | 1,23 ± 0,88 | 1,5 ± 0,86 | 1,87 ± 0,92 | 1,96 ± 0,99 |
| Tau (ms, équation deWeiss) | 6,14 ± 0,64 | 5,67 ± 0,44 | 4,92 ± 0,44 | 4,83 ± 0,55 | 4,96 ± 0,65 |
| DP/dt minimum (mmHg/s) | - 7272 ± 1403 | - 8119 ± 1295 | - 8998 ± 1240 | - 8618 ± 1129 | - 8648 ± 1468 |
| Pression diastolique terminale (mmHg) | 5,29 ± 1,01 | 5,74 ± 1,07 | 5,6 ± 1,51 | 5,37 ± 1,13 | 5,76 ± 1,15 |
| DV/dt maximum (μl/s) | 765 ± 174 | 817 ± 178 | 972 ± 156 | 1158 ± 163 | 1264 ± 153 |
Tableau 2. Analyse des mesures PVL chez des souris C57BL6/N. Paramètres PVL de la fonction cardiaque dans les conditions basales et pendant la perfusion d’isoprotérénol. Les données sont présentées comme une moyenne ± écart-type par rapport à 18 souris adultes mâles. PV: Volume de pression; BPM: Battements par minute; ESPVR: Pente de la relation PV systolique terminale, calcul insuffisant à de faibles volumes intra-ventriculaires (2,475 et 8,25 ng / min Isoproterenol); EDPVR: Relation PV diastolique finale, régression exponentielle (coefficient alpha). Veuillez cliquer ici pour télécharger ce tableau.
| Delta (%) | Taille de l’effet | Taille de l’échantillon par groupe | ||||
| Isoprotérénol ng/min | Isoprotérénol ng/min | |||||
| 0 | 0.825 | 8.25 | 0 | 0.825 | 8.25 | |
| Fréquence cardiaque | ||||||
| 10 | 2.4 | 2.6 | 3.1 | 4 | 4 | 3 |
| 15 | 3.6 | 3.9 | 4.6 | 3 | 3 | 3 |
| 20 | 4.8 | 5.3 | 6.2 | 3 | 3 | 3 |
| 25 | 6.0 | 6.6 | 7.8 | 3 | 3 | 3 |
| 30 | 7.2 | 7.9 | 9.3 | 3 | 3 | 3 |
| Volume de course | ||||||
| 10 | 0.6 | 0.7 | 1.0 | 42 | 30 | 18 |
| 15 | 0.9 | 1.1 | 1.5 | 20 | 15 | 9 |
| 20 | 1.2 | 1.5 | 2.0 | 12 | 9 | 6 |
| 25 | 1.5 | 1.8 | 2.4 | 8 | 6 | 4 |
| 30 | 1.8 | 2.2 | 2.9 | 6 | 5 | 4 |
| Précharger le travail d’AVC recrutable | ||||||
| 10 | 0.9 | 0.7 | 0.9 | 21 | 38 | 22 |
| 15 | 1.3 | 1.0 | 1.3 | 10 | 18 | 11 |
| 20 | 1.8 | 1.3 | 1.7 | 7 | 11 | 7 |
| 25 | 2.2 | 1.6 | 2.2 | 5 | 7 | 5 |
| 30 | 2.7 | 2.0 | 2.6 | 4 | 6 | 4 |
| dP/dtmax | ||||||
| 10 | 0.4 | 0.6 | 1.1 | 83 | 44 | 14 |
| 15 | 0.7 | 0.9 | 1.7 | 38 | 20 | 7 |
| 20 | 0.9 | 1.2 | 2.3 | 22 | 12 | 5 |
| 25 | 1.1 | 1.5 | 2.8 | 15 | 8 | 4 |
| 30 | 1.3 | 1.8 | 3.4 | 11 | 6 | 3 |
| Tau | ||||||
| 10 | 1.0 | 1.1 | 0.8 | 19 | 14 | 28 |
| 15 | 1.4 | 1.7 | 1.2 | 9 | 7 | 13 |
| 20 | 1.9 | 2.2 | 1.5 | 6 | 5 | 8 |
| 25 | 2.4 | 2.8 | 1.9 | 4 | 4 | 6 |
| 30 | 2.9 | 3.4 | 2.3 | 4 | 3 | 5 |
| dP/dtmin | ||||||
| 10 | 0.5 | 0.7 | 0.6 | 60 | 31 | 47 |
| 15 | 0.8 | 1.1 | 0.9 | 27 | 15 | 22 |
| 20 | 1.0 | 1.4 | 1.2 | 16 | 9 | 13 |
| 25 | 1.3 | 1.8 | 1.5 | 11 | 6 | 9 |
| 30 | 1.6 | 2.2 | 1.8 | 8 | 5 | 7 |
| Relation pression-volume systolique final | ||||||
| 10 | 0.4 | 0.3 | 0.04 | >100 | >100 | >100 |
| 15 | 0.6 | 0.5 | 0.06 | 48 | 73 | >100 |
| 20 | 0.8 | 0.6 | 0.07 | 28 | 41 | >100 |
| 25 | 1.0 | 0.8 | 0.09 | 19 | 27 | >100 |
| 30 | 1.2 | 1.0 | 0.11 | 13 | 19 | >100 |
| Volume diastolique final | ||||||
| 10 | 0.9 | 0.8 | 0.9 | 20 | 27 | 20 |
| 15 | 1.4 | 1.2 | 1.4 | 10 | 13 | 10 |
| 20 | 1.8 | 1.6 | 1.8 | 6 | 8 | 6 |
| 25 | 2.3 | 2.0 | 2.3 | 5 | 6 | 5 |
| 30 | 2.8 | 2.4 | 2.8 | 4 | 5 | 4 |
Tableau 3. Taille d’effet estimée et taille d’échantillon requise pour des paramètres sélectionnés en fonction des valeurs observées chez les souris mâles C57BL6/N. Delta décrit une différence hypothétique dans le paramètre entre un groupe témoin (c.-à-d. type sauvage) et un groupe de traitement. La taille de l’effet et la taille d’échantillon requise par groupe sont calculées à l’aide des données de contrôle (moyenne et écart-type), de l’erreur alpha (0,05) et de la puissance (0,8) via G*Power 19. Les valeurs en gras (fonds verts dans la version en ligne du tableau) indiquent une taille d’effet seuil suggérée (1≤) et la taille de l’échantillon pour chaque paramètre sur chaque dose d’isoprotérénol. dP/dtmin: Minimum dP/dt ; dP/dtmax: Maximum dP/dt. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Ici, nous fournissons un protocole pour analyser la fonction cardiaque in vivo chez les souris sous stimulation β-adrénergique croissante. La procédure peut être utilisée pour traiter à la fois les paramètres de base de la fonction cardiaque et la réserve adrénergique (par exemple, l’inotropie et la chronotropie) chez les souris génétiquement modifiées ou lors d’interventions. L’avantage le plus important des mesures en boucle pression-volume (PVL) par rapport à d’autres moyens de déterminer la fonction cardiaque est l’analyse de la fonction cardiaque intrinsèque, indépendante de la charge. Toutes les autres méthodes (p. ex., IRM et échocardiographie) ne peuvent évaluer que les paramètres dépendants de la charge de la fonction cardiaque et en particulier la contractilité cardiaque ne peuvent pas être déterminées de manière fiable. Cela fait des mesures PVL l’étalon-or pour les mesures de point final de l’analyse approfondie de la fonction cardiaque5. Cependant, les méthodes nommées précédemment permettent une analyse séquentielle de la fonction cardiaque, ce qui les place au premier plan pour les observations longitudinales (par exemple, pendant la progression de la maladie). En outre, les volumes intraventriculaires, puis le volume de l’AVC et d’autres paramètres dérivés, peuvent être sous-estimés dans les mesures PVL par rapport à l’IRM chez la souris20.
Il y a quatre étapes critiques au cours du protocole qui sont cruciales pour obtenir des données PVL valides: 1) Intubation, 2) placement du cathéter veineux fémoral, 3) placement du cathéter pression-conductance et 4) régime périprocédural. L’intubation non invasive de souris nécessite une certaine expérience et est compliquée lors de l’utilisation de l’isoflurane car le délai d’intubation est étroit (20 à 40 s). Ainsi, après l’intubation, la mise en place correcte du tube doit être soigneusement vérifiée en examinant les mouvements de la poitrine murine lors de la modification de la fréquence respiratoire des ventilateurs. Pour élargir la fenêtre d’intubation, nous avons décrit ici l’utilisation concomitante de l’étomidate hypnotique à courte durée d’action. De plus, des fibres légères pour faciliter la visualisation de la glotte sont disponibles16. Un placement approprié du cathéter veineux fémoral est essentiel pour l’application d’isoprotérénol aux stades ultérieurs. Au cours de cette étape, l’embolie aérienne peut nuire gravement aux animaux induisant une embolie pulmonaire. La mise en place correcte du cathéter fémoral peut d’abord être vérifiée par une aspiration minutieuse du sang veineux. Lorsque la mise en place correcte du cathéter est incertaine au cours des étapes ultérieures, le volume diastolique final peut être examiné, ce qui devrait augmenter en réponse au moindre bolus lors de la visualisation de PVL en ligne. Contrairement à la plupart des autres chercheurs, nous décrivons ici la canulation de la veine fémorale, alors que d’autres utilisaient le plus souvent la veine jugulaire comme vaisseau cible pour l’accès veineux central12,21. Cette approche a l’avantage de ne pas manipuler près du nerf vagal, comme cela se fait dans l’approche de la poitrine fermée lorsque la carotide est préparée, et donc nous supposons que la stimulation potentielle du système parasympathique en touchant / endommageant simplement le nerf est évitée. Un placement approprié du cathéter PV dans le ventricule est crucial pour obtenir des données significatives, en particulier en ce qui concerne les paramètres de volume. Lorsque les électrodes ne sont pas complètement à l’intérieur du ventricule ou que le cathéter n’est pas correctement placé le long de l’axe longitudinal du ventricule, les paramètres de volume sont fortement sous-estimés. De plus, le contact entre l’endocarde et le transducteur de pression provoque des pics de pression systolique terminale qui ne doivent pas être tolérés lors des mesures de base6. Enfin, le régime périprocédural incluant la profondeur de l’anesthésie et la gestion des fluides a un impact significatif sur la fiabilité des données PVL chez la souris. Le sous-dosage anesthésique ou le surdosage peut affecter gravement les paramètres hémodynamiques, entraînant le plus souvent une réduction de la fonction cardiaque. La perte de liquide, qui est principalement due à la perte de sang et à l’évaporation, doit être contrée par l’infusion constante de solutions appropriées telles que l’albumine à 12,5% dissoute dans du NaCl à 0,9%, que nous recommandons. Étant donné que l’approche est très invasive, l’inclusion d’un analgésique puissant comme la buprénorphine pour minimiser les influences sur les fonctions cardiovasculaires évoquées par un évitement insuffisant de la douleur n’est pas moins importante. Nous injectons le médicament analgésique avant l’intubation. Il est important d’effectuer l’injection ~ 30 minutes avant de commencer toute la procédure, surtout si l’opérateur est expérimenté, et donc rapide, afin d’obtenir un effet analgésique approprié en évitant toute douleur pendant la phase d’investigation. De plus, lorsque vous travaillez avec des modèles obèses, des doses plus élevées doivent probablement être envisagées en raison de la lipophilie élevée de cette substance. Enfin, ce protocole peut également être modifié pour déterminer la réponse à d’autres stimuli catécholaminergiques tels que la dobutamine ou l’épinéphrine; comme par exemple fait par Calligaris et ses collègues22 qui ont décrit l’analyse de la pression intraventriculaire lors de la stimulation par la dobutamine.
En ce qui concerne l’enregistrement et l’analyse des mesures PVL, plusieurs étapes doivent être prises en compte. Tout d’abord, il est extrêmement important d’analyser de manière cohérente les enregistrements PVL à travers un ensemble de données expérimentales. Les artefacts respiratoires qui évoluent en raison de l’alternance de la pression pulmonaire entraînant une précharge cardiaque alternée pendant la ventilation mécanique doivent être évités en éteignant le ventilateur pendant les enregistrements. Pour éliminer davantage les artefacts respiratoires, nous recommandons d’utiliser le pancuronium relaxant musculaire afin de prévenir les contractions du diaphragme qui sont fréquemment observées lors de l’anesthésie à l’isoflurane. De plus, il est possible d’arrêter la ventilation à la fin de l’expiration et d’analyser toutes les boucles sélectionnées, contrairement à d’autres protocoles recommandant de sélectionner 8 à 10 boucles puis d’identifier 5 à 6 boucles expiratoires finales qui sont ensuite analysées23. Il est important de noter que les périodes d’apnée doivent être courtes pour éviter une hypoventilation entraînant une hypercapnie et une acidose respiratoire. Pour améliorer l’oxygénation et prévenir la formation d’atélectasie, nous avons précédemment examiné l’utilisation de la ventilation PEEP lors des mesures PVL chez la souris6. Lors de la sélection de boucles pour l’analyse de données indépendantes de la précharge, sélectionnez les 5 à 6 premières boucles montrant un volume diastolique final décroissant et évitez d’inclure des boucles où seule la pression diminue, mais le volume est constant. En outre, les battements supplémentaires ne doivent pas être inclus dans l’analyse, car ils affectent de manière cruciale les paramètres PVL. Remarquablement, le plus souvent, des battements arythmiques se produisent en raison du contact entre la suture d’occlusion et le cœur murin. L’étalonnage pour la conductance parallèle par perfusion de solution saline hypertonique a un impact énorme sur les paramètres de la fonction cardiaque et devrait, à notre connaissance, être effectué à la fin d’une expérience6. Notamment, en raison de son impact sur la fonction cardiaque, l’étalonnage de la conductance parallèle n’est effectué qu’une seule fois au cours du protocole. Cependant, la conductance parallèle change légèrement au cours du protocole, en raison de changements dans la forme des ventricules lors de la stimulation adrénergique. Il existe des systèmes d’admission pour les évaluations PVL chez la souris qui n’ont pas besoin d’étalonnages salins et peuvent calculer dynamiquement la conductance parallèle tout au long des enregistrements PVL. Cependant, l’exactitude de cette méthode est encore en débat5,8,24,25.
Nous avons déterminé à partir de nos observations que lors de l’utilisation de ce protocole chez des souris mâles adultes de type sauvage en bonne santé (c.-à-d. C57Bl6/N), la pression systolique est comprise entre 70 mmHg et 90 mmHg au départ et entre 80 et 100 mmHg lors d’une stimulation maximale avec l’agoniste agoniste β-adrénorécepteur isoprotérénol. De même, on a observé que le volume de l’AVC se situait entre 13 μL et 20 μL au départ et entre 20 μL et 35 μL pendant la stimulation maximale. La fréquence cardiaque était d’environ 450 à 520 battements par minute au départ et peut bien dépasser 650 battements par minute pendant la stimulation maximale. En ce qui concerne la contractilité cardiaque indépendante de la précharge, le travail d’AVC recrutable par précharge (PRSW) le plus robuste a été considéré comme adéquat entre 60 mmHg et 80 mmHg au départ et entre 100 mmHg et 140 mmHg pendant la stimulation maximale. Si les paramètres de base divergent considérablement de ceux habituellement obtenus, ou lorsque la fonction cardiaque réagit de manière inappropriée à la stimulation β-adrénergique, des complications (par exemple, perte de sang non observée, chute / augmentation de la température corporelle ou sur / sous dose anesthésique) doivent être prises en considération.
De plus, certains artefacts peuvent survenir lors des mesures PVL chez la souris. L’artefact le plus courant est le pic de pression systolique terminale (ESPS, Figure 2C),qui résulte du piégeage du cathéter et il est facilement rectifiable en repositionnant le cathéter avant les mesures basales à 0 ng / min isoprotérénol. Les mesures ne doivent pas commencer avant que les ESPS ne soient éradiqués dans les conditions initiales afin d’obtenir des données significatives, car l’ESPS peut affecter plusieurs paramètres de la fonction cardiaque6. Cependant, lorsqu’un ESPS se produit lors d’une stimulation incrémentielle avec de l’isoprotérénol en raison d’une morphologie ventriculaire altérée dans des mesures non affectées au départ, cela n’est pas rectifiable, car le repositionnement du cathéter modifierait la conductance parallèle pendant le protocole dose-réponse. Il faut examiner cela de près, car, de même que ceux de base, il a été démontré que ces ESPS modifient de manière significative les paramètres de la fonction cardiaque non seulement par une pression maximale significativement accrue13,26, mais également par une détection de volume réduite6.
Les valeurs représentatives des paramètres hémodynamiques obtenus par des mesures PVL dans des conditions de base et lors d’une stimulation incrémentielle avec de l’isoprotérénol chez la souris varient considérablement selon les différentes approches méthodologiques et dans différentes souches de souris27,28. Au-delà de cela, il faut savoir que les phénotypes de souris génétiquement modifiées peuvent également être limités à des antécédents génétiques distincts. Sur le plan méthodologique, il existe deux approches primordiales pour effectuer une analyse pression-volume chez la souris. Chaque méthode a ses (dés)avantages et la méthode de choix dépend souvent des expériences du laboratoire et de ses chercheurs. Nous nous concentrons ici sur la procédure de poitrine ouverte, dans laquelle le cathéter est placé via une ponction sur l’apex. Cette approche a l’avancement de la mise en place du cathéter sous vision qui permet un positionnement précis du cathéter, un prédicteur essentiel pour l’enregistrement de données significatives sur la fonction cardiaque chez la souris. Cela est particulièrement vrai pour l’enregistrement des paramètres de volume dans la gamme des microlitres. En revanche, un aspect critique de cette approche est la perte de pressions physiologiques intra-thoraciques, entraînant l’effondrement des poumons et la formation d’atélectase et une perte plus élevée de liquide corporel. Cependant, en utilisant la ventilation par pression expiratoire positive (PEEP), nous décrivons ici une stratégie qui s’est avérée contrer les dommages pulmonaires lors de la PVL à poitrine ouverte chez la souris6. La deuxième approche expérimentale consiste à insérer le cathéter via l’artère carotide, puis rétrogradement à travers la valve aortique. En utilisant cette technique, les pressions intra-thoraciques peuvent être maintenues plutôt normales, bien qu’une ventilation mécanique soit toujours nécessaire, ce qui affaiblit cet avantage. De plus, l’approche de la poitrine fermée limite les possibilités des investigateurs pour un positionnement précis du cathéter. De plus, les cathéters PV utilisés chez la souris ont des diamètres allant de 1 à 1,4 Français (0,33 mm à 0,47 mm), ce qui implique une obstruction significative du tractus d’écoulement murin lors de l’utilisation de l’approche à poitrine fermée, car les aortes des souris adultes ont généralement des diamètres compris entre 0,8 mm et 1,2 mm29,30. En ce qui concerne l’utilisation de la PVL dans les modèles d’insuffisance cardiaque, l’approche de la poitrine ouverte est particulièrement importante pour les modèles de constriction aortique transversale, où la constriction est située entre l’artère innominate et l’artère carotide gauche. Ici, le cathéter ne peut pas être placé via l’artère carotide. D’autre part, l’approche de la poitrine fermée est intéressante pour les chercheurs qui étudient des modèles murins de ventricules dilatés, comme après l’induction d’un infarctus du myocarde, où la ponction de l’apex n’est pas réalisable.
Déclarations de divulgation
Aucun conflit d’intérêts ne doit être déclaré.
Remerciements
Nous remercions Manuela Ritzal, Hans-Peter Gensheimer, Christin Richter et l’équipe de l’Interfakultäre Biomedizinische Forschungseinrichtung (IBF) de l’Université de Heidelberg pour leur assistance technique experte.
Ce travail a été soutenu par le DZHK (Centre allemand pour la recherche cardiovasculaire), le BMBF (ministère allemand de l’Éducation et de la Recherche), un fonds d’innovation de l’État fédéral du Bade-Wurtemberg et la Deutsche Forschungsgemeinschaft (DFG, Fondation allemande pour la recherche) Project-ID 239283807 - TRR 152, FOR 2289 et le Centre de recherche collaborative (SFB) 1118.
matériels
| Name | Company | Catalog Number | Comments |
| 1.4F SPR-839 catheter | Millar Instruments, USA | 840-8111 | |
| 1 ml syringes | Beckton Dickinson, USA | REF303172 | |
| Bio Amplifier | ADInstruments, USA | FE231 | |
| Bridge-Amplifier | ADInstruments, USA | FE221 | |
| Bovine Serum Albumin | Roth, Germany | 8076.2 | |
| Buprenorphine hydrochloride | Bayer, Germany | 4007221026402 | |
| Calibration cuvette | Millar, USA | 910-1049 | |
| Differential pressure transducer MPX | Hugo Sachs Elektronik- Harvard Apparatus, Germany | Type 39912 | |
| Dumont Forceps #5/45 | Fine Science tools Inc. | 11251-35 | |
| Dumont Forceps #7B | Fine Science tools Inc. | 11270-20 | |
| Graefe Forceps | Fine Science tools Inc. | 11051-10 | |
| GraphPad Prism | GraphPad Software | Ver. 8.3.0 | |
| EcoLab-PE-Micotube | Smiths, USA | 004/310/168-1 | |
| Etomidate Lipuro | Braun, Germany | 2064006 | |
| Excel | Microsoft | ||
| Heparin | Ratiopharm, Germany | R26881 | |
| Hot plate and control unit | Labotec, Germany | Hot Plate 062 | |
| Isofluran | Baxter, Germany | HDG9623 | |
| Isofluran Vaporizer | Abbot | Vapor 19.3 | |
| Isoprenalinhydrochloride | Sigma-Aldrich, USA | I5627 | |
| Fine Bore Polythene tubing 0.61 mm OD, 0.28 mm ID | Smiths Medical International Ltd, UK | Ref. 800/100/100 | |
| MiniVent ventilator for mice | Hugo Sachs Elektronik- Harvard Apparatus, Germany | Type 845 | |
| MPVS Ultra PVL System | Millar Instruments, USA | ||
| NaCl | AppliChem, Germany | A3597 | |
| NaCl 0.9% isotonic | Braun, Germany | 2350748 | |
| Pancuronium-bromide | Sigma-Aldrich, USA | BCBQ8230V | |
| Perfusor 11 Plus | Harvard Apparatus | Nr. 70-2209 | |
| Powerlab 4/35 control unit | ADInstruments, USA | PL3504 | |
| Rechargeable cautery-Set | Faromed, Germany | 09-605 | |
| Scissors | Fine Science tools Inc. | 140094-11 | |
| Software LabChart 7 Pro | ADInstruments, USA | LabChart 7.3 Pro | |
| Standard mouse food | LASvendi GmbH, Germany | Rod18 | |
| Stereo microscope | Zeiss, Germany | Stemi 508 | |
| Surgical suture 8/0 | Suprama, Germany | Ch.B.03120X | |
| Venipuncture-cannula Venflon Pro Safty 20-gauge | Beckton Dickinson, USA | 393224 | |
| Vessel Cannulation Forceps | Fine Science tools Inc. | 00574-11 | |
| Water bath | Thermo Fisher Scientific, USA | ||
| Syringe filter (Filtropur S 0.45) | Sarstedt, Germany | Ref. 83.1826 |
Références
- Bacmeister, L., et al. Inflammation and fibrosis in murine models of heart failure. Basic Research in Cardiology. 114 (3), 19 (2019).
- Hartupee, J., Mann, D. L. Neurohormonal activation in heart failure with reduced ejection fraction. Nature Reviews Cardiology. 14 (1), 30-38 (2017).
- Hasenfuss, G. Animal models of human cardiovascular disease, heart failure and hypertrophy. Cardiovascular Research. 39 (1), 60-76 (1998).
- Lefkowitz, R. J., Rockman, H. A., Koch, W. J. Catecholamines, cardiac beta-adrenergic receptors, and heart failure. Circulation. 101 (14), 1634-1637 (2000).
- Cingolani, O. H. K. Pressure-volume relation analysis of mouse ventricular function. The American Journal of Physiology-Heart and Circulatory Physiology. 301, 2198-2206 (2011).
- Bacmeister, L., et al. Assessment of PEEP-Ventilation and the Time Point of Parallel-Conductance Determination for Pressure-Volume Analysis Under beta-Adrenergic Stimulation in Mice. Frontiers in Cardiovascular Medicine. 6, 36 (2019).
- Segin, S., et al. Cardiomyocyte-Specific Deletion of Orai1 Reveals Its Protective Role in Angiotensin-II-Induced Pathological Cardiac Remodeling. Cells. 9 (5), (2020).
- Clark, J. E., Marber, M. S. Advancements in pressure-volume catheter technology - stress remodelling after infarction. Experimental Physiology. 98 (3), 614-621 (2013).
- Glower, D. D., et al. Linearity of the Frank-Starling relationship in the intact heart: the concept of preload recruitable stroke work. Circulation. 71 (5), 994-1009 (1985).
- Winter, E. M., et al. Left ventricular function in the post-infarct failing mouse heart by magnetic resonance imaging and conductance catheter: a comparative analysis. Acta Physiologica. 194 (2), 111-122 (2008).
- Krenz, M. Conductance, admittance, and hypertonic saline: should we take ventricular volume measurements with a grain of salt. Journal of Applied Physiology. 107 (6), 1683-1684 (2009).
- Pacher, P., Nagayama, T., Mukhopadhyay, P., Batkai, S., Kass, D. A. Measurement of cardiac function using pressure-volume conductance catheter technique in mice and rats. Nature Protocols. 3 (9), 1422-1434 (2008).
- Wei, A. E., Maslov, M. Y., Pezone, M. J., Edelman, E. R., Lovich, M. A. Use of pressure-volume conductance catheters in real-time cardiovascular experimentation. Heart, Lung and Circulation. 23 (11), 1059-1069 (2014).
- van Hout, G. P., et al. Admittance-based Pressure-Volume Loops versus gold standard cardiac magnetic resonance imaging in a porcine model of myocardial infarction. Physiological Reports. 2 (4), 00287 (2014).
- Wei, C. L., Shih, M. H. Calibration Capacity of the Conductance-to-Volume Conversion Equations for the Mouse Conductance Catheter Measurement System. IEEE Transactions on Biomedical Engineering. 56 (6), 1627-1634 (2009).
- Das, S., MacDonald, K., Chang, H. Y., Mitzner, W. A simple method of mouse lung intubation. Journal of Visualized Experiments. (73), e50318 (2013).
- Faul, F., Erdfelder, E., Lang, A. G., Buchner, A. G*Power 3: a flexible statistical power analysis program for the social, behavioral, and biomedical sciences. Behavior Research Methods. 39 (2), 175-191 (2007).
- Weiss, J. L., Frederiksen, J. W., Weisfeldt, M. L. Hemodynamic determinants of the time-course of fall in canine left ventricular pressure. Journal of Clinical Investigation. 58 (3), 751-760 (1976).
- Faul, F., Erdfelder, E., Lang, A. G., Buchner, A. G*Power 3: a flexible statistical power analysis program for the social, behavioral, and biomedical sciences. Behavioral Research Methods. 39 (2), 175-191 (2007).
- Jacoby, C., et al. Direct comparison of magnetic resonance imaging and conductance microcatheter in the evaluation of left ventricular function in mice. Basic Research in Cardiology. 101 (1), 87-95 (2006).
- Georgakopoulos, D., Kass, D. A. Estimation of parallel conductance by dual-frequency conductance catheter in mice. The American Journal of Physiology-Heart and Circulatory Physiology. 279 (1), 443-450 (2000).
- Calligaris, S. D., Ricca, M., Conget, P. Cardiac stress test induced by dobutamine and monitored by cardiac catheterization in mice. Journal of Visualized Experiments. (72), e50050 (2013).
- Abraham, D., Mao, L. Cardiac Pressure-Volume Loop Analysis Using Conductance Catheters in Mice. Journal of Visualized Experiments. (103), e52942 (2015).
- Pearce, J. A., Porterfield, J. E., Larson, E. R., Valvano, J. W., Feldman, M. D. Accuracy considerations in catheter based estimation of left ventricular volume. Conference proceedings - IEEE engineering in medicine and biology society. 2010, 3556-3558 (2010).
- Nielsen, J. M., et al. Left ventricular volume measurement in mice by conductance catheter: evaluation and optimization of calibration. The American Journal of Physiology-Heart and Circulatory Physiology. 293 (1), 534-540 (2007).
- Townsend, D. Measuring Pressure Volume Loops in the Mouse. Journal of Visualized Experiments. (111), e53810 (2016).
- Barnabei, M. S., Palpant, N. J., Metzger, J. M. Influence of genetic background on ex vivo and in vivo cardiac function in several commonly used inbred mouse strains. Physiological Genomics. 42 (2), 103-113 (2010).
- Oosterlinck, W., Vanderper, A., Flameng, W., Herijgers, P. Glucose tolerance and left ventricular pressure-volume relationships in frequently used mouse strains. Journal of Biomedicine and Biotechnology. 2011, 281312 (2011).
- Guo, X., Kono, Y., Mattrey, R., Kassab, G. S. Morphometry and strain distribution of the C57BL/6 mouse aorta. The American Journal of Physiology-Heart and Circulatory Physiology. 283 (5), 1829-1837 (2002).
- Weiss, R. M., Ohashi, M., Miller, J. D., Young, S. G., Heistad, D. D. Calcific aortic valve stenosis in old hypercholesterolemic mice. Circulation. 114 (19), 2065-2069 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon