Method Article
Progettazione di microplot e preparazione di campioni di piante e suolo per 15Analisi dell'azoto
In questo articolo
Riepilogo
Un progetto di microplotcrolo per la ricerca di 15N tracciante è descritto per ospitare più eventi di campionamento di piante e terreni in stagione. Per l'analisi di 15N, vengono messe avanti le procedure di raccolta e lavorazione dei campioni di suolo e impianti, compresi i protocolli di macinazione e pesatura.
Abstract
Molti studi sui fertilizzanti azotati valutano l'effetto complessivo di un trattamento sulle misurazioni di fine stagione, come la resa del grano o le perdite cumulative n. Un approccio isotopo stabile è necessario per seguire e quantificare il destino del fertilizzante derivato N (FDN) attraverso il sistema di coltura del suolo. Lo scopo di questo documento è quello di descrivere un progetto di ricerca di piccole trame che utilizza microtravi arricchite non confinate 15N per eventi multipli di campionamento del suolo e dell'impianto in due stagioni di crescita e fornire protocolli di raccolta, movimentazione e lavorazione dei campioni per l'analisi totale di 15N. I metodi sono stati dimostrati utilizzando uno studio replicato dal Minnesota centro-meridionale piantato al mais(zea mays L.). Ogni trattamento consisteva in sei file di mais (76 cm a spaziatura righe) lunghi 15,2 m con un microplot (2,4 m x 3,8 m) incorporato ad un'estremità. L'urea di grado fertilizzante è stata applicata a 135 kg N∙ha-1 durante la semina, mentre la microtrama ha ricevuto urea arricchita a 5 atomi % 15N. Campioni di suolo e piante sono stati prelevati più volte durante la stagione di crescita, facendo attenzione a ridurre al minimo l'uso di strumenti separati e separando fisicamente campioni non arricchiti e arricchiti durante tutte le procedure. I campioni di suolo e piante sono stati essiccati, macinati per passare attraverso uno schermo da 2 mm, e poi macinati ad una consistenza simile alla farina utilizzando un mulino a rulli. Gli studi di tracciamento richiedono una pianificazione aggiuntiva, il tempo di elaborazione del campione e il lavoro manuale e comportano costi più elevati per 15N materiali arricchiti e analisi dei campioni rispetto agli studi N tradizionali. Tuttavia, utilizzando l'approccio del bilancio di massa, gli studi di tracciamento con più eventi di campionamento in-season consentono al ricercatore di stimare la distribuzione FDN attraverso il sistema di coltura del suolo e di stimare FDN non contabilizzato dal sistema.
Introduzione
L'uso di azoto fertilizzante (N) è essenziale in agricoltura per soddisfare le esigenze alimentari, fibre, mangimi e di carburante di una popolazione globale in crescita, ma le perdite n dai campi agricoli possono avere un impatto negativo sulla qualità ambientale. Poiché N subisce molte trasformazioni nel sistema di coltura del suolo, una migliore comprensione del ciclo N, dell'utilizzo delle colture e del destino complessivo dei fertilizzanti N sono necessari per migliorare le pratiche di gestione che promuovono l'efficienza dell'uso N e riducono al minimo le perdite ambientali. Gli studi tradizionali sui fertilizzanti N si concentrano principalmente sull'effetto di un trattamento sulle misurazioni di fine stagione come la resa delle colture, l'assorbimento di N rispetto al tasso N applicato (efficienza apparente dell'uso del fertilizzante) e il suolo residuo N. Mentre questi studi quantificano gli ingressi, le uscite e le efficienze del sistema complessivo N, non possono identificare né quantificare N nel sistema di coltura del suolo derivato da fonti di fertilizzanti o dal suolo. Un approccio diverso che utilizza isotopi stabili deve essere utilizzato per tracciare e quantificare il destino dei fertilizzanti derivati da N (FDN) nel sistema di coltura del suolo.
L'azoto ha due isotopi stabili, 14N e 15N, che si verificano in natura ad un rapporto relativamente costante di 272:1 per 14N/15N1 (concentrazione di 0,366 atom % 15N o 3600 ppm 15N2,3). L'aggiunta di 15fertilizzanti arricchiti N aumenta il totale di 15N contenuto del sistema del suolo. Come 15N arricchito miscele di fertilizzante con terreno non arricchito N, il cambiamento misurato di 14N /15N rapporto permette ai ricercatori di tracciare FDN nel profilo del suolo e nel raccolto3,4. Un bilancio di massa può essere calcolato misurando la quantità totale di 15N tracciante nel sistema e ciascuna delle sue parti2. Poiché 15fertilizzanti arricchiti N sono significativamente più costosi dei fertilizzanti convenzionali, 15microtrafele arricchite n sono spesso incorporate all'interno dei lotti di trattamento. Lo scopo di questo documento sui metodi è quello di descrivere un progetto di ricerca di piccole trame che utilizza microplots per più eventi di campionamento del suolo e delle piante in stagione per il mais(ea mays L.) e di presentare protocolli per la preparazione di campioni di piante e suolo per un totale di 15N analisi. Questi risultati possono quindi essere utilizzati per stimare l'efficienza dell'uso di N fertilizzanti e creare un bilancio N parziale che tiene contabilizzato l'FDN nel suolo sfuso e nel raccolto.
Protocollo
1. Descrizione del sito sul campo
NOTA: quando si eseguono 15N prove sul campo tracciante, i siti selezionati dovrebbero ridurre al minimo le variazioni dovute al suolo, alla topografia e alle caratteristiche fisiche5. La contaminazione incrociata può verificarsi in seguito al movimento laterale del suolo a causa della traslocazione di pendenze, vento o acqua, o di una lavorazione mentre la distribuzione verticale del suolo N può essere influenzata dal flusso dell'acqua del sottosuolo e dal drenaggio delle piastrelle6.
- Descrivere il sito sperimentale sul campo, compresa la gestione passata (ad esempio, colture e lavorazioni precedenti), la latitudine e longitudine, le proprietà fisiche e chimiche del suolo (ad esempio, l'analisi strutturale del suolo, le condizioni di fertilità iniziali, il pH e la densità delle fusi e monetari del suolo).
- Registrare le coordinate GPS per il sito di ricerca e gli angoli del campo.
- Descrivere la gestione della stagione in crescita, tra cui la gestione di parassiti e malattie (erbicida, insetticida o uso di fungicidi), la gestione della fertilità del suolo (compreso il tasso, la fonte, il posizionamento e la tempistica delle applicazioni), la coltivazione, gli eventi e gli importi di irrigazione e la gestione dei residui.
- Poiché la crescita delle colture e le trasformazioni N mediate da microbi sono influenzate dall'umidità del suolo, dalla temperatura del suolo e dalla temperatura dell'aria, registra le informazioni climatiche, tra cui temperature elevate e basse giornaliere, precipitazioni giornaliere, umidità e temperature del suolo a diverse profondità che riflettono le profondità di campionamento del suolo.
2. Progettazione della trama
- Piantate sei file di mais (86.000 piante ha-1) su una spaziatura di 76 cm con una dimensione di trama finale di 15,2 m x 4,6 m.
- Stabilire aree di confine per 1,5 m da ciascuna estremità della dimensione longitudinalmente (0-1,5 m, 13,7-15,2 m) e un'area di confine aggiuntiva lunga 1,5 m (9,8-11,3 m) adiacente alle aree di campionamento e raccolta (Figura 1).
- Designare le file 2 e 3 come area di campionamento di piante e terreni in stagione (1,5-9,8 m) e le file 4 e 5 come area di raccolta (1,5-9,8 m) per la resa del grano di mais.
- Stabilire un'area di microplotto (11,3-13,7 m) con dimensioni di 2,4 m per 3,8 m centrata sulla dimensione della larghezza. Raccogliere tutti i campioni di piante e terreni arricchiti da 15N da quest'area, lasciando 0,38 m di bordo non campionato sulle dimensioni di lunghezza e larghezza per ridurre al minimo gli effetti del bordo (Figura 2).
- Delineare la trama di trattamento e angoli microtrama con diverse bandiere colorate.
3. Precauzioni per campioni di suolo e piante
- Utilizzare attrezzature dedicate e aree di lavorazione per materiali non arricchiti e arricchiti. La contaminazione di materiali non arricchiti (fertilizzante, suolo o pianta) da materiali arricchiti e viceversa può influenzare drasticamente i risultati.
- Raccogliere ed elaborare 15n di terreno arricchito e campioni di piante in ordine di arricchimento previsto da 15N dal più basso al più alto per ridurre al minimo la contaminazione incrociata. Assicurarsi che superfici di lavoro, guanti, utensili e macchinari siano accuratamente puliti tra ogni campione per ridurre al minimo la contaminazione incrociata dal riporto del campione.
- Ridurre al minimo il traffico pedonale nelle microtravi per evitare la contaminazione di aree di campionamento non arricchite. Indossare rivestimenti protettivi per le scarpe quando si accede amicroplot e rimuoverli all'uscita dall'area del microplotto.
4. Preparazione e applicazione di fertilizzanti arricchiti da 15N
- Seguendo le linee guida formulate dagli studi Ref. 2 per l'efficienza dell'uso dei 15N (F15NUE) diluire 10 atom % 15N di urea arricchita a 5 atom % 15N e sciogliere in 2 L di acqua dionizzata per garantire l'arricchimento uniforme del fertilizzante per urea.
NOTA: La concentrazione richiesta di 15n arricchito fertilizzante dipende dagli obiettivi dello studio agronomico. Se la concentrazione di fertilizzante arricchito di stock 15N supera il fabbisogno del ricercatore, la concentrazione di fertilizzante di riserva può essere diluita con fertilizzante convenzionale simile utilizzando la seguente formula3.
X2 - [(C1/C2) - 1] X1
X2 è la massa del fertilizzante convenzionale non arricchito, X1 è la massa del fertilizzante tracciante, C1 è la concentrazione isotopica [espressa come atomo % in eccesso (atomo misurato % arricchimento meno la concentrazione di fondo naturale assumente 0.3663 atom %)] del fertilizzante tracciante originale, e C2 è la concentrazione isotopica della miscela finale. Ad esempio, dato 100 g di 10 atomi di urea arricchita, sarebbero necessari 92,7 g di fertilizzante convenzionale non arricchito per una concentrazione isotopica finale di 5 atomo %;
X2 : [(10-0.3663)/5] - 1 - Analizzare la soluzione per 15N concentrazione per verificare l'arricchimento. Gli autori hanno utilizzato i servizi analitici forniti da UC Davis Stable Isotope Facility.
NOTA: Le reazioni del regime suolo-pianta-microbo alle aggiunte di fertilizzanti possono essere influenzate dalla forma fisica di fertilizzante. A seconda degli obiettivi dello studio, la soluzione urea può essere applicata come liquido o disidratata per riformare i cristalli. I cristalli possono essere compattati in una torta utilizzando una pressa Carver a 10.000 psi, seguita dalla frantumazione della torta e dallo screening delle particelle alla dimensione desiderata3. - Applicare uniformemente le soluzioni di urea arricchite 15N alle microtravi che utilizzano uno spruzzatore CO2 dello zaino calibrato (Figura 3A). Se vengono utilizzati più tassi di N o livelli di arricchimento, prendere in considerazione l'utilizzo di spruzzatori di CO2 designati per ogni livello di arricchimento o utilizzare un singolo spruzzatore e applicare soluzioni dal più basso al più alto arricchimento per ridurre al minimo il trattamento cross-contaminazione.
- Incorporare fertilizzanti contenenti urea con la coltivazione leggera, rastrelli a mano o almeno 0,6 cm di irrigazione entro 24 h di applicazione per ridurre al minimo il potenziale di perdita di volatilità.
- Non al microplotto viene applicato alcun concime di urea arricchito da 15N aggiuntivo durante la seconda stagione di crescita. Applicare l'urea convenzionale non arricchita all'intero trattamento per evitare una risposta differenziale nella crescita del mais a causa dell'azoto.
5. Elaborazione dei campioni di campo: biomassa del mais in superficie
- In ogni fase di campionamento, raccogliere un campione composito di pianta di mais di sei mais dall'interno dell'area di campionamento (15N non arricchita) e un campione composito di pianta di mais di sei mais di superficie dal microplotto arricchito 15N. Almeno due piante dovrebbero separare ogni pianta campionata per evitare di alterare significativamente la dinamica di crescita delle piante. Gli autori hanno raccolto campioni di piante nelle fasi di sviluppo fisiologico del mais V8 e R11 e alla maturità fisiologica (Figura 2).
- Seguendo i principi descritti nei passaggi 3.1 e 3.2, tagliare V8 e R1 sopra la biomassa (5 cm per 5 cm); una cippatrice da cantiere è un'opzione soddisfacente. Mettere la biomassa tritata in tessuto etichettato o sacchetti di carta e asciugare in un forno ad aria forzata a 60 gradi fino a massa costante. Registrare il peso secco della biomassa (Figura 3B).
- Partizione piante di mais fisiologicamente mature in stover (tutti i tessuti vegetativi tra cui foglie, bucce e gambi), grano, e frazioni di pannocchia. Tritare e asciugare in forno ad aria forzata a 60 gradi centigradi fino alla massa costante. Registrare il peso secco della biomassa.
- All'interno del microplot, tagliare tutti i gambi di mais sulla superficie del suolo, legare in un fascio, etichetta in base alla trama, e rimuovere dal campo (Figura 3C). Regolare le bandiere degli angoli di microplotto per essere quasi a filo con la superficie del suolo per ridurre al minimo il rischio di rimozione dalla mietitrebbia durante il raccolto o la lavorazione dopo la raccolta.
- Raccogliere il grano dalla zona di raccolta e riportare la resa al 15,5% di contenuto di umidità12. Raccogliere le aree di ricerca rimanenti con un grafico.
- Rastrella biomassa non arricchita da fuori dall'area del microplotto. Tritare e riapplicare la microbiomassa in superficie al grafico corretto (Figura 3D).
- Incorporare i residui nella superficie del suolo con la coltivazione previa attenzione a ridurre al minimo il trasporto del suolo e dei residui di mais all'interno o all'esterno dell'area del microplotto. Sostituire eventuali bandiere d'angolo di microtrama rimosse a causa della lavorazione.
- Piantare mais del secondo anno sulle stesse file del mais del primo anno.
- Raccogliere la biomassa del mais del secondo anno sopra il suolo solo a maturità fisiologica ed elaborare come campioni di mais del primo anno, come descritto nel passaggio 5.3. Raccogliere campioni di microlotto dal centro dell'area di microplotto (1,52 m per 0,76 m) per evitare qualsiasi potenziale diluizione del segnale dopo la lavorazione (Figura 2). Raccogliere il grano dalla zona di raccolta e riportare la resa al 15,5% di contenuto di umidità.
- Seguendo i principi dei passaggi 3.1 e 3.2, mescolare accuratamente e macinare da 100 a 200 g di materiale vegetale essiccato per passare attraverso un setaccio di 2 mm. Mescolare accuratamente il materiale di terra e conservare un sottocampione in una busta di moneta etichettata per un'ulteriore elaborazione.
NOTA: Un mulino Thomas Wiley è un'opzione soddisfacente per la macinazione dei tessuti delle piante, mentre un pernito mulino da laboratorio 3610 è un'opzione soddisfacente per la macinazione del grano.
AGGIORNAMENTO: Le persone che macinano campioni di impianti devono indossare protezione dell'orecchio ed essere protetti dall'inalazione di polvere indossando un Istituto nazionale per la sicurezza e la salute sul lavoro approvato N95 Particulate Filtering Facepiece Respirator.
6. Elaborazione del campione di campo: suolo
- Raccogliere campioni di suolo del primo anno 8 giorni dopo l'applicazione di fertilizzanti arricchiti 15N, V8, R1 e post-raccolta prima della lavorazione. Raccogliere campioni di suolo del secondo anno in pre-impianto e post-raccolta. A causa dei vincoli logistici di campionamento, gli autori hanno raccolto campioni di suolo in stagione da 0 a 15, 15- a 30-, e da 30 a 60 cm di profondità, campioni di terreno post-raccolta da 0 a 15, da 15 a 30, da 30 a 60, e da 60 a 90 cm di profondità, e campioni di suolo pre-impianto del secondo anno da 0 a 30, da 30 a 60, 60-120- di profondità.
NOTA: Se una sonda del suolo non è in grado di raccogliere un nucleo del suolo alla profondità desiderata più profonda come singolo nucleo, raccogliere nuclei di profondità più profondi dagli stessi fori di trivellazione delle profondità superiori che scartano i primi 1 cm del suolo per evitare la contaminazione dal suolo che cade dalle profondità superiori.- Raccogliere un campione di terreno composito a quattro core (1,8 cm di diametro) dall'area di campionamento non arricchita a V8 e R1 utilizzando una sonda a mano. Raccogliere un nucleo nella fila di mais e tre nuclei tra le file di mais.
- Raccogliere un campione di terreno composito a due nuclei (5 cm di diametro) dall'area di campionamento non arricchita durante la pre-impianto e il post-raccolta utilizzando una sonda idraulica.
- Raccogliere un campione di terreno composito di 15 core (1,8 cm di diametro) dall'area di microlotto 8 giorni dopo l'applicazione di fertilizzanti arricchiti 15N, V8 e R1 utilizzando una sonda a mano. Raccogliere da tre a quattro nuclei nella fila di mais e da 11 a 12 nuclei tra le file di mais.
NOTA: I suoli sono estremamente eterogenei. Il maggior numero di nuclei raccolti all'interno del microplotto arricchito fornisce una migliore stima del vero arricchimento di 15N del suolo N13. - Raccogliere un campione di terreno composito di tre nuclei (5 cm di diametro) dall'area di microplotpa durante la pre-impianto e il post-raccolta utilizzando una sonda idraulica.
- Omogeneizzare ogni campione di terreno composito in un secchio e metterlo in un sacchetto di carta pre-etichetta.
- Campioni di terreno secco a 35 gradi centigradi in un forno ad aria forzata fino alla massa costante. Macinare ogni campione per passare attraverso un setaccio di 2 mm. Una smerigliatrice meccanica del terreno è soddisfacente se può essere accuratamente pulita tra ogni campione.
NOTA: I campioni di suolo possono essere essiccati all'aria diffondendo campioni su vassoi in uno strato sottile. I vassoi devono trovarsi in un'area libera da contaminazione da fonti Esterne N. I campioni non arricchiti e arricchiti devono essere separati fisicamente per evitare la contaminazione incrociata.
INFORMATIVA: Le persone che macinano campioni di terreno devono indossare protezione dell'orecchio ed essere protette dall'inalazione di polvere indossando un Istituto nazionale per la sicurezza e la salute sul lavoro approvato N95 Particulate Filtering Facepiece Respirator.
7. Lavorazione dei campioni di laboratorio: macinare i campioni di terreno e piante
- Campioni di piante a secco (2 mm) durante la notte in forno a 60 gradi centigradi.
- Seguendo i principi descritti al punto 3, macinare campioni di piante essiccate o materiale del terreno per una consistenza fine e farina. Un mulino a rulli è un'opzione soddisfacente.
NOTA: Il mulino per barattoli degli autori è un sistema di nastri trasportatori su misura in grado di elaborare 54 barattoli a rulli alla volta.- Riempire ogni barattolo a rulli (250 mL di vaso di vetro borosilicate con un coperchio a vite) con 10-20 g di pianta o campione di terreno e sette aste in acciaio inossidabile (8,5 cm di lunghezza, di0,7 cm di diametro).
- Rotoli a rulli a 0,4 g per 6-24 h o fino a quando i campioni hanno una consistenza fine e farina.
- Trasferire il materiale finemente macinato in una fiala scintillante pulita e etichettata da 20 mL.
- Tra ogni campione, lavare vasetti a rulli, aste in acciaio inossidabile e coperchi con sapone e acqua per rimuovere eventuali residui.
- Immergere barattoli e coperchi in un bagno acido HCl 5% (preparato da 36-38% brodo concentrato) durante la notte14.
AVVISO: L'acido cloridrico è corrosivo. Può causare gravi ustioni cutanee, danni agli occhi, ed è dannoso se inalato. Indossare sempre indumenti protettivi, guanti e protezione per gli occhi e il viso. Sciacquare accuratamente il tessuto contattato con acqua. Utilizzare sempre un contenitore secondario durante il trasporto degli acidi. Aggiungere sempre acido all'acqua in quanto questa reazione è esotermica. Neutralizzare immediatamente le fuoriuscite di acido con il bicarbonato di sodio.
NOTA: Un grande bagno acido può essere preparato come 100 L del 5% HCl in un contenitore di plastica 208 L. Preparare diversi volumi più piccoli in una cappa di fumi e quindi trasferire le soluzioni al contenitore di plastica. Sostituire la soluzione ogni tre mesi. - Triplo risciacquo a rulli e coperchi con acqua deionizzata e aria secca.
- Immergere le aste in acciaio inossidabile in un bagno NaOH da 0,05 M (preparato sciogliendo 2 g di NaOH in 1 L di acqua deionizzata) durante la notte14. Preparare un nuovo bagno NaOH da 0,05 M ogni giorno.
AVVISO: l'idrossido di sodio può causare gravi ustioni cutanee e danni agli occhi. Indossare sempre indumenti protettivi e protezione degli occhi. Rimuovere immediatamente gli indumenti contaminati e risciacquare la pelle o gli occhi con acqua per alcuni minuti. - Sciacquare le aste sotto l'acqua del rubinetto caldo per 5 minuti. Decant e triplo risciacquare le aste con acqua deionizzata. Lasciare asciugare all'aria le aste su un vassoio foderato di carta.
- Immergere barattoli e coperchi in un bagno acido HCl 5% (preparato da 36-38% brodo concentrato) durante la notte14.
8. Pesare campioni di piante e suolo per l'analisi totale di N e 15N
- Analizzare alcuni campioni rappresentativi di piante e terreni per il contenuto totale di N (ad esempio, l'analisi della combustione15). Calcolare la massa campione che fornisce un contenuto N adeguato per 15N analisi secondo le specifiche dell'analizzatore.
NOTA: Gli autori hanno utilizzato i servizi analitici forniti da UC Davis Stable Isotope Facility. I pesi del campione arricchito sono stati ottimizzati per 20 g di N con un massimo di 100 g di N. - Organizzare campioni simili dal più basso al più alto previsto 15N arricchimento. Duplicare ogni ottavo al quindicesimo campione in ogni esecuzione per controllare la precisione del campione. Includere almeno un campione di controllo per esecuzione16.
- Etichettare una piastra pulita da 96 po' e un coperchio con singoli anelli di evaporazione del pozzo. Tagliare una scheda indice pulita per adattarla appena all'interno del coperchio per evitare il movimento del campione tra i pozze durante il trasporto.
- Indossare guanti nitrile, pulire la microscala, superfici di lavoro, spatola, e pinze con salviette di laboratorio ed etanolo. Mettere gli utensili puliti su un Kimwipe sul banco del laboratorio.
NOTA: i campioni non arricchiti e arricchiti devono essere elaborati utilizzando bilance e utensili separati per evitare la contaminazione incrociata. - Utilizzare le pinze per posizionare una capsula di latta pre-formata di 5 mm x 9 mm su una superficie di lavoro pulita, ad esempio un blocco di acciaio inossidabile con 5 mm x 8 mm bene. Toccare delicatamente la capsula nel pozzo per riformare la forma cilindrica e appiattire il fondo della capsula, se necessario.
NOTA: Poiché le masse campione saranno molto piccole, il rischio di contaminazione del campione è elevato. Non toccare mai le capsule con i guanti. Scartare la capsula se tocca qualsiasi superficie diversa dalle pinze, dalla superficie di lavoro pulita, dalla teglia di pesatura della bilancia o dalla piastra di 96 pozzi. - Utilizzare pinze per svolazzare delicatamente fuori la parte superiore 1 mm della capsula per facilitare la manipolazione. Per evitare danni alla bilancia durante il taring il peso della capsula, librarsi e rilasciare la capsula da 1 a 2 mm sopra la padella di pesatura microscala. Tare la capsula. Utilizzare le pinze per riportare la capsula al superfici di lavoro pulito.
- Utilizzare una spatola per aggiungere con attenzione la massa richiesta di materiale campione finemente macinato alla capsula. Evitare di versare materiale campione sulla superficie esterna della capsula o sulle superfici di lavoro.
- Usando le pinze, crimpare lentamente il terzo superiore della capsula e si piega per sigillare. Utilizzando pinze, continuare a piegare e comprimere la capsula in una forma sferica facendo attenzione a non forare o strappare lo stelo.
NOTA: i campioni con basso contenuto di N possono richiedere volumi di campionamento che superano la capacità della capsula da 5x9 mm. Capsule più grandi (ad esempio, 9 mm x 10 mm) possono essere utilizzate in questi casi. - Utilizzare le pinze per far cadere la capsula avvolta più volte da un'altezza di 1 cm su una superficie o uno specchio pulito e scuro per verificare la presenza di perdite. Se non compare polvere, pesare il campione utilizzando la stessa tecnica descritta al punto 8.6. Registrare il peso del campione. Mettere la capsula in una piastra da 96 pozzetto e registrare il posizionamento del pozzo.
- Se la polvere appare sulla superficie scura, registrare il peso del campione. Avvolgere il campione in una seconda capsula di latta, ricontrollare le perdite e metterlo in una piastra pulita 96-bene.
NOTA: Se la capsula avvolta è troppo grande per essere contenuta in una piastra da 96 pozzetto, utilizzare una piastra da 24 o 48 pozze.
- Se la polvere appare sulla superficie scura, registrare il peso del campione. Avvolgere il campione in una seconda capsula di latta, ricontrollare le perdite e metterlo in una piastra pulita 96-bene.
- Tra i campioni, pulire ciascuno degli utensili e delle superfici con salviette etanolo e di laboratorio prestando particolare attenzione alla spatola e ai bordi delle pinze.
- Fissare il coperchio sulla piastra da 96 pozzetto con nastro adesivo e conservare in un desiccatore.
9. Calcoli
- Calcolare la massa di N (kg∙ha-1) contenuta nei campioni di piante o suolo utilizzando le seguenti equazioni.
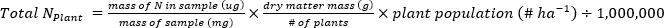
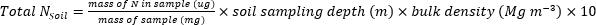
- Calcolare il fertilizzante N frazione (Nf), fertilizzante derivato N (FDN) e il suolo derivato N (SDN) per i campioni di piante e suolo17.
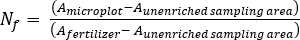
dove A è l'artomo % 15N arricchimento. -


- Calcolare l'efficienza di utilizzo del fertilizzante 15N17.

Risultati
I risultati presentati in questo articolo provengono da un sito sul campo istituito nel 2015 presso il Southern Outreach and Research Center dell'Università del Minnesota situato vicino a Waseca, MN. Il sito è stato gestito come una rotazione di soia di mais [Glycine max (L.) Merr] prima del 2015, ma è stato gestito come una rotazione mais-mais durante le stagioni di crescita 2015 e 2016. Il terreno era un complesso di loam di argilla Nicollet (fine-loamy, misto, superattivo, mesic Aquic Hapludolls)-Webster (fine-loamy, misto, superattivo, mesico Typic Endoaquolls). La fertilità del suolo è stata gestita secondo le linee guida universitarie ad eccezione di N18. Diversi trattamenti con fertilizzanti N sono stati organizzati in un progetto di blocco completo casuale con quattro repliche, ma solo il tasso di 135 kg N∙ha-1 applicato come urea al impianto è presentato in questo documento. La densità di massa del suolo è stata misurata al centro da 0 a 15, da 15 a 30, da 30 a 60, da 60 a 90, e da 60 a 120 cm di profondità da due campioni profondi da 5 cm per replica utilizzando il metodo di base intatto19. La densità di massa è stata mediata entro la profondità tra le repliche e si presuppone che sia costante in tutto il campo. L'impostazione della trama e i campioni di piante e suolo sono stati raccolti ed elaborati come descritto nella sezione del protocollo.
La biomassa totale (FDN e SDN) è aumentata con ogni evento di campionamento successivo nel corso della prima stagione di crescita (Figura 4). La concentrazione di N derivata da fertilizzante è stata la più alta all'inizio della stagione di crescita, che rappresentava il 44 % per cento (errore medio e standard) della biomassa totale fuori terra N a V8 e è diminuita a ogni periodo di campionamento successivo (Figura 4A). Tuttavia, SDN è stata costantemente la più grande frazione di biomassa sopraterra N che illustra l'importanza dell'offerta di suolo N per una crescita ottimale del mais. Alla maturità fisiologica nel primo anno, il 27 x 1% della biomassa sopranbosconina N era dovuto all'FDN con proporzioni simili in grani, stover e frazioni di pannocchia (Figura 4B). Alla maturità fisiologica nel secondo anno, solo il 2 x 0,1% del primo anno di FDN è stato recuperato nella biomassa fuori terra con 1,6 x 0,2 kg di FDN ha-1 del primo anno esportato nel grano (Figura 4A).
Il budget FDN del raccolto del suolo è utile per quantificare il ciclo FDN all'interno del sistema nel tempo. Entro 8 d dall'applicazione del fertilizzante, la maggior parte dell'FDN era nella parte superiore di 15 cm del profilo del suolo, come previsto (Figura 5). Tuttavia, 22,2 x 4,4 kg N ha-1 si erano già spostati nelle profondità più profonde, mentre il 4 x 10% dell'FDN non era stato contabilizzato. Unaccounted-for FDN è probabilmente guidato principalmente da n meccanismi di perdita tra cui lisciviazione, denitrificazione e volatilità che spostano FDN al di sotto delle profondità di campionamento del suolo o rimuovono completamente l'FDN dal sistema. A V8 e R1, l'FDN non contabilizzato è aumentato a 60,4 x 4,7 kg N ha-1 in media mentre il suolo N (0-15 cm) era in media 31,6 x 6,8 kg Nha -1. La rapida crescita del mais e l'elevata domanda di N da V8 a R1 hanno portato ad un aumento di 19,0 x 4,4 kg FDN ha-1 nella biomassa vegetale sotterranea rispecchiando la riduzione di 17,7 x 5,2 kg di FDNha -1 dalle profondità del suolo da 15 a 60 cm. Le condizioni di temperatura e umidità del suolo tra queste fasi di sviluppo del mais tendono a favorire la crescita microbica con conseguente rapido ricambio di residui organici e riutilizzo di N mineralizzato. Questi risultati suggeriscono che le radici di mais estratte in FDN inorganico dalle profondità da 15 a 60 cm, mentre l'FDN nella profondità da 0 a 15 cm è stata principalmente pedalata tra la materia organica del suolo e le frazioni microbiche. Per convalidare questa ipotesi è necessaria un'ulteriore analisi isotopica delle piscine N inorganiche e organiche del suolo e di una maggiore comprensione delle dinamiche di ciclismo FDN10. Per l'anno successivo alla vendemmia 1, il 59 x 2% dell'FDN originale non è stato contabilizzato, mentre 18,1 kg FDN ha-1 era tra i primi 30 cm del terreno (Figura 5) e 22,1 x 2,3 kg FDN ha-1 è stato esportato nel grano (Figura 4B). L'efficienza di utilizzo del fertilizzante 15N era del 24% (Equazione 7) ed è alla fine delle misure F15NUE comunemente segnalate (25-45%) riportato da altri studi20. Anche se le attrezzature sono state accuratamente pulite tra ogni campione, le misure inferiori di F15NUE dello studio potrebbero essere un artefatto di diluizione del campione arricchito elaborando campioni arricchiti in ordine di arricchimento più basso o più alto previsto. La quantità di FDN nei primi 30 cm è raddoppiata (36,0 x 5,2 kg FDN ha-1) dall'anno 1 post-raccolta all'anno 2 pre-impianto a causa della parziale ripartizione dei residui dal calo precedente, ma per l'anno successivo al raccolto 2 solo 17,3 kg - fDN ha-1 è stato ancora trovato all'interno del sistema suolo-corn (Figura 5). Questo studio indica che alla fine del primo e del secondo anno, solo il 41 e il 29%, rispettivamente del primo anno di FDN, erano contabilizzati all'interno del sistema suolo-mais (compreso il FDN esportato nel grano) mentre il resto era perso per l'ambiente o lisciviato al di sotto della profondità di campionamento del suolo di 90 cm.
I risultati spuri possono essere ottenuti quando i campioni sono contaminati in modo incrociato che interessano i calcoli di Nf,FDN e SDN. Si supponga, ad esempio, che un campione di piante arricchito di 15N con un arricchimento effettivo di 3.000 atom % 15N sia contaminato da materiale non arricchito che diluisce la concentrazione di 15N a 2.500 atom % 15N. Inoltre, si supponga che Total NPlant sia di 100 kg Nha -1, l'artomo % 15N di arricchimento del fertilizzante è stato di 5.000, e l'arricchimento dell'atomo % 15N del campione di piante non arricchite è stato 0,366. Il campione di piante arricchite 15N N Nf sarebbe ridotto da 0,568 (effettivo) a 0,461 (campione contaminato) sottovalutando il vero FDN di 10,7 kg Nha -1. Le sovrastime di FDN possono verificarsi quando i campioni con basso arricchimento di 15N sono contaminati da ulteriori 15N. Pertanto, è necessario prestare estrema attenzione in tutte le fasi di raccolta e lavorazione dei campioni per ridurre al minimo la contaminazione del campione, ma soprattutto quando le masse campione sono ridotte (ad esempio, le procedure di macinazione e pesatura).
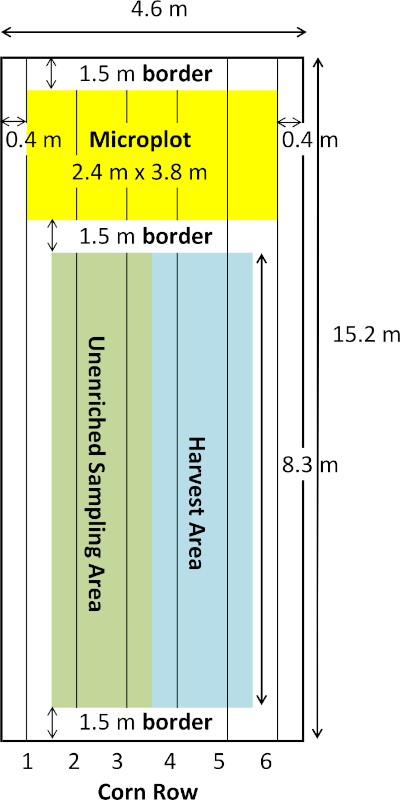
Figura 1: disegno del grafico per il plot e il microplotto di trattamento. La figura illustra le dimensioni e i posizionamenti relativi delle aree di confine, dell'area di campionamento non arricchita, dell'area di raccolta e dell'area di microplotto all'interno del ploto di trattamento. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Diagramma di campionamento dell'impianto di microplotto e del suolo. La figura illustra le relative posizioni di campionamento delle piante e del suolo in ogni fase di campionamento che evita di alterare i modelli di assorbimento del mais N delle piante di mais campionate successivamente. Gli eventi di campionamento si sono verificati 8 giorni dopo l'applicazione del fertilizzante arricchito 15N, nelle fasi di sviluppo fisiologico del mais V8 e R1, alla maturità fisiologica nell'anno 15N di applicazione dei fertilizzanti arricchiti (PMY1) e l'anno successivo (PMY2) e prima di piantare il secondo anno (PPY2). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Rappresentazione cronologica della gestione dei microtraci. (A) Sciogliere 15N di urea arricchita in 2 L di acqua deionizzata e spruzzare sul microplotto durante la semina. (B) Raccogliere e tagliare un campione composito di pianta di mais di sei mais dall'interno dell'area di campionamento (15N non arricchita) e un campione composito di pianta di mais di sei mais di 15N arricchito ai tempi di campionamento predeterminati. (C) Dopo la raccolta di campioni a maturità fisiologica, rimuovere tutta la biomassa residua all'altra dall'interno del microplotto. (D) Dopo la raccolta, rastrellare la biomassa del mais non arricchita proveniente dall'area del microlotto. Chip e riapplicare il microplotto mais sopra la biomassa del suolo all'area del microplotto. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Esempio di biomassa sotterranea N partizionata in n (FDN) derivata dal fertilizzante e frazioni N derivate dal suolo (SDN). La biomassa totale fuori terra N è stata suddivisa nelle sue singole fonti di FDN (colore solido) e SDN (colore hash) in (A) e (B). Le barre di errore rappresentano l'errore standard della media. (A) La biomassa N di superficie è stata misurata nelle fasi di sviluppo fisiologico del mais V8 e R1 e alla maturità fisiologica nell'anno di applicazione di 15fertilizzanti N (PMY1) e l'anno successivo all'applicazione di fertilizzanti 15N (PMY2). Il valore sopra ogni colonna rappresenta la percentuale del valore N totale che era FDN. (B) La biomassa N di superficie misurata a PMY1 e PMY2 è mostrata nelle sue singole parti di pannocchia (solo anno 1), stover (stalk e foglie; include pannocchia per PMY2) e grano per FDN e SDN. Fare clic qui per visualizzare una versione più grande di questa figura.
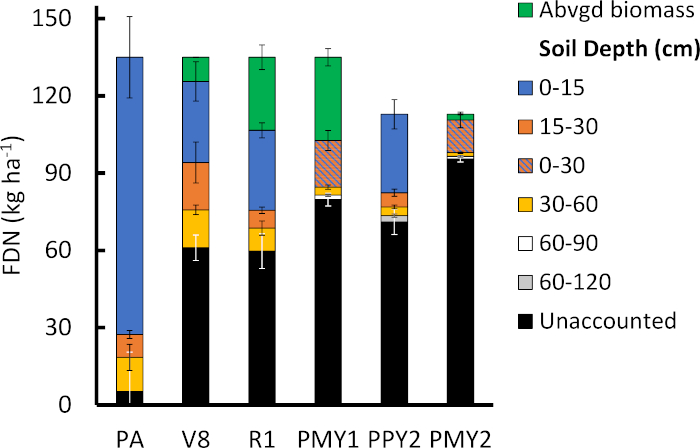
Figura 5: Esempio del bilancio N derivato da fertilizzante del suolo-mais. La massa di FDN recuperato in superficie (Abvgd) biomassa del mais e a varie profondità di campionamento del suolo è segnalato per sei eventi di campionamento in due stagioni di crescita. Gli eventi di campionamento si sono verificati 8 giorni dopo l'applicazione di fertilizzanti arricchiti 15N (PA), alle fasi di sviluppo fisiologico del mais V8 e R1, alla maturità fisiologica nell'anno 15N di applicazione di fertilizzante arricchito (PMY1) e l'anno successivo (PMY2), e prima di piantare il secondo anno (PPY2). La differenza tra il tasso di fertilizzante applicato (135 kg N ha-1) e la massa di FDN recuperata nelle porzioni suolo-mais è la frazione FDN non contabilizzata. La massa totale di FDN per PPY2 e PMY2 era di 113 kg FDN ha-1 perché 22 kg FDN ha-1 è stato esportato dal sistema del terreno-mais come grano del primo anno. Le barre di errore rappresentano l'errore standard della media. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
La ricerca sugli isotopi stabili è uno strumento utile per tracciare e quantificare l'FDN attraverso il sistema di coltura del suolo. Tuttavia, ci sono tre ipotesi principali associate a studi traccianti N che, se violati, possono invalidare le conclusioni tratte dall'utilizzo di questa metodologia. Essi sono 1) il tracciante è uniformemente distribuito in tutto il sistema, 2) processi nell'ambito dello studio si verificano alle stesse tariffe, e 3) N lasciando il 15N piscina arricchita non restituisce3. Poiché questo studio è interessato alla distribuzione dell'FDN totale in tutto il sistema di coltura del suolo, le ipotesi 2 e 3 sono di minima preoccupazione21.
L'alto costo del materiale arricchito 15N limita generalmente le dimensioni di 15n studi tracciari. Pertanto, prima di avviare uno studio di tracciamento N, il ricercatore deve pianificare attentamente gli obiettivi del progetto di ricerca considerando: il numero di eventi di campionamento, la durata dello studio (giorni fino ad anni), il tasso di applicazione di N fertilizzanti e la concentrazione di arricchimento di 15N necessaria per misurare le differenze dall'abbondanza naturale (0,366 atomo %) dopo 15N diluizione di fertilizzante arricchito dal suolo sfuso2. I livelli di arricchimento 15N di uso comune e i tassi di applicazione sono riportati per diversi tipi di ricerca agronomica in Ref. 2. Dopo aver determinato gli obiettivi dello studio, il microplotto deve essere sufficientemente grande per accogliere il campionamento del suolo e delle piante ed evitare effetti di bordo. La struttura del grafico descritta in questo protocollo utilizza un grafico non delimitato che richiede l'impiego di aree di confine non campionate6. La concentrazione di 15N nelle zone di confine è diluita dal flusso di massa attraverso il confine del microplotto e dall'assorbimento di N dall'esterno del microplotto da radici laterali di mais che crescono nelle file 1 e 6. I terreni confinati, in cui le barriere fisiche sono spinte nel suolo, non richiedono zone di confine, ma richiedono ulteriori lavori durante la creazione di microplote e possono limitare le operazioni sul campo di routine6. I riferimenti 3, 6, 22-25 forniscono ulteriori indicazioni sulla selezione delle dimensioni delle microtrame, sulla larghezza dei bordi e quando i grafici confinati o non confinati possono essere più appropriati.
Lo schema di campionamento delle piante e del suolo di questo studio è progettato per consentire eventi di campionamento multipli per due stagioni di crescita consecutive. I campioni di piante e suolo di inizio stagione vengono prelevati vicino ai bordi esterni del microplotto. Ogni evento di campionamento successivo si avvicina al centro del microplotto per evitare di campionare aree precedentemente campionate. Almeno due piante di mais separano ogni pianta campionata per ridurre al minimo i cambiamenti nello sviluppo fisiologico del mais. Una sfida con la tecnica di campionamento del suolo di questo studio è che il metodo di campionamento del nucleo del suolo potrebbe non intercettare con precisione la distribuzione eterogenea di 15N nel profilo del suolo3. La variabilità spaziale del totale del suolo N è elevata, con un coefficiente stimato di variazione del 15%3. Lo scavo completo della microtrama migliorerebbe 15N quantificazione, ma richiederebbe l'elaborazione di volumi significativi di suolo e il campionamento dei limiti a un singolo evento3 che non è in linea con gli obiettivi di questo studio. La suddivisione del microplotto in unità di campionamento più piccole consente più eventi di scavo, ma può aumentare le dimensioni necessarie per garantire che le unità non campionate non siano influenzate dalle modifiche apportate alla calotta del raccolto e alla dinamica dell'acqua del suolo. Nonostante la potenziale riduzione della precisione, molti studi utilizzano la tecnica del nucleo del suolo per microplotti n. 1 m29,22,26,27,28. La precisione del campione può essere aumentata aumentando il numero di nuclei di suolo raccolti e composti per microplot utilizzando la seguente formula13:
n - (2)(CV2)/(d2)
dove n è il numero di nuclei del suolo, il valore di normal variate standardizzato per il livello alfa corrispondente (1,96 per 0,05 e 1,65 per 0,10), il CV è il coefficiente di variazione e d è il margine di errore nella media del grafico (come decimale). Sulla base di questa formula, gli autori si aspettano che 15 core per microtrama stimerebbero il totale di N al 7,6% sul 95% dei lotti (n - 15; N. 1,96; CV - 15%; d - 0.076). Il referto 25 ha utilizzato un numero simile di nuclei, ma ha suddiviso il microplotto in 32 unità di campionamento raccogliendo campioni di piante e terreni da quattro unità ad ogni evento di campionamento.
Altri hanno dimostrato che i dati del microplotto possono essere estrapolati all'intero tracciato29. Tuttavia, affinché questa ipotesi sia valida, il complotto di trattamento e il microplotto devono essere gestiti in modo analogo. Se possibile, il fertilizzante N deve essere applicato nelle stesse forme chimiche e fisiche (ad esempio, l'urea disciolta nell'acqua) in quanto queste proprietà influiscono sulle dinamiche fertilizzante-suolo, compresi i meccanismi di perdita N, l'immobilizzazione e la disponibilità di microbi e piante del suolo3.
Il metodo di macinazione del barattolo a rulli descritto in questo protocollo è in grado di polverizzare grandi volumi di campioni di piante e suolo, ideale per garantire un campione rappresentativo omogeneo. Tuttavia, la tecnica richiede un notevole lavoro manuale e tempo per caricare, scaricare, rotolare e pulire i vasi a rullo. La lavorazione del campione è limitata dal numero disponibile di barattoli a rulli, dalla capacità dell'unità nastro trasportatore e dalle dimensioni del bagno acido. Le fiale di macinazione commerciali possono essere un'alternativa ai vasetti a rulli, ma possono limitare il volume dei campioni di piante e suolo trasformati. Possono essere costruite fiale di macinazione monouso fatte in laboratorio che potenzialmente fungono sia da contenitore di macinazione che come contenitore di stoccaggio del campione. La considerazione principale di uno di questi metodi di macinazione è quella di ridurre al minimo la contaminazione incrociata tra i campioni.
Infine, poiché il materiale fertilizzante arricchito 15N è costoso, 15N arricchito sopraterra e campioni di suolo possono essere conservati e omogeneizzati per l'uso in studi futuri. Questi prodotti possono essere particolarmente utili quando si studia la decomposizione dei residui, il potenziale di mineralizzazione o altri processi di ciclo dei nutrienti21.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori riconoscono il sostegno del Minnesota Corn Research & Promotion Council, della Hueg-Harrison Fellowship e della Borsa di studio Discovery, Research and InnoVation Economy (MnDRIVE) del Minnesota.
Materiali
| Name | Company | Catalog Number | Comments |
| 20 mL scintillation vial | ANY; Fisher Scientific is one example | 0334172C | |
| 250 mL borosilicate glass bottle | QORPAK | 264047 | |
| 48-well plate | EA Consumables | E2063 | |
| 96-well plate | EA Consumables | E2079 | |
| Cloth parts bag (30x50 cm) | ANY | NA | For corn ears |
| CO2 Backpack Sprayer | ANY; Bellspray Inc is one example | Model T | |
| Coin envelop (6.4x10.8 cm) | ANY; ULINE is one example | S-6285 | For 2-mm ground plant samples |
| Corn chipper | ANY; DR Chipper Shredder is one example | SKU:CS23030BMN0 | For chipping corn biomass |
| Corn seed | ANY | NA | Hybrid appropriate to the region |
| Disposable shoe cover | ANY; Boardwalk is one example | BWK00031L | |
| Ethanol 200 Proof | ANY; Decon Laboratories Inc. is one example | 2701TP | |
| Fabric bags with drawstring (90x60 cm) | ANY | NA | For plant sample collection |
| Fertilizer Urea (46-0-0) | ANY | NA | ~0.366 atom % 15N |
| Hand rake | ANY; Fastenal Company is one example | 5098-63-107 | |
| Hand sickle | ANY; Home Depot is one example | NJP150 | For plant sample collection |
| Hand-held soil probe | ANY; AMS is one example | 401.01 | |
| Hydraulic soil probe | ANY; Giddings is one example | GSPS | |
| Hydrochloric acid, 12N | Ricca Chemical | R37800001A | |
| Jar mill | ANY; Cole-Parmer is one example | SI-04172-50 | |
| Laboratory Mill | Perten | 3610 | For grinding grain |
| Microbalance accurate to four decimal places | ANY; Mettler Toledo is one example | XPR2 | |
| N95 Particulate Filtering Facepiece Respirator | ANY, ULINE is one example | S-9632 | |
| Neoprene or butyl rubber gloves | ANY | NA | For working in HCl acid bath |
| Paper hardware bags (13.3x8.7x27.8 cm) | ANY; ULINE is one example | S-8530 | For soil samples and corn grain |
| Plant grinder | ANY; Thomas Wiley Model 4 Mill is one example | 1188Y47-TS | For grinding chipped corn biomass to 2-mm particles |
| Plastic tags | ULINE | S-5544Y-PW | For labeling fabric bags and microplot stalk bundles |
| Sodium hydroxide pellets, ACS | Spectrum Chemical | SPCM-S1295-07 | |
| Soil grinder | ANY; AGVISE stainless steel grinder with motor is one example | NA | For grinding soil to pass through a 2-mm sieve |
| Tin capsule 5x9 mm | Costech Analytical Technologies Inc. | 041061 | |
| Tin capsule 9x10 mm | Costech Analytical Technologies Inc. | 041073 | |
| Urea (46-0-0) | MilliporeSigma | 490970 | 10 atom % 15N |
Riferimenti
- Sharp, Z. Principles of Stable Isotope Geochemistry. , 2nd Edition, (2017).
- Van Cleemput, O., Zapata, F., Vanlauwe, B. Guidelines on Nitrogen Management in Agricultural Systems. Guidelines on Nitrogen Management in Agricultural Systems. 29 (29), 19(2008).
- Hauck, R. D., Meisinger, J. J., Mulvaney, R. L. Practical considerations in the use of nitrogen tracers in agricultural and environmental research. Methods of Soil Analysis: Part 2-Microbiological and Biochemical Properties. , 907-950 (1994).
- Bedard-Haughn, A., Van Groenigen, J. W., Van Kessel, C. Tracing 15N through landscapes: Potential uses and precautions. Journal of Hydrology. 272 (1-4), 175-190 (2003).
- Peterson, R. G. Agricultural Field Experiments: Design and Analysis. , Marcel Dekker, Inc. New York. (1994).
- Follett, R. F. Innovative 15N microplot research techniques to study nitrogen use efficiency under different ecosystems. Communications in Soil Science and Plant Analysis. 32 (7/8), 951-979 (2001).
- Russelle, M. P., Deibert, E. J., Hauck, R. D., Stevanovic, M., Olson, R. A. Effects of water and nitrogen management on yield and 15N-depleted fertilizer use efficiency of irrigated corn. Soil Science Society of America Journal. 45 (3), 553-558 (1981).
- Schindler, F. V., Knighton, R. E. Fate of Fertilizer Nitrogen Applied to Corn as Estimated by the Isotopic and Difference Methods. Soil Science Society of America Journal. 63, 1734(1999).
- Stevens, W. B., Hoeft, R. G., Mulvaney, R. L. Fate of Nitrogen-15 in a Long-Term Nitrogen Rate Study. Agronomy Journal. 97 (4), 1037(2005).
- Recous, S., Fresneau, C., Faurie, G., Mary, B. The fate of labelled 15N urea and ammonium nitrate applied to a winter wheat crop. Plant and Soil. 112 (2), 205-214 (1988).
- Abendroth, L. J., Elmore, R. W., Boyer, M. J., Marlay, S. K. Corn Growth and Development. , (2011).
- Lauer, J. G. Methods for calculating corn yield. , http://corn.agronomy.wisc.edu/AA/pdfs/A033.pdf (2002).
- Gomez, K. A., Gomez, A. A. Statistical Procedures for Agricultural Research. , 2nd Edition, John Wiley and Sons. (1984).
- Khan, S. A., Mulvaney, R. L., Brooks, P. D. Diffusion Methods for Automated Nitrogen-15 Analysis using Acidified Disks. Soil Science Society of America Journal. 62 (2), 406(1998).
- Horneck, D. A., Miller, R. O. Determination of Total Nitrogen in Plant Tissue. Handbook of Reference Methods for Plant Analysis. , 75-84 (1998).
- UC Davis Stable Isotope Facility. Carbon (13C) and Nitrogen (15N) Analysis of Solids by EA-IRMS. , https://stableisotopefacility.ucdavis.edu/13cand15n.html (2019).
- Stevens, W. B., Hoeft, R. G., Mulvaney, R. L. Fate of Nitrogen-15 in a Long-Term Nitrogen Rate Study: II. Nitrogen Uptake Efficiency. Agronomy Journal. 97 (4), 1046(2005).
- Kaiser, D. E., Fernandez, F. G., Coulter, J. A. Fertilizing Corn in Minnesota. , University of Minnesota Extension. https://extension.umn.edu/crop-specific-needs/fertilizing-corn-minnesota (2018).
- Blake, G. R., Hartge, K. H. Bulk Density. Methods of Soil Analysis: Part 1 Physical and Mineralogical Methods. , 363-375 (1986).
- Jokela, W. E., Randall, G. W. Fate of Fertilizer Nitrogen as Affected by Time and Rate of Application on Corn. Soil Science Society of America Journal. 61 (6), 1695(2010).
- Hart, S. C., Stark, J. M., Davidson, E. A., Firestone, M. K. Nitrogen Mineralization, Immobilization, and Nitrification. Methods of Soil Analysis, Part 2. Microbiological and Biochemical Properties. (5), 985-1018 (1994).
- Jokela, W., Randall, G. A nitrogen-15 microplot design for measuring plant and soil recovery of fertilizer nitrogen applied to corn. Agronomy journal (USA). 79 (APRIL), http://agris.fao.org/agris-search/search/display.do?f=1988/US/US88241.xml;US875113688 322-325 (1987).
- Olson, R. V. Fate of tagged nitrogen fertilizer applied to irrigated corn. Soil Science Society of America Journal. 44 (3), 514-517 (1980).
- Follett, R. F., Porter, L. K., Halvorson, A. D. Border Effects on Nitrogen-15 Fertilized Winter Wheat Microplots Grown in the Great Plains. Agronomy Journal. 83 (3), 608-612 (1991).
- Balabane, M., Balesdent, J. Input of fertilizer-derived labelled n to soil organic matter during a growing season of maize in the field. Soil Biology and Biochemistry. 24 (2), 89-96 (1992).
- Recous, S., Machet, J. M., Mary, B. The partitioning of fertilizer-N between soil and crop: Comparison of ammonium and nitrate applications. Plant and Soil. 144 (1), 101-111 (1992).
- Bigeriego, M., Hauck, R. D., Olson, R. A. Uptake, Translocation and Utilization of 15N-Depleted Fertilizer in Irrigated Corn. Soil Science Society of America Journal. 43 (3), 528(1979).
- Glendining, M. J., Poulton, P. R., Powlson, D. S., Jenkinson, D. S. Fate of15N-labelled fertilizer applied to spring barley grown on soils of contrasting nutrient status. Plant and Soil. 195 (1), 83-98 (1997).
- Khanif, Y. M., Cleemput, O., Baert, L. Field study of the fate of labelled fertilizer nitrate applied to barley and maize in sandy soils. Fertilizer Research. 5 (3), 289-294 (1984).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon