Method Article
Identificare gli inibitori dell'interazione HBx-DDB1 utilizzando un sistema di valutazione di Luciferase diviso
In questo articolo
Riepilogo
Qui, presentiamo un metodo per lo screening degli agenti virali anti-epatite B che inibiscono l'interazione HBx-DDB1 utilizzando un sistema di analisi luciferasi divisa. Questo sistema consente una facile individuazione delle interazioni proteina-proteina ed è adatto per identificare gli inibitori di tali interazioni.
Abstract
C'è un urgente bisogno di nuovi agenti terapeutici per l'infezione da virus dell'epatite B (HBV). Sebbene gli analoghi nucleos(t)ide attualmente disponibili inibiscano potentemente la replicazione virale, non hanno alcun effetto diretto sull'espressione di proteine virali trascritte da un DNA circolare virale covalentmente chiuso (cccDNA). Poiché l'elevato carico di antigene virale può svolgere un ruolo in questa carcinogenesi cronica e correlata all'HBV, l'obiettivo del trattamento HBV è quello di sradicare le proteine virali. La proteina regolatoria HBV X (HBx) si lega alla proteina 1 (DDB1) che lega il danno al DNA ospite per degradare la manutenzione strutturale dei cromosomi 5/6 (Smc5/6), con conseguente attivazione della trascrizione virale da cccDNA. Qui, usando un sistema di analisi di completamento della luciferasi divisa, presentiamo un sistema completo di screening composto per identificare gli inibitori dell'interazione HBx-DDB1. Il nostro protocollo consente di rilevare facilmente le dinamiche di interazione in tempo reale all'interno delle cellule viventi. Questa tecnica può diventare un test chiave per scoprire nuovi agenti terapeutici per il trattamento dell'infezione da HBV.
Introduzione
L'infezione da virus dell'epatite B (HBV) è una delle principali preoccupazioni per la salute pubblica in tutto il mondo, con stime annuali di 240 milioni di persone cronicamente infettate da HBV e 90.000 decessi a causa di complicazioni dovute all'infezione, tra cui cirrosi e carcinoma epatocellulare (HCC)1. Anche se gli attuali agenti terapeutici anti-HBV, gli analoghi nucleos(t)ide, inibiscono sufficientemente la trascrizione inversa virale, raramente raggiungono l'eliminazione delle proteine virali, che è l'obiettivo clinico a lungo termine. Il loro scarso effetto sull'eliminazione delle proteine virali è dovuto alla loro mancanza di effetto diretto sulla trascrizione virale da minicromosomi circolari con chiusura apicale (cccDNA) nel nucleo epatocite2.
La trascrizione HBV è attivata dalla proteina X (HBx) regolatrice HBV3. Recenti studi hanno rivelato che HBx degrada la manutenzione strutturale dei cromosomi 5/6 (Smc5/6), un fattore di restrizione dell'ospite che blocca la trascrizione HBV dal cccDNA, dirottando un DDB1-CUL4-ROC1 E3 ubiquitin ligase complex4,5,6. Pertanto, un passo cruciale nella promozione della trascrizione virale da cccDNA è pensato per essere l'interazione HBx-DDB1. Composti in grado di inibire l'associazione tra HBx e DDB1 possono bloccare la trascrizione virale, e infatti il nitazoxanide è stato identificato come un inibitore dell'interazione HBx-DDB1 attraverso un sistema di screening sviluppato nel nostro laboratorio7.
Qui, presentiamo il nostro comodo sistema di screening utilizzato per identificare gli inibitori dell'interazione HBx-DDB1, che utilizza una spaccatura luciferasi di qualità7,8. Le sottounità luciferasi divise sono fuse in HBx e DDB1, e l'interazione HBx-DDB1 porta le sottounità in prossimità di formare un enzima funzionale che genera un segnale luminoso luminescente. Poiché l'interazione tra le sottounità è reversibile, questo sistema è in grado di rilevare proteine HBx-DDB1 rapidamente dissocianti (Figura 1). Utilizzando questo sistema, una grande libreria composta può essere facilmente esaminata, che può portare alla scoperta di nuovi composti in grado di inibire in modo efficiente l'interazione HBx-DDB1.
Protocollo
NOTA: Una rappresentazione schematica dell'analisi di suddivisione luciferate è illustrata nella Figura 1Ae il processo di analisi è descritto nella figura 1B. La dinamica di interazione può essere misurata in tempo reale senza lisi cellulare.
1. Preparazione delle cellule
- Mantenere le cellule HEK293T coltivate nel mezzo modificato di Dulbecco Eagle (DMEM) integrato con 10% v/v siero bovino fetale (FBS), 1x penicillina / streptomicina a 37 s nel 20% O2 e 5% CO2.
- Seme 5 x 106 cellule in un piatto da 100 mm con 10 mL di DMEM e incubare a 37 gradi durante la notte.
- Trasfecti transitori a 1 g di HBx e DDB1 con luciferasi divise nelle cellule secondo il seguente metodo.
NOTA: La quantità di DNA trascurato plasmide trascurato può dipendere dal reggente di trasfezione utilizzato. La posizione ottimale della lucidferala divisa fusa alla proteina bersaglio deve essere determinata in anticipo. In questo caso, HBx fuso a LgBit al C-terminus di HBx (HBx-LgBit) e DDB1 fuso a SmBit al N-terminus di DDB1 (SmBit-DDB1) ha fornito i migliori risultati (cioè, i segnali luciferase più luminosi). Questo processo è stato riportato in precedenza nel dettaglio7.- Diluire 1 g di HBx-LgBit esprimendo plasmide di DNA e 1 g di SmBit-DDB1 esprimendo plasmide di DNA (Tabella dei materiali) nel buffer di condensazione del DNA ( Tabella deimateriali) a un volume totale di 300 L.
- Aggiungere 16 l di soluzione di potenziamento (Table of Materials) e mescolare vortice per 1 s.
- Incubare il campione a temperatura ambiente per 3 min.
- Aggiungete al campione 60 -L di reagente di trasfezione (Table of Materials) e mescolate vortice vortice per 10 s.
- Incubare il campione a temperatura ambiente per 8 min.
- Durante l'incubazione, aspirare il mezzo di coltura dal piatto (preparato al punto 1.2) e lavare le cellule con 5 mL di salina tampone fosfato (PBS). Rimuovere PBS per aspirazione e aggiungere 7 mL di DMEM.
- Aggiungere 3 mL di DMEM al tubo contenente i complessi di trasfezione. Mescolare con pipettaggio e aggiungere i complessi di trasfezione sulla cella nel piatto di 10 cm.
- Incubare le cellule a 37 gradi centigradi in un'incubatrice sotto il 5% di CO2 per 10 h.
- Reseed le cellule in una piastra bianca 96 bene a 5 x 104 celle / bene in 50 - L di medio/bene secondo il seguente metodo.
- Rimuovere il mezzo di coltura delle cellule esaurite e lavare le cellule con 5 mL di PBS.
- Rimuovere PBS per aspirazione, aggiungere 1 mL di 0,25% trypsin-EDTA, e incubare a 37 s per 5 min per staccare le cellule.
- Aggiungere 4 mL di DMEM e disperdere il mezzo pipeting sulla superficie dello strato cellulare più volte. Trasferire la sospensione della cella in un tubo.
- Centrifugare le cellule a 500 x g per 5 min a temperatura ambiente.
- Scartare supernatante e risospendere il pellet cellulare in 1 mL di PBS.
- Centrifugare la sospensione cellulare a 500 x g per 5 min a temperatura ambiente e scartare supernatante.
- Diluire il pellet cellulare con un mezzo di coltura cellulare memorizzato nel buffer (Tabella dei materiali) integrato con FBS del 10% a una densità di semina di 1,0 x 106 celle/mL.
- Pipette 50 -L di sospensione cellulare in ogni pozzo di una piastra di 96 pozzi e riportare le cellule all'incubatrice.
- Incubare le cellule a 37 gradi centigradi al di sotto del 5% di CO2 per 10 h.
2. Screening composto
- Durante l'incubazione, diluire i composti di screening (Tabella dei materiali)e il solvente (solisco dimetilo [DMSO]) a una concentrazione di 13,5x. Ad esempio, se lo stock è di 10 mM e la concentrazione di screening è di 10 m, aggiungere 1 - L di soluzione stock a 73,1 litri di media di coltura cellulare tampolatata.
- Aggiungete 12,5 l di substrato luminescente (Tabella dei materiali) ad ogni pozzo e incubate per 5 min a temperatura ambiente.
NOTA: Come controlli negativi, i pozze ad entrambe le estremità della piastra (cioè le colonne 1 e 12) non devono contenere alcun substrato luminescente. - Misurare la luminescenza della linea di base utilizzando un luminometro (Tabella dei materiali).
- Subito dopo la misurazione iniziale, aggiungere 5 oL di composti e controllare d'DMSO diluito nel passaggio 2.1 per ogni pozzo.
NOTA: La concentrazione finale sarà di 10 M. - Misurare i valori di luminescenza ogni 30 min per 2 h.
NOTA: La piastra deve essere incubata al buio a temperatura ambiente. - Calcolare gli effetti inibitori confrontati con il trattamento DMSO di controllo dopo la normalizzazione ai segnali di base.
NOTA: Lo screening di ogni composto in duplicato o triplice può ridurre la variazione.
Risultati
I risultati rappresentativi dopo l'utilizzo di questo protocollo sono riportati nella figura 2A,B. Il rapporto segnale-sfondo era maggiore di 80 e il fattore9 (l'indice di qualità standard dell'oro per lo screening ad alta velocità) era maggiore di 0,5, indicando che questo sistema di analisi era accettabile per lo screening ad alto rendimento. Con la soglia impostata su >40% di inibizione rispetto al controllo (solo DMSO), abbiamo identificato nitazoxanide come farmaco candidato7. Utilizzando questo sistema, farmaci candidati migliori possono essere trovati esaminando altre librerie composte più grandi.

Figura 1: rappresentazione schematica dell'analisi della luciferasi divisa dell'interazione HBx-DDB1. (A) Il principio alla base del rilevamento HBx-DDB1 utilizzando il sistema di asino complementare split luciferase. Le sottounità luciferate separate, LgBit e SmBit, vengono fuse rispettivamente in HBx e DDB1. L'interazione HBx-DDB1 porta le sottounità in prossimità di formare un enzima funzionale che genera un segnale luminescente. L'interazione tra le sottounità è reversibile. (B) Split luciferale assay. Dopo la co-trasfezione di plasmidi per l'espressione di HBx fusa in LgBit e DDB1 fusa in SmBit, le cellule sono state re-seeded in una piastra di 96 pozze. L'aggiunta di substrato luminescente consente la misurazione dell'attività luciferasi senza un passaggio di lisi cellulare. Le attività di Luciferase possono essere misurate dopo l'aggiunta dei composti di screening. Fare clic qui per visualizzare una versione più grande di questa figura.
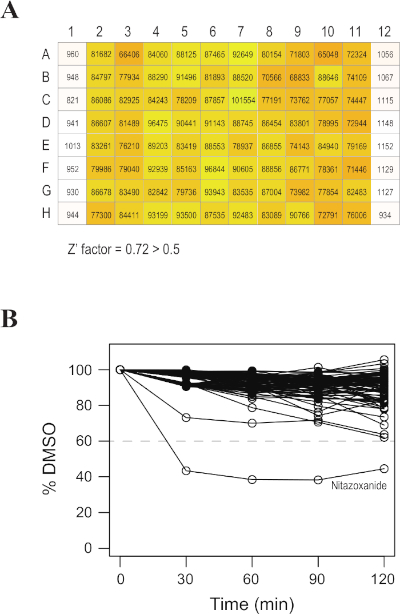
Figura 2: Risultati positivi dell'assaggio di luciferasi divisa. (A) Segnali luminescenti della linea di base rappresentativi da una lastra di 96 pozze. L'intensità di Luciferasi è rappresentata da numeri e colori. Le colonne 1 e 12 sono controlli in cui il substrato luminescente non è stato aggiunto. Il fattore di z era maggiore di 0,5. (B) Risultato rappresentativo delle serie temporali dei livelli relativi di attività luciferasi dopo l'aggiunta di composti di screening a una lastra di 96 pozzi. L'asse x rappresenta gli effetti inibitori calcolati rispetto al controllo (DMSO) dopo la standardizzazione dell'attività lucidferasi di base. Il composto più efficace era nitazoxide. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Abbiamo sviluppato un comodo metodo di screening usando un saggio di luciferasi diviso per trovare inibitori di legame HBx-DDB1. Le dinamiche di interazione possono essere rilevate in tempo reale nelle cellule viventi senza la necessità di lisi cellulare. L'inibizione dell'interazione HBx-DDB1 porta al ripristino di Smc5/6, che si traduce nella soppressione della trascrizione virale, espressione proteica e produzione di cccDNA7. Questo nuovo meccanismo di azione antivirale può superare le inadeguatezze delle attuali terapie HBV.
Anche se sono disponibili diversi metodi per studiare le interazioni proteina-proteina nelle cellule viventi, esaminare queste interazioni rimane difficile10. La nostra procedura è semplice e richiede solo un breve periodo di tempo per lo screening di un 96 pozzo piastra. Inoltre, la qualità dello screening è stata soddisfacente con un alto punteggio di z, l'indice di qualità gold standard per lo screening ad alto throughput9. Il nostro test può essere adatto per l'automazione robotica11 ed è un test efficiente per la scoperta di farmaci.
Mentre il protocollo qui descritto ha utilizzato la linea cellulare HEK293T perché la sua elevata efficacia di trasfezione e l'elevata capacità di proliferazione sono adatte per lo screening ad alto throughput, questo metodo di screening può essere eseguito utilizzando altre linee cellulari (ad esempio, HepG2) senza modifiche7. Come strategia realistica per lo screening dei composti, le cellule HEK293T possono essere utilizzate nel primo screening seguito dalle cellule HepG2 in un secondo screening di convalida. Alcuni composti potrebbero non mostrare risultati significativi in linee cellulari diverse quando gli effetti dipendono da meccanismi indiretti.
Poiché la nostra intenzione era quella di sviluppare un metodo di screening ad alto contenuto di velocità, sono necessari successivi studi di convalida per confermare se i composti identificati funzionano come inibitori dell'interazione. I livelli ridotti di segnali luminescenti in questo saggio non sempre corrispondono all'inibizione dell'interazione HBx-DDB1. I test di citotossicità, studi di co-immunoprecipitazioni e ulteriori esperimenti anti-HBV sono importanti per confermare gli effetti7.
Anche se in precedenza abbiamo identificato il nitazoxidide come inibitore dell'interazione HBx-DDB1 mediante lo screening di una libreria composta relativamente piccola7,ulteriori studi che coinvolgono lo screening di librerie composte molto più grandi possono essere facilmente eseguiti per identificare nuovi composti che sono in grado di inibire le interazioni proteina-proteina in modo più efficiente. Quando si esegue tale ulteriore screening, nitazoxide può essere utilizzato come un controllo positivo per il saggio. Inoltre, il sistema qui descritto può essere applicato ad altre interazioni proteina-proteina. Le interazioni tra proteine e proteine sono un'importante classe di bersagli farmacologici12. Infatti, molti altri virus interagiscono con fattori ospiti per replicare o esprimere la loro patogenicità13,14. L'analisi split luciferale-based qui, che si rivolge alle interazioni tra proteine virali e proteine ospiti, può fornire una nuova strategia per sviluppare cure per l'HBV e altre malattie infettive.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto da Grants-in-Aid del Ministero dell'Istruzione, della Cultura, dello Sport, Science, and Technology, Japan (#19H03430 and #17K09405 to M.O., and #19J11829 to K.S.), by a Grant-in-Aid for Scientific Research on Innovative Areas (#18H05024 to M.O.), by the Research Program on Hepatitis from Lepitis from Medical Agency for Medical Research and Development, AMED (to M.O., #JP19fk021005), by program on the Innovative Development and the Application of New Drugs for Hepatitis B (#JP19fk0310102 to K.K.) from AMED, #JP19fk021005 la Japan Foundation for Applied Enzymology e la Kobayashi Foundation for Cancer Research (a M.O.), dal GSK Japan Research Grant 2018 (per K.S.), e da una sovvenzione della Miyakawa Memorial Research Foundation (a K.S.).
Materiali
| Name | Company | Catalog Number | Comments |
| Cell culture microplate, 96 well, PS, F-BOTTOM | Greiner-Bio-One GmbH | 655098 | |
| DMEM | Sigma Aldrich | D6046 | |
| DMSO | Tocris Bioscience | 3176 | |
| Effectene transfection reagent | Qiagen | 301425 | Includes DNA-condensation buffer, enhancer solution and transfection reagent |
| FBS | Nichirei | 175012 | |
| GloMax 96 microplate luminometer | Promega | E6521 | |
| HBx–LgBit expressing DNA plasmid | Our laboratory | Available upon request | |
| HEK293T cells | American Type Culture Collection | CRL-11268 | |
| NanoBiT PPI starter systems | Promega | N2015 | Includes Nano-Glo Live Cell Reagent |
| Opti-MEM | Thermo Fisher Scientific | 11058021 | Described as "buffered cell culture medium" in the manuscript |
| PBS | Takara | T900 | |
| Penicillin-Streptomycin | Sigma Aldrich | P0781 | |
| Screen-Well FDA-approved drug library V2 version 1.0 | Enzo Life Sciences | BML-2841 | Compounds used here were as follows: mequinol, mercaptopurine hydrate, mesna, mestranol, metaproterenol hemisulfate, metaraminol bitartrate, metaxalone, methacholine chloride, methazolamide, methenamine hippurate, methocarbamol, methotrexate, methoxsalen, methscopolamine bromide, methsuximide, methyclothiazide, methyl aminolevulinate·HCl, methylergonovine maleate, metolazone, metyrapone, mexiletine·HCl, micafungin, miconazole, midodrine·HCl, miglitol, milnacipran·HCl, mirtazapine, mitotane, moexipril·HCl, mometasone furoate, mupirocin, nadolol, nafcillin·Na, naftifine·HCl, naratriptan·HCl, natamycin, nebivolol·HCl, nelarabine, nepafenac, nevirapine, niacin, nicotine, nilotinib, nilutamide, nitazoxanide, nitisinone, nitrofurantoin, nizatidine, nortriptyline·HCl, olsalazine·Na, orlistat, oxaprozin, oxtriphylline, oxybutynin Chloride, oxytetracycline·HCl, paliperidone, palonosetron·HCl, paromomycin sulfate, pazopanib·HCl, pemetrexed disodium, pemirolast potassium, penicillamine, penicillin G potassium, pentamidine isethionate, pentostatin, perindopril erbumine, permethrin, perphenazine, phenelzine sulfate, phenylephrine, phytonadione, pimecrolimus, pitavastatin calcium, and podofilox |
| SmBit–DDB1 expressing DNA plasmid | Our laboratory | Available upon request | |
| Trypsin-EDTA | Sigma Aldrich | T4049 |
Riferimenti
- Tang, L. S. Y., Covert, E., Wilson, E., Kottilil, S. Chronic hepatitis B infection: a review. The Journal of the American Medical Association. 319, 1802-1813 (2018).
- Sekiba, K., et al. Hepatitis B virus pathogenesis: Fresh insights into hepatitis B virus RNA. World Journal of Gastroenterology. 24, 2261-2268 (2018).
- Slagle, B. L., Bouchard, M. J. Hepatitis B virus X and regulation of viral gene expression. Cold Spring Harbor Perspectives in Medicine. 6, a021402(2016).
- Murphy, C. M., et al. Hepatitis B Virus X Protein Promotes Degradation of SMC5/6 to Enhance HBV Replication. Cell Reports. 16, 2846-2854 (2016).
- Decorsière, A., et al. Hepatitis B virus X protein identifies the Smc5/6 complex as a host restriction factor. Nature. 531, 386-389 (2016).
- Niu, C., et al. The Smc5/6 complex restricts HBV when localized to ND10 without inducing an innate immune response and is counteracted by the HBV X protein shortly after infection. PLoS One. 12, e0169648(2017).
- Sekiba, K., et al. Inhibition of HBV Transcription From cccDNA With Nitazoxanide by Targeting the HBx-DDB1 Interaction. Cellular and Molecular Gastroenterology and Hepatology. 7, 297-312 (2019).
- Eggers, C. T., et al. NanoLuc Complementation Reporter Optimized for Accurate Measurement of Protein Interactions in Cells. ACS Chemical Biology. 11, 400-408 (2015).
- Zhang, J. H., Chung, T. D. Y., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4, 67-73 (1999).
- Rao, V. S., Srinivas, K., Sujini, G. N., Kumar, G. N. Protein-protein interaction detection: Methods and analysis. International Journal of Proteomics. 2014. 2014, 147648(2014).
- Michael, S., et al. A Robotic Platform for Quantitative High-Throughput Screening. ASSAY and Drug Development Technologies. 6, 637-657 (2008).
- Skwarczynska, M., Ottmann, C. Protein-protein interactions as drug targets. Future Medicinal Chemistry. 7, 2195-2219 (2015).
- de Chassey, B., Meyniel-Schicklin, L., Vonderscher, J., André, P., Lotteau, V. Virus-host interactomics: New insights and opportunities for antiviral drug discovery. Genome Medicine. 6, 115(2014).
- Prasad, M., et al. Virus-Host Interactions: New Insights and Advances in Drug Development Against Viral Pathogens. Current Drug Metabolism. 18, 942-970 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon