Method Article
Indurre lesioni polmonari acute nei topi mediante instillazione diretta del lipopolioaccaride intracheale
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Presentato qui è una procedura passo-passo per indurre lesioni polmonari acute nei topi mediante instillazione lipopolysaccharide intracheale diretta ed eseguire l'analisi FACS di campioni di sangue, liquido di lavaggio bronchoalveolar e tessuto polmonare. La minima invasività, la manipolazione semplice, la buona riproducibilità e la titolazione della gravità della malattia sono vantaggi di questo approccio.
Abstract
La somministrazione di lipopolioaccharide (LPS) è un modo comune per studiare l'infiammazione polmonare e le lesioni polmonari acute (ALI) in piccoli modelli animali. Sono stati descritti vari approcci, come l'inalazione di LPS aerosolizzato e l'instillazione nasale o intratracheale. Il protocollo presentato descrive una procedura dettagliata passo-passo per indurre ALI nei topi mediante instillazione diretta InTRAtracheal LPS ed eseguire l'analisi FACS di campioni di sangue, liquido bal (Bron) e tessuto polmonare. Dopo la sedazione intraperitoneale, la trachea viene esposta e l'LPS viene somministrato tramite un catetere venoso da 22 G. Una reazione infiammatoria robusta e riproducibile con invasione di leucociti, upregulation delle citochine infiammatorie e interruzione della barriera alveolo-capillare viene indotta in poche ore a giorni, a seconda del dosaggio LPS utilizzato. La raccolta di campioni di sangue, fluido BAL e raccolta polmonare, nonché la lavorazione per l'analisi FACS, sono descritti in dettaglio nel protocollo. Anche se l'uso dell'LPS sterile non è adatto a studiare gli interventi farmacologici nelle malattie infettive, l'approccio descritto offre una minima invasività, una manipolazione semplice e una buona riproducibilità per rispondere a domande immunologiche meccanicistiche. Inoltre, la tezione della dose e l'uso di preparati LPS alternativi o ceppi di topo consentono la modulazione degli effetti clinici, che possono presentare diversi gradi di gravità ALI o in ritardo rispetto all'esordio tardivo dei sintomi della malattia.
Introduzione
I modelli animali sperimentali sono indispensabili nella ricerca immunitaria di base. La somministrazione di batteri interi o componenti microbici è stata spesso utilizzata in piccoli modelli animali per indurre l'infiammazione locale o sistemica1. Lipopolysaccharide (LPS, o endotossina batterica) è un componente della parete cellulare e antigene superficiale di batteri gram-negativi (ad esempio, Enterobacteriaceae, Pseudomonas spp., o Legionella sp.). La molecola termostabile e grande (peso molecolare 1-4 x 106 kDa) è costituita da una moiety lipidica (Lipid A), regione centrale (oligosaccharide) e un polisaccharide O (o antigene O). Il lipido A, con le sue catene di acidi grassi idrofobici, ancora la molecola in una membrana batterica e media (sulla degradazione dei batteri) l'attività immunologica e la tossicità degli LPS. Dopo il legame con la proteina legante LPS (LBP), i complessi LPS:LBP si legano il complesso del recettore CD14/TLR4/MD2 situato sulla superficie di molti tipi di cellule, inducendo una forte reazione infiammatoria con traslocazione nucleare NF-B e successiva upregulation dell'espressione citochina2.
Lesione polmonare acuta (ALI) è definita come insufficienza respiratoria iposemica acuta con edema polmonare bilaterale in assenza di insufficienza cardiaca3. La somministrazione di LPS è un modo comune per indurre infiammazione polmonare e ALI4,5,6,7. Anche se la sostanza sterile non è adatta a studiare gli interventi farmacologici nelle malattie infettive, le domande immunologiche meccanicistiche possono essere risolte con adeguata precisione. L'instillazione di LPS nella trachea induce una reazione infiammatoria robusta con invasione di leucociti, upregulation delle citochine infiammatorie e interruzione della barriera alveolo-capillare entro poche ore o giorni, a seconda del dosaggio di LPS3, 6,7.
Il protocollo presentato descrive una procedura dettagliata passo-passo per indurre ALI nei topi per instillazione Intratracheale LPS. Il modello è stato convalidato valutando l'espressione della citochina, l'invasione dei granulociti dei neutrofili e la perdita di albumina intra-alveolare come descritto in precedenza8.
Protocollo
Questo protocollo sugli animali è stato approvato dal comitato locale per la cura degli animali (LANUV, Recklinghausen, Germania; protocollo n. 84-02.04.2015) ed è stato eseguito in conformità con le linee guida del National Institutes of Health per l'uso di animali vivi (pubblicazione NIH N. 85-23, rivisto 1996).
1. Induzione ALI
- Utilizzare topi adulti C57BL/6 di età di circa 10-12 settimane. Alloggiare gli animali in gabbie ventilate individualmente con libero accesso all'acqua e al chow standard dei roditori. Tuttavia, è possibile eseguire questo approccio sugli animali più giovani e con altri ceppi di topi.
- Conservare LPS (Escherichia coli O111:B4) in aliquote in concentrazioni di 5 mg/mL a -20 gradi centigradi. Per l'instillazione intratracheale, diluire l'LPS in salina sterile con buffer di fosfato (PBS) fino a una concentrazione finale di 2.000 g/mL.
- Pesare il mouse. Iniettare chetamina [120 mg/kg di peso corporeo del topo (BW)] e xylazina (16 mg/kg BW) intraperitonealmente (inferiore a un terzo dell'addome, paramedico), e attendere l'insorgenza dell'anestesia.
- Controllare la profondità dell'anestesia inducendo uno stimolo tattile. In caso di anestesia insufficiente, ripetere l'iniezione con ketamina (30 mg/kg BW) e xylazina (4 mg/kg BW).
- Posizionare il mouse in posizione prona su un tavolo a temperatura controllata per mantenere una temperatura corporea di 37 gradi centigradi.
- Applicare lubrificante oftalmico sterile per prevenire la disidratazione delle cornee in anestesia.
- Sollevare gli incisivi di testa e ganci su una barra orizzontale posizionata a circa 5 cm sopra il tavolo, mentre le zampe anteriori rimangono a stretto contatto con il tavolo. Estendere super il collo in un angolo di 90 gradi rispetto alla tabella (Figura 1). Tenere la lingua con pinze per raddrizzare la gola per condizioni di intubazione più facili.
- Tagliare un catetere vetro 22 calibro 22 (G) a una lunghezza di 20 mm. Inserire delicatamente il catetere nella direzione verticale lungo la radice della lingua. Posizionare una fonte di luce fredda sulla pelle sopra la larinx per aiutare a visualizzare le corde vocali e mirare alla trachea. Se si verifica la resistenza della lassocia, ritrarre il catetere di qualche millimetro prima di avanzare di nuovo.
- Inserire il catetere di circa 10 mm nella trachea. Assicurarsi che l'inserimento non sia troppo profondo in quanto ciò comporterà l'instillazione unilaterale del fluido nel bronco principale destro o sinistro.
- Iniettare l'LPS (5 g/g BW) diluito in PBS utilizzando una pipetta [il volume iniettato dipende dal peso corporeo del mouse (ad esempio, 20 g di peso corporeo - utilizzare 50 L di soluzione LPS)].
NOTA: Il topo in genere risponde con tosse o ansimante per una corretta instillazione di liquido nella trachea. - Collegare una siringa e aggiungere un bolo di 50 mL di aria per assicurare che il volume liquido completo sia distribuito nei polmoni. Rimuovere lentamente il catetere.
- Mantenere la parte superiore del corpo del mouse in posizione eretta per 30 s per evitare perdite del fluido dalla trachea.
- Negli animali con finta, iniettare 50 - L di PBS sterile intratrachealmente invece di LPS.
- Iniettare l'idrocloruro buprenormina 0,08 mg/kg di BW sottocutaneamente nella pelle sciolta sopra il collo immediatamente dopo l'induzione di ALI e ogni 12 h successivamente, durante i primi 48 h.
- Mantenere una temperatura corporea di 37 gradi centigradi fino a quando non si riacquistò la piena consapevolezza mantenendo il mouse sul pad riscaldante.
- Trasferire il mouse in una gabbia ventilata individualmente con libero accesso al cibo e all'acqua. Monitorare regolarmente il mouse. Diminuendo la temperatura corporea e la depressione respiratoria indica una corretta induzione di ALI.
2. Campionamento del sangue, lavaggio bronchoalveolar, raccolta di organi
NOTA: La tempistica dell'eutanasia dipende dalla questione scientifica affrontata. Di solito, viene eseguita 12-72 h dopo l'instillazione LPS3,4,9,10. La gravità dell'ALI può essere determinata clinicamente dall'osservazione regolare della temperatura corporea e dei sintomi di disagio respiratorio11.
- Indurre l'anestesia posizionando il topo in una camera inondata di isoflurane. Utilizzare 3 vol% isoflurane con un flusso di ossigeno di 1 L/min. Assicurarsi narcosi profonda inducendo uno stimolo tattile. In caso di profondità insufficiente di anestesia, aumentare l'isoflurane fino al 5 vol%.
- Sacrificare il topo in anestesia profonda da lussazione atlanto-occipitale.
- Fissare il mouse con nastro adesivo su un tavolo operatorio e disinfettare a breve la pelliccia sull'addome con il 70% di etanolo. Aprire la cavità addominale con attenzione nella linea mediana con forbici e pinzette. Rimuovere parti dell'intestino per ottenere l'accesso alla vena cava inferiore (IVC) direttamente alla colonna vertebrale e l'aorta addominale.
- Individuare le vene renali e inserire una canula piegata da 23 G collegata a una siringa da 1 mL nell'IVC direttamente sotto la confluenza delle vene. Aspirati 250 - L di sangue e trasferire in un tubo da 1,5 mL riempito con 20 .L di 0,5 M di acido etilenediaminetra (EDTA) soluzione. Agitare delicatamente per facilitare la miscelazione EDTA e mettere il tubo sul ghiaccio.
- Per la lavanda bronchoalveolar (BAL), preparare tre siringhe da 1 mL con 0,5 mL di PBS sterile e 0,1 mL di aria ciascuna. Disinfettare poco la pelliccia della gola con il 70% di etanolo ed esporre con attenzione la trachea con forbici e pinzette. Mobilitare la trachea e avvolgere una sutura.
- Eseguire BAL: Forare la trachea utilizzando microforsa e inserire un catetere venoso da 22 G tagliato a una lunghezza di 20 mm. Fissare il catetere con la sutura e instillare 0,5 mL di PBS sterile e 0,1 mL di aria. Aspirare il fluido dopo 60 s. Ripetere la procedura con le altre due siringhe e raccogliere l'intero aspirato in un tubo da 15 mL sul ghiaccio.
- Aprire con attenzione il torace con forbici e pinzette per raccogliere i polmoni. Tagliare il diaframma lungo il margine costale e tagliare le costole con due incisioni laterali. Evitare di forare i polmoni. Sollevare lo sterno cranialmente e fissarlo o rimuoverlo.
- Preparare due siringhe da 10 mL con PBS caldo a 37 gradi (senza calcio e magnesio). Fare una piccola incisione nel ventricolo sinistro. Forare il ventricolo destro con una canula da 26 G e lavare la circolazione polmonare con il PBS preriscaldato. Essere consapevoli dei polmoni impallidire durante la procedura.
- Rimuovere il lobo destro dei polmoni e tagliarlo in due metà. Agganciali congelarli in azoto liquido, seguito da stoccaggio a lungo termine a -80 gradi centigradi per un'ulteriore espressione genica e analisi delle proteine.
- Rimuovere l'intero polmone sinistro e omogeneizzare in una piastra di 48 pozzo macintezzando il tessuto con forbice e pinzetta. Incubare il tessuto in 2 mL di buffer di digestione [RPMI 1640 con 10% siero di vitello fetale (FCS) e 0,1% NaN3, collagenase I (1 mg/mL) e DNase II (7 mg/mL) a 37 s per 60 min. Eseguire un'ulteriore omogeneizzazione con il pipetismo dei pezzi di tessuto polmonare e giù.
3. Preparazione dei tessuti per l'analisi FACS
- Preparare un buffer FACS fresco (Tabella 1): utilizzare sempre PBS senza calcio e magnesio per ridurre l'adesione da cellula a cellula dipendente dalla cation e prevenire l'aderazione. Supplemento con FCS (1%) per proteggere le cellule dall'apoptosi, prevenire la colorazione non specifica e impedire alle cellule di attaccarsi ai tubi FACS. Includere EDTA (0,5 mM) per impedire l'adesione da cellula a cellula basata sulla cation quando si lavora con cellule appiccicose e aderenti come i macrofagi. Aggiungere azide di sodio (0,1%), in quanto previene la contaminazione batterica e il fotosbiancamento di fluorocro e blocca lo spargimento di anticorpi.
- Trasferire i campioni di sangue (passaggio 2.4) in 5 mL tubi FACS e mescolare delicatamente il sangue con 2 mL di lisi di lissi dei globuli rossi. Mettere i tubi sul ghiaccio e terminare la reazione dopo 2 min aggiungendo 2 mL di PBS ghiacciato. Centrifugare i campioni per 5 min a 400 x g e scartare il supernatante. Risospendere il pellet cellulare con 60 l di buffer E processo FACS per la successiva colorazione FACS secondo i protocolli descritti in precedenza12.
NOTA: I tempi di eutanasia del topo influenza leucociti contano come parte dell'infiammazione sistemica. Pertanto, si consiglia di regolare il numero di cellulare a 1 x 106 celle/60 - L in questo passaggio per ottenere i migliori risultati di colorazione per l'analisi della citometria di flusso. - Centrifuga liquido BAL (passaggio 2.6) per 5 min a 400 x g. Aspirare il superataente e congelarlo in azoto liquido, seguito da stoccaggio a lungo termine a -80 gradi centigradi per ulteriori analisi delle proteine. Risospendere il pellet a cellule BAL con 2 mL di buffer FACS freddo, quindi trasferire la sospensione in un tubo FACS da 5 mL utilizzando un filtro a maglie da 100 m per filtrare i peli.
- Ancora una volta, centrifugare il campione per 5 min a 400 x g. Risospendere il pellet con 60 l di buffer FACS e il processo per la successiva colorazione FACS secondo i protocolli descritti in precedenza12.
NOTA: I tempi di eutanasia del topo influenza leucociti contano in BAL come parte dell'infiammazione. Pertanto, si consiglia di regolare il numero di cellulare a 1 x 106 celle/60 - L in questo passaggio per ottenere i migliori risultati di colorazione per l'analisi della citometria di flusso. - Trasferire il tessuto polmonare sinistro digerito (passaggio 2,10) in un tubo FACS da 5 mL utilizzando un filtro a rete da 100 l per estrarre i grumi e terminare il processo di digestione aggiungendo 2 mL di buffer FACS ghiacciato. Centrifugare il campione per 5 min a 400 x g. Scartare il supernatante e risospendere nuovamente il pellet con 60 l di buffer FACS e il processo per la successiva colorazione FACS secondo protocolli precedentemente descritti12.
NOTA: I tempi di eutanasia del topo influenza il leucocito contano nel tessuto polmonare come parte dell'infiammazione. Pertanto, si consiglia di regolare il numero di cellulare a 1 x 106 celle/60 l per ottenere i migliori risultati di colorazione per l'analisi della citometria di flusso. - Per l'analisi FACS, incubare cellule con anticorpi CD16/CD32 a 4 gradi centigradi per 15 min per bloccare il legame non specifico dell'immunoglobulina ai recettori Fc. Aggiungere 20 - L di soluzione di blocco a 1 x 106 celle in 60 -L in un tubo da 5 mL.
- Nel frattempo, preparare un mix master con il buffer FACS e gli anticorpi come descritto nella tabella 2.
- Dopo il blocco, non lavare le cellule. Aggiungere 20 l di miscela master anticorpale per campione per ottenere un volume finale di 100 .L. Incubare i campioni per 20 min al buio a 4 gradi centigradi.
- Lavare ogni campione con 1 mL di tampone FACS e centrifuga per 5 min a 400 x g. Scartare il supernatante e sospendere nuovamente il pellet con buffer FACS alla concentrazione cellulare appropriata per le misurazioni FACS.
NOTA: Si suggerisce un numero di cellule di 1 x 106 cellule/500 -L per ottenere i migliori risultati di fenotipizzazione immunitaria nell'analisi FACS con questo protocollo. Tuttavia, si raccomanda che gli anticorpi debbano essere titolati singolarmente. - Se necessario, aggiungere la colorazione viva/morta prima della colorazione superficiale utilizzando specifici kit disponibili in commercio8.
- Infine, aggiungere a ciascun campione un numero fisso di perline di calibrazione con accoppiamento fluorocrocro disponibile in commercio (3 x 105 perline in 20 l di buffer FACS) a ciascun campione per determinare i numeri di cella assoluti12. La strategia di gating per le cellule del sangue, BAL e tissutali è illustrata nella Figura 2.
Risultati
L'approccio descritto per indurre l'ALI nei topi è stato convalidato valutando l'espressione della citochina, l'infiltrazione dei granulociti dei neutrofili e l'interruzione della barriera alveolo-capillare 24 h e 72 h dopo l'instillazione di LPS. Gli animali iniettati da PBS fungevano da controllo. La somministrazione di LPS intratracheali ha indotto una robusta risposta infiammatoria polmonare. L'espressione del TNF-z nel tessuto polmonare è stata significativamente upregola, raggiungendo un aumento sostenuto e superiore a 50 volte rispetto agli animali di controllo [RQ (TNF-z/18s); 24 h: 53,7 (SD - 11,6); 72 h: 55,0 (SD - 20,6); p < 0.05)] (Figura 3A). L'invasione del leucocito nello spazio dei tessuti e degli alveolare è un segno distintivo e caratteristico per lo sviluppo di ALI13. L'analisi FACS ha rivelato una significativa infiltrazione di granulociti neutrofili (NG) nell'interstizio polmonare, con il numero assoluto di cellule aumentato di quasi 9 volte rispetto ai controlli dopo 24 h [65.243 (SD - 15.855) contro 7.358 (SD - 4.794), p < 0.05] ( Figura 3B). Il conteggio assoluto di NG è leggermente diminuito dopo 72 h; tuttavia, l'aumento dei fattori rispetto ai controlli è rimasto stabile [48.946 (SD - 5.223) rispetto a 5.510 (SD - 654), p < 0,05]. Coerentemente con l'infiltrazione di NG interstiziale, l'espressione di MMP-9 nel tessuto polmonare intero è stata altrettanto significativamente aumentata nel periodo di osservazione totale [RQ (MMP-9/18s), 24 h: 7.4 (SD - 1.5); 72 h: 10.4 (SD - 2.0); p < 0.05] (Figura 3C).
NG sono stati aumentati non solo nel tessuto polmonare, ma anche nel fluido BAL. L'aumento di piegatura rispetto agli animali di controllo è stato più pronunciato che nel tessuto polmonare, con conteggi NG assoluti 24 h dopo l'induzione di ALI di 52.005 (SD - 21.906) contro 1.829 (SD - 1.724) (p < 0,05) (Figura 3D). Dopo 72 h, NG sono stati aumentati a 37.254 (SD - 4.478) rispetto a 17,0 (SD - 10,8) (p < 0,05). L'edema polmonare dovuto alla grave compromissione della barriera alveolo-capillare è patognomonico per lo sviluppo di ALI, con LPS che induce rapidamente apoptosi endoteliale e una maggiore permeabilità14,15. L'analisi del contenuto di inodino nel fluido BAL di ELISA ha rivelato una significativa perdita di funzione di barriera. 24 h dopo l'instillazione di LPS, l'albumina nel fluido BAL era di 43 ng/mL (SD - 13), rispetto a 20 ng/mL (SD - 9) in condizioni di controllo (p < 0.05) (Figura 3E). Dopo 72 h, negli animali ALI, il contenuto dell'albumo era di 48 ng/mL (SD - 14), rispetto a 29 ng/mL (SD - 9) (p < 0,05).

Figura 1 : Diagramma schematico dell'impostazione dell'intubazione. Va notato che il collo del mouse deve essere super-esteso ad un angolo di 90 gradi rispetto alla tabella delle operazioni. Fare clic qui per visualizzare una versione più grande di questa figura.
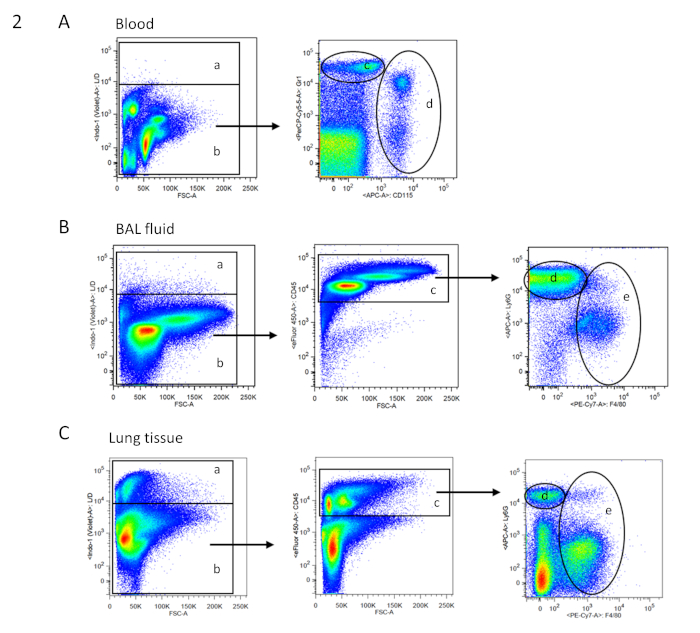
Figura 2 : strategia di gating FACS per cellule del sangue, bal e tissutali. Le macchie di punti esemplari dell'analisi FACS sono mostrate in grafici pseudocolore a due parametri (fluorescenza a doppio colore). La strategia di Gating per i rispettivi campioni si basa su singole cellule. (A) Albero gating per le cellule del sangue: un - cellule morte; b - cellule vive (secondo la colorazione delle cellule vive/morte; nessuna colorazione CD45 necessaria come nel sangue, un'elevata autofluorescenza rende le popolazioni cellulari chiaramente distinguibili); d - granulociti neutrofili; e - monociti (secondo le colorazioni Gr1 e CD115). (B) Albero di Gating per il liquido bronchoalveolar lavage (BAL): a cellule morte; b - cellule viventi (secondo la colorazione delle cellule vive/morte); c - CD45- cellule immunitarie; d - granulociti neutrofili; macrofagi (secondo la colorazione Ly6G e F4/80). (C) Albero gating per il tessuto polmonare: una cellule morte; b - cellule viventi (secondo la colorazione delle cellule vive/morte); c - CD45- cellule immunitarie; d - granulociti neutrofili; macrofagi (secondo la colorazione Ly6G e F4/80). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3 : Convalida del modello alI murine contro gli animali di controllo. (A) Espressione del TNF-z nel tessuto polmonare di topi femmina C57BL/6 24 h e 72 h a seguito dell'instillazione Intratracheale LPS (cambio di piega dell'espressione degli animali mareggiati). (B) L'analisi FACS del conteggio dei granulociti di neutrofilo assoluto nel tessuto polmonare. (C) Espressione di MMP-9 nel tessuto polmonare (cambio di espressione di animali mafiosi). (D) L'analisi FACS del conteggio dei granulociti di neutrofili asso nel liquido di lavaggio dei broncoalveolar. (E) Contenuto dell'albumina nel fluido BAL [media : SD, n - 7, test Mann-Whitney U, .p < 0.05 (vs controllo PBS)]. Questa cifra è stata modificata da Ehrentraut et al.8. Fare clic qui per visualizzare una versione più grande di questa figura.
| Nome del materiale/attrezzature | Volume (mL) |
| Dulbecco's Foshate Buffered Saline (PBS), senza cloruro di calcio e cloruro di magnesio, sterile | 1000 |
| Siero di vitello fetale (FCS) | 1 : il nome del |
| Soluzione di acido etilenediaminetratraace (EDTA) | 1 : il nome del |
| Azide di sodio (NaN3) | 0.1 0 |
Tabella 1: Composizione del buffer FACS.
| Nome del materiale/attrezzature | Diluizione suggerita | Mastermix per 10 campioni: aggiungere a 200 buffer FACS da 200 l (20 USD per campione): |
| Anti-CD115 (c-fms) APC | 0,5 l/l LL | 5 ll |
| Anti-CD11b (M1/70) - FITC | 0,5 l/l LL | 5 ll |
| Anti-CD45 (30-F11) - eF450 | 0,5 l/l LL | 5 ll |
| Anti-F4/80 (BM-8) - PE Cy7 | 0,5 l/l LL | 5 ll |
| Anti-Gr1 (RB6-8C5) | 0,5 l/l LL | 5 ll |
| Anti-Ly6C (HK1.4) PerCP-Cy5.5 | 0,5 l/l LL | 5 ll |
| Anti-Ly6G (1A8) APC/Cy7 | 0,5 l/l LL | 5 ll |
Tabella 2: Preparazione del master mix per la colorazione FACS. La tabella descrive la preparazione della combinazione master per 10 campioni.
Discussione
La minima invasività, la manipolazione semplice e la buona riproducibilità sono caratteristiche chiave dell'approccio presentato per indurre ALI in un piccolo modello di roditore. L'uso di LPS invece di batteri interi nei modelli animali ha dei vantaggi. È un composto stabile e puro e può essere conservato in forma liofilizzata fino all'uso. È un potente stimolante per le risposte immunitarie innate attraverso il percorso TLR4, e la sua attività biologica può essere facilmente quantificata, facilitando la titolazione della gravità della malattia con una buona riproducibilità. Inoltre, l'uso di LPS ha dimostrato di servire come modello sicuro per indurre bronchite acuta in volontari sani e umani e permette così la traduzione dal banco al capezzale16. Rittirsch et al. hanno dimostrato gli sviluppi dipendenti dalla dose e dal tempo della caratteristica perdita alveolo-capillare in un modello murino di instillazione LPS intratracheale6. Questo permette dose di titolazione per raggiungere alcuni effetti desiderati, che possono illustrare diversi gradi di gravità ALI o precoce contro insorgenza tardiva dei sintomi della malattia. Tuttavia, se si devono affrontare problemi infettivi o farmacologici distinti (ad esempio, terapia antibiotica), l'ALI indotto dall'instillazione sterile di LPS non è un modello adatto.
Inoltre, rispetto alla somministrazione intrapolmonare o endovenosa di batteri, l'interruzione della barriera alveolo-capillary è stata descritta come piuttosto lieve3, mettendo in discussione l'idoneità di questo modello e se la permeabilità alterata debba essere in particolare. Il corretto posizionamento del catetere per consegnare l'LPS bilateralmente nel tratto respiratorio inferiore è la fase critica dell'approccio. Per garantire una corretta intubazione intratracheale, la visualizzazione e l'identificazione della laidrola è facilitata da una fonte di luce fredda esterna. I cambiamenti nel modello respiratorio (ad esempio, tosse o ansimante) verificano la corretta instillazione intratracheale del fluido.
Inoltre, la scelta della deformazione del mouse e degli LPS sono fondamentali per l'induzione di ALI e la generazione di risultati riproducibili in questo modello e dipendono dalla questione scientifica affrontata. Secondo la letteratura, il dosaggio somministrato per suscitare un effetto massimo senza aumentare ulteriormente con l'escalation dei dosaggi varia da 10 g/topo (quando LPS da Pseudomonas aeruginosa F-D tipo 1 viene iniettato nella femmina di BALB / c topi) a 50 g / mouse quando iniettando E. coli (sierotipo O111:B4) LPS (che è stato utilizzato anche nel protocollo) nei topi maschi C57BL/66,9. In generale, i topi BALB/c dovrebbero reagire in modo sensibile quando vengono sfidati con LPS, mentre i topi C57BL/6 sembrano essere più resistenti3. Pertanto, si raccomandano esperimenti iniziali di titolazione della dose nel rispetto delle singole condizioni. Questo vale anche per la tempistica del campionamento di sangue, BAL e organo. La gravità di ALI può essere determinata clinicamente dall'osservazione regolare della temperatura corporea e dei sintomi di disagio respiratorio. Inoltre, poiché i topi condividono solo circa il 50% omologia del recettore TLR4 con gli esseri umani, un'attenta interpretazione dei risultati è obbligatoria3.
Le alternative all'approccio qui presentato comprendono il percorso di somministrazione di endotossina ai polmoni. Come descritto da Szarka et al., LPS può anche essere somministrato tramite instillazione intranasale9. ha confrontato la deposizione intratracheale diretta con l'inalazione di LPS aerosolizzati5. Sulla base delle loro scoperte, hanno concluso che la via inalazionale induce un tipo più uniforme di ALI. Tuttavia, i loro esperimenti sono stati eseguiti in ratti con un'inalazione solo naso a flusso diretto e non possono quindi essere necessariamente trasferiti all'approccio qui presentato. Al contrario, i topi sono spesso esposti a LPS aerosolizzati in una camera10. Le dimensioni della camera, la concentrazione di LPS e il numero di topi trattati simultaneamente sono variabili che limitano la comparabilità tra diversi studi e rendono raccomandato un singolo modello di stabilimento. Infine, la somministrazione endovenosa o intraperita di LPS viene spesso utilizzata per indurre alI17,18. Come suggeriscono i dati di Szarka et al., l'instillazione intratracheale sembra essere superiore al percorso i.v. o i.p. quando si affrontano specifici effetti infiammatori polmonari9. In conclusione, il protocollo rappresenta un approccio semplice e riproducibile per indurre l'ALI sterile nei topi ad affrontare problemi immunologici specifici.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori desiderano ringraziare Jan Kleiner e Susanne Schulz per aver fornito supporto tecnico. Gli autori riconoscono l'eccellente supporto della struttura centrale di citometria di flusso presso la facoltà di medicina dell'Università di Bonn. Gli autori non hanno ricevuto alcun finanziamento da alcuna organizzazione esterna. Parte dei dati forniti nella sezione dei risultati e illustrati nella figura 3 è già stata mostrata in una precedente pubblicazione8.
Materiali
| Name | Company | Catalog Number | Comments |
| 1 ml syringes | BD, Franklin Lakes, NJ, USA | 300013 | |
| 10 ml syringes | BD, Franklin Lakes, NJ, USA | 309110 | |
| Anti-CD115 (c-fms) APC | Thermo Fisher, Waltham, MA, USA | 17-1152-80 | |
| Anti-CD11b (M1/70) - FITC | Thermo Fisher, Waltham, MA, USA | 11-0112-81 | |
| Anti-CD45 (30-F11) - eF450 | Thermo Fisher, Waltham, MA, USA | 48-0451-82 | |
| Anti-F4/80 (BM-8) - PE Cy7 | Thermo Fisher, Waltham, MA, USA | 25-4801-82 | |
| Anti-Gr1 (RB6-8C5) | BD Biosciences, Franklin Lakes, NJ, USA | 552093 | |
| Anti-Ly6C (HK1.4) PerCP-Cy5.5 | Thermo Fisher, Waltham, MA, USA | 45-5932-82 | |
| Anti-Ly6G (1A8) APC/Cy7 | Bio Legend, San Diego, CA | 127623 | |
| Buprenorphine hydrochloride | Indivior UK Limited, Berkshire, UK | ||
| C57BL/6 mice, female, 10 - 12 weeks old | Charles River, Wilmongton, MA, USA | ||
| CaliBRITE APC-beads (6µm) | BD Biosciences, Franklin Lakes, NJ, USA | 340487 | |
| Canula 23 gauge 1'' | BD, Franklin Lakes, NJ, USA | 300800 | |
| Canula 26 gauge 1/2'' | BD, Franklin Lakes, NJ, USA | 303800 | |
| Cell strainer 70 µm | BD Biosciences, Franklin Lakes, NJ, USA | 352350 | |
| Collagenase Type I | Sigma-Aldrich, St. Louis, MO, USA | 1148089 | |
| Deoxyribonuclease II | Sigma-Aldrich, St. Louis, MO, USA | D8764 | |
| Dulbecco's Phosphate Buffered Saline (PBS), sterile | Sigma-Aldrich, St. Louis, MO, USA | D8662 | |
| Dulbecco’s Phosphate Buffered Saline (PBS), without calcium chloride and magnesium chloride, sterile | Sigma-Aldrich, St. Louis, MO, USA | D8537 | |
| Ethylenediaminetetraacetic acid (EDTA) solution | Sigma-Aldrich, St. Louis, MO, USA | E7889 | |
| FACS tubes, 5 ml | Sarstedt, Nümbrecht, Germany | 551579 | |
| Fetal calf serum (FCS) | Sigma-Aldrich, St. Louis, MO, USA | F2442 | |
| Forceps | Fine Science Tools, Heidelberg, Germany | 11049-10 | |
| Isoflurane | Baxter, Unterschleißheim, Germany | ||
| Ketamine hydrochloride | Serumwerk Bernburg, Bernburg, Germany | ||
| Lipopolysaccharides (LPS) from Escherichia coli O111:B4 | Sigma-Aldrich, St. Louis, MO, USA | L2630 | |
| LIVE/DEAD Fixable Dead Cell Green Kit | Thermo Fisher, Waltham, MA, USA | L23101 | |
| Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block™), Clone 2.4G2 | BD, Franklin Lakes, NJ, USA | 553141 | |
| Red blood cell lysis buffer | Thermo Fisher, Waltham, MA, USA | 00-4333-57 | |
| RPMI-1640, with L-glutamine and sodium bicarbonate | Sigma-Aldrich, St. Louis, MO, USA | R8758 | |
| Scissors | Fine Science Tools, Heidelberg, Germany | 14060-09 | |
| Sodium azide (NaN3) | Sigma-Aldrich, St. Louis, MO, USA | S2002 | |
| Spring scissors | Fine Science Tools, Heidelberg, Germany | 15018-10 | |
| Tissue forceps | Fine Science Tools, Heidelberg, Germany | 11021-12 | |
| Tubes | Eppendorf, Hamburg, Germany | 30125150 | |
| Venous catheter, 22 gauge | B.Braun, Melsungen, Germany | 4268091B | |
| Xylazine hydrochloride | Serumwerk Bernburg, Bernburg, Germany |
Riferimenti
- Fink, M. P. Animal models of sepsis. Virulence. 5 (1), 143-153 (2014).
- Lu, Y. -C., Yeh, W. -C., Ohashi, P. S. LPS/TLR4 signal transduction pathway. Cytokine. 42 (2), 145-151 (2008).
- Matute-Bello, G., Frevert, C. W., Martin, T. R. Animal models of acute lung injury. American Journal of Physiology - Lung Cellular and Molecular Physiology. 295 (3), 379-399 (2008).
- Rabelo, M. A. E., et al. Acute Lung Injury in Response to Intratracheal Instillation of Lipopolysaccharide in an Animal Model of Emphysema Induced by Elastase. Inflammation. 41 (1), 174-182 (2018).
- Liu, F., Li, W., Pauluhn, J., Trübel, H., Wang, C. Lipopolysaccharide-induced acute lung injury in rats: comparative assessment of intratracheal instillation and aerosol inhalation. Toxicology. 304, 158-166 (2013).
- Rittirsch, D., et al. Acute Lung Injury Induced by Lipopolysaccharide Is Independent of Complement Activation. Journal of Immunology. 180 (11), Baltimore, Md. 7664-7672 (2008).
- D'Alessio, F. R., et al. CD4+CD25+Foxp3+ Tregs resolve experimental lung injury in mice and are present in humans with acute lung injury. The Journal of Clinical Investigation. 119 (10), 2898-2913 (2009).
- Ehrentraut, H., Weisheit, C., Scheck, M., Frede, S., Hilbert, T. Experimental murine acute lung injury induces increase of pulmonary TIE2-expressing macrophages. Journal of Inflammation. 15, 12(2018).
- Szarka, R. J., Wang, N., Gordon, L., Nation, P. N., Smith, R. H. A murine model of pulmonary damage induced by lipopolysaccharide via intranasal instillation. Journal of Immunological Methods. 202 (1), 49-57 (1997).
- Reutershan, J., Basit, A., Galkina, E. V., Ley, K. Sequential recruitment of neutrophils into lung and bronchoalveolar lavage fluid in LPS-induced acute lung injury. American Journal of Physiology. Lung Cellular and Molecular Physiology. 289 (5), 807-815 (2005).
- Hoegl, S., et al. Capturing the multifactorial nature of ARDS - approach to model murine acute lung injury. Physiological Reports. 6 (6), (2018).
- Weisheit, C., et al. Ly6Clow and Not Ly6Chigh Macrophages Accumulate First in the Heart in a Model of Murine Pressure-Overload. PLoS ONE. 9 (11), (2014).
- Grommes, J., Soehnlein, O. Contribution of Neutrophils to Acute Lung Injury. Molecular Medicine. 17 (3-4), 293-307 (2011).
- Müller-Redetzky, H. C., Suttorp, N., Witzenrath, M. Dynamics of pulmonary endothelial barrier function in acute inflammation: mechanisms and therapeutic perspectives. Cell and Tissue Research. 355 (3), 657-673 (2014).
- Fujita, M., et al. Endothelial cell apoptosis in lipopolysaccharide-induced lung injury in mice. International Archives of Allergy and Immunology. 117 (3), 202-208 (1998).
- Doyen, V., et al. Inflammation induced by inhaled lipopolysaccharide depends on particle size in healthy volunteers. British Journal of Clinical Pharmacology. 82 (5), 1371-1381 (2016).
- Stephens, R. S., Johnston, L., Servinsky, L., Kim, B. S., Damarla, M. The tyrosine kinase inhibitor imatinib prevents lung injury and death after intravenous LPS in mice. Physiological Reports. 3 (11), (2015).
- Yu, Y., Jing, L., Zhang, X., Gao, C. Simvastatin Attenuates Acute Lung Injury via Regulating CDC42-PAK4 and Endothelial Microparticles. Shock. 47 (3), Augusta, Ga. 378-384 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon