Method Article
通过直接内切内脂多糖灌输诱导小鼠急性肺损伤
摘要
这里介绍的是一个逐步的过程,通过直接的内切内脂多糖灌输诱导小鼠急性肺损伤,并执行FACS分析血液样本,支气管洗浴液和肺组织。微创性、简单处理、良好的可重复性和疾病严重程度的滴定是这种方法的优点。
摘要
脂多糖(LPS)气道管理是研究小动物模型中肺部炎症和急性肺损伤(ALI)的常用方法。已经描述了各种方法,例如吸入气溶胶LPS以及鼻腔或内气浸灌输。提出的方案描述了通过直接宫内LPS灌输诱导小鼠ALI的详细分步程序,并执行对血液样本、支气管性(BAL)液体和肺组织的FACS分析。腹管内镇化后,气管暴露,LPS通过22G静脉导管施用。根据使用的LPS剂量,在数到几天内诱导一种强健且可重复的炎症反应,其内为白细胞入侵、前列腺炎细胞因子的增调和白细胞屏障的中断。协议详细介绍了采集血液样本、BAL液体和肺采集以及FACS分析的处理。虽然无菌LPS的使用不适合研究传染病的药理干预,但所述方法提供最小的侵入性、简单的处理和良好的可重复性来回答机械免疫学问题。此外,剂量滴定以及使用替代LPS制剂或小鼠菌株允许调节临床效果,这可能表现出不同程度的ALI严重程度或早期与晚发病症状。
引言
实验动物模型在基础免疫研究中不可或缺。管理整个细菌或微生物成分已经常用于小动物模型,以诱发局部或全身炎症1。脂多糖(LPS,或细菌内毒素)是一种细胞壁成分和克阴性细菌的表面抗原(例如,肠杆菌、伪多糖,或军团菌)。热稳定和大分子(分子量1-4 x 106 kDa)由脂质莫伊蒂(脂质A)、核心区域(寡糖)和O多糖(或O抗原)组成。脂质A,其疏水性脂肪酸链,锚定分子到细菌膜和调解(在细菌降解)的免疫活性和毒性的LPS。继与LPS结合蛋白(LBP)结合后,LPS:LBP复合物可使位于许多细胞类型的表面的CD14/TLR4/MD2受体复合物结合,通过NF-βB核易位和随后的上升调节诱导强烈的前列腺炎反应细胞因子表达2。
急性肺损伤(ALI)被定义为急性低氧呼吸衰竭与双边肺水肿,在没有心力衰竭3。LPS的气道管理是诱发肺部炎症和ALI4,5,6,7的常见方法。虽然无菌物质不适合研究传染病的药理干预,但机械免疫学问题可以足够精确地回答。LPS 注入气管诱导强大的炎症反应与白细胞入侵, 前列腺炎细胞因子的调节, 和中断的白细胞 - 毛细血管屏障在几个小时到几天内, 取决于 LPS 剂量3, 6,7.
提出的协议描述了通过内切液LPS灌输诱导小鼠的ALI的详细分步程序。该模型已经通过评估细胞因子表达、中性粒细胞细胞入侵和肺泡内白蛋白泄漏进行了验证,如前所述8。
研究方案
此动物协议由当地动物护理委员会(德国莱克林豪森的LANUV;第84-02.04.2015号协议)批准,并根据国家卫生研究院使用活体动物的准则(NIH出版物)执行第85-23号,1996年修订)。
1. 阿里公司感应
- 在10-12周的年龄使用成年C57BL/6小鼠。将动物安置在单独通风的笼子里,免费获得水和标准啮齿动物。然而,有可能对年轻的动物和其他小鼠菌株执行这种方法。
- 在-20°C下以5mg/mL的浓度将LPS(大肠杆菌O111:B4)储存在等分物中。对于内切液灌输,将无菌磷酸盐缓冲盐水(PBS)中的LPS稀释至最终浓度为2,000微克/mL。
- 称量鼠标。注射氯胺酮 [120 毫克/千克小鼠体重 (BW)] 和木拉津 (16 mg/kg BW) 腹内 (腹部下三分之一, 副苯丙胺), 并等待麻醉开始.
- 通过诱导触觉刺激检查麻醉深度。在麻醉不足的情况下,用氯胺酮(30毫克/千克BW)和木拉津(4毫克/千克BW)重复注射。
- 将鼠标置于温度控制表上的易发位置,以保持 37°C 的体温。
- 应用无菌性眼科润滑剂,防止麻醉下角膜干燥。
- 将头部和钩形切口抬起位于桌子上方约 5 厘米的水平杆上,而前爪与桌子保持密切接触。相对于桌子,以 90° 角将颈部超延长(图 1)。用钳子握住舌头,以拉直喉咙,以简化插管条件。
- 将 22 号 (G) 静脉导管切割至 20 mm 的长度,沿舌头根部沿垂直方向轻轻插入导管。在喉上方的皮肤上放置冷光源,以帮助可视化声带,并瞄准气管。如果发生喉部阻力,在再次前进之前,将导管缩回几毫米。
- 将导管插入气管约 10 mm。确保插入不要太深,因为这将导致液体单方面注入右侧或左侧主支气管。
- 使用移液器在 PBS 中稀释的注射 LPS (5 μg/g BW) [注射体积取决于小鼠体重(例如,20 g 体重 = 使用 50 μl 的 LPS 溶液)]。
注:小鼠通常会咳嗽或喘息,以适当将液体注入气管。 - 连接注射器并加入 50 mL 空气,以确保完全的液体体积分布在肺部。慢慢取下导管。
- 保持鼠标上半身直立姿势 30 s,以避免液体从气管泄漏。
- 在假手术的动物中,在气管内注射50μL无菌PBS,而不是LPS。
- 在ALI诱导后立即将盐酸氯丁丙诺啡0.08毫克/千克BW皮下注射到颈部松弛的皮肤中,此后每12小时,在前48小时。
- 保持37°C的体温,直到将鼠标放在加热垫上,恢复完全的意识。
- 将鼠标转移到单独通风的笼子里,免费获得食物和水。定期监视鼠标。体温下降和呼吸抑郁表明ALI的诱导正确。
2. 血液取样、支气管肠活管、器官采集
注:安乐死的时机取决于所处理的科学问题。通常,在LPS灌输3、4、9、10之后执行12-72小时。ALI的严重程度可以通过定期观察体温和呼吸窘迫症状11临床确定。
- 通过将鼠标放入一个充满单曲子的房间里,诱导麻醉。使用含氧量为1升/分钟的3 vol%无氧。在麻醉深度不足的情况下,增加的共分增达5 vol%。
- 通过亚特兰托-腹肌错位在深层麻醉中牺牲小鼠。
- 用胶带将鼠标固定在手术台上,然后用70%乙醇对腹部的毛皮进行消毒。用剪刀和钳子小心地打开中间线的腹腔。取出部分肠道,以达到对椎骨柱和腹部主塔的维纳斯卡瓦低劣(IVC)的通道。
- 找到肾静脉,并将连接到1 mL注射器的弯曲23 G卡努拉插入静脉汇合处正下方的IVC中。吸气250μL的血液,并转移到一个1.5 mL管,填充20μL的0.5M乙烯二甲酸(EDTA)溶液。轻轻摇动,以方便EDTA混合,并将管放在冰上。
- 对于支气管静脉排管 (BAL),准备三个 1 mL 注射器,每个注射器的无菌 PBS 为 0.5 mL,空气为 0.1 mL。很快用70%乙醇对喉咙的皮毛进行消毒,用剪刀和钳子小心地暴露气管。调动气管,包裹缝合线。
- 执行 BAL:用微剪刀刺穿气管,插入22G静脉导管切口至20毫米长。用缝合线固定导管,并注入0.5 mL的无菌PBS和0.1 mL的空气。60s后吸气。用额外的两个注射器重复这个程序,并在冰上的15 mL管中收集整个吸气液。
- 用剪刀和钳子小心地打开胸腔,以收获肺部。沿成本边角切割隔膜,用两个横向切口穿过肋骨。小心避免刺穿肺部。提起胸骨颅,并修复或移除它。
- 用37°C暖PBS(不含钙和镁)制备两个10mL注射器。在左心室做一个小切口。用 26 G 卡努拉刺穿右心室,用预热的 PBS 冲洗肺循环。请注意,在手术过程中肺部会变苍白。
- 取出肺的右叶,切成两半。将它们在液氮中冷冻,然后长期储存在-80°C,以进一步进行基因表达和蛋白质分析。
- 取出整个左肺,并通过用剪刀和钳子切碎组织,将其在48孔板中均匀化。在2 mL消化缓冲液[RPMI 1640中孵育组织,用10%胎儿小牛血清(FCS)和0.1%NaN3,胶原酶I(1mg/mL)和DNase II(7mg/mL)]在37°C下进行60分钟。通过仔细移液肺组织片断,进一步进行均质化。下来。
3. FACS分析的组织准备
- 准备新鲜的FACS缓冲液(表1):始终使用无钙和镁的PBS,以减少阳离子依赖细胞对细胞的粘附,防止结块。补充 FCS (1%)保护细胞免受凋亡,防止非特异性染色,并防止细胞粘附在FACS管上。包括 EDTA (0.5 mM),以防止在使用粘附和粘附细胞(如巨噬细胞)时,基于阳离子的细胞对细胞粘附。加入阿齐德钠(0.1%),因为它可以防止细菌污染和氟铬的光漂白,并阻止抗体脱落。
- 将血液样本(步骤2.4)转移到5 mL FACS管中,将血液与2 mL红细胞莱沙缓冲液轻轻混合。将管子放在冰上,在2分钟后通过加入2 mL的冷PBS终止反应。在 400 x g下将样品离心 5 分钟,并丢弃上清液。根据前面描述的协议12,用60μL的FACS缓冲液重新悬浮细胞颗粒,并处理后续的FACS染色过程。
注:小鼠安乐死的时机影响白细胞计数作为全身炎症的一部分。因此,建议在此步骤中将细胞数调整为 1 x 106细胞/60 μL,以实现流式细胞测定分析的最佳染色结果。 - 离心 BAL 流体(步骤 2.6)在 400 x g下 5 分钟。将上清液吸出并冷冻在液氮中,然后长期储存在-80°C,以便进一步分析蛋白质。用2 mL的冷FACS缓冲液重新悬浮BAL细胞颗粒,然后用100μm网状过滤器将悬浮液转移到5mL FACS管中,以抑制毛发。
- 再次,在400 x g下将样品离心5分钟。根据前面描述的协议12,用60μL的FACS缓冲液重新悬浮颗粒,并处理后续的FACS染色。
注:小鼠安乐死的时机影响BAL中的白细胞计数,作为炎症的一部分。因此,建议在此步骤中将细胞数调整为 1 x 106细胞/60 μL,以实现流式细胞测定分析的最佳染色结果。 - 使用 100 μL 网状过滤器将消化的左肺组织(步骤 2.10)转移到 5 mL FACS 管中,通过添加 2 mL 的冰冷 FACS 缓冲液提取团块并终止消化过程。在 400 x g下将样品离心 5 分钟。丢弃上清液,用60μL的FACS缓冲液重新悬浮颗粒,并按照前面描述的协议12进行后续FACS染色处理。
注:小鼠安乐死的时机影响肺组织中的白细胞计数,作为炎症的一部分。因此,建议将细胞数调整为1 x 106细胞/60 μL,以达到流动细胞测定分析的最佳染色结果。 - 对于FACS分析,用CD16/CD32抗体孵育细胞在4°C下15分钟,以阻止免疫球蛋白与Fc受体的非特异性结合。在 5 mL 管中向 1 x 106个细胞中加入 20 μL 的阻断溶液。
- 同时,如表2所述,准备一个与FACS缓冲液和抗体的母体混合物。
- 阻塞后,不要清洗细胞。每个样品加入20μL的抗体主混合物,以获得100μL的最终体积。
- 用1 mL的FACS缓冲液清洗每个样品,在400 x g下用离心机清洗5分钟。丢弃上清液,用FACS缓冲液将颗粒重新悬浮到适当的细胞浓度,用于FACS测量。
注:在使用该协议的FACS分析中,建议使用1 x 106细胞/500μL的细胞数,以达到最佳的免疫附称结果。然而,建议抗体必须单独打上定位。 - 如果需要,使用特定的市售套件8在表面染色之前添加活/死染色。
- 最后,在每个样品中添加固定数量的市售氟铬耦合校准磁珠(20 μL FACS缓冲液中的3 x 105个珠子),以确定绝对细胞数12。血液、BAL和组织细胞的浇注策略如图2所示。
结果
LPS灌输后,通过评估细胞因子表达、中性粒细胞渗透和肺毛细血管屏障破坏24小时和72小时后,通过评估小鼠诱导ALI的方法得到了验证。PBS注射的动物充当控制。内切术LPS管理诱导一个强大的肺前列腺炎反应。与对照动物相比,肺组织中TNF-α的表达明显增强,达到持续和超过50倍的增幅[RQ(TNF-+/18s);24小时:53.7(SD = 11.6);72小时:55.0(SD = 20.6);p <0.05)](图3A)。白细胞侵入组织和藻外空间是ALI13发展的标志和特征。FACS分析显示,中性粒细胞(NG)大量渗入肺间质,绝对细胞计数比24小时[65,243(SD = 15,855)与7,358(SD = 4,794)后对照组增加近9倍](SD = 4,794),p [lt; 0.05]图 3B.绝对NG计数在72小时后略有下降;然而,与对照组相比,系数增加保持稳定[48,946 (SD = 5,223) 与 5,510 (SD = 654),p < 0.05]。与间质NG渗透一致,整个肺组织的MMP-9表达在总观察期[RQ(MMP-9/18s),24小时:7.4(SD = 1.5);72 h:10.4(SD = 2.0);p [lt; 0.05](图3C) 中同样显著增加。
NG不仅在肺组织增加,而且在BAL流体中增加。与对照动物相比,增加的倍数比肺组织更明显,在ALI诱导52,005(SD = 21,906)后,绝对NG计数为24小时,而1,829(SD = 1,724)(p <0.05)(图3D)。72小时后,NG增加到37,254(SD = 4,478)对17.0(SD = 10.8)(p <0.05)。肺水肿由于严重损伤的肺毛细血管屏障是发展ALI的病变,与LPS迅速诱导内皮凋亡和增加渗透性14,15。ELISA对BAL流体中白蛋白含量的分析表明,阻隔功能显著丧失。LPS灌输后24小时,BAL流体中的白蛋白为43纳克/mL(SD = 13),而在控制条件下为20纳克/mL(SD = 9)(图3E)。72小时后,在ALI动物中,白蛋白含量为48纳克/mL(SD = 14),而29纳克/mL(SD = 9)(p <0.05)。

图 1:插管设置的原理图。需要注意的是,鼠标的颈部应相对于手术台以 90° 角超长。请点击此处查看此图的较大版本。
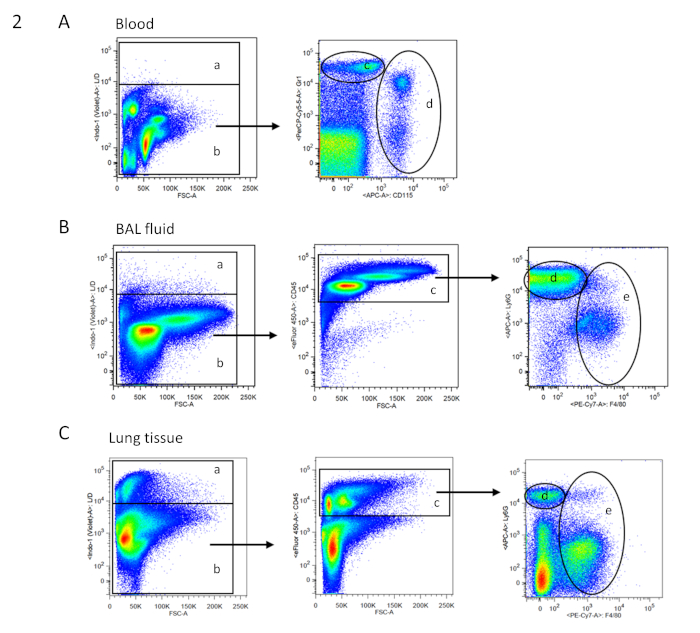
图 2:血液、BAL和组织细胞的FACS门控策略。FACS 分析的模范点缀以双参数(双色荧光)伪色图显示。各个样本的浇注策略基于单个单元。(A) 血细胞的浇注树:a = 死细胞;b = 活细胞(根据活细胞/死细胞染色;没有必要的CD45染色,如血液中,高自荧光使细胞群体明显可区分);d = 中性粒细胞;e = 单核细胞(根据 Gr1 和 CD115 染色)。(B) 支气管活杨洗浴液(BAL)液的浇注树:a= 死细胞;b = 活细胞(根据活细胞/死细胞染色);c = CD45=免疫细胞;d = 中性粒细胞;e = 巨噬细胞(根据 Ly6G 和 F4/80 染色)。(C) 肺组织用树:a = 死细胞;b = 活细胞(根据活细胞/死细胞染色);c = CD45=免疫细胞;d = 中性粒细胞;e = 巨噬细胞(根据 Ly6G 和 F4/80 染色)。请点击此处查看此图的较大版本。

图 3:对照动物验证鼠ALI模型。(A) 在雌性 C57BL/6 小鼠的肺组织中表达 TNF-α 24 小时和 72 小时后,在宫内 LPS 灌输(假手术动物的表达的折叠变化)。(B) FACS对肺组织中绝对中性粒细胞计数的分析。(C) 肺组织中MMP-9的表达(假动物表情的折叠变化)。(D) FACS分析支气管活菌洗液中绝对中性粒细胞计数。(E) BAL 流体中的白蛋白含量 [均值 = SD, n = 7, 曼-惠特尼 U 测试, [p < 0.05 (与 PBS 控制)]。这个数字已由埃伦特等人8修改。请点击此处查看此图的较大版本。
| 材料/设备名称 | 体积 (mL) |
| Dulbecco 的磷酸盐缓冲盐 (PBS),不含氯化钙和氯化镁,无菌 | 1000 |
| 胎儿小牛血清(FCS) | 1 |
| 乙烯二甲酸(EDTA)溶液 | 1 |
| 钠阿齐德 (NaN3) | 0.1 |
表1:FACS缓冲区的组成。
| 材料/设备名称 | 建议稀释 | 10 个样本的 Mastermix:添加到 200 μl FACS 缓冲液(每个样本= 20 μl): |
| 抗 CD115 (c-fms) APC | 0.5 μL/100 μL | 5 μL |
| 防 CD11b (M1/70) - FITC | 0.5 μL/100 μL | 5 μL |
| 防 CD45 (30-F11) - eF450 | 0.5 μL/100 μL | 5 μL |
| 抗 F4/80 (BM-8) - PE Cy7 | 0.5 μL/100 μL | 5 μL |
| 抗Gr1 (RB6-8C5) | 0.5 μL/100 μL | 5 μL |
| 抗 Ly6C (HK1.4) PerCP-Cy5.5 | 0.5 μL/100 μL | 5 μL |
| 抗 Ly6G (1A8) APC/Cy7 | 0.5 μL/100 μL | 5 μL |
表2:为FACS染色准备主混合物。该表描述了 10 个样本的主混合准备。
讨论
微创性、简单处理和良好的可重复性是所呈现的方法的关键特征,用于在小型啮齿动物模型中诱导 ALI。在动物模型中使用LPS代替整个细菌具有优势。它是一种稳定和纯净的化合物,可以储存在冻干形式,直到使用。它是通过TLR4途径进行先天免疫反应的有力兴奋剂,其生物活性易于量化,促进疾病严重程度的滴定,具有良好的可重复性。此外,使用LPS已被证明作为安全模型,诱导急性支气管炎在人类健康志愿者,从而允许翻译从长凳到床边16。Rittirsch等人已经证明了典型的阿尔维奥洛毛细管泄漏的剂量和时间依赖性的发展,在宫内LPS的小鼠模型6。这允许剂量滴定达到某些期望的效果,这可以说明不同程度的ALI严重程度或早期与后期发病症状。然而,如果要解决不同的感染或药理问题(例如抗生素治疗),由无菌LPS灌输引起的ALI不是一个合适的模型。
此外,与肺内或静脉注射细菌相比,肺动脉毛细血管屏障的中断被描述为相当温和3,质疑该模型的适用性,以及改变的渗透性是否应调查特别。正确放置导管,将 LPS 双边输送到下呼吸道是该方法的关键步骤。为了确保适当的内管插管,外部冷光源有助于喉部可视化和识别。呼吸模式的变化(例如,咳嗽或喘息)验证液体的气管内灌输是否正确。
此外,小鼠应变和LPS的选择对于引入ALI和生成该模型中的可重复结果至关重要,并且取决于所解决的科学问题。根据文献记载,施用的剂量,以引起最大效果,没有进一步增加与升级剂量范围从10 μg/小鼠(当LPS从伪单抗Aeruginosa F-D类型1被注射到女性BALB/c小鼠时)到50μg/小鼠将大肠杆菌(血清型O111:B4)LPS(也用于协议中)注入雄性C57BL/6小鼠6,9。一般来说,BALB/c小鼠在接受LPS挑战时应反应灵敏,而C57BL/6小鼠似乎更具有抵抗力3。因此,建议进行初始剂量滴定实验,以尊重个别条件。这也适用于血液、BAL 和器官取样的时间。ALI的严重程度可以通过定期观察体温和呼吸窘迫症状来临床确定。此外,由于小鼠只有约50%的TLR4受体与人类共享,因此对结果的仔细解释是强制性的。
本文提出的替代方法包括内毒素给给肺部的途径。正如Szarka等人所描述的,LPS也可以通过鼻内灌输9进行管理。刘等人将直接的宫内沉积与吸入气溶胶LPS5进行了比较。根据他们的发现,他们得出结论,吸入途径诱导一个更均匀的ALI类型。然而,他们的实验是在只吸入直接流鼻的大鼠身上进行的,因此不一定转移到本文介绍的方法。相反,小鼠经常在10室中暴露于气溶胶LPS。腔室大小、LPS 浓度和同时处理的小鼠数量是限制不同研究之间的可比性并使单个模型建立值得推荐的变量。最后,LPS的静脉注射或腹内给液位分给常用于诱导远程ALI17,18。正如Szarka等人的数据所表明的,当特定的肺炎效应被处理时,内气管灌输似乎优于i.v.或i.p.路径。最后,该协议代表了一种简单且可重复的方法,用于诱导小鼠的无菌ALI,以解决特定的免疫学问题。
披露声明
作者没有什么可透露的。
致谢
作者感谢扬·克莱纳和苏珊娜·舒尔茨提供技术支持。作者肯定了波恩大学医学院对流式细胞学核心设施的出色支持。提交人没有得到任何外部组织的任何资助。 结果部分给出如图3所示的部分数据已在上一份出版物8中显示。
材料
| Name | Company | Catalog Number | Comments |
| 1 ml syringes | BD, Franklin Lakes, NJ, USA | 300013 | |
| 10 ml syringes | BD, Franklin Lakes, NJ, USA | 309110 | |
| Anti-CD115 (c-fms) APC | Thermo Fisher, Waltham, MA, USA | 17-1152-80 | |
| Anti-CD11b (M1/70) - FITC | Thermo Fisher, Waltham, MA, USA | 11-0112-81 | |
| Anti-CD45 (30-F11) - eF450 | Thermo Fisher, Waltham, MA, USA | 48-0451-82 | |
| Anti-F4/80 (BM-8) - PE Cy7 | Thermo Fisher, Waltham, MA, USA | 25-4801-82 | |
| Anti-Gr1 (RB6-8C5) | BD Biosciences, Franklin Lakes, NJ, USA | 552093 | |
| Anti-Ly6C (HK1.4) PerCP-Cy5.5 | Thermo Fisher, Waltham, MA, USA | 45-5932-82 | |
| Anti-Ly6G (1A8) APC/Cy7 | Bio Legend, San Diego, CA | 127623 | |
| Buprenorphine hydrochloride | Indivior UK Limited, Berkshire, UK | ||
| C57BL/6 mice, female, 10 - 12 weeks old | Charles River, Wilmongton, MA, USA | ||
| CaliBRITE APC-beads (6µm) | BD Biosciences, Franklin Lakes, NJ, USA | 340487 | |
| Canula 23 gauge 1'' | BD, Franklin Lakes, NJ, USA | 300800 | |
| Canula 26 gauge 1/2'' | BD, Franklin Lakes, NJ, USA | 303800 | |
| Cell strainer 70 µm | BD Biosciences, Franklin Lakes, NJ, USA | 352350 | |
| Collagenase Type I | Sigma-Aldrich, St. Louis, MO, USA | 1148089 | |
| Deoxyribonuclease II | Sigma-Aldrich, St. Louis, MO, USA | D8764 | |
| Dulbecco's Phosphate Buffered Saline (PBS), sterile | Sigma-Aldrich, St. Louis, MO, USA | D8662 | |
| Dulbecco’s Phosphate Buffered Saline (PBS), without calcium chloride and magnesium chloride, sterile | Sigma-Aldrich, St. Louis, MO, USA | D8537 | |
| Ethylenediaminetetraacetic acid (EDTA) solution | Sigma-Aldrich, St. Louis, MO, USA | E7889 | |
| FACS tubes, 5 ml | Sarstedt, Nümbrecht, Germany | 551579 | |
| Fetal calf serum (FCS) | Sigma-Aldrich, St. Louis, MO, USA | F2442 | |
| Forceps | Fine Science Tools, Heidelberg, Germany | 11049-10 | |
| Isoflurane | Baxter, Unterschleißheim, Germany | ||
| Ketamine hydrochloride | Serumwerk Bernburg, Bernburg, Germany | ||
| Lipopolysaccharides (LPS) from Escherichia coli O111:B4 | Sigma-Aldrich, St. Louis, MO, USA | L2630 | |
| LIVE/DEAD Fixable Dead Cell Green Kit | Thermo Fisher, Waltham, MA, USA | L23101 | |
| Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block™), Clone 2.4G2 | BD, Franklin Lakes, NJ, USA | 553141 | |
| Red blood cell lysis buffer | Thermo Fisher, Waltham, MA, USA | 00-4333-57 | |
| RPMI-1640, with L-glutamine and sodium bicarbonate | Sigma-Aldrich, St. Louis, MO, USA | R8758 | |
| Scissors | Fine Science Tools, Heidelberg, Germany | 14060-09 | |
| Sodium azide (NaN3) | Sigma-Aldrich, St. Louis, MO, USA | S2002 | |
| Spring scissors | Fine Science Tools, Heidelberg, Germany | 15018-10 | |
| Tissue forceps | Fine Science Tools, Heidelberg, Germany | 11021-12 | |
| Tubes | Eppendorf, Hamburg, Germany | 30125150 | |
| Venous catheter, 22 gauge | B.Braun, Melsungen, Germany | 4268091B | |
| Xylazine hydrochloride | Serumwerk Bernburg, Bernburg, Germany |
参考文献
- Fink, M. P. Animal models of sepsis. Virulence. 5 (1), 143-153 (2014).
- Lu, Y. -C., Yeh, W. -C., Ohashi, P. S. LPS/TLR4 signal transduction pathway. Cytokine. 42 (2), 145-151 (2008).
- Matute-Bello, G., Frevert, C. W., Martin, T. R. Animal models of acute lung injury. American Journal of Physiology - Lung Cellular and Molecular Physiology. 295 (3), 379-399 (2008).
- Rabelo, M. A. E., et al. Acute Lung Injury in Response to Intratracheal Instillation of Lipopolysaccharide in an Animal Model of Emphysema Induced by Elastase. Inflammation. 41 (1), 174-182 (2018).
- Liu, F., Li, W., Pauluhn, J., Trübel, H., Wang, C. Lipopolysaccharide-induced acute lung injury in rats: comparative assessment of intratracheal instillation and aerosol inhalation. Toxicology. 304, 158-166 (2013).
- Rittirsch, D., et al. Acute Lung Injury Induced by Lipopolysaccharide Is Independent of Complement Activation. Journal of Immunology. 180 (11), Baltimore, Md. 7664-7672 (2008).
- D'Alessio, F. R., et al. CD4+CD25+Foxp3+ Tregs resolve experimental lung injury in mice and are present in humans with acute lung injury. The Journal of Clinical Investigation. 119 (10), 2898-2913 (2009).
- Ehrentraut, H., Weisheit, C., Scheck, M., Frede, S., Hilbert, T. Experimental murine acute lung injury induces increase of pulmonary TIE2-expressing macrophages. Journal of Inflammation. 15, 12(2018).
- Szarka, R. J., Wang, N., Gordon, L., Nation, P. N., Smith, R. H. A murine model of pulmonary damage induced by lipopolysaccharide via intranasal instillation. Journal of Immunological Methods. 202 (1), 49-57 (1997).
- Reutershan, J., Basit, A., Galkina, E. V., Ley, K. Sequential recruitment of neutrophils into lung and bronchoalveolar lavage fluid in LPS-induced acute lung injury. American Journal of Physiology. Lung Cellular and Molecular Physiology. 289 (5), 807-815 (2005).
- Hoegl, S., et al. Capturing the multifactorial nature of ARDS - approach to model murine acute lung injury. Physiological Reports. 6 (6), (2018).
- Weisheit, C., et al. Ly6Clow and Not Ly6Chigh Macrophages Accumulate First in the Heart in a Model of Murine Pressure-Overload. PLoS ONE. 9 (11), (2014).
- Grommes, J., Soehnlein, O. Contribution of Neutrophils to Acute Lung Injury. Molecular Medicine. 17 (3-4), 293-307 (2011).
- Müller-Redetzky, H. C., Suttorp, N., Witzenrath, M. Dynamics of pulmonary endothelial barrier function in acute inflammation: mechanisms and therapeutic perspectives. Cell and Tissue Research. 355 (3), 657-673 (2014).
- Fujita, M., et al. Endothelial cell apoptosis in lipopolysaccharide-induced lung injury in mice. International Archives of Allergy and Immunology. 117 (3), 202-208 (1998).
- Doyen, V., et al. Inflammation induced by inhaled lipopolysaccharide depends on particle size in healthy volunteers. British Journal of Clinical Pharmacology. 82 (5), 1371-1381 (2016).
- Stephens, R. S., Johnston, L., Servinsky, L., Kim, B. S., Damarla, M. The tyrosine kinase inhibitor imatinib prevents lung injury and death after intravenous LPS in mice. Physiological Reports. 3 (11), (2015).
- Yu, Y., Jing, L., Zhang, X., Gao, C. Simvastatin Attenuates Acute Lung Injury via Regulating CDC42-PAK4 and Endothelial Microparticles. Shock. 47 (3), Augusta, Ga. 378-384 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。