Method Article
Induire une lésion pulmonaire aigue chez la souris par instillation directe du lipopolysaccharide intratrachéal
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Présenté ici est une procédure étape par étape pour induire des dommages aigus de poumon chez les souris par l'instillation intratracheal directe de lipopolysaccharide et pour effectuer l'analyse FACS des échantillons de sang, du fluide de lavage bronchoalveolar, et du tissu de poumon. L'invasivité minimale, la manipulation simple, la bonne reproductibilité, et la titration de la sévérité de la maladie sont des avantages de cette approche.
Résumé
L'administration des voies aériennes du lipopolysaccharide (LPS) est un moyen courant d'étudier l'inflammation pulmonaire et les lésions pulmonaires aigues (ALI) dans les modèles de petits animaux. Diverses approches ont été décrites, telles que l'inhalation de LPS aérosolainsi ainsi que l'instillation nasale ou intratrachéale. Le protocole présenté décrit une procédure étape par étape détaillée pour induire ALI chez les souris par instillation intratracheal directe de LPS et exécuter l'analyse FACS des échantillons de sang, du fluide de lavage bronchoalveolar (BAL) et du tissu de poumon. Après la sédation intrapéritonéale, la trachée est exposée et Le LPS est administré par l'intermédiaire d'un cathéter veineux de 22 G. Une réaction inflammatoire robuste et reproductible avec l'invasion de leucocyte, la mise en réglementation des cytokines proinflammatoires, et la perturbation de la barrière alvéolo-capillaire est induite dans les heures aux jours, selon le dosage de LPS employé. La collecte d'échantillons de sang, de liquide BAL et de récolte pulmonaire, ainsi que le traitement pour l'analyse FACS, sont décrits en détail dans le protocole. Bien que l'utilisation du LPS stérile ne soit pas appropriée pour étudier des interventions pharmacologiques dans les maladies infectieuses, l'approche décrite offre l'invasivité minimale, la manipulation simple, et la bonne reproductibilité pour répondre aux questions immunologiques mécanistes. En outre, la titration de dose aussi bien que l'utilisation des préparations alternatives de LPS ou des souches de souris permettent la modulation des effets cliniques, qui peuvent montrer différents degrés de sévérité d'ALI ou tôt contre début tardif des symptômes de la maladie.
Introduction
Les modèles animaux expérimentaux sont indispensables dans la recherche immunisée fondamentale. L'administration de bactéries entières ou de composants microbiens a été fréquemment utilisée dans les petits modèles animaux pour induire une inflammation locale ou systémique1. Le lipopolysaccharide (LPS, ou endotoxine bactérienne) est un composant de la paroi cellulaire et l'antigène de surface des bactéries gramnégatives (p. ex. Enterobacteriaceae, Pseudomonas spp., ou Legionella spp.). La molécule thermostable et grande (poids moléculaire 1-4 x 106 kDa) se compose d'une moiety lipidique (Lipid A), région centrale (oligosaccharide), et un polysaccharide O (ou O antigène). Lipid A, avec ses chaînes d'acides gras hydrophobes, ancre la molécule dans une membrane bactérienne et médiatise (sur la dégradation des bactéries) l'activité immunologique et la toxicité du LPS. Après s'être lié à la protéine de liaison LPS (LBP), les complexes LPS:LBP ligate le complexe de récepteurs CD14/TLR4/MD2 situé à la surface de nombreux types de cellules, induisant une forte réaction proinflammatoire avec la translocation nucléaire NF-B et la régulation subséquente de cytokine expression2.
Les lésions pulmonaires aigues (ALI) sont définies comme une insuffisance respiratoire hypoxémique aigue avec un œdème pulmonaire bilatéral en l'absence d'insuffisance cardiaque3. L'administration des voies respiratoires de LPS est un moyen commun d'induire une inflammation pulmonaire et ALI4,5,6,7. Bien que la substance stérile ne soit pas appropriée pour étudier les interventions pharmacologiques dans les maladies infectieuses, les questions immunologiques mécanistes peuvent être répondues avec une précision suffisante. L'instillation du LPS dans la trachée induit une réaction inflammatoire robuste avec l'invasion de leucocyte, la régulation version des cytokines proinflammatoires, et la perturbation de la barrière alvéolo-capillaire en quelques heures à jours, selon le dosagedeLPS3, 6,7.
Le protocole présenté décrit une procédure étape par étape détaillée pour induire ALI chez les souris par instillation intratrachéale de LPS. Le modèle a été validé en évaluant l'expression de cytokine, l'invasion de granulocyte de neutrophil, et la fuite intra-alvéolaire d'albumine comme précédemment décrit8.
Protocole
Ce protocole animal a été approuvé par le comité local pour les soins aux animaux (LANUV, Recklinghausen, Allemagne; protocole no 84-02.04.2015) et a été exécuté conformément aux directives des National Institutes of Health pour l'utilisation des animaux vivants (publication des NIH No 85-23, révisé en 1996).
1. Induction ALI
- Utilisez des souris adultes C57BL/6 à l'âge d'environ 10-12 semaines. Loger les animaux dans des cages ventilées individuellement avec un accès gratuit à l'eau et à la chow standard des rongeurs. Cependant, il est possible d'effectuer cette approche sur les animaux plus jeunes et avec d'autres souches de souris.
- Stocker le LPS (Escherichia coli O111:B4) dans des aliquots en concentrations de 5 mg/mL à -20 oC. Pour l'instillation intratrachéale, diluer le LPS dans la saline stérile tamponnée par le phosphate (PBS) jusqu'à une concentration finale de 2 000 g/mL.
- Pesez la souris. Injecter de la kétamine [120 mg/kg de poids corporel de souris (BW)] et de la xylazine (16 mg/kg BW) par voie intrapéritoyonne (un tiers inférieur de l'abdomen, paramédian), et attendre le sursis de l'anesthésie.
- Vérifiez la profondeur de l'anesthésie en induisant un stimulus tactile. En cas d'anesthésie insuffisante, répéter l'injection de kétamine (30 mg/kg BW) et de xylazine (4 mg/kg BW).
- Placez la souris en position couchée sur une table à température contrôlée afin de maintenir une température corporelle de 37 oC.
- Appliquer un lubrifiant ophtalmique stérile pour prévenir la dessiccation des cornées sous anesthésie.
- Soulevez les inciseurs de tête et de crochet sur une barre horizontale placée à environ 5 cm au-dessus de la table pendant que les pattes avant restent en contact étroit avec la table. Étendre le cou dans un angle de 90 degrés par rapport à la table (Figure 1). Tenez la langue avec des forceps pour redresser la gorge pour des conditions d'intubation plus faciles.
- Couper un cathéter veineux de 22 jauges (G) sur une longueur de 20 mm. Insérez délicatement le cathéter dans la direction verticale le long de la racine de la langue. Placez une source de lumière froide sur la peau au-dessus du larynx pour aider à visualiser les cordes vocales et viser la trachée. Si la résistance du larynx se produit, rétractez le cathéter quelques millimètres avant d'avancer à nouveau.
- Insérer le cathéter d'environ 10 mm dans la trachée. Assurez-vous que l'insertion n'est pas trop profonde car cela entraînera l'instillation unilatérale du liquide dans la bronche principale droite ou gauche.
- Injecter du LPS (5 g/g BW) dilué dans le PBS à l'aide d'une pipette [le volume injecté dépend du poids corporel de la souris (p. ex., 20 g de poids corporel et utilisation de 50 l de solution LPS)].
REMARQUE : La souris réagit généralement en toussant ou en haletant à l'instillation appropriée du liquide dans la trachée. - Connectez une seringue et ajoutez un bolus de 50 ml d'air pour vous assurer que le volume liquide complet est distribué dans les poumons. Retirez lentement le cathéter.
- Gardez le haut du corps de la souris en position verticale pendant 30 s afin d'éviter les fuites du liquide de la trachée.
- Chez les animaux opérés par une feinte, injectez 50 l de PBS stérile par voie intratrache au lieu de LPS.
- Injecter de l'hydrochlorure de buprénorphine 0,08 mg/kg BW sous-cutané dans la peau lâche sur le cou immédiatement après l'induction ALI et tous les 12 h par la suite, au cours des 48 premières heures.
- Maintenir une température corporelle de 37 oC jusqu'à ce que la pleine conscience soit retrouvée en gardant la souris sur la plaque chauffante.
- Transférer la souris dans une cage aérée individuellement avec un accès gratuit à la nourriture et à l'eau. Surveillez la souris régulièrement. La diminution de la température corporelle et la dépression respiratoire indiquent une bonne induction de l'ALI.
2. Échantillonnage sanguin, lavage bronchoalveolaire, récolte d'organes
REMARQUE : Le moment de l'euthanasie dépend de la question scientifique abordée. Habituellement, il est effectué 12-72 h suite à l'instillation LPS3,4,9,10. La gravité de l'ALI peut être déterminée cliniquement par l'observation régulière de la température corporelle et des symptômes de détresse respiratoire11.
- Induire l'anesthésie en plaçant la souris dans une chambre inondée d'isoflurane. Utilisez 3 vol% isoflurane avec un flux d'oxygène de 1 L/min. Assurer la narcose profonde en induisant un stimulus tactile. En cas de profondeur insuffisante de l'anesthésie, augmenter isoflurane jusqu'à 5 vol%.
- Sacrifiez la souris dans l'anesthésie profonde par la dislocation atlanto-occipital.
- Fixez la souris avec du ruban adhésif sur une table d'opération et désinfectez rapidement la fourrure sur l'abdomen avec 70 % d'éthanol. Ouvrez soigneusement la cavité abdominale dans la ligne médiane avec des ciseaux et des pinces. Enlever les parties de l'intestin pour obtenir l'accès à la veine cava inférieure (IVC) à droite de la colonne vertébrale et de l'aorte abdominale.
- Localisez les veines rénales et insérez un canule plié de 23 G relié à une seringue de 1 ml dans l'IVC directement sous la confluence des veines. Aspirez 250 l de sang et transférez-vous dans un tube de 1,5 ml rempli de 20 l de 0,5 M d'acide éthylènediaminetetraacetic (EDTA). Agiter doucement pour faciliter le mélange EDTA et mettre le tube sur la glace.
- Pour le lavage bronchoalvéolar (BAL), préparer trois seringues de 1 ml avec 0,5 ml de PBS stérile et 0,1 ml d'air chacune. Rapidement désinfecter la fourrure de la gorge avec 70% d'éthanol et exposer soigneusement la trachée avec des ciseaux et des pincettes. Mobilisez la trachée et enroulez autour d'une suture.
- Effectuer BAL: Perforer la trachée à l'aide de micro-ciseaux et insérer un cathéter veineux de 22 G coupé à une longueur de 20 mm. Fixer le cathéter avec la suture et instiller 0,5 mL de PBS stérile et 0,1 ml d'air. Aspirer le liquide après 60 s. Répétez la procédure avec les deux seringues supplémentaires et collectez l'aspiration entière dans un tube de 15 ml sur la glace.
- Ouvrez délicatement le thorax avec des ciseaux et des pincettes pour récolter les poumons. Couper le diaphragme le long de la marge costale et couper à travers les côtes avec deux incisions latérales. Évitez soigneusement de perforer les poumons. Soulevez le sternum cranially et fixez-le ou retirez-le.
- Préparer deux seringues de 10 ml avec un PBS chaud de 37 oC (sans calcium ni magnésium). Faire une petite incision dans le ventricule gauche. Perforez le ventricule droit avec un canule de 26 G et rincer la circulation pulmonaire avec le PBS préchauffé. Soyez conscient des poumons qui pâlissent pendant la procédure.
- Enlever le lobe droit des poumons et le couper en deux moitiés. Les congeler dans de l'azote liquide, suivi d'un stockage à long terme à -80 oC pour une nouvelle expression génique et une analyse des protéines.
- Retirer tout le poumon gauche et l'homogénéiser dans une plaque de 48 puits en haletant le tissu avec des ciseaux et une pince à épiler. Incuber le tissu dans 2 ml de tampon de digestion [RPMI 1640 avec 10% sérum fœtal de veau (FCS) et 0,1% NaN3, collagène I (1 mg/mL), et DNase II (7 mg/mL)] à 37 oC pendant 60 min. Effectuer une homogénéisation plus poussée en pipetiligent soigneusement les morceaux de tissu pulmonaire et duvet.
3. Préparation des tissus pour l'analyse FACS
- Préparer un tamponFACS frais (tableau 1) : utilisez toujours du PBS sans calcium et sans magnésium pour réduire l'adhérence cellulaire à cellule dépendante de la cation et prévenir l'agglutination. Supplément avec FCS (1%) protéger les cellules de l'apoptose, prévenir les taches non spécifiques et empêcher les cellules de coller aux tubes FACS. Inclure l'EDTA (0,5 mM) pour prévenir l'adhérence cellulaire à cellule basée sur la cation lorsque vous travaillez avec des cellules collantes et adhérentes comme les macrophages. Ajouter l'azide de sodium (0,1 %), car il empêche la contamination bactérienne et le photoblanchiment des fluorochromes et bloque l'excrétion d'anticorps.
- Transférer les échantillons de sang (étape 2.4) dans 5 mL de tubes FACS et mélanger délicatement le sang avec 2 ml de tampon de lyse des globules rouges. Mettre les tubes sur la glace et terminer la réaction après 2 min en ajoutant 2 ml de PBS glacé. Centrifuger les échantillons pendant 5 min à 400 x g et jeter le supernatant. Resuspendre le granule cellulaire avec 60 L de tampon FACS et le processus pour la coloration ultérieure FACS selon les protocoles précédemment décrits12.
REMARQUE : Le moment de l'euthanatation de la souris influence le nombre de leucocytes dans le cadre de l'inflammation systémique. Par conséquent, il est recommandé d'ajuster le nombre de cellules à 1 x 106 cellules/60 L dans cette étape pour obtenir les meilleurs résultats de coloration pour l'analyse de cytométrie de flux. - Centrifugeur BAL fluide (étape 2.6) pendant 5 min à 400 x g. Aspirez le supernatant et congelez-le dans de l'azote liquide, suivi d'un stockage à long terme à -80 oC pour une analyse plus poussée des protéines. Resuspendre le granule de cellules BAL avec 2 ml de tampon FACS froid, puis transférer la suspension dans un tube FACS de 5 mL à l'aide d'un filtre à mailles de 100 m pour retenir les poils.
- Encore une fois, centrifuger l'échantillon pendant 5 min à 400 x g. Resuspendre le granule avec 60 L de tampon FACS et le processus pour la coloration ultérieure FACS selon les protocoles précédemment décrits12.
REMARQUE : Le moment de l'euthanatation de la souris influence le nombre de leucocytes dans BAL dans le cadre de l'inflammation. Par conséquent, il est recommandé d'ajuster le nombre de cellules à 1 x 106 cellules/60 L dans cette étape pour obtenir les meilleurs résultats de coloration pour l'analyse de cytométrie de flux. - Transférer le tissu pulmonaire gauche digéré (étape 2.10) dans un tube FACS de 5 mL à l'aide d'un filtre à mailles de 100 l pour extraire les amas et mettre fin au processus de digestion en ajoutant 2 ml de tampon FACS glacé. Centrifuger l'échantillon pendant 5 min à 400 x g. Jetez le supernatant et resuspendre la pastille avec 60 L de tampon FACS et le processus pour la coloration ultérieure FACS selon les protocoles précédemment décrits12.
REMARQUE : Le moment de l'euthanatation de la souris influence le nombre de leucocytes dans le tissu pulmonaire dans le cadre de l'inflammation. Par conséquent, il est recommandé d'ajuster le nombre de cellules à 1 x 106 cellules/60 L pour obtenir les meilleurs résultats de coloration pour l'analyse de cytométrie de flux. - Pour l'analyse FACS, incuber les cellules avec l'anticorps CD16/CD32 à 4 oC pendant 15 min pour bloquer la liaison non spécifique de l'immunoglobuline aux récepteurs Fc. Ajouter 20 l de solution de blocage à 1 x 106 cellules dans 60 l dans un tube de 5 ml.
- Pendant ce temps, préparez un mélange maître avec le tampon FACS et les anticorps tels que décrits dans le tableau 2.
- Après le blocage, ne pas laver les cellules. Ajouter 20 l de mélange maître d'anticorps par échantillon pour obtenir un volume final de 100 l. Incuber les échantillons pendant 20 min dans l'obscurité à 4 oC.
- Laver chaque échantillon avec 1 ml de tampon FACS et centrifugeuse pendant 5 min à 400 x g. Jetez le supernatant et suspendez la pastille avec le tampon FACS à la concentration cellulaire appropriée pour les mesures FACS.
REMARQUE : Un nombre de cellules de 1 x 106 cellules/500 L est suggéré pour réaliser les meilleurs résultats de phénotypage immunisé dans l'analyse de FACS avec ce protocole. Cependant, il est recommandé que les anticorps doivent être titrés individuellement. - Au besoin, ajouter la coloration vivante/morte avant la coloration de surface à l'aide de kits spécifiques disponibles dans le commerce8.
- Enfin, ajoutez des nombres fixes de perles d'étalonnage couplées fluorochrome disponibles dans le commerce (3 x 105 perles dans 20 l de tampon FACS) à chaque échantillon pour déterminer les nombres cellulaires absolus12. La stratégie de gating pour le sang, le BAL et les cellules tissulaires est montrée dans la figure 2.
Résultats
L'approche décrite pour induire ali chez les souris a été validée en évaluant l'expression de cytokine, l'infiltration de granulocyte de neutrophil, et la perturbation alveolo-capillaire de barrière 24 h et 72 h après instillation de LPS. Les animaux injectés par LE PBS ont servi de contrôle. L'administration intratracheal de LPS a induit une réponse proinflammatory pulmonaire robuste. L'expression du TNF-MD dans les tissus pulmonaires a été significativement régulée, atteignant une augmentation soutenue et plus de 50 fois par rapport aux animaux témoins [RQ (TNF-18s); 24 h: 53,7 (SD 11,6); 72 h: 55,0 (SD - 20,6); p lt; 0,05)] (Figure 3A). L'invasion de leucocytes dans les tissus et l'espace alvéolaire est une caractéristique et une caractéristique pour le développement de l'ALI13. L'analyse de FACS a indiqué une infiltration significative des granulocytes de neutrophile (NG) dans l'interstitium de poumon, avec le nombre absolu de cellules ayant augmenté presque 9 fois comparé aux contrôles après 24 h [65.243 (SD - 15.855) contre 7.358 (SD ' 4.794), p 'lt ; 0.05] ( Figure 3B). Le nombre absolu de NG a légèrement diminué après 72 h ; toutefois, les augmentations de facteurs par rapport aux témoins sont demeurées stables [48 946 (SD 5 223) contre 5 510 (SD 654), p 'lt; 0.05]. Conformément à l'infiltration interstitielle de NG, l'expression de MMP-9 dans le tissu entier de poumon a également été sensiblement augmentée au cours de la période d'observation totale [RQ (MMP-9/18s), 24 h : 7.4 (SD - 1.5); 72 h : 10.4 (SD - 2.0); p lt ; 0.05] (figure 3C).
Ng ont été non seulement augmentés dans le tissu pulmonaire mais également dans le fluide de BAL. L'augmentation du pli par rapport aux animaux témoins a été plus prononcée que dans les tissus pulmonaires, avec des comptes de NG absolus de 24 h après l'induction de l'ALI de 52 005 (SD à 21 906) contre 1 829 (SD à 1 724) (p lt; 0,05) (figure3D). Après 72 h, le NG a été porté à 37 254 (SD 4 478) contre 17,0 (SD à 10,8) (p et lt; 0,05). L'oème pulmonaire dû à l'affaiblissement grave de la barrière alveolo-capillaire est pathognomonique pour le développement de l'ALI, avec LPS induisant rapidement l'apoptosis endothélial et la perméabilité accrue14,15. L'analyse du contenu d'albumine dans le fluide BAL par ELISA a indiqué une perte significative de fonction de barrière. 24 h après l'instillation de LPS, l'albumine dans le fluide BAL était de 43 ng/mL (SD no 13), comparativement à 20 ng/mL (SD no 9) dans des conditions de contrôle (p lt; 0,05) (Figure 3E). Après 72 h, chez les animaux ALI, le contenu de l'albumine était de 48 ng/mL (SD 14), contre 29 ng/mL (SD 9) (p et lt; 0,05).

Figure 1 : Diagramme schématique du paramètre d'intubation. Il convient de noter que le cou de la souris doit être super-étendu à un angle de 90 degrés par rapport à la table d'opération. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
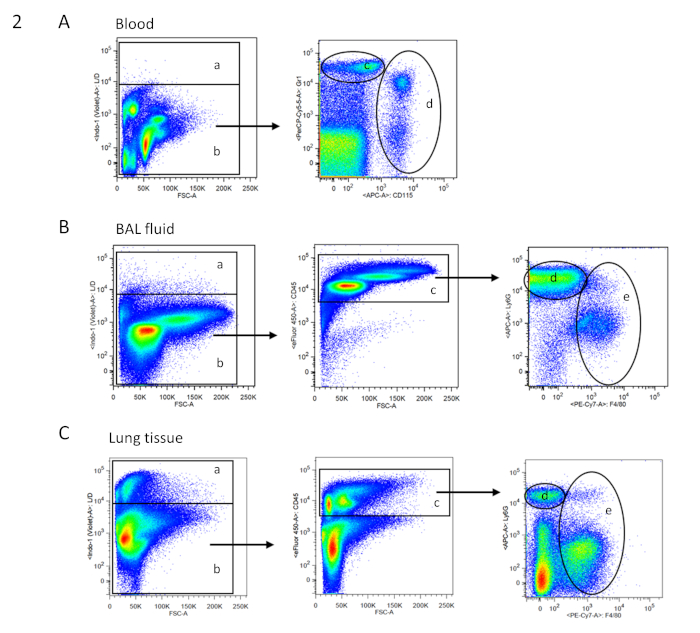
Figure 2 : FACS stratégie de gating pour le sang, le BAL et les cellules tissulaires. Des taches de points exemplaires de l'analyse FACS sont montrées dans des parcelles pseudocolores à deux paramètres (fluorescence double couleur). La stratégie de gating pour les échantillons respectifs est basée sur des cellules simples. (A) Arbre de gating pour les cellules sanguines : a -cellules mortes ; b - cellules vivantes (selon la coloration des cellules vivantes/mortes; aucune coloration CD45 nécessaire comme dans le sang, une hyperfluorescence rend les populations cellulaires clairement distinguables); d - granulocytes neutrophiles; e monocytes (selon les taches Gr1 et CD115). (B) Arbre de gating pour le lavage bronchoalveolar (BAL) fluide : a -cellules mortes ; b - cellules vivantes (selon la coloration des cellules vivantes/mortes); c - CD45- cellules immunitaires; d - granulocytes neutrophiles; et e et macrophages (selon ly6G et f4/80). (C) Arbre de gating pour le tissu pulmonaire : a -cellules mortes ; b - cellules vivantes (selon la coloration des cellules vivantes/mortes); c - CD45- cellules immunitaires; d - granulocytes neutrophiles; et e et macrophages (selon ly6G et f4/80). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : Validation du modèle ALI murine contre les animaux témoins. (A) Expression de TNF-Dans le tissu pulmonaire des femelles C57BL/6 souris 24 h et 72 h suivant l'instillation intratrachéale de LPS (changement de pli d'expression des animaux opérés de faux). (B) Analyse FACS du nombre absolu de granulocytes neutrophiles dans le tissu pulmonaire. (C) Expression de MMP-9 dans le tissu pulmonaire (changement d'expression de pli ageplides d'animaux opérés par faux). (D) Analyse FACS du nombre absolu de granulocytes neutrophiles dans le liquide de lavage bronchoalveolar. (E) Contenu d'albumine dans le fluide BAL [moyenne - SD, n 7, test Mann-Whitney U, 'p 'lt; 0.05 (vs. PBS control)]. Ce chiffre a été modifié à partir d'Ehrentraut et d'autres8. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| Nom du matériel/équipement | Volume (mL) |
| Saline tamponnée par phosphate (PBS) de Dulbecco, sans chlorure de calcium et chlorure de magnésium, stérile | 1000 |
| Sérum fœtal de veau (FCS) | 1 Fois |
| Solution d'acide éthynéaminetetraacetic (EDTA) | 1 Fois |
| Azide de sodium (NaN3) | 0,1 |
Tableau 1 : Composition du tampon FACS.
| Nom du matériel/équipement | Dilution suggérée | Mastermix pour 10 échantillons : ajouter à 200 'l tampon FACS (à 20 euros par échantillon) : |
| Anti-CD115 (c-fms) APC | 0,5 l/100 l | 5 ll |
| Anti-CD11b (M1/70) - FITC | 0,5 l/100 l | 5 ll |
| Anti-CD45 (30-F11) - eF450 | 0,5 l/100 l | 5 ll |
| Anti-F4/80 (BM-8) - PE Cy7 | 0,5 l/100 l | 5 ll |
| Anti-Gr1 (RB6-8C5) | 0,5 l/100 l | 5 ll |
| Anti-Ly6C (HK1.4) PerCP-Cy5.5 | 0,5 l/100 l | 5 ll |
| Anti-Ly6G (1A8) APC/Cy7 | 0,5 l/100 l | 5 ll |
Tableau 2 : Préparation du mélange maître pour la coloration FACS. Le tableau décrit la préparation du mélange maître pour 10 échantillons.
Discussion
L'invasivité minimale, la manipulation simple, et la bonne reproductibilité sont les dispositifs principaux de l'approche présentée pour induire ALI dans un petit modèle de rongeur. L'utilisation de LPS au lieu de bactéries entières dans les modèles animaux a des avantages. Il s'agit d'un composé stable et pur et peut être stocké sous forme lyophilisée jusqu'à l'utilisation. C'est un stimulant puissant pour les réponses immunitaires innées par l'intermédiaire de la voie de TLR4, et son activité biologique peut facilement être quantifiée, facilitant la titration de la sévérité de la maladie avec la bonne reproductibilité. En outre, l'utilisation de LPS a été montré pour servir de modèle sûr pour induire la bronchite aigue chez les volontaires humains en bonne santé et permet ainsi la traduction du banc au chevet16. Rittirsch et coll. ont démontré les développements de dose et de temps-dépendants de la fuite alveolo-capillaire caractéristique dans un modèle murine de l'instillation intratrachéaledeLPS 6. Cela permet à la titration de dose pour réaliser certains effets désirés, qui peuvent illustrer différents degrés de sévérité d'ALI ou tôt contre début tardif des symptômes de la maladie. Cependant, si des questions infectieuses ou pharmacologiques distinctes doivent être abordées (p. ex., traitement antibiotique), l'ALI induite par l'instillation stérile du LPS n'est pas un modèle approprié.
De plus, comparativement à la livraison intrapulmonaire ou intraveineuse de bactéries, la perturbation de la barrière alvéolo-capillaire a été décrite comme étant plutôt bénigne3, remettant en question la pertinence de ce modèle et la question de savoir si une perméabilité altérée devrait être particulièrement étudié. Le placement correct du cathéter pour livrer le LPS bilatéralement dans les voies respiratoires inférieures est l'étape critique de l'approche. Pour assurer une intubation intratrachéale appropriée, la visualisation et l'identification du larynx est facilitée par une source externe de lumière froide. Les changements dans les schémas respiratoires (p. ex., toux ou halètement) vérifient l'instillation intratrachéale correcte du liquide.
En outre, le choix de la souche de souris et LPS sont cruciaux pour l'induction de l'ALI et la génération de résultats reproductibles dans ce modèle et dépendent de la question scientifique abordée. Selon la littérature, la dose administrée pour obtenir un effet maximal sans autre augmentation avec des doses croissantes varie de 10 g/souris (lorsque Le LPS de Pseudomonas aeruginosa F-D type 1 est injecté dans les souris féminines BALB/c) à 50 g/souris quand injection de E. coli (sérotype O111:B4) LPS (qui a également été utilisé dans le protocole) chez des souris mâles C57BL/66,9. En général, les souris BALB/c sont censées réagir avec sensibilité lorsqu'elles sont confrontées au LPS, tandis que les souris C57BL/6 semblent plus résistantes3. Ainsi, des expériences initiales de titration de dose concernant des conditions individuelles sont recommandées. Cela s'applique également au moment de l'échantillonnage du sang, du BAL et des organes. La gravité de l'ALI peut être déterminée cliniquement par l'observation régulière de la température corporelle et des symptômes de détresse respiratoire. En outre, puisque les souris ne partagent qu'environ 50% d'homologie du récepteur TLR4 avec les humains, une interprétation attentive des résultats est obligatoire3.
Les solutions de rechange à l'approche présentée dans les présentes comprennent la voie de l'administration de l'endotoxine vers les poumons. Comme décrit par Szarka et coll., Le LPS peut également être administré par instillation intranasale9. Liu et coll. ont comparé le dépôt intratrachéal direct à l'inhalation de LPS aérosol5. Sur la base de leurs résultats, ils ont conclu que la voie par inhalation induit un type plus uniforme d'ALI. Cependant, leurs expériences ont été effectuées chez des rats avec une inhalation dirigée-flux nez-seulement et ne peuvent donc pas nécessairement être transférés à l'approche présentée ci-contre. En revanche, les souris sont souvent exposées au LPS aérosol dans une chambre10. La taille de la chambre, la concentration de LPS et le nombre de souris traitées simultanément sont des variables qui limitent la comparabilité entre les différentes études et rendent un établissement modèle individuel recommandable. Enfin, l'administration intraveineuse ou intrapéritone du LPS est souvent utilisée pour induire à distance ALI17,18. Comme le suggèrent les données de Szarka et coll. l'instillation intratrachéale semble être supérieure à la voie d'accès ou à l'i.p. lorsque des effets inflammatoires pulmonaires spécifiques sont abordés9. En conclusion, le protocole représente une approche simple et reproductible pour induire l'ALI stérile chez les souris pour aborder des issues immunologiques spécifiques.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Les auteurs tiennent à remercier Jan Kleiner et Susanne Schulz d'avoir fourni un soutien technique. Les auteurs reconnaissent l'excellent soutien de l'installation de base de cytométrie de flux à la faculté de médecine de l'Université de Bonn. Les auteurs n'ont reçu aucun financement d'un organisme externe. Une partie des données données dans la section des résultats et représentées dans la figure 3 a déjà été présentée dans une publication précédente8.
matériels
| Name | Company | Catalog Number | Comments |
| 1 ml syringes | BD, Franklin Lakes, NJ, USA | 300013 | |
| 10 ml syringes | BD, Franklin Lakes, NJ, USA | 309110 | |
| Anti-CD115 (c-fms) APC | Thermo Fisher, Waltham, MA, USA | 17-1152-80 | |
| Anti-CD11b (M1/70) - FITC | Thermo Fisher, Waltham, MA, USA | 11-0112-81 | |
| Anti-CD45 (30-F11) - eF450 | Thermo Fisher, Waltham, MA, USA | 48-0451-82 | |
| Anti-F4/80 (BM-8) - PE Cy7 | Thermo Fisher, Waltham, MA, USA | 25-4801-82 | |
| Anti-Gr1 (RB6-8C5) | BD Biosciences, Franklin Lakes, NJ, USA | 552093 | |
| Anti-Ly6C (HK1.4) PerCP-Cy5.5 | Thermo Fisher, Waltham, MA, USA | 45-5932-82 | |
| Anti-Ly6G (1A8) APC/Cy7 | Bio Legend, San Diego, CA | 127623 | |
| Buprenorphine hydrochloride | Indivior UK Limited, Berkshire, UK | ||
| C57BL/6 mice, female, 10 - 12 weeks old | Charles River, Wilmongton, MA, USA | ||
| CaliBRITE APC-beads (6µm) | BD Biosciences, Franklin Lakes, NJ, USA | 340487 | |
| Canula 23 gauge 1'' | BD, Franklin Lakes, NJ, USA | 300800 | |
| Canula 26 gauge 1/2'' | BD, Franklin Lakes, NJ, USA | 303800 | |
| Cell strainer 70 µm | BD Biosciences, Franklin Lakes, NJ, USA | 352350 | |
| Collagenase Type I | Sigma-Aldrich, St. Louis, MO, USA | 1148089 | |
| Deoxyribonuclease II | Sigma-Aldrich, St. Louis, MO, USA | D8764 | |
| Dulbecco's Phosphate Buffered Saline (PBS), sterile | Sigma-Aldrich, St. Louis, MO, USA | D8662 | |
| Dulbecco’s Phosphate Buffered Saline (PBS), without calcium chloride and magnesium chloride, sterile | Sigma-Aldrich, St. Louis, MO, USA | D8537 | |
| Ethylenediaminetetraacetic acid (EDTA) solution | Sigma-Aldrich, St. Louis, MO, USA | E7889 | |
| FACS tubes, 5 ml | Sarstedt, Nümbrecht, Germany | 551579 | |
| Fetal calf serum (FCS) | Sigma-Aldrich, St. Louis, MO, USA | F2442 | |
| Forceps | Fine Science Tools, Heidelberg, Germany | 11049-10 | |
| Isoflurane | Baxter, Unterschleißheim, Germany | ||
| Ketamine hydrochloride | Serumwerk Bernburg, Bernburg, Germany | ||
| Lipopolysaccharides (LPS) from Escherichia coli O111:B4 | Sigma-Aldrich, St. Louis, MO, USA | L2630 | |
| LIVE/DEAD Fixable Dead Cell Green Kit | Thermo Fisher, Waltham, MA, USA | L23101 | |
| Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block™), Clone 2.4G2 | BD, Franklin Lakes, NJ, USA | 553141 | |
| Red blood cell lysis buffer | Thermo Fisher, Waltham, MA, USA | 00-4333-57 | |
| RPMI-1640, with L-glutamine and sodium bicarbonate | Sigma-Aldrich, St. Louis, MO, USA | R8758 | |
| Scissors | Fine Science Tools, Heidelberg, Germany | 14060-09 | |
| Sodium azide (NaN3) | Sigma-Aldrich, St. Louis, MO, USA | S2002 | |
| Spring scissors | Fine Science Tools, Heidelberg, Germany | 15018-10 | |
| Tissue forceps | Fine Science Tools, Heidelberg, Germany | 11021-12 | |
| Tubes | Eppendorf, Hamburg, Germany | 30125150 | |
| Venous catheter, 22 gauge | B.Braun, Melsungen, Germany | 4268091B | |
| Xylazine hydrochloride | Serumwerk Bernburg, Bernburg, Germany |
Références
- Fink, M. P. Animal models of sepsis. Virulence. 5 (1), 143-153 (2014).
- Lu, Y. -C., Yeh, W. -C., Ohashi, P. S. LPS/TLR4 signal transduction pathway. Cytokine. 42 (2), 145-151 (2008).
- Matute-Bello, G., Frevert, C. W., Martin, T. R. Animal models of acute lung injury. American Journal of Physiology - Lung Cellular and Molecular Physiology. 295 (3), 379-399 (2008).
- Rabelo, M. A. E., et al. Acute Lung Injury in Response to Intratracheal Instillation of Lipopolysaccharide in an Animal Model of Emphysema Induced by Elastase. Inflammation. 41 (1), 174-182 (2018).
- Liu, F., Li, W., Pauluhn, J., Trübel, H., Wang, C. Lipopolysaccharide-induced acute lung injury in rats: comparative assessment of intratracheal instillation and aerosol inhalation. Toxicology. 304, 158-166 (2013).
- Rittirsch, D., et al. Acute Lung Injury Induced by Lipopolysaccharide Is Independent of Complement Activation. Journal of Immunology. 180 (11), Baltimore, Md. 7664-7672 (2008).
- D'Alessio, F. R., et al. CD4+CD25+Foxp3+ Tregs resolve experimental lung injury in mice and are present in humans with acute lung injury. The Journal of Clinical Investigation. 119 (10), 2898-2913 (2009).
- Ehrentraut, H., Weisheit, C., Scheck, M., Frede, S., Hilbert, T. Experimental murine acute lung injury induces increase of pulmonary TIE2-expressing macrophages. Journal of Inflammation. 15, 12(2018).
- Szarka, R. J., Wang, N., Gordon, L., Nation, P. N., Smith, R. H. A murine model of pulmonary damage induced by lipopolysaccharide via intranasal instillation. Journal of Immunological Methods. 202 (1), 49-57 (1997).
- Reutershan, J., Basit, A., Galkina, E. V., Ley, K. Sequential recruitment of neutrophils into lung and bronchoalveolar lavage fluid in LPS-induced acute lung injury. American Journal of Physiology. Lung Cellular and Molecular Physiology. 289 (5), 807-815 (2005).
- Hoegl, S., et al. Capturing the multifactorial nature of ARDS - approach to model murine acute lung injury. Physiological Reports. 6 (6), (2018).
- Weisheit, C., et al. Ly6Clow and Not Ly6Chigh Macrophages Accumulate First in the Heart in a Model of Murine Pressure-Overload. PLoS ONE. 9 (11), (2014).
- Grommes, J., Soehnlein, O. Contribution of Neutrophils to Acute Lung Injury. Molecular Medicine. 17 (3-4), 293-307 (2011).
- Müller-Redetzky, H. C., Suttorp, N., Witzenrath, M. Dynamics of pulmonary endothelial barrier function in acute inflammation: mechanisms and therapeutic perspectives. Cell and Tissue Research. 355 (3), 657-673 (2014).
- Fujita, M., et al. Endothelial cell apoptosis in lipopolysaccharide-induced lung injury in mice. International Archives of Allergy and Immunology. 117 (3), 202-208 (1998).
- Doyen, V., et al. Inflammation induced by inhaled lipopolysaccharide depends on particle size in healthy volunteers. British Journal of Clinical Pharmacology. 82 (5), 1371-1381 (2016).
- Stephens, R. S., Johnston, L., Servinsky, L., Kim, B. S., Damarla, M. The tyrosine kinase inhibitor imatinib prevents lung injury and death after intravenous LPS in mice. Physiological Reports. 3 (11), (2015).
- Yu, Y., Jing, L., Zhang, X., Gao, C. Simvastatin Attenuates Acute Lung Injury via Regulating CDC42-PAK4 and Endothelial Microparticles. Shock. 47 (3), Augusta, Ga. 378-384 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon