Method Article
Quantificare la pianta proteina solubile e digeribile carboidrati contenuti, utilizzando mais (Zea mays) As an Exemplar
In questo articolo
Riepilogo
I protocolli descritti nel presente documento forniscono una metodologia chiara e accessibile per la misurazione della proteina solubile e digeribile (non strutturali) carboidrati contenuti nei tessuti vegetali. La capacità di quantificare questi macronutrienti due pianta ha implicazioni significative per far progredire i campi di fisiologia vegetale, ecologia nutrizionale, interazioni pianta-erbivoro ed ecologia alimentare-web.
Abstract
Dati elementari sono comunemente usati per dedurre la qualità della pianta come una risorsa per gli erbivori. Tuttavia, l'ubiquità del carbonio in biomolecole, la presenza di composti difensive vegetali contenenti azoto e variazione nelle specie-correlazioni tra pianta e azoto contenuto proteico tutti limitare l'accuratezza di queste illazioni. Inoltre, ricerca focalizzata sulla pianta e/o fisiologia erbivoro richiedono un livello di precisione che non viene raggiunto utilizzando generalizzato correlazioni. I metodi qui presentati offrono ai ricercatori un protocollo chiaro e rapido per misurare direttamente proteine solubili vegetali e carboidrati digeribili, i macronutrienti due pianta più strettamente legati alle prestazioni fisiologiche degli animali. I protocolli combinano analisi colorimetriche ben caratterizzate con passaggi ottimizzato specifico impianto digestione per fornire risultati precisi e riproducibili. Le nostre analisi di granturco dolce diverso tessuti mostrano che queste analisi hanno la sensibilità per rilevare la variazione nella pianta proteina solubile e contenuto di carboidrati digeribili attraverso più scale spaziali. Questi comprendono le differenze tra pianta attraverso varietà e specie vegetali o regioni in crescita, così come all'interno-pianta differenze nel tipo di tessuto e anche posizionali all'interno del tessuto stesso. Combinazione di proteina solubile e contenuto di carboidrati digeribili con dati elementari ha anche il potenziale per fornire nuove opportunità in biologia vegetale per collegare la nutrizione minerale delle piante con processi fisiologici delle piante. Queste analisi hanno anche contribuiscono a generare la proteina solubile e dati di carboidrati digeribili dovuti studiare ecologia nutrizionale, interazioni pianta-erbivoro e cibo-web dinamiche, che a sua volta migliorerà la fisiologia e ricerca ecologica.
Introduzione
Biomassa vegetale costituisce la base di praticamente tutte le reti alimentari terrestri. Piante acquisiscono elementi nutritivi dal terreno tramite i loro sistemi di radici e utilizzano la luce solare nei loro tessuti fogliari di sintetizzare biomolecole. In particolare, carbonio e azoto vengono utilizzati per creare i carboidrati, proteine (composto da aminoacidi) e lipidi che sono necessari per costruire la biomassa vegetale (dovrebbe essere notato che in fisiologia che il termine "dei macronutrienti" spesso si riferisce a elementi del terreno, ad esempio N, vegetale P, K e S, tuttavia, in tutta questa carta questo termine farà riferimento a biomolecole, come proteine, carboidrati e lipidi). Quando erbivori consumano materiale vegetale, i macronutrienti contenuti nei tessuti vegetali sono suddivisi nelle loro parti costituenti e quindi utilizzati per guidare i processi fisiologici del consumatore. In questo modo, i macronutrienti pianta hanno una forte influenza sulla fisiologia dei consumatori con le implicazioni importanti per interazioni ecologiche di più alti ordine e cibo-web dinamiche.
In tutto il Regno animale, proteina solubile e carboidrati digeribili sono i macronutrienti più strettamente legati alla sopravvivenza, riproduzione e prestazioni1. Inoltre, la maggior parte degli animali regola attivamente la loro assunzione di questi due macronutrienti per soddisfare le loro esigenze fisiologiche1,2. Ciò è particolarmente vero per gli insetti erbivori che rilevano le concentrazioni di zuccheri e aminoacidi nei tessuti vegetali, che a sua volta indirizza il comportamento alimentare. Di conseguenza, pianta proteina solubile e contenuto di carboidrati digeribili ha svolto un ruolo forte nell'evoluzione delle interazioni pianta-insetto.
Mentre i dati sulla pianta proteina solubile e contenuto di carboidrati digeribili sono relativamente rari (ma Vedi6,7,8,9,10,11), c'è una preponderanza di dati disponibili sul contenuto elementare pianta (carbonio, azoto e fosforo). In gran parte questo è perché gli elementi svolgono un ruolo primario nella pianta nutrizione minerale3,4,5. Dove gli elementi sono misurati, le correlazioni sono state utilizzate per estrapolare la quantità di proteina solubile e carboidrati digeribili, ma calcoli accurati sono spesso difficili da ottenere. Per esempio, è Impossibile utilizzare il carbonio come un indicatore del contenuto di carboidrati digeribili pianta perché il carbonio è ubiquitariamente presente in tutti i composti organici. Esiste una relazione più forte tra azoto elementare e contenuto di proteina solubile di pianta, e fattori di conversione generalizzati azoto / proteine sono spesso utilizzati. Tuttavia, c'è forte evidenza che le conversioni di azoto / proteine sono altamente specie-12,13,14,15, rendendo probabile l'uso di conversione generalizzato imprecise. Per questo motivo, fattori di conversione dell'azoto / proteine spesso mancano di precisione, particolarmente per quanto è necessario per gli studi nutrizionali erbivori. Inoltre, la presenza di N-contenente pianta allelochemicals, come alcaloidi e glucosinolati che spesso sono tossici per gli erbivori, può confondere queste conversioni.
Qui, vi offriamo due analisi chimiche per misurare la concentrazione di proteine solubili e carboidrati digeribili nei tessuti vegetali. Queste analisi sono presentate separatamente, ma è suggerito che essi essere utilizzati contemporaneamente per analizzare i campioni di pianta stessa al fine di realizzare un'analisi più completa dei macronutrienti pianta. Entrambi utilizzano metodologie simili, costituito da una fase di estrazione, seguita da quantificazione tramite assorbanza. Preparazione di campioni di pianta anche è identico per entrambi i protocolli, che lo rende facile da eseguire entrambe le analisi in tandem. L'utilità di questi test non deriva da loro novità, come si affidano più anziani, (Bradford, Jones, Dubois) consolidata saggi colorimetrici16,17,18, ma qui abbiamo organizzato una chiara e facile da seguire protocollo che unisce questi metodi con più oscuri estrazione impianto specifiche tecniche17,19 al fine di rendere l'applicazione di questi saggi più accessibile a coloro nei campi rilevanti per la pianta.
Per entrambi i dosaggi, pianta macronutrienti prima vengono estratti fisicamente da congelamento, liofilizzazione e macinazione del materiale vegetale. Per il dosaggio di proteina solubile, ulteriore estrazione chimica è fatto17,19 attraverso diverse fasi di agitazione e riscaldamento campioni in soluzione di NaOH. L'analisi di Bradford ben noto, utilizzando G-250 di blu brillante Coomassie, viene quindi utilizzato per quantificare le proteine solubili e polipeptidi tra 3.000-5.000 Dalton16,17. Questo test ha un range tra 1-20 µ g di proteine totali per micropiastra bene o < 25 µ g/mL, ma non misura non acidi amminici liberi. La fase di estrazione del dosaggio dei carboidrati digeribili si basa sul metodo acido diluito di Smith et al. 20 e consente per l'isolamento di zuccheri solubili, amido e fructosan – ma carboidrati non strutturali. Un metodo di quantificazione di acido solforico fenolo è preso da Dubois et al. 18 e misura tutti i mono-, oligo- e polisaccaridi (nonché derivati metile). Questo test è in grado di quantificare gli zuccheri specifici, ma qui lo usiamo come un indicatore del contenuto totale di carboidrati digeribili (Vedi Smith et al. 20 per un'analisi più dettagliata). Insieme, questi saggi misurano i due macronutrienti che sono fortemente legati per prestazioni eco-fisiologia ed erbivoro, fornendo dati importanti sulla qualità della risorsa alla base delle catene alimentari terrestri delle piante. Presentando questi protocolli promuove la generazione dei DataSet dei macronutrienti pianta al fine di ottenere una comprensione più approfondita della fisiologia vegetale, ecologia nutrizionale erbivoro e interazioni pianta-erbivoro.
Protocollo
1. impianto di raccolta e elaborazione
- Raccogliere ed elaborare i campioni di pianta
- Dopo aver raccolto campioni di piante, flash-congelare campioni immergendo il materiale vegetale in azoto liquido con forcipe e conservare a-80 ° C. Se i campioni di pianta raccolti sono troppo grandi per flash-freeze, raffreddare rapidamente i campioni utilizzando ghiaccio secco e il trasferimento di un congelatore a-80 ° C appena possibile. Il contenuto di macronutrienti di materiale vegetale può cambiare dopo tessuti sono separati dalla pianta, quindi è importante congelare i campioni di pianta più presto possibile dopo la raccolta.
Attenzione: Azoto liquido può causare congelamento severo quando a contatto con la pelle. Si prega di assicurarsi che per il trasporto di azoto liquido in contenitori omologati e indossare adeguato PPE durante la sua movimentazione, tra cui cryo-guanti, occhio googles, visiera, grembiule e un camice da laboratorio. - Lyophilize materiale vegetale con un liofilizzatore per garantire che i tessuti sono metabolicamente inattivi mentre acqua viene rimossa. A secco fino a quando la massa del campione si stabilizza per garantire tutta l'acqua è stata rimossa.
- Una volta i campioni sono asciutti, macinare in una polvere fine utilizzando una smerigliatrice o mulino. Conservare i campioni in un armadietto di inaridimento fino all'analisi.
- Dopo aver raccolto campioni di piante, flash-congelare campioni immergendo il materiale vegetale in azoto liquido con forcipe e conservare a-80 ° C. Se i campioni di pianta raccolti sono troppo grandi per flash-freeze, raffreddare rapidamente i campioni utilizzando ghiaccio secco e il trasferimento di un congelatore a-80 ° C appena possibile. Il contenuto di macronutrienti di materiale vegetale può cambiare dopo tessuti sono separati dalla pianta, quindi è importante congelare i campioni di pianta più presto possibile dopo la raccolta.
2. analisi della proteina solubile
- Preparazione del campione
- Pesare campioni replicati di ogni tessuto, circa 20 mg ciascuno, in polistirolo per microcentrifuga da 1,5 mL e tubi di etichetta. Questi campioni saranno in seguito essere denominati campioni incogniti. Registrare la massa esatta di ciascun campione, come queste informazioni è necessario calcolare la % di proteine solubili in ogni campione sconosciuto. Utilizzare per microcentrifuga con coperchi di chiusura, come coperchi non di blocco possono aprire durante la fase di riscaldamento successivo, con conseguente perdita della soluzione campione.
- Solubilizzano e isolare proteine del campione sconosciuto
- Utilizzo di una micro-pipetta, aggiungere 500 µ l di 0.1 M NaOH in ogni provetta. Chiudere ermeticamente il coperchio e Sonicare per 30 minuti. Preriscaldare un acqua calda bagno 90 ° C.
Attenzione: Idrossido di sodio è una base forte e possono provocare ustioni a contatto con la pelle. Anche se 0,1 M NaOH rappresenta una concentrazione bassa, indossare guanti protettivi per evitare irritazioni della pelle. - Inserire le provette in una rastrelliera nel bagno di acqua calda per 15 minuti.
- Centrifugare le provette a 15.000 x g per 10 minuti. Dispensare il liquido supernatante nei nuovi con etichetta microcentrifuga, utilizzando un nuovo puntale per ogni campione. Aggiungere 300 µ l di 0.1 M NaOH nella provetta contenente il pellet e centrifugare nuovamente a 15.000 x g per 10 minuti. Ancora una volta, raccogliere il supernatante e combinarlo con altri il sovranatante dallo stesso campione. Si tratta di un potenziale punto di sosta, e campioni possono essere conservati a 4 ° C durante la notte se necessario.
- Utilizzo di una micro-pipetta, aggiungere 500 µ l di 0.1 M NaOH in ogni provetta. Chiudere ermeticamente il coperchio e Sonicare per 30 minuti. Preriscaldare un acqua calda bagno 90 ° C.
- Precipitare le proteine vegetali
- Neutralizzare il pH della soluzione supernatante aggiungendo 11 µ l di 5,8 M HCl. confermare un pH di 7 ~ immergendo tornasole in ogni soluzione di esempio.
Attenzione: L'acido cloridrico è un acido forte corrosivo che possa causare ustioni a contatto con la pelle (applicazione cutanea o per inalazione). Si prega di indossare guanti per evitare irritazioni della pelle durante la manipolazione di HCl. - Aggiungere 90 µ l di 100% acido tricloroacetico (TCA) in ogni provetta e incubare le provette in ghiaccio per 30 minuti. La precipitazione delle proteine si trasformerà la soluzione da trasparente ad opaco. Se questo non si verifica dopo 30 minuti, conservare le provette per 1 ora. Si tratta di un potenziale punto di sosta, e campioni possono essere conservati a 4 ° C durante la notte se necessario.
Attenzione: Acido tricloroacetico è corrosivo. Indossare guanti durante la manipolazione per evitare il contatto con la pelle ed evitare l'inalazione. - Centrifugare i campioni a 13.000 x g per 10 minuti a 4 ° C. Rimuovere con delicatezza TCA surnatante l'aspirazione mediante una linea del vuoto attaccata a una punta di una micropipetta di vetro fine (la stessa punta può essere utilizzata attraverso campioni). Non disturbare il pellet di proteine evitando aspirazione pesante e mantenere una distanza adeguata tra il puntale e il pellet.
- Pellet di lavare rapidamente con 100 µ l di acetone da-20 ° C. Questo passaggio rimuove qualsiasi TCA rimanente dal pellet, che può interferire con l'analisi di Bradford successiva; Tuttavia, acetone inizierà a sciogliere il pellet di proteina se rimane a contatto troppo a lungo, in modo da acetone dovrebbe aggiungersi poi rapidamente Estratto dal pellet entro 5 secondi.
- Consentire l'acetone a evaporare mettendo tubi in una cappa aspirante o frigorifero. Quindi, dissolva la pallina di proteina aggiungendo 1 mL di NaOH M 0.1 a ciascuna provetta. Sciogliere completamente il pellet potrebbe richiedere diversi cicli di riscaldamento in un acqua calda vasca, Vortex e sonicating.
Nota: Il più a lungo i tubi sedersi la cappa o frigorifero e secco il pellet fatti, tanto più difficile sarà ri-solubilizzare. Si consiglia di asciugare il pellet per 30 minuti, e quindi verificare la presenza di acetone ogni 10-15 minuti fino a quando è chiaro che l'acetone evaporato (nessun vapori di acetone sono rilevabili).
- Neutralizzare il pH della soluzione supernatante aggiungendo 11 µ l di 5,8 M HCl. confermare un pH di 7 ~ immergendo tornasole in ogni soluzione di esempio.
- Mescolare soluzioni standard, diluire soluzioni campione sconosciuto e quantificare il contenuto proteico totale dei campioni sconosciuti utilizzando l'analisi di Bradford.
- Preparare a bovino dell'immunoglobulina G (IgG) soluzioni standard secondo concentrazioni elencate in tabella 1 (liofilizzato o soluzione di riserva di IgG può essere miscelato con acqua deionizzata per ottenere ogni concentrazione). Conservare gli standard a 4 ° C. In una piastra a 96 pozzetti, aggiungere 160 µ l di ciascuna soluzione standard di IgG in triplice copia a partire dalla posizione di A1 della piastra ben (0 µ g / µ l in A1, A2, A3 posizione, 0,0125 µ g / µ l in B1, B2, B3 posizioni, ecc.).
- Preparare una soluzione di NaOH diluita aggiungendo 50 µ l di NaOH M 0.1 a 950 µ l di acqua distillata. Come controllo negativo vuoto, aggiungere 60 µ l di questa soluzione alla piastra ben in triplice copia (G1, G2, G3 posizioni).
- Preparare le diluizioni dei campioni sconosciuti aggiungendo 50 µ l di ogni soluzione di campione a 950 µ l di acqua distillata in un nuovo tubo per microcentrifuga da 1,5 mL. Quindi, aggiungere 60 µ l di ciascun campione diluito alla piastra ben in triplice copia, a partire dalla posizione di H1. Per l'analisi di 25 campioni sconosciuti quando letti in triplice copia, 6 standard e 1 vuoto dovrebbe consentire una piastra a 96 pozzetti. Ogni piatto ben analizzato dovrebbe contenere propri campioni standard e vuoti di IgG.
- Aggiungere 100 µ l di acqua distillata a tutti i pozzetti di campioni in bianco e sconosciuto. Ora ognuno bene deve contenere un totale di 160 µ l. utilizzando una pipetta multicanale (8 canali), aggiungere 40 µ l di proteina del G-250 di blu brillante Coomassie tintura ad ogni bene nella prima colonna della piastra bene. Mescolare la tintura con i campioni immergendo ripetutamente. Ripetere per tutte le altre colonne, sostituendo i puntali per evitare la contaminazione.
Attenzione: G-250 di blu brillante Coomassie è un irritante e contatto con la pelle, gli occhi, o i polmoni dovrebbero essere evitati. Si prega di indossare guanti per evitare il contatto con la pelle. In caso di contatto con la pelle, questo prodotto si macchia. - Utilizzare un ago per pop tutte le bolle presenti nei pozzetti, che potrebbero interferire con la lettura di spettrofotometro di micropiastre. Pulire l'ago per evitare la contaminazione tra pozzetti. Lasciate che la micropiastra Incubare a temperatura ambiente per 5 minuti.
- Utilizzando uno spettrofotometro per micropiastre, registrare i valori di assorbanza di ciascun pozzetto a 595 nm.
- Annotare l'assorbanza media per tre pozzetti del bianco e sottrarre questo valore da ciascuna delle letture del campione standard e sconosciuta. Quindi, annotare l'assorbanza media per ciascun campione standard e sconosciuta.
Nota: Per calcolare la quantità di proteine presenti in ciascun campione sconosciuto utilizzando la curva standard, è più facile a regredire l'assorbanza media di ogni standard contro la microgrammi di proteine presenti in ogni livello, ma uno può tracciare la concentrazione nella proteina (µ g / µ l) di ogni standard se auspicabile. I calcoli seguenti, tuttavia, fare riferimento a una curva standard basata su microgrammi, non le concentrazioni (µ g / µ l). - Tracciare l'assorbanza media di ogni standard contro la quantità totale di proteine presenti in ogni standard ben (tabella 1). Montare una retta di regressione lineare a questi dati e utilizzare l'equazione per calcolare la quantità di proteina (µ g) in ciascun campione sconosciuto ben basato sull'assorbanza media (Figura 1a).
Nota: Il coefficiente di correlazione (valorer ) di questa linea deve essere maggiore di 0,98 e ordinariamente vicino a 0,99. La regressione standard sarà specifica per ogni piatto, quindi pozzetti sconosciuto in ogni piatto devono essere analizzati separatamente. - Una volta che la quantità media di proteina è calcolata per ciascun pozzetto campione sconosciuto, è possibile utilizzare la seguente equazione per calcolare la quantità totale di proteine (µ g) ogni campione originale:
Mp = (((Wp60) x 1000) / 50) * 1000
Mp = µ g di proteina nel campione originale
Wp = µ g di proteina nel campione sconosciuto ben- Quindi, utilizzare la seguente equazione per determinare la percentuale di proteine in ogni campione:
Pp = ((Mp/1000) /Mi) * 100
Pp = % proteina nel campione
Mmi = massa iniziale del campione (mg)
Nota: In alcuni casi, il campione può superare la soglia di assorbanza superiore. In questo caso, esempi di soluzioni possono richiedere un'ulteriore diluizione al punto 2.4.3.
Ulteriori diluizioni devono quindi essere contabilizzati nei calcoli successivi. Alcune marche di lettore di micropiastre anche forniscono software per computer che calcola automaticamente la concentrazione di proteina medio di ogni campione sconosciuto sulla base dei dati di curva standard.
- Quindi, utilizzare la seguente equazione per determinare la percentuale di proteine in ogni campione:
3. digeribile di carboidrati Assay
- Preparazione del campione
- Pesare campioni replicati di ogni tessuto, circa 20 mg, in vetro provette da 15 mL con tappo a vite gommati (100 mm di lunghezza). Queste campione verrà in seguito essere denominati campioni incogniti. Etichettare le provette con un pennarello impermeabile o con etichettatura nastro sui coperchi e registrare la massa esatta di ciascun campione, come queste informazioni è necessario calcolare la % di carboidrati in ogni campione sconosciuto.
- Estrarre carboidrati digeribili da ogni campione sconosciuto.
- Aggiungere 1 mL di 0,1 M H2così4 a ciascuna provetta e tappi a vite su tubi strettamente. Posto in un bagno di acqua bollente per 1 ora.
Attenzione: L'acido solforico è molto corrosivo. Si prega di indossare guanti, occhio googles e un grembiule maneggiare H2così4 ed eseguire questo passaggio in una cappa aspirante. - Rinfrescarsi con tubi in bagno d'acqua tiepida. Versare filmato contenuto nel etichettati 1,5 mL microcentrifuga (non essere preoccupati se alcuni pianta resti materiali dei tubi di vetro).
- Centrifugare le provette a 15.000 x g per 10 minuti. Rimuovere il liquido supernatante con micro-pipettatore e mettere in nuovo per microcentrifuga da 1,5 mL con etichetta. Tubi possono essere refrigerati a questo punto durante la notte. Se continuando con l'analisi, fare riferimento al punto 3.3.2.
- Aggiungere 1 mL di 0,1 M H2così4 a ciascuna provetta e tappi a vite su tubi strettamente. Posto in un bagno di acqua bollente per 1 ora.
- Mescolare soluzioni standard e quantificare il contenuto di carboidrati digeribili totale dei campioni sconosciuti.
- Preparare D(+) glucosio soluzioni standard con le concentrazioni elencate in tabella 2. Preparare sei provette di vetro con 400 µ l di ciascuna soluzione.
- Pipettare 15 µ l di ogni campione sconosciuto nella propria provetta e aggiungere 385 µ l di acqua distillata a ciascuna per un volume totale di 400 µ l in ogni provetta. In una cappa, aggiungere 400 µ l di fenolo al 5% per ogni provetta di campione standard e sconosciuta e quindi rapidamente Pipettare 2 mL di concentrato H2SO4 in ogni provetta. Non toccare il contenuto della provetta con il puntale della pipetta, basta aggiungere alla superficie di soluzione (una pipetta a ripetizione funziona meglio per questo).
- Lasciate che tubi Incubare per 10 minuti e poi accuratamente vortice i tubi per mescolare il contenuto. Incubare per altri 30 minuti.
Attenzione: Fenolo e acido solforico sono sostanze irritanti corrosivi. Per proteggere dall'esposizione della pelle, occhi e inalazione, questo passaggio deve essere eseguito in una cappa chimica utilizzando il PPE adeguato, che comprende: faccia scudo o occhio occhiali di protezione, guanti di gomma, grembiule di laboratorio e stivali. Miscelazione fenolo con acido solforico anche risultati in una reazione esotermica, che si tradurrà nei tubi diventando caldo. - Pipettare 800 µ l di campione da ciascuna provetta in ognuna delle 3 cuvette semimicro di polistirolo da 1,5 mL (3 tecniche ripetizioni per campione). Impostare lo spettrofotometro a leggere a 490 nm. Calibrazione di una provetta vuota contenente acqua distillata prima di leggere norme o campioni incogniti e ad intermittenza durante letture campione. Eseguire ogni provetta attraverso uno spettrofotometro e annotare l'assorbanza. Media in tecnico replica per ogni campione sconosciuto.
Nota: In alcuni casi, i campioni possono superare la soglia di assorbanza superiore. In questo caso, i campioni devono essere diluiti al punto 3.2.3. Diluizioni devono essere contabilizzati anche nei calcoli successivi. - Calcolare l'assorbanza media per ogni standard.
Nota: Per calcolare la quantità di carboidrati digeribili totali presenti in ogni campione sconosciuto utilizzando la curva standard, è più facile a regredire l'assorbanza media di ogni standard contro la microgrammi di D (+) glucosio presente in ogni standard, ma si può anche tracciare la concentrazione di glucosio di D (+) (µ g / µ l) di ogni standard se auspicabile. I calcoli seguenti, tuttavia, fare riferimento a una curva standard basata su microgrammi, non le concentrazioni (µ g / µ l). - Calcolare la curva standard tracciando l'assorbanza media contro la quantità totale di D (+) glucosio (µ g) in ogni soluzione standard. Forma una retta di regressione lineare a questi dati e quindi utilizzare la seguente equazione per calcolare la quantità totale di carboidrati (µ g) in ciascun campione sconosciuto:
Mc = (((Ax -b)/m)/(15)) * 1000
Mc = µ g di carboidrati nel campione
Ax = assorbanza media del campione sconosciuto
b = intercetta (linea di regressione standard)
m = pendenza (linea di regressione standard)
Il coefficiente di correlazione di questa linea dovrebbe essere maggiore di 0,98 e ordinariamente vicino a 0,99. Quindi, utilizzare la seguente equazione per determinare la percentuale di carboidrati in ogni campione:
Pc = ((Mc/1000) / (Mi)) * 100
Pc = % di carboidrati
Mmi = massa iniziale del campione (mg)
Risultati
Per mostrare l'utilità di questi metodi, abbiamo analizzato la proteina solubile e il contenuto di carboidrati digeribili di quattro differente campo e tessuti di granturco dolce che fungono da potenziali risorse nutrizionali distinte per gli insetti erbivori. Abbiamo raccolto spighe di grano da tre regioni agricole negli Stati Uniti (Minnesota, North Carolina e Texas), che comprende cinque diverse varietà di granoturco (cioè, genotipi) e una varietà di mais di campo come un outgroup. La tabella 3 Mostra un riepilogo di questi campioni di mais e dove sono stati raccolti. Tutte le varietà sono stati raccolti a maturità, ma a causa di differenze inerenti allo sviluppo tra varietà, non erano tutti raccolti nello stesso giorno dopo la piantatura. Abbiamo elaborato le orecchie nei tessuti distinti separando rapidamente le bucce (foglie modificate circondano la pannocchia) e sete (splendente fibre tra la buccia e noccioli) dall'orecchio prima di riporre tutti i tessuti a-80 ° C come indicato nei metodi. Ogni tessuto è stato poi liofilizzata. Una volta essiccato, abbiamo separato i kernel dalla base e la punta dell'orecchio dopo la rasatura kernel da un terzo superiore (punta) e un terzo inferiore (base) di pannocchia. Successivamente, tutti i tessuti sono stati macinati in polvere fine. Abbiamo quindi analizzato buccia, seta, punta kernel e campioni di tessuto di base del kernel per proteina solubile e contenuto di carboidrati digeribili secondo le procedure descritte nei metodi di cui sopra. Dato i vincoli sulla quantità di tessuto disponibile, abbiamo analizzato un totale di 217 campioni di piante per proteine solubili e contenuto di carboidrati digeribili.
Proteina solubile
Abbiamo analizzato nove piatti campione con lo spettrofotometro in totale e generale, standard curve avevano alti coefficienti di correlazione (r), con valori compresi tra 0.985-1.00. La figura 1 Mostra la curva standard ottenuta con il più alto (A) e più basso (B) valori di r per esibire la variabilità che abbiamo osservato attraverso piastre. Abbiamo calcolato la proteina solubile % per tutti i campioni utilizzando massa del campione iniziale (tabella 4) e quindi analizzati i dati per statistica delle differenze nel contenuto di proteina solubile tra regioni, varietà e tipi di tessuto. I dati erano rango-trasformato per soddisfare le ipotesi di normalità quando necessario.
Abbiamo osservato differenze significative nel contenuto di proteina solubile tra regioni (Welch ANOVA; F(2, 133,5) = 4.303, P = 0,015), come un risultato, dati da ogni regione sono stati successivamente analizzati separatamente. Minnesota campioni hanno mostrato una significativa interazione tra varietà e il tipo di tessuto sul contenuto di proteina solubile (ANOVA a due vie; F(3, 64) = 16,51, P < 0,001). Maggior parte dei tessuti ha avuto simili proteine solubili contenute in entrambe le varietà, tranne che per i kernel base, dove la varietà di mais dolce conteneva quasi 7 volte la quantità rispetto alla varietà di mais di campo. Per la varietà di mais di campo (Syngenta/NK-3122A-EZ), gusci e sete erano simili e avevano il più basso contenuto di proteina solubile di tutti i tessuti. Kernel dalla punta dell'orecchio ha avuto il più alto contenuto di proteine solubili e noccioli dalla base dell'orecchio sono stati intermedi (Figura 2a). Per la varietà di mais dolce (Providence Bicolor), tutti i tessuti erano distinti, con le bucce e sete contenente più basso contenuto di proteine solubili e kernel base contenute ~2.5 volte più di noccioli di punta (Figura 2b).
North Carolina campioni hanno mostrato anche un'interazione significativa fra varietà e il tipo di tessuto (ANOVA a due vie; F(3, 77) = 3,33, P < 0,024). Maggior parte dei tessuti ha mostrato la proteina solubile simile contenuto attraverso varietà, fatta eccezione per il kernel di punta che ha esibito un più alto contenuto in non - varietàBt (Sweet G90 ibrido). Per il Bt gusci di varietà (Seedway Bt 1576) erano il tessuto con la proteina solubile più basso contenuto, seguita da sete e noccioli di suggerimento, che aveva un contenuto simile. Kernel base aveva il più alto contenuto di proteine solubili ma non erano statisticamente differenti da quello di noccioli di punta (Figura 2C). Nella non -Bt varietà (Sweet G90 ibrido), tutti i tessuti erano distinti ad eccezione di punta e base noccioli che erano statisticamente simili. Lolla aveva la proteina solubile più basso contenuta, seguita da sete e kernel punta e base che aveva il più alto contenuto (figura 2d).
Campioni di Texas ha mostrati differenze significative nel contenuto di proteina solubile tra varietà (ANOVA a due vie; F(1, 76) = 12,91, P = 0,001) e tessuti (ANOVA a due vie; F(3, 76) = 21.90, P < 0,001), ma nessuna interazione significativa (ANOVA a due vie; F(3, 76) = 0,436, P = 0,728). Nel complesso, la varietà bicolor (Sh2 SS2742 NAT III) ha mostrato un contenuto di proteina solubile medio inferiore rispetto alla varietà di Silver Queen (TRTD F1 (su)). Attraverso entrambi i vitigni, gusci avevano il più basso contenuto di proteine, seguirono da sete e quindi il suggerimento e noccioli, entrambi i quali aveva similmente alto contenuto (Figura 2e-f) di base.
Carboidrati digeribili
Perché tutti i campioni sono stati analizzati in una sola volta, ci siamo imbattuti solo una curva standard. Figura 1 c Mostra che il coefficiente di correlazione era alto, a 0.998. Abbiamo calcolato il contenuto di carboidrati digeribili % per tutti i campioni (tabella 5) e quindi analizzato i dati per statistiche differenze nel contenuto di carboidrati digeribili tra regioni, varietà e tipi di tessuto. I dati sono stati trasformati a rango quando necessario per soddisfare l'ipotesi di normalità.
Non c'erano differenze significative tra regioni (ANOVA; F(2, 216) = 1.47, P = 0.231), ma per ragioni di continuità con le analisi di proteine abbiamo analizzato nuovamente i dati da ogni regione separatamente. Campioni del Minnesota ha mostrati nessuna differenza significativa nel contenuto di carboidrati digeribili tra varietà (ANOVA a due vie; F(1, 64) = 0.00014, P = 0.990) o tipo di tessuto (ANOVA a due vie; F(3, 64) = 0.818, P = 0,489). Non c'era inoltre nessuna interazione significativa tra varietà e tessuto (ANOVA a due vie; F(3, 64) = 2.26, P = 0,092). Figura 2a -b Mostra che tutti i tessuti hanno esibito un contenuto medio del 36,5% (± 0,53).
North Carolina campioni hanno mostrato un effetto significativo del tipo del tessuto il contenuto di carboidrati digeribili (ANOVA a due vie; F(3, 77) = 3,99, P = 0,011), ma nessun effetto di varietà (ANOVA a due vie; F(1, 77) = 1,06, P = 0.307) o interazione (ANOVA a due vie; F(3, 77) = 0.465, P = 0.708). Figura 2 c -d Mostra che sete ha avuto il più basso contenuto di carboidrati digeribili, seguita da gusci, suggerimento kernel e base. Tutti i tessuti erano statisticamente simili tranne che per la sete e kernel base.
Campioni di Texas ha mostrati alcun effetto significativo di varietà (ANOVA a due vie; F(1, 76) = 0.834, P = 0.364) o tipo di tessuto (ANOVA a due vie; F(3, 76) = 1.03, P = 0.385), ma ha mostrato un'interazione significativa (ANOVA a due vie; F(3, 76) = 3.34, P = 0.024). Questo effetto è stato in gran parte perché kernel base nella varietà bicolor (Sh2 SS2742 NAT III) aveva un significativamente più alti carboidrati digeribili contenuto rispetto a quelli nella varietà Silver Queen (TRTD F1 (su)). Figura 2e -f Mostra che non c'erano differenze statistiche nel contenuto di carboidrati digeribili attraverso tipi di tessuto nella varietà Silver Queen (TRTD F1 (su)), ma c'era una differenza significativa tra seta e tessuti di base del kernel per la (varietà bicolor SH2 SS2742 NAT III).
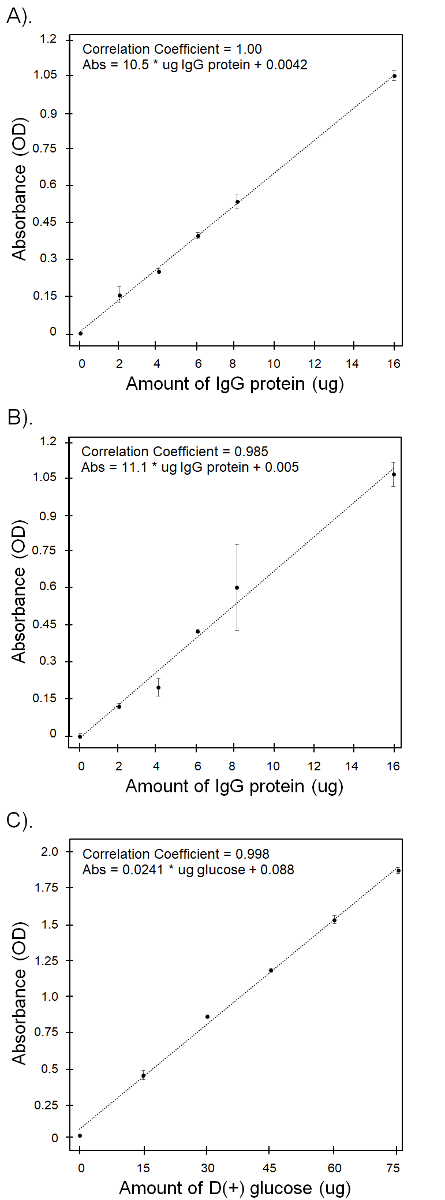
Figura 1. Curve standard per le analisi dei macronutrienti. (A) la curva standard per l'analisi della proteina solubile mostrando la piastra con il più alto coefficiente di correlazione (migliore curva). (B) la curva standard per l'analisi della proteina solubile mostrando la piastra con il più basso coefficiente di correlazione (peggiore curva). (C) la curva standard per il dosaggio di carboidrati digeribili. Clicca qui per visualizzare una versione più grande di questa figura.
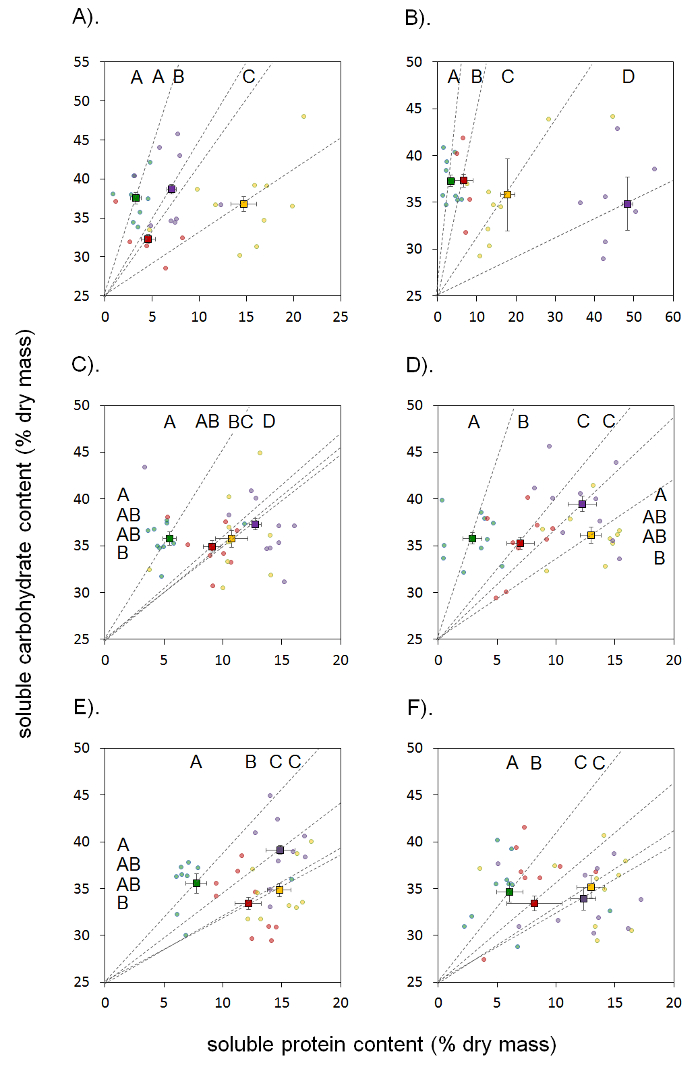
Figura 2. Dire proteina solubile % e contenuto di carboidrati digeribili % per ogni tipo di tessuto. (A) MN - Bt Syngenta/NK-3122A-EZ (campo di mais), (B) MN - non -Bt Providence Bicolor, (C) NC - Seedway Bt 1576, (D) NC - non -Bt Sweet G90 ibrido, (E) TX - Sh2 SS2742 F1 NAT III Bicolor, (F) TX - Silver Queen TRTD F1 (su). Cerchi mostrano dati grezzi, mentre piazze mostrano i valori medi. Verde (buccia), rosso (seta), giallo (punta noccioli) e viola (kernel base). Le linee punteggiate che collegano l'origine per ogni quadrato Visualizza il rapporto P:C per ogni tessuto (rapporto è la pendenza alla linea punteggiata). Lettere mostrano risultati post hoc, per differenze di proteina lungo le differenze del carboidrato e top lungo il lato, con diverse lettere che rappresentano valori significativamente diversi tra tessuti. Clicca qui per visualizzare una versione più grande di questa figura.
| IgG concentrazione (ug/uL) | Proteine in campioni Standard (ug) |
| 0.0000 | 0 |
| 0,0125 | 2 |
| 0,0250 | 4 |
| 0.0375 | 6 |
| 0.0500 | 8 |
| 0.1000 | 16 |
Tabella 1. Calcolo della curva standard per l'analisi della proteina solubile. La quantità di proteina in ogni standard è calcolata prendendo la concentrazione di ogni standard e moltiplicandolo per la quantità di soluzione standard in ogni pozzetto (160 µ l).
| D (+) glucosio concentrazione (ug/uL) | D (+) glucosio in campioni Standard (ug) |
| 0.0000 | 0 |
| 0.0375 | 15 |
| 0.0750 | 30 |
| 0.1125 | 45 |
| 0.1500 | 60 |
| 0,1875 | 75 |
Tabella 2. Calcolo della curva standard per l'analisi di carboidrati digeribili. La quantità di glucosio in ogni standard è calcolata prendendo la concentrazione di ogni standard e moltiplicandolo per la quantità di soluzione standard in ogni provetta (400 µ l).
| Regione | Varietà | Posizione | N |
| Minnesota | BT Syngenta/NK-3122A-EZ (campo di mais) | Rosemount, MN (44.7070,-93.1073) | 10 |
| non - Bt Providence Bicolor | Rosemount, MN (44.7070,-93.1073) | 10 | |
| Carolina del Nord | non - Bt Sweet G90 ibrido | Rocky Mount, NC (35.8918,-77.6780) | 10 |
| Seedway Bt 1576 | Edenton, NC (36.1758,-76.7057) | 10 | |
| Texas | SH2 SS2742 F1 NAT III Bicolor | Lubbock, TX (33.6935,-101.8249) | 10 |
| Silver Queen TRTD F1 (su) | Lubbock, TX (33.6935,-101.8249) | 10 |
Tabella 3. Riepilogo della posizione di campionamento di mais e varietà. Per ogni combinazione di regione e varietà, sono stati raccolti 10 orecchie e sono stati analizzati quattro tessuti: buccia, sete, punta kernel e base.
| Regione | Varietà | % di proteine solubili | |||
| buccia | sete | kernel di punta | kernel base | ||
| Minnesota | BT Syngenta/NK-3122A-EZ (campo di mais) | 3,29 ± 0,38 | 4.57 ± 1.27 | 14.74 ± 1.54 | 7,07 ± 0,84 |
| non - Bt Providence Bicolor | 3.35 ± 0,58 | 6,71 ± 0.70 | 17.87 ± 3,85 | 48.41 ± 2,85 | |
| Carolina del Nord | non - Bt Sweet G90 ibrido | 2,90 ± 0.60 | 6.97 ± 0,63 | 12.95 ± 0,86 | 12.23 ± 0,83 |
| Seedway Bt 1576 | 5.48 ± 0,73 | 9.08 ± 0.62 | 10.75 ± 0.93 | 12.76 ± 1.16 | |
| Texas | SH2 SS2742 F1 NAT III Bicolor | 7.74 ± 1,03 | 12.15 ± 0,63 | 14.79 ± 0.69 | 14.88 ± 0,48 |
| Silver Queen TRTD F1 (su) | 6,06 ± 1.05 | 8.17 ± 0,79 | 12.95 ± 1.19 | 12.32 ± 1.23 | |
Tabella 4. Proteina valori medi per ogni tipo di tessuto, varietà e regione. Dire le percentuali (di massa secca) sono mostrate ± 1 SE.
| Regione | Varietà | % di carboidrati digeribili | |||
| buccia | sete | kernel di punta | kernel base | ||
| Minnesota | BT Syngenta/NK-3122A-EZ (campo di mais) | 37.55 ± 0,88 | 32.31 ± 1.38 | 36.79 ± 1.60 | 38.66 ± 1.57 |
| non - Bt Providence Bicolor | 37.30 ± 0,82 | 37.31 ± 2.30 | 35.80 ± 1.77 | 34.83 ± 1,37 | |
| Carolina del Nord | non - Bt Sweet G90 ibrido | 35.79 ± 0,81 | 35.28 ± 1.17 | 36.13 ± 0.91 | 39,47 ± 1.18 |
| Seedway Bt 1576 | 35.75 ± 0,58 | 34.91 ± 0,76 | 35.73 ± 1,35 | 37.29 ± 1.13 | |
| Texas | SH2 SS2742 F1 NAT III Bicolor | 35.55 ± 0,87 | 33.40 ± 1.10 | 34.85 ± 1,01 | 39.14 ± 1,22 |
| Silver Queen TRTD F1 (su) | 34.63 ± 1.13 | 33.42 ± 2.33 | 35.16 ± 1.16 | 33.93 ± 1,03 | |
Tabella 5. Carboidrato valori medi per ogni tipo di tessuto, varietà e regione. Dire le percentuali (di massa secca) sono mostrate ± 1 SE.
Discussione
Combinando analisi colorimetriche ben consolidate con protocolli efficace impianto specifico dell'estrazione, le analisi hanno dimostrate qui forniscono un metodo ragionevole e preciso per la misurazione della proteina solubile vegetale e contenuto di carboidrati digeribili. I nostri risultati utilizzando mais come exemplar illustra come questi protocolli possono essere utilizzati per ottenere misurazioni precise tra diverse scale spaziali biologicamente rilevanti. Ad esempio, siamo stati in grado di rilevare differenze nella pianta proteina solubile e contenuto di carboidrati digeribili geografica regioni, varietà (o genotipi), tipi di tessuto e tessuti anche spazialmente segregate. Entrambi i test possono essere fatto utilizzando apparecchiature di laboratorio e reagenti, che richiedono solo competenze di laboratorio di base, comuni e può analizzare un numero relativamente elevato di campioni (50-75) entro un breve lasso di tempo.
Anche se è relativamente facile da effettuare, alcuni passaggi sono più critici rispetto ad altri e se fatto in modo non corretto possono limitare l'accuratezza dei risultati. Ad esempio, è imperativo che i materiali vegetali sono gestite correttamente durante la fase di campionamento. Tessuto vegetale anche dissecata rimarrà metabolicamente attivo fino a quando esposto ad una temperatura letale, e durante questa periodo pianta dei macronutrienti contenuto può cambiare. Di conseguenza, lunghi periodi di tempo tra impianto di campionamento e congelamento (sia di stoccaggio liquidi N o congelatore) possono aumentare la probabilità che contenuto di esempio pianta dei macronutrienti non può riflettere il contenuto che era presente al momento del campionamento.
Passi 2.3.3-2.3.5 nel protocollo della proteina sono particolarmente importanti per un risultato di successo, come procedura trattare con proteine precipitate. Cura deve essere presa per evitare di perdere qualsiasi del pellet proteina quando aspirare il surnatante TCA da microcentrifuga, perché così facendo si tradurrà in una sottovalutazione del contenuto proteico. È importante anche quando si lava il pellet di proteina con acetone a farlo molto rapidamente. Acetone può degradare il pellet se rimane a contatto per più di alcuni secondi. Ti consigliamo di limitare il contatto tra acetone e il pellet a meno di 5 secondi. Infine, quando si asciuga il pellet, è importante prendersi cura solo consentire tempo sufficiente per l'acetone ad evaporare. Se la pallina viene lasciata ad per asciugare per troppo tempo, diventa molto difficile risospendere in NaOH. Ti consigliamo di asciugare il pellet per 30 minuti e quindi verificare la presenza di acetone, o osservando visivamente liquido nel tubo o rilevando attentamente l'odore dei fumi di acetone. Continuare il controllo il pellet ogni 10-15 minuti fino a che l'acetone evaporato.
Come descritto in Bradford 197616, la procedura di quantificazione usando colorante del G-250 di blu brillante Coomassie consentire ad alta sensibilità, con una deviazione standard di proteina solo 5 µ g/mL, stabilità del complesso alta proteina-colorante e limitata interferenza da composti non proteici. Questo test ha un range tra 1-20 µ g di proteine totali per micropiastra ben (analisi di basso-concentrazione) o un massimo di 25 µ g/mL; Tuttavia, qualsiasi concentrazione che supera gli standard più elevati dovrebbe essere diluito e ri-analizzati per i risultati più accurati (il protocollo produce un eccesso di soluzione nel caso in cui tali diluizioni e ri-analisi è necessario). C'è un pregiudizio per la tintura preferenzialmente associare a amminoacidi basici, come arginina e residui di amminoacido aromatico; Tuttavia, l'analisi di Bradford rimane il metodo più accurato e facile da usare per quantificazione della proteina totale in campioni misti.
Il dosaggio di carboidrati digeribili è un metodo veloce, conveniente e semplice per quantificare saccaridi pianta escludendo carboidrati strutturali (quali la cellulosa), che sono indigeribili da maggior parte erbivori. I passaggi più problematici nei saggi del carboidrato sono punti 3.2.1 e 3.3.2-3.3.4. Qui, è fondamentale per mantenere le provette in posizione verticale e serrare i coperchi a vite ben durante l'ebollizione, come l'introduzione di qualsiasi acqua farà diluire i campioni e influenzare la quantificazione accurata. Inoltre, la cura deve essere presa quando si lavora con fenolo e concentrato acido solforico, in quanto entrambi sono altamente corrosivi. Dovrebbe essere notato che sosteniamo registrazione assorbanza del campione a 490 nm, che è l'assorbanza massima per esosi, ma non altri zuccheri, ad esempio pentosi e Acidi uronici che hanno una capacità massima di assorbimento a 480 nm20,21. Per le miscele di zucchero in campioni di piante, 490 nm fornisce una lunghezza d'onda appropriata per la quantificazione complessiva del carboidrato contenuto22,23,24, ma per un'analisi più dettagliata dei diversi zuccheri vedere20, 21. Dovrebbe anche essere notato che Masuko et al. 23 fornisce un metodo di micropiastre semplificata per l'analisi di fenolo-solforico acido carboidrati.
Degni di nota un altro metodo per la stima pianta nutriente contenuto25,26,27 è spettroscopia nel vicino infrarosso (NIRS). La tecnologia NIRS è ampiamente usata in agricoltura e produzione alimentare. Questa tecnica alternativa è non invasiva, non distruttiva, richiede una frazione del tempo coinvolto in qualsiasi metodo di chimica umida e può essere applicata a diverse scale da un paesaggio verso il basso per un singolo pezzo di tessuto vegetale. Questa tecnica misura indirettamente le sostanze nutrienti e si basa su misurazioni accurate chimica umida del prodotto chimico pianta di interesse per la calibrazione. I metodi descritti nel presente documento avrà dunque un luogo critico in futuro di analisi dei nutrienti vegetali, assicurando che taratura è basata sulla quantificazione dei macronutrienti solubile e digeribile e non distorte da surrogati elementali non nutritivi.
I metodi presentati per la misurazione della proteina solubile vegetale e contenuto di carboidrati digeribili hanno implicazioni significative per le scienze ambientali e biologiche. Malgrado una ricchezza di informazioni sulla composizione elementare dei tessuti vegetali, informazioni sul contenuto di macronutrienti di pianta sono gravemente carente. Dato le limitazioni che esistono nella correlazione Elementale misure con dei macronutrienti contenuti e riconoscendo la forte relazione tra pianta processi ecologici nutrizionali e più ordine, ottenere questo tipo di dati è essenziale per avanzando i campi di fisiologia vegetale, ecologia nutrizionale, interazioni pianta-erbivoro, cibo-web dinamiche11,28,29,30. È nostra speranza che fornendo una metodologia chiara e accessibile per la misurazione della proteina solubile vegetale e contenuto di carboidrati digeribili incoraggerà i ricercatori a raccogliere e incorporare questo tipo di dati in future ricerche.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Grazie a tutti i nostri collaboratori che hanno assistito con raccolte di campi di mais dolce, tra cui Dominic Reisig e Dan Mott alla North Carolina State University e Pat Porter alla Texas A & M University a Lubbock, TX. Grazie a Fiona Clissold per aiutare ad ottimizzare i protocolli e per fornire le modifiche apportate a questo manoscritto. Questo lavoro è stato sostenuto in parte da Texas A & M C. Everette Stancapiano Fellowship (Department of Entomology) e il programma di sovvenzione di valutazione biotecnologia rischio competitivo concedere no. 2015-33522-24099 dal dipartimento di agricoltura degli Stati Uniti (assegnato a GAS e STB).
Materiali
| Name | Company | Catalog Number | Comments |
| microplate reader (spectrophotometer) | Bio-Rad | Model 680 XR | |
| Bio-Rad Protein Assay Dye Reagent concentrate | Bio-Rad | #5000006 | 450mL |
Riferimenti
- Simpson, S. J., Raubenheimer, D. The Nature of Nutrition: A Unifying Framework from Animal Adapation to Human Obesity. , Princeton University Press. Princeton, NJ. (2012).
- Behmer, S. T. Insect herbivore nutrient regulation. Annual Review of Entomology. 54, 165-187 (2009).
- Epstein, E. Mineral nutrition of plants: mechanisms of uptake and transport. Annual Review of Plant Physiology. 7 (1), 1-24 (1956).
- Chapin, F. S. III The mineral nutrition of wild plants. Annual Review of Ecology, Evolution, and Systematics. 11 (1), 233-260 (1980).
- Marschner, H. Marschner's Mineral Nutrition of Higher Plants. , Academic press. London, UK. (1956).
- Stieger, P. A., Feller, U. Senescence and protein remobilization in leaves of maturing wheat plants grown on waterlogged soil. Plant and Soil. 166, 173-179 (1994).
- Li, R., Volenec, J. J., Joern, B. C., Cunningham, S. M. Seasonal changes in nonstructural carbohydrates, protein, and macronutrients in roots of alfalfa, red clover, sweetclover, and birdsfoot trefoil. Crop Science. 36, 617-623 (1996).
- Sánchez, E., Rivero, R. M., Ruiz, J. M., Romero, L. Changes in biomass, enzymatic activity and protein concentration in roots and leaves of green bean plants (Phaseolus vulgaris L. cv. Strike) under high NH4NO3 application rates. Scientia Horticulturae. 99, 237-248 (2004).
- Lenhart, P. A., Eubanks, M. D., Behmer, S. T. Water stress in grasslands: Dynamic responses of plants and insect herbivores. Oikos. 124, 381-390 (2015).
- Machado, A. R., Arce, C. C. M., Ferrieri, A. P., Baldwin, I. T., Erb, M. Jasmonate-dependent depletion of soluble sugars compromises plant resistance to Manduca sexta. New Phytologist. 207, 91-105 (2015).
- Deans, C. A., Behmer, S. T., Fiene, J., Sword, G. A. Spatio-temporal, genotypic, and environmental effects of plant soluble protein and digestible carbohydrate content: implications for insect herbivores with cotton as an exemplar. Journal of Chemical Ecology. 42 (11), 1151-1163 (2016).
- Boisen, S., Bech-Andersen, S., Eggum, B. O. A critical view of the conversion factor 6.25 from total nitrogen to protein. Acta Agriculturae Scandinavica. 37, 299-304 (1987).
- Seed protein contents and nitrogen-to-protein conversion factors for some uncultivated tropical plant seeds. Food Chemistry. Ezeagu, I. E., Petzke, J. K., Metges, C. C., Akinsoyinu, A. O., Ologhobo, A. D. 78, 105-109 (2002).
- Izhaki, I. Influence of nonprotein nitrogen on estimation of protein from total nitrogen in fleshy fruits. Journal of Chemical Ecology. 19, 2605-2615 (1993).
- Mossé, J. Nitrogen to protein conversion factor for ten cereals and six legume or oilseeds. A reappraisal of its definition and determination. Variation according to species and seed protein content. Journal of Agricultural and Food Chemistry. 38, 18-24 (1990).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1-2), 248-254 (1976).
- Jones, C. G., Hare, J. D., Compton, S. J. Measuring plant protein with the Bradford assay. Journal of Chemical Ecology. 15 (3), 979-992 (1989).
- Dubois, M., Gilles, K. A., Hamilton, J. K., Rebers, P. A., Smith, F. Colormetric method for determination of sugars and related substances. Analytical Biochemistry. 28, 350-358 (1956).
- Clissold, F. J., Sanson, G. D., Read, J. The paradoxical effects of nutrient ratios and supply rates on an outbreaking insect herbivore, the Australian plague locust. Journal of Animal Ecology. 75, 1000-1013 (2006).
- Smith, D., Paulsen, G. M., Raguse, C. A. Extraction of total available carbohydrates from grass and legume tissue. Plant Physiology. 39 (6), 960-962 (1964).
- Cui, S. W. Food carbohydrates: Chemistry, physical properties, and applications. , CRC Press. Boca Raton, FL, USA. (2005).
- Chow, P. S., Landhäusser, S. M. A method for routine measurements of total sugar and starch content in woody plant tissues. Tree Physiology. 24 (10), 1129-1136 (2004).
- Masuko, T., Minami, A., Iwasaki, N., Majima, T., Nishimura, S. I., Lee, Y. C. Carbohydrate analysis by a phenol-sulfuric acid method in microplate format. Analytical Biochemistry. 339 (1), 69-72 (2005).
- Foley, W. J., McIlwee, A., Lawler, I., Aragones, L., Woolnough, A. P., Berding, N. Ecological applications of near infrared reflectance spectroscopy- a tool for rapid, cost-effective prediction of the composition of plant and animal tissues and aspects of animal performance. Oecologia. 116 (3), 292-305 (1998).
- Kokaly, R. F. Investigating a physical basis for spectroscopic estimates of leaf nitrogen concentration. Remote Sensing of Environment. 75 (2), 153-161 (2001).
- Schulz, H., Baranska, M. Identification and quantification of valuable plant substances by IR and Raman spectroscopy. Vibrational Spectroscopy. 43 (1), 13-25 (2007).
- Cozzolino, D., Morón, A. The potential of near-infrared reflectance spectroscopy to analyse soil chemical and physical characteristics. The Journal of Agricultural Science. 140, 65-71 (2003).
- Simpson, S. J., Sword, G. A., Lorch, P. D., Couzin, I. D. Cannibal crickets on a forced march for protein and salt. Proceedings of the National Academy of Sciences of the United States of America. 103 (11), 4152-4156 (2006).
- Lihoreau, M., Buhl, J., Sword, G. A., Raubenheimer, D., Simpson, S. J. Nutritional ecology beyond the individual: a conceptual framework for integrating nutrition and social interactions. Ecology Letters. 18 (3), 273-286 (2015).
- Deans, C. A., Behmer, S. T., Tessnow, A., Tamez-Guerra, P., Pusztai-Carey, M., Sword, G. A. Nutrition affects insect susceptibility to Bt. Scientific Reports. 7, 39705(2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon