Method Article
Che caratterizzano i processi di riparazione del DNA alle rotture del DNA transitori e duraturo doppio filo da microscopia di immunofluorescenza
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Riparazione di rotture a doppio filamento del DNA è un processo dinamico, che richiede non solo la formazione di complessi di riparazione presso le pause, ma anche la loro risoluzione dopo che la lesione è indirizzata. Qui, usiamo il microscopia di immunofluorescenza per interruzioni di double-stranded transitorie e di lunga durata come strumento per sezionare questo meccanismo di mantenimento del genoma.
Abstract
La riparazione delle rotture a doppio filamento (DSBs) nel DNA è un processo altamente coordinato, rendendo necessaria la formazione e la risoluzione di complessi di riparazione della multi-proteina. Questo processo è regolato da una miriade di proteine che promuovono l'associazione e dissociazione delle proteine a queste lesioni. Grazie in gran parte alla capacità di eseguire schermi funzionali di una vasta libreria di proteine, c'è un maggiore apprezzamento dei geni necessari per la riparazione di rottura del DNA double-strand. Schermi di inibitore spesso knockout o chimici identificano proteine coinvolte nei processi di riparazione utilizzando tossicità aumentata come indicatore per una proteina che è necessaria per la riparazione DSB. Sebbene sia utile per identificazione romanzo proteine cellulari coinvolte nel mantenimento della fedeltà del genoma, analisi funzionale richiede la determinazione di se la proteina di interesse promuove la localizzazione, la formazione o la risoluzione di complessi di riparazione.
L'accumulo di proteine di riparazione può essere facilmente individuata come distinti foci nucleari da microscopia di immunofluorescenza. Così, associazione e dissociazione di queste proteine nei siti di danno del DNA può essere letta osservando questi fuochi nucleari intervalli rappresentativi dopo l'induzione di rotture a doppio filamento del DNA. Questo approccio può anche identificare proteine del fattore di riparazione mis-localizzata, se difetti di riparazione non si verificano simultaneamente con incompleti ritardi nella riparazione. In questo scenario, lunga durata rotture a doppio filamento del DNA possono essere progettate esprimendo un'endonucleasi di taglio raro (ad es., SceI) in cellule dove il sito di riconoscimento per l'enzima suddetto è stato integrato nel genoma della cellula. La lesione risultante è particolarmente difficile da risolvere come fedele riparazione reintrodurrà il sito di riconoscimento dell'enzima, che richiede un altro giro di clivaggio. Di conseguenza, vengono eliminate le differenze nella cinetica della riparazione. Se non si formano complessi di riparazione, localizzazione è stato ostacolato. Questo protocollo descrive la metodologia necessaria per identificare le modifiche nella cinetica di riparazione, nonché la localizzazione della proteina di riparazione.
Introduzione
Ogni giorno, ogni cellula nel corpo umano è bombardato con un 10.000 stimato DNA lesioni1. Questa minaccia esistenziale ci mette a rischio di mutazioni, oncogenesi, nonché delle cellule morte. Per proteggere la fedeltà del genoma, le cellule di mammiferi si sono evolute per rispondere a danno del DNA con una complessa serie di associazioni di proteina e modifiche. Questa risposta è organizzata in più percorsi, conosciuti collettivamente come il DNA danni risposta (DDR)2,3. Il DDR è costituito dall'accumulo di proteine di riparazione del DNA alle lesioni del DNA, coordinate sia temporalmente e spazialmente. DDR frequentemente induce arresto del ciclo cellulare per evitare la propagazione o l'intensificazione dei danni che possono verificarsi durante la replica di danneggiato DNA2,4,5. A sua volta, è anche necessario per la vitalità cellulare si disattiva arresto del ciclo cellulare tramite la dissociazione complessi di riparazione dopo la riparazione è stata completata.
Tra le varie tipologie di danno del DNA, DSBs sono più deleteri. Omissione di riparare DSBs può provocare di riarrangiamenti cromosomici o eliminazioni su larga scala come la perdita di braccia di intero cromosoma. La riparazione di DSBs è diviso in due percorsi6,7,8. Ricombinazione omologa (HR) richiede una sorella cromosoma da utilizzare come un modello di DNA e quindi è limitato a fine fasi S e G2/M del ciclo cellulare9,10. Non-omologa fine unirsi (NHEJ) non hanno queste limitazioni ma può causare piccole omissioni quando riparare DSBs11,12.
DSB riparazione specificamente e il DDR in generale sono aree attive di indagine. Pur essendo organizzati in vie convenientemente separate, c'è una grande quantità di ridondanza. Infatti, molte proteine (BRCA1, BRCA2 e il RPA complessa per esempio) sono coinvolti in molteplici vie13,14,15,16. La riparazione di una lesione di una via, può portare a danni intermedio che devono essere riparato da un altro percorso14. L'intreccio di queste vie, combinate con il loro complesso compito di reclutare le proteine giuste al posto giusto per la precisa quantità di tempo necessario, richiede un processo di regolamentazione multilivello.
Un recente rapporto mette in evidenza la complessità della DDR dimostrando che formazione di complessi di riparazione, la risoluzione e la localizzazione può ciascuno separatamente essere alterata17. L'obiettivo generale del seguente protocollo è definitivamente dissezionare la capacità delle cellule di riparare DSB. Usando la microscopia di immunofluorescenza, accumulo di proteine di riparazione presso i siti di danno possa essere visualizzato nei punti di tempo rappresentativo dopo l'induzione di DSBs.
Questa tecnica ha diversi vantaggi per gli approcci comunemente utilizzati. Riparazione è spesso studiati intervalli di tempo singolo e incapace di rappresentare il processo dinamico dell'Assemblea e la dissociazione dei complessi di riparazione. Osservando l'intera gamma di riparazione dall'attivazione iniziale a piena risoluzione assicura che un ritardo nella riparazione non è erroneamente identificato come l'inibizione completa. Al contrario, assicura che l'induzione di una risposta di riparazione che è in grado di inattivare tale riscontro non è erroneamente identificato come il normale o l'eccessiva attivazione.
Formazione dei complessi della proteina in ritardo e la mis-localizzazione delle proteine di riparazione, tuttavia, può non essere inequivocabilmente distinto con questo approccio. Per determinare se proteine di riparazione sono mis-localizzate contro il ritardo nella loro localizzazione, una "lunga durata" DSB può essere introdotto attraverso scissione enzimatica del DNA cellulare. La lesione risultante è ripassare ogni volta che si è riparato, risultante in un focus distinti grande riparazione nucleare ed eliminando la limitazione temporale dal reclutamento. Ciò può essere ottenuto modificando l'approccio esistente con l'uso di un'endonucleasi di taglio raro (ad es., SceI) per indurre un DSB di lunga durata. La longevità di DSBs consente la visualizzazione delle proteine di riparazione sfuggente da microscopia di immunofluorescenza. L'abbondanza di avanzata potrebbe anche migliorare la visualizzazione quando il rilevamento è ostacolato dalla limitazione della qualità di anticorpo, una caratteristica che potrebbe essere utile quando meno proteine studiate sono identificate come aventi un impatto sulla riparazione del DNA.
In particolare, forniamo istruzioni esplicite per un immagini elaborazione ed analisi software (ad es., ImageJ). Consente di rimuovere un ostacolo finanziario analisi dell'immagine, aprendo l'interrogatorio di riparazione di danni del DNA ad un pubblico più ampio.
Protocollo
Siete pregati di notare che questo protocollo è stato scritto per U2OS celle contenenti un sito di riconoscimento-SceI18. Le celle non devono essere U2OS ma devono contenere il sito SceI. Il protocollo potrebbe essere necessario essere regolato (ad es., numero di cellule seminate e tempi di incubazione) a seconda del tipo di celle utilizzate.
1. definire la cinetica di formazione di complessi di riparazione DSB
- Crescere le cellule U20S-DRGFP su una piastra di coltura del tessuto 10 cm fino a 85 – 90% confluenti.
- Rimuovere il supporto e incubare a temperatura ambiente (TA) in 3 mL di EDTA per 2 min.
- Sostituire EDTA con 1 mL di tripsina e incubare a 37 ° C per 5 min, assicurarsi che le cellule si staccano dalla superficie della piastra di visualizzazione al microscopio. Neutralizzare la tripsina con 5 mL di Dulbecco per volta Eagle Medium (DMEM) completati con 10% siero bovino fetale (FBS) e 1% di penicillina/streptomicina.
- Determinare la concentrazione di cellule in sospensione utilizzando un emocitometro e il metodo di esclusione del blu di trypan.
- Seme 6 x 103 cellule/pozzetto in 200 µ l di una piastra a 96 pozzetti con fondo di vetro. In alternativa, seme 4 x 106 cellule in 8 mL sulle lamelle 12 mm posizionato in un piatto di 10 cm.
Nota: Ogni bene o vetrino coprioggetti rappresentano un unico punto di tempo, compreso il controllo. - Crescere le cellule durante la notte a 37 ° C e 5% CO2.
- Indurre DSBs
- Sostituire il supporto del piatto cm piastra 96 pozzetti/10 con H2O2 diluito ad una concentrazione di 25 µM con DMEM + 10% FBS e incubare a 37 ° C per 1 h.
- Lavare le cellule 3x con 1x PBS e Sostituisci con DMEM fresco completati con 10% FBS e 1% di penicillina/streptomicina. Incubare le cellule a 37 ° C per 0, 1, 4, 8, 24 e 48 h. assicura che fresche diluizioni di H2O2 sono usate per ogni esperimento.
Nota: Per evitare di uccidere le cellule alla concentrazione H2O2 usato qui, assicurarsi che la dose di danni sia bassa abbastanza in modo tale che la maggior parte delle cellule permetterà di evitare l'apoptosi e senescenza. È fondamentale osservare il processo di recupero. Ciò si ottiene misurando la sensibilità ad una gamma di dosi. Eseguire un'analisi di MTT o altre analisi di attuabilità delle cellule per determinare la minima concentrazione di perossido di idrogeno che può essere utilizzato.
- Fissaggio e permeabilizing cellule
- Lavare le cellule 3 volte con PBS 1X. Rimuovere un vetrino coprioggetti dalla piastra di 10 cm per ogni punto del tempo e posizionarlo in un singolo pozzo di una piastra a 24 pozzetti per il fissaggio. Utilizzare l'ago e pinzette per rimuovere delicatamente il vetrino coprioggetti ed evitando di graffiare le cellule fuori dalla superficie del vetrino coprioggetti.
- Fissare le cellule mediante incubazione per 15 min con paraformaldeide al 4% (PFA) a volte dopo 1 h di esposizione di H2O2 e la sostituzione di DMEM fresco (0, 1, 4, 8, 24 e 48 h) designato.
- Lavare i vetrini coprioggetti fissi 3 volte con PBS. Permeabilize le cellule con un detergente non ionico diluito in 1X PBS 0,5%. Incubare per 15 min a RT, prima di lavare 3 volte con PBS.
Nota: Dopo il permeabilization, deposito di lamelle è possibile in PBS a 4 ° C per almeno una settimana.
- Visualizzazione complessa riparazione
- Bloccare il piastra 96 pozzetti/coprioggetti in una soluzione di 3% albumina di siero bovino (BSA) e detergenti non ionici 0.1%, diluito in PBS 1X (soluzione al 3% BSA) per 1 h a TA.
- Incubare con gli anticorpi primari che la proteina di riparazione di interesse, diluito secondo le indicazioni del produttore in soluzione al 3% BSA per 1h a RT, prima di lavare 3 volte con PBS 1X di destinazione.
- Incubare il piastra 96 pozzetti/coprioggetti con anticorpo secondario diluito secondo il protocollo del produttore in soluzione al 3% BSA. Confermare che i fluorophores secondario non dispone di eccitazione sovrapposti o spettri di emissione.
- Dopo aver lavato le cellule con PBS 3 volte aggiungere DAPI, diluito secondo le indicazioni del produttore in 1X PBS e incubare a temperatura ambiente per 5 min.
- Montare i vetrini coprioggetti sui vetrini con una goccia di agente di montaggio, assicurandosi che le facce di lato della cella verso il basso. Premere con attenzione i coprioggetti e godersi qualsiasi agente di montaggio in eccesso con un panno.
- Sigillare i coprioggetti con asciugatura rapida smalto trasparente e garantire una buona tenuta del coprivetrino con lo scivolo.
- Prendere le immagini al microscopio confocale concentrandosi sul canale DAPI, prima di altri canali (con segnali da gene di riparazione del DNA di interesse) per evitare di introdurre bias l'esperimento.
- In alternativa, le immagini possono essere acquisite prendendo Z-sezioni dell'area desiderata e condensando l'immagine in un unico piano per visualizzare tutti i fuochi rilevabili.
Nota: Se la risoluzione DSB o proteina di interesse non è osservata in momenti scelti, determinare quando DSBs risolvere selezionando una vasta gamma di punti di tempo inizialmente (0 – 48 h dopo induzione di DSB). I punti di tempo di interesse variano dal metodo di induzione del DSB e la riparazione della proteina di interesse.
- Utilizzare software libero ImageJ per definire i nuclei nelle immagini di microscopia di immunofluorescenza.
Nota: Per aprire immagini al microscopio, il Bio-Formats plugin deve essere installato in ImageJ.- Aprire le immagini confocale (.czi o. TIF) trascinando il file di immagine nella finestra di ImageJ, oppure selezionando "Bio-Formats importatore" dalla barra "Plugin" in ImageJ.
Nota: Apparirà la finestra "Opzione di importazione di Bio-Formats". - Selezionare "Canali Split" per dividere l'immagine in DAPI costitutiva e immagini fluorescenti all'interno della finestra "Opzione di importazione di Bio-Formats".
- Selezionare "Colorized" in "Opzioni di colore" dal menu a discesa. Selezionare "OK" per aprire il DAPI e istone H2AX (H2AX) immagini come finestre separate e scegliere l'immagine DAPI.
- Selezionare l'opzione di "Regolare la soglia" per selezionare i nuclei e la barra degli strumenti "Immagine".
Nota: Verrà visualizzata una finestra di "Soglia". - Regolare la soglia di immagine facendo scorrere la barra inferiore della finestra di "Soglia" completamente a destra. Regolare la barra superiore fino a quando i nuclei appaiono completamente rossi con contorni distinti e il nero di sfondo. NON selezionare Applica. Chiudere la finestra di "Regolare la soglia".
- Selezionare l'opzione di "Analizzare particelle" e "Analizza" barra degli strumenti. Visualizzata una finestra di "Analizzare particelle" che appaiono sullo schermo.
- La dimensione minima di un nucleo di input.
Nota: Particelle sotto la dimensione immessi non verranno conteggiate come nuclei. - Dal menu a discesa "Mostra", selezionare "Contorni". Selezionare l'opzione "Aggiungi a Manager". Fare clic su "OK" per aprire una finestra di "Gestione di ROI".
Nota: I contorni dei nuclei verranno visualizzato in una finestra separata. - Assegnare i numeri ai nuclei che possono essere selezionati dalla finestra "ROI Manager".
- Aprire le immagini confocale (.czi o. TIF) trascinando il file di immagine nella finestra di ImageJ, oppure selezionando "Bio-Formats importatore" dalla barra "Plugin" in ImageJ.
- Utilizzare ImageJ per quantificare i fuochi H2AX in immagini di microscopia di immunofluorescenza.
- Selezionare la finestra di fuochi "H2AX" (macchiata con l'anticorpo secondario coniugato fluorescente). Quindi, selezionare la barra degli strumenti di "Processo" e scegliere "Trova Maxima" per trovare i fuochi all'interno dei nuclei.
Nota: Si aprirà una finestra di "Trovare Maxima". - Scegliere l'opzione "Singolo punti" dal menu a discesa "Tipo di Output" e selezionare "Selezione punto anteprima" per visualizzare i maxima/fuochi. Immettere un valore di "Tolleranza di rumore" a seconda dell'intensità di fluorescenza dell'immagine (Figura 1). Controllare l'aspetto di una finestra bianca con piccoli punti neri.
Nota: Questi punti rappresentano la H2AX foci/maxima che sono stata rilevata. Il valore di tolleranza di rumore deve essere mantenuto costante per tutte le immagini sono analizzate. Una tolleranza bassa/alta rumore si raffigurano troppo molte/poche maxima (fuochi) all'interno del nucleo e non sarà una rappresentazione accurata dei fuochi all'interno del nucleo. - Selezionare i nuclei per i quali i fuochi H2AX devono essere quantificati dalla finestra "ROI Manager". Selezionare tutti i nuclei selezionando l'opzione "Mostra tutti".
- Selezionare "Misura" per misurare il numero di maxima/fuochi all'interno dei nuclei selezionati.
Nota: Il numero di maxima/fuochi appaiono come multipli di 255, cioè, uno massimo ha una lettura di "RawIntDen" (densità integrata) di 255. - Copiare i valori di "RawIntDen" e incollarli in software per l'analisi dei dati.
- Selezionare la finestra di fuochi "H2AX" (macchiata con l'anticorpo secondario coniugato fluorescente). Quindi, selezionare la barra degli strumenti di "Processo" e scegliere "Trova Maxima" per trovare i fuochi all'interno dei nuclei.
2. analisi di localizzazione per una rottura del DNA Double-strand di lunga durata
- Cellule di seme sulle 96 pozzetti piastre/lamelle come descritto nelle sezioni 1.1 e 1.2.
-
Induzione di rotture del DNA a doppio filamento
- Transfect cellule con il vettore di espressione-SceI utilizzando un reagente di transfezione basata sui lipidi secondo le specifiche del produttore. Attendere 24-72 h dopo la trasfezione per massimizzare l'espressione dell'endonucleasi. Determinare se la transfezione è stata completata individuando le cellule con un focus di singolare grande nucleare γ-H2AX.
-
Acquisizione di immagini
- Difficoltà, permeabilize, bloccare e lavare il piastra 96 pozzetti/coprioggetti, come descritto nella sezione 1.8.
- Co-Incubare le cellule con un anticorpo contro γ-H2AX e la riparazione della proteina di interesse (qui, un anticorpo primario contro RAD51 è stato usato) diluiti secondo le specifiche del produttore in soluzione al 3% BSA.
- Lavare il piastra 96 pozzetti/coprioggetti 3 volte con PBS 1X. Incubare il piastra 96 pozzetti/coprioggetti con anticorpo secondario diluito secondo il protocollo del produttore in soluzione al 3% BSA. Confermare che i fluorophores secondario non dispone di eccitazione sovrapposti o spettri di emissione.
- Identificare le cellule che hanno un fuoco grande nucleare γ-H2AX. Solo scattare foto di queste cellule per evitare distorsioni.
-
Analisi di lunga durata SceI fuochi indotti
- Analizzare i fuochi di lunga durata manualmente, contando il numero di cellule che hanno la grande γ-H2AX foci e co-localizzati i fuochi della riparazione proteina di interesse.
Risultati
Figura 1 illustra la selezione della discriminazione rumore corretto per la quantificazione di maxima/fuochi usando ImageJ. Le immagini unite di DAPI e la proteina di riparazione di interesse sono sul pannello di sinistra. Figura 1A Mostra una discriminazione di rumore di 90 e segna il numero corretto dei fuochi. I nuclei sul bordo (raffigurato con una freccia rosa) e i fuochi di fuori dei nuclei (raffigurati con una freccia gialla) non vengono conteggiati durante la quantificazione. Figura 1B raffigura una tolleranza di rumore basso di 50. Numerose maxima è identificati di fuori del nucleo e all'interno del nucleo. Figura 1 Mostra una tolleranza alta rumore di 220. È stato rilevato solo un singolo fuoco (una freccia bianca). Per offrire al lettore un senso di "positivo" e "negativo" risultati, abbiamo compilato anche risultati rappresentativi nella Figura 2. In particolare, Figura 2A raffigura co-localizzazione tra un focus di γ-H2AX (verde) e una proteina di riparazione di interesse (rosso). Allo stesso modo, una cella untransfected è mostrata in alto a sinistra di questo pannello e una cella con un focus non nucleari (falso) γ-H2AX viene visualizzata in alto a destra. Per favore nota i micronuclei associano con macchinari di danni del DNA sono una fonte probabile di questi fuochi non nucleari19. Figura 2B fornisce un ingrandimento superiore delle due celle più a destra da Figura 2A per fornire chiarezza in quanto erano decisi a essere interni ed esterni al nucleo, rispettivamente. In Figura 2è riportato un esempio di una messa a fuoco nucleare γ-H2AX senza co-localizzazione di una proteina di riparazione. Un disegno schematico del presente protocollo è fornito in Figura 3 , che riassume questo approccio per la caratterizzazione di riparazione del DNA.

Figura 1 : Analisi rappresentativa della cinetica di riparazione di doppio filamento del DNA pausa. Immagini rappresentative di quantificazione di fuochi di γ-H2AX utilizzando software ImageJ (con plugin Bio-Formats). I pannelli a sinistra sono immagini composite di nuclei (ingrandimento 40x), tinto blu per DAPI e verde per γ-H2AX. Centro pannelli mostrano riferimento nuclei ONU-analizzati con γ-H2AX foci/maxima. (A) il pannello di destra mostra rilevamento maxima/fuochi con una tolleranza di rumore di 90 e rappresentativo della reale stima del numero dei fuochi all'interno del nucleo. (B) il diritto pannello mostra quantificazione maxima con una tolleranza di basso rumore (50). Maxima/fuochi possono essere rilevati di fuori del nucleo (freccia gialla), mentre la maggioranza dei massimi si trova all'interno del nucleo sono segnali aspecifici sfondo. (C) il diritto pannello mostra quantificazione maxima con tolleranza di rumore elevato (220). Solo un singolo massimo/fuoco (freccia bianca) viene rilevato all'interno del nucleo e non è rappresentativo dei fuochi all'interno del nucleo. Clicca qui per visualizzare una versione più grande di questa figura.
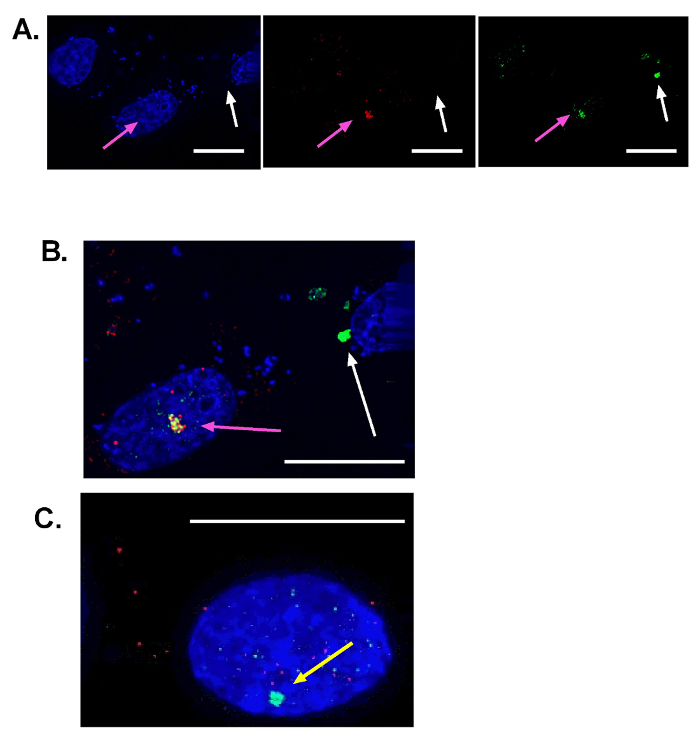
Figura 2 : Rappresentante SceI indotto da rotture del DNA a doppio filamento. Immagini rappresentative dei nuclei da cellule cresciute su vetrini coprioggetti (ingrandimento 40x). Nuclei sono colorati in blu. Una proteina di riparazione (RAD51) è macchiata di rosso e γ-H2AX è macchiato di verde. (A), i tre pannelli Visualizza le stesse tre celle. A sinistra la maggior parte pannello, nuclei sono visibili. Nel pannello centrale, macchiatura per RAD51 è mostrata. Sul pannello di destra, γ-H2AX macchiatura è indicata. Il nucleo in alto a destra non mostra che alcun segno di SceI indotto DSBs. Il nucleo nel centro (freccia rosa) rappresenta un vero evento positivo come ha sia un grande γ-H2AX nucleare focus e focus nucleare RAD51 co-localizzato. Il nucleo sul lato destro ha un focus di falsa grande γ-H2AX come è extranucleare. I fuochi di fuori del nucleo non devono essere utilizzati per l'analisi di co-localizzazione. (B) si tratta di un maggiore ingrandimento dell'immagine unita nella parte A (centro e destra la maggior parte delle cellule). Il grande focus nucleare giallo che indica la sovrapposizione del segnale RAD51 e H2AX è indicato con la freccia rosa. (C), A immagine rappresentativa di un fuoco nucleare γ-H2AX senza co-macchiatura della proteina di riparazione del DNA di interesse. A differenza del fuoco indicato con una freccia bianca in (A) e (B), la freccia gialla illustra i risultati tipici quando proteine di riparazione sono impediti di localizzazione di siti di danno. Barra della scala = 15 µm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3 : Rappresentazione visiva del protocollo per l'analisi di riparazione di rottura del DNA double-strand. Piastre di fondo (1), rappresentazione del protocollo passaggi 1.1 per la semina di cellule su vetrini coprioggetti/vetro. (2) illustrazione dell'induzione del doppio-filo si rompe dal trattamento con perossido di idrogeno (a destra) o indurre rotture a doppio filamento lungo-durevole di transfezione 3 µ g di SceI. (3) rappresentazione dei passaggi del protocollo 1.4 a 1.5.3 per la visualizzazione di rotture a doppio filamento. (4a) immagine con microscopia confocale della cella colorato con DAPI (blu) e γ-H2AX foci (verde). i nuclei (4b), immagine di singolare grande γ-H2AX foci (verde) nuovo macchiano DAPI (blu). (5a) rappresentazione dell'analisi di γ-H2AX foci usando ImageJ (protocollo passi 1.10.1–1.11.5). (5b) rappresentazione del conteggio manuale di grande lunga durata γ-H2AX foci (punto 2.4 del protocollo). Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
L'analisi del DNA danni riparazione in generale e la riparazione delle rotture del DNA double-stranded in particolare è un'area attiva di ricerca, poiché le sue conseguenze estendono su tumorigenesi a biologia di base6,20. Questo dettagli di manoscritto un approccio che analizza con precisione il contributo delle proteine RAD51 e γ-H2AX alla risoluzione di DSBs attraverso HR. guardando al futuro, questo metodo può essere usato per delucidare ulteriori funzioni delle proteine di riparazione DSBs14. Il confronto della cinetica di riparazione e il reclutamento di riparazione macchine per DSBs SceI indotta fra le cellule di controllo e le cellule con la proteina di interesse buttato giù, sarebbe definire il contributo di quella proteina al reclutamento, localizzazione, e risoluzione dei fattori di riparazione di DSBs.
Visualizzazione di riparazione cinetica presenta parecchi vantaggi sopra gli approcci comunemente utilizzati. Frequentemente, riparazione è studiato in intervalli di tempo unico, che è incapace di rappresentare il processo dinamico dell'Assemblea e la dissociazione dei complessi di riparazione. Osservando l'intera gamma di riparazione da attivazione iniziale a piena risoluzione assicura che un ritardo nella riparazione non è erroneamente identificato come l'inibizione completa. Al contrario, assicura che l'induzione di una risposta di riparazione senza la capacità di inattivare che risposta non è erroneamente identificato come normale o eccessiva attivazione. Questi sono in gran parte i cambiamenti nell'applicazione di un approccio stabilito, ma l'uso di un'endonucleasi di taglio raro per indurre un DSB di lunga durata è un nuovo strumento. Esso consente al ricercatore di determinare in modo inequivocabile se la localizzazione di una proteina di riparazione è inibita invece suo reclutamento in ritardo un breve periodo di tempo oltre la conclusione dell'esperimento. SceI indotta può DSB durano giorni e teoricamente fintanto che l'enzima è espresso (dovrebbe la cella rimangono vitale). La cinetica di riparazione DSB può essere osservata anche tramite immagini di cellule vive. Tuttavia, anche se live cell imaging permette di rilevazione degli eventi di riparazione in tempo reale, la sua applicazione è ostacolato dal requisito che proteine essere marcati con un fluoroforo come GFP. Tale manipolazione genetica ha il potenziale di alterare la funzione delle proteine e rappresenta un ulteriore ostacolo tecnico.
Analisi dell'immagine tramite software ImageJ possono essere ingombrante da padroneggiare. Le istruzioni dettagliate per la riparazione focus riconoscimento e quantificazione utilizzando questo software sono fornita nella speranza di rimuovere questo ostacolo per altri gruppi. Ciò potrebbe condurre ad utilizzazione aumentata del software potente ed eliminare il costo dei programmi più costosi in un momento di contrazione piscine di sovvenzioni federali.
In linea di principio, la durata di questi DSBs dovrebbe consentire la visualizzazione delle proteine di riparazione sfuggente da microscopia di immunofluorescenza. Questo potrebbe essere il caso per le proteine che sono difficili da Mostra perché non si accumulano in un alto abbastanza concentrazione per essere rilevato, ad esempio, la persistenza dei risultati DSB SceI indotta in un maggiore rispetto tipico accumulo di proteine di riparazione presso la lesione. L'abbondanza di avanzata potrebbe anche migliorare la visualizzazione quando il rilevamento è ostacolato da una limitazione in termini di qualità dell'anticorpo; una caratteristica che potrebbe essere particolarmente utile quando meno proteine studiate sono identificate come aventi un impatto sul DNA di riparazione. Ad oggi, questo approccio è stato verificato per 4 proteine, vale a dire RAD51, RPA70, BRCA1 e BRCA2 di riparazione del DNA (dati non mostrati, Figura 2e riferimento17)
Infine, ci sono modifiche che potrebbero essere fatto a questo protocollo per espandere i tipi di danno del DNA che può essere interrogato come pure gli ambienti cellulari. La modifica più evidente sarebbe cambiare la fonte o il tipo di danno indotto del DNA. La prova di principio per l'utilizzo di UVB, radiazioni ionizzanti o radiomimetics (phleomycin, bleomicina ed etoposide) per studiare la cinetica della riparazione del DNA è già stato pubblicato18,19,23,24 , 25. con piccole modifiche, questo approccio può delucidare anche risposta di proteina di riparazione di NHEJ a DSBs. in alternativa, Britton et al. descrivere una tecnica di pre-estrazione che potrebbe essere usato26. Ulteriormente, ci sono homing intaccare endonucleasi (-HmuI o BasI) che dispongono di siti di ampio riconoscimento, simili a-SceI27. Questi enzimi, che li distingue da SceI, causano rotture del singolo filo del DNA (SSB). Introduzione al sito di riconoscimento per questi enzimi in una linea cellulare consentirebbe l'analisi di riparazione SSB che affianca il protocollo descritto in questo manoscritto per interrogare duraturo DSBs. in particolare, il processo di integrazione il riconoscimento SceI sito e verificando l'introduzione del sito può essere laboriosi. Gli avanzamenti nella tecnologia (ad esempio sistemi di frutta e verdura/Cas9) di modifica del genoma hanno attenuato questo onere28. C'è anche un campo di ricerca attivo che è riuscito a ingegneria homing endonucleases per tagliare una desiderata posizione genomica, che suggerisce che in futuro, questi progressi tecnologici e l'uso di CRISPR/Cas9 può portare questo passaggio clonazione di essere dispensabile28,29.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Grazie a Joel Sanneman e Dr. Philine Wangemann del nucleo di microscopia confocale, finanziato da la Kansas State University College di medicina veterinaria, per il loro sostegno degli sforzi per sviluppare questa tecnica. pCBASceI era un regalo di Maria Jasin (Addgene plasmide # 26477) 30. Le cellule U2OS DR-GFP erano un regalo gentile da Maria Jasin18.
Materiali
| Name | Company | Catalog Number | Comments |
| 12mm Coverslips | VWR | 89015-725 | |
| 16% Paraformaldehyde (PFA) | ThermoFisher Scientific | 28908 | |
| 24-well plate | VWR | 82050-892 | |
| 96-well glass bottom plate | Cellvis | P96-1.5H-N | |
| Anti-H2AX Alexa488 | EMD Millipore | 05-636-AF488 | |
| Anti-Rad51 (D4B10) | Cell Signaling Technology | 8875S | |
| Bio-formats plugin for ImageJ | National Institute of Health (NIH) | https://imagej.nih.gov/ij/plugins/index.html | |
| Bovine Serum Albumin (BSA) | VWR | 97061-416 | |
| DAPI | ThermoFisher Scientific | D1306 | |
| DMEM, High Glucose | ThermoFisher Scientific | 12100046 | |
| EDTA | Invitrogen | 15576-028 | |
| Fetal Bovine Serum (FBS) | VWR | 89510-194 | |
| Goat Anti-Rabbit IgG Alexa594 | ThermoFisher Scientific | A-11012 | |
| Hydrogen Peroxide | sigma-Aldrich | 216763-100ML | |
| ImageJ Software | National Institute of Health (NIH) | https://imagej.nih.gov/ij/ | |
| I-SceI Expression Vector | Addgene | 26477 | |
| Nail Polish- Insta Dri | Sally and Hansen | Clearly Quick (103) | |
| Phosphate Buffered Saline (PBS) | Bio Basic | PD8117 | |
| ProLong Gold Antifade Reagent | Life Technologies | P36930 | |
| Triton X-100 | Sigma-Aldrich | X100-100ML | |
| Trypsin-EDTA | Sigma-Aldrich | T4049-500ML | |
| TurboFect Transfection Reagent | ThermoFisher Scientific | R0531 | |
| Tween-20 | Fisher Scientific | BP337-500 |
Riferimenti
- Lindahl, T. Instability and decay of the primary structure of DNA. Nature. 362 (6422), 709-715 (1993).
- Branzei, D., Foiani, M. Regulation of DNA repair throughout the cell cycle. Nat Rev Mol Cell Biol. 9 (4), 297-308 (2008).
- Ciccia, A., Elledge, S. J. The DNA damage response: making it safe to play with knives. Mol Cell. 40 (2), 179-204 (2010).
- Auclair, Y., Rouget, R., Drobetsky, E. A. ATR kinase as master regulator of nucleotide excision repair during S phase of the cell cycle. Cell Cycle. 8 (12), 1865-1871 (2009).
- Awasthi, P., Foiani, M., Kumar, A. ATM and ATR signaling at a glance. J Cell Sci. 128 (23), 4255-4262 (2015).
- Ceccaldi, R., Rondinelli, B., D'Andrea, A. D. Repair Pathway Choices and Consequences at the Double-Strand Break. Trends Cell Biol. 26 (1), 52-64 (2016).
- Chapman, J. R., Taylor, M. R. G., Boulton, S. J. Playing the End Game: DNA Double-Strand Break Repair Pathway Choice. Mol Cell. 47 (4), 497-510 (2012).
- Daley, J. M., Sung, P. 53BP1, BRCA1, and the Choice between Recombination and End Joining at DNA Double-Strand Breaks. Mol Cell Biol. 34 (8), 1380-1388 (2014).
- Hartlerode, A., Odate, S., Shim, I., Brown, J., Scully, R. Cell Cycle-Dependent Induction of Homologous Recombination by a Tightly Regulated I-SceI Fusion Protein. PLOS ONE. 6 (3), e16501 (2011).
- Brandsma, I., Gent, D. C. Pathway choice in DNA double strand break repair: observations of a balancing act. Genome Integr. 3, 9 (2012).
- Davis, A. J., Chen, D. J. DNA double strand break repair via non-homologous end-joining. Transl Cancer Res. 2 (3), 130-143 (2013).
- Reid, D. A., et al. Organization and dynamics of the nonhomologous end-joining machinery during DNA double-strand break repair. Proc Natl Acad Sci. 112 (20), E2575-E2584 (2015).
- Chen, J. J., Silver, D., Cantor, S., Livingston, D. M., Scully, R. BRCA1, BRCA2, and Rad51 Operate in a Common DNA Damage Response Pathway. Cancer Res. 59 (7 Supplement), 1752s-1756s (1999).
- D'Andrea, A. D. BRCA1: A Missing Link in the Fanconi Anemia/BRCA Pathway. Cancer Discov. 3 (4), 376-378 (2013).
- Gudmundsdottir, K., Ashworth, A. The roles of BRCA1 and BRCA2 and associated proteins in the maintenance of genomic stability. Oncogene. 25 (43), 5864-5874 (2006).
- Liu, S., et al. Distinct roles for DNA-PK, ATM and ATR in RPA phosphorylation and checkpoint activation in response to replication stress. Nucleic Acids Res. 40 (21), 10780-10794 (2012).
- Wallace, N. A., Khanal, S., Robinson, K. L., Wendel, S. O., Messer, J. J., Galloway, D. A. High Risk Alpha Papillomavirus Oncogenes Impair the Homologous Recombination Pathway. J Virol. , (2017).
- Pierce, A. J., Johnson, R. D., Thompson, L. H., Jasin, M. XRCC3 promotes homology-directed repair of DNA damage in mammalian cells. Genes Dev. 13 (20), 2633-2638 (1999).
- Luzhna, L., Kathiria, P., Kovalchuk, O. Micronuclei in genotoxicity assessment: from genetics to epigenetics and beyond. Front Genet. 4, (2013).
- Jasin, M. Homologous repair of DNA damage and tumorigenesis: the BRCA connection. Oncogene. 21 (58), 8981-8993 (2002).
- Wallace, N. A., Robinson, K., Howie, H. L., Galloway, D. A. β-HPV 5 and 8 E6 Disrupt Homology Dependent Double Strand Break Repair by Attenuating BRCA1 and BRCA2 Expression and Foci Formation. PLOS Pathog. 11 (3), e1004687 (2015).
- Wallace, N. A., Robinson, K., Howie, H. L., Galloway, D. A. HPV 5 and 8 E6 Abrogate ATR Activity Resulting in Increased Persistence of UVB Induced DNA Damage. PLoS Pathog. 8 (7), (2012).
- Mah, L. J., Vasireddy, R. S., Tang, M. M., Georgiadis, G. T., El-Osta, A., Karagiannis, T. C. Quantification of γH2AX Foci in Response to Ionising Radiation. J Vis Exp. (38), e1957 (2010).
- Popp, H. D., Brendel, S., Hofmann, W. K., Fabarius, A. Immunofluorescence Microscopy of γH2AX and 53BP1 for Analyzing the Formation and Repair of DNA Double-strand Breaks. J Vis Exp. (129), e56617 (2017).
- Burma, S., Chen, B. P., Murphy, M., Kurimasa, A., Chen, D. J. ATM Phosphorylates Histone H2AX in Response to DNA Double-strand Breaks. J Biol Chem. 276 (45), 42462-42467 (2001).
- Britton, S., Coates, J., Jackson, S. P. A new method for high-resolution imaging of Ku foci to decipher mechanisms of DNA double-strand break repair. J Cell Biol. 202 (3), 579-595 (2013).
- Landthaler, M., Shen, B. W., Stoddard, B. L., Shub, D. A. I-BasI and I-HmuI: two phage intron-encoded endonucleases with homologous DNA recognition sequences but distinct DNA specificities. J Mol Biol. 358 (4), 1137-1151 (2006).
- Lackner, D. H., et al. A generic strategy for CRISPR-Cas9-mediated gene tagging. Nat Commun. 6, 10237 (2015).
- Chan, S. H., Stoddard, B. L., Xu, S. Y. Natural and engineered nicking endonucleases--from cleavage mechanism to engineering of strand-specificity. Nucleic Acids Res. 39 (1), 1-18 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon