Method Article
Murino discendente anteriore sinistra (LAD) Coronary legatura dell'arteria: una migliore e semplificata del modello di infarto miocardico
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
We provide a reliable method for left anterior descending artery (LAD) ligation in a mouse model. This method is comparatively less invasive than other methods, involving endotracheal intubation, a left-sided thoracotomy approach, and thoracentesis. This method can be used as a model for both acute and chronic myocardial infarction (MI).
Abstract
cardiopatia ischemica (IHD), o sindrome coronarica acuta (ACS), è una delle principali cause di morte negli Stati Uniti. IHD è caratterizzata da un ridotto apporto di sangue al cuore, con conseguente perdita di ossigeno e la necrosi conseguente del muscolo cardiaco. Il modello MI ha guadagnato popolarità per il suo uso come un modello di ischemia-riperfusione a breve termine e un modello di legatura permanente a lungo termine. Qui di seguito, si descrive un metodo affidabile per la legatura permanente della LAD. Con il mouse tecnologia di ingegneria genetica sempre più avanzati, e con una crescente disponibilità di strumenti chirurgici murini di qualità, il mouse è diventato un modello popolare per interventi chirurgici MI. Il nostro modello chirurgico incorpora l'uso di un anestetico facilmente reversibile per il rapido recupero del mouse; un'intubazione endotracheale minimamente invasivo senza coinvolgere una tracheotomia; ed una toracentesi attraverso il sito toracotomia originale senza creare un'incisione supplementare nel petto, come èfatto in alcuni altri metodi, per rimuovere efficacemente sangue in eccesso e l'aria dalla cavità toracica. Questo metodo è relativamente meno invasivo rispetto ad altri metodi, che riduce drasticamente le complicanze e mortalità chirurgiche e post-chirurgiche e migliora la riproducibilità.
Introduzione
Malattia coronarica, o di ACS, è l'evento cardiovascolare più diffusa e sarà considerato la principale causa di morbilità e mortalità in tutto il mondo nel 2020 1. La causa di ACS è la presenza di una trombosi infarto a causa della rottura di una placca aterosclerotica coronarica che blocca o riduce il flusso di sangue al tessuto cardiaco 2. Pertanto, ci sono segni clinici compatibili con la presenza di ischemia miocardica acuta, come infarto del miocardio (MI) 3, 4. MI porta ad una perdita di massa dei cardiomiociti e una progressione di rimodellamento ventricolare patologica, che può portare alla disfunzione ventricolare e di insufficienza cardiaca 5, 6.
Uno dei modi più efficaci per lo studio IHD è stato quello di imitare l'infarto del miocardio umano in un modello animale. Ciò si ottiene occludendo il LAD intopi. Utilizzando questo modello, studiamo come il cuore può essere protetto dai danni derivanti da IHD.
Negli ultimi dieci anni, i ricercatori hanno spostato da utilizzando modelli animali più grandi per gli animali più piccoli, tra cui il passaggio da ratti ai topi. Il modello di topo più piccola sta cominciando a essere preferito per molte ragioni, tra le loro piccole dimensioni, di grandi dimensioni lettiera, a basso costo per mantenere, e di breve periodo di gestazione, nonché per la disponibilità espansiva di transgenici e knockout gene modelli 7. Anche se i topi sono di piccole dimensioni, nuovi strumenti chirurgici appositamente pensate per loro hanno aiutato in questo sviluppo. Il nostro metodo utilizza questi nuovi strumenti chirurgici.
Mentre diversi metodi implementano una tracheotomia invasivo, usiamo un metodo meno invasivo di intubazione endotracheale. Utilizzando illuminazione zenitale dell'orofaringe, abbiamo intubare senza creare incisioni, fornendo un'esperienza più sicuro e meno traumatico per tegli animali. Il mouse viene poi posto su un ventilatore e continuò a isoflurano durante l'intera procedura. A causa della breve durata dell'anestesia prodotta dalla droga, ci vogliono solo pochi minuti per consentire all'animale di riprendersi dall'anestesia una volta che è interrotto. Il nostro modello chirurgico include anche una toracentesi minimamente invasiva. La facilità di rimozione del sangue e aria in eccesso dalla cavità toracica utilizzando toracentesi attraverso l'incisione toracotomia originale ha inviato una complicanza postoperatoria comune dei legatura LAD: il pneumotorace. Questo metodo, che elimina la necessità per le due incisioni supplementari usati in altri metodi, uno per la tracheotomia e un altro per le toracentesi-ha prodotto un minor numero di complicanze post-chirurgiche e ha drasticamente ridotto la mortalità.
Protocollo
Questo protocollo animale è stato esaminato e approvato dal Comitato Istituzionale cura degli animali ed uso (IACUC) a Rhode Island Hospital.
1. Anestesia e intubazione
- Pesare il mouse per calcolare il dosaggio del farmaco dolore post-operatorio.
- Posizionare il mouse in una camera di induzione e fornire 4% isoflurano per 9-10 min, monitorando l'animale in tutto. Attivare uno sterilizzatore a caldo tallone in modo che il dispositivo può preriscaldare a circa 250 ° C. Il preriscaldamento si 15 - 20 min.
- Una volta che il mouse raggiunge un profondo piano di anestesia, con un tasso di respirazione di circa 32 respiri / min, posizionare il topo supina su un bordo polistirolo e utilizzare un elastico fissato sotto all'inizio incisivi per tenere la bocca aperta. Confermare la sedazione eseguendo un pizzico dito del piede. Posizionare un illuminatore ad alta intensità sopra il mouse in modo che l'orofaringe può essere visualizzato.
- Utilizzare pinze curve per aprire la mascella e un'altra coppiadi pinze per sollevare la linguetta fuori strada. Assicurati di intubare mentre posizionata in corrispondenza o leggermente al di sotto degli occhi a livello con il corpo del mouse. Si raccomanda l'uso di occhialini chirurgici.
- Visualizza l'apertura e la chiusura delle corde vocali. Quando aperto, inserire un calibro 20, 1-a endovenosa (IV) catetere con un ago introduttore smussato-punta. Utilizzare l'ago per guidare il catetere per l'apertura tracheale, ma evitare di inserire l'ago nella trachea. Verifica del corretto posizionamento può essere fatto utilizzando una pipetta di trasferimento di plastica.
- Trasferire il mouse intubato ad una superficie operativo dotato di un dispositivo di riscaldamento. Collegare il mouse per un piccolo ventilatore roditore impostato su un volume di eiezione di 150 microlitri / ictus e una frequenza corsa di 130 colpi / min.
- Consegnare 2,5% isoflurano. Verificare l'intubazione controllando per sollevamento del torace bilaterale. Verificare anestesia eseguendo un pizzico punta. Il mouse può avere bisogno di 5 - 10 minuti sul ventilatore per diventare pienamente anestetizzati.
2. Preparazione del mouse
- Nastro lungo il tubo di intubazione nel sito di collegamento tra il ventilatore e il catetere IV. Tape le estremità. Mettere gocce lubrificanti sterili sugli occhi.
- Tagliare la parte ventrale sinistro del torace con un rasoio elettrico. Rispolverare il pelo rasato con panni asciutti e applicare un piccolo strato di crema depilatoria usando un tampone di cotone sterile. La crema deve rimanere in contatto con i follicoli dei capelli per circa 30 - 45 s.
- Mentre i processi crema, posizionare tre tamponi di cotone sterile in tre provette da 1,5 mL riempito con Betadine ammollo. Utilizzando salviette inumidite con acqua distillata, delicatamente spazzare via la panna e pelliccia.
- Pulire il campo chirurgico tre volte, alternando Betadine e sterili 70% pastiglie isopropanolo preparazione, pulizia in un movimento circolare dal centro alla periferia. Posizionare un telo sterile con un foro quarto imprese sopra il campo operatorio del mouse.
- Pulire la zona circostante il mouse con il 70% di etanolo. Verificare l'anestesia ancora una volta con un pizzico dito del piede.
3. LAD legatura
- Posizionare gli strumenti chirurgici sterilizzati in autoclave a caldo sterilizzatore tallone preriscaldato a 250 ° C per circa 20 s. Posizionare gli strumenti sterilizzati in autoclave sterile telo chirurgico. Munirsi di guanti chirurgici.
- Utilizzare pinze fine-tip per sollevare delicatamente la pelle in un punto a circa 5 mm a sinistra della cartilagine xifoide prominente. Utilizzare un bisturi chirurgico con una lama n ° 10 per creare un'incisione verticale nella pelle da questo punto in alto, al livello del manubrio.
- Utilizzare pinze curve per separare delicatamente gli strati della pelle e dei muscoli. Aprire lo strato muscolare, dopo l'incisione cutanea. Inserire due 5-0 suture in polipropilene attraverso lo strato muscolare, uno su ciascun lato dell'incisione, e fissare i punti di sutura temporaneamente con morsetti per tenere lo strato muscolare aperta.
- Identificare e fare un'incisione nel terzo spazio intercostale, a seguito dellaAngolo naturale della gabbia toracica. Rimuovere il nastro dalle estremità sinistro del mouse e fissare il piede posteriore sinistro al suo piede posteriore destra con del nastro adesivo. Tagliare un pezzo di nastro più lungo e fissare il piede anteriore sinistro alla superficie operativa in una posizione leggermente elevata. Pulire i guanti con il 70% di etanolo.
- Utilizzare un riavvolgitore per diffondere delicatamente a parte i 3 ° e 4 ° costole. Tagliare una piccola sezione di garza sterile, circa 1 x ½, ed immergerlo in soluzione fisiologica 0,9% sterile. Spremere il eccesso salina e utilizzare pinze per inserire delicatamente la garza contro polmone sinistro per evitare danni ai polmoni accidentali durante la procedura.
- Rimuovere delicatamente il pericardio sottile con una pinza.
- Strappare una piccola quantità di cotone fuori un tampone di cotone sterile e rotolare in una piccola sfera. Immergere il batuffolo di cotone sterile in soluzione fisiologica 0,9% e tamponare delicatamente sulla superficie del cuore di apprezzare le arterie. Spingere delicatamente il padiglione auricolare sinistro verso l'alto e individuare le arterie coronarie sottoNeath.
- Identificare il LAD e passare una sutura 8-0 nylon sotto il LAD; completa due tiri per fissare la legatura. Se la legatura è successo, il ventricolo sinistro distale dalla volontà Blanch legatura.
- Utilizzando pinze, rimuovere la garza inseriti in precedenza, e quindi rimuovere delicatamente il divaricatore. Inserire un 6-a, 25-gauge tubo flessibile collegato a un ago calibro 25 nella cavità toracica attraverso l'apertura toracotomia. Anticipo di circa 1 - 2 in di tubo nello spazio sopra il polmone sinistro. Ritorna il mouse in una posizione supina e pulire i guanti con il 70% di etanolo.
- Utilizzare 5-0 suture polipropilene in un semplice schema interrotto per chiudere la cassa toracica, mantenendo il tubo toracico in posizione. Rimuovere i due punti di sutura che tengono lo strato muscolare aperta. Utilizzare 5-0 punti di sutura in polipropilene in un semplice modello continuo di chiudere lo strato muscolare, mantenendo ancora una volta il tubo toracico al suo posto.
- Attaccare una siringa da 1 ml al ago calibro 25 sul tubo toracico. Tirare delicatamente verso l'alto il grande passor contemporaneamente gradualmente estrarre il tubo toracico dalla cavità toracica con una pinza. Estrarre il tubo lentamente, come questo passaggio rimuove l'aria in eccesso e sangue, che altrimenti intrappolata nella cavità toracica e risultato in una pneumotorace.
- Una volta che la siringa è pieno, staccare la siringa dal ago e smaltire i rifiuti in un bicchiere rifiuti o lavandino. Continuare questa procedura finché il tubo toracico è completamente estratto. Assicurarsi che il torace è chiuso.
- Diminuire l'isoflurano al 1,5%. Chiudere la pelle con 4-0 punti di sutura in polipropilene in un semplice schema interrotto. Girare il vaporizzatore isoflurano off.
- Somministrare 0,1 mg di buprenorfina / ml in 0,9% di soluzione salina tramite un'iniezione intraperitoneale (IP). applicare topicamente 2 mg / mL di lidocaina con 2 mg / ml in bupivacaina 0,9% soluzione salina per l'incisione. Somministrare tra i 200 - 500 microlitri di soluzione salina allo 0,9% con un'iniezione sottocutanea, scalando l'importo salina al peso del mouse.
- Attendere 5 minuti dopo administering i farmaci per il dolore per rimuovere il mouse dal tubo di intubazione. Questo aiuta nella transizione dal ventilatore.
- Se il mouse non dispone di un aumento del torace bilaterale volta fuori il ventilatore, eseguire la decompressione ago. Per fare questo, introdurre un ago sterile da 25 gauge e una siringa da 1 ml tra i 3 ° e 4 ° costole fino ad entrare nella cavità toracica, indicato con una diminuzione improvvisa della resistenza. Tirare verso l'alto delicatamente lo stantuffo per eliminare l'aria in eccesso.
- Quando il mouse dimostra un tasso di respirazione bilaterale adeguata e la profondità e risponde ad un pizzico dito del piede, posizionare il mouse in una gabbia di recupero pulito sotto una lampada di calore. Fornire il mouse con alimento umido e una bottiglia di acqua, controllando in una cappa a flusso laminare per 15 - 20 min. Monitor per uno sforzo esagerato respirazione, sanguinamento eccessivo, o altre complicazioni potenzialmente letali.
- Per i prossimi tre giorni, somministrare 0,1 mg / ml di dolore buprenorfina farmaco tramite un IPjection due volte al giorno. Monitorare il mouse quotidiano.
Risultati
I topi sono eutanasia ventotto giorni dopo l'intervento, e il cuore vengono raccolti ed esaminati. I topi vengono anestetizzati con il 50 - 75 mg / kg di ketamina e 5 - 10 mg / kg xilazina. Quando l'animale è sotto anestesia adeguata, la cavità toracica viene aperto, e utilizzando un ago 23-gauge, cloruro di potassio freddo (KCl, 30 mM) viene iniettata nella regione basale posteriore del cuore. Il cuore è arrestato in diastole. Per ulteriore convalida della ligazione, il cuore viene rimosso dall'animale e viene iniettato con 4% paraformaldeide e quindi 1% di colorante blu di Evan. La Figura 1 mostra la mancanza di blu di Evan nel ventricolo sinistro ischemico. La figura 2 illustra una configurazione corretta intubazione endotracheale. Figura 3 mostra il posizionamento del tubo toracico per l'ecografia nelle sito di incisione iniziale, con lo strato muscolare suturato chiuso attorno al tubo prima estrazione dell'aria dal ccavità hest. Colorazione tricromica mostra un aumento del collagene nella regione infartuata (Figura 4).

Figura 1: Iniezione blu di Evan. iniezione blu del Evan rivela una mancanza di colorante nel tessuto ischemico, localizzato nella regione infartuata ventricolo sinistro. Si prega di cliccare qui per vedere una versione più grande di questa figura.

Figura 2: intubazione endotracheale. Dimostrazione di una buona impostazione l'intubazione endotracheale. L'operatore, che indossa lenti di ingrandimento chirurgiche, è seduto a livello degli occhi con il mouse. Un illuminatore ad alta intensità è focalizzato verso il basso sulla regione tracheale, transilluminating l'Oropharynx. Un elastico viene agganciato dietro gli incisivi superiori, consentendo all'operatore di aprire la bocca con le pinze curve. Le pinze curve sono utilizzati per tenere la linguetta a lato per la visualizzazione chiara. Una cannula endovenosa catetere intubazione con un ago introduttore smussato punta viene fatta avanzare con una leggera inclinazione verso l'alto mentre l'apertura e la chiusura delle corde vocali vengono visualizzati. Visualizzazione delle corde vocali di apertura e chiusura prima del tentativo intubazione è uno dei punti critici per un'intubazione di successo. Si prega di cliccare qui per vedere una versione più grande di questa figura.
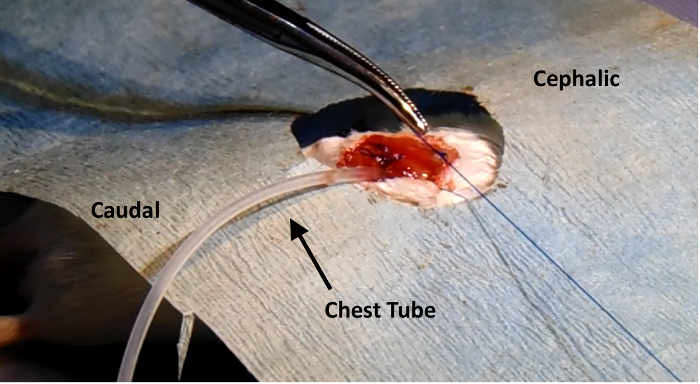
Figura 3: Toracentesi. Il posizionamento del tubo toracico utilizzato per toracentesi, inserito nel sito di incisione originale. Lo strato di muscolo viene suturata chiuso intornoil tubo prima che l'aria all'interno della cavità toracica viene estratto con una siringa, e poi il tubo toracico viene rimosso. Si prega di cliccare qui per vedere una versione più grande di questa figura.
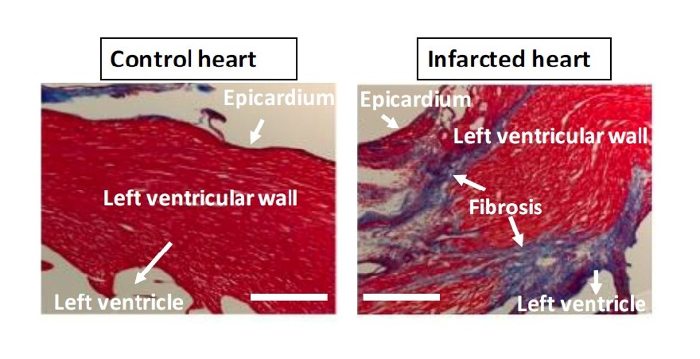
Figura 4: Trichrome colorazione. Pannello di sinistra: il cuore di controllo, non LAD-legatura. Pannello destro: LAD-legatura, il cuore infartuato. Colorazione tricromica (Masson) impiegando soluzione Biebrich scarlatto-fucsina acida, soluzione di acido fosfotungstico / fosfomolibdico e blu anilina rivela aumentato collagene (blu) come marker per la fibrosi nella regione infartuata ventricolo sinistro sezionata. Bar = 500 micron. Si prega di cliccare qui per vedere una versione più grande di questa figura.
Discussione
Con un uso crescente del modello MI nei laboratori, la procedura descritta mira ad aumentare il tasso di efficienza e la sopravvivenza dei topi, riducendo al minimo il loro dolore post-operatorio e disagio. Questo protocollo è ridurre al minimo la mortalità facendo numerosi miglioramenti a vari aspetti della procedura LAD legatura. Ci sono alcune distinzioni. Alcuni studi di intubazione murini che utilizzano ketamina e xilazina con isoflurano per l'induzione, grazie al vantaggio della loro durata dell'anestesia, hanno mostrato un aumento della mortalità 8. Il nostro metodo utilizza solo isoflurano per l'induzione, riducendo di molto il rischio di complicanze legati alla droga. Un altro simile protocollo LAD legatura comprende una tracheotomia, producendo un tempo di recupero prolungato e una maggiore necessità di formazione preciso 9. La procedura che descriviamo qui utilizza un metodo non invasivo di intubazione endotracheale, causando lola mortalità wer e superiori riproducibilità dei risultati. Inoltre, anziché usare solo un rasoio elettrico, il nostro procedimento utilizza anche crema depilatoria per la rimozione pelliccia, fornisce una completamente chiara visualizzazione del campo sterile in meno di 1 minuto.
Un'altra differenza fondamentale è il riposizionamento del mouse, che si verifica dopo, e non prima, le incisioni iniziali. Rendendo le incisioni mentre il mouse è supina consente una visualizzazione più diretta e precisa dei punti di riferimento come la cartilagine xifoide, con conseguente maggiore riproducibilità dei risultati. Il nostro metodo utilizza anche tamponi di cotone sterili piuttosto che un Cauter di sanguinamento gestione, diminuendo ustioni iatrogene e il rischio di infezione. Oltre a queste differenze, l'inserimento del tubo toracico per la toracentesi è particolarmente di nota, come nostro metodo non comporta la creazione di una nuova incisione per il tubo. Piuttosto, si tratta di inserimento del tubo nel un'incisione precedente, di nuovo decrescente mortalità. La procedura descriviamo anche include: (1) l'uso di un divaricatore, consente una visualizzazione più accurata e stabile delle arterie coronarie; (2) l'inserimento di garza sterile nella cavità toracica durante la procedura, riducendo così il rischio di lesioni polmonari iatrogene; e (3) la somministrazione di soluzione fisiologica seguendo la procedura, che ha dimostrato sia abbreviare il tempo di recupero e prevenire l'ipotermia.
Anche se si descrive un modello di legatura permanente, questa procedura può anche essere modificato per un modello di infarto miocardico acuto. Il modello MI acuto, come descritto anche ischemia e riperfusione, si riferisce a 30 - 60 min di ischemia seguita da riperfusione nel tessuto cardiaco 7. Un metodo alternativo di valutare le dimensioni dell'infarto o la zona a rischio dopo ischemia e riperfusione è la colorazione del 2% trifeniltetrazolo cloruro (TTC) 10. TTC colorazione si basa sulla capacità di macchiare tessuto vitale dopo l'insulto ischemicodovuto deidrogenasi presenti nel tessuto cardiaco. Questi enzimi convertono un componente solubile in componente insolubile rosso, delineando così la regione infartuata 11. Il modello di infarto miocardico acuto in grado di simulare i meccanismi che si verificano nella malattia di cuore umano e, quindi, può essere uno strumento utile per chiarire gli eventi di ischemia miocardica 10. Legatura LAD può essere verificato osservando un immediato cambiamento di colore del tessuto, fornendo un vantaggio per questo metodo di indurre un MI. Un altro metodo per verificare la legatura di successo è l'uso di elettrocardiogrammi, anche se ciò comporta l'uso di apparecchiature costose e non può essere fattibile per tutti i laboratori.
Come descritto in precedenza, esistono diverse tecniche molecolari facile e conveniente per confermare la legatura dopo la raccolta cuore. Le due tecniche sopra riportati sono la colorazione blu di Evan e la colorazione tricromica. colorante blu di Evan viene iniettato direttamente l'arco del AORTA, indicando dove v'è una mancanza di flusso sanguigno. Questo è un metodo rapido ed efficiente impiegato subito dopo la raccolta il cuore per verificare se il modello ha avuto successo e per misurare il grado di ostruzione coronarica. Per la colorazione tricromica, il cuore deve essere sezionato e quindi sottoposto a immunoistochimica. Trichrome colorazione può indicare le aree fibrotiche post-ischemica o aree cardiache colpite da ischemia cronica. L'iniezione di post-operatorio topi 2 - 24 h prima del sacrificio con 5-etinil-2'-deossiuridina (EdU), un analogo di timidina, è un metodo efficace per indicare aree della replicazione del DNA e la proliferazione delle cellule dopo ischemia, soprattutto in studi riguardanti la rigenerazione vascolare 12.
In generale, i limiti dello studio LAD legatura comprendono l'incidenza della mortalità post-operatoria, causati principalmente dalla presenza di aritmie cardiache, sanguinamento e pneumotorace. Un toracentesi efficace, ingegnoHout incisioni toraciche aggiuntivi (descritto nel metodo corrente), e cura post-operatoria sono necessarie per evitare la morbilità e mortalità negli animali. Il molto attento monitoraggio di ipotermia post-operatorio è anche critico. La riduzione del numero di incisioni del collo e del torace (per tracheotomia e toracentesi) descritta nel metodo corrente contribuirà a migliorare i tassi di sopravvivenza. A scanso di anestetici pre-operatorie iniettabili qui descritti migliorerà anche il recupero post-operatorio degli animali.
Al fine di ottenere un'alta riproducibilità, il modello LAD legatura richiede una formazione rigorosa e l'esperienza. L'operatore deve effettuare diverse settimane di interventi chirurgici per ottenere la capacità di rendere riproducibile infarti nei siti desiderati sul cuore. La formazione e l'esperienza sono due fattori critici per un intervento chirurgico di sopravvivenza LAD legatura di successo.
Divulgazioni
The authors declare that they have no competing financial interests.
Riconoscimenti
This model was developed with the support of the National Institute of General Medical Sciences (NIGMS)/the National Institute of Health (NIH) grant 1P20GM103652 (Project# 3) (to MRA) and the American Heart Association (AHA) Grant-in-Aid 14GRNT20460291 (to MRA); the Brazilian government grant CAPES (to KR and FR); and a Brown University LINK award (to IM). We also acknowledge the outstanding technical support from our veterinarians and animal facility staff.
Materiali
| Name | Company | Catalog Number | Comments |
| High-Intensity Light Source | Harvard Apparatus | 72-0215 | |
| SurgiSuite Operating Platform | Kent Scientific Corporation | SurgiSuite | Uses a rechargeable, battery-operated far infrared warming pad. Charge overnight before surgery. |
| SurgiSuite LED Lighting Kit | Kent Scientific Corporation | SURGI-5003 | |
| Hot Bead Sterilizer | Fine Science Tools | 18000-45 | Preheating takes 15 - 20 min. Instruments take 20 s to sterilize. |
| Small Rodent Anesthesia System | VetEquip Inc. | 901810 | |
| Isofluorane | Piramal Enterprises | 66794-017-10 | |
| Buprenorphine | Rhode Island Hospital Pharmacy | NDC 12496-0757-1, 12496-0757-5 | |
| Surgical Loupes | Roboz | RS-6687 | |
| Small Rodent Ventilator | Harvard Apparatus | 73-0043 | |
| Lubricating Drops | Thermo Fisher Scientific | 19-898-350 | |
| Electric Razor | Kent Scientific Corporation | CL 9990-1201 | |
| Hair Removal Cream | Nair | ||
| Medical Tape | Thermo Fisher Scientific | 18-999-380 | |
| Betadine | Thermo Fisher Scientific | 19-027136 | |
| 70% Isopropanol Wipes | Thermo Fisher Scientific | 22-363-750 | |
| Surgical Drapes | Braintree | SP-TS | |
| Surgical Gloves | Thermo Fisher Scientific | 18999102D | |
| 5-0 Polypropylene Sutures | Ethicon | 8630G | |
| 8-0 Nylon Sutures | Fine Science Tools | 12051-08 | |
| Platinum-Cured Tubing | Harvard Apparatus | 72-1042 | 0.3 mm inside diameter x 0.6 mm outside diameter |
| 0.9% Saline | Thermo Fisher Scientific | 19-310-207 | |
| 4-0 Polypropylene Sutures | Ethicon | 8631G | |
| 1 CC Syringe with 25-Gauge Needle | Thermo Fisher Scientific | 14-826-100 | |
| Scissors | Kent Scientific Corporation | INSS600225 | |
| Forceps | Kent Scientific Corporation | INS700100 | |
| Cotton Swabs | Thermo Fisher Scientific | 23-400-118 | |
| IV Catheter, 20-Gauge | Thermo Fisher Scientific | NC9892181 | |
| Retractor | Kent Scientific Corporation | INS 750369 | |
| Forceps | Fine Science Tools | 11003-12 | |
| Dissecting Forceps, Straight | Kent Scientific Corporation | INS 700101 | |
| Dissecting Forceps, Curved | Kent Scientific Corporation | INS 700103 | |
| Hemostatic Forceps, Straight | Kent Scientific Corporation | INS 750451 | |
| Hemostatic Forceps, Curved | Kent Scientific Corporation | INS 750452 | |
| Tissue Forceps | Kent Scientific Corporation | INS 700131 | |
| Needle Holder | Kent Scientific Corporation | INS 600109 | |
| Scissors | Kent Scientific Corporation | INS 600225 |
Riferimenti
- Hausenloy, D. J., Yellon, D. M. New directions for protecting the heart against ischaemia-reperfusion injury: targeting the Reperfusion Injury Salvage Kinase (RISK)-pathway. Cardiovasc Res. 61 (3), 448-460 (2004).
- Roffi, M., et al. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J. 37 (3), 267-315 (2015).
- Kumar, A., Cannon, C. P. Acute Coronary Syndromes: Diagnosis and Management, Part I. Mayo Clin Proc. 84 (10), 917-938 (2009).
- Eitan, A., Nikolsky, E. Antithrombotic therapy in patients with acute coronary syndromes: how to make the right choice. Minerva Med. 104 (4), 357-381 (2013).
- Abbate, A., Bussani, R., Amin, M. S., Vetrovec, G. W., Baldi, A. Acute myocardial infarction and heart failure: role of apoptosis. Int J Biochem Cell Biol. 38 (11), 1834-1840 (2006).
- Zheng, Z., et al. Nebivolol protects against myocardial infarction injury via stimulation of beta 3-adrenergic receptors and nitric oxide signaling. PLOS ONE. 9 (5), 98179 (2014).
- Tarnavski, O., et al. Mouse cardiac surgery: comprehensive techniques for the generation of mouse models of human diseases and their application for genomic studies. Physiol Genomics. 16 (3), 349-360 (2004).
- Buitrago, S., Martin, T. E., Tetens-Woodring, J., Belicha-Villanueva, A., Wilding, G. E. Safety and Efficacy of Various Combinations of Injectable Anesthetics in BALB/c Mice. J Am Assoc Lab Anim Sci. 47 (1), 11-17 (2008).
- Kolk, M. V., et al. LAD-Ligation: A Murine Model of Myocardial Infarction. J Vis Exp. (32), e1438 (2009).
- Wu, Y., Yin, X., Wijaya, C., Huang, M. H., McConnell, B. K. Acute myocardial infarction in rats. Journal of visualized experiments : J Vis Exp. (48), (2011).
- Ferrera, R., Benhabbouche, S., Bopassa, J. C., Li, B., Ovize, M. One hour reperfusion is enough to assess function and infarct size with TTC staining in Langendorff rat model. Cardiovasc Drugs Ther. 23 (4), 327-331 (2009).
- Zeng, C., et al. Evaluation of 5-ethynyl-2'-deoxyuridine staining as a sensitive and reliable method for studying cell proliferation in the adult nervous system. Brain Res. 1319, 21-32 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon