Method Article
Lo sviluppo di un anticorpo salivare Multiplex immunoenzimatico per misurare l'esposizione umana ad agenti patogeni ambientali
In questo articolo
Riepilogo
In the current climate of scarce resources, new technologies are emerging that allow researchers to conduct studies cheaper, faster and with more precision. Here we describe the development of a bead-based salivary antibody multiplex immunoassay to measure human exposure to multiple environmental pathogens simultaneously.
Abstract
L'eziologia e impatti di esposizione umana ad agenti patogeni ambientali sono di grande preoccupazione in tutto il mondo e, quindi, la capacità di valutare efficaci approcci high-throughput di esposizione e le infezioni utilizzando costo sarebbe indispensabile. Questo manoscritto descrive lo sviluppo e l'analisi di un immunodosaggio multiplex bead-based in grado di misurare la presenza di anticorpi nella saliva umana per diversi patogeni contemporaneamente. La saliva è particolarmente interessante in questa applicazione, perché è non invasiva, meno costoso e più facile da raccogliere dal siero. Gli antigeni da patogeni ambientali sono stati accoppiati a microsfere carbossilati (perle) e utilizzati per misurare gli anticorpi in molto piccoli volumi di campioni di saliva umana utilizzando una, saggio soluzione fasi bead-based. Beads sono stati accoppiati con gli antigeni di Campylobacter jejuni, Helicobacter pylori, Toxoplasma gondii, norovirus (G e G I.1 II.4) e virus dell'epatite. Per garantire che gli antigeni sono stati sufficientemente accoppiatile perline, l'accoppiamento è stata confermata usando specie-specifici, anticorpi di cattura primario di derivazione animale, seguita da incubazione con biotinilati anti-specie anticorpi di rilevamento secondarie e streptavidina-R-ficoeritrina giornalista (SAPE). Come controllo per misurare legame non specifico, un insieme di sferette è stata trattata in modo identico agli altri tranne che non è stato accoppiato a qualsiasi antigene. Le perle antigene-accoppiati e di controllo sono stati poi incubati con campioni di saliva umana prospetticamente raccolti, misurato su un analizzatore alto rendimento basato sui principi della citometria a flusso, e la presenza di anticorpi ciascun antigene è stata misurata in unità di intensità mediana fluorescenza (MFI) . Questo immunodosaggio multiplex ha una serie di vantaggi, tra cui più dati con meno di esempio; riduzione dei costi e del lavoro; e la possibilità di personalizzare il dosaggio per molti obiettivi di interesse. I risultati indicano che il test immuno-multiplex salivare può essere in grado di individuare esposizioni e infezioni precedenti, che può essere especially utile negli studi di sorveglianza che coinvolgono grandi popolazioni umane.
Introduzione
L'ottantotto per cento delle malattie diarroiche in tutto il mondo è associata con l'esposizione umana ad acqua contaminata, alimenti non sicuri, e scarsa igiene / igiene, causando circa 1,5 milioni di morti, la maggior parte dei quali sono bambini 1. Questa è una delle principali cause di preoccupazione per i funzionari della sanità pubblica e dei responsabili politici. Nel tentativo di indagare le esposizioni e le malattie associate con vie d'acqua ed altri agenti patogeni ambientali, abbiamo sviluppato un test immunologico multiplex per misurare gli anticorpi in campioni umani 2-4. Questo metodo può essere applicato a studi epidemiologici per determinare l'esposizione umana a questi agenti patogeni e di definire meglio le infezioni immunoprevalence e incidenti.
La saliva contiene molto promettente come alternativa al siero per la ricerca biomarker umana. Tra i vantaggi derivanti dall'utilizzo di saliva sono la non invasività e facilità di raccolta del campione, a basso costo, ed i campioni possono essere facilmente raccolti da bambini 5-7 </ Sup>. I campioni di siero e saliva sono stati ampiamente studiati per gli anticorpi contro H. pylori 2,3,8, Plasmodium falciparum 9, Entamoeba histolytica 10, Cryptosporidium parvum 3,11, Streptococcus pneumoniae 12, virus dell'epatite A e C 13-14, norovirus 2-4,15, T. gondii 2-4, virus della dengue 16, virus dell'immunodeficienza umana (HIV) 17, ed Escherichia coli O157: H7 18.
Un immunodosaggio multiplex permette l'analisi di analiti multipli simultaneamente all'interno di un volume del campione singolo e all'interno di un singolo ciclo o correre. Antigeni multiplex da C. jejuni, T. gondii, H. pylori, sono stati utilizzati virus dell'epatite A, e due norovirus a misura umana salivare IgG 2-4 e IgA 3,4 e nel plasma IgG 2,3 risposte anticorpali a questi agenti patogeni con unbead-based immunologico multiplexing. Quando utilizzato in combinazione con studi epidemiologici di esposizione ai microbi in acqua, suolo e cibo, il tipo di analisi descritto in questo studio può fornire informazioni preziose per migliorare la comprensione delle infezioni causate da patogeni ambientali. Inoltre, i dati di anticorpi salivari ottenuti da tali studi possono essere utilizzati per migliorare i modelli di valutazione del rischio 19-22.
Protocollo
L'approvazione è stata ottenuta dalla Institutional Review Board (IRB # 08-1844, University of North Carolina, Chapel Hill, NC, USA) per la raccolta di campioni di saliva stimolati crevicolare da bagnanti a Boqueron Beach, Porto Rico, come parte degli Stati Uniti Environmental Protection Agency (EPA) nazionale epidemiologici e valutazione ambientale di attività ricreative (neear) acqua Studio 23 per la valutazione di nuoto associato esposizioni e malattie. I soggetti dello studio fornito il consenso informato e sono stati istruiti sull'uso del dispositivo di raccolta della saliva da personale qualificato e imprenditori USEPA. I campioni di saliva sono stati spediti in ghiaccio e, sulla ricevuta, sono stati centrifugati e conservati a -80 ° C come descritto 4.
1. Attivazione Bead
- Risospendere le scorte di sferette di vortex e sonicating per 20 secondi e il trasferimento di circa 5,0 x 10 6 delle perline stock (400 microlitri) per provette da microcentrifuga.
Nota: Tha perle vengono alimentate ad una concentrazione di 12,5 x 10 6 perline / ml. - Agglomerare le azionari perline per centrifugazione a 10.000 xg per 2 minuti.
- Rimuovere il surnatante e risospendere le sfere in pellet in 100 ml di acqua distillata (DH 2 O) dal vortice e ultrasuoni per 20 sec. Ripetere il punto 1.2.
- Rimuovere il surnatante e risospendere le sfere lavate in 80 ml di 100 mM sodio fosfato monobasico, pH 6,2 per vortice e sonicazione per 20 sec.
- Immediatamente prima dell'uso, effettuare una soluzione di 50 mg / ml N -hydroxysulfosuccinimide (Sulfo-NHS) con l'aggiunta di 200 pl dH 2 O al 10 mg Sulfo-NHS aliquota. Miscelare vortice.
- Aggiungere 10 ml di 50 mg / ml solfo-NHS ai talloni. Miscelare vortice.
- Immediatamente prima dell'uso, fare un 50 mg / ml di 1-etil [3dimethylaminopropyl] carbodiimide soluzione (EDC) cloridrato con l'aggiunta di 200 ml di acqua distillata (DH 2 O) al 10 mg EDC aliquota. Miscelare vortice.
- Aggiungere 10 ml di 50mg / ml soluzione EDC ai talloni. Miscelare vortice. Incubare le perline per 20 min a temperatura ambiente, al buio, con miscelazione vortex ad intervalli di 10 min. Pellet le perle attivate da microcentrifugation a 10.000 xg per 2 minuti.
- Rimuovere il surnatante e risospendere le sfere in 250 microlitri di 50 mm 2- [N -Morpholino] acido etansolfonico (MES), pH 5,0 da vortice e ultrasuoni per 20 sec.
- Pellet le perle attivate da microcentrifugation a 10.000 xg per 2 minuti.
- Ripetere i punti 1.9 e 1.10.
Nota: Questo fornisce un totale di due lavaggi con 50 mM MES, pH 5,0. - Risospendere le sfere in 100 ml di 50 mM MES, pH 5,0 da vortice e ultrasuoni per 20 sec.
2. Giunto Bead
- Coppia antigeni ai set tallone utilizzando le concentrazioni indicate nella Tabella 1.
- Aggiungere ciascun antigene ai talloni attivati e portare il volume totale a 500 microlitri in 50 mM MES, pH 5,0. Mescolare gli antigeni und perline di vortice.
- Incubare gli antigeni e perline per 2 ore con miscelazione mediante rotazione (~ 15 rpm) a temperatura ambiente al buio. Agglomerare le perline accoppiate di microcentrifugation a 10.000 xg per 2 minuti.
- Rimuovere il surnatante e risospendere le sfere in 500 ml di tampone fosfato (PBS) -bovine albumina sierica (BSA) monolaurato -polyoxyethylenesorbitan (Tween-20) -Sodio azide (PBS-TBN) pH 7,4 per vortice e ultrasuoni. Pellet le perle di microcentrifugation a 10.000 xg per 2 minuti e rimuovere il surnatante.
Attenzione: azide di sodio è una sostanza chimica altamente tossici. È fatale se ingerito o si mette in contatto con la pelle. Non respirare la polvere / i fumi / gas / la nebbia / vapori o spray. Indossare dispositivi di protezione adeguati (di DPI) durante la manipolazione e smaltire secondo le leggi appropriate. - Risospendere le sfere in 1 ml di PBS-TBN di vortice e ultrasuoni per 20 sec.
- Pellet le perle di microcentrifugation a 10.000 xg per 2 minuti.
- Ripetere i punti 2.5 e 2.6.
Nota: Questo fornisce un totale di due lavaggi con PBS-TBN. - Risospendere le sfere accoppiati e lavati con 1 ml di PBS, 1% BSA, 0,05% azide, pH 7,4. Conservare le perline accoppiate in C frigorifero 2-8 ° al buio.
3. Conte Bead
- Preparare una diluizione 1:10 di perline accoppiate in acqua o PBS.
- Carico 10 ml di diluizione tallone SU UN emocitometro nel punto di introduzione del campione.
- Contare le perline visto in una delle griglie 4 x 4 angolari. Calcolare il numero totale di perline accoppiate utilizzando la seguente formula: Count (1 angolo di 4 x 4 griglia) x (1 x 10 4) x (fattore di diluizione) x risospensione volume in ml.
4. Conferma di Antigen Coupling
- Risospendere la miscela magazzino di perline accoppiate agli antigeni di interesse da vortice e ultrasuoni per 20 sec.
- Preparare una miscela tallone di lavoro diluendo le scorte di perline accoppiate ad una finaleconcentrazione di 100 perline / pl di ciascuna sfera unica situata all'interno di PBS-1 tampone% BSA (PBS-BSA 1%, pH 7,4).
- Preparare almeno 7 due diluizioni seriali di anti-IgG specie di anticorpo primario in base alle raccomandazioni del produttore a 96 pozzetti a fondo tondo con tampone PBS-BSA 1%.
- Pre-bagnare una colonna 8 pozzetti separato (8 righe) di un filtro piastra inferiore 96 pozzetti per ciascun test di conferma accoppiamento dell'antigene con 100 ml di tampone di lavaggio e rimuovere surnatante tramite aspirazione. Aggiungere 50 ml di lavoro miscela sferette (perline antigene-coupled) ai pozzetti pre-umido.
- Aggiungere 50 ml di diluizioni di anticorpi alle righe 1-7 di ciascuna colonna della piastra filtrante a 96 pozzetti e 50 ml di PBS-1 tampone BSA% alla riga 8 al posto di anticorpo diluito per servire come pozzi sfondo. Mescolare con una pipetta multicanale pipettando su e giù per 5 volte. Eseguire la stessa procedura per ogni insieme di sferette antigene-accoppiato ad essere confermata.
- Coprire e lasciare incubare al buio a temperatura ambienteerature per 1 ora, un vortex a 500 rpm. Rimuovere il surnatante mediante vuoto.
- Lavare i pozzetti con 100 ml di tampone di lavaggio e rimuovere il surnatante dal vuoto. Ripetere 1x. Risospendere le sfere in 50 microlitri di PBS-BSA 1% con una pipetta multicanale.
- Diluire biotinilati anti-specie specifico anticorpo di rilevazione secondario IgG a 16 mg / ml in PBS-BSA 1%.
- Aggiungere 50 ml di anticorpo secondario diluito in ciascun pozzetto pipettando su e giù 5 volte.
- Coprire piastra filtrante e lasciar incubare al buio a temperatura ambiente per 30 minuti su un agitatore. Rimuovere il surnatante mediante vuoto. Lavare i pozzetti con 100 ml di tampone di lavaggio e rimuovere il surnatante dal vuoto. Ripetere il lavaggio 1x.
- Risospendere le sfere in 50 microlitri di PBS-BSA 1% con una pipetta multicanale.
- Diluire streptavidina-R-ficoeritrina giornalista (SAPE) a 24 mg / ml in PBS-BSA 1%.
- Aggiungere 50 ml di giornalista in ogni pozzetto e mescolare pipettando su e giù per 5 volte.
- Csu piastra di filtraggio e lasciare ad incubare al buio a temperatura ambiente per 30 minuti su un agitatore. Rimuovere il surnatante mediante vuoto. Lavare i pozzetti con 100 ml di tampone di lavaggio e rimuovere il surnatante dal vuoto. Ripetere il lavaggio 1x.
- Perline risospendere in 100 ml di PBS-BSA 1% e analizzare 50 ml utilizzando l'analizzatore 29.
Nota: I risultati del test immunologico multiplex bead-based sono misurati in fluorescenza mediana (MFI). Fare sempre riferimento alla versione più recente del manuale del software, se disponibile per evitare errori.
5. salivare Multiplex immunoenzimatico
- Rimuovere saliva dal -80 ° C freezer e lasciare scongelare a temperatura ambiente.
- Risospendere antigene accoppiato scorte perline da vortice e ultrasuoni per 20 sec.
- Preparare una miscela sferette lavoro diluendo le scorte tallone accoppiato ad una concentrazione finale di 100 perline / ml di ogni insieme di sferette unico in PBS-1 tampone% BSA.
- Preparare una diluizione 1: 4 di saliva wesimo PBS-1% tampone BSA in un 96 ben, piatto pozzo profondo.
- Piastra filtro di pre-bagnato con 100 ml di tampone di lavaggio e rimuovere il surnatante dal vuoto.
- Aggiungere 50 ml di una miscela sferette di lavoro e un volume uguale di saliva diluita a 95 pozzetti delle piastre filtranti 96 e per una diluizione 1: 8 finale. Mescolare reazioni con una pipetta multicanale. Per il controllo di un bene, aggiungere 50 perline antigene-accoppiato microlitri più 50 ml di PBS-1 tampone% di BSA (come un sostituto di saliva).
- Coprire e lasciar incubare al buio a temperatura ambiente per 1 ora, un vortex a 500 rpm. Rimuovere il surnatante mediante vuoto. Lavare i pozzetti con 100 ml di tampone di lavaggio e rimuovere il surnatante dal vuoto. Ripetere il lavaggio 1x.
- perline risospendere in 50 ml di PBS-BSA 1% con una pipetta multicanale.
- Diluire biotinilato di capra anti-IgG umane anticorpo di rilevazione secondario a 16 mg / ml in PBS-BSA 1%.
- Aggiungere 50 ml diluito anticorpo secondario in ogni pozzetto e mescolare il contenuto conuna pipetta multicanale.
- Coprire piastra filtrante e lasciar incubare al buio a temperatura ambiente per 30 minuti su un agitatore. Rimuovere il surnatante mediante vuoto. Lavare i pozzetti con 100 ml di tampone di lavaggio e rimuovere il surnatante dal vuoto. Ripetere il lavaggio 1x.
- perline risospendere in 50 ml di PBS-BSA 1% con una pipetta multicanale.
- Diluire streptavidina-R-ficoeritrina giornalista (SAPE) a 24 mg / ml in PBS-BSA 1%.
- Aggiungere 50 ml giornalista in ogni pozzetto e mescolare con una pipetta multicanale.
- Coprire piastra filtrante e lasciar incubare al buio a temperatura ambiente per 30 minuti su un agitatore. Rimuovere il surnatante mediante vuoto. Lavare i pozzetti con 100 ml di tampone di lavaggio e rimuovere il surnatante dal vuoto. Ripetere il lavaggio 1x.
- Perline risospendere in 100 ml di PBS-BSA 1% e analizzare 50 ml utilizzando l'analizzatore 29.
Nota: I risultati del test immunologico multiplex sono misurati in mediana fluorescenza intensità unità (MFI). Fare sempre riferimentol'ultima versione del manuale del software, se disponibile per evitare errori.
Risultati
Un unico insieme di sferette è stato utilizzato come controllo per misurare il legame non specifico e campione a campione variabilità. Queste perle sono state trattate in maniera identica ai antigene accoppiato perline con l'eccezione che non erano incubate con qualsiasi antigene in fase di accoppiamento. valori di MFI> 500 ottenuti dalle sfere di controllo incubati con tutti i campioni di saliva sono stati rimossi da ulteriori analisi a causa della contaminazione sospetta dal siero e le risposte restanti sono stati distribuiti di registro. La saliva può essere contaminato con siero se le gengive vengono strofinate troppo energicamente con la spugna allegata al dispositivo di raccolta o se lo studio partecipante ha la malattia parodontale. Il registro trasforma i dati delle IFM sono stati usati per calcolare una immunopositive punto di cut-off di 505 IFM basato sulla media più 3 deviazioni standard dei valori MFI di registro. Inoltre, perline antigene accoppiato sono stati aggiunti ai pozzetti specifici che sono stati trattati come pozzetti di test in ogni modo tranne dilsaliva buite stato sostituito con PBS-BSA 1% per valutare fluorescenza di fondo e cross-reattività. I valori di MFI ottenuti in questi pozzi di fondo sono stati sottratti dai valori MFI da ogni insieme di sferette antigene-accoppiato per ciascun campione di saliva.
accoppiamento Bead è stata confermata usando specifici per ciascun antigene di origine animale specie-specifici anticorpi di rilevamento primario. Per garantire che l'antigene accoppiato perline erano in grado di affrontare la gamma dinamica del test, abbiamo definito accoppiamento corretto come MFI ≥18,000, osservazione di risposta e di cross-reattività tra anticorpi primari e non-target di <10% come descritto 2 . Conferme di accoppiamento Rappresentante per C. jejuni e T. gondii degli antigeni nel test sono mostrati in Figura 1.
Sulla base del punto di cut-off stabilito (505 MFI), il tasso di immunoprevalences per i campioni (n = 2.078) variava da circa 2% (n = 41) per T. gondii a quasi il 50% (n = 1.009) per norovirus GI.1 (Figura 2). I dati indicano che il tasso di immunoprevalence è stato più alto per le norovirus seguita da virus dell'epatite A e H. pylori.
Mentre 32% (n = 672) dei campioni erano immunonegative per tutti i patogeni nel test, 68% (n = 1.406) erano immunopositive ad uno o più agenti patogeni. Figura 3 mostra la composizione dei immunopositività ad uno o più dei patogeni.
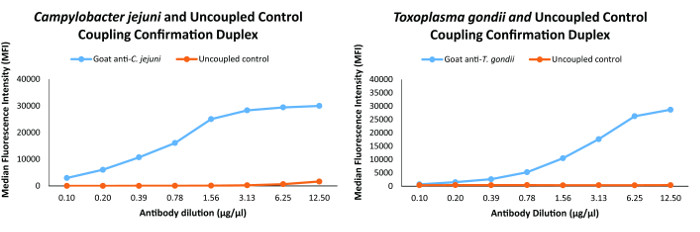
Figura 1: accoppiamento analisi di conferma per due organismi nel immunodosaggio multiplex conferma accoppiamento è stata eseguita per tutti gli antigeni ei grafici per C.. jejuni e T. gondii in questa figura sono rapprepresentante delle conferme di accoppiamento per gli antigeni del immunologico multiplex. Cliccate qui per vedere una versione più grande di questa figura.
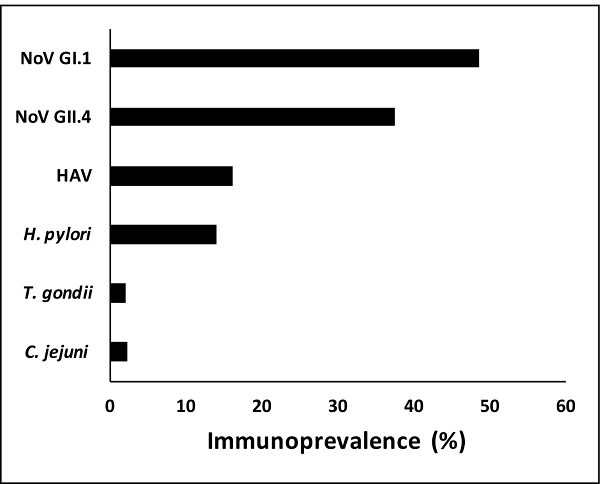
Figura 2:. Immunoprevalence a patogeni specifici Immunoprevalence a patogeni specifici nel saggio immunologico multiplex variava da circa il 2% per il T. gondii a quasi il 50% per i norovirus GI.1. Gli anticorpi contro gli antigeni di norovirus sono stati più comunemente osservato seguiti da HAV (virus dell'epatite A) e H. pylori. T. gondii e C. anticorpi jejuni è apparso meno frequentemente nei campioni di saliva analizzati. Cliccate qui per vedere una versione più grande di Thè figura.

Figura 3:. Composizione della immunopositività a più patogeni contemporaneamente L'immunodosaggio multiplex permette l'analisi di immunopositività a più patogeni contemporaneamente in un volume di campione 50 microlitri. Quasi un terzo dei campioni di saliva analizzati era immunonegative per gli anticorpi contro tutti gli antigeni del multiplex. Circa il 31% dei campioni era immunopositive per un antigene, mentre un quarto è stato positivo per due antigeni. 9,4% è stato immunopositive a tre antigeni. 3% è stato positivo per quattro o più antigeni contemporaneamente. Si prega di cliccare qui per vedere una versione più grande di questa figura.
| Antigene | Set Bead | buffer di accoppiamento | Ag Concentrazione (mg) | # 1 di perle in angolo | # Di perline / ml | Vol. per 100 B / UL per 4 ml (ml) |
| C. jejuni | 8 | MES 5.0 | 50 | 64 | 6.400 | 94 |
| H. pylori | 33 | MES 5.0 | 25 | 71 | 7.100 | 85 |
| Epatite A | 42 | MES 5.0 | 100 | 91 | 9.100 | 66 |
| T. gondii | 30 | MES 5.0 | 25 | 85 | 8.500 | 71 |
| Norovirus GII.4 | 55 | MES 5.0 | 5 | 72 | 7.200 | 83 |
| Norovirus GI.1 | 67 | MES 5.0 | 5 | 63 | 6.300 | 95 |
| disaccoppiato | 80 | MES 5.0 | 60 | 6.000 | 100 | |
| Il volume totale di perline (ml) | 594 | |||||
| Il volume totale di tampone necessario (ml) | 3.406 | |||||
Tabella 1:. Lavorare miscela di sferette per la immunologico multiplex Dopo l'accoppiamento e la conferma sono stati completati, una master mix composto da ogni insieme di sferette è stato preparato come indicato. Il master mix è stato distribuito tra unll dei pozzi nella piastra ben 96. Tutti i pozzetti sono stati incubati con la saliva con l'eccezione di un pozzetto controllo di sfondo che conteneva solo perline e PBS-1 tampone% BSA.
Discussione
Questi risultati indicano che il metodo immunologico multiplex è utile per discriminare tra campioni di saliva che sono immunopositive o immunonegative. Per determinare immunopositività, un unico punto di cut-off è stato sviluppato calcolando la media più tre deviazioni standard dei log trasformato risposte MFI del controllo perline disaccoppiati testati con tutti i campioni di saliva. Il punto di cut-off concessa la possibilità di valutare l'esposizione e immunoprevalence ad un singolo o più agenti patogeni. Questo potere discriminante può essere utile in studi di popolazione per indagare i rischi per la salute associati con l'esposizione a patogeni ambientali e di altro.
Ci sono molti altri metodi che possono essere utilizzati per determinare un punto di cut-off a seconda della distribuzione della IFM, controlli disaccoppiati e quale domanda lo studio è stato progettato per rispondere. Alcuni esempi per la determinazione cut-off sono finiti modellazione mista 24-26, significano più 3deviazioni standard di risposte ai controlli, media più 2 deviazioni standard di risposte ai controlli, e tre volte la media di risposte a controlli 27,28. Per semplici proiezioni, criteri meno rigorosi possono essere usati ma per gli studi epidemiologici, può essere più appropriato impiegare una definizione più stringente per ridurre la probabilità di riportare falsi positivi. La nostra domanda iniziale è quello di esaminare immunoconversion e immunoprevalence tra nuotatori e non nuotatori. In questo studio, le IFM di controllo disaccoppiati non erano normalmente distribuiti ei risultati sono stati trasformati log.
Vantaggi per l'esecuzione di un test immunologico multiplex bead-based includono l'uso di volumi molto bassi di esempio, riduzione del tempo e del lavoro e la capacità di misurare le risposte fino a 500 analiti contemporaneamente pur richiedendo una minima quantità di reagenti. Al contrario, i metodi tradizionali di valutare i livelli di anticorpi indicativi di esposizione e / o infezione (ad esempio , il test ELISA) può richiedere diverse ore per completare, sono alta intensità di lavoro, e può essere utilizzato solo per misurare un analiti alla volta. Questi metodi tradizionali richiedono anche grandi quantità di campioni del paziente / partecipante. Ad esempio, la maggior parte di ELISA richiedono almeno 100 ml di campione, mentre un test immunologico multiplex può richiedere 50 ml o meno.
Limitazioni di un immunodosaggio multiplex includono la necessità di ottimizzazione rigoroso per determinare le concentrazioni ottimali di cattura primari e secondari anticorpi di rilevamento, antigeni e giornalista. Cross-reattività è anche una delle principali preoccupazioni in saggi immunologici come anticorpi contro un particolare antigene possono attraversare-reagiscono con gli antigeni di altri organismi e quindi portare a falsi positivi. Ottimizzazione, cross-reattività e legame non specifico è stato affrontato in precedenza 2-4. Il successo di tale dosaggio dipende in larga misura la capacità di ottenere antigeni altamente immunogenici così come specifici Antibomuore a questi antigeni per l'utilizzo nelle fasi di accoppiamento tallone e di conferma di accoppiamento. Un altro limite è la limitata disponibilità di campioni caratterizzati (diagnostico positivi e negativi) per convalidare i test.
Ci sono un certo numero di fasi critiche nel protocollo. Questi includono: assicurare gli antigeni che verranno accoppiati ai talloni non contengono proteine estranee, azide, glicina, Tris o qualsiasi ammine primarie. Se uno qualsiasi di questi agenti esistono nella preparazione dell'antigene, essi devono essere rimossi mediante dialisi o cromatografia. Si raccomanda che uno dovrebbe iniziare con 5 mcg di antigene per 5 milioni di perline e titolare di trovare la concentrazione ottimale. Scegliere la concentrazione di anticorpi di rilevamento ottimale che offre la migliore sensibilità e la gamma dinamica. Tenete a mente che i segnali tendono a diminuire con concentrazioni dell'antigene e l'individuazione di anticorpi incremento (effetto gancio). Ad esempio, se il segnale diminuisce all'aumentare della concentrazione di antigene poi rilevareanticorpo ioni può essere limitante. Al contrario, se i segnali diminuiscono all'aumentare anticorpo di rilevazione allora giornalista (SAPE) può essere limitante. Controllare il multiplex per reattività crociata combinando l'accoppiamento ottimale per ogni proteina (5.000 ciascuna sfera impostato per pozzetto). Testare i set di sferette multiplex, combinando con la quantità ottimale anticorpo di rilevazione. Ottimizzare il giornalista e fare una curva standard dell'antigene testando ciascun antigene singolarmente.
Risoluzione dei problemi un test immunologico multiplex per migliorare la sensibilità e per aumentare segnale fluorescente mediana sono di fondamentale importanza. Per migliorare la sensibilità, ridurre sia la quantità di antigene accoppiato alle perline o la concentrazione di anticorpo di rilevazione. L'uso di un anticorpo maggiore affinità per la cattura e / o di rilevazione può anche migliorare la sensibilità. Aumentando la quantità di antigene accoppiato ai talloni può aumentare il segnale fluorescente mediana. Uno studio ha dimostrato che la pre-incubazione campioni di siero con polyvinylalcohol più polivinilpirrolidone tampone (PVX) è in grado di sopprimere vincolante nei test sierologici che utilizzano il test multiplex tallone a base 30 non specifico come quello che stiamo descrivendo qui. Tuttavia, un altro studio condotto da nostri collaboratori ha trovato alcun effetto significativo tra PBS-BSA e PVX buffer. Essi hanno concluso inoltre che a causa della maggiore viscosità del buffer PVX, ha creato problemi di acquisizione tallone nell'analizzatore e schiuma formata nei pozzetti 3.
In conclusione, abbiamo presentato un metodo che sia in grado di misurare la presenza di anticorpi IgG salivari umane a più patogeni contemporaneamente in un volume di campione molto piccolo. In futuro, questo test sarà utilizzato per rilevare la presenza di anticorpi salivari associati alle esposizioni o infezioni correlate nuoto e per contribuire ad informare i modelli di valutazione del rischio. Inoltre, il test può essere utilizzato per misurare anticorpi associati con exposur aerea e trasmissione alimentareES, determinare infezioni incidenti o immunoconversions e fornire informazioni immunologico fondamentale per epidemiologi che conducono studi di popolazione questionario-tipo.
Divulgazioni
L'Environmental Protection Agency degli Stati Uniti attraverso il suo Ufficio di Ricerca e Sviluppo finanziato e gestito la ricerca descritta qui. E 'stato sottoposto a controllo amministrativo dell'Agenzia e approvato per la pubblicazione. La citazione di marchi o prodotti commerciali non costituisce approvazione o raccomandazione per l'uso.
Riconoscimenti
Clarissa Curioso was supported through an appointment to the Research Participation Program at the U.S. Environmental Protection Agency administered by the Oak Ridge Institute for Science and Education through an interagency agreement between the U.S. Department of Energy and U.S. EPA.
Materiali
| Name | Company | Catalog Number | Comments |
| Equipment and Software | |||
| Microcentrifuge | Thermo Electron Corporation | 75002446 | Used to centrifuge samples |
| Vortex Mixer | VWR | G560 | Used to mix samples |
| Sonicator (mini) | Fisher Scientific | 15-337-22 | Used to separate beads |
| Pipettors P10, P20, P100, P1000, 8 ch. | Capp | Various | |
| Hemacytometer (Bright Line) | Housser Scientific | 3200 | Used to count coupled beads |
| Multiscreen Vacuum Manifold | Millipore | MSVMHTS00 | Used in washing steps to remove supernatant |
| MicroShaker | VWR | 12620-926 | Used to agitate beads during incubations |
| Tube rack (1.5 ml and 0.5 ml) (assorted) | VWR | 30128-346 | |
| Weighing Scale | Mettler or other | Used to measure wash reagents for making buffers | |
| Dynabead Sample Mixer | Invitrogen | 947-01 | Used during coupling incubation step |
| MatLab (R2014b) | The MathWorks, Inc. | Used to analyze antibody response data | |
| Microsoft Excel 2014 | Microsoft Corporation | Used to analyze antibody response data | |
| Luminex Analyzer with xPonent 3.1 software | Luminex Corporation | LX200-XPON3.1 | Instrument and software used to run assay |
| Antigens | |||
| GI.1 Norwalk Virus: p-particle | Xi Jiang (CCHMC)* | NA | *Cincinnati Childrens' Hospital. Final conc. 5 µg. |
| GII.4 Norovirus VA387: p-particle | Xi Jiang (CCHMC)* | NA | *Cincinnati Childrens' Hospital. Final conc. 5 µg. |
| Hepatitis A Virus: grade II concentrate from cell culture | Meridian Life Sciences | 8505 | Antigen coupled at 100 µg |
| Helicobacter pylori: lysate | Meridian Life Sciences | R14101 | Antigen coupled at 25 µg |
| Toxoplasma gondii: recombinant p30 (SAG1) | Meridian Life Sciences | R18426 | Antigen coupled at 25 µg |
| Campylobacter jejuni: heat killed whole cells | KPL | 50-92-93 | Antigen coupled at 50 µg |
| Primary Antibodies | |||
| Guinea pig anti-Norovirus | (CCHMC)* | NA | Used for coupling confirmation |
| Mouse anti-Hepatitis A IgG | Meridian Life Sciences | C65885M | Used for coupling confirmation |
| Mouse anti-Hepatitis A IgG | Meridian Life Sciences | C65885M | Used for coupling confirmation |
| BacTraceAffinity Purified Antibody to Helicobacter pylori | KPL | 01-93-94 | Used for coupling confirmation |
| Goat pAb to Toxoplasma gondii | Abcam | Ab23507 | Used for coupling confirmation |
| BacTrace Goat anti-Campylobacter species | KPL | 01-92-93 | Used for coupling confirmation |
| Secondary Antibodies | |||
| Biotin-SP-Conjugated AffiniPure Donkey anti-Goat IgG (H+L) | Jackson | 705-065-149 | Used for coupling confirmation |
| Biotinylated Rabbit anti-Goat IgG (H+L) | KPL | 16-13-06 | Used for coupling confirmation |
| Biotinylated Goat anti-Mouse IgG (H+L) | KPL | 16-18-06 | Used for coupling confirmation |
| Affinity Purified Antibody Biotin Labeled Goat anti-Rabbit IgG (H+L) | KPL | 176-1506 | Used for coupling confirmation |
| Consumables | |||
| 1.5 ml copolymer microcentrifuge tubes | USA Scientific | 1415-2500 | Used as low binding microcentrifuge tubes |
| 10 µl pipette tip refills | BioVentures | 5030050C | |
| 200 µl pipette tip refills | BioVentures | 5030080C | |
| 1,000 µl pipette tip refills | BioVentures | 5130140C | |
| Aluminum foil | Various Vendors | Used keep beads in the dark during incubations | |
| Deep Well plates | VWR | 40002-009 | Used for diluting saliva samples |
| Multiscreen Filter Plates | Millipore | MABVN1250 | Used to run assays |
| Oracol saliva collection system | Malvern Medical Developments Limited | Used for saliva collection | |
| Reagents | |||
| Carboxylated microspheres (beads) | Luminex Corporation | Dependent on bead set | Antigens are coupled to the microspheres |
| EDC (1-ethyl-3-[3-dimethylaminopropyl] carbodiimide hydrochloride) | Pierce | 77149 or 22980 | Used in bead activation |
| Sulfo-NHS (N-hydroxysulfosuccinimide) | Pierce | 24510 | Used in bead activation |
| Steptavidin-R-phycoerythrin (1 mg/ml) | Molecular Probes | S-866 | Used as reporter |
| MES (2-[N-Morpholino]ethanesulfonic acid) | Sigma | M-2933 | Used for coupling |
| Tween-20 (Polyoxyethylenesorbitan monolaurate) | Sigma | P-9416 | Used in wash buffer to remove non-specific binding |
| Protein Buffers | |||
| PBS-TBN Blocking/ Storage Buffer (PBS, 0.1% BSA, 0.02% Tween-20, 0.05% Azide, pH 7.4)** | Filter Sterilize and store at 4 °C | ||
| PBS, pH 7.4 | Sigma | P-3813 | 138 mM NaCl, 2.7 mM KCl |
| BSA | Sigma | A-7888 | 0.1% (w/v) |
| Tween-20 | Sigma | P-9416 | 0.2% (v/v) |
| Sodium Azide (0.05% azide)** | Sigma | S-8032 | **Caution: Sodium azide is acutely toxic. Avoid contact with skin and eyes. Wear appropriate PPE's. Dispose of according to applicable laws. |
| MES/Coupling Buffer (0.05 M MES, pH 5.0) | |||
| MES (2-[N-Morpholino]ethanesulfonic acid) | Sigma | S-3139 | |
| 5 N NaOH | Fisher | SS256-500 | |
| Assay Buffer (PBS, 1% BSA, pH 7.4) | Filter Sterilize and store at 4 °C | ||
| PBS, 1% BSA, pH 7.4 | Sigma | P-3688 | 138 mM NaCl, 2.7 mM KCl, 1% BSA |
| Activation Buffer (0.1 M NaH2PO4, pH 6.2) | Filter Sterilize and store at 4 °C | ||
| NaH2PO4 (Sodium phosphate, monobasic anhydrous) | Sigma | S-3139 | 0.1 M NaH2PO4 |
| 5 N NaOH | Fisher | SS256-500 | |
| Wash Buffer (PBS, 0.05% Tween-20, pH 7.4) | Filter Sterilize and store at 4 °C | ||
| PBS, 0.05% Tween-20, pH 7.4 | Sigma | P-3563 | 138 mM NaCl, 2.7 mM KCl, 0.05% TWEEN |
Riferimenti
- Prüss-Üstün, A., Gore, F., Bartram, J. . Safer water, better health: costs, benefits and sustainability of interventions to protect and promote health. , (2008).
- Augustine, S., et al. Statistical approaches to developing a multiplex immunoassay for determining human exposure to environmental pathogens. J Immunol Methods. 425, 1-9 (2015).
- Griffin, S., et al. Application of salivary antibody immunoassays for the detection of incident infections with Norwalk virus in a group of volunteers. J Immunol Methods. 424, 53-63 (2015).
- Griffin, S., Chen, I., Fout, G., Wade, T., Egorov, A. Development of a multiplex microsphere immunoassay for the quantitation of salivary antibody responses to selected waterborne pathogens. J Immunol Methods. 364 (1-2), 83-93 (2011).
- Ferguson, D. Current diagnostic uses of saliva. J Dent Res. 66, 420-424 (1987).
- Mandel, I. The diagnostic uses of saliva. J Oral Pathol Med. 19, 119-125 (1990).
- Malamud, D. Saliva as a Diagnostic Fluid. Brit Med J. 305, 207-208 (1992).
- Ballam, L., et al. Western blotting is useful in the salivary diagnosis of Helicobacter pylori infection. J Clin Pathol. 53, 314-317 (2000).
- Estevez, P., Satoguina, J., Nwakanma, D., West, S., Conway, D., Drakeley, C. Human saliva as a source of anti-malarial antibodies to examine population exposure to Plasmodium falciparum. Malar J. 10, 104 (2011).
- Abd-Alla, M., Jackson, T., Reddy, S., Ravdin, J. Diagnosis of invasive amebiasis by enzyme-linked immunosorbent assay of saliva to detect amebic lectin antigen and anti-lectin immunoglobulin G antibodies. J Clin Microbiol. 38 (6), 2344-2347 (2000).
- Toyoguchi, A., et al. Antibody reactivity to Cryptosporidium parvum in saliva of calves after experimental infection. J Vet Med Sci. 62 (11), 1231-1234 (2000).
- Choo, S., Zhang, Q., Seymour, L., Akhtar, S., Finn, A. Primary and booster salivary antibody responses to a 7-valent pneumococcal conjugate vaccine in infants. J Infect Dis. 182 (4), 1260-1263 (2000).
- Tourinho, R., et al. Importance of the cutoff ratio for detecting antibodies against hepatitis A virus in oral fluids by enzyme immunoassay. J Virol Methods. 173 (2), 169-174 (2011).
- Moorthy, M., Daniel, H., Kurian, G., Abraham, P. An evaluation of saliva as an alternative to plasma for the detection of hepatitis C virus antibodies. Indian J Med Microbiol. 26 (4), 327-332 (2008).
- Moe, C., Sair, A., Lindesmith, L., Estes, M., Jaykus, L. Diagnosis of norwalk virus infection by indirect enzyme immunoassay detection of salivary antibodies to recombinant norwalk virus antigen. Clin Diagn Lab Immunol. 11 (6), 1028-1034 (2004).
- Yap, G., Sil, B., Ng, L. Use of saliva for early dengue diagnosis. PLoS Negl Trop Dis. 5 (5), e1046 (2011).
- Schramm, W., Angulo, G., Torres, P., Burgess-Cassler, A. A simple saliva-based test for detecting antibodies to human immunodeficiency virus. Clin Diagn Lab Immunol. 6 (4), 577-580 (1999).
- Chart, H., Perry, N., Willshaw, G., Cheasty, T. Analysis of saliva for antibodies to the LPS of Escherichia coli O157 in patients with serum antibodies to E. coli O157 LPS. J Med Microbiol. 52 (Pt 7), 569-572 (2003).
- Ashbolt, N., Bruno, M. Application and refinement of the WHO risk framework for recreational waters in Sydney, Australia. J Water Health. 1 (3), 125-131 (2003).
- Westrell, T., Schonning, C., Stenstrom, T., Ashbolt, N. QMRA (quantitative microbial risk assessment) and HACCP (hazard analysis and critical control points) for management of pathogens in wastewater and sewage sludge treatment and reuse. Water Sci Technol. 50 (2), 23-30 (2004).
- Ashbolt, N. Microbial contamination of drinking water and disease outcomes in developing regions. Toxicology. 198 (1-3), 229-238 (2004).
- Eisenberg, J., Soller, J., Scott, J., Eisenberg, D., Colford, J. A dynamic model to assess microbial health risks associated with beneficial uses of biosolids. Risk Anal. 24, 221-236 (2004).
- Wade, T. J., et al. . Report on 2009 National Epidemiologic and Environmental Assessment of Recreational Water Epidemiology Studies, US EPA. US EPA Report Number: EPA/600/R-10/168: US EPA2011. , (2011).
- Fujii, Y., et al. Serological surveillance development for tropical infectious diseases using simultaneous microsphere-based multiplex assays and finite mixture models. PLoS Negl Trop Dis. 8, e3040 (2014).
- Rota, M., Massari, M., Gabutti, G., Guido, M., De Donno, A., Ciofi degli Atti, M. Measles serological survey in the Italian population: interpretation of results using mixture model. Vaccine. 26 (34), 4403-4409 (2008).
- Vyse, A., Gay, N., Hesketh, L., Pebody, R., Morgan-Capner, P., Miller, P. Interpreting serological surveys using mixture models: the seroepidemiology of measles, mumps and rubella in England and Wales at the beginning of the 21st century. Epidemiol Infect. 134 (6), 1303-1312 (2006).
- Baughman, A., et al. Establishment of diagnostic cutoff points for levels of serum antibodies to pertussis toxin, filamentous hemagglutinin, and fimbriae in adolescents and adults in the United States. Clin Diagn Lab Immunol. 11 (6), 1045-1053 (2004).
- Clotilde, L., Bernard, C., Hartman, G., Lau, D., Carter, J. Microbead-based immunoassay for simultaneous detection of Shiga toxins and isolation of Escherichia coli O157 in foods. J Food Prot. 74 (3), 373-379 (2011).
- . . Luminex User Software Manual (RUO) xPONENT 3.1 Rev. 2. 3, 6-102 (2014).
- Waterboer, T., Sehr, P., Pawlita, M. Suppression of non-specific binding in serological Luminex assays. J Immunol Methods. 309 (1-2), 200-204 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon