Method Article
Le développement d'un anticorps salivaire Multiplex Immunoassay mesurer l'exposition humaine aux agents pathogènes environnementaux
Dans cet article
Résumé
In the current climate of scarce resources, new technologies are emerging that allow researchers to conduct studies cheaper, faster and with more precision. Here we describe the development of a bead-based salivary antibody multiplex immunoassay to measure human exposure to multiple environmental pathogens simultaneously.
Résumé
L'étiologie et les impacts de l'exposition humaine aux agents pathogènes environnementaux sont une préoccupation majeure dans le monde entier et, par conséquent, la capacité d'évaluer des approches à haut débit rentables d'exposition et les infections à l'aide serait indispensable. Ce mémoire décrit le développement et l'analyse d'un essai immunologique à base de billes multiplexe capable de mesurer la présence d'anticorps dans la salive humaine à des agents pathogènes multiples simultanément. Saliva est particulièrement intéressante dans cette application car elle est non invasive, moins cher et plus facile à recueillir que du sérum. Des antigènes provenant d'agents pathogènes environnementaux ont été couplés à des microsphères carboxylées (billes) et sont utilisés pour mesurer les anticorps dans de très petits volumes d'échantillons de salive humaine en utilisant un dosage en phase de solution à base de billes. Les billes ont été couplés à des antigènes provenant de Campylobacter jejuni, Helicobacter pylori, Toxoplasma gondii, norovirus (G et G I.1 II.4) et le virus de l' hépatite A. Faire en sorte que les antigènes sont suffisamment couplés àles billes, le couplage a été confirmée en utilisant des espèces, des anticorps de capture primaires dérivés d'animaux, suivie par une incubation avec biotinylés anti-espèce des anticorps de détection secondaires et de la streptavidine-R-phycoérythrine rapporteur (SAPE). En tant que contrôle pour mesurer la liaison non spécifique, un jeu de billes a été traité de manière identique aux autres, sauf qu'il n'a pas été couplé à un antigène. Les billes d'antigène couplé et de contrôle ont ensuite été incubées avec des échantillons prospectivement recueillies salive humaine, mesurée sur un analyseur à haut débit basé sur les principes de la cytométrie de flux, et la présence d'anticorps dirigés contre l'antigène a été mesurée dans médiane de fluorescence unités d'intensité (MFI) . Ce dosage immunologique multiplex a un certain nombre d'avantages, y compris davantage de données avec moins de l'échantillon; les coûts et la main-d'œuvre réduits; et la possibilité de personnaliser le test à plusieurs cibles d'intérêt. Les résultats indiquent que le dosage immunologique multiplex salivaire peut être capable d'identifier les expositions et les infections antérieures, qui peut être especially utile dans les études de surveillance impliquant de grandes populations humaines.
Introduction
Quatre-vingt-huit pour cent des maladies liées à la diarrhée dans le monde entier est associé à l' exposition humaine à l' eau contaminée, des aliments dangereux et un mauvais assainissement / hygiène, causant environ 1,5 millions de décès, dont la majorité sont des enfants 1. Ceci est une cause majeure de préoccupation pour les responsables de la santé publique et les décideurs politiques. Dans un effort pour enquêter sur les expositions et les maladies associées à l' origine hydrique et d' autres agents pathogènes environnementaux, nous avons développé un dosage immunologique multiplex pour mesurer les anticorps dans les échantillons humains 2-4. Cette méthode peut être appliquée à des études épidémiologiques pour déterminer l'exposition humaine à ces agents pathogènes et de mieux définir les infections de immunoprevalence et incidents.
Saliva est très prometteur comme alternative au sérum pour la recherche de biomarqueurs humains. Parmi les avantages de l' utilisation de la salive sont les non-invasivité et la facilité de prélèvement d'échantillons, à faible coût, et les échantillons peuvent être facilement recueillies auprès des enfants 5-7 </ Sup>. Des échantillons de sérum et de salive ont été largement étudiés pour les anticorps contre H. pylori 2,3,8, Plasmodium falciparum 9, Entamoeba histolytica 10, Cryptosporidium parvum 3,11, Streptococcus pneumonie 12, hépatite virus A et C 13-14, norovirus 2-4,15, T. gondii 2-4, le virus de la dengue 16, le virus de l' immunodéficience humaine (VIH) 17 et Escherichia coli O157: H7 18.
Un dosage immunologique multiplex permet l'analyse de plusieurs analytes simultanément dans un volume d'échantillon unique et dans un seul cycle ou courir. Antigènes multiplexés de C. jejuni, T. gondii, H. pylori, l' hépatite A virus, et deux norovirus ont été utilisés pour mesurer la salive humaine IgG et IgA 2-4 3,4 et plasma IgG 2,3 réponses d'anticorps à ces agents pathogènes en utilisant unà base de billes de dosage immunologique multiplexage. Lorsqu'il est utilisé en conjonction avec des études épidémiologiques de l'exposition aux microbes dans l'eau, le sol et la nourriture, le type de dosage décrit dans cette étude peut fournir des informations précieuses pour améliorer la compréhension des infections causées par des pathogènes environnementaux. En outre, les données d' anticorps salivaires obtenues à partir de ces études peuvent être utilisées pour améliorer les modèles d'évaluation des risques 19-22.
Protocole
L'approbation a été obtenue à partir de l'Institutional Review Board (IRB # 08-1844, University of North Carolina, Chapel Hill, NC, USA) pour la collecte des échantillons de salive créviculaire stimulés de baigneurs à Boquerón Beach, Puerto Rico, dans le cadre des États-Unis Environmental protection Agency (EPA) nationale épidémiologique et évaluation environnementale des loisirs (NEEAR) étude sur l' eau 23 pour évaluer les expositions et les maladies de natation associée. Les sujets ont donné leur consentement éclairé et ont été informés sur l'utilisation du dispositif de collecte de salive par des entrepreneurs USEPA formés. Les échantillons de salive ont été expédiés sur de la glace et, à la réception, ils ont été centrifugés et conservés à -80 ° C comme décrit 4.
1. Bead Activation
- Remettre en suspension les stocks de billes par vortex et sonication pendant 20 s et le transfert d' environ 5,0 x 10 6 des perles de stock (400 pi) à des tubes de microcentrifugation.
Remarque: Til billes sont fournies à une concentration de 12,5 x 10 6 billes / ml. - Sédimenter les billes de licence par centrifugation à 10 000 x g pendant 2 min.
- Eliminer le surnageant et remettre en suspension les billes sous forme de granulés dans 100 ul d' eau distillée (dH 2 O) par vortex et sonication pendant 20 secondes. Répétez l'étape 1.2.
- Eliminer le surnageant et remettre en suspension les billes lavées dans 80 ul d'mM de phosphate de sodium monobasique 100, pH 6,2 par vortex et sonication pendant 20 secondes.
- Immédiatement avant utilisation, faire un 50 mg / ml N -hydroxysulfosuccinimide (Sulfo-NHS) solution en ajoutant 200 pi de dH 2 O à 10 mg Sulfo-NHS aliquote. Mélanger par vortex.
- Ajouter 10 ul de 50 mg / ml Sulfo-NHS à billes. Mélanger par vortex.
- Immédiatement avant utilisation, faire un / ml 1-éthyl- [3dimethylaminopropyl] carbodiimide 50 mg (EDC) de la solution par addition de 200 pi d' eau distillée (dH 2 O) à 10 mg EDC aliquote. Mélanger par vortex.
- Ajouter 10 ul de 50mg / ml solution EDC aux billes. Mélanger par vortex. Incuber les billes pendant 20 minutes à la température ambiante, dans l'obscurité, avec un mélange par tourbillon à des intervalles de 10 min. Pellet les billes activées par microcentrifugation à 10 000 g pendant 2 min.
- Eliminer le surnageant et remettre en suspension les billes dans 250 pl d'mM d' acide 2- [N - morpholino] éthanesulfonique acide 50 (MES), pH 5,0 par vortex et sonication pendant 20 secondes.
- Pellet les billes activées par microcentrifugation à 10 000 g pendant 2 min.
- Répétez les étapes 1.9 et 1.10.
Note: Ceci permet d'obtenir un total de deux lavages avec du MES 50 mM, pH 5,0. - Remettre en suspension les billes dans 100 pl d'mM de MES, pH 5,0 50 par vortex et sonication pendant 20 secondes.
2. Perle Couplage
- Coupler les antigènes vers les ensembles de billes en utilisant les concentrations indiquées dans le tableau 1.
- Ajouter chaque antigène aux billes activées et amener le volume total à 500 ul dans du MES 50 mM, pH 5,0. Mélanger les antigènes d'perles d par vortex.
- Incuber les antigènes et les billes pendant 2 h avec un mélange par rotation (~ 15 min) à la température ambiante dans l'obscurité. Sédimenter les billes couplées par microcentrifugation à 10 000 x g pendant 2 min.
- Eliminer le surnageant et remettre en suspension les billes dans 500 pl de tampon phosphate salin (PBS), l'albumine de sérum -bovine (BSA), le monolaurate -polyoxyethylenesorbitan (Tween-20) -sodium azoture (PBS-TBN), pH 7,4 par vortex et sonication. Pellet les billes par microcentrifugation à 10 000 xg pendant 2 minutes et retirer le surnageant.
Attention: L'azoture de sodium est un produit chimique extrêmement toxique. Il est mortel en cas d'ingestion ou prend contact avec la peau. Ne pas respirer les poussières / fumées / gaz / brouillards / vapeurs ou aérosols. Porter un équipement de protection individuelle approprié (EPP) lors de la manipulation et de l'éliminer conformément aux lois appropriées. - Resuspendre les billes dans 1 ml de PBS-TBN par vortex et sonication pendant 20 secondes.
- Sédimenter les billes par microcentrifugation à 10 000 x g pendant 2 min.
- Répétez les étapes 2.5 et 2.6.
Note: Ceci permet d'obtenir un total de deux lavages avec du PBS-TBN. - Remettre en suspension les billes couplées et lavées dans 1 ml de PBS, 1% de BSA, 0,05% d'azoture, pH 7,4. Stocker les billes couplées dans un réfrigérateur C 2-8 ° dans l'obscurité.
3. Count Bead
- Préparer une dilution 1:10 des billes couplées à de l'eau ou du tampon PBS.
- Charge 10 pi de la dilution de talon sur un hémocytomètre au point d'introduction d'échantillon.
- Comptez les perles vu dans l'une des grilles 4 x 4 de coin. Calculer le nombre total de billes couplées à l' aide de la formule suivante: Décompte (1 coin de la grille 4 x 4) x (1 x 10 4) x (facteur de dilution) x resuspension volume en millilitres.
4. Confirmation de l'antigène de couplage
- Remettre en suspension le mélange des stocks de billes couplées à des antigènes d'intérêt par vortex et sonication pendant 20 sec.
- Préparer un mélange de travail de perles en diluant les stocks de billes couplées à une finaleconcentration de 100 perles / ul de chaque perle unique situé dans PBS-1% de tampon BSA (PBS-BSA 1%, pH 7,4).
- Préparer au moins 7 à deux dilutions d'anti-espèces anticorps primaire IgG selon les recommandations du fabricant en plaque de 96 puits à fond rond avec du tampon PBS-BSA 1%.
- Pré-humidifier une colonne de 8 puits séparés (8 rangées) d'un filtre plaque de fond de 96 puits pour chaque test de confirmation de couplage de l'antigène avec 100 pi de tampon de lavage et retirer le surnageant par le vide. Ajouter 50 pi de mélange de perles de travail (billes d'antigène couplé) aux puits pré-mouillées.
- Ajouter 50 ul de dilutions d' anticorps à des lignes 1-7 de chaque colonne de la plaque filtrante à 96 puits et 50 ul de tampon PBS-BSA 1% à la ligne 8 à la place d'anticorps dilué à servir de puits de fond. Mélanger avec une pipette multi-canaux par pipetage de haut en bas 5 fois. Effectuez la même procédure pour chaque perle ensemble de l'antigène couplé à confirmer.
- Couvrir et laisser incuber dans l'obscurité à la température ambianterature pendant 1 h sur un agitateur de microplaque à 500 tours par minute. Retirer le surnageant par le vide.
- Laver les puits avec 100 ul de tampon de lavage et retirer le surnageant par le vide. Répéter 1x. Remettre en suspension les billes dans 50 pl de PBS-BSA à 1% avec un pipetteur multi-canal.
- Diluer anti-espèce anticorps de détection biotinylé secondaire IgG spécifique à 16 pg / ml dans du PBS-BSA à 1%.
- Ajouter 50 pi d'anticorps secondaire dilué dans chaque puits par pipetage de haut en bas 5 fois.
- Recouvrir la plaque filtrante et laisser incuber dans l'obscurité à température ambiante pendant 30 min sur un agitateur de plaque. Retirer le surnageant par le vide. Laver les puits avec 100 ul de tampon de lavage et retirer le surnageant par le vide. Répétez lavage 1x.
- Remettre en suspension les billes dans 50 pl de PBS-BSA à 1% avec un pipetteur multi-canal.
- Diluer la streptavidine-R-phycoérythrine rapporteur (SAPE) à 24 pg / ml dans du PBS-BSA à 1%.
- Ajouter 50 ul de reporter à chaque puits et mélanger par pipetage de haut en bas 5 fois.
- Cau-dessus de la plaque filtrante et laisser incuber dans l'obscurité à température ambiante pendant 30 min sur un agitateur de plaque. Retirer le surnageant par le vide. Laver les puits avec 100 ul de tampon de lavage et retirer le surnageant par le vide. Répétez lavage 1x.
- Resuspendre les billes dans 100 pl de PBS-BSA à 1% et à analyser 50 ul en utilisant l'analyseur 29.
Note: Les résultats de l'analyse immunologique multiplex à base de perles sont mesurées en intensité de fluorescence médiane (MFI). Toujours se référer à la dernière version du manuel du logiciel, si disponible pour éviter les erreurs.
5. salivaire Multiplex Immunoassay
- Retirer la salive du congélateur à -80 ° C et laisser décongeler à température ambiante.
- un antigène couplé resuspendre les stocks de billes par vortex et sonication pendant 20 secondes.
- Préparer un mélange de perles de travail en diluant les stocks de perles couplées à une concentration finale de 100 perles / ul de chaque jeu de billes unique dans un tampon PBS-1% BSA.
- Préparer une dilution 1: 4 en poids de la saliveith PBS-1% de tampon de BSA dans un 96 puits, plaque de puits profonds.
- plaque de filtre pré-humide avec 100 pi de tampon de lavage et retirer le surnageant par le vide.
- Ajouter 50 ul d'un mélange de perles de travail et un volume égal de la salive diluée à 95 puits des plaques à 96 puits de filtre pour un rapport 1: 8 dilution finale. Mélanger les réactions avec un pipetteur multi-canal. Pour une commande bien, ajouter 50 perles d'antigène couplé ul plus 50 pi de tampon PBS-BSA à 1% (en remplacement de la salive).
- Couvrir et laisser incuber dans l'obscurité à température ambiante pendant 1 h sur un agitateur de microplaque à 500 tours par minute. Retirer le surnageant par le vide. Laver les puits avec 100 ul de tampon de lavage et retirer le surnageant par le vide. Répétez lavage 1x.
- Resuspendre les billes dans 50 pl de PBS-BSA à 1% avec un pipetteur multi-canal.
- Diluer l'IgG anti-humain de l'anticorps de détection secondaire biotinylé de chèvre à 16 pg / ml dans du PBS-BSA à 1%.
- Ajouter 50 ul dilué anticorps secondaire à chaque puits et mélanger le contenu avecun pipetteur multi-canal.
- Recouvrir la plaque filtrante et laisser incuber dans l'obscurité à température ambiante pendant 30 min sur un agitateur de plaque. Retirer le surnageant par le vide. Laver les puits avec 100 ul de tampon de lavage et retirer le surnageant par le vide. Répétez lavage 1x.
- Resuspendre les billes dans 50 pl de PBS-BSA à 1% avec un pipetteur multi-canal.
- Diluer la streptavidine-R-phycoérythrine rapporteur (SAPE) à 24 pg / ml dans du PBS-BSA à 1%.
- Ajouter 50 ul reporter à chaque puits et mélanger avec une pipette multi-canaux.
- Recouvrir la plaque filtrante et laisser incuber dans l'obscurité à température ambiante pendant 30 min sur un agitateur de plaque. Retirer le surnageant par le vide. Laver les puits avec 100 ul de tampon de lavage et retirer le surnageant par le vide. Répétez lavage 1x.
- Resuspendre les billes dans 100 pl de PBS-BSA à 1% et à analyser 50 ul en utilisant l'analyseur 29.
Note: Les résultats de l'analyse immunologique multiplex sont mesurées en Median Fluorescence Intensity (MFI) unités. Toujours se référer àla dernière version du manuel du logiciel, si disponible pour éviter les erreurs.
Résultats
Un jeu de billes unique a été utilisé comme témoin pour mesurer la liaison non spécifique et de l'échantillon à la variabilité de l'échantillon. Ces billes ont été traitées de manière identique à l'antigène billes couplées à l'exception qu'ils ne sont pas mises en incubation avec un antigène dans l'étape de couplage. Les valeurs MFI> 500 obtenues à partir des billes témoins incubées avec les échantillons de salive ont été prélevés à partir d'autres analyses en raison d'une contamination suspectée à partir de sérum et les autres réponses ont été log distribués. La salive peut être contaminée avec du sérum si les gencives sont frottés trop vigoureusement avec l'éponge fixée au dispositif de collecte ou si le participant à l'étude a une maladie parodontale. Le journal transformé les données des IMF ont été utilisés pour calculer un point de coupure immunopositif de 505 IMF basé sur la moyenne plus 3 écarts-types des valeurs de MFI du journal. En outre, des billes d'antigène couplé ont été ajoutés à des puits spécifiques qui ont été traités comme des puits d'essai de toutes les manières, sauf dilsalive bué a été remplacé par du PBS-BSA à 1% pour évaluer la fluorescence de fond et de la réactivité croisée. Les valeurs de MFI obtenues dans ces puits de fond ont été soustraites des valeurs de MFI de chaque ensemble de billes d'antigène couplé pour chaque échantillon de salive.
couplage Perle a été confirmée par des animaux provenant d'espèces-anticorps spécifiques de détection primaires spécifiques pour chaque antigène. Pour veiller à ce que les billes d'antigène couplé étaient capables d'approcher la plage dynamique de l'essai, nous avons défini un couplage approprié comme un ≥18,000 MFI, l' observation de la réponse de la dose et de la réactivité croisée entre les anticorps primaires et non-cibles de <10% comme décrit 2 . Confirmations de couplage représentatifs pour C. jejuni et T. gondii des antigènes présents dans l'essai sont présentés sur la figure 1.
Basé sur le point de coupure établie (505 IMF), le taux de immunoprevalences pour les échantillons (n = 2078) varie entre environ 2% (n = 41) pour T. gondii à près de 50% (n = 1,009) pour le norovirus GI.1 (figure 2). Les données indiquent que le taux de immunoprevalence a été le plus élevé des norovirus suivie par l' hépatite A et H. pylori.
Tandis que 32% (n = 672) des échantillons étaient immunonegative pour tous les agents pathogènes présents dans l'essai, 68% (n = 1406) étaient immunopositives à un ou plusieurs agents pathogènes. La figure 3 montre la répartition des immunopositivité à une ou plusieurs des agents pathogènes.
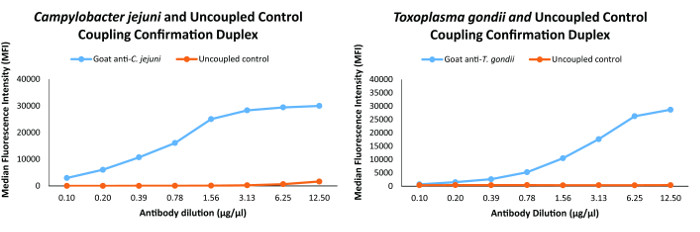
Le couplage des analyses de confirmation pour deux des organismes présents dans l'immuno - essai multiplex confirmation de couplage a été effectuée pour tous les antigènes et les graphiques pour C.: la figure 1. jejuni et T. gondii dans cette figure sont représentant des confirmations de couplage pour les antigènes dans le dosage immunologique multiplex. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
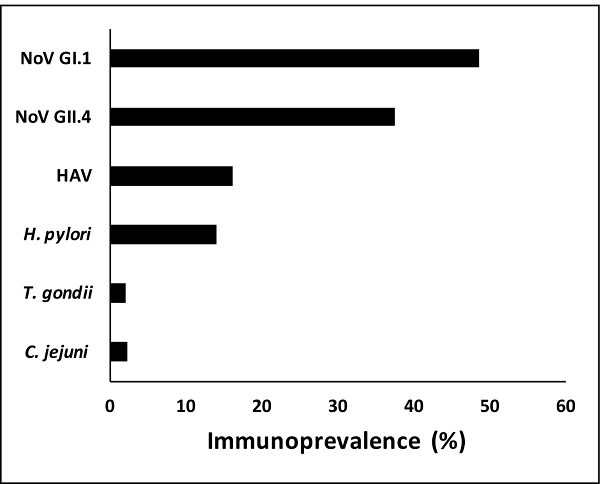
Figure 2:. Immunoprevalence à des agents pathogènes spécifiques Immunoprevalence à des pathogènes spécifiques dans le dosage immunologique multiplex varie d'environ 2% pour T. gondii à près de 50% pour les norovirus GI.1. Les anticorps dirigés contre les antigènes de norovirus ont été plus fréquemment observés suivis par HAV (hépatite A) et H. pylori. Toxoplasma gondii et C. anticorps jejuni sont apparus moins fréquemment dans les échantillons de salive analysés. S'il vous plaît cliquer ici pour voir une version agrandie de thest la figure.

Figure 3:. Répartition des immunopositivité de pathogènes multiples simultanément le dosage immunologique multiplexe permet l'analyse de immunopositivité à des agents pathogènes multiples simultanément dans un volume d'échantillon de 50 ul. Près d'un tiers des échantillons de salive analysés était immunonegative pour les anticorps contre tous les antigènes dans le multiplex. Environ 31% des échantillons était immunopositif pour un antigène tandis qu'un quart était positif à deux antigènes. 9,4% étaient immunopositives à trois antigènes. 3% était positif à quatre ou plusieurs antigènes simultanément. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
| Antigène | Bead Set | Un tampon de couplage | Ag Concentration (pg) | Nombre de billes dans 1 coin | Nombre de billes / ul | Vol. pour 100 B / uL pour 4 ml (pi) |
| C. jejuni | 8 | MES 5.0 | 50 | 64 | 6400 | 94 |
| H. pylori | 33 | MES 5.0 | 25 | 71 | 7100 | 85 |
| Hépatite A | 42 | MES 5.0 | 100 | 91 | 9100 | 66 |
| T. gondii | 30 | MES 5.0 | 25 | 85 | 8500 | 71 |
| norovirus GII.4 | 55 | MES 5.0 | 5 | 72 | 7200 | 83 |
| norovirus GI.1 | 67 | MES 5.0 | 5 | 63 | 6.300 | 95 |
| Déconnectées | 80 | MES 5.0 | 60 | 6000 | 100 | |
| Le volume total de billes (ul) | 594 | |||||
| Le volume total de tampon nécessaire (ul) | 3406 | |||||
Tableau 1:. Travailler talon mélange pour le dosage immunologique multiplex Après le couplage et la confirmation ont été achevées, un mélange maître constitué de chaque ensemble de billes a été préparé comme indiqué. Le mélange maître a été réparti entre unell des puits dans la plaque de 96 puits. Tous les puits ont été incubées avec de la salive, à l'exception d'un puits de contrôle d'arrière-plan qui ne contenait que des perles et du tampon PBS-BSA 1%.
Discussion
Ces résultats indiquent que la méthode d'immuno-essai multiplex est utile pour établir une discrimination entre des échantillons de salive qui sont immunopositif ou immunonegative. Pour déterminer immunopositivité, un seul point de coupure a été développé par le calcul de la moyenne plus trois écarts-types des journaux transformé IMF réponses des perles découplées de contrôle testés avec tous les échantillons de salive. Le point de coupure a donné la capacité d'évaluer l'exposition et immunoprevalence soit à un seul ou plusieurs agents pathogènes. Ce pouvoir discriminant peut être utile dans les études de population pour enquêter sur les risques sanitaires associés à l'exposition à des agents pathogènes environnementaux et autres.
Il existe plusieurs autres méthodes qui peuvent être utilisées pour déterminer un point de coupure en fonction de la répartition des IMF, les contrôles découplées et quelle question l'étude est conçue pour répondre. Quelques exemples pour la détermination de seuils comprennent finie modélisation mixte 24-26, signifient plus 3les écarts types de réponses aux commandes, la moyenne plus 2 écarts - types de réponses aux commandes, et trois fois la moyenne des réponses aux commandes 27,28. Pour des projections simples, des critères moins stricts peuvent être utilisés, mais pour les études épidémiologiques, il peut être plus approprié d'employer une définition plus stricte pour réduire la probabilité de déclarer faux positifs. Notre première demande est de regarder immunoconversion et immunoprevalence entre les nageurs et les non-nageurs. Dans cette étude, les IMF de contrôle découplées ne sont pas normalement distribués et les résultats ont été transformés journal.
Avantages pour effectuer un dosage immunologique multiplex à base de perles comprennent l'utilisation de volumes d'échantillons très faibles, la réduction du temps et du travail et la capacité de mesurer les réponses jusqu'à 500 analytes simultanément tout en exigeant une quantité minimale de réactifs. En revanche, les méthodes traditionnelles d'évaluation des niveaux d' anticorps indicatives d'exposition et / ou une infection (par exemple , , le test ELISA) peut prendre plusieurs heures pour terminer, sont de main-d'œuvre, et ne peut être utilisé pour mesurer un analyte à la fois. Ces méthodes traditionnelles exigent également de plus grands volumes d'échantillons du patient / participant. Par exemple, la plupart ELISA nécessitent au moins 100 pi d'échantillon alors qu'un dosage immunologique multiplex peut exiger 50 pi ou moins.
Limitations d'un dosage immunologique multiplex comprennent la nécessité d'une optimisation rigoureuse afin de déterminer les concentrations optimales de capture primaire et des anticorps de détection secondaires, des antigènes et reporter. La réactivité croisée est également une préoccupation majeure dans les immunoessais que des anticorps contre un antigène particulier peuvent réagir de façon croisée avec des antigènes provenant d'autres organismes et ainsi conduire à des faux positifs. Optimisation, réactivité croisée et la liaison non spécifique ont été abordées précédemment 2-4. Le succès d'un tel test est largement tributaire de la capacité d'obtenir des antigènes hautement immunogènes ainsi que Antibo spécifiquemeurt à ces antigènes destinés à être utilisés dans l'assemblage de talon et de confirmation d'accouplement étapes. Une autre limite est la disponibilité limitée des échantillons caractérisés (diagnostic positif et négatif) pour valider les essais.
Il existe un certain nombre d'étapes critiques dans le protocole. Ceux-ci comprennent: assurer les antigènes qui seront couplés à des billes ne contiennent pas de protéines étrangères, de l'azoture, la glycine, le Tris ou d'amines primaires. Si l'un de ces agents existent dans la préparation d'antigènes, ils doivent être éliminés par dialyse ou Chromatographie. Il est recommandé que l'on devrait commencer avec 5 pg d'antigène par 5 millions de perles et titrez pour trouver la concentration optimale. Choisissez la concentration d'anticorps de détection optimale qui donne la meilleure sensibilité et une plage dynamique. Gardez à l'esprit que les signaux ont tendance à diminuer à mesure que les concentrations d'anticorps de l'antigène et de détection augmentation (effet crochet). Par exemple, si le signal diminue à mesure que la concentration augmente ensuite l'antigène détectentanticorps ionique peut être limitatif. A l'inverse, si les signaux diminuent à mesure que l'anticorps de détection augmente alors reporter (SAPE) peut être limitative. Vérifiez le multiplex pour la réactivité croisée en combinant le couplage optimal pour chaque protéine (5000 de chaque perle fixé par puits). Testez les ensembles de billes multiplexées par combinaison avec la quantité optimale d'anticorps de détection. Optimisez le journaliste et faire une courbe standard de l'antigène en testant chaque antigène individuellement.
Dépannage d'un dosage immunologique multiplex pour améliorer la sensibilité et d'augmenter le signal médian fluorescent sont d'une importance cruciale. Pour améliorer la sensibilité, soit diminuer la quantité d'antigène couplé aux billes ou de la concentration d'anticorps de détection. L'utilisation d'un anticorps d'affinité plus élevée pour la capture et / ou de détection peut également améliorer la sensibilité. L'augmentation de la quantité d'antigène couplé aux billes peut augmenter le signal fluorescent médian. Une étude a démontré que la pré-incubation des échantillons de sérum avec polyvinylalCohol ainsi polyvinylpyrrolidone (PVX) tampon est capable de supprimer la liaison non spécifique dans des tests sérologiques utilisant la base de perles test multiplex 30 tel que celui que nous décrivons ici. Cependant, une autre étude par nos collaborateurs n'a trouvé aucun effet significatif entre PBS-BSA et PVX tampons. Ils ont conclu en outre qu'en raison de la viscosité élevée du tampon de PVX, il crée des problèmes avec l' acquisition bourrelet dans l'analyseur et la mousse formée dans les puits de microplaques 3.
En conclusion, nous avons présenté un procédé qui est capable de mesurer la présence d'anticorps IgG salivaires humaines à des agents pathogènes multiples simultanément dans un très petit volume d'échantillon. Dans l'avenir, ce test sera utilisé pour détecter la présence d'anticorps salivaires associés à des expositions ou des infections de natation connexes et pour aider à informer les modèles d'évaluation des risques. En outre, le test peut être utilisé pour mesurer les anticorps associés à l'air et d'origine alimentaire Exposures, de déterminer les infections incidentes ou immunoconversions et fournir des informations critiques immunologique aux épidémiologistes qui mènent des études de population de type questionnaire.
Déclarations de divulgation
L'Agence américaine pour la protection de l'environnement par le biais de son Bureau de recherche et de développement financé et géré la recherche décrite ici. Il a été soumis à l'examen administratif de l'Agence et approuvé pour publication. La mention d'appellations commerciales ou de produits commerciaux ne constitue pas une approbation ou une recommandation pour l'utilisation.
Remerciements
Clarissa Curioso was supported through an appointment to the Research Participation Program at the U.S. Environmental Protection Agency administered by the Oak Ridge Institute for Science and Education through an interagency agreement between the U.S. Department of Energy and U.S. EPA.
matériels
| Name | Company | Catalog Number | Comments |
| Equipment and Software | |||
| Microcentrifuge | Thermo Electron Corporation | 75002446 | Used to centrifuge samples |
| Vortex Mixer | VWR | G560 | Used to mix samples |
| Sonicator (mini) | Fisher Scientific | 15-337-22 | Used to separate beads |
| Pipettors P10, P20, P100, P1000, 8 ch. | Capp | Various | |
| Hemacytometer (Bright Line) | Housser Scientific | 3200 | Used to count coupled beads |
| Multiscreen Vacuum Manifold | Millipore | MSVMHTS00 | Used in washing steps to remove supernatant |
| MicroShaker | VWR | 12620-926 | Used to agitate beads during incubations |
| Tube rack (1.5 ml and 0.5 ml) (assorted) | VWR | 30128-346 | |
| Weighing Scale | Mettler or other | Used to measure wash reagents for making buffers | |
| Dynabead Sample Mixer | Invitrogen | 947-01 | Used during coupling incubation step |
| MatLab (R2014b) | The MathWorks, Inc. | Used to analyze antibody response data | |
| Microsoft Excel 2014 | Microsoft Corporation | Used to analyze antibody response data | |
| Luminex Analyzer with xPonent 3.1 software | Luminex Corporation | LX200-XPON3.1 | Instrument and software used to run assay |
| Antigens | |||
| GI.1 Norwalk Virus: p-particle | Xi Jiang (CCHMC)* | NA | *Cincinnati Childrens' Hospital. Final conc. 5 µg. |
| GII.4 Norovirus VA387: p-particle | Xi Jiang (CCHMC)* | NA | *Cincinnati Childrens' Hospital. Final conc. 5 µg. |
| Hepatitis A Virus: grade II concentrate from cell culture | Meridian Life Sciences | 8505 | Antigen coupled at 100 µg |
| Helicobacter pylori: lysate | Meridian Life Sciences | R14101 | Antigen coupled at 25 µg |
| Toxoplasma gondii: recombinant p30 (SAG1) | Meridian Life Sciences | R18426 | Antigen coupled at 25 µg |
| Campylobacter jejuni: heat killed whole cells | KPL | 50-92-93 | Antigen coupled at 50 µg |
| Primary Antibodies | |||
| Guinea pig anti-Norovirus | (CCHMC)* | NA | Used for coupling confirmation |
| Mouse anti-Hepatitis A IgG | Meridian Life Sciences | C65885M | Used for coupling confirmation |
| Mouse anti-Hepatitis A IgG | Meridian Life Sciences | C65885M | Used for coupling confirmation |
| BacTraceAffinity Purified Antibody to Helicobacter pylori | KPL | 01-93-94 | Used for coupling confirmation |
| Goat pAb to Toxoplasma gondii | Abcam | Ab23507 | Used for coupling confirmation |
| BacTrace Goat anti-Campylobacter species | KPL | 01-92-93 | Used for coupling confirmation |
| Secondary Antibodies | |||
| Biotin-SP-Conjugated AffiniPure Donkey anti-Goat IgG (H+L) | Jackson | 705-065-149 | Used for coupling confirmation |
| Biotinylated Rabbit anti-Goat IgG (H+L) | KPL | 16-13-06 | Used for coupling confirmation |
| Biotinylated Goat anti-Mouse IgG (H+L) | KPL | 16-18-06 | Used for coupling confirmation |
| Affinity Purified Antibody Biotin Labeled Goat anti-Rabbit IgG (H+L) | KPL | 176-1506 | Used for coupling confirmation |
| Consumables | |||
| 1.5 ml copolymer microcentrifuge tubes | USA Scientific | 1415-2500 | Used as low binding microcentrifuge tubes |
| 10 µl pipette tip refills | BioVentures | 5030050C | |
| 200 µl pipette tip refills | BioVentures | 5030080C | |
| 1,000 µl pipette tip refills | BioVentures | 5130140C | |
| Aluminum foil | Various Vendors | Used keep beads in the dark during incubations | |
| Deep Well plates | VWR | 40002-009 | Used for diluting saliva samples |
| Multiscreen Filter Plates | Millipore | MABVN1250 | Used to run assays |
| Oracol saliva collection system | Malvern Medical Developments Limited | Used for saliva collection | |
| Reagents | |||
| Carboxylated microspheres (beads) | Luminex Corporation | Dependent on bead set | Antigens are coupled to the microspheres |
| EDC (1-ethyl-3-[3-dimethylaminopropyl] carbodiimide hydrochloride) | Pierce | 77149 or 22980 | Used in bead activation |
| Sulfo-NHS (N-hydroxysulfosuccinimide) | Pierce | 24510 | Used in bead activation |
| Steptavidin-R-phycoerythrin (1 mg/ml) | Molecular Probes | S-866 | Used as reporter |
| MES (2-[N-Morpholino]ethanesulfonic acid) | Sigma | M-2933 | Used for coupling |
| Tween-20 (Polyoxyethylenesorbitan monolaurate) | Sigma | P-9416 | Used in wash buffer to remove non-specific binding |
| Protein Buffers | |||
| PBS-TBN Blocking/ Storage Buffer (PBS, 0.1% BSA, 0.02% Tween-20, 0.05% Azide, pH 7.4)** | Filter Sterilize and store at 4 °C | ||
| PBS, pH 7.4 | Sigma | P-3813 | 138 mM NaCl, 2.7 mM KCl |
| BSA | Sigma | A-7888 | 0.1% (w/v) |
| Tween-20 | Sigma | P-9416 | 0.2% (v/v) |
| Sodium Azide (0.05% azide)** | Sigma | S-8032 | **Caution: Sodium azide is acutely toxic. Avoid contact with skin and eyes. Wear appropriate PPE's. Dispose of according to applicable laws. |
| MES/Coupling Buffer (0.05 M MES, pH 5.0) | |||
| MES (2-[N-Morpholino]ethanesulfonic acid) | Sigma | S-3139 | |
| 5 N NaOH | Fisher | SS256-500 | |
| Assay Buffer (PBS, 1% BSA, pH 7.4) | Filter Sterilize and store at 4 °C | ||
| PBS, 1% BSA, pH 7.4 | Sigma | P-3688 | 138 mM NaCl, 2.7 mM KCl, 1% BSA |
| Activation Buffer (0.1 M NaH2PO4, pH 6.2) | Filter Sterilize and store at 4 °C | ||
| NaH2PO4 (Sodium phosphate, monobasic anhydrous) | Sigma | S-3139 | 0.1 M NaH2PO4 |
| 5 N NaOH | Fisher | SS256-500 | |
| Wash Buffer (PBS, 0.05% Tween-20, pH 7.4) | Filter Sterilize and store at 4 °C | ||
| PBS, 0.05% Tween-20, pH 7.4 | Sigma | P-3563 | 138 mM NaCl, 2.7 mM KCl, 0.05% TWEEN |
Références
- Prüss-Üstün, A., Gore, F., Bartram, J. . Safer water, better health: costs, benefits and sustainability of interventions to protect and promote health. , (2008).
- Augustine, S., et al. Statistical approaches to developing a multiplex immunoassay for determining human exposure to environmental pathogens. J Immunol Methods. 425, 1-9 (2015).
- Griffin, S., et al. Application of salivary antibody immunoassays for the detection of incident infections with Norwalk virus in a group of volunteers. J Immunol Methods. 424, 53-63 (2015).
- Griffin, S., Chen, I., Fout, G., Wade, T., Egorov, A. Development of a multiplex microsphere immunoassay for the quantitation of salivary antibody responses to selected waterborne pathogens. J Immunol Methods. 364 (1-2), 83-93 (2011).
- Ferguson, D. Current diagnostic uses of saliva. J Dent Res. 66, 420-424 (1987).
- Mandel, I. The diagnostic uses of saliva. J Oral Pathol Med. 19, 119-125 (1990).
- Malamud, D. Saliva as a Diagnostic Fluid. Brit Med J. 305, 207-208 (1992).
- Ballam, L., et al. Western blotting is useful in the salivary diagnosis of Helicobacter pylori infection. J Clin Pathol. 53, 314-317 (2000).
- Estevez, P., Satoguina, J., Nwakanma, D., West, S., Conway, D., Drakeley, C. Human saliva as a source of anti-malarial antibodies to examine population exposure to Plasmodium falciparum. Malar J. 10, 104 (2011).
- Abd-Alla, M., Jackson, T., Reddy, S., Ravdin, J. Diagnosis of invasive amebiasis by enzyme-linked immunosorbent assay of saliva to detect amebic lectin antigen and anti-lectin immunoglobulin G antibodies. J Clin Microbiol. 38 (6), 2344-2347 (2000).
- Toyoguchi, A., et al. Antibody reactivity to Cryptosporidium parvum in saliva of calves after experimental infection. J Vet Med Sci. 62 (11), 1231-1234 (2000).
- Choo, S., Zhang, Q., Seymour, L., Akhtar, S., Finn, A. Primary and booster salivary antibody responses to a 7-valent pneumococcal conjugate vaccine in infants. J Infect Dis. 182 (4), 1260-1263 (2000).
- Tourinho, R., et al. Importance of the cutoff ratio for detecting antibodies against hepatitis A virus in oral fluids by enzyme immunoassay. J Virol Methods. 173 (2), 169-174 (2011).
- Moorthy, M., Daniel, H., Kurian, G., Abraham, P. An evaluation of saliva as an alternative to plasma for the detection of hepatitis C virus antibodies. Indian J Med Microbiol. 26 (4), 327-332 (2008).
- Moe, C., Sair, A., Lindesmith, L., Estes, M., Jaykus, L. Diagnosis of norwalk virus infection by indirect enzyme immunoassay detection of salivary antibodies to recombinant norwalk virus antigen. Clin Diagn Lab Immunol. 11 (6), 1028-1034 (2004).
- Yap, G., Sil, B., Ng, L. Use of saliva for early dengue diagnosis. PLoS Negl Trop Dis. 5 (5), e1046 (2011).
- Schramm, W., Angulo, G., Torres, P., Burgess-Cassler, A. A simple saliva-based test for detecting antibodies to human immunodeficiency virus. Clin Diagn Lab Immunol. 6 (4), 577-580 (1999).
- Chart, H., Perry, N., Willshaw, G., Cheasty, T. Analysis of saliva for antibodies to the LPS of Escherichia coli O157 in patients with serum antibodies to E. coli O157 LPS. J Med Microbiol. 52 (Pt 7), 569-572 (2003).
- Ashbolt, N., Bruno, M. Application and refinement of the WHO risk framework for recreational waters in Sydney, Australia. J Water Health. 1 (3), 125-131 (2003).
- Westrell, T., Schonning, C., Stenstrom, T., Ashbolt, N. QMRA (quantitative microbial risk assessment) and HACCP (hazard analysis and critical control points) for management of pathogens in wastewater and sewage sludge treatment and reuse. Water Sci Technol. 50 (2), 23-30 (2004).
- Ashbolt, N. Microbial contamination of drinking water and disease outcomes in developing regions. Toxicology. 198 (1-3), 229-238 (2004).
- Eisenberg, J., Soller, J., Scott, J., Eisenberg, D., Colford, J. A dynamic model to assess microbial health risks associated with beneficial uses of biosolids. Risk Anal. 24, 221-236 (2004).
- Wade, T. J., et al. . Report on 2009 National Epidemiologic and Environmental Assessment of Recreational Water Epidemiology Studies, US EPA. US EPA Report Number: EPA/600/R-10/168: US EPA2011. , (2011).
- Fujii, Y., et al. Serological surveillance development for tropical infectious diseases using simultaneous microsphere-based multiplex assays and finite mixture models. PLoS Negl Trop Dis. 8, e3040 (2014).
- Rota, M., Massari, M., Gabutti, G., Guido, M., De Donno, A., Ciofi degli Atti, M. Measles serological survey in the Italian population: interpretation of results using mixture model. Vaccine. 26 (34), 4403-4409 (2008).
- Vyse, A., Gay, N., Hesketh, L., Pebody, R., Morgan-Capner, P., Miller, P. Interpreting serological surveys using mixture models: the seroepidemiology of measles, mumps and rubella in England and Wales at the beginning of the 21st century. Epidemiol Infect. 134 (6), 1303-1312 (2006).
- Baughman, A., et al. Establishment of diagnostic cutoff points for levels of serum antibodies to pertussis toxin, filamentous hemagglutinin, and fimbriae in adolescents and adults in the United States. Clin Diagn Lab Immunol. 11 (6), 1045-1053 (2004).
- Clotilde, L., Bernard, C., Hartman, G., Lau, D., Carter, J. Microbead-based immunoassay for simultaneous detection of Shiga toxins and isolation of Escherichia coli O157 in foods. J Food Prot. 74 (3), 373-379 (2011).
- . . Luminex User Software Manual (RUO) xPONENT 3.1 Rev. 2. 3, 6-102 (2014).
- Waterboer, T., Sehr, P., Pawlita, M. Suppression of non-specific binding in serological Luminex assays. J Immunol Methods. 309 (1-2), 200-204 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon