Method Article
Mucina Agarosio elettroforesi su gel: Western Blotting per glicoproteine ad alto peso molecolare
In questo articolo
Riepilogo
Mucins are high-molecular-weight glycoconjugates, with size ranging from 0.2 to 200 megadalton (MDa). As a result of their size, mucins do not penetrate conventional polyacrylamide gels and require larger pores for separation. We provide a detailed protocol for mucin agarose gel electrophoresis to assess relative quantification and study polymer assembly.
Abstract
Mucine, le proteine pesantemente glicosilata che rivestono le superfici mucose, si sono evoluti come componente chiave di difesa innata proteggendo l'epitelio contro gli agenti patogeni invasori. Il ruolo principale di queste macromolecole è di facilitare la cattura delle particelle e la clearance favorendo la lubrificazione della mucosa. Durante la sintesi proteica, mucine subiscono intensa O-glicosilazione e multimerizzazione, che aumentano notevolmente la massa e le dimensioni di queste molecole. Queste modificazioni post-traduzionali sono critici per le proprietà viscoelastiche del muco. Come risultato della complessa natura biochimica e biofisica di queste molecole, lavorando con mucine fornisce molte sfide che non possono essere superati mediante metodi di analisi proteica convenzionali. Per esempio, il loro alto peso molecolare impedisce migrazione elettroforetica mediante gel di poliacrilammide regolari e la loro natura appiccicosa provoca l'adesione al tubo sperimentale. Tuttavia, indagando il ruolo di mucine nella salute(Ad es., Mantenendo l'integrità della mucosa) e malattia (ad es., Iperconcentrazione, mucostasis, cancro) ha recentemente guadagnato interesse e mucine sono oggetto di indagine come un obiettivo terapeutico. Una migliore comprensione della produzione e della funzione di macromolecole mucina può portare ad approcci farmaceutici innovativi, ad esempio, inibitori di mucina esocitosi di granuli e / o agenti mucolitici. Pertanto, i protocolli coerenti e affidabili per indagare la biologia mucina sono fondamentali per il progresso scientifico. Qui, descriviamo i metodi convenzionali per separare mucina macromolecole mediante elettroforesi utilizzando un gel, il trasferimento della proteina in membrana di nitrocellulosa, e rilevare il segnale con anticorpi specifici mucina così come lettore di gel a fluorescenza a raggi infrarossi. Queste tecniche sono ampiamente applicabile per determinare mucina quantificazione, multimerizzazione e per testare gli effetti dei composti farmacologici su mucine.
Introduzione
Mucine sono normalmente prodotti da superfici mucose che rivestono le cavità esposti all'ambiente esterno (ad es., Respiratorio, digestivo, tratto riproduttivo, superficie oculare), così come gli organi interni (ad esempio, pancreas, della cistifellea, ghiandole mammarie). La presenza di queste glicoproteine mantiene l'idratazione superficiale e forma una barriera fisica contro i patogeni. Anche se la produzione di mucina è essenziale per la salute della mucosa, mucina iperconcentrazione e / o muco aberranti può portare a ostruzione del dotto, la colonizzazione batterica e infiammazione cronica, che può causare danni ai tessuti irreversibili. Un simile cascata di eventi sono stati osservati in diverse malattie, per esempio., La fibrosi cistica 1, otite media cronica 2 e l'infezione cervicovaginale 3. Pertanto, è importante comprendere il ruolo di mucine di salute e di malattia e di stabilire protocolli di routine per l'identificazione di proteine.
Ad oggi, 19 mucine geni sono stati identificati e codificano per grandi catene polipeptidiche che vanno da 1.200 (ad es., MUC1) a 22.000 (per esempio, MUC16) aminoacidi. La famiglia genica mucina può essere divisa in due sottotipi: le mucine associate alla membrana, coinvolte nella segnalazione cellulare e la superficie schermante e le mucine gelificanti, responsabile delle proprietà viscoelastiche del gel muco. mucine associata alla membrana sono per lo più monomerica e allegare alla superficie delle cellule tramite un dominio di membrana-spanning idrofoba. Al contrario, mucine gelificanti possiedono diversi -come e ricche di cisteina domini fattore di von Willebrand (vWF) che sono essenziali per la formazione di reti polimeriche dinamiche. Grandi glicani sono attaccati alla serina e treonina distribuiti in tutto il apomucin. Questi oligosaccaridi densi O-linked possono contribuire fino al 80% del peso molecolare 4. Intra e inter-molecolari legami disolfuro che collegano monomeri mucina garantire l'integrità del networ gel di mucinaK. Come risultato di glicosilazione pesante e multimerizzazione, mucine sono tra le più grandi molecole nel mondo animale e non possono essere analizzati mediante elettroforesi su gel standard utilizzando convenzionale gel SDS-PAGE poliacrilammide e scale proteine standard. Questi metodi risolvono / proteine separate con pesi molecolari inferiori a 250 kDa mentre monomeri mucina possono raggiungere fino a 2 MDa nel caso di MUC16. Tuttavia, scale di proteine ad alto peso molecolare possono essere utilizzati per studiare piccoli monomeri mucina (es., MUC1).
Una varietà di tecniche può essere applicata per studiare dimensioni mucina, conformazione e interazione. Tradizionalmente, caratterizzazione biochimica di mucine si ottiene mucina isolamento tramite isopycnic centrifugazione in gradiente di densità in buffer di denaturazione, seguita da cromatografia dimensione esclusione e immunorilevazione (ad es., Di slot blotting) 5. e / o diffusione della luce multi-angolo dinamico fornire informazioni sullo stato oligomerico di campioni ricchi di mucina 1. Inoltre, centrifugazione rate-zonale accoppiato con immunolocalizzazione e microscopia elettronica a trasmissione sono comunemente utilizzati per determinare la conformazione macromolecolare di mucine 6. La spettrometria di massa è anche usato per quantificare mucine, rilevare taglio proteolitico e analizzare la composizione oligosaccaride 1,7,8. Tali tecniche sono costose, richiede tempo e spesso richiedono grandi volumi e / o alte concentrazioni di campione. La metodologia descritta, ad esempio., Mucina separazione mediante elettroforesi, è riproducibile, a basso costo e può essere usato in studi di alta throughput per fornire relativa mucina quantificazione e indagare assemblaggio polimero. Tuttavia, questo test richiede ad alta affinità, ad alta specificità anticorpi mucina che potrebbero non essere disponibili per rari mucine (ad es., MUC19) o alcune specie (ad es., Maiale, Ferret).
Agarose Western blotting è adatto per risolvere una varietà di campioni ricchi di mucina con concentrazionezioni che vanno da 50 mg / ml (ad es., lavaggi cellulari) a 5 mg / ml (ad es., espettorato). Questo test è stato introdotto nel 1990 ed è stata eseguita solo in pochi laboratori specializzati 9,10. Inizialmente, questa tecnica ha contribuito ad individuare sottopopolazioni di monomeri mucina nelle secrezioni respiratorie dell'uomo 11,12 e confermato il processo di oligomerizzazione in cellule caliciformi, che consiste di formazione dimero nel reticolo endoplasmatico seguita da dimero multimerizzazione nel Golgi 13. Più di recente, la generazione di anticorpi policlonali contro mucine murini facilitato studi su modelli animali di piccole dimensioni (ad es., Mucina deficienti, modelli murini βENaC, OVA-sfidati) e ha aperto un nuovo campo di ricerca per gli studi preclinici composti test farmacologici che mirano a rimuovere il muco dal i polmoni 14-17. Come risultato di un crescente interesse mucina biologia e la generazione di nuovi e più specifici anticorpi mucina, descriviamo herein metodologia per separare mucine mediante elettroforesi su gel di agarosio, trasferimento vuoto nitrocellulosa e rilevazione fluorescente infrarosso bicolore.
Protocollo
1. Preparare buffer per Mucin Gel Western Blotting
- Preparare 1 litro di 50x TAE (Tris-acetato-EDTA) buffer.
- In 700 ml di acqua distillata (dH 2 O) aggiungere 242 g di Tris base (0,4 M), 57,1 g di acido acetico glaciale (pesare liquido) (0,2 M) e 14.61 g di acido etilendiamminotetraacetico (EDTA) (50 mM).
- Regolare il pH a 8,0 e rendere il volume fino a 1 litro con dH 2 O.
- Preparare 10 ml di 10x tampone di caricamento.
- Preparare 5 ml di tampone 1x TAE. A tale scopo, aggiungere 5 ml di glicerolo (50%), 25 mg di blu di bromofenolo (0,25%) e 100 mg di sodio dodecil solfato (SDS) (1%).
- Preparate 2 litri di tampone 20x di sodio citrato di soluzione salina (SSC).
- In 1,5 litri di dH 2 O, aggiungere 350,6 g di NaCl (3 M) e 176,4 g di citrato trisodico (Na 3 C 6 H 5 O 7) (0,3 M). Regolare il pH a 7,0 e portare il volume a 2 litri con dH 2 O.
- Preparare 1 litro di 1x tampone TAE-0.1% SDS.
- Aggiungere 20 ml di 50x TAE a 980 ml di dH 2 O. Aggiungere 1 g di SDS per ottenere una soluzione 0,1% SDS-TAE.
2. TAE-SDS agarosio gel Preparazione
- (. Vale a dire, 150 ml) Versare un volume sufficiente di 1x TAE-0,1% tampone SDS in un pallone di Erlenmeyer nel microonde per fare un 5 - gel di 7 millimetri di spessore. Aggiungere 0,8% (1,2 g) di polvere di agarosio.
- Forno a microonde pallone in intervalli di 30 sec con vorticoso intermittente fino agarosio è completamente sciolto (in genere 1 - 3 min). Usare tamponi mano calda durante questo processo. Fare attenzione di ebollizione eruttiva mentre vorticoso.
- Lasciare che la soluzione di agarosio raffreddare per 5 - 10 minuti. Nota: La soluzione di agarosio sarà pronto per essere versato quando fondo del pallone può essere lasciato sul palmo per 5 sec.
- Preparare vassoio colata elettroforesi (10 x 15 cm) sigillando i bordi con nastro e sistemazione ben pettine in posizione.
- Versare lentamente soluzione di agarosio in tha colata vassoio per evitare la formazione di bolle. Eliminare le bolle utilizzando una punta della pipetta. Attendere il gel raffreddare e solidificare completamente. Una volta solidificato, rimuovere il pettine lentamente per evitare collasso pozzetti mediante aspirazione e rimuovere il nastro dai bordi del vassoio.
- Mettere gel nella casella di gel e riempire l'unità di elettroforesi con 1x TAE-0.1% tampone SDS fino a quando il gel è completamente coperto.
3. Il campione Caricamento e elettroforesi La separazione
Nota: Nel nostro laboratorio, usiamo comunemente campioni sia da mouse e gli esseri umani, tra cui il fluido di lavaggio broncoalveolare (BAL; entrambe le specie), lavaggio delle cellule dalle cellule epiteliali bronchiali umane (HBE), e campioni di saliva e di espettorato umani. I campioni possono essere denaturate in 6 M di urea al momento della raccolta o conservati per brevi periodi di tempo (6 ore) con l'aggiunta di inibitore della proteinasi cocktail.
- Preparare campioni per loading aggiungendo 10% di colorante di caricamento per ciascun campione (es., 30 ml di campione e 3ml di colorante). Omogeneizzare campioni pipettando su e giù. Brevemente spin down tubi a 5.000 giri per raccogliere gocce.
- caricare con cautela uguale volume di campioni nei pozzetti.
- punte Pre-umidi e / o utilizzare pipette spostamento positivo per facilitare il caricamento dei campioni altamente viscosi. Lentamente aspirato 80-90% della soluzione del campione-dye (per esempio, 27 - 30 ml) per evitare le bolle di pipettamento.
- Lentamente caricare al fondo dei pozzetti e progressivamente spostare la punta della pipetta verso l'alto. Per i campioni che rimangono attaccate alla punta della pipetta, dispensare a 45 ° e allungare dritto sopra pozzo o delicatamente utilizzare il lato del pozzo per rompere il muco filante. Non sovraccaricare i pozzi.
- Collegare gli elettrodi dalla scatola gel per il generatore di corrente elettroforesi. Assicurarsi che gli elettrodi siano collegati correttamente (es., Cavo rosso collegato all'uscita positivo del generatore) per consentire negativamente mucine a correre verso il positivo addebitato elettrodo.
- Attivare il gel a 80 Volts per 90 minuti per un singolo gel pettine, o 60 - 75 min per un gel doppio pettine per evitare sovrapposizioni tra le due file.
- SPEGNERE generatore e scollegare gli elettrodi dalla sorgente di alimentazione.
- Rimuovere accuratamente il gel dalla scatola gel con una mano su entrambi i lati del vassoio di colata per garantire il gel rimanga in posizione.
4. Ridurre agarosio gel per un efficiente trasferimento Mucin
- posizionare con cura il piano di gel in un contenitore di vetro. Lavare il gel con dH 2 O per rimuovere le tracce di tampone TAE-SDS.
- Preparare 1 litro di tampone di 4x SSC aggiungendo 200 ml di 20x SSC in 800 ml di dH 2 O. Rendere 200 ml di 10 mM ditiotreitolo (DTT) soluzione 4x SSC aggiungendo 309 mg di fresco DTT in 200 ml di tampone 4x SSC.
- Immergere il gel con tampone DTT-4x SSC e la copertura. Agitare delicatamente per 20 min (10 rotazioni al minuto). Risciacquare gel con DTT-libera tampone 4x SSC.
- Preparare carta assorbente vuoto per il trasferimento.
- Asportare accuratamente membrana di nitrocellulosa a dimensioni leggermente più ampie rispetto al gel (es., 10 x 15 cm).
- Wet tappeto poroso con dH 2 O e posizionarlo liscio-side-up nella carta assorbente.
- Wet membrana di nitrocellulosa con tampone SSC 4x DTT-libero e posizionarlo al centro del tappeto porosa.
- Coprire il tappetino poroso con la guarnizione di gomma, lasciando l'apertura della guarnizione precisamente allineato con la membrana di nitrocellulosa. Se mat porosa è ancora visibile, regolare con cura la membrana per garantire l'assenza divario resta tra la guarnizione e la membrana.
- posizionare accuratamente il gel di agarosio sopra della membrana. Assicurare forma un gel una tenuta ermetica con la guarnizione ed i pozzetti del gel sono posizionati sulla membrana per il trasferimento.
- Evitare la formazione di bolle tra la membrana ed il gel. Per minimizzare laformazione di bolle, spruzzare qualche goccia di 4x SSC tampone sulla membrana e far scorrere il gel da cima a fondo per svuotare eventuali bolle formate. Evitare di spostare il gel sulla membrana proteine inizierà a cancellare immediatamente.
- coprire con cura il gel con il tampone 4x SSC.
- Inizia trasferimento mucina mediante aspirazione.
- Accendere carta assorbente vuoto su e impostare la pressione a 40 - 50 mbar. Aggiungere qualche goccia di tampone 4x SSC sul gel ogni 5 - 10 minuti per evitare che il gel si asciughi. trasferimento Run per 90 min. Opzionale: Al termine, segnare i pozzetti con una matita per l'orientamento.
- Eliminare il gel e recuperare membrana di nitrocellulosa utilizzando pinzette di plastica sul bordo della membrana.
6. Blocco membrana e rilevamento
- Risciacquare membrana immediatamente con soluzione salina 1x tampone fosfato (PBS). Non lasciate che la membrana asciugare.
- Immergere la membrana in 50 ml di 3% di latte-PBS tampone di bloccaggio e posto su un rocker a temperatura ambiente per 1 ora. Dopo l'incubazione, scartare il tampone bloccante.
- Immergere membrana 1% soluzione di anticorpo primario latte-PBS. Incubare la membrana nella soluzione di anticorpo primario durante la notte su una sedia a dondolo a 4 ° C. Dopo l'incubazione, scartare la soluzione di anticorpo primario. Diluire gli anticorpi primari ad un rapporto di 1: 2.000 di soluzione di anticorpi al tampone di bloccaggio. Nota: Per i campioni provenienti da topi, usiamo UNC 222 coniglio anti-Muc5b e capra proteina anti-verde fluorescente (GFP). Per i campioni provenienti da esseri umani, usiamo H300 anti-MUC5B e 45M1 anti-MUC5AC anticorpi primari.
- membrana lavata 3 volte con PBS per 10 minuti su un agitatore meccanico.
- Immergere membrana 1% soluzione di anticorpo secondario latte-PBS. Diluire gli anticorpi secondari ad un rapporto di 1: 7.500 di soluzione di anticorpi tampone bloccante e incubare a temperatura ambiente per 1 ora su un agitatore meccanico (ad esempio, 700 anti-coniglio e 680 anti-capra.). Proteggere dalla luce incubando in un co non trasparententainer. Scartare la soluzione di anticorpo secondario dopo 1 ora.
- membrana lavare 3 volte con PBS per 5 min. Risciacquare a membrana con dH 2 O per rimuovere il sale.
- Leggere la membrana su un sistema di fluorescenza a raggi infrarossi secondo le istruzioni del produttore.
Risultati
Mostriamo risultati rappresentativi di espressione mucina seguenti elettroforesi su gel di agarosio in BALF dai polmoni di topi (Figura 1). In questo esempio, abbiamo usato il gel per mostrare upregulation di mucina produzione di IL-13 dopo il trattamento del modello di topo Tg-MUC5AC. Il Western blot mostra una rappresentazione visiva di espressione mucina, che può essere utilizzato per l'analisi quantitativa di multimero o l'intensità del segnale di banda monomero (Figura 2). Questo metodo può anche essere usato per mostrare l'espressione di mucine in umani lavaggi delle cellule epiteliali bronchiali (HBE) e campioni di espettorato umani. Questo metodo può essere usato per mostrare la riduzione di mucine dopo il trattamento con agenti riducenti. Mostriamo risultati rappresentativi da lavaggi HBE trattate con concentrazioni crescenti di DTT (Figura 3). Abbiamo quantificato la perdita di intensità del segnale multimero seguenti riduzioni mucina con trattamento con un'età riduzionent (Figura 4).
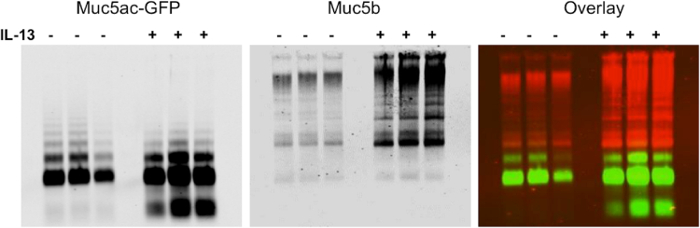
Figura 1. upregulation di Mucin Produzione seguito di IL-13 Trattamento dei / Protein Tg-MUC5AC verde fluorescente (GFP) modello di topo I topi che iperesprimono MUC5AC etichettato con GFP sono stati instillati con PBS. (-) O IL-13 (+) per indurre il calice metaplasia cellulare e aumento mucina produzione nei polmoni (n = 3 per gruppo). BAL sono state raccolte e separati tramite mucina Western blotting agarosio. Membrane stato sondato con un coniglio policlonale anti-Muc5b (rosso) e un anticorpo policlonale di capra anti-GFP (verde). Il sistema a raggi infrarossi può essere utilizzato per visualizzare i risultati come una sovrapposizione o come un unico canale con la possibilità di cambiare le immagini in bianco e nero. Si prega di cliccare qui per vedere una versione più grande di questa figura.

Figura 2. Analisi quantitativa di Mucin Agarose gel Visualizzazione upregulation di Mucin secrezione di IL-13-topi trattati. Intensità del segnale Muc5b è stata misurata per ogni corsia del gel mucina mostrato in Figura 1. I risultati mostrano che la secrezione di mucina è stata aumentata 5,1 volte rispetto topi PBS-trattati in animali IL-13-trattati (n = 3, p <0.005). I dati mostrati come media ± SEM. Cliccate qui per vedere una versione più grande di questa figura.
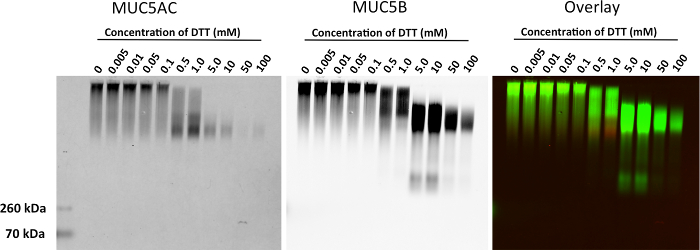
Figura 3. Riduzione di MUC5AC e MUC5B mucine nei lavaggi HBE trattati con lavaggi DTT. HBE stati trattati con 0, 0,005, 0,01, 0,05, 0,1, 0,5, 1, 5, 10, 50 e 100 mM DTT a 37 ° C per 30 minutes. Membrana è stato sondato con un policlonale di coniglio anti-MUC5B (verde) e un policlonale topo anti-MUC5AC (rosso). Clicca qui per vedere una versione più grande di questa figura.

Figura 4. Analisi quantitativa di Mucin Agarose gel Visualizzazione scomparsa del multimerico Band in lava HBE trattati con DTT. MUC5AC e l'intensità del segnale MUC5B è stata misurata per ogni corsia del gel mucina. Cliccate qui per vedere una versione più grande di questa figura.
Discussione
Il protocollo di mucina Western blotting descritto in questo video combina tecniche convenzionali utilizzate in biologia molecolare per separare e trasferire grandi macromolecole, come il DNA, con tecniche regolari per il rilevamento di proteine, cioè., Immunoblotting. La stessa tecnica può essere applicata per studiare la biologia di glicosaminoglicani complessi, quali la ripartizione di alta peso molecolare dell'acido ialuronico 18. Sebbene questa tecnica potrebbe essere utilizzata in un'ampia gamma di analisi, di successo Western blotting agarosio si basa su una moltitudine di passaggi che richiedono azioni meticolosi e dipendenti dal tempo. Al fine di massimizzare il successo, dovrebbero essere rivisti alcuni passaggi critici.
Preparazione dei campioni e di caricamento del gel sono passaggi critici per ottenere risultati accurati. Campioni di mucina-ricchi, vale a dire., Sputa, sono, per natura, aderente al tubo sperimentale, vale a dire., Puntali, provette da centrifuga, filtri. L'uso di pipette a spostamento positivo e pre-wetting puntali può facilitare il carico di materiale viscoelastico nei pozzetti. Tali campioni richiedono un'attenzione particolare a causa di galleggiabilità accresciuta e la viscosità di questi materiali. campioni concentrati (superiore a 5 mg / ml) saranno mal migrare attraverso la porosità di un gel di agarosio 0,8% e possono richiedere ulteriore diluizione e / o denaturazione fino a 6 M urea. Tuttavia, evitare di correre i campioni denaturato in cloruro di guanidinio (GuHCl) come guanidinio precipiterà con SDS. Quindi, campioni conservati in GuHCl richiedono un passo di dialisi aggiuntivo. Per gli studi di stato non polimerici, riduzione parziale (0,5 mM DTT per 5 min) migliorerà notevolmente la migrazione dei campioni concentrati (vedi Figura 3).
trasferimento di proteine alla membrana di nitrocellulosa è un passo fondamentale per questo protocollo e, se non eseguita con precisione, può portare a membrana macchiato, segnale debole e risultati quantitativi falsi. membrane di nitrocellulosa sono delicati e facilmente contaminati edovrebbe sempre essere maneggiato con i guanti e la cura per evitare legame aspecifico e danni. Posizionamento del gel sulla membrana richiede allineamento preciso per generare una guarnizione stretta e impedire il trasferimento di perdite di buffer, che porterebbe a macchie e ridurre l'efficienza di trasferimento. La formazione di bolle tra il gel e la membrana impedisce il trasferimento di proteine e dovrebbe essere evitata accuratamente.
immunolocalizzazione ottimale si basa su alta affinità, anticorpi ad alta specificità contro la spina dorsale delle proteine della mucina bersaglio. Recentemente, nuove tecnologie strategia di immunizzazione, di progettazione antigene e di screening cedono ad una maggiore successo con la generazione di anticorpi mucina e ha fornito nuovi strumenti per studiare biologia mucina. Al fine di rilevare due mucine differenti su una macchia, vale a dire., MUC5AC e MUC5B, i due anticorpi primari devono provenire da diverse specie ospiti, vale a dire, coniglio e di capra. Inoltre, gli anticorpi secondari devono essere etichettati con diversi fluoroforos da rilevare sia 700 NM- e 800 nm-channel.
Relativa abbondanza mucina e le dimensioni mucina possono essere quantificate direttamente con software di imaging. Segnale fluorescente è direttamente proporzionale alla quantità di mucina bersaglio, permettendo la quantificazione di una vasta gamma di campioni, dal basso (ad es., Lavaggi cellulari) ad elevati (es., Espettorato) mucina concentrazione. Tuttavia, la concentrazione assoluta mucina richiede la purificazione di standard mucina, che non è stato descritto in questo protocollo in quanto è un processo lungo e difficile che è stato descritto in Abdullah et al. 19. Inoltre, agarosio occidentale blotting fornisce la possibilità di eseguire shift assays mucina di studiare il processo di polimerizzazione o depolimerizzazione. La mobilità elettroforetica di mucine dipende dal loro stato polimerico, cioè., Migrazione di grandi polimeri è ritardato, e può essere quantificato utilizzando il software di imaging. Per esempio, agenti riducenti indurrà un sh mobilitàift del segnale correlato con variazioni delle proprietà biofisiche del muco. Tale dosaggio può essere usato per studiare mucina processo multimerizzazione 13, ma anche per testare agenti farmacologici diretto a pregiudicare la rete mucina 11. Per concludere, mucina blotting agarosio occidentale accoppiato con l'etichettatura di fluorescenza è significativamente cambiato il nostro approccio per studiare mucine producendo dati qualitativi e quantitativi elevati.
Problemi comuni con agarosio mucina Western blotting può provocare i seguenti risultati: bassa intensità di segnale, di fondo e / o la comparsa di punctates sulla membrana. Diverse strategie di risoluzione dei problemi possono essere utilizzati per migliorare le immagini gel mucina. intensità di segnale può essere aumentata caricando campioni di volume e / o di concentrazioni crescenti di anticorpi primari e secondari. Tipicamente, alta segnale di fondo è attribuibile al blocco e / o lavaggio insufficiente, che può essere risolto eseguendo blocco più lungo/ Lavare incubazione, così come l'utilizzo ottimizzato bloccare i buffer che sono disponibili in commercio. La comparsa di punctates può essere il risultato di incubazioni membrana estesi a temperatura ambiente, che facilita la crescita batterica. Punctates possono anche essere causati da danni membrana di nitrocellulosa dalla soluzione ammollo DTT (passo 4.1) e possono essere evitati con il risciacquo del gel a fondo prima del trasferimento e / o diminuendo la concentrazione DTT a 5 mm.
Il principale limite di agarosio mucina Western blotting è la mancanza di scala proteine per le proteine ad alto peso molecolare e standard mucina, che ostacola quantificazione assoluta mucina. La maggior parte dei risultati pubblicati da gel di agarosio mucina sono studi comparativi per le dimensioni e la concentrazione. Dimensione cromatografia di esclusione con light scattering accoppiato con indice di rifrazione è un'altra tecnica comunemente usata per determinare preciso peso molecolare e concentrazione di macromolecole. Tuttavia, questa tecnica è costosa unND manca di specificità per mucine, di conseguenza, le misure di altre molecole di grandi dimensioni incluse nei campioni, ad esempio, il DNA. Inoltre, la dimensione di esclusione cromatografia è in grado di distinguere tra i tipi di mucina, vale a dire., MUC5AC contro MUC5B, e misure e media concentrazione e dimensione dalla miscela di mucine inclusi in un dato campione.
Altre tecniche possono essere utilizzate per studiare mucine tra luce dinamica e multi-angolo di scattering 1, centrifugazioni isopycnic e tasso-zonale 6, microscopia elettronica, spettrometria di massa 1,7,8. Tuttavia, con l'inchiesta di nuovi agenti farmacologici mirati molecole mucina, è imperativo sviluppare tecniche di laboratorio affidabili per studiare biologia mucina. Agarose mucina Western blotting è una tecnica relativamente semplice e poco costoso che può essere utilizzato per rispondere a domande importanti sui processi mucina, cioè., Cambiamento di mucina peso, dimensioni e il rapporto. Questo saggio sarà utilizzatain applicazioni future per testare l'efficacia dei farmaci e tossicità per nuove molecole che mirano a rimuovere muco adeso in vitro ed in vivo.
Divulgazioni
Gli autori non hanno alcun conflitto di rivelare.
Riconoscimenti
The authors would like to acknowledge Dr. John Sheehan and Dr. Lubna Abdullah for their guidance and mentoring that were central in the completion of this work. This work was supported by funds from the National Institutes of Health (P01HL108808, UH2HL123645) and the Cystic Fibrosis Foundation Therapeutics, Inc. (EHRE07XX0). Kathryn Ramsey is supported by an NHMRC Early Career Research fellowship.
Materiali
| Name | Company | Catalog Number | Comments |
| Tris Base | Sigma | T6060-1kg | 1 kg |
| Glacial Acetic Acid | Sigma | ARK2183-1L | 1 L |
| EDTA | Sigma | EDS-100g | 100 g |
| Glycerol | Fisher | BP229-1 | 1 L |
| Bromophenol Blue | Sigma | 114391-5g | 5 g |
| SDS (Sodium Dodecyl Sulfate) | Sigma | L6026-50g | 50 g |
| 20x SSC (Sodium Saline Citrate) Buffer | Promega | V4261 | 1 L |
| NaCl | Fisher | S271-1 | 1 kg |
| Trisodium Citrate (Na3C6H5O7) | Sigma | W302600-1kg | 1 kg |
| 10 mM DTT (dithiothreitol) | Sigma | D0632 | 25 g |
| Milk Powder | Saco | Instant non-fat dry milk | |
| Dulbecco Phosphate Buffered Saline (D-PBS) | Gibco lifetechnologies | 14200-025 | 500 ml |
| Anti-GFP Goat Primary Antibody (mouse samples) | Rockland antibodies and assays | 600-101-215 | 1 mg |
| UNC 222 Anti-Muc5b Rabbit Primary Antibody (mouse samples) | UNC | ||
| H300 Anti-MUC5B Primary Antibodies (human samples) | Santa Cruz | sc-20119 | 200 μg |
| 45M1 Anti-MUC5AC Primary Antibodies (human samples) | Abcam | ab3649 | 100 μg |
| Donkey Anti-rabbit 800CW IR Dye | LI-COR Biosciences | 926-32213 | 0.5 mg |
| Donkey Anti-mouse 680LT IR Dye | LI-COR Biosciences | 926-68022 | 0.5 mg |
| Electrophoresis Gel Box and Casting Tray | Owl Seperation Systems | ||
| Power Supply Box | Biorad | Model 200/20 | |
| Membrane Blotting Paper | Amersham | 10600016 | |
| Whatman Paper and Nitrocellulose membrane | GE | 10 439 196 | |
| Boekel/Appligene Vacuum Blotter 230 v | Expotech USA | 230600-2 | |
| Odyssey Infrared Fluorescence System | LI-COR Biosciences |
Riferimenti
- Henderson, A. G., et al. Cystic fibrosis airway secretions exhibit mucin hyperconcentration and increased osmotic pressure. J Clin Invest. 124 (7), 3047-3060 (2014).
- Preciado, D., et al. MUC5B Is the predominant mucin glycoprotein in chronic otitis media fluid. Pediatr Res. 68 (3), 231-236 (2010).
- Wang, Y. Y., et al. IgG in cervicovaginal mucus traps HSV and prevents vaginal herpes infections. Mucosal Immunol. 7 (5), 1036-1044 (2014).
- Linden, S. K., Sutton, P., Karlsson, N. G., Korolik, V., McGuckin, M. A. Mucins in the mucosal barrier to infection. Mucosal Immunol. 1 (3), 183-197 (2008).
- Thornton, D. J., et al. Mucus glycoproteins from 'normal' human tracheobronchial secretion. Biochem J. 265 (1), 179-186 (1990).
- Kesimer, M., Makhov, A. M., Griffith, J. D., Verdugo, P., Sheehan, J. K. Unpacking a gel-forming mucin: a view of MUC5B organization after granular release. Am J Physiol Lung Cell Mol Physiol. 298 (1), L15-L22 (2010).
- Kesimer, M., Sheehan, J. K. Mass spectrometric analysis of mucin core proteins. Methods Mol Biol. 842, 67-79 (2012).
- van der Post, S., Thomsson, K. A., Hansson, G. C. Multiple enzyme approach for the characterization of glycan modifications on the C-terminus of the intestinal MUC2mucin. J Proteome Res. 13 (12), 6013-6023 (2014).
- Thornton, D. J., Carlstedt, I., Sheehan, J. K. Identification of glycoproteins on nitrocellulose membranes and gels. Methods Mol Biol. 32, 119-128 (1994).
- Thornton, D. J., Carlstedt, I., Sheehan, J. K. Identification of glycoproteins on nitrocellulose membranes and gels. Mol Biotechnol. 5 (2), 171-176 (1996).
- Sheehan, J. K., et al. Physical characterization of the MUC5AC mucin: a highly oligomeric glycoprotein whether isolated from cell culture or in vivo from respiratory mucous secretions. Biochem J. 347 Pt 1, 37-44 (2000).
- Thornton, D. J., Howard, M., Khan, N., Sheehan, J. K. Identification of two glycoforms of the MUC5B mucin in human respiratory mucus. Evidence for a cysteine-rich sequence repeated within the molecule. J Biol Chem. 272 (14), 9561-9566 (1997).
- Sheehan, J. K., et al. Identification of molecular intermediates in the assembly pathway of the MUC5AC mucin. J Biol Chem. 279 (15), 15698-15705 (2004).
- Ehre, C., et al. Overexpressing mouse model demonstrates the protective role of Muc5ac in the lungs. Proc Natl Acad Sci U S A. 109 (41), 16528-16533 (2012).
- Livraghi, A., et al. Airway and lung pathology due to mucosal surface dehydration in {beta}-epithelial Na+ channel-overexpressing mice: role of TNF-{alpha} and IL-4R{alpha} signaling, influence of neonatal development, and limited efficacy of glucocorticoid treatment. J Immunol. 182 (7), 4357-4367 (2009).
- Martino, M. B., et al. The ER stress transducer IRE1beta is required for airway epithelial mucin production. Mucosal Immunol. 6 (3), 639-654 (2013).
- Nguyen, L. P., et al. Chronic exposure to beta-blockers attenuates inflammation and mucin content in a murine asthma model. Am J Respir Cell Mol Biol. 38 (3), 256-262 (2008).
- Papakonstantinou, E., et al. COPD exacerbations are associated with pro-inflammatory degradation of hyaluronic acid. Chest. , (2015).
- Abdullah, L. H., Wolber, C., Kesimer, M., Sheehan, J. K., Davis, C. W. Studying mucin secretion from human bronchial epithelial cell primary cultures. Methods Mol Biol. 842, 259-277 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon