Method Article
Mucin Agarose ג'ל אלקטרופורזה: מערבי סופג עבור גליקופרוטאינים גבוה בעל משקל מולקולרי
In This Article
Summary
Mucins are high-molecular-weight glycoconjugates, with size ranging from 0.2 to 200 megadalton (MDa). As a result of their size, mucins do not penetrate conventional polyacrylamide gels and require larger pores for separation. We provide a detailed protocol for mucin agarose gel electrophoresis to assess relative quantification and study polymer assembly.
Abstract
מוקיוס, החלבונים הריריים משטחים ריריים-glycosylated בכבדות, התפתחו כמרכיב מרכזי של הגנה מולדת ידי גינה האפיתל נגד פתוגנים פולשים. תפקידה המרכזי של מולקולות אלו הוא להקל השמנת חלקיקים ופינוי תוך קידום שימון של הרירית. במהלך סינתזת החלבון, מוקיוס לעבור O-glycosylation ו multimerization אינטנסיבי, אשר להגדיל באופן משמעותי את מסת וגודל המולקולות האלה. שלאחר translational שינויים אלה הם קריטיים עבור מאפייני viscoelastic של ריר. כתוצאת האופי ביוכימיות biophysical המורכבת של מולקולות אלה, עובדים עם מוקיוס מספק אתגרים רבים כי לא ניתן להתגבר על ידי שיטות ניתוח חלבון קונבנציונליות. למשל, גבוה בעל המשקל המולקולרי שלהם מונע גירת electrophoretic באמצעות ג'ל polyacrylamide הקבוע והטבע הדביק שלהם גורם הידבקות צינורות הניסיונות. עם זאת, חוקרים את התפקיד של מוקיוס בבריאות(למשל., שמירה על שלמות רירית) ומחלות (למשל., Hyperconcentration, mucostasis, הסרטן) צבר לאחרונה עניין מוקיוס נחקרים כיעד טיפולי. הבנה טובה יותר של הייצור והתפקוד של מקרומולקולות mucin עלולה להוביל לגישות פרמקולוגיות רומן, למשל, מעכבי exocytosis גרגיר mucin ו / או סוכני mucolytic. לכן, פרוטוקולים עקבי ואמין לחקור ביולוגיה mucin הן קריטיות בהתקדמות המדע. כאן אנו מתארים שיטות קונבנציונליות להפריד מקרומולקולות mucin ידי אלקטרופורזה באמצעות ג'ל agarose, להעביר החלבון לתוך קרום nitrocellulose, וכדי לזהות אותות עם נוגדנים ספציפיים mucin וכן הקורא ג'ל ניאון אינפרא אדום. טכניקות אלה חלות נרחבים כדי לקבוע quantitation mucin, multimerization וכדי לבדוק את ההשפעות של תרכובות תרופתיות על מוקיוס.
Introduction
מוקיוס מיוצר בדרך כלל על ידי משטחים ריריים המרפדים חללים חשופים לסביבה החיצונית (למשל., נשימה, עיכול, קטעי רבייה, משטח עין), כמו גם איברים פנימיים (למשל, לבלב, כיס מרה, בלוטות חלב). הנוכחות של גליקופרוטאינים אלה שומר הידרציה שטח מהווה מכשול פיזי מפני פתוגנים. למרות הייצור mucin חיוני הרירית בריאות, mucin hyperconcentration ו / או נכסים ריר סוטה יכול להוביל הפרעות בצינור, קולוניזציה חיידקית ודלקת כרונית, אשר יכול לגרום נזק לרקמות בלתי הפיך. מפל דומה של אירועים הם נצפו במחלות כמה, למשל., סיסטיק פיברוזיס 1, דלקת אוזן תיכונה כרונית 2 ו הצרויקו זיהום 3. לכן, חשוב להבין את התפקיד של מוקיוס בבריאות ובחולי ולהקים פרוטוקולים שיגרתי לזיהוי חלבונים.
עד כה19 גני מוקיוס, זוהו לקודד עבור רשתות פוליפפטיד גדולות החל מ- 1,200 (למשל., MUC1) 22,000 (למשל, MUC16) חומצות אמינו. משפחת גנים mucin ניתן לחלק לשתי תת: את מוקיוס קרום הקשורים, מעורב מיגון איתות פני התא, ואת מוקיוס יוצרי ג'ל, אחראי המאפיינים viscoelastic של ג'לים ריר. מוקיוס קרום הקשורים ברובם monomeric ולצרף אל משטחי תא באמצעות תחום קרום פורש הידרופובי. לעומת זאת, מוקיוס יוצרי ג'ל להחזיק מספר גורם פון Willebrand (vWF)-כמו ציסטאין עשיר תחומים חיוניים להיווצרות רשתות פולימריות דינמית. גליקנים גדולים המחוברים סרין ושאריות תראונין מופצים ברחבי apomucin. אוליגוסכרידים O צמודים הצפופים אלה יכולים לתרום עד 80% של המשקל המולקולרי 4. תוך אג"ח דיסולפיד הבין-מולקולרי חיבור מונומרים mucin להבטיח את תקינותו של רשתות ג'ל mucink. כתוצאה glycosylation ו multimerization כבד, מוקיוס הם בין המולקולות הגדולות בעולם החי ולא יכול להיות מנותח על ידי ג'ל אלקטרופורזה רגיל באמצעות ג'ל polyacrylamide SDS-PAGE קונבנציונאלי וסולמות חלבון סטנדרטי. שיטות אלה נפתרות / חלבונים נפרדים עם משקל מולקולרי נמוך מ -250 kDa בעוד מונומרים mucin יכולים להגיע עד 2 מד"א במקרה של MUC16. עם זאת, סולמות חלבון גבוה משקל מולקולרי יכולים לשמש כדי לחקור מונומרים mucin קטנים (כלומר., MUC1).
מגוון של טכניקות ניתן ליישם ללמוד גודל mucin, קונפורמציה ואינטראקציה. באופן מסורתי, אפיון ביוכימי של מוקיוס מושגת על ידי mucin בידוד באמצעות צנטריפוגה צפיפות שיפוע isopycnic חיץ denaturing, ואחריו כרומטוגרפיה בגודל הדרה ו immunodetection (למשל., סופג חריץ) 5. דינמי ו / או פיזור אור רב-זווית לספק מידע על מצב oligomeric של דגימות mucin עשירי 1. בנוסף, צנטריפוגה אזורי-שיעור בשילוב עם immunodetection מיקרוסקופית אלקטרונים חודרת משמשים בדרך כלל כדי לקבוע את הקונפורמציה macromolecular של מוקיוס 6. ספקטרומטריית מסה משמשת גם לכמת מוקיוס, לזהות מחשוף פרוטאוליטים ולנתח 1,7,8 רכב oligosaccharide. שיטות אלו הן יקרות, זמן רב ולעתים קרובות דורשים כמויות גדולות ו / או ריכוזים גבוהים של מדגם. המתודולוגיה המתוארת במסמך זה, כלומר., Mucin הפרדה על ידי אלקטרופורזה, ניתנת לשחזור, בעלות נמוכה והוא יכול לשמש במחקרי תפוקה גבוהה כדי לספק quantitation mucin ביחס ולחקור הרכבת פולימרים. עם זאת, assay זה דורש נוגדנים גבוהה זיקה גבוהה סגולי mucin כי לא יהיו זמין עבור מוקיוס נדיר (למשל., MUC19) או מינים מסוימים (לדוגמא., חזיר, חמוס).
המערבי סופג Agarose מתאים לפתרון מגוון רחב של דוגמאות עשיר mucin עם Concentraהמשא הנעים בין 50 מיקרוגרם / מ"ל (למשל., שטיפות התא) עד 5 מ"ג / מ"ל (למשל., ליחה). Assay זה הוצג בשנת 1990 בוצע רק כמה מעבדות מיוחדות 9,10. בתחילה, טכניקה זו סייעה לזהות תת-אוכלוסיות של מונומרים mucin בהפרשות אדם הנשימה 11,12 ואישר את תהליך oligomerization בתאים הגביע, אשר מורכב של היווצרות dimer ב reticulum endoplasmic ואחריו דימר multimerization במנגנון Golgi 13. לאחרונה, הדור של נוגדנים polyclonal נגד מוקיוס murine הקל מחקרים על במודלים של בעלי חיים קטנים (למשל., Mucin לקוי, βENaC, במודלים של עכברים OVA מאותגרי) ופתח תחום חדש של מחקר מחקרים פרה תרכובות תרופתי בדיקות שמטרתן הסרת ריר מ הריאות 14-17. כתוצאה עניין גובר mucin ביולוגיה הדור של הרומן, נוגדנים mucin ספציפי יותר, אנו מתארים herein המתודולוגיה להפריד מוקיוס ידי ג'ל אלקטרופורזה agarose, ואקום העברת nitrocellulose וזיהוי פלורסנט אינפרא אדום בשני צבעים.
Protocol
1. הכינו חוצצים עבור סופג mucin ג'ל המערבי
- כן 1 ליטר של 50x טה (טריס-תצטט-EDTA) חיץ.
- בשנת 700 מ"ל של מים מזוקקים (O DH 2) להוסיף 242 גרם של בסיס טריס (0.4 M), 57.1 גרם של חומצה אצטית קרחונית (שוקל נוזלי) (0.2 M) ו 14.61 גרם של חומצה ethylenediaminetetraacetic (EDTA) (50 מ"מ).
- התאם ל- pH 8.0 ולעשות את נפח עד 1 ליטר עם DH 2 O.
- הכן 10 מ"ל של חיץ טעינת 10x.
- הכן 5 מ"ל של חיץ 1x טה. לשם כך, להוסיף 5 מ"ל של גליצרול (50%), 25 מ"ג של כחול bromophenol (0.25%), ו -100 מ"ג של סולפט dodecyl נתרן (SDS) (1%).
- כן 2 ליטר ציטראט מלוח 20x נתרן (SSC) החיץ.
- ב 1.5 ליטר של DH 2 O, להוסיף 350.6 גרם של NaCl (3 M) ו 176.4 גרם של ציטראט Trisodium (Na 3 C 6 H 5 O 7) (0.3 M). התאם ל- pH 7.0 ולעשות את הווליום עד 2 ליטר עם DH 2 O.
- כן 1 ליטר של חיץ 1x טה-0.1% SDS.
- הוסף 20 מ"ל של 50x TAE כדי 980 מ"ל של DH 2 O. הוסף 1 גרם של SDS לבצע פתרון 0.1% SDS-טה.
2. טה-SDS Agarose ג'ל הכנה
- (. כלומר, 150 מ"ל) יוצקים נפח מספיק של חיץ 1x טה-0.1% SDS בבקבוק Erlenmeyer במיקרוגל לבצע 5 - ג'ל 7 מ"מ בעובי. להוסיף 0.8% (1.2 גרם) אבקת agarose.
- בקבוק המיקרוגל ב 30 מרווחי שניות עם מתערבל לסירוגין עד agarose נמס לגמרי (בדרך כלל 1 - 3 דקות). השתמש כריות יד חמות במהלך תהליך זה. היזהר של רתיחה המתפרץ בעוד מתערבל.
- אפשר פתרון agarose להתקרר למשך 5 - 10 דקות. הערה: פתרון agarose יהיה מוכן להיות שפך כאשר החלק תחתון של הבקבוק ניתן להשאיר על הכף במשך 5 שניות.
- הכן מגש הליהוק אלקטרופורזה (10 x 15 ס"מ) על ידי הדבקת שולי עם קלטת והצבת גם מסרק בעמדה.
- יוצקים פתרון agarose לאט tהוא הליהוק מגש כדי למנוע היווצרות של בועות. הסר בועות באמצעות קצה פיפטה. חכו ג'ל לקירור לחזק לחלוטין. לאחר הקרושה, להסיר את המסרק לאט, כדי למנוע התמוטטות הבארות על ידי יניקה והסר את הסרט מקצות המגש.
- מניחים ג'ל agarose לתוך תיבת ג'ל ולמלא את יחידת אלקטרופורזה עם חיץ 1x טה-0.1% SDS עד הג'ל מכוסות במלואן.
3. טוענים לדוגמא והפרדת אלקטרופורזה
הערה: במעבדה שלנו, אנו משתמשים בדרך כלל דגימות משני עכבר ובני אדם, כולל נוזל השטיפה ברונכואלוואולרית (BALF; שני מינים), כביסות תא מתאי אפיתל סימפונות אדם (HBE), דגימות רוק כיח אדם. דוגמאות ניתן מפוגלות ב 6 M אוריאה על בסיס גבייה או מאוחסנות במשך פרקי זמן קצרים (6 שעות) על ידי הוספת מעכבי קוקטייל proteinase.
- הכינו דגימות לטעינה באמצעות הוספת 10% של צבע טעינת מדגם זה (כלומר., 30 μl של מדגם ו -3μl של צבע). Homogenize דגימות ידי pipetting למעלה ולמטה. בקצרה ספין למטה צינורות ב 5000 סל"ד כדי לאסוף טיפות.
- בזהירות לטעון נפח שווה של דגימות לתוך הבארות.
- טיפים טרום רטובים ו / או להשתמש טפטפות תזוזה חיוביות כדי להקל העמסת דגימות צמיגות מאוד. לאט לשאוב 80 - 90% של פתרון המדגם-צבע (כלומר, 27 - 30 μl) כדי למנוע בועות pipetting.
- לאט לטעון בתחתית בארות בהדרגה להזיז את קצה pipet כלפי מעלה. לקבלת דוגמיות כי נשארים מחוברים קצה פיפטה, לוותר בזווית של 45 מעלות ו להאריך ישר מעל הבאר או בעדינות להשתמש בצד של הבאר לשבור את הליחה הצמיגה. אין להעמיס על הבארות.
- חברו את האלקטרודות מתיבת ג'ל אל הגנרטור כוח אלקטרופורזה. ודא אלקטרודות מחוברות כראוי (כלומר., עופרת אדומה הפקוקה אל התוצר החיובי של הגנרטור) כדי לאפשר מטען שלילי מוקיוס לרוץ לעבר חיובי אֶלֶקטרוֹדָה.
- הפעל את הג'ל על 80 וולט למשך 90 דקות עבור ג'ל מסרק יחיד, או 60 - 75 דקות עבור ג'ל מסרק כפול כדי למנוע חפיפה בין שתי השורות.
- כבה כוח גנרטור ולנתק את האלקטרודות ממקור החשמל.
- מוציאים בזהירות את הג'ל מתיבת ג'ל ביד אחת משני צדי המגש הליהוק כדי להבטיח את הג'ל נשאר במקום.
4. להפחית ג'ל Agarose עבור העברת mucin יעילה
- בזהירות במקום בדירה ג'ל במיכל זכוכית. שוטפים את הג'ל עם DH 2 O כדי להסיר עקבות של חיץ טה-SDS.
- הכן 1 ליטר של חיץ 4x SSC על ידי הוספת 200 מ"ל של 20x SSC לתוך 800 מ"ל של DH 2 O. להרוויח 200 מ"ל של 10 מ"מ dithiothreitol (DTT) פתרון 4x SSC על ידי הוספת 309 מ"ג של DTT טרי לתוך 200 מ"ל של חיץ 4x SSC.
- משרים את הג'ל עם DTT-4x SSC חיץ ומכסים. נער בעדינות במשך 20 דקות (10 סיבובים לדקה). לשטוף ג'ל עם חיץ 4x SSC DTT-חינם.
- הכין נייר סופג ואקום להעברה.
- בזהירות לחתוך קרום nitrocellulose ממדי מעט רחב יותר מאשר הג'ל (כלומר., 10 x 15 ס"מ).
- מחצלת נקבובית רטובה עם DH 2 O ולמקם אותו החלקה בצד למעלה ב הסופג.
- קרום nitrocellulose רטוב עם חיץ SSC 4x DTT ללא ולמקם אותו במרכז המזרן נקבובי.
- מכסה את המחצלת הנקבובית עם אטם הגומי, כשעזב את הפתיחה של האטם מיושר במדויק עם קרום nitrocellulose. אם המחצלת נקבובית עדיין גלויה, בזהירות להתאים את הממברנה כדי להבטיח שאין פער נשאר בין אטם קרום.
- בזהירות במקום הג'ל agarose על גבי הממברנה. ודא צורות ג'ל חותם חזק עם אטם ואת הבארות של ג'ל מוצבים על הממברנה עבור ההעברה.
- למנוע היווצרות של בועות בין הממברנה ואת ג'ל. כדי למזער אתהיווצרותן של בועות, להשפריץ כמה טיפות של 4x SSC חיץ על הממברנה וחלק הג'ל מלמעלה למטה כדי לשטוף כל בועות נוצרות. הימנע מלהזיז את הג'ל על הממברנה חלבונים יתחילו למחוק מיד.
- בזהירות לכסות את הג'ל עם חיץ 4x SSC.
- בגין העברת mucin ידי יניקה.
- הפעל סופג ואקום ON ולחץ שקיעה ב- 40 - 50 mbar. הוסף כמה טיפות של חיץ 4x SSC על הג'ל כל 5 - 10 דקות כדי למנוע את הג'ל מהתייבשות. הפעל העברה של 90 דקות. אופציונלי: בסיום, לסמן את הבארות עם עיפרון להתמצאות.
- השלך את הג'ל ולאחזר קרום nitrocellulose באמצעות פינצטה פלסטיק על שפת הממברנה.
6. חסימת ממברנה וזיהוי
- לשטוף קרום מיד עם בופר פוספט 1x (PBS). אל תתנו הממברנה להתייבש.
- לטבול את הממברנה לתוך 50 מיליליטר של חלב 3%-PBS חיץ חסימה ומניח על rocker בטמפרטורת החדר למשך שעה 1. לאחר דגירה, לבטל את חיץ החסימה.
- לטבול קרום 1% פתרון ראשוני נוגדנים בחלב-PBS. דגירה הממברנה בפתרון הנוגדן הראשוני לילה על כיסא נדנדה ב 4 ° C.. לאחר דגירה, להשליך את פתרון הנוגדן הראשוני. לדלל את הנוגדנים הראשוניים כדי יחס של 1: 2,000 של פתרון נוגדנים כדי חסימת חיץ. הערה: לקבלת דוגמיות שמקורם עכברים, אנו משתמשים UNC 222 ארנב חלבון אנטי Muc5b ו עז נגד גרין פלורסנט (GFP). לקבלת דוגמיות שמקורם בבני אדם, אנו משתמשים נוגדנים נגד MUC5B ו 45M1 אנטי MUC5AC העיקרי H300.
- הממברנה לשטוף 3 פעמים עם PBS במשך 10 דקות על כיסא נדנדה.
- לטבול קרום 1% פתרון משני נוגדן חלב-PBS. לדלל את הנוגדנים המשניים ביחס של 1: 7,500 של פתרון נוגדנים כדי חסימת חיץ דגירה בטמפרטורת חדר למשך שעה 1 על כיסא נדנדה (למשל, 700 ארנבת אנטי ו 680 אנטי-עז.). להגן מפני אור על ידי דוגרי שותף שאינו שקוףntainer. מחק את פתרון נוגדנים משני לאחר 1 שעה.
- הממברנה לשטוף 3 פעמים עם PBS במשך 5 דקות. לשטוף הממברנה עם DH 2 O להסיר מלח.
- קראו את הקרום על מערכת קרינה האינפרא-אדומה על פי הוראות היצרן.
תוצאות
אנו מציגים תוצאות נציגי ביטוי mucin הבאים ג'ל אלקטרופורזה agarose ב BALF מהריאות של עכברים (איור 1). בדוגמא זו, השתמשנו ג'ל agarose להראות גברת ביטוי של mucin ייצור הבא IL-13 לטיפול במודל עכבר TG-Muc5ac. הכתם המערבי מראה ייצוג חזותי של ביטוי mucin, אשר ניתן להשתמש בהם עבור ניתוח כמותי של multimer או עוצמת האות הלהקה מונומר (איור 2). שיטה זו יכולה לשמש גם כדי להראות ביטוי מוקיוס ב אפיתל סימפונות אדם (HBE) כביסות תא דגימות כיח אדם. שיטה זו יכולה לשמש כדי להראות הפחתת מוקיוס לאחר טיפול עם צמצום סוכנים. אנו מציגים תוצאות נציגי כביסות HBE שטופלו בריכוזים גוברים של DTT (איור 3). אנו לכמת את ההפסד של עוצמת אות multimer הבאה הפחתת mucin עם טיפול עם גיל צמצום NT (איור 4).
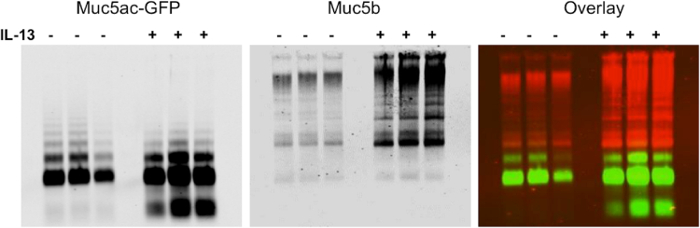
איור 1. הגברת הביטוי של ייצור mucin בעקבות IL-13 טיפול של חלבון TG-Muc5ac / ירוק פלורסנט (GFP) במודל של עכברים עכברים overexpressing Muc5ac מתויג עם GFP היו החדירו עם PBS. (-) או IL-13 (+) כדי לגרום הגביע מטפלזיה תא ייצור mucin גידול הריאות (n = 3 לכל קבוצה). BALF נקצרו מופרדים באמצעות המערבי סופג agarose mucin. ממברנה עבר מבחנים עם ארנב polyclonal אנטי Muc5b (אדום) ו polyclonal עז נגד GFP (ירוק). מערכת אינפרא האדומה יכולה לשמש כדי להראות את תוצאות כשכבה או כערוץ בודד עם האפשרות לשנות תמונות בשחור לבן. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
her.within-page = "1"> 
איור 2. ניתוח כמותי של mucin Agarose ג'ל מציג upregulation של הפרשת mucin ב IL-צבוע 13 עכברים. עוצמת האות Muc5b נמדדה עבור כל נתיב של הג'ל mucin שמוצג באיור 1. התוצאות הראו כי הפרשת mucin הוגדל 5.1 מקפלים עכברים שטופלו PBS בחיות IL-שטופלו 13 (n = 3, p <0.005). הנתונים המוצגים כפי ממוצע ± SEM. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
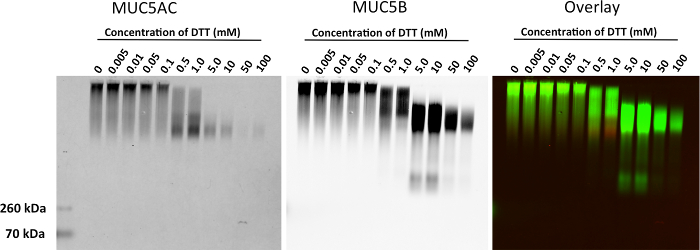
הפחתת איור 3. MUC5AC ו MUC5B מוקיוס ב רוחצת HBE מטופלים עם DTT. שטיפות HBE טופלו 0, 0.005, 0.01, 0.05, 0.1, 0.5, 1, 5, 10, 50 ו -100 מ"מ DTT ב 37 מעלות צלזיוס למשך 30 מינוטes. ממברנה עבר מבחנים עם ארנב polyclonal אנטי MUC5B (ירוק) וכן polyclonal עכבר MUC5AC אנטי (אדום). נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 4. ניתוח כמותי של mucin Agarose ג'ל מציגות העלמות של להקת Multimeric ב רוחצת HBE מטופלים עם DTT. MUC5AC ואת עוצמת אות MUC5B נמדד עבור כל נתיב של הג'ל mucin. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
הפרוטוקול של mucin מערבי סופג מתוארת וידאו זה משלב טכניקות קונבנציונליות המשמשות ביולוגיה מולקולרית להפריד ולהעביר מקרומולקולות גדולות, כגון דנ"א, עם טכניקות קבועות לגילוי חלבון, כלומר., Immunoblotting. באותה הטכניקה יכולה להיות מיושמת כדי ללמוד את הביולוגיה של glycosaminoglycans המורכבת, כגון הפירוט של חומצה היאלורונית גבוה מולקולרי משקל 18. למרות טכניקה זו יכולה לשמש במגוון רחב של מבחנים, מערבי סופג agarose מוצלח מסתמך על מספר רב של צעדים הדורשים פעולות מוקפדות שזמן גרמן. על מנת למקסם את ההצלחה, צריכים להיבדק כמה שלבים קריטיים.
להכנת דגימות וטעינת ג'ל הן שלבים קריטיים עבור תוצאות מדויקות. דגימות mucin עשיריות, כלומר., ספוטה, הם, מטבעם, חסיד צינורות הניסיונות, כלומר., טיפי pipet, צינורות צנטריפוגה, מסננים. השימוש pipets וטרום תזוזה חיובית-wetting טיפים pipet יכול להקל על עומס של חומר viscoelastic לתוך הבארות. דגימות כאלה דורשים תשומת לב מיוחדת בשל ציפה מוגברת דביקות של חומרים אלה. דגימות מרוכזות (מעל 5 מ"ג / מיליליטר) גרועות תהגרנה דרך הגודל הנקבובי של ג'ל 0.8% agarose והן עשוי לחייב דילול נוסף ו / או denaturation עד 6 M אוריאה. עם זאת, להימנע מהפעלת דגימות מפוגלות כלורי guanidinium (GuHCl) כמו guanidinium יהיה להאיץ עם SDS. לפיכך, דגימות המאוחסנות GuHCl דורשות צעד דיאליזה נוסף. עבור מחקרי מעמד הלא-פולימרים, הפחתה חלקית (0.5 המ"מ DTT במשך 5 דקות) תשפר את ההגירה של דגימות מרוכזות מאוד (ראה תרשים 3).
העברת חלבון הממברנה nitrocellulose היא צעד מפתח עבור פרוטוקול זה, ואם לא להורג עם דיוק, יכולה להוביל קרום מוכתם, אות חלשה תוצאות כמותיות שווא. ממברנות Nitrocellulose הם עדינים מזוהם בקלותצריך תמיד להיות מטופלים עם כפפות ולדאוג להימנע מחייב ונזק נוקבים. המיקום של ג'ל על הממברנה דורש תיאום מדויק כדי ליצור חותם חזק ולמנוע זליגת חיץ העברה, אשר תגרום כתמים ולהפחית את יעילות ההעברה. היווצרותן של בועות בין ג'ל הקרום תמנע העברת חלבון יש להימנע בזהירות.
immunodetection אופטימום מסתמך על נוגדנים גבוהה זיקה גבוהה סגולי נגד עמוד שדרת החלבון של mucin היעד. לאחרונה, אסטרטגית חיסון רומן, טכנולוגיות עיצוב אנטיגן וסינון להניב להצלחה גדלה עם הדור של נוגדני mucin וספקו כלים חדשים ללמוד ביולוגית mucin. על מנת לזהות שני מוקיוס שונים על כתם אחד, כלומר., MUC5AC ו MUC5B, שני הנוגדנים הראשיים חייבים להיות נגזר מיני מארחת שונים, כלומר, ארנב עז. כמו כן, נוגדנים משני צריכים להיות מתויגים עם fluorophore השונההים להתגלות הוא 700 nm- ו -800 ערוצים ננומטר.
שפע mucin יחסית וגודל mucin ניתן ונרשמים ישירות עם תוכנת הדמיה. אות ניאון הוא ביחס ישר לכמות של mucin היעד, המאפשר כימות של מגוון רחב של דוגמאות, מהנמוך (למשל., שטיפות התא) לגבוה (למשל., כיח) mucin ריכוז. עם זאת, ריכוז mucin המוחלט מחייב טיהור של סטנדרטים mucin, אשר לא תוארה בפרוטוקול זה כפי שהוא תהליך ממושך וקשה שתואר עבדאללה ואח '. 19. בנוסף, המערבי סופג agarose מספק את האפשרות לבצע מבחני משמרת mucin כדי ללמוד את התהליך של פילמור או depolymerization. ניידות electrophoretic של מוקיוס תלויה במצב פולימריות שלהם, כלומר., הגירה של פולימרים גדולים מתעכבת, וניתן לכמת באמצעות תוכנת ההדמיה. למשל, צמצום סוכנים יניע sh ניידותIFT של האות כי בקורלציה עם שינויים במאפייני biophysical של ריר. ניתן להשתמש assay כזה ללמוד תהליך multimerization mucin 13 אלא גם כדי לבדוק סוכנים תרופתיים שמטרתו להשפיע על רשת mucin 11. לסיכום, mucin סופג agarose מערבי יחד עם תיוג קרינה באופן משמעותי השתנה בגישה שלנו ללמוד מוקיוס ידי הפקת נתונים איכותיים וכמותיים גבוהים.
בעיות נפוצות עם agarose mucin המערבי סופג יכול לגרום התוצאות הבאות: עוצמת האות נמוכה, רקע גבוה ו / או הופעת punctates על הממברנה. ניתן להשתמש אסטרטגיות לפתרון בעיות מספר כדי לשפר את התמונות ג'ל mucin. עוצמת האות יכול להיות מוגברת על ידי טעינת כרכים מדגם גדול יותר ו / או הגדלת ריכוזי נוגדנים ראשוניים ומשניים. בדרך כלל, אות רקע גבוהה נובעת חסימה מספיק ו / או כביסות, אשר ניתן לפתור על ידי ביצוע לחסום עוד/ לשטוף incubations, וכן באמצעות אופטימיזציה חסימת מאגרים כי הם זמינים מסחרית. הופעת punctates יכולה להיות התוצאה של incubations קרום המורחב בטמפרטורת חדר, המאפשרת התפתחות חיידקים. Punctates יכול להיגרם גם על ידי נזק קרום nitrocellulose מפתרון השריה DTT (שלב 4.1) והוא יכול להימנע על ידי שטיפה את הג'ל agarose ביסודיות לפני העברת ו / או להקטין ריכוז DTT עד 5 מ"מ.
המגבלה העיקרית של agarose mucin מערבי סופגים היא חוסר סולם חלבון חלבונים גבוה מולקולרי משקל וסטנדרטי mucin, אשר מעכב כימות mucin מוחלטות. רוב התוצאות מתפרסמות מעת ג'לים agarose mucin מחקרים השוואתיים גודל וריכוז. גודל כרומטוגרפיה הדרה עם פיזור אור בשילוב עם מקדם שבירה היא טכניקה נוספת נפוץ לקבוע משקל מולקולרי מדויק וריכוז מקרומולקולות. עם זאת, הטכניקה הזו היא יקרnd חסר וספציפיות מוקיוס, ומכאן, אמצעים אחרים מולקולות גדולות הכלולות דגימות, למשל, דנ"א. בנוסף, כרומטוגרפיה הדרת גודל אינה מסוגל להבחין בין סוגי mucin, כלומר., MUC5AC לעומת MUC5B, ואמצעים וריכוז ממוצע וגדלים מהתערובת של מוקיוס כלולה בתוך דגימה נתונה.
ניתן להשתמש בטכניקות אחרות כדי ללמוד מוקיוס כולל אור דינאמי ורב-זווית פיזור 1, centrifugations isopycnic וקצב-אזורי 6, מיקרוסקופית אלקטרונים, ספקטרומטריית מסה 1,7,8. עם זאת, עם החקירה של סוכני תרופתי רומן מיקוד מולקולות mucin, קיים הכרח לפתח טכניקות מעבדה אמינות ללמוד ביולוגית mucin. Agarose mucin המערבי סופג היא טכניקה קלה וזולה יחסית, שניתן להשתמש בהם כדי לענות על שאלות חשובות לגבי תהליכים mucin, כלומר., שינוי mucin הנטל, גודל ויחס. assay זה ישמשביישומים עתידיים לבדוק יעילות תרופה ורעילה עבור מולקולות רומן שמטרתן הסרת ריר חסיד ב במבחנה במודלי vivo.
Disclosures
אין מחברי סכסוך לחשוף.
Acknowledgements
The authors would like to acknowledge Dr. John Sheehan and Dr. Lubna Abdullah for their guidance and mentoring that were central in the completion of this work. This work was supported by funds from the National Institutes of Health (P01HL108808, UH2HL123645) and the Cystic Fibrosis Foundation Therapeutics, Inc. (EHRE07XX0). Kathryn Ramsey is supported by an NHMRC Early Career Research fellowship.
Materials
| Name | Company | Catalog Number | Comments |
| Tris Base | Sigma | T6060-1kg | 1 kg |
| Glacial Acetic Acid | Sigma | ARK2183-1L | 1 L |
| EDTA | Sigma | EDS-100g | 100 g |
| Glycerol | Fisher | BP229-1 | 1 L |
| Bromophenol Blue | Sigma | 114391-5g | 5 g |
| SDS (Sodium Dodecyl Sulfate) | Sigma | L6026-50g | 50 g |
| 20x SSC (Sodium Saline Citrate) Buffer | Promega | V4261 | 1 L |
| NaCl | Fisher | S271-1 | 1 kg |
| Trisodium Citrate (Na3C6H5O7) | Sigma | W302600-1kg | 1 kg |
| 10 mM DTT (dithiothreitol) | Sigma | D0632 | 25 g |
| Milk Powder | Saco | Instant non-fat dry milk | |
| Dulbecco Phosphate Buffered Saline (D-PBS) | Gibco lifetechnologies | 14200-025 | 500 ml |
| Anti-GFP Goat Primary Antibody (mouse samples) | Rockland antibodies and assays | 600-101-215 | 1 mg |
| UNC 222 Anti-Muc5b Rabbit Primary Antibody (mouse samples) | UNC | ||
| H300 Anti-MUC5B Primary Antibodies (human samples) | Santa Cruz | sc-20119 | 200 μg |
| 45M1 Anti-MUC5AC Primary Antibodies (human samples) | Abcam | ab3649 | 100 μg |
| Donkey Anti-rabbit 800CW IR Dye | LI-COR Biosciences | 926-32213 | 0.5 mg |
| Donkey Anti-mouse 680LT IR Dye | LI-COR Biosciences | 926-68022 | 0.5 mg |
| Electrophoresis Gel Box and Casting Tray | Owl Seperation Systems | ||
| Power Supply Box | Biorad | Model 200/20 | |
| Membrane Blotting Paper | Amersham | 10600016 | |
| Whatman Paper and Nitrocellulose membrane | GE | 10 439 196 | |
| Boekel/Appligene Vacuum Blotter 230 v | Expotech USA | 230600-2 | |
| Odyssey Infrared Fluorescence System | LI-COR Biosciences |
References
- Henderson, A. G., et al. Cystic fibrosis airway secretions exhibit mucin hyperconcentration and increased osmotic pressure. J Clin Invest. 124 (7), 3047-3060 (2014).
- Preciado, D., et al. MUC5B Is the predominant mucin glycoprotein in chronic otitis media fluid. Pediatr Res. 68 (3), 231-236 (2010).
- Wang, Y. Y., et al. IgG in cervicovaginal mucus traps HSV and prevents vaginal herpes infections. Mucosal Immunol. 7 (5), 1036-1044 (2014).
- Linden, S. K., Sutton, P., Karlsson, N. G., Korolik, V., McGuckin, M. A. Mucins in the mucosal barrier to infection. Mucosal Immunol. 1 (3), 183-197 (2008).
- Thornton, D. J., et al. Mucus glycoproteins from 'normal' human tracheobronchial secretion. Biochem J. 265 (1), 179-186 (1990).
- Kesimer, M., Makhov, A. M., Griffith, J. D., Verdugo, P., Sheehan, J. K. Unpacking a gel-forming mucin: a view of MUC5B organization after granular release. Am J Physiol Lung Cell Mol Physiol. 298 (1), L15-L22 (2010).
- Kesimer, M., Sheehan, J. K. Mass spectrometric analysis of mucin core proteins. Methods Mol Biol. 842, 67-79 (2012).
- van der Post, S., Thomsson, K. A., Hansson, G. C. Multiple enzyme approach for the characterization of glycan modifications on the C-terminus of the intestinal MUC2mucin. J Proteome Res. 13 (12), 6013-6023 (2014).
- Thornton, D. J., Carlstedt, I., Sheehan, J. K. Identification of glycoproteins on nitrocellulose membranes and gels. Methods Mol Biol. 32, 119-128 (1994).
- Thornton, D. J., Carlstedt, I., Sheehan, J. K. Identification of glycoproteins on nitrocellulose membranes and gels. Mol Biotechnol. 5 (2), 171-176 (1996).
- Sheehan, J. K., et al. Physical characterization of the MUC5AC mucin: a highly oligomeric glycoprotein whether isolated from cell culture or in vivo from respiratory mucous secretions. Biochem J. 347 Pt 1, 37-44 (2000).
- Thornton, D. J., Howard, M., Khan, N., Sheehan, J. K. Identification of two glycoforms of the MUC5B mucin in human respiratory mucus. Evidence for a cysteine-rich sequence repeated within the molecule. J Biol Chem. 272 (14), 9561-9566 (1997).
- Sheehan, J. K., et al. Identification of molecular intermediates in the assembly pathway of the MUC5AC mucin. J Biol Chem. 279 (15), 15698-15705 (2004).
- Ehre, C., et al. Overexpressing mouse model demonstrates the protective role of Muc5ac in the lungs. Proc Natl Acad Sci U S A. 109 (41), 16528-16533 (2012).
- Livraghi, A., et al. Airway and lung pathology due to mucosal surface dehydration in {beta}-epithelial Na+ channel-overexpressing mice: role of TNF-{alpha} and IL-4R{alpha} signaling, influence of neonatal development, and limited efficacy of glucocorticoid treatment. J Immunol. 182 (7), 4357-4367 (2009).
- Martino, M. B., et al. The ER stress transducer IRE1beta is required for airway epithelial mucin production. Mucosal Immunol. 6 (3), 639-654 (2013).
- Nguyen, L. P., et al. Chronic exposure to beta-blockers attenuates inflammation and mucin content in a murine asthma model. Am J Respir Cell Mol Biol. 38 (3), 256-262 (2008).
- Papakonstantinou, E., et al. COPD exacerbations are associated with pro-inflammatory degradation of hyaluronic acid. Chest. , (2015).
- Abdullah, L. H., Wolber, C., Kesimer, M., Sheehan, J. K., Davis, C. W. Studying mucin secretion from human bronchial epithelial cell primary cultures. Methods Mol Biol. 842, 259-277 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved