Method Article
Mucine Agarose Gel Electrophoresis: Western Blot pour les glycoprotéines de haut poids moléculaire,
Dans cet article
Résumé
Mucins are high-molecular-weight glycoconjugates, with size ranging from 0.2 to 200 megadalton (MDa). As a result of their size, mucins do not penetrate conventional polyacrylamide gels and require larger pores for separation. We provide a detailed protocol for mucin agarose gel electrophoresis to assess relative quantification and study polymer assembly.
Résumé
Mucines, les protéines fortement glycosylées qui tapissent la surface des muqueuses, ont évolué comme un élément clé de la défense innée en protégeant l'épithélium contre les agents pathogènes envahisseurs. Le rôle principal de ces macromolécules est de faciliter le piégeage des particules et de dégagement, tout en favorisant la lubrification de la muqueuse. Au cours de la synthèse des protéines subissent une intense mucines O-glycosylation et multimérisation, ce qui augmente considérablement la masse et la taille de ces molécules. Ces modifications post-traductionnelles sont critiques pour les propriétés viscoélastiques du mucus. En raison de la nature biochimique et biophysique complexe de ces molécules, en travaillant avec des mucines fournit de nombreux problèmes qui ne peuvent pas être résolus par des méthodes d'analyse des protéines classiques. Par exemple, leur haut poids moléculaire empêche la migration électrophorétique par des gels de Polyacrylamide réguliers et leur nature collante provoque l'adhérence à un tube expérimental. Cependant, étudier le rôle des mucines dans la santé(Par exemple., Le maintien de l' intégrité des muqueuses) et de la maladie (par exemple., Hyperconcentration, mucostase, cancer) a récemment suscité un intérêt et mucines sont à l'étude comme cible thérapeutique. Une meilleure compréhension de la production et la fonction des macromolécules mucine peut conduire à de nouvelles approches pharmaceutiques, par exemple, les inhibiteurs de la mucine exocytose de granules et / ou agents mucolytiques. Par conséquent, des protocoles cohérents et fiables pour étudier la biologie mucine sont essentiels pour le progrès scientifique. Ici, nous décrivons des méthodes classiques pour séparer les macromolécules de mucine par électrophorèse en utilisant un gel d'agarose, transfert des protéines dans une membrane de nitrocellulose, et à détecter le signal avec des anticorps spécifiques de la mucine, ainsi que l'infrarouge lecteur de gel de fluorescence. Ces techniques sont largement applicables pour déterminer la mucine quantification, multimérisation et de tester les effets des composés pharmacologiques sur mucines.
Introduction
Les mucines sont normalement produites par des surfaces muqueuses qui tapissent les cavités exposées à l'environnement extérieur (par exemple., Respiratoires, digestifs, les secteurs de la reproduction, la surface oculaire), ainsi que les organes internes (par exemple, le pancréas, la vésicule biliaire, les glandes mammaires). La présence de ces glycoprotéines maintient l'hydratation de la surface et forme une barrière physique contre les agents pathogènes. Bien que la production de mucine est essentielle à la santé des muqueuses, mucine hyperconcentration et / ou des propriétés de mucus aberrantes peut conduire à obstruction du canal, la colonisation bactérienne et l'inflammation chronique, qui peut causer des lésions irréversibles des tissus. Une cascade d'événements semblables sont observés dans plusieurs maladies, par exemple., La fibrose kystique 1, otite moyenne chronique 2 et l' infection cervico 3. Par conséquent, il est important de comprendre le rôle des mucines dans la santé et la maladie, et d'établir des protocoles de routine pour l'identification des protéines.
À ce jour, 19 mucines gènes ont été identifiés et codent pour de grandes chaînes de polypeptides allant de 1200 (par exemple., MUC1) à 22.000 (par exemple, MUC16) acides aminés. La famille des gènes de mucine peut être divisé en deux sous-types: les mucines associées à la membrane, impliqué dans la signalisation cellulaire et la surface de blindage, et les mucines formant un gel, responsable des propriétés viscoélastiques du gel de mucus. mucines associées à la membrane sont essentiellement monomère et se fixent sur les surfaces cellulaires par l'intermédiaire d'un domaine transmembranaire hydrophobe. En revanche, les mucines formant des gels possèdent plusieurs facteur Willebrand (FvW) -comme et riches en cysteine des domaines qui sont essentiels pour la formation de réseaux polymères dynamiques. Grandes glycanes sont attachés à la sérine et thréonine répartis dans la apomucine. Ces oligosaccharides O-liés denses peuvent contribuer jusqu'à 80% du poids moléculaire 4. Intra- et inter-moléculaires des liaisons disulfure reliant les monomères mucine assurent l'intégrité du networ de gel de mucinek. À la suite de glycosylation lourd et multimérisation, mucines sont parmi les plus grandes molécules dans le monde animal et ne peuvent pas être analysés par électrophorèse sur gel standard en utilisant un gel SDS-PAGE polyacrylamide classique et échelles de protéines standard. Ces méthodes résolvent / protéines séparées avec des poids moléculaires inférieurs à 250 kDa tandis que les monomères mucine peuvent atteindre jusqu'à 2 MDa dans le cas de MUC16. Cependant, à haute masse moléculaire échelles de protéines peuvent être utilisées pour étudier les petits monomères mucine (ie., MUC1).
Diverses techniques peuvent être appliquées pour étudier la taille de la mucine, la conformation et de l'interaction. Traditionnellement, la caractérisation biochimique des mucines est réalisée par isolement mucine par l' intermédiaire isopycnique en gradient de densité centrifugation dans un tampon dénaturant, suivie d' une Chromatographie d'exclusion de taille et immunodétection (par ex., Un slot blot) 5. Dynamique et / ou la diffusion de lumière multi-angle fournir des informations sur l'état oligomérique d'échantillons de mucine riche 1. En outre, les taux zonal centrifugation couplé à l' immunodétection et la microscopie électronique à transmission sont communément utilisés pour déterminer la conformation macromoléculaire de mucines 6. La spectrométrie de masse est également utilisée pour quantifier les mucines, détecter le clivage protéolytique et d' analyser la composition oligosaccharide 1,7,8. De telles techniques sont coûteuses, prennent du temps et exigent souvent de grands volumes et / ou des concentrations élevées d'échantillon. La méthodologie décrite ici, à savoir., Mucine séparation par électrophorèse, reproductible, peu coûteuse et peut être utilisée dans les études à haut débit pour fournir mucine par rapport quantification et d' étudier l' assemblage du polymère. Cependant, ce test nécessite de haute affinité, de haute spécificité des anticorps de mucine qui peuvent ne pas être disponibles pour les mucines rares (par exemple., MUC19) ou certaines espèces (par exemple., Porc, furet).
Agarose Western blot est adapté pour résoudre une grande variété d'échantillons de mucine riche avec concentrations allant de 50 pg / ml (par ex., des lavages cellulaires) à 5 mg / ml (par ex., du crachat). Cet essai a été introduit dans les années 1990 et n'a été réalisée dans quelques laboratoires spécialisés 9,10. Dans un premier temps , cette technique a permis d' identifier des sous - populations de monomères de mucine dans les sécrétions respiratoires humaines 11,12 et a confirmé le procédé d'oligomérisation dans des cellules caliciformes, qui comprend la formation du dimère dans le réticulum endoplasmique suivie dimère multimérisation dans l'appareil de Golgi 13. Plus récemment, la production d'anticorps polyclonaux contre mucines murins facilité des études sur des petits modèles animaux (par exemple., Mucine modèles de souris déficientes, βENaC, OVA contestées) et a ouvert un nouveau champ de recherche pour les études précliniques composés d'essais pharmacologiques visant à éliminer le mucus les poumons 14-17. En raison de l'intérêt croissant pour la mucine biologie et la génération de nouveaux anticorps de mucine plus spécifiques, nous décrivons herein la méthode pour séparer les mucines par électrophorèse sur gel d'agarose, transfert sous vide à la nitrocellulose et à deux couleurs de détection de fluorescence infrarouge.
Protocole
1. Préparer Tampons pour Gel mucine Western blot
- Préparer 1 litre de 50x TAE (Tris-acétate-EDTA) tampon.
- Dans 700 ml d'eau distillée (dH 2 O) , ajouter 242 g de base Tris (0,4 M), 57,1 g d'acide acétique glacial (peser liquide) (0,2 M) et 14,61 g d'acide éthylènediaminetétraacétique (EDTA) (50 mM).
- Ajuster le pH à 8,0 et rendre le volume jusqu'à 1 litre avec dH 2 O.
- Préparer 10 ml de 10 x tampon de charge.
- Préparer 5 ml de tampon TAE 1X. Pour ce faire, ajouter 5 ml de glycérol (50%), 25 mg de bleu de bromophénol (0,25%) et 100 mg de dodécylsulfate de sodium (SDS) (1%).
- Préparez 2 litres de 20x sodium salin citrate (SSC) tampon.
- Dans 1,5 litres de dH 2 O, ajouter 350,6 g de NaCl (3 M) et 176,4 g de citrate trisodique (Na 3 C 6 H 5 O 7) (0,3 M). Ajuster le pH à 7,0 et porter le volume à 2 litres avec dH 2 O.
- Préparer 1 litre de tampon 1x TAE-SDS à 0,1%.
- Ajouter 20 ml de 50x TAE à 980 ml de dH 2 O. Ajouter 1 g de SDS pour faire une solution SDS-TAE 0,1%.
2. TAE-SDS Agarose Gel Préparation
- (. -À- dire, 150 ml) verser un volume suffisant de tampon SDS 0,1% TAE 1x dans un erlenmeyer micro - ondes pour faire un 5 - Gel de 7 mm d'épaisseur. Ajouter 0,8% (1,2 g) de poudre d'agarose.
- flacon à micro-ondes dans intervalles de 30 s avec tourbillonnant intermittente jusqu'à ce que l'agarose est complètement dissous (généralement 1 - 3 min). Utiliser des tampons à main chaude pendant ce processus. Faites attention à ébullition éruptive tout en faisant tourbillonner.
- Laisser la solution d'agarose refroidir pendant 5 - 10 min. Remarque: La solution d'agarose sera prête à être versée lorsque le fond du flacon peut être laissé sur la paume pendant 5 sec.
- Préparer plateau de coulée d'électrophorèse (10 x 15 cm) en scellant les bords avec du ruban adhésif et en plaçant bien peigne en position.
- Verser la solution d'agarose lentement dans til plateau de coulée pour éviter la formation de bulles. Retirer les bulles à l'aide d'une pointe de pipette. Attendez que le gel pour refroidir et complètement solidifier. Une fois solidifié, enlever le peigne lentement pour éviter l'effondrement des puits par aspiration et enlever le ruban à partir des bords du plateau.
- Placez un gel d'agarose dans la boîte de gel et de remplir l'unité d'électrophorèse avec un tampon 1x TAE-SDS à 0,1% jusqu'à ce que le gel est entièrement couvert.
3. L'échantillon en cours de chargement et Électrophorèse Séparation
Remarque: Dans notre laboratoire, nous utilisons couramment des échantillons provenant de la souris et les humains, y compris fluide bronchoalvéolaire de lavage (LLBA; les deux espèces), les lavages cellulaires à partir de cellules humaines épithéliales bronchiques (HBE), et des échantillons de salive et les expectorations humaines. Les échantillons peuvent être dénaturés dans 6 M d'urée lors de la collecte ou stockées pendant de courtes périodes de temps (6 heures) en ajoutant un inhibiteur protéinase de cocktail.
- Préparer des échantillons pour le chargement en ajoutant 10% de colorant de charge à chaque échantillon (ie., 30 pl d'échantillon et 3pi de colorant). Homogénéiser les échantillons par pipetage vers le haut et vers le bas. Brièvement centrifuger les tubes à 5000 rpm pour recueillir des gouttelettes.
- charger soigneusement volume égal d'échantillons dans les puits.
- des conseils et / ou utiliser des pipettes volumétriques pour faciliter le chargement d'échantillons très visqueux pré-humides. Lentement aspirée 80 - 90% de la solution échantillon de colorant (ie, 27 - 30 pi) afin d' éviter les bulles de pipetage.
- charger lentement au fond des puits et se déplacer progressivement la pointe de la pipette vers le haut. Pour les échantillons qui restent attachés à la pointe de la pipette, passer à un angle de 45 ° et allongé droit au-dessus du puits ou doucement utiliser le côté du puits à briser le mucus filandreux. Ne pas surcharger les puits.
- Raccorder les électrodes dans la zone de gel pour le générateur d'énergie d'électrophorèse. Vérifiez que les électrodes sont connectées correctement (ie., Le fil rouge branché à la sortie positive du générateur) pour permettre chargé négativement mucines à courir vers le positif électrode.
- Exécutez le gel à 80 volts pendant 90 min pour un gel de peigne unique, ou 60-75 min pour un gel double peigne pour éviter le chevauchement entre les deux rangées.
- Mettez le générateur hors tension et débranchez les électrodes de la source d'alimentation.
- Retirez délicatement le gel de la boîte de gel avec une main de chaque côté du plateau de coulée pour assurer le gel reste en place.
4. Réduire Agarose Gel efficace Transfert mucine
- Placez délicatement le plat de gel dans un récipient en verre. Rincer le gel avec dH 2 O pour éliminer les traces de tampon TAE-SDS.
- Préparer 1 litre de tampon SSC 4x par addition de 200 ml de SSC 20X dans 800 ml d'dH 2 O. Faire 200 ml de dithiothréitol 10 mM (DTT) solution 4x SSC en ajoutant 309 mg de frais DTT dans 200 ml de tampon SSC 4x.
- Faire tremper le gel avec un tampon TNT-4x SSC et le couvercle. Agitez doucement pendant 20 min (10 rotations par minute). Rincer le gel avec du tampon TNT sans 4x SSC.
- Préparer buvard à vide pour le transfert.
- Découpez soigneusement membrane de nitrocellulose à des dimensions légèrement plus larges que le gel (ie., 10 x 15 cm).
- Mat poreux humide avec dH 2 O et placez - le lisse côté-up dans le buvard.
- membrane de nitrocellulose humide avec un tampon de SSC 4x TNT gratuite et le placer au centre du tapis poreux.
- Recouvrir le mat poreux avec le joint en caoutchouc, en laissant l'ouverture du joint d'étanchéité précisément alignée avec la membrane de nitrocellulose. Si mat poreux est encore visible, ajuster soigneusement la membrane pour assurer ne reste aucun espace entre le joint et la membrane.
- Placez délicatement le gel d'agarose sur le dessus de la membrane. Veiller à ce gel se forme un joint étanche avec le joint et les puits du gel sont positionnés sur la membrane pour le transfert.
- Éviter la formation de bulles entre la membrane et le gel. Pour réduire au minimum leformation de bulles, gicler quelques gouttes de 4x SSC tampon sur la membrane et faites glisser le gel de haut en bas pour vider toutes les bulles formées. Évitez de déplacer le gel sur la membrane sous forme de protéines vont commencer à effacer immédiatement.
- couvrir délicatement le gel avec un tampon 4x SSC.
- Commencez le transfert mucine par aspiration.
- Mettez buvard ON sous vide et la pression fixée à 40 - 50 mBar. Ajouter quelques gouttes de tampon 4x SSC sur le gel tous les 5 - 10 min pour empêcher le gel de se dessécher. transfert d'exécution pendant 90 min. Facultatif: Une fois terminé, marquer les puits avec un crayon pour l'orientation.
- Éliminer le gel et récupérer membrane de nitrocellulose en utilisant des pinces en plastique sur le bord de la membrane.
6. Membrane Blocage et détection
- Rincer la membrane avec du sérum physiologique immédiatement 1x tamponnée au phosphate (PBS). Ne pas laisser la membrane sécher.
- Immerger la membrane dans 50 ml de 3% de lait-PBS tampon de blocage et déposer sur une rocker à la température ambiante pendant 1 h. Après incubation, jeter le tampon de blocage.
- Immerger la membrane dans du lait-PBS à la solution d'anticorps primaire à 1%. Incuber la membrane dans la solution d'anticorps primaire pendant une nuit sur un agitateur à 4 ° C. Après incubation, jeter la solution d'anticorps primaire. Diluer les anticorps primaires à un rapport 1: 2000 d'une solution d'anticorps à un tampon de blocage. Remarque: Pour les échantillons provenant de souris, nous utilisons UNC 222 de lapin anti-MUC5B et de chèvre anti-protéine fluorescente verte (GFP). Pour les échantillons provenant de l'homme, nous utilisons des anticorps primaires H300 anti-MUC5B et 45M1 anti-MUC5AC.
- membrane Laver 3 fois avec du PBS pendant 10 minutes sur une bascule.
- Immerger la membrane dans du lait-PBS à la solution d'anticorps secondaire de 1%. Diluer les anticorps secondaires à un rapport 1: 7500 d' une solution d'anticorps à un tampon de blocage et on incube à température ambiante pendant 1 heure sur une bascule (par exemple, 700 anti-lapin et anti-chèvre 680.). Protéger de la lumière par incubation dans une co non-transparentntainer. Jeter la solution secondaire d'anticorps après 1 h.
- membrane Laver 3 fois avec du PBS pendant 5 min. Rincer la membrane avec dH 2 O pour éliminer le sel.
- Lire la membrane sur un système de fluorescence infrarouge selon les instructions du fabricant.
Résultats
Nous montrons des résultats représentatifs de l' expression de la mucine après électrophorèse sur gel d' agarose dans BALF des poumons de souris (Figure 1). Dans cet exemple, nous avons utilisé le gel d'agarose pour montrer la régulation positive de la production de mucine suivant l'IL-13 le traitement du modèle de la souris Tg-MUC5AC. Le Western Blot montre une représentation visuelle de l' expression de la mucine, qui peut être utilisé pour une analyse quantitative d' un multimère ou d'une bande de monomères intensité du signal (figure 2). Cette méthode peut également être utilisée pour montrer l'expression des mucines dans l'épithélium bronchique (HBE) de lavage des cellules humaines et des échantillons de crachats humains. Cette méthode peut être utilisée pour montrer la diminution de mucines après un traitement avec des agents réducteurs. Nous montrons des résultats représentatifs de lavages HBE traités avec des concentrations croissantes de la TNT (Figure 3). Nous avons mesuré la perte d'intensité de signal multimère après réduction de la mucine avec un traitement avec un âge réduisantnt (figure 4).
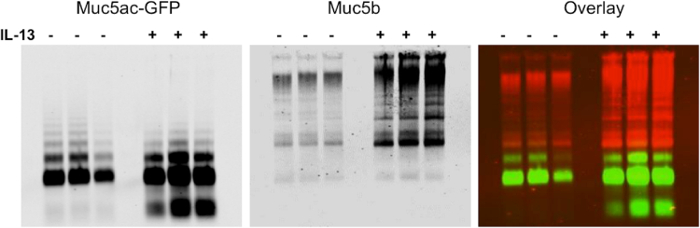
La figure 1. La régulation positive de la production de mucine après un traitement d' IL-13 de la Tg MUC5AC / protéine fluorescente verte (GFP) modèle de souris Les souris surexprimant MUC5AC marquées avec la GFP ont été instillées avec du PBS. (-) Ou l' IL-13 (+) pour induire Gobelet métaplasie des cellules et de la production de mucine de l'augmentation dans les poumons (n = 3 par groupe). LLBA ont été récoltés et séparés par mucine Western blot agarose. La membrane a été sondée avec un anticorps polyclonal de lapin anti MUC5B (rouge) et un anticorps polyclonal de chèvre anti-GFP (vert). Le système infrarouge peut être utilisé pour afficher les résultats comme une superposition ou comme un seul canal avec la possibilité de changer les images en noir et blanc. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 2. Analyse quantitative du Gel Agarose mucine Affichage régulation positive de la sécrétion de mucine dans l' IL-13-souris traitées. MUC5B intensité du signal a été mesurée pour chaque piste du gel de mucine montré à la figure 1. Les résultats montrent que la sécrétion de mucine a augmenté de 5,1 fois par rapport à les souris traitées avec du STP chez les animaux de l'IL-13 traités (n = 3, p <0,005). Les données présentées comme moyenne ± SEM. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
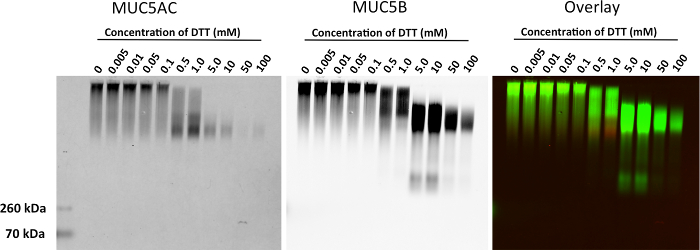
Figure 3. Réduction des MUC5AC et MUC5B mucines dans les lave HBE traités avec des lavages TNT. HBE ont été traités avec 0, 0,005, 0,01, 0,05, 0,1, 0,5, 1, 5, 10, 50 et 100 mM DTT à 37 ° C pendant 30 minutes. La membrane a été sondée avec un anticorps polyclonal de lapin anti-MUC5B (vert) et un anticorps polyclonal de souris anti-MUC5AC (rouge). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 4. Analyse quantitative de mucine Agarose Gel Affichage disparition de la bande Multimeric dans Washes HBE traités avec la TNT. MUC5AC et MUC5B intensité du signal a été mesurée pour chaque piste du gel de mucine. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Le protocole de mucine par Western Blot décrit dans cette vidéo combine les techniques classiques utilisées en biologie moléculaire pour séparer et transférer des macromolécules telles que l' ADN, par des techniques normales pour la détection des protéines, à savoir., Immunotransfert. La même technique peut être appliquée pour étudier la biologie des glycosaminoglycanes complexes, telles que la dégradation de l' acide hyaluronique de haut poids moléculaire 18. Bien que cette technique pourrait être utilisée dans une large gamme d'essais, avec succès Western blot agarose repose sur une multitude d'étapes qui nécessitent des actions méticuleux et dépendant du temps. Afin de maximiser le succès, certaines étapes critiques devraient être examinées.
Préparation de l'échantillon et le chargement du gel sont des étapes importantes pour des résultats précis. Échantillons mucine-riches, ie., Expectorations, sont, par nature, adhérente à un tube expérimental, ie., Embouts de pipettes, tubes de centrifugation, les filtres. L'utilisation de pipettes volumétriques et pré-wetting embouts de pipette peut faciliter le chargement du matériau visco-élastique dans les puits. Ces échantillons nécessitent une attention particulière en raison de la flottabilité accrue et l'adhésivité de ces matériaux. échantillons concentrés (au-dessus de 5 mg / ml) vont mal migrer à travers la taille des pores d'un gel d'agarose à 0,8%, et peuvent nécessiter une dilution supplémentaire et / ou dénaturation dans un maximum de 6 M d'urée. Cependant, éviter de courir des échantillons dénaturés dans du chlorure de guanidinium (GuHCl) comme guanidinium précipitera avec SDS. Par conséquent, les échantillons stockés dans GuHCl nécessitent une étape supplémentaire de dialyse. Pour les études d'état non-polymères, réduction partielle (DTT 0,5 mM pendant 5 minutes) permettra d' améliorer grandement la migration des échantillons concentrés (voir Figure 3).
transfert de protéines à la membrane de nitrocellulose est une étape clé pour ce protocole et, si non exécuté avec précision, peut conduire à membrane taché, signal faible et des résultats quantitatifs faux. Les membranes de nitrocellulose sont délicates et facilement contaminés etdevraient toujours être manipulés avec des gants et des soins pour éviter une liaison non spécifique et les dommages. Le placement du gel sur la membrane nécessite un alignement précis pour produire un joint étanche et d'éviter les fuites de mémoire tampon de transfert, ce qui se traduirait par des taches et de réduire l'efficacité du transfert. La formation de bulles entre le gel et la membrane empêche le transfert de protéines et doit être soigneusement évité.
immunodétection optimale dépend de haute affinité et de haute spécificité des anticorps contre le squelette protéique de la mucine cible. Récemment, les technologies nouvelle stratégie de vaccination, la conception de l'antigène et de dépistage donnent à l'augmentation du succès avec la génération d'anticorps de mucine et ont fourni de nouveaux outils pour étudier la biologie de la mucine. Afin de détecter deux mucines différents sur un blot, ie., MUC5AC et MUC5B, les deux anticorps primaires doivent provenir de différentes espèces hôtes, à savoir, le lapin et la chèvre. En outre, les anticorps secondaires doivent être étiquetés avec fluorophore différents à détecter à la fois le canal 700 nm et 800 nm-.
abondance de la mucine relative et la taille de la mucine peut être quantifiée directement avec un logiciel d'imagerie. Le signal fluorescent est directement proportionnelle à la quantité de cible mucine, permettant la quantification d'un large éventail d'échantillons, de faible (par exemple., Lavages cellulaires) à élevé (par exemple., Expectoration) mucine concentration. Toutefois, la concentration de mucine absolue exige la purification des normes mucine, qui n'a pas été décrit dans ce protocole car il est un processus long et difficile qui a été décrit dans Abdullah et al. 19. En outre, l'agarose Western Blot offre la possibilité d'effectuer des dosages de décalage de mucine à étudier le processus de polymérisation ou dépolymérisation. Mobilité électrophorétique des mucines dépend de leur état polymère, à savoir., La migration des grands polymères est retardé, et peut être quantifiée en utilisant le logiciel d'imagerie. Par exemple, des agents réducteurs va induire un sh de mobilitéift du signal qui est en corrélation avec les changements dans les propriétés biophysiques du mucus. Ce test peut être utilisé pour étudier processus de multimérisation mucine 13 mais aussi pour tester des agents pharmacologiques visant à affecter le réseau de mucine 11. Pour conclure, mucine agarose Western blot couplé avec marquage par fluorescence a considérablement changé notre approche pour étudier mucines en produisant des données quantitatives et qualitatives élevées.
Les problèmes communs avec agarose mucine Western blot peut entraîner les résultats suivants: faible intensité du signal, bruit de fond élevé et / ou l'apparition de ponctuations sur la membrane. Plusieurs stratégies de dépannage peuvent être utilisées pour améliorer les images de gel mucine. L'intensité du signal peut être augmentée par le chargement des échantillons plus volumineux et / ou l'augmentation des concentrations d'anticorps primaires et secondaires. Typiquement, le signal de fond élevé est attribuable au blocage et / ou de lavage insuffisant, ce qui peut être résolu en effectuant plus bloc/ Laver incubations, ainsi que l'utilisation optimisée de blocage des tampons qui sont disponibles dans le commerce. L'apparition des ponctuations peut être le résultat de l'incubation de la membrane prolongée à la température ambiante, ce qui facilite la croissance bactérienne. Ponctuations peuvent également être causés par une membrane de nitrocellulose de la solution de trempage de DTT (étape 4.1) et peut être évitée par un rinçage du gel d'agarose à fond avant le transfert et / ou la diminution de la concentration du DTT à 5 mM.
La principale limitation de l'agarose mucine Western blot est le manque d'échelle de protéines pour des protéines de haute masse moléculaire et des normes mucine, qui entrave absolue quantification de mucine. La plupart des résultats publiés à partir de gels d'agarose mucine sont des études comparatives pour la taille et la concentration. Chromatographie d'exclusion stérique avec diffusion de la lumière couplée à l'indice de réfraction est une autre technique couramment utilisée pour déterminer le poids moléculaire précis et la concentration des macromolécules. Cependant, cette technique est coûteuse unee manque de spécificité pour la mucine, par conséquent, des mesures autres grosses molécules incluses dans les échantillons, par exemple de l' ADN. En outre, la chromatographie d'exclusion stérique est incapable de distinguer entre les différents types de mucines, ie., MUC5AC par rapport MUC5B, ainsi que des mesures et de la concentration moyenne et la taille du mélange de mucines inclus dans un échantillon donné.
D' autres techniques peuvent être utilisées pour étudier les mucines , y compris dynamique et multi-angle diffusion de la lumière 1, centrifugations isopycnique et taux bizonale 6, microscopie électronique, spectrométrie de masse 1,7,8. Cependant, avec l'enquête de nouveaux agents pharmacologiques ciblant les molécules de mucine, il est impératif de développer des techniques de laboratoire fiables pour étudier la biologie de la mucine. Agarose mucine Western blot est une technique relativement facile et peu coûteux qui peut être utilisé pour répondre à des questions importantes concernant les processus de mucine, ie., Changement de mucine charge, la taille et le rapport. Cet essai sera utilisédans des applications futures pour tester l' efficacité des médicaments et de la toxicité pour les nouvelles molécules visant à éliminer le mucus adhérent in vitro et dans des modèles in vivo.
Déclarations de divulgation
Les auteurs ont pas de conflit de divulguer.
Remerciements
The authors would like to acknowledge Dr. John Sheehan and Dr. Lubna Abdullah for their guidance and mentoring that were central in the completion of this work. This work was supported by funds from the National Institutes of Health (P01HL108808, UH2HL123645) and the Cystic Fibrosis Foundation Therapeutics, Inc. (EHRE07XX0). Kathryn Ramsey is supported by an NHMRC Early Career Research fellowship.
matériels
| Name | Company | Catalog Number | Comments |
| Tris Base | Sigma | T6060-1kg | 1 kg |
| Glacial Acetic Acid | Sigma | ARK2183-1L | 1 L |
| EDTA | Sigma | EDS-100g | 100 g |
| Glycerol | Fisher | BP229-1 | 1 L |
| Bromophenol Blue | Sigma | 114391-5g | 5 g |
| SDS (Sodium Dodecyl Sulfate) | Sigma | L6026-50g | 50 g |
| 20x SSC (Sodium Saline Citrate) Buffer | Promega | V4261 | 1 L |
| NaCl | Fisher | S271-1 | 1 kg |
| Trisodium Citrate (Na3C6H5O7) | Sigma | W302600-1kg | 1 kg |
| 10 mM DTT (dithiothreitol) | Sigma | D0632 | 25 g |
| Milk Powder | Saco | Instant non-fat dry milk | |
| Dulbecco Phosphate Buffered Saline (D-PBS) | Gibco lifetechnologies | 14200-025 | 500 ml |
| Anti-GFP Goat Primary Antibody (mouse samples) | Rockland antibodies and assays | 600-101-215 | 1 mg |
| UNC 222 Anti-Muc5b Rabbit Primary Antibody (mouse samples) | UNC | ||
| H300 Anti-MUC5B Primary Antibodies (human samples) | Santa Cruz | sc-20119 | 200 μg |
| 45M1 Anti-MUC5AC Primary Antibodies (human samples) | Abcam | ab3649 | 100 μg |
| Donkey Anti-rabbit 800CW IR Dye | LI-COR Biosciences | 926-32213 | 0.5 mg |
| Donkey Anti-mouse 680LT IR Dye | LI-COR Biosciences | 926-68022 | 0.5 mg |
| Electrophoresis Gel Box and Casting Tray | Owl Seperation Systems | ||
| Power Supply Box | Biorad | Model 200/20 | |
| Membrane Blotting Paper | Amersham | 10600016 | |
| Whatman Paper and Nitrocellulose membrane | GE | 10 439 196 | |
| Boekel/Appligene Vacuum Blotter 230 v | Expotech USA | 230600-2 | |
| Odyssey Infrared Fluorescence System | LI-COR Biosciences |
Références
- Henderson, A. G., et al. Cystic fibrosis airway secretions exhibit mucin hyperconcentration and increased osmotic pressure. J Clin Invest. 124 (7), 3047-3060 (2014).
- Preciado, D., et al. MUC5B Is the predominant mucin glycoprotein in chronic otitis media fluid. Pediatr Res. 68 (3), 231-236 (2010).
- Wang, Y. Y., et al. IgG in cervicovaginal mucus traps HSV and prevents vaginal herpes infections. Mucosal Immunol. 7 (5), 1036-1044 (2014).
- Linden, S. K., Sutton, P., Karlsson, N. G., Korolik, V., McGuckin, M. A. Mucins in the mucosal barrier to infection. Mucosal Immunol. 1 (3), 183-197 (2008).
- Thornton, D. J., et al. Mucus glycoproteins from 'normal' human tracheobronchial secretion. Biochem J. 265 (1), 179-186 (1990).
- Kesimer, M., Makhov, A. M., Griffith, J. D., Verdugo, P., Sheehan, J. K. Unpacking a gel-forming mucin: a view of MUC5B organization after granular release. Am J Physiol Lung Cell Mol Physiol. 298 (1), L15-L22 (2010).
- Kesimer, M., Sheehan, J. K. Mass spectrometric analysis of mucin core proteins. Methods Mol Biol. 842, 67-79 (2012).
- van der Post, S., Thomsson, K. A., Hansson, G. C. Multiple enzyme approach for the characterization of glycan modifications on the C-terminus of the intestinal MUC2mucin. J Proteome Res. 13 (12), 6013-6023 (2014).
- Thornton, D. J., Carlstedt, I., Sheehan, J. K. Identification of glycoproteins on nitrocellulose membranes and gels. Methods Mol Biol. 32, 119-128 (1994).
- Thornton, D. J., Carlstedt, I., Sheehan, J. K. Identification of glycoproteins on nitrocellulose membranes and gels. Mol Biotechnol. 5 (2), 171-176 (1996).
- Sheehan, J. K., et al. Physical characterization of the MUC5AC mucin: a highly oligomeric glycoprotein whether isolated from cell culture or in vivo from respiratory mucous secretions. Biochem J. 347 Pt 1, 37-44 (2000).
- Thornton, D. J., Howard, M., Khan, N., Sheehan, J. K. Identification of two glycoforms of the MUC5B mucin in human respiratory mucus. Evidence for a cysteine-rich sequence repeated within the molecule. J Biol Chem. 272 (14), 9561-9566 (1997).
- Sheehan, J. K., et al. Identification of molecular intermediates in the assembly pathway of the MUC5AC mucin. J Biol Chem. 279 (15), 15698-15705 (2004).
- Ehre, C., et al. Overexpressing mouse model demonstrates the protective role of Muc5ac in the lungs. Proc Natl Acad Sci U S A. 109 (41), 16528-16533 (2012).
- Livraghi, A., et al. Airway and lung pathology due to mucosal surface dehydration in {beta}-epithelial Na+ channel-overexpressing mice: role of TNF-{alpha} and IL-4R{alpha} signaling, influence of neonatal development, and limited efficacy of glucocorticoid treatment. J Immunol. 182 (7), 4357-4367 (2009).
- Martino, M. B., et al. The ER stress transducer IRE1beta is required for airway epithelial mucin production. Mucosal Immunol. 6 (3), 639-654 (2013).
- Nguyen, L. P., et al. Chronic exposure to beta-blockers attenuates inflammation and mucin content in a murine asthma model. Am J Respir Cell Mol Biol. 38 (3), 256-262 (2008).
- Papakonstantinou, E., et al. COPD exacerbations are associated with pro-inflammatory degradation of hyaluronic acid. Chest. , (2015).
- Abdullah, L. H., Wolber, C., Kesimer, M., Sheehan, J. K., Davis, C. W. Studying mucin secretion from human bronchial epithelial cell primary cultures. Methods Mol Biol. 842, 259-277 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon