Method Article
Acqua in emulsioni olio: un nuovo sistema di montaggio idrosolubili proteine clorofilla vincolante con pigmenti idrofobi
In questo articolo
Riepilogo
Questo manoscritto descrive un metodo semplice e ad alta produttività per assemblare proteine solubili in acqua con pigmenti idrofobiche che è basato su emulsioni acqua-in-olio. Dimostriamo l'efficacia del metodo per l'assemblaggio di clorofille nativi con quattro varianti di ricombinante solubile in acqua-clorofilla proteine leganti (WSCPs) di piante Brassica espressi in E. coli.
Abstract
Clorofille (Chls) e batterioclorofilla (BChls) sono i cofattori principali che effettuano la raccolta luce fotosintetica e di trasporto degli elettroni. La loro funzionalità dipende in modo critico dalla loro specifica organizzazione all'interno di grandi ed elaborati complessi proteici multisubunit transmembrana. Per comprendere a livello molecolare come questi complessi facilitano conversione dell'energia solare, è essenziale comprendere proteina-pigmento, e le interazioni pigmenti pigmento, e il loro effetto sulla dinamica eccitati. Un modo per ottenere questo senso sia costruendo e studiando complessi di Chls con semplici proteine ricombinanti solubili in acqua. Tuttavia, incorporando le Chls lipofile e BChls in proteine solubili in acqua è difficile. Inoltre, non esiste un metodo generale, che potrebbero essere utilizzati per l'assemblaggio delle proteine solubili in acqua con pigmenti idrofobi. Qui, dimostriamo un sistema di throughput semplice ed alta basato su emulsioni acqua-in-olio, che consente assembly di proteine solubili in acqua con Chls idrofobi. Il nuovo metodo è stato convalidato assemblando versioni ricombinanti della clorofilla proteina legante idrosolubile di Brassicaceae piante (WSCP) con Chl a. Dimostriamo l'assemblaggio di successo di Chl A utilizzando lisati grezzi di WSCP esprimono E. cellule coli, che può essere usato per sviluppare un sistema di screening genetico per nuove proteine Chl-leganti idrosolubili, e per studi di interazione Chl-proteina e processi di assemblaggio.
Introduzione
pigmenti idrofobi, come clorofille (Chls), batterioclorofilla (BChls) e carotenoidi sono i cofattori primari in centri di reazione fotosintetici e le proteine di raccolta di luce che effettuano trasporto di elettroni, e la cattura l'energia della luce e il trasferimento. I centri di reazione e la maggior parte dei complessi di raccolta della luce Chl-leganti sono proteine transmembrana. La Fenna-Matthews-Olson (FMO) proteine di batteri fotosintetici verde-zolfo non oxygenic 1,2, e la proteina peridinina-Chl (PCP) dei dinoflagellati 3 sono esempi eccezionali di solubili in acqua proteine luce raccolta. Il legame clorofilla proteine solubili in acqua (WSCPs) di Brassicacee, Polygonaceae, Chenopodiaceae e piante Amaranthaceae 4, 5 sono un altro esempio unico, ma a differenza di FMO e PCP, questi non sono coinvolti nella raccolta della luce, né in alcuna della reazione fotosintetica primaria , e la loro precisa pHYfunzioni siological sono ancora poco chiari 5-8. La loro alta affinità Chl vincolante hanno portato ad una funzione suggerito come portatori transitori di Chls e derivati Chl 9,10. In alternativa, è stato ipotizzato che WSCP svolge un ruolo nei collettori Chls in cellule danneggiate e protegge contro Chl-indotta danni photooxidative 7,11-13. Più di recente, è stato suggerito che le funzioni WSCP come un inibitore della proteasi e svolge un ruolo durante la resistenza erbivoro e regola la morte delle cellule durante lo sviluppo del fiore 14. WSCPs sono divisi in due classi principali in base alle loro proprietà fotofisiche. La prima classe (classe I, ad es. Da Chenopodium album) può subire fotoconversione su di illuminazione. WSCPs Classe II da piante del genere Brassica, che non subiscono fotoconversione 5,10, sono ulteriormente suddivisi in classe IIa (ad es., Dalla Brassica oleracea, Raphanus sativus) e IIb (ad es., Da lepidium virginicum ). La struttura di classe IIb WSCP da lepidium virginicum è stato risolto con la cristallografia a raggi X con una risoluzione di 2.0 Å 8. Si rivela un omotetramero simmetrica in cui le subunità proteiche formano un core idrofobico. Ogni subunità lega un singolo Chl che si traduce in una stretta disposizione di quattro Chls stipati all'interno delle core.This semplice tutti convenire Chl rende WSCPs un sistema modello potenzialmente utile per studiare vincolante e assemblaggio di complessi Chl-proteina, e gli effetti della vicina Chls e ambienti proteine sulle proprietà spettrali ed elettroniche di singoli Chls. Inoltre, può fornire modelli per la costruzione di proteine artificiali Chl vincolanti che possono essere utilizzati per i moduli che raccolgono la luce nei dispositivi fotosintetici artificiali.
Studi rigorosi di WSCPs nativi non sono realizzabili perché i complessi purificati da piante contengono sempre una miscela eterogenea di tetrameri con diverse combinazioni di Chl ae Chl b 9. Pertanto, è necessario un metodo per assemblare WSCPs ricombinanti espresse con Chls in vitro. Questo è contestata dalla trascurabile idrosolubilità Chls che rende impossibile assemblare il complesso in vitro per semplice miscelazione dei apoproteine idrosolubili con pigmenti in soluzioni acquose. In vitro assemblaggio miscelando i apoproteine con membrane tilacoidi 15 è stata dimostrata, ma questo metodo è limitato al nativo Chls presente nei tilacoidi. Schmidt et al. riportato sul montaggio diversi derivati Chl e BCHL con WSCP dal cavolfiore (CaWSCP) esprimendo una proteina ricombinante, istidina-marcato in E. coli immobilizzare esso su una colonna Ni-affinità e l'introduzione di strumenti derivati Chl solubilizzati nei detergenti 11. Con successo della ricostituzione di WSCPs ricombinanti da A. thaliana 6, e cavolini di Bruxelles (BoWSCP), giapponese ravanello selvatico (RshWSCP) unsono stati anche riferito d Virginia pepperweed (LvWSCP) con un metodo simile.
Qui, vi presentiamo un romanzo, in generale, il metodo semplice per l'assemblaggio di Chls con WSCP che non richiede codifica o immobilizzare le proteine. Essa si basa sulla preparazione di emulsioni dalle loro soluzioni acquose dei apoproteine idrosolubili in olio minerale. Le proteine sono quindi incapsulati in acqua-in-olio (W / O) microgocce con un'elevata superficie in rapporto al volume 16. I cofattori idrofobi vengono disciolti nell'olio e vengono facilmente introdotti nelle goccioline della fase oleosa. Riportiamo di utilizzare il metodo per l'assemblaggio di diverse varianti di apoproteine WSCP ricombinante espresse in E. coli con Chl a. Dimostriamo il gruppo dal lisato grezzo di batteri WSCP-iperespressione che possono essere utilizzati come un sistema di screening per lo sviluppo di nuovi Chl proteine leganti.
Protocollo
1. Preparazione Chl uno stock Solutions
- PUNTO CRITICO: eseguire tutte le fasi della preparazione clorofilla in una cappa chimica, sotto luce verde (520 nm) o al buio, al fine di ridurre al minimo fotodanneggiamento. Aggiungere sempre azoto o argon prima del congelamento dei pigmenti per la conservazione. Assicurarsi che tutti i solventi sono grado analitico.
- Pesare circa 5 mg di cellule Spirulina platensis liofilizzati o altre cellule cianobatterio che contengono solo Chl a nelle membrane tilacoidi e schiacciarlo con un mortaio e pestello.
- Caricare cellule schiacciato su una colonna di vetro e lavare con circa 50-100 ml di 100% di acetone per rimuovere carotenoidi. Eliminare il arancione / verde frazione eluita.
Nota: Se la frazione arancione non sia eluito con 100 ml di acetone continuano lavare le cellule con acetone fino frazione verde inizia ad eluire. - Scambio di acetone con il 100% di metanolo e raccogliere la frazione verde contenente Chl a. Il volume di fract eluitaioni può variare tra 50-100 ml. All'inizio, la frazione eluita ha un colore verde scuro, che cambia in verde pallido a fine eluizione. Quando il colore della frazione eluita si trasforma in verde pallido fermare l'eluizione.
- Si evapora il metanolo usando un evaporatore rotante fino l'estratto è completamente asciutta. Non applicare calore alla soluzione; accertarsi che la temperatura bagnomaria dell'evaporatore non superi 30 ° C.
Nota: Il tempo di evaporazione dipende dal volume della frazione metanolo essere evaporato e può variare tra 10-60 min. È importante asciugare completamente estratto. - Sciogliere i pigmenti estratto secco in un piccolo volume di etere dietilico (5-10 ml) e filtrata attraverso cotone idrofilo. Assicurarsi che i pigmenti sono completamente disciolti in etere prima del filtraggio.
- Far evaporare l'etere etilico fino a quando i pigmenti sono completamente asciutti (10-30 min).
Nota: I pigmenti secchi possono essere eliminati con e tenuti sotto azoto o argon a -20 ° C, al buio, fino al procedimento. - Sciogliere i pigmenti secchi nel minor volume possibile di 100% metanolo (circa 1 ml), anche se non tutto è completamente sospeso. Aggiungere 4 ml di acetone alla soluzione, e flick il vetro delicatamente per sciogliere completamente i pigmenti.
- Usando una pipetta Pasteur, caricare il campione delicatamente su una colonna di DEAE Sepharose equilibrata in 100% acetone.
- carotenoidi Eluire (una banda giallo-arancio) con il 100% di acetone. Poi, eluire Chl a (fascia verde) con 3: miscela 1 v / v acetone / metanolo.
Nota: Il volume di acetone e la miscela acetone / metanolo è approssimativamente equivalente al volume di DEAE Sepharose caricata sulla colonna. - Verifica Chl purezza, in cromatografia su strato sottile utilizzando un 68: 25: 5: 2 diclorometano / n-esano / isopropanolo / metanolo (v / v) come eluente la miscela 17.
- Si evapora il solvente usando un evaporatore rotante fino alla Chl a completa asciugatura (10-60 min).
Nota: Il secco Chl a poter essere spurgato con azoto o argon e conservati in atmosfera di argon a -20 ° C al buio. - Preparare Chl una soluzione stock di ri-dissoluzione secco Chl a in 2-4 ml di etanolo al 100%.
Nota: Il coefficiente di estinzione di Chl a a 663 nm è 74.400 cm -1 M -1 (83,3 cm -1 (mg / ml) -1) in etanolo. Una tipica soluzione di riserva deve avere OD di 1.860 corrispondente ad una concentrazione di 25 mM (23 mg / ml). Aggiunta di 20 microlitri di questo stock da un'emulsione contenente 5 ml di fase organica, e 1 mg di WSCP in 1 ml di risultati di fase acquosa in una miscela con 10 volte eccesso molare di Chl a vs. WSCP.
2. Preparazione fase organica dell'emulsione
Nota: La fase organica dell'emulsione è composto da olio minerale contenente 4,5% (v / v) Span 80, e 0,4% (v / v) Tween 80.
- Pesare in 50 ml tubo 0,2 g di Tween 80, 1,8 g di Span 80, e 38 g di olio minerale. Mescolare bene tutti i componenti e raffreddare su ghiaccio.
Nota: La fase organica può essere memorizzato in 4 ° C fino ad una settimana.
3. Preparazione della fase acquosa dell'emulsione
Nota: La fase acquosa dell'emulsione può essere composto da uno WSCP purificato, o l'estratto grezzo di batteri iperesprimono WSCP.
- Preparazione di una fase acquosa contenente WSCP purificata.
- Grow batteri E.coli BL21 contenenti WSCP plasmide 12 in 1 L di terreno LB a 37 ° C fino a OD di 0.3-0.6.
- Indurre l'espressione delle proteine con l'aggiunta di 1 mM IPTG. Dopo l'induzione crescere batteri a 30 ° C per 12-16 ore.
- batteri Harvest per centrifugazione a 5.000 xg per 10 minuti a 4 ° C.
- Sciogliere il pellet nel buffer e ultrasuoni vincolante sul ghiaccio (30 sec a 15 sec spento, cinque volte). Usare 10 ml di tampone per il pellet ottenuto dalla centrifugazione di 250 ml diterreno LB con cellule che sovraesprimono la proteina.
Nota: A seconda del metodo di purificazione, il tampone di legame può essere composto da 100 mM tampone fosfato, pH 7,2 o 50 mM Tris, pH 7,5, 500 mM NaCl, 5 mM EDTA. - Centrifugare il lisato cellulare a 12.000 xg per 30 min a 4 ° C.
- Purificare WSCP mediante cromatografia di affinità. A seconda del tag fuso WSCP, purificare le proteine ricombinanti utilizzando il sistema di cromatografia di affinità disponibile in commercio adatto per la purificazione della proteina seguendo le istruzioni del produttore.
- Per la preparazione dell'emulsione, utilizzare WSCP purificata in 50 mM tampone fosfato, pH 7,8. Assicurarsi che la quantità di proteine finale usata per la ricostituzione è 0,5-1,0 mg per 1 ml di tampone.
- Preparazione di una fase acquosa contenente lisato batterico grezzo con WSCP.
- Crescere le cellule di E.coli BL21 contenenti WSCP plasmide esprimente in 250 ml di terreno LB a 37 ° C fino a OD 0.3-0.6.
- Indurre l'espressione della proteina con1 mM IPTG e crescere i batteri notte a 30 ° C.
- cellule batteriche Harvest per centrifugazione a 5.000 xg per 10 minuti a 4 ° C.
- Sciogliere il pellet in 1-2 ml di 50 mM tampone fosfato di sodio pH 7,8, Sonicare (30 sec acceso, 15 sec off, tre volte) e centrifugare a 12.000 xg per 30 min a 4 ° C.
- Preparare la fase acquosa dell'emulsione mescolando 0,125 ml di surnatante con 0,875 ml di 50 mM sodio fosfato tampone pH 7.8.
4. Montaggio di WSCP con Chl a in emulsione
- Transfer 5 ml di miscela olio-tensioattivo in una fiala di vetro e raffreddare in ghiaccio. Prima di pipettamento, verificare che tutti i componenti della fase organica vengono miscelati accuratamente e non vi è alcuna separazione di fase tra tensioattivi e olio minerale.
- Aggiungere 1 ml di fase acquosa ghiacciata preparato come al punto 3 a 5 ml di fase organica.
- Mescolare le due fasi usando un omogeneizzatore tessuto per 2 min a 9500 rpm su ghiaccio.
- PUNTO CRITICO: Da questo punto in poi, eseguire tutte le ulteriori passi sotto la luce verde (520 nm) al fine di minimizzare fotodanneggiamento. Aggiungere 20 ml di 25 mM Chl una soluzione madre (vedi paragrafo 1.13) per l'emulsione. Disperdere muovendo e invertendo la fiala di vetro. Assicurarsi che il Chl è distribuito uniformemente in emulsione.
- Incubare la emulsione per 1-2 ore in ghiaccio al buio.
- Al fine di abbattere l'emulsione e goccioline di acqua separata dalla fase organica trasferire l'emulsione in provette di plastica da 1,5 ml e centrifugare a 14000 xg per 5 min a temperatura ambiente.
Nota: Se il gruppo ha successo, la fase acquosa inferiore dovrebbe avere un colore verde. - Smaltire la fase superiore dell'olio e aggiungere 1 ml di olio minerale. Mescolare bene l'olio minerale con l'emulsione pellet dal vortice o girando la provetta accuratamente. Centrifugare il campione a 14.000 xg per 5 min a temperatura ambiente. Ripetere questa operazione fino a quando un menisco chiaro che separa il acquosa e minatorefasi di petrolio al, senza alcuna emulsione intermedio si ottiene.
- Eseguire questo passaggio in una cappa chimica. Dopo le fasi di petrolio acquose e minerali sono chiaramente separati, rimuovere l'olio minerale e aggiungere 1 ml di acqua satura di etere etilico. Vortex e centrifugare il campione a 14.000 xg per 5 min a temperatura ambiente. Ripetere questa operazione due volte.
- Dopo la seconda centrifugazione, eliminare l'etere etilico e lasciare i tubi aperti per 5-20 min nella cappa.
- Infine, caricare la fase acquosa contenente la WSCP / Chl un complesso su una colonna dissalazione ed eluire con tampone appropriato per ulteriori esperimenti.
Nota: La proteina è stabile in buffer Tris fosfati o in una vasta gamma di pH (6.0-7.5). Il campione può essere conservato a 4 ° C al riparo dalla luce fino a un mese.
Risultati
Apoproteine WSCP ricombinanti sono stati assemblati con Chl a in emulsioni / O W secondo il protocollo descritto nella sezione precedente. Il protocollo è stato implementato utilizzando fasi acquose contenenti sia WSCPs puri, o lisati cellule di E.coli sovraesprimono WSCP (Figura 1). Il protocollo è semplice, veloce e non richiede particolari attrezzature tranne un omogeneizzatore tessuto.
L'assorbanza e spettri CD di Chl a complessi di quattro varianti WSCP ricombinanti, vale a dire RshWSCP, CaWSCP, BoWSCP e LvWSCP sono mostrati in Figura 2. Questi sono simili nella forma di banda e la posizione di spettri precedentemente riportato dei rispettivi complessi nativi 10,18, 19. Questi risultati mostrano chiaramente che WSCP / complessi Chl ricostituiti nel sistema I / O emulsione W assomiglia complessi nativi.
Per dimostrare il potenziale di emulsioni W / O come un sistema di screening rapido per l'assemblaggio positivo WSCPs con Chls, lisati grezzi di cellule di E.coli che esprimono WSCPs stati usati come fase acquosa dell'emulsione. Lisati di batteri che non esprimono WSCPs stati usati come controllo negativo. Assemblaggio positiva di WSCP con Chl a viene facilmente osservata dal colore verde della fase acquosa, ma solo in lisati di cellule esprimenti WSCP (Figura 3). Goccioline contenenti questi lisati caratteristica distinta Chl a fluorescenza in immagini al microscopio confocale. Questo implica che l'assemblaggio successo WSCP / Chl complessi può essere rilevata direttamente in goccioline d'acqua, che può essere la base per sistemi di screening basati su emulsioni W / O.
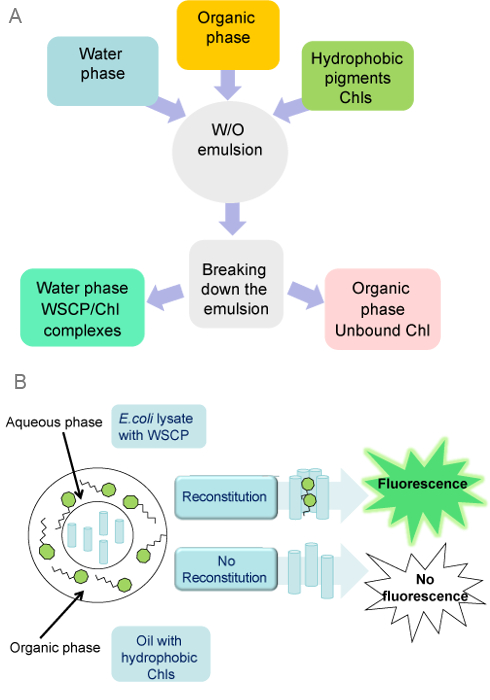
Figura 1: Assemblea dei WSCP con Chls in W / O Emulsioni (A. ) In un protocollo preparativa, la fase organica viene miscelato con una fase acquosa, contenente WSCP purificato o lisati cellulari esprimenti E.coli WSCP. Quando l'emulsione è pronto, Chls sono aggiunti all'emulsione. Dopo ricostituzione, goccioline d'acqua sono separati da fase organica mediante centrifugazione. (B) W sistema di emulsione / O può essere utilizzato per throughput screening veloce e di alta per la ricostituzione positivo di WSCPs con Chls. La fluorescenza del complesso / Chl WSCP può essere rilevato direttamente dalle microgocce d'acqua da parte di un microscopio confocale. Clicca qui per vedere una versione più grande di questa figura.
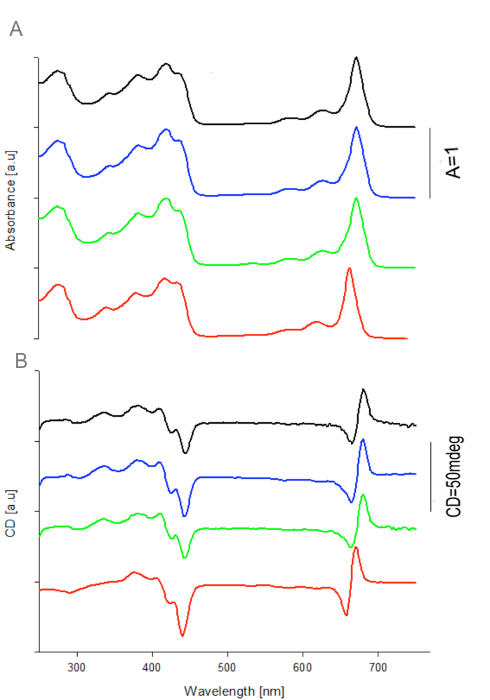
Figura 2: Assorbanza e spettri CD di WSCP / Chl a Complessi apoproteine di quattro.Varianti WSCP sono stati ricostituiti con 10 volte eccesso molare di Chl a. Gli spettri di assorbimento (a) sono stati normalizzati per 1 a 673nm per BoWSCP (nero), CaWSCP (verde), e RshWSCP (blu) e 663nm per LvWSCP (rosso). Gli stessi fattori di normalizzazione sono stati applicati al CD (b). Riprodotto con il permesso di 16. Cliccate qui per vedere una versione più grande di questa figura.
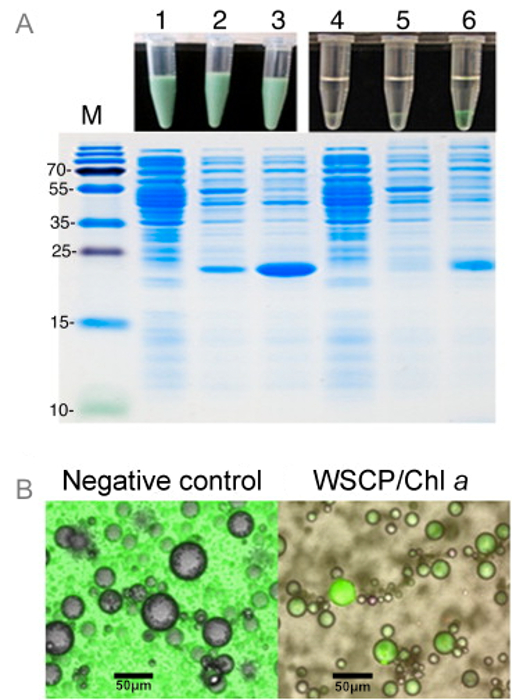
Figura 3: la scansione microscopia a fluorescenza e Visual Proiezione di WSCP / Chl Assembly Complex (A) SDS-PAGE di E.. lisati cellulari coli BL21 prima e dopo ricostituzione con Chl a nelle emulsioni W / O. Corsia 1: cellule BL21 senza il plasmide WSCP, corsia 2: le cellule BL21 con il PLA WSCPSmid senza induzione con IPTG, corsia 3: cellule BL21 con il plasmide WSCP indotta con IPTG. Corsia 4, 5 e 6 sono gli stessi campioni come corsie 1, 2 e 3, rispettivamente, ma dopo separazione dell'acqua fase organica dalla fase dell'emulsione. Piccole aliquote di ciascun campione sono stati analizzati su un gel SDS-proteina. Corsia M: marcatore dimensioni delle proteine. Immagini dei campioni prima e dopo la separazione di fase sono mostrati in cima a ciascuna corsia. (B) immagini al microscopio confocale di goccioline W / O preparate con Chl a nella fase oleosa. Le goccioline sulla immagine a sinistra non contenevano alcuna proteina, mentre quelle sul diritto di immagine conteneva proteine WSCP. La fluorescenza è stata monitorata a 682 nm. Riprodotto con il permesso di 16. Cliccate qui per vedere una versione più grande di questa figura.
Discussione
Il nostro obiettivo era quello di sviluppare un nuovo sistema generale per l'assemblaggio delle proteine clorofilla-binding solubili in acqua con pigmenti idrofobiche. Qui si dimostra che il nuovo sistema di ricostituzione basato su W / O emulsione è un approccio generale dimostrato di funzionare per l'assemblaggio di apoproteine WSCP da cavolini di Bruxelles, cavolfiore, rafano giapponese e Virginia pepperweed ricombinante espresse in E. coli. Qui i risultati sono presentati dalla ricostituzione di 1 mg di WSCP con 10 volte eccesso molare di Chl a. Tuttavia è anche possibile utilizzare concentrazioni più basse di WSCP per ricostruzioni e differenti / proteina rapporti molari Chl. La quantità minima di proteine, che siamo stati in grado di assemblare in emulsioni / O W era 100 mg, mentre il pigmento rapporto proteina potrebbe variare da 5: 1 e fino a 20: 1. Inoltre, il volume della fase acquosa potrebbe essere abbassata fino a 50 microlitri. In questo lavoro viene presentato l'assemblaggio di WSCP con Chl a. Tuttavia, è anche possibile montareWSCP con altri Chls idrofobici, BChls e loro derivati. Attualmente, stiamo testando il nostro sistema con altre proteine pigmento-binding solubili in acqua, come FMO e PCP.
Anche se, il nostro metodo è semplice e veloce ci sono alcuni passaggi critici, che devono essere considerati durante la preparazione / O W e la ricostituzione di WSCP con Chl. Le fiale di vetro, che sono utilizzati per la preparazione dell'emulsione, devono essere puliti e privi di detersivo. Anche piccole tracce di detergenti in fiale influenzerà la preparazione dell'emulsione e causare bassa qualità dell'emulsione. Inoltre, i flaconcini devono essere completamente asciutti. Altro passaggio fondamentale, che possa influenzare l'efficienza di ricostituzione, è completamente dispersione di Chl in fase organica di emulsione. Pertanto, è importante mescolare completamente un piccolo volume di Chl in 5 ml di emulsione. È altresì importante fare altrettante fasi necessarie per abbattere emulsione e rimuovere completamente l'olio minerale da fase acquosa. Eventuali tracce di oli minerali in acqua pHase potrebbe influenzare ulteriori esperimenti.
W / O emulsione è un approccio alternativo per il metodo stabilito dalla Schmidt et al. 11, che si basava su immobilizzare WSCP His-tag sulla cromatografia su colonna di affinità e incubazione con Chls. Anche se, il metodo di Schmidt et al., Ha dimostrato di lavorare per diverse WSCPs, richiede proteine His-tag e può provocare legame non specifico di Chls mediante legatura alle istidine del tag. Inoltre, immobilizzare proteine su una superficie solida può influenzare la struttura della proteina, influenzando così il processo di assemblaggio con pigmenti. Inoltre, Chl, che è stato utilizzato per il montaggio di WSCPs in questo sistema è stato sciolto in tampone contenente sia detersivi o 40% metanolo 11,12. Tali solventi possono causare aggregazione pigmento e / o non specifico legame Chl a WSCP. Il nostro nuovo sistema di ricostituzione basato su W / O emulsione non si basa su immobilizzare le proteine di supporto solido. therefore, non è richiesto alcun tag purificazione fuso WSCPs, e proteine ricombinanti con sequenza nativa può essere montato. Un altro importante vantaggio del metodo W / O è in minimizzare pigmenti aggregazione che possono influenzare l'efficienza ricostituzione, oligomerizzazione e stechiometria pigmento / proteina. Questo perché i pigmenti idrofobi sono disciolti nella fase oleosa e la loro introduzione nelle goccioline W / O è abilitato dalla superficie elevata in rapporto al volume di quest'ultimo. Inoltre, il legame aspecifico di Chls di WSCP sia aggirata dal pigmenti idrofobi non possono diffondere tra fasi organica ed acquosa dell'emulsione. Solo pigmenti che sono attivamente assemblati dal WSCP Durante la ricostituzione può entrare nel microgocce d'acqua dell'emulsione.
Metodo per assemblare WSCP con pigmenti mescolando WSCP con tilacoidi isolati 10 è simile al sistema di emulsione W / O qui presentata. Si richiede detergenti o solventi organici per Solubilizing le Chls, non codifica le proteine. Tuttavia, il metodo W / O può essere utilizzato con pigmenti che è solubile nella fase oleosa che il metodo precedente è limitato a Chls che sono nativamente presenti nelle membrane tilacoidi. Così, il montaggio con puro Chl a Chl o D è possibile da perché questi sono disponibili da tilacoidi cianobatteri di esempio. Synechocystis PCC 6803 o Acaryochloris marina, rispettivamente. Tuttavia, non è possibile ricostituire WSCP con Chl b poiché questo pigmento è sempre accompagnato da un Chl in tilacoidi. Al contrario, il montaggio WSCP in emulsione / O W può essere testato con qualsiasi Chl, BCHL o porfirina derivati naturali o artificiali. Non richiede utilizzando membrane fotosintetiche e, quindi, è libero da interferenze di componenti extra-membrana, come ficobilisoma che possono essere associate alle membrane di cianobatteri. Il metodo W / O è limitata solo dalla solubilità dei pigmenti nella fase oleosa unaND quindi adatto per il montaggio WSCP con qualsiasi Chl, BCHL o porfirina derivati naturali o artificiali.
In sintesi, abbiamo presentato qui un metodo generale per l'assemblaggio di proteine solubili in acqua con pigmenti idrofobiche. I suoi vantaggi sono stati di dimostrata dall'assemblea successo di Chl a diverse WSCPs ricombinanti da piante del genere Brassica, come chiaramente indicato dal spettroscopiche e risultati biochimici. Inoltre, abbiamo dimostrato come il protocollo di montaggio W / O può essere utilizzato per una rapida proiezione di WSCP / Chl assieme complesso utilizzando lisati cellulari E.coli iperespressione WSCPs ricombinanti ed estratti Chl greggio. In questo modo si può ignorare tempo fasi di purificazione di proteine e la necessità di rompere emulsioni per separare le goccioline d'acqua dalla fase organica può essere evitata anche mediante microscopia a fluorescenza per visualizzare direttamente l'assemblaggio in goccioline d'acqua. L'applicabilità generale del nuovo metodo permette un usostrumento per lo studio Ful vincolante cofattore e l'assemblaggio, e meccanismi energetico e trasferimento di elettroni in transmembrana complessi proteici-cofattore progettando e costruendo le loro semplificate analoghi proteine solubili in acqua artificiali.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti.
Riconoscimenti
DN riconosce il sostegno dell'Unione europea del 7 ° PQ progetti PEPDIODE (GA 256.672) e REGPOT-2012-2013-1 (GA 316.157), e un assegno di ricerca personale (n ° 268/10) dalla Israel Science Foundation. Ringraziamo il Prof. Shmuel Rubinstein, Facoltà di Ingegneria e Scienze Applicate, Università di Harvard, Cambridge, MA, USA per prendere le immagini di microscopia confocale.
Materiali
| Name | Company | Catalog Number | Comments |
| Mineral oil | Sigma | M5904 | |
| Span80 | Sigma | 85548 | |
| Tween80 | Sigma | P8074 | |
| Bio-Scale Mini Profinity eXact Cartridges | Bio Rad | 10011164 | Affinity chromatography for WSCP purification with native sequence. |
| His Trap HF column | GE Healthcare Life Science | 17-5248-02 | Affinity chromatography for WSCP purification with His-tag |
| DEAE Sepharose Fast Flow | GE Healthcare Life Science | 17-0709-01 | Chromatography medium for chlorophyll purification |
Riferimenti
- Bryant, D. A., Frigaard, N. -. U. Prokaryotic photosynthesis and phototrophy illuminated. Trends Microbiol. 14, 488-496 (2006).
- Tronrud, D. E., Wen, J. Z., Gay, L., Blankenship, R. E. The structural basis for the difference in absorbance spectra for the FMO antenna protein from various green sulfur bacteria. Photosynth. Res. 100, 79-87 (2009).
- Schulte, T., Johanning, S., Hofmann, E. Structure and function of native and refolded peridinin-chlorophyll-proteins from dinoflagellates. Eur. J. Cell Biol. 89, 990-997 (2010).
- Renger, G., et al. Water soluble chlorophyll binding protein of higher plants: a most suitable model system for basic analyses of pigment-pigment and pigment-protein interactions in chlorophyll protein complexes. J. Plant Physiol. 168, 1462-1472 (2011).
- Satoh, H., Uchida, A., Nakayama, K., Okada, M. Water-soluble chlorophyll protein in Brassicaceae plants is a stress-induced chlorophyll-binding protein. Plant Cell Physiol. 42, 906-911 (2001).
- Bektas, I., Fellenberg, C., Paulsen, H. Water-soluble chlorophyll protein (WSCP) of Arabidopsis is expressed in the gynoecium and developing silique. Planta. 236, 251-259 (2012).
- Damaraju, S., Schlede, S., Eckhardt, U., Lokstein, H., Grimm, B. Functions of the water soluble chlorophyll-binding protein in plants. J. Plant Physiol. 168, 1444-1451 (2011).
- Horigome, D., et al. Structural mechanism and photoprotective function of water-soluble chlorophyll-binding protein. J. Biol. Chem. 282, 6525-6531 (2007).
- Reinbothe, C., Satoh, H., Alcaraz, J. -. P., Reinbothe, S. A Novel Role of Water-Soluble Chlorophyll Proteins in the Transitory Storage of Chorophyllide. Plant Physiol. 134, 1355-1365 (2004).
- Satoh, H., Nakayama, K., Okada, M. Molecular cloning and functional expression of a water-soluble chlorophyll protein, a putative carrier of chlorophyll molecules in cauliflower. J. Biol. Chem. 273, 30568-30575 (1998).
- Schmidt, K., Fufezan, C., Krieger-Liszkay, A., Satoh, H., Paulsen, H. Recombinant water-soluble chlorophyll protein from Brassica oleracea var. Botrys binds various chlorophyll derivatives. Biochemistry. 42, 7427-7433 (2003).
- Takahashi, S., et al. Molecular cloning, characterization and analysis of the intracellular localization of a water-soluble Chl-binding protein from Brussels sprouts (Brassica oleracea var. gemmifera). Plant Cell Physiol. 53, 879-891 (2012).
- Takahashi, S., Ono, M., Uchida, A., Nakayama, K., Satoh, H. Molecular cloning and functional expression of a water-soluble chlorophyll-binding protein from Japanese wild radish. J. Plant Physiol. 170, 406-412 (2013).
- Boex-Fontvieille, E., Rustgi, S., von Wettstein, D., Reinbothe, S., Reinbothe, C. Water-soluble chlorophyll protein is involved in herbivore resistance activation during greening of Arabidopsis thaliana. Proc. Natl. Acad. Sci. U. S. A. 112, 7303-7308 (2015).
- Hughes, J. L., et al. Magneto-optic spectroscopy of a protein tetramer binding two exciton-coupled chlorophylls. J. Am. Chem. Soc. 128, 3649-3658 (2006).
- Bednarczyk, D., Takahashi, S., Satoh, H., Noy, D. Assembly of water-soluble chlorophyll-binding proteins with native hydrophobic chlorophylls in water-in-oil emulsions. BBA - Bioenergetics. 1847, 307-313 (2015).
- Fiedor, L., Rosenbach-Belkin, V., Scherz, A. The stereospecific interaction between chlorophylls and chlorophyllase. Possible implication for chlorophyll biosynthesis and degradation. J. Biol. Chem. 267, 22043-22047 (1992).
- Kamimura, Y., Mori, T., Yamasaki, T., Katoh, S. Isolation, properties and a possible function of a water-soluble chlorophyll a/b-protein from brussels sprouts. Plant Cell Physiol. 38, 133-138 (1997).
- Murata, T., Itoh, R., Yakushiji, E. Crystallization of water-soluble chlorophyll-proteins from Lepidium virginicum. Biochim. Biophys. Acta. 593, 167-170 (1980).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon