Method Article
Wasser in Öl-Emulsionen: Ein neues System für die Montage wasserlösliche Chlorophyll-bindenden Proteine mit hydrophober Pigments
In diesem Artikel
Zusammenfassung
Diese Handschrift beschreibt eine einfache und Hochdurchsatzverfahren für wasserlösliche Proteine mit hydrophoben Pigmente Zusammenbauen, die auf Wasser-in-Öl-Emulsionen basiert. Wir zeigen die Wirksamkeit des Verfahrens bei der Montage von nativen Chlorophylle mit vier Varianten von rekombinantem wasserlösliches Chlorophyll-Bindungsproteine (WSCPs) von Brassica - Pflanzen in E. ausgedrückt coli.
Zusammenfassung
Chlorophylle (Chls) und bacteriochlorophylls (BChls) sind die primären Cofaktoren, die photosynthetischen Lichtnutzung und Elektronentransport durchzuführen. Ihre Funktionalität hängt entscheidend von ihrer spezifischen Organisation in großen und aufwendigen Multiuntertransmembranprotein-Komplexe. Um auf molekularer Ebene zu verstehen, wie diese Komplexe Umwandlung von Solarenergie zu erleichtern, ist es wesentlich, Protein-Pigment, und das Pigment-Pigment-Wechselwirkungen und ihre Wirkung auf die angeregten Dynamik zu verstehen. Eine Möglichkeit, ein solches Verständnis zu gewinnen, ist durch die Konstruktion und Komplexe von Chls mit einfachen wasserlöslichen rekombinanten Proteinen zu studieren. Jedoch ist die lipophile Chls und BChls in wasserlösliche Proteine enthält schwierig. Darüber hinaus gibt es kein allgemeines Verfahren, das für die Montage von wasserlöslichen Proteinen mit hydrophoben Pigmente verwendet werden könnten. Hier zeigen wir ein einfaches und hohen Systemdurchsatz auf Basis von Wasser-in-Öl-Emulsionen, die Esel ermöglichtembly von wasserlöslichen Proteinen mit hydrophoben Chls. Das neue Verfahren wurde durch Zusammenfügen von rekombinanten Versionen des wasserlöslichen Chlorophylls Bindungsprotein von Brassicaceae Pflanzen (WSCP) mit Chl validierten einem. Wir zeigen die erfolgreiche Montage von Chl a mit rohen Lysaten von WSCP E. exprimieren coli - Zelle, die für die Entwicklung eines genetischen Siebsystem für neue wasserlösliche Chl-Bindungsproteine verwendet werden können, und für Studien der Chl-Protein - Wechselwirkungen und Montageprozessen.
Einleitung
Hydrophobe Pigmente wie Chlorophylle (Chls), bacteriochlorophylls (BChls) und Carotinoide sind die primären Cofaktoren in photosynthetischen Reaktionszentren und Lichtsammelproteine, die den Elektronentransport durchzuführen, und Lichtenergie Erfassung und Übertragung. Die Reaktionszentren und die meisten der Chl-bindenden Lichtsammelkomplexe sind Transmembranproteine. Die Fenna-Matthews-Olson (FMO) Protein von nicht-oxygenic photo grün-Schwefelbakterien 1,2 und die Peridinin-Chl Protein (PCP) von Dinoflagellaten 3 sind außergewöhnliche Beispiele von wasserlöslichen Lichtsammelproteine. Die wasserlöslichen Chlorophyll - bindenden Proteinen (WSCPs) von Brassicaceae, Polygonaceae, Chenopodiaceae und Amaranthaceae Pflanzen 4, 5 sind ein weiteres einzigartiges Beispiel, aber im Gegensatz zu FMO und PCP, sind diese weder in einem Licht Ernte noch in einem der primären photosynthetischen Reaktions und ihre genaue PHYphysiologischen Funktionen sind noch unklar 5-8. Ihre hohe Chl-Bindungsaffinität haben zu einem empfohlenen Funktion führte als vorübergehende Träger von Chls und Chl Derivate 9,10. Alternativ wurde die Hypothese aufgestellt , dass WSCP spielt eine Rolle bei Spülung Chls in geschädigten Zellen und schützt vor Chl-induzierten Photooxidationsschäden 7,11-13. In jüngerer Zeit wurde gezeigt , dass WSCP Funktionen als Protease - Inhibitor vorgeschlagen und spielt während der Blütenentwicklung 14 eine Rolle bei der Pflanzenfresser Widerstand als auch reguliert Zelltod. WSCPs werden in zwei Hauptklassen aufgeteilt, den photophysikalischen Eigenschaften auf. Die erste Klasse (Klasse I, z. B. von Chenopodium album) kann Photokonversion bei Beleuchtung unterziehen. Klasse II WSCPs von Brassica - Pflanzen , die durchlaufen nicht fotovoltaischen 5,10, sind weiter in der Klasse IIa unterteilt (z. B. von Brassica oleracea, Raphanus sativus) und IIb (z. B. von Lepidium virginicum ). Die Struktur der Klasse IIb WSCP von Lepidium virginicum 8 wurde durch Röntgenkristallographie bei 2,0 Å Auflösung gelöst. Es zeigt eine symmetrische Homotetramers, in dem die Protein-Untereinheiten einen hydrophoben Kern bilden. Jede Untereinheit bindet ein einzelnes Chl, die in einer engen Anordnung Ergebnisse von vier dicht gepackten Chls innerhalb der core.This einfach alle Chl Anordnung WSCPs ein potentiell nützliches Modellsystem zur Untersuchung der Bindung und Montage von Chl-Protein-Komplexe bildet, und die Auswirkungen der benachbarten Chls und Protein-Umgebungen auf die spektralen und elektronischen Eigenschaften einzelner Chls. Darüber hinaus kann es Vorlagen bieten für die Konstruktion künstlicher Chl-bindende Proteine, die für die lichtsammelnden Module in künstlichen Photosynthese-Geräten verwendet werden kann.
Rigorose Studien von nativen WSCPs sind nicht durchführbar , da die Komplexe aus Pflanzen gereinigt immer ein heterogenes Gemisch von Tetrameren mit verschiedenen Kombinationen von Chl a enthaltenund Chl b 9. Somit wird ein Verfahren zur rekombinant exprimierten WSCPs mit Chls in vitro Zusammenbauen erforderlich. Dies wird durch die vernachlässigbare Wasserlöslichkeit Chls herausgefordert , die es unmöglich macht , den Komplex in vitro zusammenzubauen , indem einfach die wasserlöslichen Apoproteine mit Pigmenten in wässrigen Lösungen vermischt wird . In vitro Montage durch die Apoproteine mit Thylakoidmembranen Vermischen von 15 gezeigt wurde, aber dieses Verfahren ist mit dem nativen Chls in den thylakoids begrenzt. Schmidt et al. berichtete über mehrere Chl und BChl - Derivate mit WSCP von Blumenkohl (CaWSCP) Montage von rekombinant ein Histidin-markierten Protein in E. exprimieren coli Immobilisierung es auf eine Ni-Affinitätssäule und in Detergenzien 11 Chl Derivate solubilisiert einzuführen. Erfolgreich Rekonstitution von rekombinantem WSCPs von A. thaliana 6 und Rosenkohl (BoWSCP), Japanisch Hederich (RshWSCP) eind Virginia pepperweed (LvWSCP) durch ein ähnliches Verfahren wurden ebenfalls berichtet.
Hier stellen wir eine neue, allgemeine, einfache Methode zur Chls mit WSCP Montage, die nicht Tagging erfordert oder die Immobilisierung von Proteinen. Es stützt sich auf Emulsionen aus ihren wäßrigen Lösungen der wasserlöslichen Apoproteine in Mineralöl vor. Die Proteine werden daher in Wasser-in-Öl (W / O) Mikrotröpfchen mit sehr hohen Oberflächen - Volumen - Verhältnis 16 eingekapselt. Die hydrophoben Cofaktoren werden dann in dem Öl gelöst und leicht in den Tröpfchen aus Ölphase eingeführt. Wir berichten über die Verwendung der Methode für Apoproteine von mehreren Varianten von WSCP Montage rekombinant in E. ausgedrückt coli mit Chl a. Wir veranschaulichen die Anordnung aus rohem Lysat von WSCP-überexprimierenden Bakterien, die für die Entwicklung neuer Bindeproteine Chl als Screeningsystem verwendet werden kann.
Protokoll
1. Vorbereiten Chl ein Stammlösungen
- Kritischste Schritt: Führen Sie alle Schritte des Chlorophylls Zubereitung in einer chemischen Haube, unter grünem Licht (520 nm) oder in der Dunkelheit, um Lichtschäden zu minimieren. Immer Stickstoff oder Argon hinzufügen, bevor die Pigmente für die Lagerung einfrieren. Stellen Sie sicher, dass alle Lösungsmittel Analysequalität sind.
- Man wiegt etwa 5 mg lyophilisiertes Spirulina platensis Zellen oder andere Cyanobakterium Zellen , die nur Chl a in Thylakoidmembran und zerquetschen sie mit einem Mörser zerstoßen.
- Legen zerstoßenen Zellen auf eine Glassäule und wäscht mit etwa 50 bis 100 ml 100% Aceton, um Carotinoide zu entfernen. Entsorgen Sie die eluierte orange / grün Fraktion.
Hinweis: Wenn das orangefarbene Fraktion nicht mit 100 ml Aceton weiter Waschen der Zellen mit Aceton, bis die grüne Fraktion eluiert wird, beginnt zu eluieren. - Austausch Aceton mit 100% Methanol und sammeln die grüne Fraktion , die Chl ein. Das Volumen des eluierten fractIon kann zwischen 50 bis 100 ml variieren. Am Anfang hat die eluierte Fraktion eine dunkelgrüne Farbe, die am Ende der Elution in hellgrün verändert. Wenn die Farbe der eluierten Fraktion in blass grün wird die Elution stoppen.
- Man dampft das Methanol am Rotationsverdampfer, bis der Extrakt vollständig trocken ist. Wenden Sie keine Wärme an die Lösung; sicherzustellen, dass die Wasserbadtemperatur des Verdampfers nicht mehr als 30 ° C nicht übersteigt.
Hinweis: Die Zeit der Verdampfung auf das Volumen des Methanolfraktion hängt verdampft und kann variieren zwischen 10-60 min. Es ist wichtig, den Extrakt vollständig trocknen. - Man löst die Pigmente aus dem getrockneten Extrakt in einem kleinen Volumen Diethylether (ca. 5-10 ml) und filtriere durch Watte. Stellen Sie sicher, dass Pigmente vollständig in Ether vor der Filterung gelöst sind.
- Man dampft das Diethylether, bis die Pigmente vollständig trocken sind (10-30 min).
Anmerkung: Die trockenen Pigmente mit gespült werden kann und gehalten unter Stickstoff oder Argon bei -2im Dunkeln 0 ° C bis zur Weiterverarbeitung. - Man löst die trockenen Pigmente in dem kleinsten Volumen möglich von 100% Methanol (ca. 1 ml), auch wenn nicht alles vollständig suspendiert. 4 ml Aceton zu der Lösung, und schlagen Sie das Glas vorsichtig, um vollständig die Pigmente auflösen.
- Mit Hilfe einer Pasteur-Pipette, laden Sie die Probe vorsichtig auf eine Säule von DEAE-Sepharose in 100% Aceton ins Gleichgewicht gebracht.
- Eluieren Carotinoide (ein orange-gelbes Band) mit 100% Aceton. Dann eluieren Chl a (grünes Band) mit 3: 1 v / v Aceton / Methanol - Gemisch.
Hinweis: Das Volumen an Aceton und Aceton / Methanol-Gemisch auf das Volumen der DEAE entspricht etwa Sepharose auf die Säule geladen. - Überprüfen Chl eine Reinheit durch Dünnschichtchromatographie unter Verwendung einer 68: 25: 5: 2 Dichlormethan / n-Hexan / Isopropanol / Methanol (v / v) -Mischung als Eluierungsmittel 17.
- Dampfe das Lösungsmittel mit einem Rotationsverdampfer , bis der Chl a vollständig trocken ist (10-60 min).
Hinweis: Das trockene Chl a kann mit Stickstoff oder Argon gelagert und unter Argonatmosphäre bei -20 ° C im Dunkeln gespült werden. - Bereiten Sie Chl eine Stammlösung von 2-4 ml 100% Ethanol , um das trockene Chl a wieder aufzulösen.
Hinweis: Der Extinktionskoeffizient von Chl a bei 663 nm beträgt 74.400 cm -1 M -1 (83,3 cm -1 (mg / ml) -1) in Ethanol. Eine typische Vorratslösung sollte eine OD von 1,860 haben, auf eine Konzentration von 25 mM (23 mg / ml) entspricht. Zugabe von 20 ul dieser Lager zu einer Emulsion , enthaltend 5 ml der organischen Phase, und 1 mg WSCP in 1 ml der wässrigen Phase führt zu einem Gemisch mit 10 - facher molarer Überschuß von Chl a vs. WSCP.
2. Herstellung von organischen Phase der Emulsion
Anmerkung: Die organische Phase der Emulsion aus Mineralöl zusammengesetzt ist, das 4,5% (v / v) Span 80 und 0,4% (v / v) Tween 80.
- Wiegen in einem 50-ml-Röhrchen mit 0,2 g Tween 80, 1,8 g Span 80 und 38 g Mineralöl. Gut mischen alle Komponenten und abkühlen auf Eis.
Anmerkung: Die organische Phase kann bis zu einer Woche in 4 ° C gelagert werden.
3. Herstellung der wässrigen Phase der Emulsion
Anmerkung: Die wässrige Phase der Emulsion von entweder gereinigtem WSCP zusammengesetzt sein kann, oder Rohextrakt von Bakterien überexprimieren WSCP.
- Herstellung einer wässrigen Phase gereinigten WSCP enthält.
- Wachsen E.coli BL21 - Bakterien WSCP Plasmid 12 in 1 l LB - Medium bei 37 ° C bis zur OD von 0,3-0,6 enthält.
- Induzieren die Proteinexpression durch Zugabe von 1 mM IPTG. Nach der Induktion wachsen Bakterien bei 30 ° C für 12 bis 16 Stunden.
- Ernte Bakterien durch Zentrifugation bei 5.000 xg für 10 min bei 4 ° C.
- Man löst das Pellet in Bindungspuffer und beschallen auf Eis (30 sec auf 15 sec ab, fünf Mal). Verwenden 10 ml Puffer für das erhaltene Pellet aus der Zentrifugation von 250 mlLB-Medium mit Zellen, die das Protein überexprimieren.
Hinweis: Je nach Reinigungsverfahren kann die Bindungspuffer aus 100 mM Phosphatpuffer bestehen, pH 7,2 oder 50 mM Tris, pH 7,5, 500 mM NaCl, 5 mM EDTA. - Drehen, um die Zell-Lysats bei 12.000 xg für 30 min bei 4 ° C.
- Reinige WSCP durch Affinitätschromatographie. Je nach dem Tag zu WSCP fusioniert, reinigen rekombinante Proteine die geeignete im Handel erhältliche Affinitätschromatographie System zur Proteinreinigung folgende Anweisungen des Herstellers verwendet wird.
- Zur Emulsionsherstellung Verwenden gereinigter WSCP in 50 mM Phosphatpuffer, pH 7,8. Stellen Sie sicher, dass die endgültige Proteinmenge zur Rekonstitution verwendet wird, ist 0,5 bis 1,0 mg pro 1 ml Puffer.
- Herstellung einer wässrigen Phase rohen Bakterienlysats mit WSCP enthält.
- Wachsen E.coli BL21 Zellen enthaltende Plasmid-exprimierenden WSCP in 250 ml LB - Medium bei 37 ° C bis zur OD 0,3-0,6.
- Induce Proteinexpression mit1 mM IPTG und Bakterien wachsen über Nacht bei 30 ° C.
- Erntebakterienzellen durch Zentrifugation bei 5.000 xg für 10 min bei 4 ° C.
- Auflösen des Pellets in 1-2 ml 50 mM Natriumphosphatpuffer pH 7,8, Sonikat (30 sec auf 15 sec ausgeschaltet, dreimal) und Zentrifuge bei 12.000 xg für 30 min bei 4 ° C.
- Vorbereitung der wässrigen Phase der Emulsion von 0,125 ml Überstand Mischen mit 0,875 ml 50 mM Natriumphosphatpuffer pH 7,8.
4. Montage von WSCP mit Chl a in Emulsion
- Transfer 5 ml Öl-Tensid-Mischung in einen Glaskolben und zu kühlen es auf Eis. Vor dem Pipettieren, sicherzustellen, dass alle Komponenten der organischen Phase werden gründlich gemischt, und es gibt keine Phasentrennung zwischen Tenside und Mineralöl.
- 1 ml eiskaltem wässrige Phase hergestellt, wie in Abschnitt 3 bis 5 ml der organischen Phase.
- Das Vermischen der beiden Phasen ein Gewebe-Homogenisator für 2 min bei 9.500 Umdrehungen pro Minute auf Eis verwenden.
- Kritischste Schritt: Von diesem Zeitpunkt an, führen alle weiteren Schritte unter grünem Licht (520 nm), um Lichtschäden zu minimieren. In 20 ul 25 mM Chl eine Stammlösung zu der Emulsion (Abschnitt 1.13 sehen). Disperse durch Ausklopfen und Umkehren der Glasfläschchen. Stellen Sie sicher, dass die Chl gleichmäßig in der Emulsion verteilt wird.
- Inkubieren Sie die Emulsion für 1-2 h auf Eis im Dunkeln.
- Um die Emulsion und einem separaten Wassertröpfchen aus der organischen Phase übertragen, die Emulsion zu 1,5 ml Kunststoffröhrchen und Zentrifuge für 5 Minuten bei Raumtemperatur bei 14.000 xg abzubauen.
Hinweis: Falls die Montage erfolgreich ist, sollte die untere wässrige Phase, die eine grüne Farbe haben. - Entsorgen Sie die obere Ölphase und 1 ml Mineralöl. Gut mischen das Mineralöl mit der pelle Emulsion durch Wirbel oder durch das Rohr gründlich Spiegeln. Spin down die Probe bei 14.000 xg für 5 min bei Raumtemperatur. Wiederholen Sie diesen Schritt, bis eine klare Meniskus Abtrennen der wässrigen und Bergmannal Ölphasen, ohne Zwischen Emulsion erhalten.
- Führen Sie diesen Schritt in einer chemischen Haube. Nachdem die wässrige und Mineralöl Phasen deutlich voneinander getrennt sind, Mineralöl zu entfernen, und 1 ml Wasser-gesättigtem Diethylether hinzu. Vortex und Spin der Probe bei 14.000 × g für 5 Minuten bei Raumtemperatur nach unten. Zweimal wiederholen Sie diesen Schritt.
- die Diethylether Nach der zweiten Zentrifugation, zu entfernen und die Röhrchen für 5-20 min in der Haube offen lassen.
- Schließlich laden die wässrige Phase , die die WSCP / Chl einen Komplex auf eine Entsalzungssäule und Eluieren mit Puffer geeignet für weitere Experimente enthält.
Hinweis: Das Protein in Phosphat- und Tris-Puffer in einem breiten Bereich von pH-stabil ist, (6,0-7,5). Die Probe kann bis zu einem Monat vor Licht geschützt bei 4 ° C gelagert werden.
Ergebnisse
Rekombinante WSCP Apoproteine wurden in W / O - Emulsionen gemäß dem Protokoll mit Chl a montiert in dem vorhergehenden Abschnitt beschrieben. Das Protokoll wurde unter Verwendung von wässrigen Phasen umgesetzt entweder reine WSCPs enthält, oder Lysaten von E. coli - Zellen überexprimieren WSCP (Abbildung 1). Das Protokoll ist einfach, schnell und erfordert keine spezielle Ausrüstung, außer einem Gewebe-Homogenisator.
Die Absorption und CD - Spektren von Chl a Komplexe von vier rekombinanten WSCP Varianten, nämlich RshWSCP, CaWSCP, BoWSCP und LvWSCP sind in Abbildung 2. Diese ähnlich wie zuvor berichtet Spektren der jeweiligen nativen Komplexe 10,18, in Bandform und Position gezeigt 19. Diese Ergebnisse zeigen deutlich, dass WSCP / Chl Komplexe rekonstituiert in W / O-Emulsion System gleicht die nativen Komplexe.
Um das Potenzial der W / O - Emulsion als schnelles Screening - System für positive Montage WSCPs mit Chls, rohen Lysaten von E. coli - Zellen, die WSCPs demonstrieren wurden als wässrige Phase der Emulsion verwendet. Lysaten von Bakterien, die WSCPs nicht exprimieren, wurden als negative Kontrolle verwendet. Positive Montage von WSCP mit Chl a wird durch die grüne Farbe der wässrigen Phase, aber nur in Lysaten von WSCP exprimierenden Zellen (Figur 3) leicht beobachtet. Droplets diese Lysate verfügen über ausgeprägte Chl a Fluoreszenz in konfokalen Mikroskop Bilder enthält. Dies bedeutet, dass eine erfolgreiche Montage von WSCP / Chl-Komplexe können direkt in den Wassertröpfchen erfasst werden, die die Grundlage für die W / O-Emulsion-basierte Screening-Systemen sein kann.
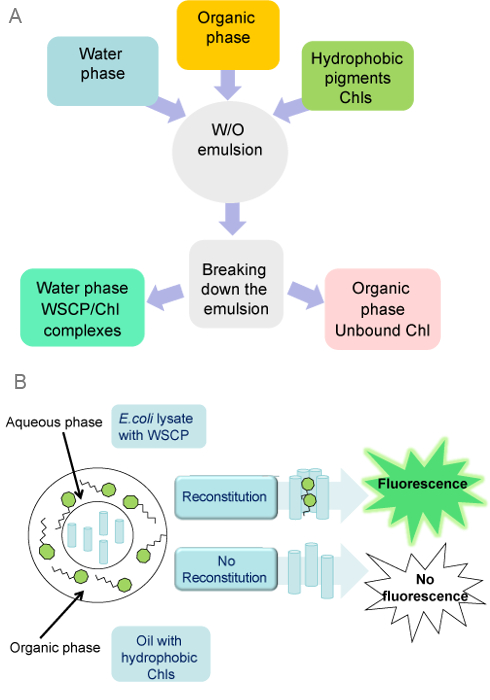
Abbildung 1: Montage von WSCP mit Chls in W / O - Emulsionen (A. ) In einem präparativen Protokolls wird die organische Phase mit einer wässrigen Phase gemischt, die exprimierenden WSCP gereinigter WSCP oder E.coli Zell - Lysate enthält. Wenn die Emulsion fertig ist, Chls werden der Emulsion zugegeben. Nach der Rekonstitution Wassertröpfchen werden aus organischen Phase durch Zentrifugation abgetrennt. (B) W / O - Emulsionssystem kann für eine schnelle und Screening mit hohem Durchsatz für positive Rekonstitution WSCPs mit Chls verwendet werden. Die Fluoreszenz des WSCP / Chl - Komplex kann durch ein konfokales Mikroskop direkt aus dem Wassermikrotröpfchen erfasst werden. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
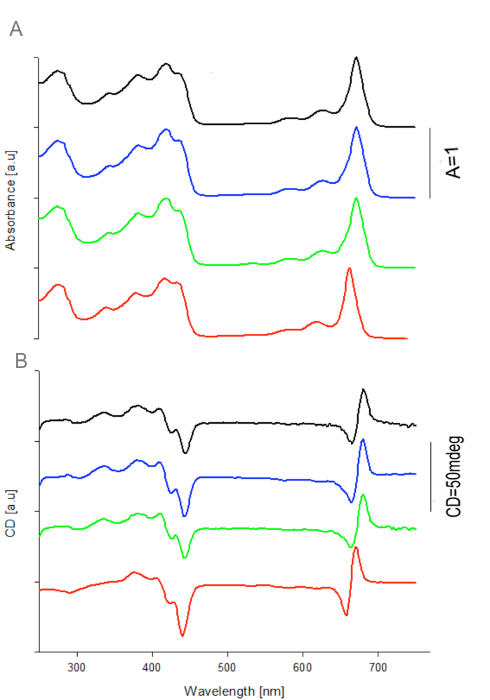
Abbildung 2: Absorptions- und CD - Spektren von WSCP / Chl a Komplexe Apoproteine von vier.WSCP Varianten wurden mit einem 10-fachen molaren Überschuß von Chl rekonstituiert. Die Absorptionsspektren (a) wurden auf 1 normiert bei 673nm für BoWSCP (schwarz), CaWSCP (grün) und RshWSCP (blau) und 663nm für LvWSCP (rot). Die gleichen Normalisierungsfaktoren wurden auf der CD (b) angewendet. Wiedergabe mit freundlicher Genehmigung von 16. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
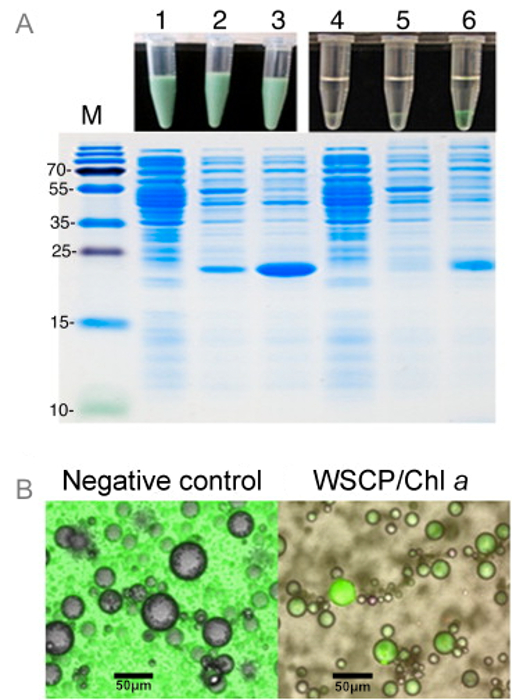
Abbildung 3: Scanning Fluoreszenzmikroskopie und Visual Screening von WSCP / Chl Complex Assembly (A) SDS-PAGE von E.. coli BL21 Zelllysaten vor und nach Rekonstitution mit Chl a in den W / O - Emulsionen. Spur 1: BL21 Zellen ohne das Plasmid WSCP, Spur 2: BL21-Zellen mit dem WSCP plaSmid ohne Induktion durch IPTG, Bahn 3: BL21-Zellen mit dem WSCP Plasmid mit IPTG induziert. Spur 4, 5 und 6 sind die gleichen Proben wie die Bahnen 1, 2 bzw. 3, aber nach dem Abtrennen der Wasserphase von der organischen Phase der Emulsion. Kleine Aliquote jeder Probe wurden auf einem SDS-Protein-Gel laufen gelassen. Spur M: Proteingrößenmarker. Bilder der Proben vor und nach der Phasentrennung werden oben auf jeder Spur angezeigt. (B) Konfokale Mikroskopbilder von W / O - Tröpfchen , hergestellt mit Chl a in der Ölphase. Die Tröpfchen auf dem linken Bild enthielt kein Protein, während die auf der rechten Bild WSCP Protein enthielt. Fluoreszenz wurde bei 682 nm überwacht. Wiedergabe mit freundlicher Genehmigung von 16. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Diskussion
Unser Ziel war es, ein neues allgemeines System für die Montage von wasserlöslichen Chlorophylls-bindende Proteine mit hydrophoben Pigmente zu entwickeln. Hier wird gezeigt , dass das neue Rekonstitution System auf Basis von W / O - Emulsion ein allgemeiner Ansatz ist erwiesen , für die Montage von WSCP Apoproteine von Rosenkohl, Blumenkohl, japanischer Meerrettich und Virginia pepperweed rekombinant in E. ausgedrückt arbeiten coli. Hier werden Ergebnisse aus der Rekonstitution von 1 mg WSCP mit 10-facher molarer Überschuß von Chl präsentierte. Jedoch ist es auch möglich, niedrigere Konzentrationen von WSCP für Rekonstruktionen und unterschiedliche Chl / Protein-Molverhältnisse verwendet werden. Die minimale Menge an Protein, das wir in der Lage waren, in W / O-Emulsionen zu montieren war 100 & mgr; g, während das Pigment zu Protein-Verhältnis von 5 variieren kann: 1 und bis zu 20: 1. Auch könnte das Volumen der wässrigen Phase gesenkt werden bis auf 50 & mgr; l. In dieser Arbeit wird die Montage von WSCP mit Chl a dargestellt. Doch ist es auch möglich, zusammenWSCP mit anderen hydrophoben Chls, BChls und deren Derivate. Derzeit testen wir unser System mit anderen wasserlöslichen Pigmentbindeproteine wie FMO und PCP.
Obwohl unsere Methode ist schnell und einfach gibt es einige wichtige Schritte, die bei der W / O-Zubereitung und Rekonstitution von WSCP mit Chl berücksichtigt werden müssen. Die Glasfläschchen, die für die Emulsionsherstellung verwendet werden, müssen sauber und frei von Reinigungsmittel zu sein. Selbst geringe Spuren von Waschmitteln in Fläschchen wird die Emulsionsherstellung und führen zu einer geringen Qualität der Emulsion beeinflussen. Auch sollten die Fläschchen vollständig trocken sein. Andere kritische Schritt, der die Rekonstitution Effizienz beeinflussen könnten, ist durch und durch Dispersion von Chl in der organischen Phase der Emulsion. Daher ist es wichtig, vollständig ein kleines Volumen von Chl in 5 ml Emulsion vermischt. Es ist auch wichtig, so viele Schritte wie notwendig zu tun Emulsion zu brechen und vollständig Mineralöl von Wasserphase zu entfernen. Irgendwelche Spuren von Mineralöl in Wasser phase könnten weitere Experimente beeinflussen.
W / O - Emulsion ist ein alternativer Ansatz für das Verfahren von Schmidt et al etabliert. 11, die His-tagged WSCP auf Affinitätschromatographiesäule auf Immobilisierung und Inkubieren mit Chls beruhte. Obwohl das Verfahren von Schmidt et al., Erwies sich für verschiedene WSCPs zu arbeiten, erfordert sie His-markierte Proteine und können zu nicht-spezifische Bindung von Chls durch Ligation an die Histidine des Tags. Ferner kann die Immobilisierung Proteine auf einer festen Oberfläche Proteinstruktur beeinflussen, also mit Pigmenten den Montageprozess zu beeinflussen. Zusätzlich Chl, die für die Montage von WSCPs in diesem System verwendet wurde , gelöst entweder in Puffer Detergenzien oder 40% Methanol 11,12 enthält. Solche Lösungsmittel in Pigmentaggregation und / oder unspezifische Bindung an Chl WSCP führen könnte. Unser neues Rekonstitution System auf Basis von W / O-Emulsion verlässt sich nicht auf die Proteine an einen festen Träger zu immobilisieren. TherefoRe, wird keine Reinigung Tag WSCPs fusioniert erforderlich, und rekombinante Proteine mit nativer Sequenz zusammengesetzt werden kann. Ein weiterer wichtiger Vorteil der W / O-Verfahren ist Pigmente Aggregation zu minimieren, die Rekonstitution Effizienz, Oligomerisierung beeinflussen können und Pigment / Protein-Stöchiometrie. Dies ist, weil die hydrophoben Pigmente in der Ölphase und ihre Einführung in die W / O-Tröpfchen gelöst wird durch die hohe Verhältnis Oberfläche zu Volumen des letzteren aktiviert. Weiterhin ist eine unspezifische Bindung von Chls durch WSCP umgangen, da hydrophobe Pigmente nicht zwischen organischen und wässrigen Phasen der Emulsion diffundieren kann. Nur Pigmente, die aktiv von WSCP bei der Zubereitung zusammengesetzt werden können in die Wassermikrotröpfchen der Emulsion ein.
Verfahren nach WSCP mit Pigmenten Zusammenbauen von WSCP mit isolierten Thylakoiden 10 Misch ist ähnlich der W / O - Emulsionssystem vorgestellt. Es erfordert Reinigungsmittel oder organische Lösungsmittel für Solubilizing die Chls, noch die Proteine Tagging. Jedoch kann die W / O-Verfahren mit beliebigen Pigmente verwendet werden, die in der Ölphase löslich ist, wohingegen das vorhergehende Verfahren zu Chls begrenzt ist, die nativ in Thylakoidmembranen sind. Somit Montage mit reinem Chl a oder Chl d möglich ist , aus , weil diese von Cyanobakterien thylakoids zB zur Verfügung stehen. Synechocystis PCC 6803 oder Acaryochloris Marina sind. Jedoch ist es nicht möglich , WSCP mit Chl b zu rekonstituieren , da dieses Pigment immer von Chl a in Thylakoide begleitet wird. Hingegen in WSCP Baugruppe W / O-Emulsion kann mit beliebigen natürlichen oder künstlichen Chl, BChl oder Porphyrinderivate getestet werden. Es erfordert keine photo Membranen und dadurch ist es frei von Störungen der außerMembranKomponenten wie Phycobilisomen, die Cyanobakterien Membranen befestigt werden kann. Die W / O-Verfahren wird lediglich durch die Löslichkeit der Pigmente in der Ölphase eine begrenztend daher geeignet für WSCP Montage mit natürlichen oder künstlichen Chl, BChl oder Porphyrin-Derivate.
Zusammenfassend zeigten wir hier ein allgemeines Verfahren zur wasserlöslichen Proteinen mit hydrophoben Pigmente Zusammenbauen. Seine Vorteile durch den erfolgreichen Aufbau von Chl a mit unterschiedlichen rekombinanten WSCPs von Brassica - Pflanzen nachgewiesen wurden als eindeutig durch spektroskopische und biochemische Ergebnisse angezeigt. Darüber hinaus haben wir gezeigt , wie die W / O - Montage - Protokoll kann für die schnelle Screening von WSCP / Chl komplexe Montage unter Verwendung von E. coli - Zelllysaten überexprimierenden rekombinanten WSCPs und rohen Chl Extrakte verwendet werden. Auf diese Weise können wir zeitraubend Proteinreinigungsschritte und die Notwendigkeit des Brechens Emulsionen, um die Wassertröpfchen aus der organischen Phase zu trennen, kann auch für direkt durch Verwendung von Fluoreszenzmikroskopie vermieden werden Visualisieren der Montage in Wassertröpfchen zu überspringen. Die allgemeine Anwendbarkeit des neuen Verfahrens macht es zu einem Einsatzful Werkzeug Kofaktor für das Studium Bindung und Montage sowie Energie- und Elektronentransfermechanismen in Transmembranprotein-Cofaktor-Komplexen durch die Entwicklung und ihre vereinfachte künstliche wasserlösliche Protein-Analoga zu konstruieren.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessen haben.
Danksagungen
DN dankt für die Unterstützung von EU - FP7 - Projekten PEPDIODE (GA 256672) und REGPOT-2012-2013-1 (GA 316157) und einer persönlichen Forschungsstipendium (Nr 268/10) von der Israel Science Foundation. Wir danken Prof. Shmuel Rubinstein, School of Engineering and Applied Sciences, Harvard University, Cambridge MA, USA für die konfokale Mikroskopie die Aufnahme von Bildern.
Materialien
| Name | Company | Catalog Number | Comments |
| Mineral oil | Sigma | M5904 | |
| Span80 | Sigma | 85548 | |
| Tween80 | Sigma | P8074 | |
| Bio-Scale Mini Profinity eXact Cartridges | Bio Rad | 10011164 | Affinity chromatography for WSCP purification with native sequence. |
| His Trap HF column | GE Healthcare Life Science | 17-5248-02 | Affinity chromatography for WSCP purification with His-tag |
| DEAE Sepharose Fast Flow | GE Healthcare Life Science | 17-0709-01 | Chromatography medium for chlorophyll purification |
Referenzen
- Bryant, D. A., Frigaard, N. -. U. Prokaryotic photosynthesis and phototrophy illuminated. Trends Microbiol. 14, 488-496 (2006).
- Tronrud, D. E., Wen, J. Z., Gay, L., Blankenship, R. E. The structural basis for the difference in absorbance spectra for the FMO antenna protein from various green sulfur bacteria. Photosynth. Res. 100, 79-87 (2009).
- Schulte, T., Johanning, S., Hofmann, E. Structure and function of native and refolded peridinin-chlorophyll-proteins from dinoflagellates. Eur. J. Cell Biol. 89, 990-997 (2010).
- Renger, G., et al. Water soluble chlorophyll binding protein of higher plants: a most suitable model system for basic analyses of pigment-pigment and pigment-protein interactions in chlorophyll protein complexes. J. Plant Physiol. 168, 1462-1472 (2011).
- Satoh, H., Uchida, A., Nakayama, K., Okada, M. Water-soluble chlorophyll protein in Brassicaceae plants is a stress-induced chlorophyll-binding protein. Plant Cell Physiol. 42, 906-911 (2001).
- Bektas, I., Fellenberg, C., Paulsen, H. Water-soluble chlorophyll protein (WSCP) of Arabidopsis is expressed in the gynoecium and developing silique. Planta. 236, 251-259 (2012).
- Damaraju, S., Schlede, S., Eckhardt, U., Lokstein, H., Grimm, B. Functions of the water soluble chlorophyll-binding protein in plants. J. Plant Physiol. 168, 1444-1451 (2011).
- Horigome, D., et al. Structural mechanism and photoprotective function of water-soluble chlorophyll-binding protein. J. Biol. Chem. 282, 6525-6531 (2007).
- Reinbothe, C., Satoh, H., Alcaraz, J. -. P., Reinbothe, S. A Novel Role of Water-Soluble Chlorophyll Proteins in the Transitory Storage of Chorophyllide. Plant Physiol. 134, 1355-1365 (2004).
- Satoh, H., Nakayama, K., Okada, M. Molecular cloning and functional expression of a water-soluble chlorophyll protein, a putative carrier of chlorophyll molecules in cauliflower. J. Biol. Chem. 273, 30568-30575 (1998).
- Schmidt, K., Fufezan, C., Krieger-Liszkay, A., Satoh, H., Paulsen, H. Recombinant water-soluble chlorophyll protein from Brassica oleracea var. Botrys binds various chlorophyll derivatives. Biochemistry. 42, 7427-7433 (2003).
- Takahashi, S., et al. Molecular cloning, characterization and analysis of the intracellular localization of a water-soluble Chl-binding protein from Brussels sprouts (Brassica oleracea var. gemmifera). Plant Cell Physiol. 53, 879-891 (2012).
- Takahashi, S., Ono, M., Uchida, A., Nakayama, K., Satoh, H. Molecular cloning and functional expression of a water-soluble chlorophyll-binding protein from Japanese wild radish. J. Plant Physiol. 170, 406-412 (2013).
- Boex-Fontvieille, E., Rustgi, S., von Wettstein, D., Reinbothe, S., Reinbothe, C. Water-soluble chlorophyll protein is involved in herbivore resistance activation during greening of Arabidopsis thaliana. Proc. Natl. Acad. Sci. U. S. A. 112, 7303-7308 (2015).
- Hughes, J. L., et al. Magneto-optic spectroscopy of a protein tetramer binding two exciton-coupled chlorophylls. J. Am. Chem. Soc. 128, 3649-3658 (2006).
- Bednarczyk, D., Takahashi, S., Satoh, H., Noy, D. Assembly of water-soluble chlorophyll-binding proteins with native hydrophobic chlorophylls in water-in-oil emulsions. BBA - Bioenergetics. 1847, 307-313 (2015).
- Fiedor, L., Rosenbach-Belkin, V., Scherz, A. The stereospecific interaction between chlorophylls and chlorophyllase. Possible implication for chlorophyll biosynthesis and degradation. J. Biol. Chem. 267, 22043-22047 (1992).
- Kamimura, Y., Mori, T., Yamasaki, T., Katoh, S. Isolation, properties and a possible function of a water-soluble chlorophyll a/b-protein from brussels sprouts. Plant Cell Physiol. 38, 133-138 (1997).
- Murata, T., Itoh, R., Yakushiji, E. Crystallization of water-soluble chlorophyll-proteins from Lepidium virginicum. Biochim. Biophys. Acta. 593, 167-170 (1980).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten