Method Article
L'eau dans l'huile Emulsions: un nouveau système d'assemblage des protéines Chlorophylle liaison solubles dans l'eau avec Pigments hydrophobes
Dans cet article
Résumé
Ce manuscrit décrit une méthode simple et à haut débit pour l'assemblage des protéines solubles dans l'eau avec des pigments hydrophobes qui est basée sur des émulsions eau-dans-huile. Nous démontrons l'efficacité de la méthode dans l'ensemble des chlorophylles indigènes avec quatre variantes de l' eau-soluble dans la chlorophylle recombinante des protéines de liaison (WSCPs) de plantes Brassica exprimé dans E. coli.
Résumé
Chlorophylles (CHLS) et bactériochlorophylles (BCHLS) sont les cofacteurs primaires qui effectuent la récolte de lumière photosynthétique et de transport d'électrons. Leur fonctionnalité dépend essentiellement de leur organisation spécifique au sein de grandes et complexes complexes protéiques multimérique transmembranaires. Afin de comprendre au niveau moléculaire comment ces complexes facilitent la conversion de l'énergie solaire, il est essentiel de comprendre la protéine-pigment, et les interactions pigment pigment, et leur effet sur la dynamique excités. Une façon d'obtenir une telle compréhension est par la construction et à l'étude des complexes de CHLS avec des protéines recombinantes solubles dans l'eau simples. Cependant, l'incorporation des CHLS et BCHLS lipophiles dans les protéines solubles dans l'eau est difficile. De plus, il n'y a pas de méthode générale qui pourrait être utilisé pour l'assemblage des protéines solubles dans l'eau avec des pigments hydrophobes. Ici, nous démontrons un système de débit simple et haute à base d'émulsions eau dans l'huile, ce qui permet le culembly de protéines solubles dans l'eau avec CHLS hydrophobes. La nouvelle méthode a été validée par l' assemblage des versions recombinantes de la protéine de liaison à la chlorophylle soluble dans l'eau des plantes brassicacées (WSCP) avec un Chl. Nous démontrons l'assemblage réussi de Chl a l' aide de lysats bruts de WSCP exprimant E. cellule coli, qui peut être utilisé pour le développement d' un système de criblage génétique pour de nouvelles protéines Chl liant soluble dans l'eau, et pour l' étude des interactions Chl-protéine et des procédés d'assemblage.
Introduction
des pigments hydrophobes tels que les chlorophylles (CHLS), bactériochlorophylles (Bchl) et caroténoïdes sont des cofacteurs primaires dans les centres réactionnels photosynthétiques et les protéines de récolte de lumière qui effectuent le transport d'électrons, et la capture de l'énergie lumineuse et de transfert. Les centres réactionnels et la plupart des antenne collectrice CHL-liaison sont des protéines transmembranaires. La protéine Fenna-Matthews-Olson (FMO) des bactéries vert-soufre photosynthétique non oxygénés 1,2, et la protéine péridinine-Chl (PCP) de dinoflagellés 3 sont des exemples exceptionnels de protéines lumière de récolte solubles dans l'eau. La liaison chlorophylle protéines solubles dans l'eau (WSCPs) de Brassicaceae, Polygonaceae, Chénopodiacées et plantes Amaranthacées 4, 5 sont un autre exemple unique, mais contrairement à FMO et le PCP, ceux - ci ne sont ni impliqués dans la récolte de lumière ni dans aucun de la réaction photosynthétique primaire et leur phy précisefonctions siologique sont pas encore claires 5-8. Leur grande affinité Chl liaison ont conduit à une fonction proposée en tant que porteurs transitoires de CHLS et dérivés de Chl 9,10. Alternativement, il a émis l' hypothèse que WSCP joue un rôle dans la récupération des CHLS dans les cellules endommagées et protège contre les dommages photooxydation Chl-induite 7,11-13. Plus récemment, il a été suggéré que les fonctions de WSCP comme un inhibiteur de protéase et joue un rôle lors de la résistance à l'herbivore et régule la mort cellulaire au cours du développement de la fleur 14. WSCPs sont divisés en deux grandes catégories en fonction de leurs propriétés photophysiques. La première classe (classe I, par exemple. De Chenopodium album) peut subir photoconversion lors de l' illumination. WSCPs de classe II à partir de plantes Brassica, qui ne subissent pas photoconversion 5,10, sont subdivisées en classe IIa (par exemple., De Brassica oleracea, Raphanus sativus) et IIb (par ex., À partir de Lepidium virginicum ). La structure de la classe IIb WSCP de Lepidium virginicum a été résolu par cristallographie aux rayons X à une résolution de 2,0 Å 8. Elle révèle une homotétramère symétrique dans laquelle les sous-unités protéiques forment un noyau hydrophobe. Chaque sous-unité se lie un seul Chl qui se traduit par un arrangement serré de quatre CHLS serrées dans les core.This simples tout arrangement Chl fait WSCPs un système modèle potentiellement utile pour l'étude de la liaison et l'assemblage de complexes Chl-protéine, et les effets de CHLS voisins et les environnements de protéines sur les propriétés spectrales et électroniques de CHLS individuels. En outre, il peut fournir des modèles de construction de protéines artificielles Chl de liaison qui peuvent être utilisés pour des modules collecteurs de lumière dans les dispositifs photosynthétiques artificiels.
Des études rigoureuses de WSCPs natifs ne sont pas réalisables parce que les complexes purifiés à partir de plantes contiennent toujours un mélange hétérogène de tétramères avec différentes combinaisons de Chl aet Chl b 9. Ainsi, un procédé d'assemblage WSCPs exprimées par recombinaison in vitro avec CHLS est nécessaire. Ceci est contesté par la solubilité dans l' eau négligeable de CHLS ce qui rend impossible d'assembler le complexe in vitro en mélangeant simplement les apoprotéines solubles dans l'eau avec des pigments dans des solutions aqueuses. Assemblage in vitro en mélangeant les apoprotéines avec membranes thylacoïdes 15 a été démontrée, mais cette méthode est limitée à l'indigène CHLS présent dans les thylakoïdes. Schmidt et al. rapport sur l' assemblage de plusieurs dérivés de Chl et BChl avec WSCP de chou - fleur (CaWSCP) en exprimant une protéine recombinante marquée à l' histidine dans E. coli immobilisant sur une colonne Ni-affinité et l' introduction de dérivés de Chl solubilisés dans les détergents 11. Réussir reconstitution de WSCPs recombinants de A. thaliana 6, et les choux de Bruxelles (BoWSCP), radis sauvage japonais (RshWSCP) und Virginia pepperweed (LvWSCP) par un procédé similaire ont également été signalés.
Ici, nous présentons un roman, général, méthode simple pour l'assemblage CHLS avec WSCP qui ne nécessitent pas de marquage ou immobilisant les protéines. Elle repose sur la préparation d'émulsions à partir de leurs solutions aqueuses des apoprotéines solubles dans l'eau dans de l'huile minérale. Les protéines sont ainsi encapsulés dans (E / H) avec des micro - gouttelettes très grande surface dans l'huile dans l'eau à rapport volumétrique 16. Les cofacteurs hydrophobes sont ensuite dissous dans l'huile et sont facilement introduits dans les gouttelettes de la phase huileuse. Nous rapportons sur l' utilisation du procédé d'assemblage de plusieurs variantes de apoprotéines WSCP exprimées par recombinaison dans E. coli avec un Chl. Nous démontrons l'ensemble du lysat brut de bactéries WSCP surexprimant qui peuvent être utilisés en tant que système de criblage pour le développement de nouvelles protéines de liaison Chl.
Protocole
1. Préparation de Chl un stock Solutions
- ÉTAPE CRITIQUE: Effectuez toutes les étapes de la préparation de la chlorophylle dans une hotte chimique, sous la lumière verte (520 nm) ou dans l'obscurité afin de minimiser le photovieillissement. Toujours ajouter azote ou l'argon avant la congélation des pigments pour le stockage. Veiller à ce que tous les solvants sont de qualité analytique.
- Peser environ 5 mg de cellules Spirulina platensis lyophilisées ou d' autres cellules cyanobactérie ne contenant que Chl a dans les membranes thylacoïdes et l' écraser à l' aide d' un mortier et un pilon.
- Charger des cellules écrasées sur une colonne de verre et laver avec environ 50-100 ml d'acétone à 100% afin d'éliminer les caroténoïdes. Jeter l'orange / fraction verte élue.
Remarque: Si la fraction orange n'a pas été élue avec 100 ml d'acétone, continuer le lavage des cellules avec de l'acétone jusqu'à ce que la fraction verte commence à éluer. - Échange acétone avec 100% de méthanol et de recueillir la fraction verte contenant Chl a. Le volume de élué fraction peut varier entre 50-100 ml. Au début, la fraction éluée a une couleur vert foncé, qui se transforme en vert pâle à la fin de l'élution. Lorsque la couleur de la fraction éluée se transforme en vert pâle arrêter l'élution.
- Evaporer le méthanol en utilisant un évaporateur rotatif jusqu'à ce que l'extrait est complètement sec. Ne pas appliquer de la chaleur à la solution; faire en sorte que la température du bain d'eau de l'évaporateur ne dépasse pas 30 ° C.
Remarque: Le temps d'évaporation est fonction du volume de la fraction de méthanol étant évaporée et peut varier entre 10 à 60 min. Il est important de sécher l'extrait complètement. - Dissoudre les pigments de l'extrait sec dans un petit volume d'éther diéthylique (environ 5 à 10 ml) et filtrer à travers de la laine de coton. Veiller à ce que les pigments sont complètement dissous dans de l'éther avant de filtrer.
- Évaporer l'éther diéthylique jusqu'à ce que les pigments sont complètement secs (10-30 min).
Remarque: Les pigments secs peuvent être purgés avec et conservés sous azote ou argon à -20 ° C, dans l'obscurité jusqu'à un traitement ultérieur. - Dissoudre les pigments secs dans le plus petit volume possible de 100% de méthanol (environ 1 ml), même si tout ne soit complètement suspendue. Ajouter 4 ml d'acétone à la solution, et secouez doucement le verre afin de dissoudre complètement les pigments.
- À l'aide d'une pipette Pasteur, charger l'échantillon doucement sur une colonne de DEAE-Sepharose équilibrée dans 100% d'acétone.
- caroténoïdes Éluer (une bande jaune-orange) avec 100% d'acétone. Puis, éluer Chl a (bande verte) avec mélange 3: 1 v / v d' acétone / méthanol.
Remarque: Le volume d'acétone et le mélange acétone / méthanol est approximativement équivalent au volume de la DEAE sépharose chargé sur la colonne. - Vérifier Chl une pureté par Chromatographie sur couche mince en utilisant un 68: 25: 5: 2 de dichlorométhane / n-hexane / isopropanol / méthanol (v / v) comme éluant 17.
- Evaporer le solvant en utilisant un évaporateur rotatif jusqu'à ce que la Chl a est complètement sec (10-60 min).
Remarque: Le Chl sec a peut être purgé avec de l' azote ou de l' argon et stockée sous atmosphère d'argon à -20 ° C dans l'obscurité. - Préparer Chl une solution mère en re-dissoudre le sec Chl a dans 2-4 ml d'éthanol à 100%.
Remarque: Le coefficient de Chl une extinction à 663 nm est de 74.400 cm -1 M -1 (83,3 cm -1 (mg / ml) -1) dans l' éthanol. Une solution typique des stocks devrait avoir une DO de 1,860 correspondant à une concentration de 25 mM (23 mg / ml). En ajoutant 20 pi de ce stock à une émulsion contenant de 5 ml de phase organique et 1 mg de WSCP dans 1 ml de résultats de la phase aqueuse dans un mélange avec 10 fois en excès molaire par rapport à une Chl WSCP.
2. Préparation de la phase organique de l'émulsion
Remarque: la phase organique de l'émulsion est composée d'huile minérale contenant 4,5% (v / v) de Span 80 et 0,4% (v / v) de Tween 80.
- Peser dans un tube de 50 ml 0,2 g de Tween 80, 1,8 g de Span 80 et 38 g d'huile minérale. Bien mélanger tous les composants et refroidir sur la glace.
Remarque: la phase organique peut être stocké dans 4 ° C jusqu'à une semaine.
3. Préparation de la phase aqueuse de l'émulsion
Note: La phase aqueuse de l'émulsion peut être constituée soit de WSCP purifié, ou d'un extrait brut des bactéries surexprimant WSCP.
- Préparation d'une phase aqueuse contenant WSCP purifiée.
- Cultiver des bactéries E. coli BL21 contenant le plasmide 12 WSCP dans 1 litre de milieu LB à 37 ° C jusqu'à ce que la DO de 0,3-0,6.
- Provoquer expression de la protéine en ajoutant 1 mM IPTG. Après l'induction croissance des bactéries à 30 ° C pendant 12-16 h.
- bactéries de récolte par centrifugation à 5000 xg pendant 10 min à 4 ° C.
- Dissoudre le culot dans un tampon et sonication de liaison sur la glace (30 sec sur 15 sec éteint, cinq fois). Utiliser 10 ml de tampon pour le culot obtenu à partir d'une centrifugation de 250 ml d'un milieu LB avec des cellules surexprimant la protéine.
Remarque: Selon le procédé de purification, le tampon de liaison peut être constituée de tampon phosphate 100 mM, pH 7,2 et 50 mM de Tris, pH 7,5, 500 mM de NaCl, 5 mM d'EDTA. - Isoler le lysat cellulaire à 12.000 xg pendant 30 min à 4 ° C.
- Purifier WSCP par chromatographie d'affinité. En fonction de l'étiquette fusionnée à WSCP, de purifier des protéines recombinantes en utilisant le système disponible dans le commerce de chromatographie d'affinité appropriée pour la purification des protéines en suivant les instructions du fabricant.
- Pour la préparation de l'émulsion, en utilisant WSCP purifié dans 50 mM de tampon phosphate, pH 7,8. Assurez-vous que la quantité de protéine finale utilisée pour la reconstitution est de 0,5-1,0 mg par 1 ml de tampon.
- Préparation d'une phase aqueuse contenant le lysat bactérien brut avec WSCP.
- Cultiver des cellules de E. coli BL21 contenant le WSCP plasmide exprimant dans 250 ml de milieu LB à 37 ° C jusqu'à ce que la DO 0,3 à 0,6.
- Provoquer expression de la protéine avec1 mM IPTG et croître les bactéries pendant une nuit à 30 ° C.
- Récolte des cellules bactériennes par centrifugation à 5000 xg pendant 10 min à 4 ° C.
- Dissoudre le culot dans 1-2 ml de 50 mM de tampon phosphate de sodium pH 7,8, sonication (30 sec sur 15 sec off, trois fois) et centrifuger à 12000 xg pendant 30 min à 4 ° C.
- Préparer la phase aqueuse de l'émulsion par mélange de 0,125 ml de surnageant avec 0,875 ml de 50 mM de tampon phosphate de sodium à pH 7,8.
4. Assemblée des WSCP avec Chl a en Emulsion
- Transfert 5 ml de mélange d'huile-surfactant dans un flacon en verre et refroidir sur de la glace. Avant de pipetage, vérifier que tous les composants de la phase organique sont mélangés à fond et il n'y a pas de séparation de phase entre les tensioactifs et les huiles minérales.
- Ajouter 1 ml de phase aqueuse glacée préparée comme dans l'article 3 à 5 ml de phase organique.
- Mélanger les deux phases à l'aide d'un homogénéiseur tissulaire pendant 2 minutes à 9.500 tours par minute sur la glace.
- ÉTAPE CRITIQUE: A partir de cette étape, effectuez toutes les autres étapes sous la lumière verte (520 nm) afin de minimiser le photovieillissement. Ajouter 20 ul de 25 mM Chl une solution de stock (voir la section 1.13) à l'émulsion. Disperser en tapotant et en inversant le flacon en verre. Assurez-vous que la Chl est répartie uniformément dans l'émulsion.
- Incuber l'émulsion pendant 1-2 heures sur la glace dans l'obscurité.
- Afin de briser l'émulsion et des gouttelettes d'eau séparées de la phase organique transférer l'émulsion à des tubes en plastique de 1,5 ml et centrifuger à 14 000 xg pendant 5 min à température ambiante.
Remarque: Si l'ensemble est réussi, la phase aqueuse inférieure doit avoir une couleur verte. - Éliminer la phase huileuse supérieure et ajouter 1 ml d'huile minérale. Bien mélanger l'huile minérale avec l'émulsion culot par vortex ou en retournant le tube à fond. Centrifuger l'échantillon à 14 000 g pendant 5 min à température ambiante. Répétez cette étape jusqu'à un ménisque clairement séparer la phase aqueuse et mineurphases de pétrole al, sans aucune émulsion intermédiaire est obtenue.
- Effectuez cette étape dans une hotte chimique. Après les phases aqueuses et l'huile minérale sont clairement séparées, enlever l'huile minérale et ajouter 1 ml d'éther éthylique saturé d'eau. Vortex et centrifuger l'échantillon à 14 000 xg pendant 5 min à température ambiante. Répéter deux fois cette étape.
- Après la seconde centrifugation, éliminer l'éther diéthylique et on laisse les tubes ouverts à 20.05 min dans le capot.
- Enfin, la charge de la phase aqueuse contenant le WSCP / Chl un complexe sur une colonne de dessalage et éluer avec un tampon approprié pour d' autres expériences.
Remarque: La protéine est stable dans des tampons Tris et phosphatés dans une large gamme de pH (6,0-7,5). L'échantillon peut être conservé à 4 ° C à l'abri de la lumière jusqu'à un mois.
Résultats
Apoprotéines WSCP recombinants ont été assemblés avec un Chl dans les émulsions E / H selon le protocole décrit dans la section précédente. Le protocole a été réalisé en utilisant des phases aqueuses contenant soit WSCPs purs, ou des lysats de E. coli surexprimant les cellules WSCP (figure 1). Le protocole est simple, rapide et ne nécessite aucun équipement spécial, sauf un homogénéisateur de tissu.
L'absorbance et les spectres CD de Chl a des complexes de quatre variantes de WSCP recombinantes, à savoir RshWSCP, CaWSCP, BoWSCP et LvWSCP sont présentés dans la figure 2. Elles sont similaires en forme de bande et la position des spectres précédemment rapporté des complexes natifs respectifs 10,18, 19. Ces résultats montrent clairement que WSCP / Chl complexes reconstitués dans le système W / O émulsion ressemble à des complexes natifs.
Pour démontrer le potentiel de W / O émulsion comme un système de dépistage rapide pour l' assemblage positif de WSCPs avec CHLS, lysats bruts de cellules de E. coli exprimant WSCPs ont été utilisés comme phase aqueuse de l'émulsion. Les lysats de bactéries qui n'exprimaient WSCPs ont été utilisés comme témoin négatif. Ensemble positif de WSCP avec un Chl est facilement observée par la couleur verte de la phase aqueuse, mais seulement dans des lysats de cellules exprimant le WSCP (figure 3). Gouttelettes contenant ces lysats caractéristique distincte Chl une fluorescence dans les images de microscopie confocale. Cela implique que l'assemblage réussi de complexes WSCP / Chl peut être détectée directement dans les gouttelettes d'eau, qui peuvent être à la base de systèmes de criblage à base d'émulsion E / S.
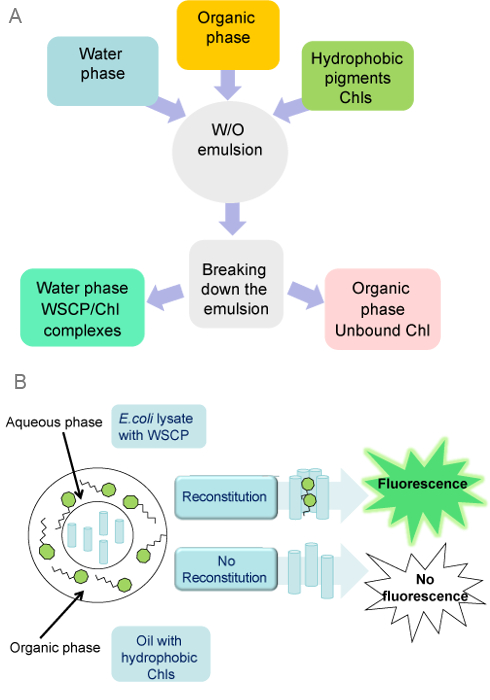
Figure 1: Assemblage de WSCP avec CHLS en W / O Emulsions (A. ) Dans un protocole préparative, la phase organique est mélangée avec une phase aqueuse, qui contient WSCP E. coli purifiée ou des lysats de cellules exprimant WSCP. Lorsque l'émulsion est prête, CHLS sont ajoutés à l'émulsion. Après reconstitution, les gouttelettes d'eau sont séparées de la phase organique par centrifugation. (B) W / système d'émulsion O peut être utilisé pour le criblage à haut rapide et pour la reconstitution positive de WSCPs avec CHLS. La fluorescence du complexe / Chl de WSCP peut être détectée directement à partir des microgouttelettes d'eau par un microscope confocal. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
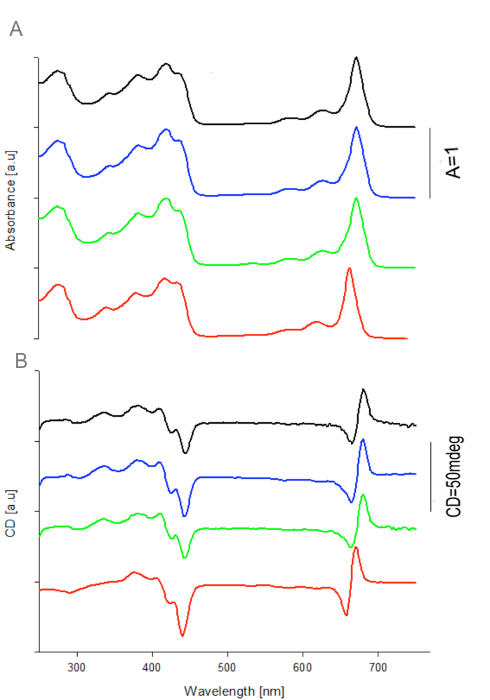
Figure 2: Absorbance et spectres CD de WSCP / Chl a Complexes apoprotéines de quatre.Variantes de WSCP ont été reconstitués avec 10 fois en excès molaire de Chl a. Les spectres d'absorption (a) ont été normalisées à 1 à 673nm pour BoWSCP (noir), CaWSCP (vert), et RshWSCP (bleu) et 663nm pour LvWSCP (rouge). Les mêmes facteurs de normalisation ont été appliqués sur le CD - ROM (b). Reproduit avec la permission de 16. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
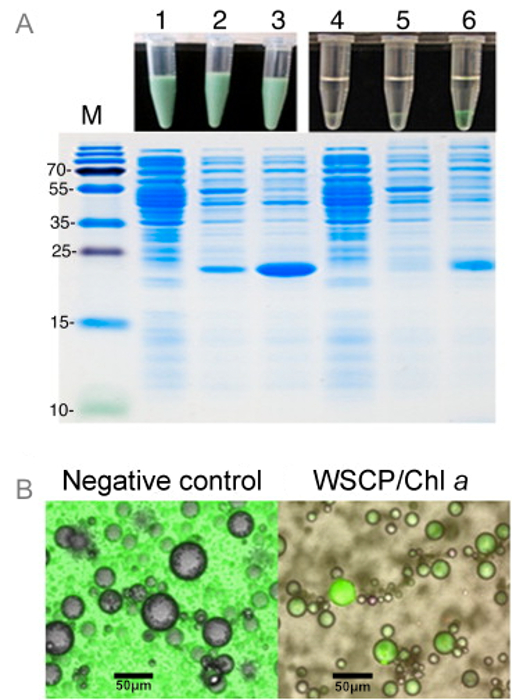
Figure 3: Numérisation Fluorescence Microscopy and Screening visuelle de l' Assemblée Complex WSCP / Chl (A) SDS-PAGE de E.. coli BL21 lysats cellulaires avant et après reconstitution avec une Chl dans les émulsions E / H. Lane 1: cellules BL21 sans le plasmide WSCP, piste 2: les cellules BL21 avec le ferm WSCPsmid sans induction par l'IPTG, piste 3: cellules BL21 avec le plasmide WSCP induite par IPTG. Piste 4, 5 et 6 sont les mêmes échantillons que les voies 1, 2 et 3, respectivement, mais après séparation de la phase aqueuse de la phase organique de l'émulsion. De petites aliquotes de chaque échantillon ont été entraînés sur un gel de SDS-protéine. Lane M: protéine marqueur de taille. Des images des échantillons avant et après la séparation de phase sont représentés sur le dessus de chaque voie. (B) images de microscopie confocale de W gouttelettes / S préparés avec Chl a dans la phase huileuse. Les gouttelettes sur l'image de gauche ne contiennent pas de protéines alors que celles sur l'image de droite contenait la protéine WSCP. Fluorescence a été contrôlée à 682 nm. Reproduit avec la permission de 16. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Notre objectif était de développer un nouveau système général pour l'assemblage des protéines de chlorophylle liant soluble dans l'eau avec des pigments hydrophobes. Ici , il est indiqué que le nouveau système de reconstitution basée sur émulsion E / H est une approche générale éprouvée à travailler pour l' assemblage des apoprotéines WSCP de choux de Bruxelles, chou - fleur, raifort japonais et Virginia pepperweed exprimées par recombinaison dans E. coli. Voici les résultats sont présentés à partir de la reconstitution de 1 mg de WSCP avec un excès molaire de 10 fois de Chl a. Cependant, il est également possible d'utiliser des concentrations plus faibles de WSCP et différents pour les reconstitutions / protéine rapports molaires Chl. La quantité minimale de protéines, ce qui nous a permis de monter dans les émulsions E / H a été de 100 ug, tandis que le rapport du pigment à la protéine peut varier de 5: 1 jusqu'à 20: 1. En outre, le volume de la phase aqueuse peut être abaissée jusqu'à 50 ul. Dans ce travail , l'assemblage de WSCP avec Chl a est présenté. Pourtant, il est également possible d'assemblerWSCP avec d'autres CHLS hydrophobes, BCHLS et leurs dérivés. À l'heure actuelle, nous testons notre système avec d'autres protéines de pigment liant soluble dans l'eau tels que les FMO et le PCP.
Bien, notre méthode est simple et rapide il y a quelques étapes essentielles qui doivent être pris en considération lors de la préparation W / S et la reconstitution de WSCP avec Chl. Les flacons de verre, qui sont utilisés pour la préparation de l'émulsion, doivent être propres et exempts de détergent. Même de petites traces de détergents dans des flacons auront une incidence sur la préparation de l'émulsion et entraîner une faible qualité de l'émulsion. En outre, les flacons doivent être complètement sec. Autre étape cruciale, ce qui pourrait influer sur l'efficacité de la reconstitution, est soigneusement dispersion de Chl en phase organique de l'émulsion. Par conséquent, il est important de mélanger complètement un petit volume de Chl dans 5 ml d'émulsion. Il est également important de faire autant d'étapes que nécessaire pour briser l'émulsion et supprimer complètement l'huile minérale de la phase d'eau. Toute trace d'huile minérale dans l'eau pHase pourrait influencer d'autres expériences.
Émulsion E / H est une approche alternative pour la méthode établie par Schmidt et al. 11, qui était basée sur immobilisant WSCP His-tagged sur une colonne de chromatographie d' affinité et l' incubation avec CHLS. Bien que, la méthode de Schmidt et al., A prouvé à travailler pour différents WSCPs, il exige des protéines His-tagged et peut entraîner une liaison non-spécifique de CHLS par ligature des histidines de la balise. De plus, immobiliser des protéines sur une surface solide peut influencer la structure des protéines, influençant ainsi le processus d'assemblage avec des pigments. En outre, CHL, qui a été utilisé pour l' assemblage de WSCPs dans ce système a été dissous soit dans un tampon contenant des détergents ou 40% de methanol 11,12. De tels solvants peuvent entraîner une agrégation de pigment et / ou une liaison non spécifique à la Chl WSCP. Notre nouveau système de reconstitution basée sur émulsion E / H ne repose pas sur l'immobilisation des protéines support solide. Therefore, aucune étiquette de purification fusionnée à WSCPs est nécessaire, et des protéines recombinantes avec la séquence naturelle peut être assemblé. Un autre avantage important du procédé W / O est en réduisant au minimum l'agrégation des pigments qui peuvent influer sur l'efficacité de reconstitution, d'oligomérisation et de pigment / protéine stoechiométrie. En effet, les pigments hydrophobes sont dissous dans la phase huileuse et leur introduction dans les gouttelettes W / O est activé par la surface à haut rapport de volume de celui-ci. En outre, la liaison non spécifique de CHLS par WSCP est contourné puisque les pigments hydrophobes ne peuvent pas diffuser entre phases organique et aqueuse de l'émulsion. Seuls les pigments qui sont activement assemblés par WSCP lors de la reconstitution peuvent entrer dans les microgouttes d'eau de l'émulsion.
Procédé d'assemblage WSCP avec des pigments en mélangeant avec WSCP thylakoïdes isolés 10 est similaire au système d'émulsion E / H présenté ici. Il ne nécessite des détergents ou des solvants organiques pour solubilizing les CHLS, ni marquage des protéines. Cependant, la méthode W / O peut être utilisé avec tous les pigments qui est soluble dans la phase huileuse alors que la méthode précédente est limitée à CHLS qui sont nativement présentes dans les membranes thylakoïdes. Ainsi, l' assemblage avec pur Chl a ou Chl d est possible à partir car ceux - ci sont disponibles auprès de thylakoïdes cyanobactériens de par exemple. Synechocystis PCC 6803 ou Acaryochloris marina, respectivement. Cependant, il est impossible de reconstituer le WSCP avec Chl b étant donné que ce pigment est toujours accompagné d'un Chl dans thylakoïdes. En revanche, l'ensemble de WSCP en émulsion E / H peut être testée avec toute Chl, BChl ou les dérivés de porphyrines naturelles ou artificielles. Il ne nécessite pas l'aide de membranes photosynthétiques et, par conséquent, il est libre de toute interférence des composants extra-membranaires tels que phycobilisome qui peuvent être attachés à des membranes de cyanobactéries. Le procédé W / O est limitée uniquement par la solubilité des pigments dans la phase huileuse d'unend donc approprié pour le montage de WSCP avec des Chl, BChl ou porphyrine dérivés naturels ou artificiels.
En résumé, nous avons présenté ici une méthode générale pour l'assemblage des protéines solubles dans l'eau avec des pigments hydrophobes. Ses avantages ont été démontrés par l'assemblage réussi de Chl a avec différents WSCPs recombinants à partir de plantes Brassica aussi clairement indiquées par spectroscopique et les résultats biochimiques. De plus, nous avons démontré comment le protocole d'assemblage W / O peut être utilisé pour le criblage rapide de WSCP / Chl assemblage complexe en utilisant des lysats de cellules de E. coli recombinantes surexprimant WSCPs et extraits bruts Chl. De cette façon, nous pouvons passer du temps des étapes de purification des protéines et de la nécessité de briser les émulsions afin de séparer les gouttelettes d'eau de la phase organique peut également être évité en utilisant la microscopie à fluorescence pour visualiser directement l'ensemble dans des gouttelettes d'eau. L'applicabilité générale de la nouvelle méthode permet une utilisationoutil ful pour étudier la liaison cofacteur et d'assemblage, et des mécanismes à l'énergie et transfert d'électrons dans les complexes protéine-cofacteur transmembranaires en concevant et en construisant leurs analogues protéiques simplifiés artificiels solubles dans l'eau.
Déclarations de divulgation
Les auteurs déclarent qu'ils ont aucun intérêt financier concurrents.
Remerciements
DN reconnaît le soutien de projets européens FP7 PEPDIODE (GA 256672) et REGPOT-2012-2013-1 (GA 316.157), et une subvention de recherche personnelle (n ° 268/10) de la Science Foundation Israël. Nous remercions le Pr Shmuel Rubinstein, École d'ingénierie et de sciences appliquées, Université de Harvard, Cambridge MA, États-Unis pour prendre les images de microscopie confocale.
matériels
| Name | Company | Catalog Number | Comments |
| Mineral oil | Sigma | M5904 | |
| Span80 | Sigma | 85548 | |
| Tween80 | Sigma | P8074 | |
| Bio-Scale Mini Profinity eXact Cartridges | Bio Rad | 10011164 | Affinity chromatography for WSCP purification with native sequence. |
| His Trap HF column | GE Healthcare Life Science | 17-5248-02 | Affinity chromatography for WSCP purification with His-tag |
| DEAE Sepharose Fast Flow | GE Healthcare Life Science | 17-0709-01 | Chromatography medium for chlorophyll purification |
Références
- Bryant, D. A., Frigaard, N. -. U. Prokaryotic photosynthesis and phototrophy illuminated. Trends Microbiol. 14, 488-496 (2006).
- Tronrud, D. E., Wen, J. Z., Gay, L., Blankenship, R. E. The structural basis for the difference in absorbance spectra for the FMO antenna protein from various green sulfur bacteria. Photosynth. Res. 100, 79-87 (2009).
- Schulte, T., Johanning, S., Hofmann, E. Structure and function of native and refolded peridinin-chlorophyll-proteins from dinoflagellates. Eur. J. Cell Biol. 89, 990-997 (2010).
- Renger, G., et al. Water soluble chlorophyll binding protein of higher plants: a most suitable model system for basic analyses of pigment-pigment and pigment-protein interactions in chlorophyll protein complexes. J. Plant Physiol. 168, 1462-1472 (2011).
- Satoh, H., Uchida, A., Nakayama, K., Okada, M. Water-soluble chlorophyll protein in Brassicaceae plants is a stress-induced chlorophyll-binding protein. Plant Cell Physiol. 42, 906-911 (2001).
- Bektas, I., Fellenberg, C., Paulsen, H. Water-soluble chlorophyll protein (WSCP) of Arabidopsis is expressed in the gynoecium and developing silique. Planta. 236, 251-259 (2012).
- Damaraju, S., Schlede, S., Eckhardt, U., Lokstein, H., Grimm, B. Functions of the water soluble chlorophyll-binding protein in plants. J. Plant Physiol. 168, 1444-1451 (2011).
- Horigome, D., et al. Structural mechanism and photoprotective function of water-soluble chlorophyll-binding protein. J. Biol. Chem. 282, 6525-6531 (2007).
- Reinbothe, C., Satoh, H., Alcaraz, J. -. P., Reinbothe, S. A Novel Role of Water-Soluble Chlorophyll Proteins in the Transitory Storage of Chorophyllide. Plant Physiol. 134, 1355-1365 (2004).
- Satoh, H., Nakayama, K., Okada, M. Molecular cloning and functional expression of a water-soluble chlorophyll protein, a putative carrier of chlorophyll molecules in cauliflower. J. Biol. Chem. 273, 30568-30575 (1998).
- Schmidt, K., Fufezan, C., Krieger-Liszkay, A., Satoh, H., Paulsen, H. Recombinant water-soluble chlorophyll protein from Brassica oleracea var. Botrys binds various chlorophyll derivatives. Biochemistry. 42, 7427-7433 (2003).
- Takahashi, S., et al. Molecular cloning, characterization and analysis of the intracellular localization of a water-soluble Chl-binding protein from Brussels sprouts (Brassica oleracea var. gemmifera). Plant Cell Physiol. 53, 879-891 (2012).
- Takahashi, S., Ono, M., Uchida, A., Nakayama, K., Satoh, H. Molecular cloning and functional expression of a water-soluble chlorophyll-binding protein from Japanese wild radish. J. Plant Physiol. 170, 406-412 (2013).
- Boex-Fontvieille, E., Rustgi, S., von Wettstein, D., Reinbothe, S., Reinbothe, C. Water-soluble chlorophyll protein is involved in herbivore resistance activation during greening of Arabidopsis thaliana. Proc. Natl. Acad. Sci. U. S. A. 112, 7303-7308 (2015).
- Hughes, J. L., et al. Magneto-optic spectroscopy of a protein tetramer binding two exciton-coupled chlorophylls. J. Am. Chem. Soc. 128, 3649-3658 (2006).
- Bednarczyk, D., Takahashi, S., Satoh, H., Noy, D. Assembly of water-soluble chlorophyll-binding proteins with native hydrophobic chlorophylls in water-in-oil emulsions. BBA - Bioenergetics. 1847, 307-313 (2015).
- Fiedor, L., Rosenbach-Belkin, V., Scherz, A. The stereospecific interaction between chlorophylls and chlorophyllase. Possible implication for chlorophyll biosynthesis and degradation. J. Biol. Chem. 267, 22043-22047 (1992).
- Kamimura, Y., Mori, T., Yamasaki, T., Katoh, S. Isolation, properties and a possible function of a water-soluble chlorophyll a/b-protein from brussels sprouts. Plant Cell Physiol. 38, 133-138 (1997).
- Murata, T., Itoh, R., Yakushiji, E. Crystallization of water-soluble chlorophyll-proteins from Lepidium virginicum. Biochim. Biophys. Acta. 593, 167-170 (1980).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon