Method Article
Procedura per la safena umane Veins
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
I meccanismi che portano allo sviluppo di iperplasia intimale (IH) e il fallimento del trapianto vena sono ancora poco conosciuti. Questo studio descrive un sistema ex vivo di perfusione vene umane sotto flusso e pressione controllata. Inoltre l'efficienza di rinforzo maglia esterna per limitare lo sviluppo di IH è stata valutata.
Abstract
Il pilastro di terapie contemporanee per esteso arteriopatia obliterante è venosa bypass. Tuttavia, la sua durata è minacciato da iperplasia intimale (IH), che alla fine porta a occlusione nave e fallimento del trapianto. Forze meccaniche, particolarmente basso shear stress e la tensione alto muro, si pensa di avviare e sostenere questi cambiamenti molecolari e cellulari, ma il loro contributo esatto resta da dipanare. Per valutare in modo selettivo il ruolo di pressione e sollecitazione di taglio sulla biologia di IH, un ex vivo sistema di perfusione (EVPS) è stato creato per perfusione segmenti di vene safene umani sotto il regime arteriosa (stress elevato shear e alta pressione). Ulteriori innovazioni tecniche hanno permesso di perfusione simultanea di due segmenti della stessa vena, uno armato con una rete esterna. Le vene sono state raccolte utilizzando una tecnica no-touch e immediatamente trasferiti al laboratorio per il montaggio in EVPS. Un segmento del isol appenaated vena non è stato perfuso (controllo, giorno 0). Gli altri due segmenti sono stati perfusi per un massimo di 7 giorni, un essere completamente al riparo con un 4 mm (diametro) della maglia esterno. La pressione, velocità del flusso, e la frequenza cardiaca sono stati costantemente monitorati e adeguati per simulare le condizioni emodinamiche prevalenti nell'arteria femorale. Al termine della perfusione, vene sono stati smontati e utilizzati per l'analisi istologica e molecolare. In ex vivo, condizioni di perfusione ad alta pressione (arteriosa, medio = 100 mm Hg) è sufficiente a generare IH e il rimodellamento delle vene umane. Queste alterazioni sono ridotti in presenza di una rete di poliestere esterno.
Introduzione
Le malattie cardiovascolari sono la principale causa di morbilità e mortalità nei paesi occidentali 1. Nonostante i progressi compiuti nei trattamenti endovascolari, la chirurgia di bypass rimane il fondamento delle terapie contemporanee, così oltre mezzo milione di innesti di vena vengono eseguite ogni anno negli Stati Uniti. Tuttavia, nonostante decenni di ricerca, 30-60% dei minori innesti estremità vena falliscono entro i primi anni a causa di iperplasia intimale (IH) 2. Forze meccaniche, particolarmente basso sforzo di taglio (SS) e la tensione alto muro, sono fondamentali nel l'avvio e lo sviluppo di questa risposta iperplastica 3,4. Per risolvere questo problema, un ex vivo vene sistema di perfusione (EVPS) è stato generato per studiare, in condizioni strettamente controllate emodinamiche (pressione e lo stress di taglio), il comportamento di safene umane. In questo studio, dopo l'inserimento nella circolazione arteriosa simile, ad alta pressione (media = 100 mm Hg) era sufficiente per stimolare prolifrazione e la migrazione delle cellule muscolari lisce nello strato intimale (IH) 5.
Studi mammiferi hanno suggerito l'uso del rinforzo esterno come un metodo efficace per sostenere la "vena arterializzato" e contrastare l'emodinamica acuta cambia la vena facce, una volta impiantato in un ambiente arteriosa. La maglia ha impedito sovra-distensione, aumento dello stress di taglio, e ridotta tensione di parete e di conseguenza IH 6-10. Tuttavia, i meccanismi alla base e la sua applicabilità alle vene umane per migliorare bypass pervietà non sono stati completamente caratterizzati. I nostri EVPS è stato utilizzato per confrontare, in condizioni che mimano le alterazioni vena volti, una volta inserito in un regime arteriosa (stress e pressione alta di taglio), il comportamento di safene umane in assenza e presenza di una rete tubolare in poliestere macroporosa esterno. Impedendo rimodellamento patologico e IH, la rete ha fornito prove della sua potenziale efficacia clinica 11 .
Questo studio 1) introduce un modello di ex vivo safene umane perfusione sotto pressione controllata e sforzo di taglio 2) dimostra che in poliestere maglia macro-poroso esterno riduce IH e fornisce informazioni fondamentali per la sua potenziale applicazione clinica.
Protocollo
Il Comitato Etico dell'Università di Losanna ha approvato gli esperimenti, che sono in conformità con i principi enunciati nella Dichiarazione di Helsinki del 1975, riveduta nel 1983 per l'uso di tessuti umani.
1. umano Grande vena safena Harvest
- Ottenere segmenti eccedenti di non varicose safene umane da pazienti sottoposti a chirurgia degli arti inferiori di bypass per ischemia. In sala operatoria, disinfettare tutta la gamba con una soluzione di iodio e drappeggio al paziente di esporre la gamba dall'inguine al piede.
- Eseguire un'incisione mediana dall'inguine al ginocchio (lasciando la parte della pelle interrotto).
- Raccogliere la vena grande safena con un peduncolo di circostante (tecnica no-touch) del tessuto. Sicuro rami laterali delle vene con 4-0 cravatte di seta. Memorizzare immediatamente un minimo di 9 cm segmento avanzo lungo della grande safena, con un diametro esterno di 2,5-4 mm a 4 ° C in RPMI-1640 Glutamax medio, integrato con siero di vitello fetale 12,5% e portarlo al laboratorio.
2 EVPS design
- Montare l'apparecchiatura generale mostrato in Figura 1. Autoclave tutte le apparecchiature e mantenere tutti i componenti in condizioni sterili. Inoltre, assicurarsi che il sistema è impermeabile e non perde sostanze chimiche nel mezzo. Utilizzare polimetacrilato di metile (PMMA-GS) per la copertina. Acciaio (X5 Cr Ni 18 10) e plastica poliossimetilene (POM) come supporto vena.
- Progettare la camera di perfusione alla geometria desiderata per consentire il posizionamento della vena e la sua connessione. Assicurarsi che la profondità (o raggio se si utilizza la costruzione cilindrica) è almeno 2,5 cm in modo che permette la flessione minima e dilatazione del vaso con una copertura costante da parte del terreno di coltura (Figura 1). Tenuta è una questione importante ed è il motivo rettangolare costruzione PMMA-GS viene utilizzato.
- Progettare il sostegno vena al geometr desideratoy. Per evitare piegatura vena o sopra distensione, consentire la regolazione della lunghezza spingendo o tirando (vite non può essere usato per questo scopo, come la vena potrebbe essere attorcigliato insieme con la vite).
NOTA: Un tondino di acciaio pieno collegati da 2 pezzi scorrevoli a forma di L che supportano i cilindri 2 vena (5 mm di diametro per adattarsi nave) e la vena (Figura 1B e Figura 2) è qui utilizzato. - Progettare colonna di pressione, in modo tale che la "pressione di riposo" applicato al sistema è: p = 0-10 = hx ρ xg, dove p = pressione (N / m 2, Pa) h = altezza della colonna di liquido (m) ρ = densità del liquido (kg / m 3) e g = costante gravitazionale (9,81 m / sec 2). Condotti di collegamento Progettazione quattro, dall'alto verso il basso: per applicare la pressione, per il deflusso (dalla vena), l'afflusso (alla vena) e per consentire medie cambiamento.
- Preparare il terreno. Sulla base di studi precedenti 5,11-14, scegliere RPMI-1640, integrato con Glutamax, 12,5Siero di vitello fetale%, e soluzione antibiotica-antimicotica 1% (10.000 U / ml di penicillina G, oltre a 10 mg / ml di streptomicina solfato, più 25 mg / ml di amfotericina B, oltre a 0,5 mg / ml: gentamicina). Lo sforzo di taglio (SS) è data da SS = 4 μQ / π * r 3 Q è la portata (ml / sec), r il raggio (cm) del segmento di vena, e μ è la viscosità del mezzo di perfusione.
- Modulare SS regolando la viscosità mediante aggiunta di 70 kDa destrano. Misurare la viscosità con un viscosimetro. Qui, aggiungere 8% 70 kDa destrano per impostare SS a 9-15 dyn / cm 2.
- Impostare la pompa ingranaggi per indurre un segnale cardioide pulsatile di 60 impulsi / min e ampiezza costante generando un flusso unidirezionale di 150 ± 15 ml / min, indipendentemente dalla pressione applicata nel sistema e controllato da un computer. Assicurarsi che il software di guida integra l'acquisizione costante e il monitoraggio delle pressioni, velocità di flusso, frequenza del polso, e il segnale. Se lo si desidera, utilizzare una seconda pompa (non synchronized) per produrre un non-laminare, turbolento.
3. EVPS Assembly (Figura 1)
- Prima di iniziare, assicurarsi che tutta l'attrezzatura è sterile. Eseguire le seguenti operazioni sotto asepsi in una cappa a flusso laminare.
- Posizionare la vena in una capsula di Petri riempite con terreno. Utilizzare una lama chirurgica e dividere la vena in 3 segmenti uguali.
- Sciacquare immediatamente un segmento in PBS. Dividere il segmento in 3 parti, fissare uno in formalina per morfometria. Congelare gli altri due per la trascrizione quantitativa (RT-PCR) e di proteine (Western Blot) analisi. Considerare questi segmenti come controllo, vena non perfuso.
- Utilizzare i 2 segmenti rimanenti per perfusione.
- Iniettare molto delicatamente medio nella vena e determinare la normale direzione del flusso; in presenza di valvole vena è invertita.
- Tenuta le vene è della massima importanza per il successo sperimentale. Controllare eventuali perdite attraverso collaterali. Fissare eventuali perdite con 6-0 punti di sutura in seta.
- Collegare il segmento vena tra i due cilindri metallici, un'estremità alla volta (2.3, figura 1). Fissare i cilindri con Ethibon 3-0 intorno alle rientranze (Figure 1A e B).
- Posizionare l'intero segmento venoso nella camera di perfusione in precedenza occupato dal mezzo. Ripetere la stessa procedura per il secondo segmento.
NOTA: La mancata sigillare adeguatamente la vena al cilindro sarà una fonte di perdita, richiede reintervento, e aumentare significativamente il rischio di infezione e fallimento sperimentale.
- Posizionare l'intero segmento venoso nella camera di perfusione in precedenza occupato dal mezzo. Ripetere la stessa procedura per il secondo segmento.
- Per rinforzare (mesh) il secondo segmento, rilasciare i due cilindri (con la vena allegato) dai pezzi a forma di L (2.3 e Figura 1).
- Sii gentile e non toccare la vena con qualsiasi strumento. Far scorrere la maglia prima sul cilindro poi sulla vena. A spintoni push / pull otterrà la maglia sulla vena.
- Una volta che la rete copre l'intera superficie della vena fissare il jvena acketed ai cilindri con Ethibon 3-0.
- Rimontare il composto vena / cilindro al supporto a forma di L e trasferirlo alla camera di perfusione, precedentemente occupato dal mezzo.
- Collegare ogni cilindro metallico (in-e deflusso) di un Y-splitter utilizzando tubi al silicone perossido-trattato con un diametro interno di 3,2 mm.
- Collegare lo splitter deflusso di un secondo partitore a Y utilizzando lo stesso tipo di tubazione. Da questo Y-splitter, utilizzare un tubo per misurare la pressione di perfusione attraverso entrambe le navi. Collegare l'altra posteriore alla colonna per formare un sistema ad anello chiuso (Figura 2).
- All'interno l'incubatore, utilizzare un tubo lungo (lunghezza di un metro) per collegare la colonna di pressione alla testa della pompa.
- Completa il set up collegando la testa della pompa per l'afflusso Y-splitter con un altro tubo lunga durata (Figura 1).
4. Vene Perfusione
- Dopo l'assemblea EVPS è stato completed, riempire la colonna con supporto (rimanere al di sotto del condotto di scarico vena per consentire la ricarica). Aggiungere più media nella colonna fino a quando il sistema è pieno. Spostare tutto il sistema in incubatore mantenuto a 37 ± 0,1 ° C con un pH mantenuto costante a 7.40 ± 0.01 (utilizzando un algoritmo di CO 2 / pH sulla base dell'equazione di Henderson-Hasselbach).
- Portare la testa della pompa ad ingranaggi all'esterno dell'incubatrice e collegarlo all'unità pompa ad ingranaggi. Avvitare le aste per fissare il gruppo.
- Accendere la pompa di alimentazione, assicurarsi che sia attivato il software di guida e lasciare 5 minuti a media e devono essere distribuiti equamente in ogni vano.
- Per monitorare la pressione, utilizzare un monitoraggio linea arteriosa. Collegate l'uscita di pressione EVPS (corrisponde al catetere arterioso) al trasduttore di pressione collegato al computer.
- Assicurarsi che il tubo è interamente occupata dal mezzo e non contiene bolle. De-bolla il sistema cultura attraverso la "li arteriosane tubo "(Figura 2). Prestare attenzione al display e cercare un segnale cardioide pulsatile di 60 impulsi / min di ampiezza costante. A questo punto, la pressione media è compresa tra 0-10 mm Hg. Se la pressione è <0 e la colonna si svuota progressivamente cercare una perdita (collaterale della vena o tenuta inadeguata tra la vena e il tubo).
- Impostare la pressione minima a 6 mm Hg per un test venoso o 90 mm Hg per un test arteriosa. In queste condizioni, un iniettore aria si applica la pressione necessaria alla colonna e sistema.
- Cambiare il mezzo ogni 2 giorni utilizzando il tubo collegato alla colonna di pressione. Per evitare danni cambiamento di pressione, aprire il tappo della colonna prima.
5 Completamento della perfusione
- Dopo 3 o 7 giorni di perfusione: prendere i EVPS fuori dell'incubatore e smontare le vene. Eliminare il prossimale 5 mm e vena distale estremità collegata alle apparecchiature. Tagliare un centrale, rin spessore di 5 mmgs del segmento rimanente e fissare in formalina (morfometria). Congelare i frammenti rimanenti e ridurre in polvere per ulteriori analisi molecolari.
Risultati
Il EVPS fornisce un prezioso strumento per valutare autonomamente le forze emodinamiche sulla vena safena umana innesta rimodellamento e IH.
La Figura 1 mostra la camera di perfusione e il supporto vena. Nelle figure 1A e B, il supporto vena prima (Figura 1A) e dopo (Figura 1B) assemblaggio, rispettivamente è raffigurato. È composto (dalla parte superiore alla parte inferiore) di 1 tubo di acciaio inox piano di misura 9 cm che funge da supporto per 2 pezzi a forma di L, che può facilmente scivolare (da sinistra a destra) e fornisce una tecnica affidabile per regolare la dimensione supporto alla vena. Ciascuno di questi pezzi detiene un disco POM montare un cilindro di acciaio (connettore vena) fissato in posizione da viti integrato (freccia). Figura 1C-D mostra solo (C) e dopo l'inserimento del supporto vena (D) la camera di perfusione. Nella camera di perfusione, depressioni sono progettati pertenere il supporto vena in posizione (in alto) e per evitare attorcigliamenti del tubo di collegamento a entrare e uscire dalla vena (in basso).
La Figura 2 mostra le immagini in tempo reale (Figura 2A) e una rappresentazione schematica (Figura 2B) del EVPS. La camera di perfusione, vene e dei suoi supporti, così come la colonna di pressione, sono mantenuti in un ambiente controllato (temperatura, CO 2 e O 2), mentre la pompa, iniettore a pressione, dispositivi di controllo e tutti rimangono all'esterno dell'incubatrice. La figura illustra la pompa ingranaggi (1) che genera un segnale pulsatile controllato da un computer (2), che controlla la velocità di flusso (3), pressione (4), e regola la pressione diastolica minima (5); due segmenti di una stessa vena safena sono collegati in parallelo alla pompa di perfusione all'interno di camere di perfusione separate (6a e 6b) posti in un incubatore di coltura cellulare.
In figura 3, Analisi istomorfometrica mostra che il rinforzo esterno impedisce iperplasia intimale e rimodellamento dei media patologici altrimenti osservata dopo 7 giorni ad alta pressione (regime arteriosa, medio = 100 mm Hg) perfusione. Nella Figura 3A, sezioni rappresentative istologiche colorate per ematossilina-eosina (HE) rivela il rivestimento del lume da nuclei di cellule endoteliali e dei nuclei della CML nello strato di supporto in tutte le condizioni. Figure 3B-C mostra rappresentante Van Gieson elastico Lamina ( VGEL) macchiato sezioni. Nella Figura 3B, l'intima è ispessita (IH) nelle vene perfusi ad alta pressione (media = 100 mm Hg) per 7 giorni rispetto al controllo vene non perfusi, un fenomeno ampiamente diminuita in presenza di una rete esterna. Figura 3C illustra il rimodellamento patologico verso l'esterno e supporti diradamento nelle vene sottoposte a 7 giorni di pressione arteriosa. Questo è in gran parte impedito dal rinforzo esterno. Furthermore, nella figura 3D, colorazione tricromica di Masson (blu = tessuto connettivo, rosso = muscolo) associa questo rimodellamento patologico con la persistenza di uno solo dei tre strati muscolari e accumulo di cellule muscolari lisce nello strato interno (intima). Il rinforzo esterno conserva la distribuzione del CML e media struttura.
La figura 4 illustra una corrente applicazione clinica della maglia esterna. Un esempio illustrativo è fornito dal rinforzo esterno di una fistola artero-venosa aneurismatica (emodialisi). Figura 4A mostra una rappresentazione tempo-corso del rinforzo vena (dalla parte superiore alla parte inferiore). In primo luogo, la maglia è stato collocato attorno ad un tubo rigido, mentre all'estremità della vena è fissato su un mandrino (pannello superiore). Poi, la vena è stato tirato attraverso il tubo grazie al mandrino. Una volta che la vena era a posto, il tubo è stato lentamente retratto, lasciando la maglia intorno alla vena (upper e pannello centrale). In questo caso particolare, la procedura è stata ripetuta su entrambi i lati delle vene, ei segmenti vene e rinforzi maglia sono stati assemblati da una anastomosi end-to-end (pannello inferiore). Figura 4B fornisce una visione più ampia del termine artero-venosa anastomosi -to-side, mostrando che la rete è avvolto intorno alla anastomosi legandola lungo la parete posteriore dell'arteria.

Figura 1 Il supporto vena e camera di perfusione. A. Il supporto vena è composto da 1 tubo pianura, 2 pezzi a forma di L, dischi e cilindri (formare la parte superiore verso il basso). B. Una volta che il supporto vena assemblato. C. Vista della camera di perfusione. D. La perfusione Camera è progettata per tenere in posizione il supporto vena e permette la sua connessioneione alla vena e tubi di collegamento.

Figura 2 Il sistema di perfusione ex vivo. A. Il assemblare completamente EVPS in incubatrice coltura cellulare. B. Rappresentazione schematica. 1) la pompa genera un'onda cardioide pulsatile; 2) il computer che controlla la pressione, flusso (tipo, frequenza e ampiezza); 3) il flussometro; 4) il trasduttore di pressione - linea arteriosa; 5) l'iniettore pressione; 6) due segmenti di una stessa vena safena sono perfusi senza (6a) o con rinforzo in rete esterno (6b).

Figura 3 Il rinforzo esterno impedisce iperplasia intimale. La. sezioni istologiche rappresentative colorate con ematossilina-eosina (HE). Bar rappresenta 50 micron. AC. Sezioni istologiche colorate Rappresentante per l'elastina (VGEL). l = lumen m = supporto, IH = iperplasia intimale. Bar rappresenta 50 micron. D. Rappresentante sezioni istologiche colorate con tricromica di Masson. Bar rappresenta 50 micron.
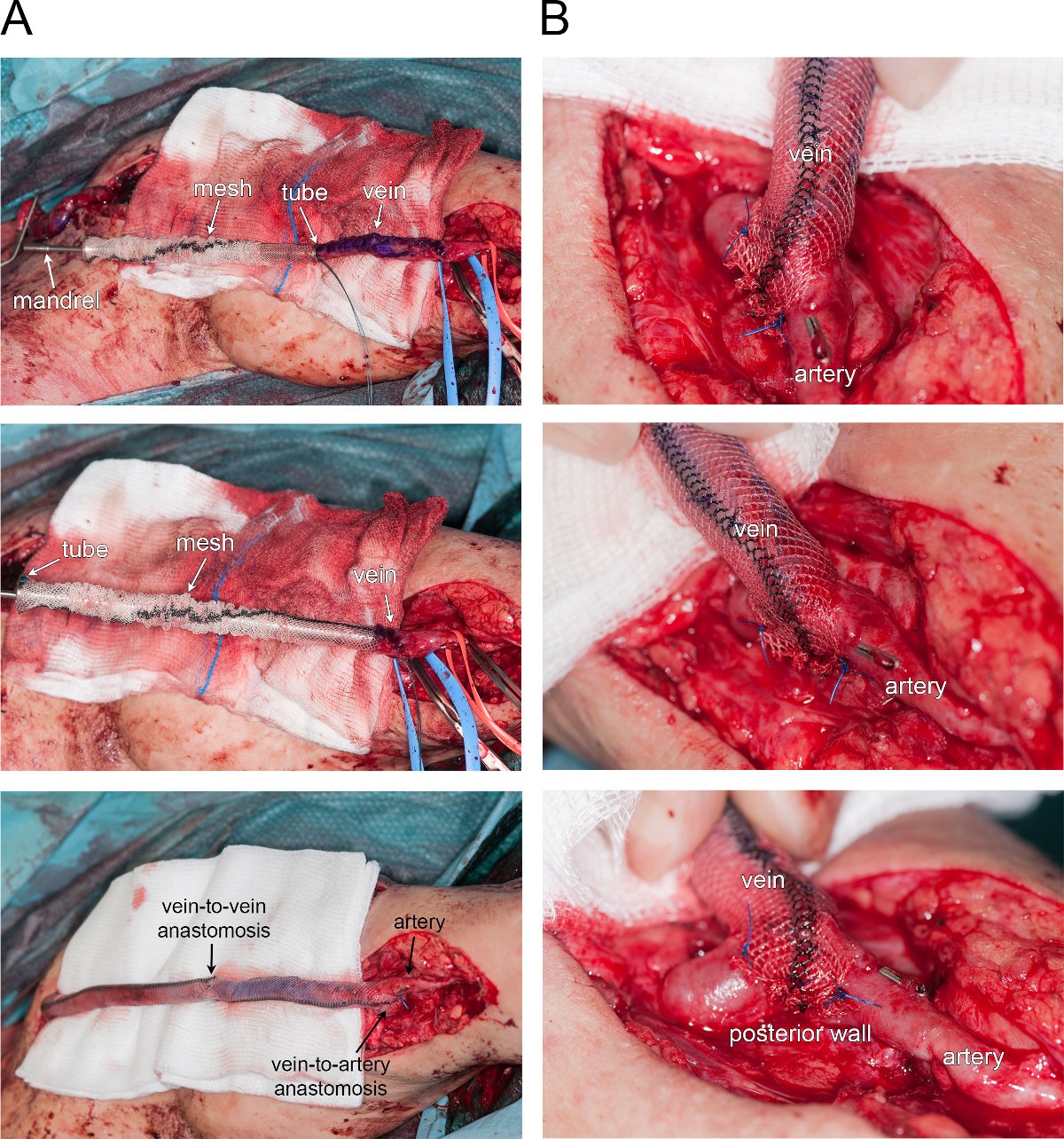
Figura 4 rinforzo esterno di una fistola aneurismatica. Fotografie di A. Time-corso di rinforzo vena (dall'alto verso il basso). B. Visualizzazione ingrandita della end-to-side anastomosi artero-venosa.
Discussione
Questo studio rivela un ex vivo sistema di perfusione venosa (EVPS) per eseguire studi approfonditi emodinamiche nelle vene umane. Questo sistema permette safene perfusione sotto parametri emodinamici definiti in assenza di fattori infiammatori e di crescita aggravanti rilasciati dalle cellule circolanti in vivo. Pertanto, esso fornisce una migliore comprensione dei meccanismi sottostanti coinvolti nel controllo della IH in vene umane innesti 5,11,12,15.
Perturbazioni emodinamiche riproducibili e quantificabili sono limitati in vivo. Sono state descritte varie procedure microchirurgiche murini complesse. Utilizzando un modello di bypass isograft mediante interposizione di una vena cava da un topo donatore nel diritto carotide comune e la creazione di un ulteriore legatura ramo deflusso, metà innesto o stenosi carotidea comune, il flusso e la SS acutamente diminuito e migliorato IH 3. Verso l'esterno rispetto al rimodellamento verso l'interno può essere ulteriormente trarogated con un mid-focale rispetto distale della carotide comune stenosi 16. Negli animali di grandi dimensioni (ovini, suini, e babbuino), innesti di bypass sono tecnicamente più semplice e rappresentano un approccio interessante per testare i dispositivi di dimensioni umane pre-clinici, come la maglia utilizzata nel presente studio 8-10. Tuttavia, il suo costo e la scarsità di strumenti molecolari validati limitare l'uso di tali strategie. Infine, queste manipolazioni di flusso alterano costantemente tensione della parete e non riescono a interrogare un singolo costituente. Inoltre, le intricate relazioni tra i emodinamica e il sistema immunitario ed endocrino ulteriori limitano l'analisi di un singolo attore.
Diversi problemi sorgono con l'uso del EVPS. 1) basso grado di contaminazione batterica spesso accompagnata raccolto vena umana e l'assenza ex-vivo di cellule circolanti presentarsi come una causa importante di infezione. Questo è impedito principalmente lavaggio a mano i pezzi separatamente, poi in autoclave tutto il materiale prima diutilizzare. Inoltre, il montaggio avviene in meno di 90 minuti e sotto rigorosa asepsi. 2) di tenuta che dura ripetute sterilizzazioni. Per questo motivo, una costruzione rettangolare PMMA-GS è stato usato, evitando l'uso di giunti e limitando la deformazione. 3) SS e tensione della parete sono calcolate in momenti definiti, in base al raggio lume del vaso (istologia), il flusso e la viscosità di essere costante. L'integrazione di una di imaging longitudinale (fotocamera ad alta definizione, laser o Doppler) che controlla continuamente il diametro della vena e / o il flusso fornirà informazioni più dettagliate sulle variazioni di portata locale e permettere calcoli deformazione ciclici. 4) I due segmenti di vene parallele possono avere differenze non controllate nella loro compliance della parete e raggio. Quindi, mettiamo a confronto solo i segmenti da uno stesso filone e supponiamo che sotto la stessa pressione, il modello di flusso è simile in entrambi i segmenti.
In questo studio, le vene sono stati sottoposti a flusso laminare pulsatile; tuttavia, il 50%f lesioni iperplastiche intimali si verificano nelle zone di end-to-side perianastomotico del trapianto vena, dove il flusso laminare è interrotto. Condizioni di turbolenza possono essere modellati con l'aggiunta di una seconda pompa, non sincronizzati con la prima pompa. Studi futuri saranno eseguiti per valutare in modo specifico l'impatto di interruzione flusso laminare sulla IH e il potenziale effetto benefico di rinforzo di maglia. È interessante notare che la struttura flessibile della maglia permette avvolgimento circonferenziale nei siti anastomosi, come già effettuato per riparare fistole aneurismatiche 17 (Figura 4). Così, la rete potrebbe rivelarsi utile per limitare la dilatazione perianastomotico, interruzione flusso laminare e di conseguenza ridurre IH presso i siti di anastomosi. Questo può essere particolarmente utile nel distale bypass graft, spesso colpiti da diametro mancata corrispondenza tra la vena e l'arteria tibiale o peroneale.
In sintesi, la configurazione mostrata qui permette perfusione parallela di v umanaeins, in condizioni emodinamiche identiche. Questi dati dimostrano che l'uso di una maglia tubolare poliestere macroporosa esterno è un metodo efficace per limitare lo sviluppo di IH in vena innesti inseriti in un ambiente arterioso 11. Questo sistema può trarre profitto diverse aree di ricerca. In particolare, emerge come un potente strumento per eseguire studi pre-clinici di verificare la fattibilità e l'efficacia di vari approcci per ridurre IH in materiale umano, ed è una preziosa aggiunta ai modelli animali in vivo. Altri supporti protesici o mesh rivestiti con agenti farmaceutici saranno valutati con questo metodo 6-10. Inoltre, si potrebbe immaginare di testare molecole farmacologiche applicate a livello locale per evitare IH nel tessuto umano, in stato fisiologico vicino. Interventi di terapia genica sono anche realizzabili, trasduzione un segmento di vena di iperespressione o geni bersaglio silenzio di interesse.
In conclusione, il nostro sistema aumenterà la nostra ONUcompren- del contributo emodinamico alle malattie trapianto vena umane. Esso fornisce una piattaforma innovativa per testare nuove strategie terapeutiche e può verificarsi come un "banco di fianco strumento di traduzione."
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto da finanziamenti del SNF [31003A-138528], la Octav e la Botnar Fondazione Marcella, la Fondazione Novartis e la Muschamp Fondazione Emma. Ringraziamo Martine Lambelet, e Jean-Christophe Stehle per la loro assistenza tecnica eccellente.
Materiali
| Name | Company | Catalog Number | Comments |
| Name | Company | Catalog Number | Comments |
| RPMI 1640 - Glutamax | Life Technologies | 61870-010 | |
| Penicilline/Streptomycine/Fungizone | Bioconcept | 4-02F00-H | |
| Dextran from Leuconostoc spp. 500 gr. | Sigma-Aldrich | 31390 | |
| Tampon PBS CHUV pH 7.1-7.3 1 lt. | Laboratorium und Grosse Apotheke Dr. G. Bichsel AG | 100 0 324 00 | |
| Cryosectionning embedding medium - Tissue-Tek OCT Compound | Fisher Scientific | 14-373-65 | |
| Silicon Tubing (Peroxide) L/S 16 (96400-16 ) - 7.5m | Idex Health & Science GMBH | MF0037ST | |
| Y-splitter | Idex Health & Science GMBH | Y-connector | |
| 35 mm Culture dish | Sigma-Aldrich | CLS430165-100EA | |
| 15 ml Falcon tube | BD Bioscence | 352096 | |
| 50 ml Falcon tube | BD Bioscence | 352098 | |
| Gearing pump - Reglo-Z | Idex Health & Science GMBH | SM 895 | App-Nr 03736-00194 |
| Pump Head | Idex Health & Science GMBH | MI0008 | |
| Monitoring Kit TRANSPAC IV | icumedical | 011-0J736-01 | |
| 20 mL Syringes | B. Braun Medical SA | 4612041-02 | |
| Etibon 3-0 FS-2 | Ethicon- Johnson&Johnson | EH7346H | |
| Mesh ProVena 6-8mm | B. Braun Medical SA | 1105012-14 | |
| NaCl: Sodium Chlorure Solution perfusion 0.9% (100 ml) | B. Braun Medical SA | 534534 | |
| Masterflex L/S Standard Drive | Cole-Parmer Instrument Co | 7521-10 | |
| Acquisition card | National Instruments | PCI-6024 E | |
| Flowmeter module | Transonic Systems Inc. | TS410 and T402 | |
| Stopcock with 3-ways | BD Connexta Luerlock | 394600 | |
| Millex Filter | Milian | SE2M229I04 |
Riferimenti
- Sal Go, A., et al. Executive summary: heart disease and stroke statistics--2014 update: a report from the american heart association. Circulation. 129, 399-410 (2014).
- Sal Conte, M., et al. Results of PREVENT III: a multicenter, randomized trial of edifoligide for the prevention of vein graft failure in lower extremity bypass surgery. Journal of Vascular Surgery. 43, 742-751 (2006).
- Yu, P., Nguyen, B. T., Tao, M., Bai, Y., Ozaki, C. K. Mouse vein graft hemodynamic manipulations to enhance experimental utility. The American Journal of Pathology. 178, 2910-2919 (2011).
- Davies, M. G., Hagen, P. O. Reprinted article "Pathophysiology of vein graft failure: a review". European journal of vascular and endovascular surgery : the official journal of the European Society for Vascular Surgery. 42, S19-S29 (2011).
- Berard, X., et al. Role of hemodynamic forces in the ex vivo arterialization of human saphenous veins. Journal of Vascular Surgery. 57, 1371-1382 (2013).
- Vijayan, V., et al. Long-term reduction of medial and intimal thickening in porcine saphenous vein grafts with a polyglactin biodegradable external sheath. Journal of Vascular Surgery. 40, 1011-1019 (2004).
- Jeremy, J. Y., et al. On the biology of saphenous vein grafts fitted with external synthetic sheaths and stents. Biomaterials. 28, 895-908 (2007).
- Zilla, P., et al. Constrictive external nitinol meshes inhibit vein graft intimal hyperplasia in nonhuman primates. The Journal of Thoracic and Cardiovascular Surgery. 136, 717-725 (2008).
- Zilla, P., et al. Utilization of shape memory in external vein-graft meshes allows extreme diameter constriction for suppressing intimal hyperplasia: a non-human primate study. Journal of Vascular Surgery. 49, 1532-1542 (2009).
- Yeoman, M. S., et al. A constitutive model for the warp-weft coupled non-linear behavior of knitted biomedical textiles. Biomaterials. 31, 8484-8493 (2010).
- Longchamp, A., et al. The use of external mesh reinforcement to reduce intimal hyperplasia and preserve the structure of human saphenous veins. Biomaterials. 35, 2588-2599 (2014).
- Saucy, F., et al. Ex vivo pulsatile perfusion of human saphenous veins induces intimal hyperplasia and increased levels of the plasminogen activator inhibitor 1. European Surgical Research. Europaische Chirurgische Forschung. Recherches Chirurgicales Europeennes. 45, 50-59 (2010).
- Dubuis, C., et al. Atorvastatin-loaded hydrogel affects the smooth muscle cells of human veins. The Journal of pharmacology and experimental. 347, 574-581 (2013).
- Deglise, S., et al. Increased connexin43 expression in human saphenous veins in culture is associated with intimal hyperplasia. Journal of Vascular Surgery. 41, 1043-1052 (2005).
- Muto, A., Model, L., Ziegler, K., Eghbalieh, S. D., Dardik, A. Mechanisms of vein graft adaptation to the arterial circulation: insights into the neointimal algorithm and management strategies. Circulation Journal : Official Journal of the Japanese Circulation Society. 74, 1501-1512 (2010).
- Tao, M., et al. A simplified murine intimal hyperplasia model founded on a focal carotid stenosis. The American Journal of Pathology. 182, 277-287 (2013).
- Berard, X., et al. Salvage treatment for venous aneurysm complicating vascular access arteriovenous fistula: use of an exoprosthesis to reinforce the vein after aneurysmorrhaphy. European Journal of Vascular and Endovascular Surgery : the Official Journal of the European Society for Vascular Surgery. 40, 100-106 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon