Method Article
Procédure pour saphènes humaines veines
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Les mécanismes conduisant au développement de l'hyperplasie intimale (IH) et la veine échec de la greffe sont encore mal compris. Cette étude décrit un système ex vivo pour perfuser les veines humaines sous écoulement et pression contrôlée. En outre, l'efficacité de renforcement de maille externe pour limiter le développement d'IH a été évaluée.
Résumé
Le pilier de thérapies contemporaines pour une maladie étendue artérielle occlusive est pontage veineux. Cependant, sa durée de vie est menacé par une hyperplasie de l'intima (IH) qui mène éventuellement à une occlusion des vaisseaux et échec de la greffe. Les forces mécaniques, en particulier à faible contrainte de cisaillement et haute tension de la paroi, sont pensés pour initier et de soutenir ces changements cellulaires et moléculaires, mais leur contribution exacte reste à démêler. Pour évaluer de façon sélective le rôle de la pression et la contrainte de cisaillement sur la biologie de IH, un ex vivo système de perfusion (EVP) a été créé pour perfuser les segments de veines saphènes humaines sous régime artérielle (stress de cisaillement élevé et haute pression). D'autres innovations techniques ont permis à la perfusion simultanée de deux segments de la même veine, on renforcé avec un maillage externe. Les veines ont été récoltées en utilisant une technique sans contact et immédiatement transférés au laboratoire pour le montage dans la EVP. Un segment de la isol fraîchementATED veine n'a pas été perfusé (contrôle, jour 0). Les deux autres segments ont été perfusés pendant jusqu'à 7 jours, un être complètement à l'abri avec un 4 mm (diamètre) maillage externe. La pression, la vitesse d'écoulement, et la fréquence du pouls ont été contrôlés en permanence et adaptés à reproduire les conditions hémodynamiques régnant dans l'artère fémorale. A la fin de la perfusion, les veines ont été démontées et utilisées pour l'analyse histologique et moléculaire. Sous conditions ex vivo, la perfusion à haute pression (artérielle, moyenne = 100 mm Hg) est suffisante pour générer IH et le remodelage des veines humaines. Ces altérations sont réduits en présence d'un filet de polyester externe.
Introduction
Les maladies cardiovasculaires sont la principale cause de morbidité et de mortalité dans les pays occidentaux 1. Malgré les progrès réalisés dans les traitements endovasculaires, la chirurgie de pontage reste le pilier de thérapies contemporaines, ainsi plus d'un demi-million de greffes veineuses sont effectuées chaque année aux États-Unis. Cependant, malgré des décennies de recherche, 30-60% de la baisse des greffes extrémité de la veine échouent dans les premières années en raison de l'hyperplasie intimale (IH) 2. Les forces mécaniques, en particulier à faible contrainte de cisaillement (SS) et haute tension de la paroi, jouent un rôle essentiel dans l'initiation et le développement de cette réponse hyperplasique 3,4. Pour résoudre ce problème, un ex vivo veines système de perfusion (EVP) a été généré pour étudier, dans des conditions strictement contrôlées hémodynamiques (pression et la contrainte de cisaillement), le comportement des veines saphènes humaines. Dans cette étude, après insertion dans la circulation artérielle analogue, l'hypertension (moyenne = 100 mm Hg) a été suffisant pour stimuler prolifration et la migration des cellules musculaires lisses dans l'intima (IH) 5.
Études sur les mammifères ont suggéré l'utilisation du renforcement externe comme une méthode efficace pour soutenir la "veine artérialisée" et contrecarrer l'hémodynamique aigu change la veine faces une fois implanté dans un milieu artérielle. Le maillage empêché surdistension, des contraintes de cisaillement, et de réduire la tension de la paroi et par conséquent IH 6-10. Cependant, les mécanismes sous-jacents et son applicabilité aux veines humaines dans l'amélioration de dérivation perméabilité n'ont pas été entièrement caractérisé. Nos EVP ont été utilisées pour comparer, dans un état imitant les modifications une veine visages fois inséré dans un régime artérielle (stress et de pression à cisaillement élevé), le comportement des veines saphènes humaines dans l'absence et la présence d'un macroporeuse maille polyester tubulaire externe. En empêchant le remodelage pathologique et IH, le maillage a fourni la preuve de son efficacité clinique potentielle 11 .
Cette étude 1) présente un modèle ex vivo de veines saphènes humaines perfusion sous pression contrôlée et la contrainte de cisaillement 2) démontre que maille polyester macro-poreuse externe réduit IH et fournit des informations cruciales pour son application clinique potentielle.
Protocole
Le comité d'éthique de l'Université de Lausanne a approuvé les expériences, qui sont en conformité avec les principes énoncés dans la Déclaration d'Helsinki de 1975, tel que révisé en 1983 pour l'utilisation de tissus humains.
1. Human grande veine saphène récolte
- Obtenir des segments de surplus de veines saphènes humaines non variqueuses de patients subissant une chirurgie de dérivation membre inférieur de l'ischémie. Dans la salle d'opération, de désinfecter l'ensemble de la jambe avec une solution d'iode et le drapé du patient pour exposer la jambe de l'aine au pied.
- Faire une incision médiane de l'aine au genou (en laissant la partie interrompue de la peau).
- Récolter la grande veine saphène avec un pédicule de ses environs (technique sans contact) de tissu. Sécurisés branches latérales des veines avec 4-0 cravates en soie. Stocker immédiatement d'au moins 9 cm de segments de surplus de temps de la plus grande veine saphène, avec un diamètre externe de 2,5 à 4 mm à 4 ° C dans un milieu RPMI-1640 Glutamax milieu, additionné de 12,5% de sérum de veau foetal et l'amener au laboratoire.
2 EVP Conception
- Assembler l'équipement général de la figure 1. Autoclave tous les équipements et garder tous les composants dans des conditions stériles. En outre, s'assurer que le système est étanche et ne fuit pas de produits chimiques dans le milieu. Utilisez le polyméthacrylate de méthyle (PMMA-GS) pour la couverture. Acier (X5 Cr Ni 18 10) et de polyoxyméthylène en plastique (POM) et le support de la veine.
- Conception de la chambre de perfusion à la géométrie souhaitée pour permettre le placement de la veine et de sa connexion. Assurez-vous que la profondeur (ou le rayon si vous utilisez construction cylindrique) est d'au moins 2,5 cm de sorte qu'il permet une flexion minimale et dilatation du vaisseau ainsi que la couverture constante par les milieux de culture (Figure 1). L'étanchéité est un problème majeur et c'est la raison rectangulaire construction PMMA-GS est utilisé.
- Concevoir le soutien de la veine à la geometr souhaitéey. Afin d'éviter le vrillage de la veine ou plus de distension, permettre le réglage de la longueur de poussée ou de traction (vis ne peut être utilisé à cet effet, que la veine soit tordu le long de la vis).
REMARQUE: Une tige en acier plein relié par 2 pièces coulissantes en forme de L qui prennent en charge les deux cylindres de la veine (5 mm de diamètre pour s'adapter à la cuve) et la veine (figure 1B et figure 2) est utilisé ici. - Conception de la colonne de pression, de telle sorte que la "pression de repos» appliquée au système est la suivante: p = 0-10 = hx ρ xg, où p = pression (N / m 2, Pa) h = hauteur de la colonne de fluide (m) ρ = masse volumique du liquide (kg / m 3), et g = l'accélération de la pesanteur (9,81 m / s 2). Conception quatre conduits de raccordement, de haut en bas: à appliquer une pression, pour la sortie (de la veine), l'entrée (à la veine) et de permettre changement de milieu.
- Préparer le milieu. Basé sur des études antérieures 5,11-14, choisissez RPMI-1640, complétée par Glutamax, 12,5% De sérum de veau foetal, et une solution d'antibiotique-antimycotique à 1% (10 000 U / ml de pénicilline G, ainsi que 10 mg / ml de sulfate de streptomycine, plus 25 mg / ml d'amphotéricine B, plus 0,5 ug / ml de gentamycine):. La contrainte de cisaillement (SS) est donnée par SS = 4 μQ / π * r 3 Q représente le débit (ml / sec), r le rayon (cm) du segment de veine, et μ est la viscosité du milieu de perfusion.
- Moduler SS en ajustant la viscosité par addition de 70 kDa dextran. Mesure de la viscosité avec un viscosimètre. Ici, ajouter 8% de dextran 70 kDa pour définir SS à 9-15 dyn / cm 2.
- Mettre la pompe à engrenage pour induire un signal cardioïde pulsatile de 60 impulsions / min et amplitude constante à générer un flux unidirectionnel de 150 ± 15 ml / min, indépendante de la pression appliquée dans le système et commandé par un ordinateur. Assurez-vous que le logiciel de pilotage intègre l'acquisition constante et la surveillance des pressions, vitesse d'écoulement, la fréquence du pouls, et le signal. Si vous le souhaitez, utiliser une deuxième pompe (non synchronisationhronized) pour produire un non-laminaire, l'écoulement turbulent.
3. Assemblée EVP (Figure 1)
- Avant de commencer, assurez-vous que tout le matériel est stérile. Effectuez toutes les étapes suivantes sous asepsie dans une hotte à flux laminaire.
- Placez la veine dans une boîte de Pétri remplie avec le milieu. Utilisez une lame chirurgicale et diviser la veine en 3 segments égaux.
- Rincer immédiatement un segment dans du PBS. Diviser le segment en 3 parties, fixer un dans le formol pour la morphométrie. Congeler les deux autres pour la transcription quantitative (RT-PCR) et de protéines (western blot) analyse. Tenez compte de ces segments en tant que témoin, non veine perfusée.
- Utiliser les deux segments restants de la perfusion.
- Injecter très doucement moyen dans la veine et déterminer le sens d'écoulement normale; en présence de la veine soupapes est inversée.
- Sceller les veines est d'une importance capitale pour le succès expérimental. Vérifier les fuites à travers collatéraux. Fixez les fuites avec 6-0 points de suture de soie.
- Connectez le segment de veine entre les deux cylindres métalliques, une extrémité à la fois (2.3, Figure 1). Fixer les cylindres avec Ethibon 3-0 autour des indentations (figure 1A et B).
- Placer le segment veineux ensemble dans la chambre de perfusion préalablement remplie avec un milieu. Répétez la même procédure pour le deuxième segment.
REMARQUE: une panne de bien sceller la veine de la bouteille sera une source de la fuite, nécessite une réintervention, et augmenter de façon significative le risque d'infection et d'insuffisance expérimentale.
- Placer le segment veineux ensemble dans la chambre de perfusion préalablement remplie avec un milieu. Répétez la même procédure pour le deuxième segment.
- Pour renforcer (mesh) du deuxième segment, de libérer les deux cylindres avec la veine (ci-joint) des pièces en forme de L (2.3 et figure 1).
- Soyez doux et ne pas toucher la veine avec des instruments. Faites glisser la maille d'abord sur le cylindre puis sur la veine. Une bousculade push / pull obtiendra le maillage sur la veine.
- Une fois que le maillage couvre toute la surface de la veine assurer la jveine acketed aux cylindres avec Ethibon 3-0.
- Réassembler le composé veine / cylindre sur le support en forme de L et le transférer à la chambre de perfusion, préalablement remplie avec un milieu.
- Connecter chaque cylindre métallique (et en sortie) à un séparateur en Y en utilisant un tube de silicone traitée avec du peroxyde d'un diamètre intérieur de 3,2 mm.
- Raccorder la sortie à un deuxième séparateur séparateur en Y à l'aide du même type de tube. De ce répartiteur en Y, utiliser un tube pour mesurer la pression de perfusion à travers les deux navires. Connectez l'autre à la colonne pour former un système en boucle fermée (Figure 2).
- A l'intérieur de l'incubateur, utiliser un long (d'un mètre de longueur) pour connecter le tube de la colonne de pression à la tête de la pompe.
- Remplissez le mettre en place en reliant la tête de la pompe à l'entrée Y-splitter avec un autre tube de grande longueur (Figure 1).
4 veines perfusion
- Après l'assemblée EVP a été completed, remplir la colonne avec le milieu (rester en dessous de la veine conduit d'évacuation pour permettre le remplissage). Ajouter plus moyen dans la colonne jusqu'à ce que le système est plein. Déplacer tout le système dans l'incubateur maintenu à 37 ± 0,1 ° C avec un pH maintenu constant à 7,40 ± 0,01 (en utilisant un algorithme de CO 2 / pH sur la base de l'équation de Henderson-Hasselbach).
- Apportez la tête de pompe à engrenage extérieur de l'incubateur et le connecter à l'entraînement de la pompe à engrenages. Visser les tiges pour fixer l'ensemble.
- Mettez la puissance de la pompe, assurez-vous qu'il est activé sur le logiciel de pilotage et permet 5 min à moyen et à répartir de façon égale dans tous les compartiments.
- Pour contrôler la pression, utilisez un contrôle de la ligne artérielle. Raccorder la sortie de pression d'EVP (il correspond à cathéter artériel) pour le transducteur de pression relié à l'ordinateur.
- Assurez-vous que le tube est entièrement remplie de fluide et ne contient pas de bulles. De-bulles, le système de culture à travers le "li artérielne "tube (Figure 2). Faites attention à l'écran et de regarder pour un signal cardioïde pulsatile de 60 impulsions / min d'amplitude constante. A ce stade, la pression moyenne est comprise entre 0 à 10 mm Hg. Si la pression est <0 et la colonne vide progressivement rechercher une fuite (veine collatérale ou joint insuffisant entre la veine et le tube).
- Régler la pression minimale de 6 mm Hg pour un test veineuse ou à 90 mm Hg pour un test artérielle. Dans ces conditions, un injecteur d'air applique la pression nécessaire à la colonne et le système.
- Changer le milieu tous les 2 jours en utilisant le tube relié à la colonne de pression. Pour éviter d'endommager le changement de pression, ouvrir le bouchon de la première colonne.
5. achèvement de la perfusion
- Après 3 ou 7 jours de perfusion: prendre les EVP sur l'incubateur et démonter les veines. Jeter le 5 mm proximale et distale veine extrémités fixées à l'équipement. Couper, un rin 5 mm d'épaisseur centralegs du segment restant et fixer dans du formol (morphométrie). Geler les fragments restants et réduire en poudre pour d'autres analyses moléculaires.
Résultats
L'EVP est un outil précieux pour évaluer de manière indépendante les forces hémodynamiques sur la veine saphène humaine greffe remodelage et IH.
La figure 1 montre la chambre de perfusion et le support de la veine. Dans les figures 1A et B, le soutien de la veine avant (figure 1A) et après (figure 1B) assemblage, respectivement, sont représentés. Il se compose (de haut en bas) de 1 brut tube en acier inoxydable mesurant 9 cm, qui sert de support pour les deux pièces en forme de L qui peut facilement coulisser (de la gauche vers la droite) et fournit une technique fiable pour ajuster la taille de l'appui de la veine. Chacune de ces pièces est titulaire d'un disque de POM pour s'adapter à un cylindre en acier (de connecteur veineuse) fixé en place par des vis intégrées (tête de flèche). Figure 1C-D montre la chambre de perfusion seul (C) et après l'insertion du support de nervure (D). Sur la chambre d'irrigation, les dépressions sont conçus pourmaintenir le support de la veine en place (en haut) et d'éviter le vrillage du tube de raccordement qui entrent et sortent de la veine (en bas).
La figure 2 montre des images en temps réel (Figure 2A) et une représentation schématique (figure 2B) de la EVP. La chambre de perfusion, les veines et les supports, ainsi que la colonne de pression, sont maintenus dans un environnement contrôlé (température, CO 2 et O 2), tandis que la pompe, l'injecteur de charge, et des dispositifs de commande restent tous à l'extérieur de l'incubateur. La figure montre la pompe à engrenage (1) qui génère un signal impulsionnel commandé par un ordinateur (2), qui contrôle la vitesse d'écoulement (3), la pression (4), et commande la pression diastolique minimale (5); deux segments d'un même veine saphène sont connectés en parallèle à la pompe à perfusion à l'intérieur des chambres de perfusion séparés (6a, 6b) placés dans un incubateur de culture cellulaire.
Sur la figure 3,, L'analyse montre que histomorphométrique renfort externe empêche l'hyperplasie de l'intima et média remodelage pathologique autrement observé après 7 jours sous haute pression (schéma artériel, = 100 mm Hg moyenne) perfusion. Dans la figure 3A, les coupes histologiques représentatives colorées pour l'hématoxyline-éosine (HE) révèle le revêtement de la lumière par des noyaux de cellules endothéliales et les noyaux de SMC dans la couche de support dans toutes les conditions. Figures 3B-C montre représentant Van Gieson élastique Lamina ( VGEL) sections colorées. Sur la figure 3B, l'intima est épaissie (IH) dans les veines perfusés à haute pression (moyenne = 100 mm Hg) pendant 7 jours par rapport au témoin non perfusées veines, un phénomène largement diminué en présence d'une maille externe. Figure 3C illustre pathologique remodelage extérieur et des médias éclaircie dans les veines soumis à 7 jours de la pression artérielle. Ceci est en grande partie empêché par l'armature externe. AILLEURSe, sur la figure 3D, trichrome de coloration de Masson (bleu = tissu conjonctif, rouge = muscle) associe ce remodelage pathologique avec la persistance de seulement l'une des trois couches musculaires et l'accumulation de cellules de muscle lisse dans la couche interne (intima). L'armature externe préserve la distribution de la structure de support et de CML.
La figure 4 illustre une application clinique actuelle de la maille externe. Un exemple illustratif est fourni par un renfort externe de la fistule artério-veineuse d'anévrisme (accès d'hémodialyse). Figure 4A montre une représentation temps-courant de l'armature de la veine (du haut vers le bas). En premier lieu, le filet a été placé autour d'un tube rigide tandis que l'extrémité de la veine est fixée sur un mandrin (panneau supérieur). Ensuite, la veine a été tiré à travers le tube, grâce à la broche. Une fois que la veine a été mis en place, le tube a été retiré lentement, en laissant la maille autour de la veine (uREFPP et du milieu). Dans ce cas particulier, la procédure a été répétée sur les deux côtés des veines, et les veines segments et des renforts de maille ont été assemblés par une anastomose de bout en bout (panneau inférieur). Figure 4B offre une vue agrandie de la fin artério-veineuse anastomose -HDMI côté, montrant que le treillis est enroulé autour de l'anastomose en l'attachant le long de la paroi postérieure de l'artère.

Figure 1: Le support de la veine et de la chambre de perfusion. A. Le soutien de la veine est composé de 1 tube lisse, en forme de L 2-pièces, disques et cylindres (former du haut vers le bas). B. Le soutien de la veine D. La perfusion une fois assemblés. C. Vue de la chambre de perfusion. chambre est conçue pour maintenir en place le support de la veine et permet sa connexionion de la veine et tubes de liaison.

La figure 2 ex vivo du système de perfusion. A. Le tout assembler EVP dans l'incubateur de culture cellulaire. B. Représentation schématique. 1) la pompe générer une onde pulsatile cardioïde; 2) l'ordinateur contrôlant la pression, le débit (type, taux et amplitude); 3) l'appareil de mesure de débit; 4) du transducteur de pression - la ligne artérielle; 5) de l'injecteur sous pression; 6) deux segments d'un même veine saphène sont perfusés sans (6a) ou avec treillis d'armature externe (6b).

Figure 3 Le renforcement externe empêche l'hyperplasie intimale. A. coupes histologiques représentatives colorées à l'hématoxyline-éosine (HE). Bar représente 50 um. Colombie-Britannique. Coupes histologiques représentatives colorées pour l'élastine (VGEL). l = m = lumière médias, IH = hyperplasie intimale. Bar représente 50 um. D. représentatifs des coupes histologiques colorées au trichrome de Masson. Bar représente 50 um.
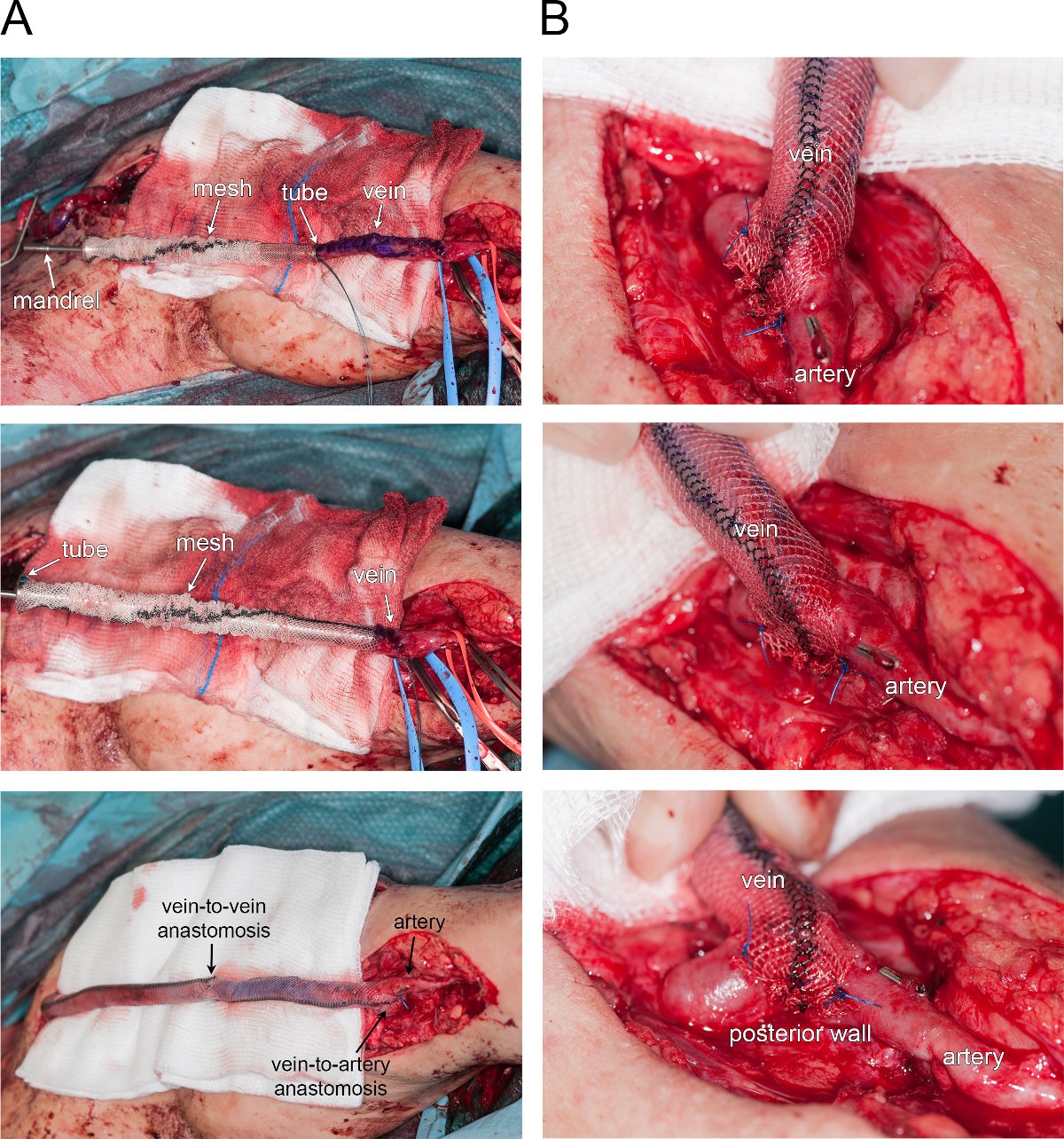
Figure 4 Renforcement externe d'une fistule d'anévrisme. Photos A. Temps-cours de renforcement de la veine (de haut en bas). B. Vue agrandie de l'anastomose de bout en côté artérioveineuse.
Discussion
Cette étude révèle une ex vivo système veine de perfusion (EVP) d'effectuer des études approfondies hémodynamiques dans les veines humaines. Ce système permet de veines saphènes sous perfusion des paramètres hémodynamiques déterminées en l'absence de facteurs aggravants inflammatoires et de la croissance libérés par les cellules circulantes in vivo. Ainsi, il permet une meilleure compréhension des voies sous-jacents impliqués dans le contrôle de IH dans les veines humaines greffes 5,11,12,15.
Perturbations hémodynamiques reproductibles et quantifiables sont limitées in vivo. Plusieurs procédures complexes de microchirurgie murins ont été décrits. En utilisant un modèle de dérivation de isogreffe par interposition d'une veine cave d'une souris donneuse dans le droit artère carotide commune et la création supplémentaire d'une ligature sortie de branche, mi greffe ou une sténose de l'artère carotide commune, le débit et SS aiguë a diminué et amélioré IH 3. Extérieur vers l'intérieur par rapport remodelage peut en outre être interrogated l'aide d'un mi-focale par rapport à la sténose carotide commune distale 16. Dans les grands animaux (moutons, porcs, et babouin), pontages sont techniquement plus facile et représentent une approche intéressante pour tester des dispositifs à taille humaine pré-cliniques tels que le maillage utilisé dans la présente étude 8-10. Cependant, son coût et la rareté des outils moléculaires validées limitent l'utilisation de ces stratégies. Enfin, ces manipulations de flux modifient constamment la tension de la paroi et ne parviennent pas à interroger un seul constituant. En outre, les relations complexes entre l'hémodynamique et les systèmes immunitaire et endocrinien autres limitent l'analyse d'un seul acteur.
Plusieurs questions se posent à l'utilisation de l'EVP. 1) de bas grade contamination bactérienne souvent accompagnée récolte de veine humaine et l'absence ex vivo de cellules circulantes se présenter comme une cause importante d'infection. Ceci est principalement empêché par le lavage des mains les pièces séparément, puis autoclavage tout le matériel avantutiliser. En outre, l'assemblage est effectué en moins de 90 minutes et sous asepsie rigoureuse. 2) d'étanchéité qui endure des stérilisations répétées. Pour cette raison, une construction rectangulaire PMMA-GS a été utilisé, ce qui évite l'utilisation de joints et de limiter la déformation. 3) SS et la tension de paroi sont calculées en des points de temps définis, sur la base du rayon de lumière du vaisseau (histologie), l'écoulement et la viscosité est constante. L'intégration d'une imagerie longitudinale (caméra haute définition, laser ou Doppler) qui surveille en permanence le diamètre de la veine et / ou le débit fournira des informations plus détaillées sur les variations de débit locales et de permettre des calculs de contraintes cycliques. 4) Les deux segments de veines parallèles peuvent avoir des différences non contrôlés dans leur respect de paroi et le rayon. Ainsi, on compare uniquement les segments d'un même ordre d'idée, et supposons que, sous la même pression, le motif de débit est similaire dans les deux segments.
Dans cette étude, les veines ont été soumis à un écoulement laminaire pulsatile; Toutefois, 50% olésions hyperplasiques intima f se produisent dans les zones périanastomotique bout en face de la greffe de la veine, où l'écoulement laminaire est perturbé. Des conditions de turbulence peuvent être modélisées avec l'ajout d'une deuxième pompe, non synchronisés avec la première pompe. Les futures études seront effectuées pour évaluer précisément l'impact de la perturbation de l'écoulement laminaire sur IH et l'effet potentiellement bénéfique de grille de renfort. Fait intéressant, la structure flexible de la maille permet enveloppement circonférentiel au niveau des sites d'anastomose, comme déjà réalisée pour réparer les fistules anévrisme 17 (figure 4). Ainsi, le maillage pourrait s'avérer utile pour limiter la dilatation périanastomotique, la perturbation de l'écoulement laminaire et par conséquent réduire IH sur les sites d'anastomose. Cela peut être particulièrement bénéfique dans un pontage distal, souvent affecté par le diamètre inadéquation entre la veine et l'artère tibiale ou une artère fibulaire.
En résumé, la configuration illustrée ici permet perfusion parallèle de v humaineins, dans des conditions hémodynamiques identiques. Ces données démontrent que l'utilisation d'une maille de polyester macroporeux tubulaire externe est une méthode efficace pour limiter le développement de greffes veineuses IH en insérés dans un milieu artériel 11. Ce système peut profiter de plusieurs domaines de recherche. Surtout, il apparaît comme un outil puissant pour réaliser des études pré-cliniques destinés à tester la faisabilité et l'efficacité des différentes approches pour réduire IH dans le matériel humain, et est un ajout précieux à des modèles animaux in vivo. Autres supports de prothèse ou mailles recouvertes avec des agents pharmaceutiques seront évalués en utilisant cette méthode 6-10. En outre, on pourrait envisager de tester des molécules pharmacologiques appliquées localement pour éviter IH dans les tissus humains, sous état proche physiologique. interventions de thérapie génique sont également réalisables, la transduction d'un segment de veine pour surexprimer des gènes cibles ou de silence d'intérêt.
En conclusion, notre système va augmenter notre noncompré- de la contribution hémodynamique aux maladies de greffe de veine humaines. Il fournit une plate-forme innovante de tester de nouvelles stratégies thérapeutiques et peut se poser comme un «banc à côté de l'outil de traduction."
Déclarations de divulgation
Les auteurs n'ont rien à divulguer.
Remerciements
Ce travail a été financé par des subventions de la SNF [31003A-138528], le Octav et la Fondation Marcella Botnar, la Fondation Novartis et la Fondation Emma Muschamp. Nous remercions Martine Lambelet, et Jean-Christophe Stehle pour leur excellente assistance technique.
matériels
| Name | Company | Catalog Number | Comments |
| Name | Company | Catalog Number | Comments |
| RPMI 1640 - Glutamax | Life Technologies | 61870-010 | |
| Penicilline/Streptomycine/Fungizone | Bioconcept | 4-02F00-H | |
| Dextran from Leuconostoc spp. 500 gr. | Sigma-Aldrich | 31390 | |
| Tampon PBS CHUV pH 7.1-7.3 1 lt. | Laboratorium und Grosse Apotheke Dr. G. Bichsel AG | 100 0 324 00 | |
| Cryosectionning embedding medium - Tissue-Tek OCT Compound | Fisher Scientific | 14-373-65 | |
| Silicon Tubing (Peroxide) L/S 16 (96400-16 ) - 7.5m | Idex Health & Science GMBH | MF0037ST | |
| Y-splitter | Idex Health & Science GMBH | Y-connector | |
| 35 mm Culture dish | Sigma-Aldrich | CLS430165-100EA | |
| 15 ml Falcon tube | BD Bioscence | 352096 | |
| 50 ml Falcon tube | BD Bioscence | 352098 | |
| Gearing pump - Reglo-Z | Idex Health & Science GMBH | SM 895 | App-Nr 03736-00194 |
| Pump Head | Idex Health & Science GMBH | MI0008 | |
| Monitoring Kit TRANSPAC IV | icumedical | 011-0J736-01 | |
| 20 mL Syringes | B. Braun Medical SA | 4612041-02 | |
| Etibon 3-0 FS-2 | Ethicon- Johnson&Johnson | EH7346H | |
| Mesh ProVena 6-8mm | B. Braun Medical SA | 1105012-14 | |
| NaCl: Sodium Chlorure Solution perfusion 0.9% (100 ml) | B. Braun Medical SA | 534534 | |
| Masterflex L/S Standard Drive | Cole-Parmer Instrument Co | 7521-10 | |
| Acquisition card | National Instruments | PCI-6024 E | |
| Flowmeter module | Transonic Systems Inc. | TS410 and T402 | |
| Stopcock with 3-ways | BD Connexta Luerlock | 394600 | |
| Millex Filter | Milian | SE2M229I04 |
Références
- Sal Go, A., et al. Executive summary: heart disease and stroke statistics--2014 update: a report from the american heart association. Circulation. 129, 399-410 (2014).
- Sal Conte, M., et al. Results of PREVENT III: a multicenter, randomized trial of edifoligide for the prevention of vein graft failure in lower extremity bypass surgery. Journal of Vascular Surgery. 43, 742-751 (2006).
- Yu, P., Nguyen, B. T., Tao, M., Bai, Y., Ozaki, C. K. Mouse vein graft hemodynamic manipulations to enhance experimental utility. The American Journal of Pathology. 178, 2910-2919 (2011).
- Davies, M. G., Hagen, P. O. Reprinted article "Pathophysiology of vein graft failure: a review". European journal of vascular and endovascular surgery : the official journal of the European Society for Vascular Surgery. 42, S19-S29 (2011).
- Berard, X., et al. Role of hemodynamic forces in the ex vivo arterialization of human saphenous veins. Journal of Vascular Surgery. 57, 1371-1382 (2013).
- Vijayan, V., et al. Long-term reduction of medial and intimal thickening in porcine saphenous vein grafts with a polyglactin biodegradable external sheath. Journal of Vascular Surgery. 40, 1011-1019 (2004).
- Jeremy, J. Y., et al. On the biology of saphenous vein grafts fitted with external synthetic sheaths and stents. Biomaterials. 28, 895-908 (2007).
- Zilla, P., et al. Constrictive external nitinol meshes inhibit vein graft intimal hyperplasia in nonhuman primates. The Journal of Thoracic and Cardiovascular Surgery. 136, 717-725 (2008).
- Zilla, P., et al. Utilization of shape memory in external vein-graft meshes allows extreme diameter constriction for suppressing intimal hyperplasia: a non-human primate study. Journal of Vascular Surgery. 49, 1532-1542 (2009).
- Yeoman, M. S., et al. A constitutive model for the warp-weft coupled non-linear behavior of knitted biomedical textiles. Biomaterials. 31, 8484-8493 (2010).
- Longchamp, A., et al. The use of external mesh reinforcement to reduce intimal hyperplasia and preserve the structure of human saphenous veins. Biomaterials. 35, 2588-2599 (2014).
- Saucy, F., et al. Ex vivo pulsatile perfusion of human saphenous veins induces intimal hyperplasia and increased levels of the plasminogen activator inhibitor 1. European Surgical Research. Europaische Chirurgische Forschung. Recherches Chirurgicales Europeennes. 45, 50-59 (2010).
- Dubuis, C., et al. Atorvastatin-loaded hydrogel affects the smooth muscle cells of human veins. The Journal of pharmacology and experimental. 347, 574-581 (2013).
- Deglise, S., et al. Increased connexin43 expression in human saphenous veins in culture is associated with intimal hyperplasia. Journal of Vascular Surgery. 41, 1043-1052 (2005).
- Muto, A., Model, L., Ziegler, K., Eghbalieh, S. D., Dardik, A. Mechanisms of vein graft adaptation to the arterial circulation: insights into the neointimal algorithm and management strategies. Circulation Journal : Official Journal of the Japanese Circulation Society. 74, 1501-1512 (2010).
- Tao, M., et al. A simplified murine intimal hyperplasia model founded on a focal carotid stenosis. The American Journal of Pathology. 182, 277-287 (2013).
- Berard, X., et al. Salvage treatment for venous aneurysm complicating vascular access arteriovenous fistula: use of an exoprosthesis to reinforce the vein after aneurysmorrhaphy. European Journal of Vascular and Endovascular Surgery : the Official Journal of the European Society for Vascular Surgery. 40, 100-106 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon