Method Article
Generazione di
In questo articolo
Riepilogo
Enterobacter sp. YSU cresce in glucosio sali minima quantità di terreno. Auxotrofi sono generati trasformandola con transposome che si inserisce in modo casuale nel genoma dell'ospite. Mutanti si trovano di replicazione delle piastre da medie complesso terreno minimo. Geni interrotti sono identificati da salvataggio e sequenziamento del gene.
Abstract
Prototrofici batteri crescono su M-9 sali minimi mezzo addizionato con glucosio (M-9 medio), che viene utilizzato come fonte di carbonio e di energia. Auxotrofi possono essere generati utilizzando un transposome. Il commercialmente disponibile, Tn 5 transposome -derived utilizzato in questo protocollo è costituito da un segmento lineare di DNA contenente una origine di replicazione γ R6K, un gene per la resistenza alla kanamicina e termina due sequenze mosaico, che servono come siti di legame trasposasi. Il transposome, fornito come un complesso proteico DNA / trasposasi, viene introdotta mediante elettroporazione nel ceppo prototrofici, Enterobacter sp. YSU, e si inserisce in modo casuale nel genoma di questo host. I trasformanti sono placcati in replica su Luria-Bertani agar piastre contenenti kanamicina, (LB-kan) e su piastre di agar M-9 medie contenenti kanamicina (M-9-kan). I trasformanti che crescono su piastre LB-kan, ma non su piastre M-9-kan sono considerati auxotrofi. Genomico purificatoDNA da un auxotroph è parzialmente digerito, legata e trasformato in un pir + Escherichia coli (E. coli) ceppo. L'origine di replicazione R6Kγ permette il plasmide di replicare in pir + E. ceppi di coli, e il marcatore di resistenza alla kanamicina consente per la selezione plasmide. Ogni trasformante possiede un nuovo plasmide contenente il trasposone affiancato dalla regione cromosomica interrotto. Sanger sequenziamento e il Local Alignment Search Tool di base (BLAST) suggeriscono una identità putativo del gene interrotto. Ci sono tre vantaggi nell'utilizzo di questa strategia mutagenesi transposome. In primo luogo, non si basa sulla espressione di un gene trasposasi dall'host. In secondo luogo, il transposome viene introdotto nel host di destinazione mediante elettroporazione, piuttosto che per coniugazione o trasduzione e quindi è più efficiente. In terzo luogo, l'origine di replicazione R6Kγ rende facile identificare il g mutatoene che è parzialmente recuperato in un plasmide ricombinante. Questa tecnica può essere utilizzata per studiare i geni coinvolti nelle altre caratteristiche di Enterobacter sp. YSU o di una più ampia varietà di ceppi batterici.
Introduzione
Prototrofici batteri crescono in M-9 sali minimi terreno contenente glucosio (M-9 medio), la conversione del glucosio attraverso percorsi metabolici carbonio centrali per generare precursori, come amminoacidi, acidi nucleici e vitamine, per biosintesi 1. M-9 terreno contiene cloruro di ammonio come fonte di azoto, sodio e fosfato di potassio come buffer e fonte di fosforo, solfato di magnesio come fonte di zolfo e glucosio come fonte di carbonio e di energia. Luria-Bertani (LB) mezzo è ricco di aminoacidi da tryptone e di vitamine e fattori di crescita da estratto di lievito. Esso supporta la crescita di auxotrofi che non possono sintetizzare aminoacidi, vitamine e altri fattori di crescita necessari per la crescita su M-9 medie. Così, prototrofi cresceranno in LB e M-9 medie, che auxotrofi cresceranno in terreno LB ma non in M-9 medie. Con l'introduzione di mutazioni in una popolazione prototrofici di batteri e di identificare geni mutati che causano fenotipi auxotrofi, è possible per ottenere una migliore comprensione del metabolismo in un ceppo batterico.
Transposon mutagenesi può essere utilizzato per identificare molti dei geni necessari per la crescita su glucosio nel M-9 medie. I trasposoni si inseriscono in modo casuale nel genoma dell'ospite 2. Individuando trasformanti trasposoni su piastre di agar LB e replica li placcatura su piastre M-9 agar, è possibile selezionare per auxotrofi. Geni interrotti sono identificati attraverso il salvataggio del gene. Questo studio utilizza un Tn disponibile in commercio 5 -derived transposome che viene fornito come una soluzione di un segmento di DNA trasposone lineare mescolato con proteine trasposasi. Il segmento di DNA manca un gene trasposasi, ma contiene un gene per la resistenza alla kanamicina, una origine di replicazione γ R6K e due motivi mosaico che sono sequenze di DNA per trasposasi vincolanti a ciascuna estremità del segmento 3,4. Poiché la proteina trasposasi viene aggiunto direttamente al DNA, il segmento di DNA da solodefinito come il trasposone, e il complesso proteico DNA / trasposasi è definito come il transposome. Il transposome viene trasformato mediante elettroporazione 5 in un kanamicina ospitante sensibile (Figura 1A). Le colonie che crescono su piastre di agar LB contenenti kanamicina (LB-kan) hanno inserti di trasposoni (Figura 1B), e replica placcato trasformanti che non riescono a crescere su M 9-piastre di agar contenenti kanamicina (M-9-kan) sono auxotrofi (Figire 1C). DNA genomico da un mutante è purificata e parzialmente digerito con 4-base restrizione taglio endonucleasi, BFU CI (Figura 1D). Il DNA ligato si trasforma in un ceppo di Escherichia coli (E. coli) che contiene il gene pir (Figura 1E). Questo gene permette il nuovo plasmide contenente il trasposone e fiancheggiante regione cromosomica ospite di replicare in E. coli 6. Il gene di resistenza alla kanamicina funge damarcatore eleggibile per il nuovo plasmide. Infine, sequenziamento usando primers complementari a ciascuna estremità del trasposone e Basic Local Alignment Search Tool (BLAST) Analisi 7,8 della sequenza risultante viene utilizzata per determinare l'identità dei geni interrotti.
Questa strategia transposome mutagenesi offre tre vantaggi 3. In primo luogo, poiché la proteina trasposasi è legato direttamente al trasposone, inserimento non dipende espressione del gene trasposasi all'interno dell'ospite. Una volta che il trasposone in sé incorpora nel genoma dell'ospite, la trasposasi è degradato, impedendo il movimento addizionale del trasposone. Tuttavia, il movimento supplementare non può essere evitata se l'host possiede un elemento endogeno Tn 5 traspositivo. In secondo luogo, l'introduzione del transposome mediante elettroporazione permette di utilizzarlo in un'ampia varietà di ospiti. Inoltre, elimina la necessità di introdurre il trasposone per coniugazione batterica o viinfezione ral. Entrambi i processi richiedono suscettibilità dell'ospite. Terzo, l'inserimento del gene per la resistenza alla kanamicina e l'origine di replicazione γ R6K nel transposome rende più facile identificare il gene interrotto. Regioni trasposone-interrotto possono essere memorizzati e sequenziati come plasmidi, eliminando la necessità di utilizzare la reazione a catena della polimerasi inversa (PCR) per l'identificazione del gene.
Il protocollo presentato in questo video descrive ogni passo per trasposone mutagenesi di Enterobacter sp. YSU 9 utilizzando un transposome dalla sua introduzione nelle cellule batteriche per l'identificazione del gene putativo è interrotto. Oltre ai protocolli precedentemente pubblicati 3,4,10, metodi dettagliati per l'utilizzo di replicazione delle piastre per lo screening auxotrofi sono presentati. Questa tecnica di mutagenesi possono essere utilizzate per indagare altri fenotipi, quali antibiotici e metallo resistenze, in diversi tipi di batteri, per identcando il numero minimo di geni necessari per la crescita in condizioni di coltura definiti in studi di biologia sintetica, o per l'insegnamento di un componente di un laboratorio di genetica o corso di fisiologia microbica.
Protocollo
1. elettroporazione di cellule competenti 5,11
- Diluire un O / N cultura LB di Enterobacter sp. YSU 1/20 in 50 ml di terreno LB fresco e crescere con agitazione a 120 rpm e 30 ° C ad un OD (600 nm) tra 0,4 e 0,6. Facoltativamente, crescere altri ceppi batterici alla loro temperatura di crescita ottimale.
- Raffreddare le cellule in ghiaccio per 5 min e centrifugare a 4 ° C e 7.000 xg per 5 min.
- Eliminare il surnatante, risospendere le cellule in 50 ml di acqua ghiacciata sterile e centrifugare a 4 ° C e 7.000 xg per 5 min. Ripetere questo passaggio.
- Eliminare il supernatante e risospendere le cellule in un volume di acqua ghiacciata pari al volume pellet. Per la conservazione a lungo termine, lavare le cellule con 10 ml di ghiaccio freddo 10% (v / v) glicerolo, risospendere in un volume uguale di pellet di ghiaccio freddo 10% (v / v) glicerolo, conservare a -80 ° C, e disgelo in ghiaccio prima elettroporazione.
- Aggiungere 0,5 ml di transposome a 40 ml dicellule. La soluzione transposome disponibile in commercio viene fornito ad una concentrazione di DNA di 0,33 mg / mL. Sebbene 0,33 mg è raccomandato, 0,165 mg DNA è sufficiente.
- Posizionare la miscela di cellule / transposome in ghiacciata, 0,2 mm, elettroporazione cuvetta e toccare la miscela sul fondo della cuvetta. Shock le cellule a 25 uF, 200 Ω, e 2,5 kV. Al fine di garantire che le cellule rimangono refrigerati, memorizzare le cuvette elettroporazione in un freezer -20 ° C prima dell'uso.
- Immediatamente, aggiungere 960 ml di filtro sterilizzati brodo eccellente ottimale con la repressione da cataboliti (SOC) di media. Mescolare pipettando su e giù e trasferire le cellule ad una sterile 1,5 ml provetta da microcentrifuga.
NOTA: Le cellule iniziano a morire dopo lo shock, ma il sale nel mezzo SOC permette loro di recuperare. Per risparmiare, non è necessario aggiungere transposome o urti cellule di controllo negativo. Basta aggiungere 960 ml di mezzo SOC sterile ad esso. - Incubare le cellule a 30 ° C fo 45-60 min con agitazione a 120 rpm. Ciò fornisce il tempo per la transposome di ricombinarsi con il genoma ospite e per le celle di esprimere la resistenza alla kanamicina.
- Distribuire 100 microlitri di cellule su una piastra di agar LB-kan e incubare la piastra di O / N a 30 ° C. Conservare la miscela trasformazione rimanente in frigorifero a 4 ° C. Stendere importi aggiuntivi in un secondo momento fino a 2 settimane dopo l'elettroporazione iniziale, se necessario.
2. Gridding di trasformanti
- Nastro una griglia al coperchio di un piatto 100 x 15 mm di Petri vuota. Copiare una griglia da "Un corso breve in Genetica batterica" 12.
- Tracciare una linea sul fondo di una piastra di agar LB-kan. Utilizzare un piccolo pezzo di nastro per ancorarlo al coperchio con griglia in modo che la griglia è visibile attraverso l'agar. Assicurarsi che la linea sulla parte inferiore della piastra è allineata con la parte superiore, centro della griglia. Ancoraggio del piatto con del nastro impedisce di scivolare, consentendo anche gridding. La linea facilita l'identificazione delle colonie dopo la replicazione delle piastre.
- Scegliere un singolo trasformante con uno stuzzicadenti sterile e posto nel centro di un quadrato nella griglia. Basta toccare la colonia e il posto. Non scavare il stuzzicadenti nel agar. Per evitare di contaminare la piastra, gestire lo stuzzicadenti ad una sola estremità.
- Spot altro trasformante in una casella adiacente come al punto 2.3. Quando la piastra è pieno, incubare O / N a 30 ° C. Questa è la piastra master.
3. Replica Plating determinare il fenotipo Auxotroph 12
- Per ogni piastra che è stato grigliata; fare una pila di tre piastre di agar fresco numerati da uno a tre: uno per LB-kan, due per M-9-kan e tre per LB-kan. Essiccare le piastre a testa in giù, O / N a 37 ° C prima dell'uso.
- Tracciare una linea sulla parte superiore di ciascuna piastra come al punto 2.2.
- Pulire lo strumento replicazione delle piastre con il 70% di etanolo, posizionare un quadrato di velluto sterile in cima alla replicazione delle piastre diolo e bloccare la piazza velluto verso il basso. Le mani sono ricchi di microbi anche dopo il lavaggio loro. Evitare l'introduzione di contaminanti microbi gestendo la piazza velluto dal bordo.
- Allineare la linea sulla piastra principale con una linea tracciata sul morsetto e posizionare la piastra di sopra del quadrato velluto. Applicare una leggera pressione per trasferire i batteri dalla piastra alla piazza velluto. Fare attenzione a non imbrattare i batteri. Rimuovere la piastra principale dalla piazza velluto.
- Allineare la linea tracciata su una targa con la linea sulla pinza e posizionarlo sulla parte superiore della piazza velluto. Applicare una leggera pressione per trasferire i batteri dalla piazza velluto alla piastra. Rimuovere un numero di targa.
- Eliminare la piazza velluto in un bicchiere di acqua e mettere un pulito, sterile, velluto piazza sullo strumento di replicazione delle piastre come descritto al punto 3.3. Questo passaggio impedisce over-inoculazione che causa la crescita svolta e dei risultati falsi positivi.
- Allineare illine sul numero uno piastra con la linea sul morsetto e posizionarlo sulla parte superiore della nuova piazza velluto. Applicare una leggera pressione per trasferire i batteri di targa uno alla piazza velluto. Rimuovere un numero di targa.
- Allineare la linea tracciata sul numero due piastra con la linea sul morsetto e posizionarlo sulla parte superiore della piazza velluto. Applicare una leggera pressione per trasferire i batteri dalla piazza velluto di numero due piatto. Rimuovere numero due piatto.
- Ripetere il punto 3.8 per il numero di targa tre. La terza piastra è un controllo per il trasferimento completo dalla piastra master agli altri due piastre. Eliminare la piazza velluto in un bicchiere d'acqua. Per riutilizzare le piazze di velluto, sterilizzare in autoclave il bicchiere contenente le piazze di velluto contaminati, lavarli, asciugarli, avvolgerli in un foglio di alluminio e li ri-sterilizzare in autoclave.
- Incubare le piastre a 30 ° CO / N. Le colonie che crescono su entrambe le piastre di agar LB-kan, ma non riescono a crescere su piastre M-9-kan sono considerati auxotrofi ( Figura 2).
- Streak fuori auxotrofi da un numero di targa su una piastra di agar LB-kan fresca e incubare la piastra a 30 ° CO / N.
- Streak per isolamento 3 colonie dalla piastra striscia al punto 3.11 su una piastra LB-kan fresco. Incubare la piastra a 30 ° CO / N. Questo assicura che il mutante è ben isolato. Dividere il piatto in tre parti e strisciare fuori ogni colonia in una sezione.
- Colonie Spot dalle colonie strisciate derivanti dal passaggio 3.12 su una piastra di LB-kan fresca per formare una griglia, come nei passaggi 2.1-2.4. Ogni mutante viene ri-testato in triplicato.
- Replicare nuovo piatto come nei passaggi 3,1-3,10 per confermare il fenotipo auxotroph.
4. Gene Rescue
- Grow 3 ml O / N di una coltura isolata colonia mutante dal punto 3.13 nel mezzo liquido LB-kan a 30 ° C. Purificare il DNA genomico da 1 ml di coltura usando un kit di purificazione del DNA genomico disponibile in commercio.
- Impostare una miscela di 0.025 UBFU CI endonucleasi di restrizione e 14 microlitri di 1 mg / mL di DNA genomico in una reazione di 20 microlitri su ghiaccio. Poiché BFU CI taglia il trasposone a dodici siti diversi, può essere più efficiente utilizzare endonucleasi di restrizione, Bfa I o Hae III, che taglia il trasposone a due e tre siti diversi, rispettivamente.
- Incubare la reazione a 37 ° C per 25 min e poi a 80 ° C per 20 minuti per inattivare l'enzima. Analizzare 3 ml di DNA parzialmente digerito su un gel di agarosio 0,8% (Figura 3). Un successo i risultati di digestione parziali in uno striscio di superiori a 10 kb fino al fondo del gel.
- Legare 15 microlitri di DNA genomico parzialmente digerito con 800 unità di T4 DNA ligasi in una reazione 500 microlitri. Incubare la reazione di O / N a 4 ° C. Il volume di reazione ampio massimizza la legatura dei singoli frammenti a se stessi e minimizza le interazioni tra due o più frammenti di DNA.
- Precipitazionite il DNA ligato aggiungendo 50 ml di 3 M acetato di sodio, pH 5,5, e 1 ml di etanolo al 95% e incubando è a -20 ° C per 20 min.
- Microcentrifuga il DNA a 4 ° C e 13.500 xg per 10 min, lavare il pellet con il 70% di etanolo, asciugare in un concentratore a vuoto centrifuga, e risospendere in 10 ml di acqua priva di nucleasi. In alternativa, il DNA può essere essiccato all'aria a temperatura ambiente per 15 min.
- Utilizzare 4 ml di DNA risospeso per trasformare E. coli ceppo ECD100D pir o ECD100D pir116 mediante elettroporazione come nel paragrafo 1. L'origine di replica γ R6k richiede un ceppo batterico con un gene pir per replicare 6. I risultati di deformazione pir in plasmidi copia bassi, e il ceppo pir116 contiene un gene mutante pir che si traduce in plasmidi alta copia. Ogni trasformante contiene un nuovo plasmide con il trasposone e una regione del cromosoma interrotto (Figura 1E).
- Inoculate 5 ml di terreno LB-kan con una singola colonia, crescere O / N con agitazione a 120 rpm e 37 ° C, e purificare DNA plasmidico dal / coltura intera O N utilizzando un kit commerciale.
- Digest 14 ml di plasmide usando l'endonucleasi di restrizione Xho I. Assicurarsi che il volume finale della reazione è di 20 microlitri. Questo enzima riconosce un sito della metà del trasposone all'estremità 5 'del gene di resistenza alla kanamicina. Analizzare 10 ml di non digerito e digerito plasmide su un gel di agarosio 0,8% (Figura 3). Il plasmide è costituito dal 2 kb trasposone più accompagnamento DNA ospite.
Sequencing 5. DNA
- Sequenza plasmide utilizzando un kit disponibile in commercio sequenziamento, primer che sono omologhe a ciascuna estremità del trasposone, e un sistema di analisi di sequenziamento capillare. In alternativa, il plasmide può essere spedito in un istituto esterno per il sequenziamento.
- Utilizzare lo standard di peso molecolare (1 kb scala) inil gel di stimare le dimensioni del plasmide. Poi, stimare il numero di nanogrammi (ng) di plasmide che è necessario per il 50 fmol.
- Misurare la concentrazione del DNA plasmidico utilizzando uno spettrofotometro a lunghezze d'onda di 260 nm (A 260) e 280 nm (A 280). Assicurarsi che la lunghezza del percorso della luce attraverso la cuvetta è di 1 cm. Determinare la concentrazione moltiplicando l'assorbanza a 260 nm da 50 ng / ml. Alta qualità DNA plasmidico avrà un A 260 / A 280 Rapporto tra 1,8 e 2,0.
- Il volume di DNA richiesto per ogni reazione di sequenziamento è il numero di ng necessario per il 50 fmol divisa per la concentrazione del plasmide. Mescolare il volume del plasmide richiesto con acqua per portare il volume totale di 10 microlitri.
- Riscaldare la miscela di DNA plasmidico / acqua a 96 ° C per 1 min e poi raffreddare a temperatura ambiente.
- Aggiungere 8 ml di master mix dal kit di sequenziamento e 2 ml di 1,6 mM di uno dei primer di sequenziamento.
- Folbasso il protocollo del kit di sequenziamento per il programma termociclatore e la reazione di pulizia.
- Analizzare ogni campione utilizzando un sistema di analisi del DNA capillare.
- Utilizzare un pacchetto software disponibile in commercio per visualizzare la sequenza del DNA. Ricercare la sequenza "5'-GAGACAG-3 '", che è l'ultimo 7 bp del trasposone (Figura 4). La sequenza prima estremità 5 'di questo segmento 7 bp appartiene al trasposone. La sequenza dopo all'estremità 3 'di questo segmento 7 bp appartiene al gene interrotto.
- Determinare la possibile funzione del gene interrotto utilizzando il Local Alignment Search Tool (BLAST) 7,8 di base. Utilizzare la seguente link: http://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastn&BLAST_PROGRAMS=megaBlast&PAGE_TYPE=BlastSearch . Incollare la sequenza di interrupted gene nella casella di ricerca, selezionare "Altro" sotto la base di dati e clicca su "BLAST" in fondo alla pagina. Quando viene visualizzato il risultato, scorrere la pagina per visualizzare i risultati di allineamento (Figura 5).
Risultati
Trasformazione di Enterobacter sp. YSU mediante elettroporazione con il transposome avviato inserimento genoma casuale nel genoma dell'ospite (Figura 1A, B). Un elettroporazione di successo ha prodotto diverse migliaia di trasformanti che crescono su piastre LB-Kan. Per ottenere 300-400, colonie per piastra ben distanziati, la quantità di trasformazione miscela diffusione su ciascuna piastra di agar LB-kan è stato ottimizzato. Ogni trasformante conteneva almeno un inserto trasposoni, ma non era chiaro se un gene importante per la crescita su M-9 mezzo è stato interrotto senza controlli di replicazione delle piastre. I trasformanti sono stati trasferiti in piastre di LB-kan fresche in griglie di 88 e replica placcati su M-9 di media. Nota, per garantire che il trasposone è mantenuto nei trasformanti, la sezione Protocolli raccomanda di aggiungere kanamicina alle M-9 piastre di terreno. Il medium M-9 non è stato integrato con kanamicina in questo caso, ma era ancora possibile avere auxotrofi senza. In Figura 2, i quadrati neri mostrano due colonie che crescevano sulla piastra LB-kan (2A) ma non sulla M-9 minima piastra media (2B). Questi auxotrofi probabilmente contenevano interruzioni geni coinvolti nella sintesi di un amminoacido, un acido nucleico o di una vitamina che si trovano in terreno LB ma non in M-9 terreno minimo (Figura 1C). Gli altri 86 colonie non avevano un'interruzione in un gene che è necessario per la crescita su M-9 terreno minimo.
Alcune colonie possono essere stati contaminati da colonie adiacenti durante la replicazione delle piastre. Per isolare un mutante come una coltura pura, è stato striato dalla LB-kan targa uno al passo 3.1 su una piastra di agar LB-kan fresco e coltivato O / N a 30 ° C. Tre colonie cresciute sono state strisciate su una seconda piastra LB-kan freschi e coltivati O / N a 30 ° C. Poi, una colonia che nasce da ciascuna delle tre colonie è stato avvistato su una terza nuova piastra LB-kan. Replica placcatura indietro su un M-9 minima medium piatto verificato in triplice copia il fenotipo auxotrophic che è stato osservato nella Figura 2. Dei 1.760 trasformanti trasposoni proiettati in un corso di 2013 microbica Fisiologia, 23 erano auxotrofi.
Il gene interrotto da un auxotroph è stato poi identificato utilizzando salvataggio gene. Una colonia auxotrophic dalla seconda piastra striscia sopra (punto 3.13) è stato coltivato O / N in terreno LB-kan, e il DNA genomico è stato purificato dalla coltura utilizzando un kit di purificazione del DNA genomico. Elettroforesi su gel di agarosio ha mostrato che il DNA purificato era più grande di 10 kb di dimensione (Figura 3, corsia 2). Per rompere il DNA genomico in frammenti più piccoli che contenevano il trasposone e fiancheggianti interrotti regioni ospitanti (Figura 1D), è stato parzialmente digerito con 0.025 unità di BFU CI per 25 min a 37 ° C. Questa restrizione tagli endonucleasi di 5'-GATC-3 'siti che si verificano circa ogni 200 a 500 paia di basi. Anche se cisono dodici 5'-GATC-3 siti 'all'interno del trasposone, un gran numero di frammenti contenenti il trasposone intatto e accompagnamento genoma ospite sarà ancora presente nel DNA parzialmente digerito. Corsia 3 di Figura 3 mostra parzialmente digerito DNA genomico con una macchia di DNA iniziando superiore a 10 kb, fino al fondo del gel al di sotto di 0,5 kb. Se lo striscio DNA comincia sotto 2 kb, la dimensione del trasposone, allora il DNA è stato digerito troppo. Sarà necessario diminuire la quantità di enzima aggiunto, il tempo di incubazione 37 ° C, o entrambi. Se non c'è striscio e la corsia con il DNA digerito è la stessa dimensione come il DNA con il DNA digerito, allora non si sono verificati digestione. Sarà necessario aumentare la quantità di enzima aggiunto, il tempo di incubazione 37 ° C o entrambi. Invece di utilizzare BFU CI, potrebbe essere possibile utilizzare la endonucleasi di restrizione Bfa I o Hae III, che taglia il trasposone a due e tre siti differentirispettivamente. L'uso di uno di questi enzimi può aumentare la E. coli pir + trasformazione resa durante il salvataggio del gene.
Il DNA parzialmente digerito è stato ligato in una reazione 500 microlitri. Questo volume aumentato minimizzata interazioni tra altri frammenti di DNA e massimizzata la probabilità che ogni frammento legatura con se stessa per formare una molecola circolare. Il DNA è stato precipitato legatura e trasformata mediante elettroporazione in E. coli pir116 ceppo ECD100D. La miscela trasformazione è stata sparsa su piastre LB-Kan. Le colonie che crescevano contenevano un nuovo plasmide consistente del trasposone e una regione del gene ospitante interrotto (Figura 1E). Il numero di unità formanti colonie variava da 0 a 2.000 per ml di trasformazione della miscela. Se la regione cromosomica di accompagnamento codificato una proteina che è tossico per la E. ospitante coli, l'efficienza di trasformazione era basso o solo un piccolo segmento del cromoun po 'è stato associato con il nuovo plasmide. DNA plasmidico è stato purificato da una coltura che è stato inoculato con un singolo trasformante e digerito con l'endonucleasi di restrizione, Xho I, che riconosce un singolo sito nel centro del trasposone vicino all'estremità 5 'del gene di resistenza alla kanamicina. Corsia 4 nella figura 3 conteneva il plasmide digerito e corsia 5 conteneva plasmide digerito. Perché purificato DNA plasmidico tende ad essere superavvolto, è migrato a un ritmo più veloce rispetto allo stesso filamento di DNA lineare digerito. La corretta dimensione di questo plasmide è stato 3 kb. Conteneva 2 kb del trasposone, oltre a circa 1 kb del gene di accoglienza interrotto. Se il DNA ospite di accompagnamento contiene uno o più siti di riconoscimento Xho I, si osserveranno due o più bande plasmide nella corsia con Xho I digerito DNA.
La figura 4 mostra un risultato di sequenziamento per un plasmide che è stato isolato da un auxotroph. Dopo aver rimosso la short sequenza trasposone in grassetto, la sequenza di DNA ospite è stato presentato per Basic Local Alignment Search Tool (BLAST) Analisi 7,8. Uno dei risultati BLAST suggerito che la sequenza interrotta è simile a un subsp Enterobacter cloacae. cloacae NCTC 9394 (emb | FP929040.1 |) gene per mutasi corismato, che è coinvolto nella biosintesi di L-tirosina e L-fenilalanina (Figura 5) 13. A volte, durante la legatura del DNA genomico parzialmente digerito, il trasposone lineare ligates a uno o più altri frammenti BFU CI. Questo può rendere il BLAST risultati confusione perché l'identità di un gene cambia bruscamente. Ad esempio, i primi 41 coppie di basi di un'altra auxotroph abbinati ad un gene per la glutammato deidrogenasi-5-semialdeide che è coinvolto nella biosintesi prolina 1. Poi, i successivi 219 coppie di basi abbinati ad un gene per una subunità ribonucleoside-difosfato reduttasi, seguito da un segmento coppia 62 di base per lipide-A-disacc chinasi haride. L'ultimo segmento di 295 coppie di basi abbinato al glutammato-5-semialdeide deidrogenasi di nuovo. La presenza di 5'-GATC-3 siti 'per upi CI suggerito che due frammenti di DNA più piccole legatura nel plasmide salvato. Così, la diluizione del DNA parzialmente digerito per reazioni di ligazione non elimina completamente fondo causato dalla legatura di frammenti più piccoli. Da questi risultati, si è concluso che la stessa transposome inserito il gene per la glutammato-5-semialdeide deidrogenasi perché la sequenza di questo gene è stato immediatamente adiacente alla trasposone. Altri auxotrofi contenevano interruzioni nel gene per la beta cystathione liasi coinvolti nella biosintesi della metionina; per Istidinolo deidrogenasi coinvolti nella biosintesi istidina; per fosfoserina fosfatasi coinvolta in serina, glicina e cisteina biosintesi; e per Chetoacido reduttoisomerasi coinvolto in leucina, isoleucina e valina biosintesi 1.
nt "fo: keep-together.within-page =" always ">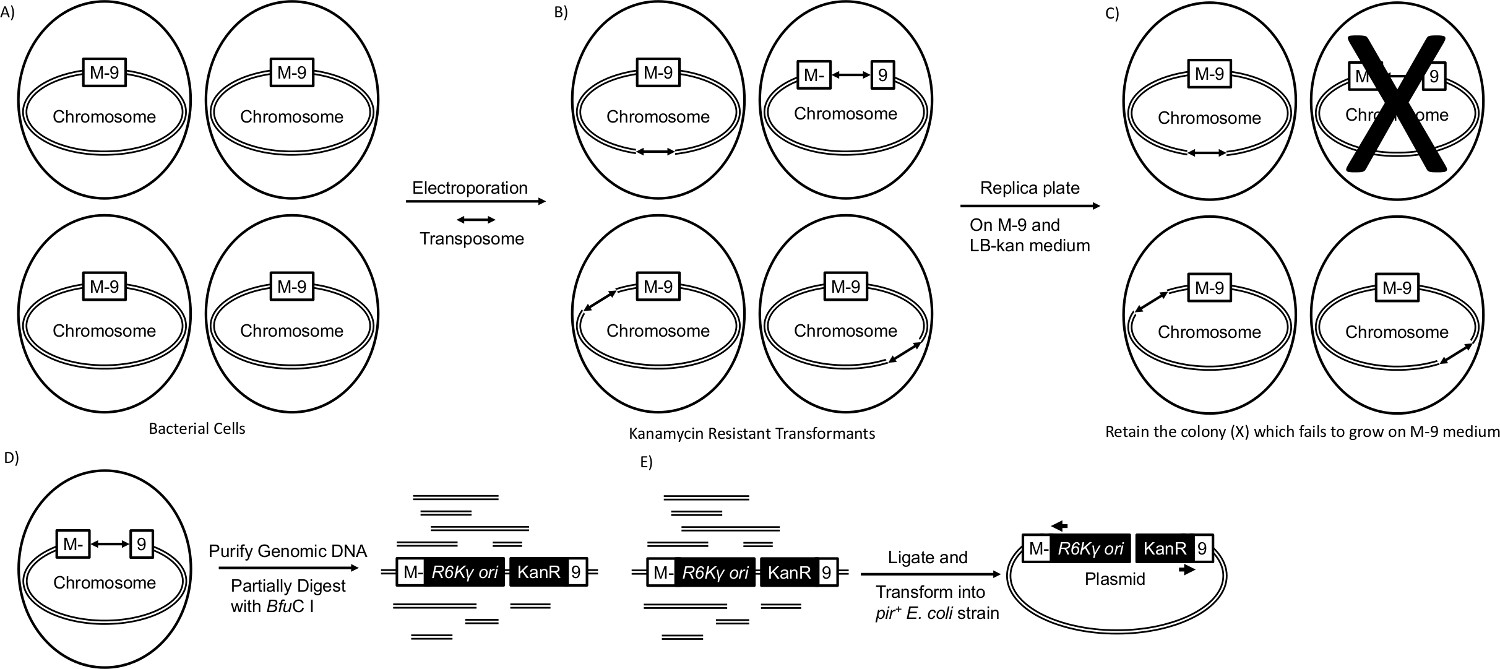
Figura 1. Transposon mutagenesi. (A) Le cellule batteriche contenenti un gene che è necessario per la crescita su M-9 sali minimi mezzo contenente glucosio. L'M-9 inscatolato rappresenta un gene auxotrophic. (B) La transposome viene introdotto nel ceppo batterico mediante elettroporazione, e la proteina trasposasi legato a ciascuna estremità del mosaico (frecce) inserisce casualmente il trasposone nel cromosoma ospite 3,4. Solo trasposoni contenente trasformanti cresceranno su piastre LB medio-Kan. (C) I trasformanti sono placcati in replica su M-9 terreno contenente glucosio e sul medio LB-kan. I trasformanti che non riescono a crescere (barrata) su M-9 terreno contenente glucosio sono auxotrofi. (D) Il DNA genomico è purificato dalle auxotrofi ed è parzialmente digerito con il cutt 4-baseer, BFU CI, che riconosce il sito di DNA, 5'-GATC-3 '. (E) Il DNA parzialmente digerito viene trattato con T4 DNA ligasi e trasformato mediante elettroporazione in E. coli ceppo ECD100D pir per formare un nuovo plasmide che contiene il trasposone e il gene cromosomico interrotta, necessaria per la crescita su M-9 medie. Il gene pir consente di frammenti di DNA circolari contenenti l'origine di replicazione γ R6K nel trasposone per servire come origine di replicazione del plasmide 6. Il gene di resistenza alla kanamicina serve come marcatore selezionabile per il nuovo plasmide. Il plasmide è purificata, e una sequenza bp ~ 500 del gene interrotto è determinato utilizzando primer (frecce) che sono omologhi a ciascuna estremità del trasposone. Clicca qui per vedere una versione più grande di questa figura.
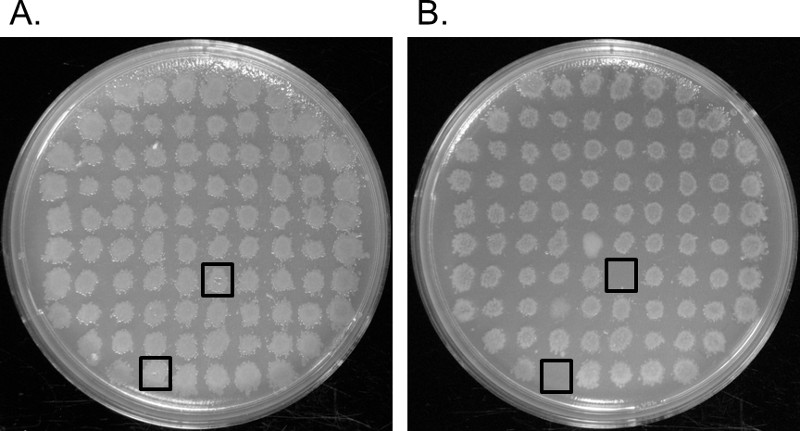
Figura 2. Replica placcatura. (A) Griglia di trasformanti che sono stati trasferiti ad una piastra di agar LB-kan. (B) Griglia degli stessi trasformanti che sono stati trasferiti ad un M-9 medie piatto. Auxotrofi cresciute su piastre LB-kan, ma non sulle M-9 piastre di terreno. Questi sono identificati dai quadrati neri. Cliccate qui per vedere una versione più grande di questa figura.
Figura 3. 0.8% di agarosio gel Corsia 1:. 1 kb scala. Corsia 2: non digerito DNA genomico. Corsia 3: upi C ho parzialmente digerito DNA genomico. Corsia 4: non digerito plasma salvatiid. Corsia 5: plasmide Xho I digeriti salvato.

Figura 4. Sequenza di DNA parziale di un plasmide. La sequenza in grassetto è parte del trasposone e non è stato sottoposto per l'analisi BLAST. Il resto della sequenza è un segmento dei geni salvato dall'host.

Figura 5. Analisi BLAST 7,8. A partire dalla prima base (Query), il gene interrotto sembra codificare un corismato mutasi Enterobacter cloacae, che si occupa di fenilalanina e tirosina biosintesi.
Discussione
Mutagenesi trasposone utilizzando un transposome è uno strumento efficace per la generazione di auxotrofi in Enterobacter sp. YSU e altri tipi di Gram-negativi e batteri Gram-positivi 3,4. Il processo è stato avviato con l'introduzione della Tn 5 transposome -derived nell'ospite mediante elettroporazione. Per identificare colonie con inserti, il ceppo di destinazione non trasformata doveva essere sensibili alla kanamicina per la selezione per il marcatore di resistenza portata dal trasposone. Alcuni host producono enzimi di restrizione che degradano il DNA trasposone prima che possa ricombinarsi con il genoma dell'ospite. L'aggiunta di un inibitore di endonucleasi di restrizione alla miscela elettroporazione può minimizzare la degradazione ed aumentare la resa di trasformazione 3. Mentre si prepara batteri competenti elettroporazione, era importante rimuovere tutto il sale possibile per evitare un arco elettrico o scintille che uccide i batteri dovuti alla presenza di sale. Anche in assenza diun arco elettrico, le cellule hanno cominciato a morire rapidamente dopo di loro scioccante. Con il sale contenente terreno di coltura SOC immediatamente ripristinato l'equilibrio osmotico, la morte cellulare ridotto al minimo e una maggiore efficienza di trasformazione 5. Trasformanti resistenti kanamicina sono stati poi avvistati su una piastra di LB-kan fresco e replica placcato a M-9 minima quantità di terreno agar. Per evitare un eccesso di inoculazione che può causare risultati falsi positivi che mancano possibili auxotrofi, velluto piazze sono passati al punto 3.6 prima che il resto dei piatti sono state inoculate. Poi, durante la replicazione delle piastre, sufficiente pressione è stata applicata per trasferire le colonie senza provocare sbavature o contaminazione tra colonie adiacenti.
I geni mutati nelle auxotrofi sono stati identificati attraverso il salvataggio del gene. DNA genomico da ogni auxotroph è stata tranciata con una digestione parziale, con la frequente-base taglierina upi C I. digestioni parziali utilizzando Bfa I o Hae III, che ha tagliato il transposon meno frequentemente, può migliorare l'efficienza di trasformazione trasposoni. È anche possibile utilizzare una digestione completa con altri enzimi di restrizione, taglia 6-base e base 8, che mancano siti all'interno del trasposone. Il DNA digerito è stato poi ligato e trasformato in E. coli ceppo ECD100D pir o ECD100D pir116 6. Sebbene la E. coli ceppo pir116 stata trasformata mediante elettroporazione nel passo 4.8, è anche possibile utilizzare cellule chimicamente competenti. In questo caso, l'intera trasformazione dovrebbe essere diffuso per ottenere una vasta selezione di plasmidi salvati. Il gene pir consente di trasposone circolarizzato di replicare il più basso numero di copia plasmide, e il gene mutante pir116 permette di replicare un elevato plasmide copia. Le rese di trasformazione a basso utilizzando il ceppo pir116 possono essere dovuti alla espressione di prodotti genici tossici dall'host originale. La tossicità può essere ridotto utilizzando la copia a basso Ceppo pir. Tuttavia, bassa resa plasmide dal ceppo pir può rendere la sequenza più difficile.
Sequenziamento genomico 10 e PCR sequenziamento 14 sono metodi alternativi per il salvataggio dei geni. Il metodo di sequenziamento genomico sequenze di regioni cromosomiche fiancheggianti direttamente dal DNA genomico purificato. Questa strategia è utile quando il genoma dell'organismo bersaglio è già stato sequenziato. Una volta che la regione mutato è stato identificato mediante sequenziamento genomico e BLAST, l'intera regione può essere amplificato mediante PCR e clonato per ulteriori analisi. Il metodo PCR utilizza due reazioni di PCR e quattro differenti primer. Le prime coppie di reazione primer omologa trasposone (Primer 1) con un primer degenerato che contiene una breve DNA, sequenza linker (primer 2). La seconda reazione di PCR è una reazione di nested PCR, l'associazione un'altra trasposone Primer omologa (Primer 3) con un omologa fondo sequenza linker (iniettore 4). Il sito di adescamento per fondo 3 èsituato sul lato 3 'del sito adescamento primer 1. Quindi, la amplicand dalla seconda reazione di PCR viene pulito e sequenziato. Questo metodo di sequenziamento automatico amplifica il DNA direttamente dalle cellule mutanti, eliminando la necessità di purificazione del DNA genomico sia plasmide e soccorso.
Invece di identificare geni coinvolti nella Auxotrofia, trasposone mutagenesi può anche essere usato per studiare altri fenotipi facilmente dosati. Enterobacter sp. YSU è un ceppo batterico resistente a più di metallo che è anche resistente a 100 mg / ml di ampicillina (dati non pubblicati). La sua concentrazione minima inibente (MIC) per HgCl 2 è di 70 micron, ZnCl 2 è di 800 micron, AgNO 3 è di 80 micron e NAASO 2 è 14 mm 9. Dopo aver introdotto il transposome in questo ceppo e gridding trasformanti su piastre LB-kan, le colonie a griglia possono essere replica piastrati su terreno contenente metalli a concentrazioni inferiori al MIC di questo bacteceppo rial. Salvataggio e sequenziamento di un gene interrotto da un mutante con una MIC abbassata può rivelare un gene che conferisce resistenza ad uno di questi metalli.
Oltre ai mutanti generazione, la transposome può essere usato come un vettore in vitro o in vivo per identificare guadagno di geni funzionali, come la resistenza agli antibiotici o metallo. Per la strategia in vitro, il DNA genomico da Enterobacter sp. YSU viene digerito con endonucleasi di restrizione che riconosce i siti al di fuori del trasposone. Il DNA è legata e miscelato con il transposome in un tampone contenente Mg 2+. Dopo la ricombinazione tra il trasposone e frammenti genomici casuali, E. coli ceppo ECD100D pir viene trasformato con il DNA e spalmata su piastre contenenti ampicillina o un sale metallico. Le colonie che crescono possederanno un nuovo plasmide che contiene il trasposone situato vicino al gene di resistenza dell'ospite. Per in vivo vrategy, Enterobacter sp. YSU si trasforma con il transposome. Poi, l'intera reazione di trasformazione è coltivato in LB-kan mezzo liquido di selezionare per una grande popolazione con inserti trasposoni casuali. Il DNA genomico viene digerito con endonucleasi di restrizione che riconosce i siti al di fuori del transposome, legata e trasformato in E. coli pir ceppo ECD100D. Come nel metodo in vitro, trasformanti sono distribuite su piastre di ampicillina o di metallo. Ancora una volta, il plasmide risultante consisterà trasposone inserito accanto ad un gene di resistenza. Queste due strategie potranno avere successo solo se il gene di resistenza di destinazione può essere espresso ed è attiva nel E. coli.
Transposon mutagenesi può essere utilizzato per identificare il numero minimo di geni un ceppo batterico è necessario per la crescita 15,16. Due transposomes contenenti siti loxP e diversi marcatori di resistenza agli antibiotici sono necessari per questa strategia iceppo batterico na con una sequenza genomica nota. Dopo i due trasposoni integrano, espressa ricombinasi cre catalizza una reazione di ricombinazione tra i due siti loxP, eliminando regioni cromosomiche tra le inserzioni di trasposoni. La conoscenza della sequenza del genoma permette di identificare quali geni vengono eliminati. La capacità di crescere dimostra che i geni eliminati non sono necessari per la crescita. Questa tecnica è laborioso e un genoma minimo di crescita utilizzando questa strategia non è stata ancora completata. Tuttavia, uno studio di mutagenesi trasposone automatizzato di Pseudomonas aeruginosa mediante PCR sequenziamento stima che 300-400 geni erano necessari per la crescita di questo batterio nel terreno ricco 14. Questo studio non ha utilizzato il sistema ricombinasi loxP / cre.
I microbi con genomi minimi sono utili per la biologia sintetica 17. Un ceppo batterico con un minimo di un genoma è especially utile per eliminare la produzione di sottoprodotti indesiderati. Ad esempio, Clostridium acetobutylicum (C. acetobutylicum) è utilizzato per produrre biocarburante, butanolo 18. Durante la sua crescita, questo ceppo produce butanolo al termine della fase di crescita esponenziale appena prima che entri fase stazionaria. A questo punto, diventa sensibile a butanolo e altri prodotti di fermentazione e forma endospore dormienti che cessano di sintetizzare prodotto. Poiché transposomes sono stati utilizzati per studiare Clostridium perfringens 3, può essere possibile utilizzare un simile sistema transposome / loxP / cre ricombinasi per costruire un ceppo di C. acetobutylicum che manca dei geni per prodotti di fermentazione indesiderate e sporulazione, ma contiene geni per una maggiore Tolleranza butanolo. Questo ceppo aumenterebbe la resa del prodotto con contaminanti minime.
In sintesi, questo articolo il video ufficiale offre una ste completop Descrizione dettagliata delle procedure utilizzate per creare auxotrofi di trasposoni mutagenesi. Copre l'introduzione del transposome mediante elettroporazione, lo screening per le mutazioni di replicazione delle piastre, salvataggio geni mutati con tecniche e identificazione di geni interrotti clonazione dal sequenziamento del DNA. Questa tecnica può essere utilizzata per identificare la funzione dei geni ignoti o eventualmente costruire un ceppo batterico che può essere utilizzato in un processo industriale.
Divulgazioni
L'autore non ha nulla da rivelare.
Riconoscimenti
L'autore desidera ringraziare tutta la mia laurea di Ricerca Indipendente Studenti e tutti i miei microbica Fisiologia studenti laureati che hanno testato le mie idee trasposone mutagenesi durante i semestri di primavera 2010-2014. Questo lavoro è stato finanziato dal Dipartimento di Scienze Biologiche presso Youngstown State University.
Materiali
| Name | Company | Catalog Number | Comments |
| EZ-Tn5 R6Kγori/KAN-2 Tnp Transposome Kit | Epicentre (Illumina) | TSM08KR | |
| EC100D pir+ Electrocompetent E. coli | Epicentre (Illumina) | ECP09500 | Capable of replicating plasmids with an R6Kγ replication origin at a low copy number |
| EC100D pir-116 Electrocompetent E. coli | Epicentre (Illumina) | EC6P095H | Capable of replicating plasmids with an R6Kγ replication origin at a high copy number |
| 5X M-9 Salts | Thermo Fisher | DF048517 | |
| Lennox LB Broth | Thermo Fisher | BP1427-2 | |
| Agar | Amresco, Inc. | J637-1KG | Solid media contained 1.6% (w/v) agar |
| Kanamycin Sulfate | Amresco, Inc. | 0408-25G | When required, media contained 50 μg/ml kanamycin sulfate |
| D-Glucose Monohydrate | Amresco, Inc. | 0643-1KG | |
| Yeast Extract | Amresco, Inc. | J850-500G | |
| Tryptone | Amresco, Inc. | J859-500G | |
| KCl | Sigma-Aldrich | P4504-500G | |
| NaCl | Amresco, Inc. | X190-1KG | |
| MgCl2 | Fisher Scientific | BP214-500 | |
| MgSO2 | Fisher Scientific | BP213-1 | |
| Super Optimal Broth with Catabolite Repression (SOC) medium | 0.5% (w/v) yeast extract, 2% (w/v) tryptone, 10 mM NaCl, 2.5 mM KCl, 10 mM MgCl2, 20 mM MgSO4 and 20 mM Glucose | ||
| BfuC I | NEB | R0636S | Partial digestion of genomic DNA |
| Xho I | NEB | R0146S | Plasmid digestion |
| T4 DNA Ligase | NEB | M0202S | |
| Nuclease Free Water | Amresco, Inc. | E476-1L | For dissolving precipitated DNA and restriction endonuclease reactions |
| GenomeLab DTCS - Quick Start Kit | Beckman Coulter | 608120 | DNA sequencing |
| Wizard Genomic DNA Purification Kit | Promega | A1120A | |
| Wizard Plus SV Minipreps DNA Purification System | Promega | A1460 | Plasmid purification |
| Replica Plating Block | Thermo Fisher | 09-718-1 | |
| Velveteen Squares | Thermo Fisher | 09-718-2 | Replica plating |
| PetriStickers | Diversified Biotech | PSTK-1100 | Grid for replica plating |
| Petri Dishes | Thermo Fisher | FB0875712 | |
| Gene Pulser II | BioRad | Electroporation | |
| Electroporation Cuvettes – 2 mm | BioExpress | E-5010-2 | |
| CentriVap DNA Vacuum Concentrator | Labconco | 7970010 | Drying DNA |
| CEQ 2000XL DNA Analysis System | Beckman Coulter | DNA sequencing | |
| Vector NTI Advance 11.5.0 | Life Technologies | 12605099 | DNA sequence analysis |
Riferimenti
- Kim, B. H., Gadd, G. M. . Bacterial physiology and metabolism. , (2008).
- Hayes, F. Transposon-based strategies for microbial functional genomics and proteomics. Annual review of genetics. 37, 3-29 (2003).
- Hoffman, L. M. Random chromosomal gene disruption in vivo using transposomes. Methods in molecular biology. 765, 55-70 (2011).
- Goryshin, I. Y., Jendrisak, J., Hoffman, L. M., Meis, R., Reznikoff, W. S. Insertional transposon mutagenesis by electroporation of released Tn5 transposition complexes. Nature biotechnology. 18 (1), 97-100 (2000).
- Dower, W. J., Miller, J. F., Ragsdale, C. W. High Efficiency Transformation of E. coli by High Voltage Electroporation. Nucleic Acids Research. 16 (13), 6127-6145 (1988).
- Metcalf, W. W., Jiang, W., Wanner, B. L. Use of the rep technique for allele replacement to construct new Escherichia coli hosts for maintenance of R6Kγ origin plasmids at different copy numbers. Gene. 138 (1-2), 1-7 (1994).
- Morgulis, A., Coulouris, G., Raytselis, Y., Madden, T. L., Agarwala, R., Schäffer, A. a Database indexing for production MegaBLAST searches. Bioinformatics. 24 (16), 1757-1764 (2008).
- Zhang, Z., Schwartz, S., Wagner, L., Miller, W. A greedy algorithm for aligning DNA sequences. Journal of computational biology a journal of computational molecular cell biology. 7 (1-2), 203-214 (2000).
- Holmes, A., Vinayak, A., et al. Comparison of two multimetal resistant bacterial strains: Enterobacter sp. YSU and Stenotrophomonas maltophilia OR02. Current microbiology. 59 (5), 526-531 (2009).
- Hoffman, L. M., Jendrisak, J. J., Meis, R. J., Goryshin, I. Y., Reznikoff, W. S. Transposome insertional mutagenesis and direct sequencing of microbial genomes. Genetica. 108 (1), 19-24 (2000).
- Ausubel, F., Brent, R., et al. . Short Protocols in Molecular Biology. , (1997).
- Miller, J. H. . A short course in bacterial genetics: a laboratory manual and handbook for Escherichia coli and related bacteria. 2, (1992).
- Gibson, M. I., Gibson, F. Preliminary studies on the isolation and metabolism of an intermediate in aromatic biosynthesis: chorismic acid. The Biochemical journal. 90 (2), 248-256 (1964).
- Jacobs, M. A., Alwood, A., et al. Comprehensive transposon mutant library of Pseudomonas aeruginosa. Proceedings of the National Academy of Sciences of the United States of America. 100 (24), (2003).
- Reznikoff, W., Winterberg, K. Transposon-Based Strategies for the Identification of Essential Bacterial Genes. Microbial Gene Essentiality: Protocols and Bioinformatics SE. 2, 13-26 (2008).
- Suzuki, N., Inui, M., Yukawa, H. Random genome deletion methods applicable to prokaryotes. Applied Microbiology and Biotechnology. 79 (4), 519-526 (2008).
- Malley, M. A., Powell, A., Davies, J. F., Calvert, J. Knowledge-making distinctions in synthetic biology. BioEssays news and reviews in molecular, cellular and developmental biology. 30 (1), 57-65 (2008).
- Zheng, Y. -. N., Li, L. -. Z., et al. Problems with the microbial production of butanol. Journal of industrial microbiolog., & biotechnology. 36 (9), 1127-1138 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon