Method Article
דור של
In This Article
Summary
sp Enterobacter. YSU גדל במדיום מלחים מינימאליים של גלוקוז. Auxotrophs מופקים על ידי הפיכתה עם transposome שמכניס את עצמו באופן אקראי לגנום המארח. מוטציות נמצאות על ידי ציפוי העתק מבינוני מורכבת עד בינוני מינימאלי. גנים נקטעו מזוהים על ידי הצלת גן ורצף.
Abstract
חיידקי Prototrophic גדלים על M-9 מלחים מינימאליים בינוני בתוספת גלוקוז (בינוני M-9), המשמש כמקור פחמן ואנרגיה. יכול להיות שנוצר Auxotrophs באמצעות transposome. Tn 5 transposome זמין מסחרי, -derived שימוש בפרוטוקול זה מורכב ממקטע ליניארי של ה- DNA המכיל מקור R6K שכפול γ, גן לעמידות kanamycin ושני ברצף הפסיפס מסתיים, המשמש כאתרי transposase מחייבים. Transposome, סיפק כמתחם חלבון ה- DNA / transposase, מוצג על ידי electroporation למתח prototrophic, sp Enterobacter. YSU, ובאופן אקראי משלב את עצם לתוך הגנום של מארח זה. Transformants היא העתק מצופה על לוריא-Bertani צלחות אגר המכילות kanamycin, (LB-קאן) ועל גבי צלחות אגר M-9 מדיום המכילות kanamycin (M-9-קאן). Transformants הגדלים על צלחות LB-קאן, אבל לא על צלחות M-9-קאן נחשב auxotrophs. הגנומי מטוהרDNA מauxotroph מתעכל באופן חלקי, ligated והפך לPIR + Escherichia, מתח (E. coli). מקור שכפול R6Kγ מאפשר פלסמיד לשכפל בPIR + E. coli זנים, וסמן התנגדות kanamycin מאפשרים בחירת פלסמיד. כל transformant בעל פלסמיד חדש המכיל את transposon מוקף אזור כרומוזומליות שהופסק. סנגר רצף והמקומי יישור חיפוש הכלי בסיסי (פיצוץ) מציעים זהות משוערת של הגן שהופסק. ישנם שלושה יתרונות לשימוש באסטרטגית mutagenesis transposome זה. ראשית, הוא אינו מסתמך על הביטוי של גן transposase על ידי המארח. שנית, transposome מוחדר מארח היעד על ידי electroporation, ולא על ידי נטיה או על ידי התמרה ולכן הוא יעיל יותר. שלישית, מקור שכפול R6Kγ עושה את זה קל לזהות g המוטציהENE שהוא התאושש באופן חלקי בפלסמיד רקומביננטי. טכניקה זו יכולה לשמש כדי לחקור את הגנים מעורבים במאפיינים אחרים של sp Enterobacter. YSU או של מגוון רחב יותר של זני חיידקים.
Introduction
חיידקי Prototrophic לגדול בM-9 מלחים מינימאליים בינוני המכילים גלוקוז (M-9 בינוניים), המרת גלוקוז דרך מסלולי חילוף חומרים פחמן מרכזיים לייצר מבשרים, כגון חומצות אמינו, חומצות גרעין וויטמינים, לביוסינתזה 1. M-9 בינוניים מכיל אמוניום כלוריד כמקור חנקן, נתרן ופוספט אשלגן כחיץ ומקור זרחן, מגנזיום סולפט כמקור גופרית וגלוקוז כמקור פחמן ואנרגיה. לוריא-Bertani הבינוני (LB) הוא עשיר בחומצות אמינו מtryptone ובויטמינים וגורמי גדילה מתמצית שמרים. הוא תומך בצמיחה של auxotrophs שלא יכול לסנתז חומצות אמינו, ויטמינים וגורמי גדילה אחרים הנדרשים לצמיחה על M-9 בינוניים. כך, prototrophs יגדל בLB ו- M-9 בינוני, ואילו auxotrophs יגדל במדיום LB אבל לא בM-9 בינוניים. על ידי החדרת מוטציות לאוכלוסיית prototrophic של חיידקים וזיהוי גנים שעברו מוטציה שגורמים לפנוטיפים auxotrophic, זה פוssible להשיג הבנה טובה יותר של חילוף החומרים בזן חיידקים.
mutagenesis transposon יכול לשמש כדי לזהות רב של גנים הדרושים להתפתחות ברמת הסוכר בM-9 בינוניים. Transposons להכניס את עצמם באופן אקראי לגנום המארח 2. על ידי תצפית transformants transposon על צלחות אגר LB והעתק ציפוים על גבי צלחות אגר M-9 בינוניים, ניתן להקרין לauxotrophs. גנים נקטעו מזוהים דרך הצלת גן. מחקר זה משתמש Tn זמין מסחרי 5 -derived transposome שנשלח כפתרון של קטע DNA transposon יניארי מעורבב עם חלבון transposase. קטע DNA חסר גן transposase אבל מכיל את גן לעמידות kanamycin, המוצא שכפול γ R6K ושני מוטיבים פסיפס שהם רצפי DNA לtransposase מחייבים בכל קצה של הקטע 3,4. מאחר וחלבון transposase מתווסף ישירות ל- DNA, מגזר ה- DNA לבדמוגדר כtransposon, ומורכב חלבון ה- DNA / transposase מוגדר כtransposome. Transposome עובר טרנספורמציה על ידי electroporation 5 למארח רגיש kanamycin (איור 1 א). יש מושבות הגדלים על צלחות אגר LB המכילות kanamycin (LB-קאן) מוסיף transposon (איור 1), וtransformants העתק מצופה שלא מצליח לגדול על M-9 צלחות אגר המכילות בינוני kanamycin (M-9-קאן) הם auxotrophs (Figire 1 ג '). הדנ"א הגנומי של מוטציה הוא מטוהר ומעוכל חלקית עם endonuclease הגבלת חיתוך 4-הבסיס, Bfu CI (1D איור). DNA ligated הופך לזן של Escherichia coli (E. coli) המכיל את גן PIR (איור 1E). גן זה מאפשר לפלסמיד החדש המכיל את transposon ואיגוף אזור כרומוזומליות מארח לשכפל בE. coli 6. גן התנגדות kanamycin משמש כסמן electable לפלסמיד החדש. לבסוף, רצף באמצעות פריימרים משלימים לכל קצה של transposon והיסוד מקומי יישור חיפוש כלי הניתוח (פיצוץ) 7,8 של הרצף וכתוצאה מכך נמצא בשימוש כדי לקבוע את זהותו של גנים נקטעו.
אסטרטגית mutagenesis transposome זה מספקת שלושה יתרונות 3. ראשית, מאז חלבון transposase קשור ישירות לtransposon, הכנסה אינה תלויה בביטוי של גן transposase בתוך הפונדקאי. ברגע שtransposon משלב את עצם לתוך הגנום המארח, transposase נפגע, מניעת תנועה נוספת של transposon. עם זאת, לא ניתן למנוע תנועה נוספת אם המארח בעל אלמנט transpositional אנדוגני Tn 5. שנית, כניסתה של transposome ידי electroporation מאפשרת להשתמש בו במגוון רחב של מארחים. זה גם מבטל את הצורך להציג את transposon ידי קוניוגציה או על ידי viזיהום RAL. שני התהליכים דורשים רגישות מארח. שלישית, הכללה של גן התנגדות kanamycin והמוצא שכפול γ R6K בtransposome עושה את זה קל יותר לזהות את הגן שהופסק. ניתן לאחסן אזורי transposon-מופרע ורצף כפלסמידים, ומבטל את הצורך להשתמש בתגובת השרשרת של פולימראז ההפוך טכניקה (PCR) לזיהוי גן.
הפרוטוקול שהוצג בסרטון הזה מתאר כל שלב לmutagenesis transposon של sp Enterobacter. 9 YSU באמצעות transposome מהחדרתו לתאי החיידקים לזיהוי של הגן המשוער שזה ייפסק. בנוסף לפרוטוקולים שפורסמו בעבר 3,4,10, שיטות מפורטות לשימוש בציפוי העתק למסך auxotrophs מוצגות. טכניקת mutagenesis זה יכול לשמש לחקר פנוטיפים אחרים, כגון התנגדויות אנטיביוטיות ומתכת, בסוגים שונים של חיידקים, לזיהויifying המספר המינימלי של גנים הדרושים להתפתחות בתנאי תרבות הוגדרו במחקרים בביולוגיה סינטטיים, או להוראת מרכיב מעבדה של גנטיקה או קורס פיזיולוגיה של חיידקים.
Protocol
1. Electroporation של תאים מוסמכות 5,11
- לדלל O / תרבות N LB של sp Enterobacter. YSU 1/20 ל -50 מיליליטר של מדיום LB הטרי ולגדול עם רועד ב120 סל"ד ו -30 ° C עד OD (600 ננומטר) בין 0.4 ו -0.6. לחלופין, לגדול זני חיידקים אחרים בטמפרטורת הצמיחה האופטימלית שלהם.
- צ'יל התאים על קרח למשך 5 דקות ו צנטריפוגות ב 4 ° C ו -7,000 XG למשך 5 דקות.
- בטל supernatant, resuspend תאי 50 מיליליטר של מים סטריליים קרח קרים ו צנטריפוגות ב 4 ° C ו -7,000 XG למשך 5 דקות. חזור על פעולה זו.
- בטל supernatant ו resuspend התאים בנפח מים קרים כקרח שווים לגלולת נפח תא. עבור אחסון לטווח ארוך, לשטוף את התאים עם 10 מיליליטר של קרח קר 10% (v / v) גליצרול, גלול בשווה גלולה נפח של קרח קר 10% (v / v) גליצרול, חנות ב -80 מעלות צלזיוס, והפשרה על קרח לפני electroporation.
- הוסף 0.5 μl של transposome 40 μl שלתאים. פתרון transposome זמין המסחרית מסופק בריכוז ה- DNA של 0.33 מיקרוגרם / μl. למרות 0.33 מיקרוגרם מומלץ, 0.165 מיקרוגרם DNA מספיק.
- מניחים את תערובת התא / transposome בקרח קר, 0.2 מ"מ, קובט electroporation ולהקיש על התערובת לתחתית של קובט. לזעזע את התאים ב 25 μF, 200 Ω, ו -2.5 קילו וולט. כדי להבטיח שהתאים נשארים מקוררים, לאחסן cuvettes electroporation במקפיא C -20 ° לפני השימוש.
- מייד, להוסיף 960 μl של מסנן מעוקר מרק סופר אופטימלי עם דיכוי catabolite בינוני (SOC). מערבבים על ידי pipetting למעלה ולמטה ולהעביר את תאי צינור microfuge סטרילי 1.5 מיליליטר.
הערה: התאים מתחילים למות לאחר ההלם, אבל מלח במדיום SOC מאפשר להם להתאושש. כדי לחסוך, אין זה הכרחי להוסיף transposome או לזעזע את תאי בקרה השליליים. רק להוסיף 960 μl בינוני SOC סטרילי אליו. - דגירה התאים ב 30 מעלות צלזיוס ואו דקות 45-60 עם רועד ב120 סל"ד. זה מספק זמן לtransposome ללהשתלב מחדש עם גנום המארח ולתאים להביע התנגדות kanamycin.
- התפשטות של תאים 100 μl על צלחת אגר LB-קאן ודגירת O הצלחת / N ב 30 מעלות צלזיוס. אחסן את תערובת הטרנספורמציה שנותרה במקרר ב 4 מעלות צלזיוס. מורחים סכומים נוספים במועד מאוחר יותר עד 2 שבועות לאחר electroporation הראשוני במידת צורך.
2. gridding של transformants
- סרט רשת למכסה של צלחת פטרי מ"מ ריקה 100 x 15. העתק רשת מ" קורס קצר בקטריאלי הגנטיקה "12.
- למתוח קו על החלק התחתון של צלחת אגר LB-קאן. השתמש בפיסה קטנה של סרט לעגן אותו למכסה gridded כך שהרשת היא גלויה לעין דרך אגר. ודא שהשורה על החלק התחתון של הצלחת מיושרת עם החלק העליון, מרכז הרשת. עיגון הצלחת עם קלטת שומר עליו מפני החלקה, ומאפשר לאף gridding. הקו מאפשר זיהוי מושבה לאחר ציפוי העתק.
- בחר transformant יחיד עם קיסם סטרילי ולהבחין בו במרכזה של כיכר ברשת. רק לגעת במושבה והמקום. לא לחפור הקיסם לתוך אגר. כדי למנוע זיהום הצלחת, להתמודד עם הקיסם רק בקצה אחד.
- ספוט transformant נוסף בכיכר סמוכה כמו בשלב 2.3. כאשר הצלחת מלאה, דגירה אותו O / N ב 30 מעלות צלזיוס. זה צלחת האדון.
3. Replica ציפוי לקביעת Auxotroph הפנוטיפ 12
- לכל צלחת שgridded, להפוך את ערימה של שלוש צלחות טריות אגר ממוספרות אחד עד שלוש: אחד לLB-קאן, שני לM-9-קאן ושלושה לLB-קאן. ייבש את הצלחות הפוכות, O / N, על 37 מעלות צלזיוס לפני השימוש.
- צייר קו בחלק העליון של כל צלחת כמו בשלב 2.2.
- נגב את כלי ציפוי העתק עם 70% אתנול, למקם את כיכר קטיפה סטרילית על גבי ציפוי ההעתק לol ולצבוט את כיכר הקטיפה. ידיים רוחשת חיידקים גם לאחר שטיפתם. למנוע הכניסה של זיהום חיידקים על ידי הטיפול מרובע הקטיפה בקצה שלה.
- יישר קו על צלחת ההורים עם קו משורטט על המהדק ומניח את הצלחת על גבי כיכר הקטיפה. להפעיל לחץ עדין להעביר את החיידקים מהצלחת לכיכר הקטיפה. היזהר שלא למרוח את החיידקים. הסר את צלחת האב מכיכר הקטיפה.
- יישר את הקו שצויר על מספר לוחית אחד עם הקו על המהדק ולמקם אותו על גבי כיכר הקטיפה. להפעיל לחץ עדין להעביר את החיידקים מכיכר הקטיפה לצלחת. הסר את מספר לוחית אחת.
- מחק את כיכר הקטיפה לתוך כוס מים ומניח את ריבוע נקי, סטרילי קטיפה על כלי ציפוי העתק כמו בשלב 3.3. פעולה זו מונעת על-חיסון שגורם לצמיחת פריצת דרך ותוצאות חיוביות כוזבות.
- יישרקו על מספר לוחית אחד עם הקו על המהדק ולמקם אותו על גבי כיכר הקטיפה החדשה. להפעיל לחץ עדין להעביר את החיידקים ממספר לוחית אחת לכיכר הקטיפה. הסר את מספר לוחית אחת.
- יישר את הקו שצויר על מספר לוחית שתיים עם הקו על המהדק ולמקם אותו על גבי כיכר הקטיפה. להפעיל לחץ עדין להעביר את החיידקים מכיכר הקטיפה למספר צלחת שתי. הסר את מספר לוחית שתי.
- חזור על שלב 3.8 למספר לוחית שלוש. הצלחת השלישית היא שליטה להעברה מלאה מהצלחת הראשית לשתי צלחות האחרות. מחק את כיכר הקטיפה לתוך כוס של מים. כדי לעשות שימוש חוזר ריבועי הקטיפה, חיטוי הכוס המכילה ריבועי קטיפה המזוהמים, לשטוף אותם, לייבש אותם, לעטוף אותם בנייר אלומיניום ומחדש חיטוי אותם.
- דגירה הצלחות על 30 מעלות CO / N. מושבות הגדלים על שני הצלחות אגר LB-קאן, אבל לא מצליחים לגדול על צלחות M-9-קאן נחשבות auxotrophs ( איור 2).
- auxotrophs פס החוצה ממספר לוחית אחת על צלחת אגר LB-קאן טרי, ודגירה את הצלחת על 30 מעלות CO / N.
- פס החוצה לבידוד 3 מושבות מצלחת הפס בשלב 3.11 על צלחת LB-קאן טרי. דגירה את הצלחת על 30 מעלות CO / N. הדבר מבטיח כי המוטציה היא מבודדת היטב. מחלקים את הצלחת לשלישים ופס את כל מושבה בסעיף אחד.
- מושבות ספוט מהמושבות הנמוגות נגזרות מצעד 3.12 על צלחת LB-קאן טרי כדי ליצור רשת כמו בצעדים 2.1-2.4. כל מוטציה היא להיות מחדש נבדקה בשלושה עותקים.
- לשכפל את צלחת שוב כמו בצעדים 3.1-3.10 כדי לאשר את הפנוטיפ auxotroph.
4. ג'ין הצלה
- לגדול 3 O מיליליטר / תרבות N של מושבה מוטציה מבודדת מצעד 3.13 במדיום LB-קאן נוזלי על 30 מעלות צלזיוס. לטהר DNA הגנומי של 1 מיליליטר של התרבות באמצעות ערכת טיהור הדנ"א הגנומי זמינה מסחרי.
- הגדר את תערובת של 0.025 Uendonuclease Bfu CI הגבלה ו -14 μl של 1 מיקרוגרם / הדנ"א הגנומי μl בתגובת 20 μl על קרח. מאז Bfu CI חותך את transposon בעשרה אתרים שונים, זה יכול להיות יעיל יותר להשתמש endonuclease הגבלה, BFA אני או Hae III, אשר חותך את transposon בשניים ושלושה אתרים שונים, בהתאמה.
- דגירה התגובה על 37 מעלות צלזיוס למשך 25 דקות ולאחר מכן ב 80 מעלות צלזיוס למשך 20 דקות כדי להשבית את האנזים. ניתוח 3 μl של ה- DNA המעוכל חלקית על ג'ל 0.8% agarose (איור 3). תוצאות מוצלחות חלקיות עיכול במריחה מ 10 kb עד לתחתית של הג'ל.
- ולקשור 15 μl של הדנ"א הגנומי מעוכל חלקית באמצעות 800 יחידות של האנזים T4 DNA בתגובת μl 500. דגירה C ° O תגובה / N ב 4. גדול נפח התגובה מגדיל את קשירה של שברים יחידים לעצמם וממזער את יחסי גומלין בין שניים או יותר שברי DNA.
- Precipitate DNA ligated על ידי הוספת 50 μl של 3 אצטט M נתרן, pH 5.5, ו 1 מיליליטר של 95% אתנול ו דוגרים אותו ב -20 מעלות צלזיוס למשך 20 דקות.
- Microfuge DNA על 4 מעלות צלזיוס ו13,500 XG במשך 10 דקות, לשטוף את הכדור עם 70% אתנול, לייבש אותו ברכז ואקום צנטריפוגלי, וresuspend אותו 10 μl מים nuclease חינם. לחלופין, ה- DNA יכול להיות אוויר יבש ב RT במשך 15 דקות.
- השתמש 4 μl של ה- DNA resuspended להפוך E. PIR coli ECD100D מתח או pir116 ECD100D ידי electroporation כאמור בסעיף 1. המקור שכפול γ R6k דורש זן חיידקים עם גן PIR לשכפל 6. תוצאות מתח PIR בפלסמידים עותק נמוכים, ומתח pir116 מכיל את גן שעבר מוטציה PIR כי תוצאות בפלסמידים עותק גבוהים. כל transformant מכיל פלסמיד חדש עם transposon ואזור של כרומוזום שהופסק (איור 1E).
- Inoculאכלתי 5 מיליליטר של מדיום LB-קאן עם מושבה אחת, לגדל אותו O / N עם רועד ב120 סל"ד ו -37 מעלות צלזיוס, ולטהר את פלסמיד דנ"א מכל O / התרבות N באמצעות ערכה מסחרית.
- לעכל 14 μl של פלסמיד באמצעות I. Xho endonuclease ההגבלה ודא הנפח הסופי של התגובה הוא 20 μl. אנזים זה מזהה אתר באמצע transposon בסוף '5 של גן התנגדות kanamycin. לנתח 10 μl של מעוכל ומתעכל פלסמיד על 0.8% agarose ג'ל (איור 3). פלסמיד מורכב מה- DNA מארח transposon kb 2 בתוספת האיגוף.
רצף 5. DNA
- רצף פלסמיד באמצעות מערכת ניתוח רצפי נימי ערכה זמינה מסחרי רצף, פריימרים שהומולוגיים לכל קצה של transposon, ו. לחלופין, פלסמיד ניתן לשלוח למוסד מחוץ לרצף.
- משתמש בתקן המשקל המולקולרי (סולם kb 1) בג'ל להעריך את גודלו של פלסמיד. ואז, להעריך את מספר ננוגרם (ng) של פלסמיד הנדרש ל-50 fmol.
- למדוד את הריכוז של פלסמיד דנ"א באמצעות ספקטרופוטומטר באורכי גל של 260 ננומטר (260) ו- 280 ננומטר (280). להבטיח את אורך נתיב האור דרך קובט הוא 1 סנטימטר. קבע את הריכוז על ידי הכפלת הספיגה ב 260 ננומטר ב -50 ng / μl. פלסמיד דנ"א באיכות גבוהה יהיה 260 / יחס 280 בין 1.8 ו -2.0.
- הנפח של ה- DNA הנדרש לכל תגובת סידור הוא מספר NG נדרש ל-50 fmol מחולק בריכוז של פלסמיד. מערבבים את הנפח של פלסמיד הנדרש במים כדי להביא את הנפח הכולל של עד 10 μl.
- מחממים את תערובת פלסמיד דנ"א / מים על 96 מעלות צלזיוס במשך דקות 1 ולאחר מכן לקרר אותו לRT.
- הוסף 8 μl של תערובת הורים מערכת הרצף ו -2 μl של 1.6 מיקרומטר של אחד מצבעי יסוד הרצף.
- Folנמוך הפרוטוקול מערכת הרצף לתכנית Cycler תרמית וניקוי תגובה.
- לנתח כל דגימה באמצעות מערכת ניתוח ה- DNA נימים.
- השתמש בחבילת תוכנה זמינה מסחרי כדי להציג את רצף ה- DNA. חפש את הרצף, "5'-GAGACAG-3", "שהוא 7 נ"ב האחרון של transposon (איור 4). הרצף לפני סוף '5 של קטע 7 נ"ב זה שייך לtransposon. הרצף אחרי סוף '3 של קטע 7 נ"ב זה שייך לגן שהופסק.
- לקבוע את הפונקציה האפשרית של הגן שהופסק שימוש המקומי יישור חיפוש הכלי בסיסי (פיצוץ) 7,8. השתמש הבא link: http://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastn&BLAST_PROGRAMS=megaBlast&PAGE_TYPE=BlastSearch . הדבק את הרצף של הפסיקהגן ed לתוך תיבת השאילתה, בחר באפשרות "אחר" תחת מסד הנתונים ולחץ על "פיצוץ" בחלק התחתון של הדף. כאשר התוצאה מופיעה, לגלול את הדף למטה כדי להציג את תוצאות היישור (איור 5).
תוצאות
הפיכתו של sp Enterobacter. YSU ידי electroporation עם transposome יזם הכנסת הגנום אקראית לתוך הגנום המארח (איור 1 א, ב '). Electroporation מוצלח הניב כמה אלף transformants שגדלה על צלחות LB-קאן. כדי להשיג 300-400, היטב במרווחי מושבות בכל צלחת, הסכום של התפשטות תערובת הטרנספורמציה על כל צלחת אגר LB-קאן היה מותאם. כל transformant כלול להוסיף transposon לפחות אחד, אבל זה לא היה ברור אם גן חשוב לצמיחה בM-9 בינוניים נקטע ללא סינון על ידי ציפוי העתק. Transformants הועברה לצלחות LB-קאן טריים ברשתות של 88 והעתק מצופים על M-9 בינוניים. שים לב, על מנת להבטיח כי transposon נשמר בtransformants, סעיף הפרוטוקולים ממליץ הוספת kanamycin לM-9 הצלחות בינוניות. בינוני M-9 לא היה בתוספת kanamycin במקרה זה, אבל זה עדיין ניתן היה להשיג auxotrophs בלי זה. ב איור 2, הריבועים השחורים להראות שתי מושבות שגדלו על צלחת LB-קאן (2 א), אבל לא על צלחת M-9 המינימלית בינונית (2B). auxotrophs אלה כנראה הכיל הפרעות בגנים מעורבים בסינתזה של חומצות אמינו, חומצות גרעין או ויטמין אשר נמצאות במדיום LB אבל לא בM-9 בינוני מינימאלי (איור 1 ג '). 86 מושבות האחרות לא היו הפרעה בגן שנדרש לצמיחה על M-9 בינוניים מינימאלי.
מושבות מסוימות עשויות להיות מזוהמות במושבות סמוכות בציפוי העתק. כדי לבודד מוטציה כתרבות טהורה, זה היה מפוספס ממספר לוחית LB-קאן אחד בשלב 3.1 על צלחת אגר LB-קאן טרי וגדל O / N ב 30 מעלות צלזיוס. שלוש מושבות שגדלו היו נמוגות על צלחת LB-קאן טרי שנייה וגדלו O / N ב 30 מעלות צלזיוס. ואז, מושבה אחת שעלתה מכל אחת משלוש המושבות זוהתה על צלחת LB-קאן שלישי טרי. Replica ציפוי בחזרה אל Medi המינימלי M-9אממ צלחת מאומתת בשלושת עותקים פנוטיפ auxotrophic שנצפה באיור 2. של transformants transposon 1,760 הוקרנה בקורס מיקרוביאלית פיזיולוגיה 2013, 23 היו auxotrophs.
הגן שהופסק מauxotroph אז זוהה באמצעות הצלת גן. מושבה auxotrophic מצלחת הפס השנייה לעיל (שלב 3.13) הייתה גדלה O / N במדיום LB-קאן, והדנ"א הגנומי היה מטוהרים מן התרבות באמצעות ערכת טיהור הדנ"א הגנומי. ג'ל אלקטרופורזה agarose הראתה כי ה- DNA המטוהר היה גדול יותר מ -10 kb בגודל (איור 3, מסלול 2). כדי לשבור את הדנ"א הגנומי לרסיסים קטנים שהכילו transposon ואיגוף נקטעו אזורי מארח (1D איור), הוא מתעכל באופן חלקי עם 0.025 יחידות של Bfu CI 25 דקות ב 37 מעלות צלזיוס. קיצוצים זה הגבלת endonuclease ב5'-GATC-3 אתרים 'אשר מתרחשים בערך כל 200-500 זוגות בסיסים. למרות שיששנתי עשר 5'-GATC-3 אתרים 'בתוך transposon, מספר גדול של שברים המכילים transposon שלם ואיגוף גנום מארח עדיין יהיה נוכח בDNA המעוכל חלקית. מסלול 3 של תרשים 3 מראה באופן חלקי מתעכל הדנ"א הגנומי עם מריחה של ה- DNA מתחילה מעל 10 קילו, כל הדרך עד לתחתית הג'ל אל מתחת ל -0.5 קילו. אם למרוח DNA מתחיל מתחת ל -2 קילו, בגודל של transposon, אז ה- DNA נעשה מתעכל יותר מדי. יהיה צורך להקטין את כמות האנזים הוסיף, זמן הדגירה 37 ° C, או שניהם. אם אין למרוח והנתיב עם DNA מתעכל הוא באותו גודל כמו ה- DNA עם DNA לא מעוכל, אז לא עיכול התרחש. יהיה צורך להגדיל את כמות האנזים הוסיף, זמן הדגירה 37 ° C או שניהם. במקום להשתמש CI Bfu, זה עשוי להיות אפשרי להשתמש בהגבלה endonucleases BFA אני או Hae III, אשר חתך את transposon בשניים ושלושה אתרים שוניםבהתאמה. שימוש באחד מהאנזימים אלה עלולים להגביר את ה תשואת PIR + שינוי coli בהצלת גן.
DNA המעוכל חלקית שנקשר בתגובת 500 μl. נפח מוגבר ממוזער אינטראקציות בין קטעי דנ"א אחרים ומקסם את ההסתברות שכל בר ligated עם עצמו כדי ליצור מולקולה מעגלית. DNA ligated היה זירז והפך על ידי electroporation לE. pir116 ECD100D זן coli. תערובת הטרנספורמציה להתפשט על צלחות LB-קאן. מושבות שגדלו הכילו פלסמיד חדש בהיקף של transposon ואזור של גן המארח שהופסק (איור 1E). מספר היחידות יוצרות מושבה נע בין 0 ל -2,000 לכל מיליליטר של תערובת שינוי. אם אזור כרומוזומליות האיגוף מקודד חלבון שהיה רעיל לE. מארח coli, יעילות השינוי הייתה נמוכה או קטע קטן בלבד של כרומוכמה היה קשור עם פלסמיד החדש. פלסמיד דנ"א היה מטוהר מתרבות שהיה מחוסן עם transformant אחת ומתעכלת עם endonuclease ההגבלה, Xho אני, שהכיר באתר אחד במרכז transposon ליד הקצה '5 של גן התנגדות kanamycin. מסלול 4 באיור 3 מכיל פלסמיד לא מעוכל ומסלול 5 הכיל את הפלסמיד מתעכל. מכיוון שה- DNA פלסמיד מטוהר נוטה להיות supercoiled, נדד בקצב מהיר יותר מאשר אותו קווצת יניארי מתעכל DNA. הגודל הנכון של פלסמיד זה היה 3 קילו. הוא הכיל 2 קילו של transposon, ועוד כ 1 קילו של גן המארח שהופסק. אם ה- DNA מארח האיגוף מכיל אתרי הכרת Xho אני אחד או יותר, שתי או יותר להקות פלסמיד יקויימו בנתיב עם Xho אני מעכל את ה- DNA.
איור 4 מראה תוצאת רצף לפלסמיד שהיה מבודד מauxotroph. לאחר הסרת shoרצף transposon rt מודגש, רצף ה- DNA המארח הוגש ליסוד מקומי יישור חיפוש כלי 7,8 (פיצוץ) ניתוח. אחת תוצאות הפיצוץ הציע שהרצף נקטע דומה לsubsp cloacae Enterobacter. cloacae NCTC 9394 (EMB | FP929040.1 |) גן מוטאז chorismate, העוסק בסינתזה של L-tyrosine ו- L-פנילאלנין (איור 5) 13. לפעמים במהלך קשירה של הדנ"א הגנומי המעוכל חלקית, transposon יניארי ligates לברי Bfu CI אחד או יותר אחרים. זה יכול להפוך את פיצוץ תוצאות מבלבל, כי זהותו של גן משתנה בפתאומיות. לדוגמא, 41 הזוגות הבסיסים הראשונים של auxotroph אחר מותאמים לגן לdehydrogenase גלוטמט-5-semialdehyde העוסק בסינתזת פרולין 1. ואז, זוגות הבסיסים 219 הבאים מותאמים לגן למקטע רדוקטאז ribonucleoside-דיפוספט, ואחריו קטע זוג 62 בסיס לשומנים בדם-disacc קינאז haride. קטע זוג הבסיס האחרון 295 מותאם לdehydrogenase גלוטמט-5-semialdehyde שוב. הנוכחות של 5'-GATC-3 אתרים 'לBfu CI הציעה ששני קטעי DNA קטנים ligated לתוך פלסמיד הציל. כך, הדילול של ה- DNA המעוכל חלקית לתגובות קשירה לא מונע לחלוטין את הרקע שנגרם על ידי קשירה של שברים קטנים יותר. מתוצאות אלה, הגיעה למסקנה כי transposome מוכנס את עצמו לגן לdehydrogenase גלוטמט-5-semialdehyde בגלל הרצף לגן זה היה מייד בסמוך לtransposon. auxotrophs אחר כלול הפרעות בגן לאנזים בטא cystathione המעורב בסינתזת מתיונין; לdehydrogenase histidinol המעורב בסינתזת היסטידין; לphosphatase phosphoserine המעורב בסרין, גליצין, וביוסינטזה ציסטאין; ולreductoisomerase ketol חומצה המעורב בלבנן, isoleucine ולין ביוסינתזה 1.
NT "FO: לשמור על-together.within עמודים =" תמיד ">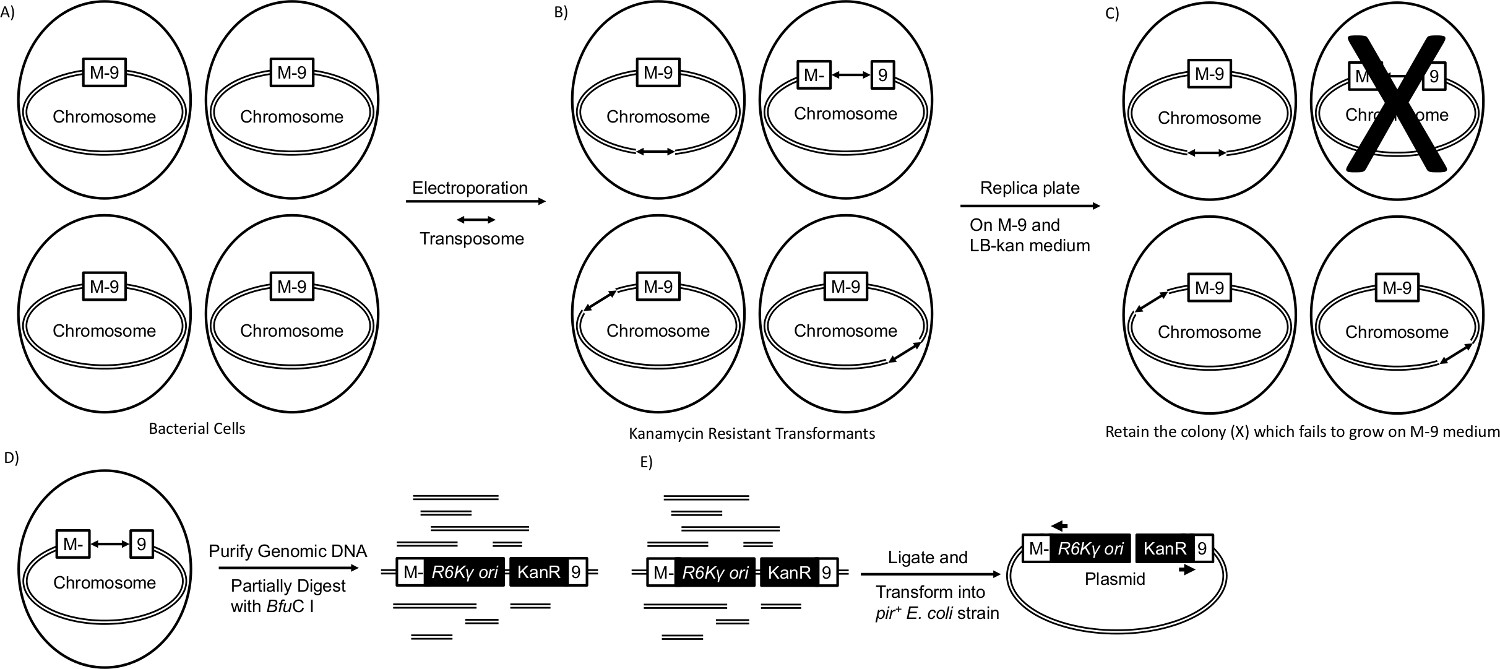
איור 1. transposon mutagenesis. (א) בתאים בקטריה המכילים גן הנדרש לצמיחה על M-9 מלחים מינימאליים בינוני המכילים גלוקוז. M-9 התאגרף מייצג גן auxotrophic. (ב) transposome מוחדר זן החיידקים על ידי electroporation, וחלבון transposase מחויב לכל קצה פסיפס (חיצים) באופן אקראי מוסיף transposon לכרומוזום מארח 3,4. transformants רק transposon מכיל תגדל על צלחות בינוניות LB-קאן. (ג) transformants היא העתק מצופה על M-9 בינוניים המכיל גלוקוז ועל מדיום LB-קאן. Transformants שלא מצליחות לגדול (מחוקית) על M-9 בינוני המכילה גלוקוז הוא auxotrophs. (ד) הדנ"א הגנומי מטוהר מauxotrophs ומתעכל באופן חלקי עם cutt 4-הבסיס אה, Bfu CI, אשר מכיר את אתר ה- DNA, 5'-GATC-3 מטופל DNA המעוכל חלקית עם האנזים T4 DNA והפך על ידי electroporation לא '. (ה) PIR ECD100D זן coli כדי ליצור פלסמיד חדש המכיל את transposon וגן כרומוזומליות שהופסק אשר נדרש לצמיחה על M-9 בינוניים. גן PIR מאפשר לקטעי DNA מעגליים המכילים את המקור שכפול γ R6K בtransposon לשמש כמקור שכפול בפלסמיד החדש 6. גן התנגדות kanamycin משמש כסמן לבחירה לפלסמיד החדש. פלסמיד מטוהר, ורצף נ"ב ~ 500 של הגן שהופסק נקבע באמצעות פריימרים (חיצים), כי הם הומולוגיים לכל קצה של transposon. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
EP-together.within עמודים = "תמיד"> 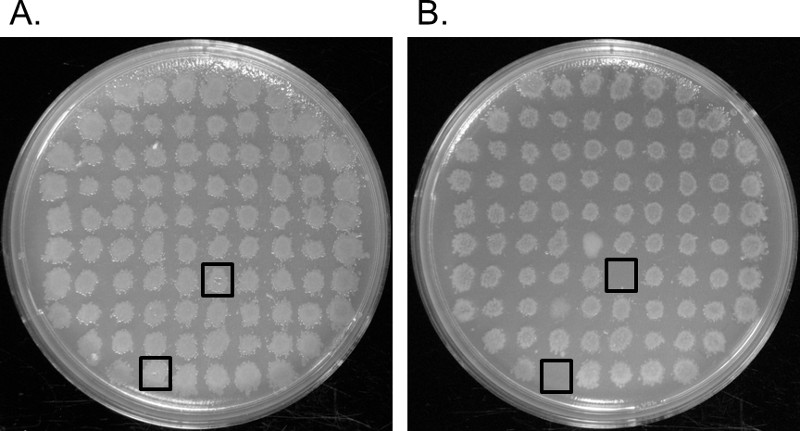
איור 2. Replica ציפוי. (א) רשת של transformants שהועברו לצלחת אגר LB-קאן. (ב) רשת של אותו transformants שהועברו לצלחת בינונית M-9. Auxotrophs גדל על צלחות LB-קאן, אבל לא על M-9 צלחות בינוניות. אלה מזוהים על ידי הריבועים השחורים. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
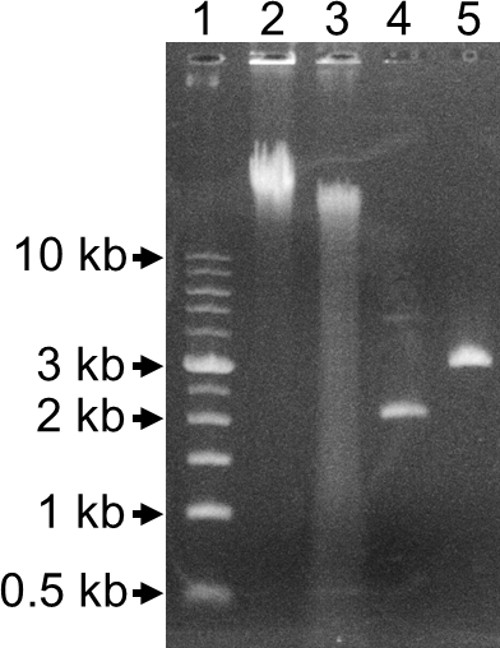
איור 3. 0.8% Agarose ג'ל ליין 1:. סולם kb 1. מסלול 2: הדנ"א הגנומי לא מעוכל. ליין 3: Bfu C אני באופן חלקי מתעכל הדנ"א הגנומי. מסלול 4: plasm הציל לא מעוכלid. מסלול 5: פלסמיד Xho אני מתעכל הצלתי.

איור 4. רצף ה- DNA חלקי של פלסמיד. הרצף מודגש הוא חלק מtransposon ולא הוגש לניתוח פיצוץ. שאר הרצף הוא קטע של גנים חולצו מהמארח.

איור 5. תפציץ ניתוח 7,8. החל מהבסיס הראשון (שאילתה), את הגן שהופסק מופיע לקודד מוטאז chorismate cloacae Enterobacter, העוסק בסינתזת פנילאלנין וטירוזין.
Discussion
mutagenesis transposon באמצעות transposome הוא כלי יעיל ליצירת auxotrophs בsp Enterobacter. חיידקים חיוביים YSU וסוגים אחרים של שלילי גרם וגרם 3,4. התהליך נעשה ביוזמת החדרת Tn 5 transposome -derived למארח על ידי electroporation. לזהות מושבות עם מוסיף, מתח יעד untransformed היה צריך להיות רגיש לkanamycin כדי לבחור עבור סמן ההתנגדות המבוצע על ידי transposon. מארחים מסוימים לייצר endonucleases הגבלה שלבזות את ה- DNA transposon לפני שהיא יכולה להשתלב מחדש עם גנום המארח. תוספת של מעכב endonuclease הגבלה לתערובת electroporation עשויה למזער השפלה ולהגדיל את תשואת שינוי 3. בעת הכנת חיידקים המוסמכים electroporation, היה חשוב להסיר כמה מלח ככל האפשר כדי למנוע קשת חשמלית או ניצוץ שהורג את החיידקים שנגרמו על ידי הנוכחות של מלח. גם בהיעדרו שלקשת חשמלית, התאים החלו למות במהירות לאחר שהכה אותם. הוספת מלח המכיל מדיום גידול SOC שוחזרה באופן מיידי על האיזון האוסמוטי, המוות של תאים ממוזערים ויעילות שינוי מוגבר 5. transformants עמידה Kanamycin אז הבחינה לצלחת טרי LB-קאן והעתק מצופה על ל- M-9 אגר בינוני מינימאלי. כדי למנוע יתר חיסון שיכול לגרום לתוצאות חיוביות כוזבות שמתגעגעות auxotrophs האפשרי, ריבועי קטיפה הוחלפו בשלב 3.6 לפני שאר הצלחות היו מחוסן. ואז, במהלך ציפוי העתק, רק לחץ מספיק יושם להעביר את המושבות מבלי לגרום למריחות או זיהום בין מושבות סמוכות.
גנים שעברו מוטציה בauxotrophs זוהו באמצעות הצלת גן. הדנ"א הגנומי מכל auxotroph היה טעון באמצעות עיכול חלקי עם תכוף-הבסיס חותך digestions החלקי I. Bfu C באמצעות BFA אני או Hae III, אשר חתך את TRansposon בתדירות נמוכה יותר, עשוי לשפר את יעילות שינוי transposon. אפשר גם להשתמש בעיכול להשלים עם endonucleases אחר הגבלה, חותכי 6-בסיס ו8-בסיס, שבו חוסר אתרים בtransposon. DNA מתעכל אז ligated והפך לE. coli PIR ECD100D מתח או ECD100D pir116 6. למרות E. מתח pir116 coli הפך על ידי electroporation בשלב 4.8, אפשר גם להשתמש בתאים כימיים המוסמכים. במקרה זה, כל השינוי צריך להתפשט כדי לקבל מבחר גדול של פלסמידים הצילו. גן PIR מאפשר לtransposon circularized לשכפל כפלסמיד מספר נמוך עותק, ואת הגן שעבר מוטציה pir116 מאפשר לו לשכפל כעותק פלסמיד גבוה. תשואות נמוכות שינוי באמצעות מתח pir116 יכולות להיות בגלל הביטוי של מוצרי גנים רעילים מהמארח המקורי. רעילות עשויות להיות מופחתות על ידי שימוש בעותק הנמוך מתח PIR. עם זאת, תשואת פלסמיד נמוכה מלחץ PIR יכול לעשות רצף מאתגר יותר.
רצף הגנומי 10 ורצף PCR 14 שיטות חלופיות להצלת גן. שיטת סידור הגנומי רצפי אזורי כרומוזומים האיגוף ישירות מהדנ"א הגנומי מטוהר. אסטרטגיה זו שימושית כאשר הגנום של האורגניזם היעד כבר רצף. ברגע שהאזור שעבר מוטציה זוהה על ידי רצף ואפציץ הגנומי, האזור כולו יכול להיות מוגבר על ידי PCR ושבט לניתוח נוסף. שיטת PCR משתמשת בשתי תגובות PCR וארבעה צבעים יסוד שונים. זוגות התגובה הראשונים של פריימר transposon הומולוגי (פריימר 1) עם פריימר מנוון המכיל DNA קצר, רצף מקשר (פריימר 2). תגובת PCR השנייה היא תגובה מקוננת PCR, זיווג אחר פריימר הומולוגי transposon (פריימר 3) עם פריימר הומולוגי רצף מקשר (פריימר 4). האתר תחול לפריימר 3 הואממוקם בצד השני '3 של האתר תחול על פריימר 1. אז, amplicand מתגובת PCR השנייה הוא ניקה ורצף. שיטת סידור אוטומטי זה מגבירה DNA ישירות מהתאים שעברו מוטציה, ומבטל את הצורך בשתי הצלת טיהור DNA והפלסמיד הגנומי.
במקום זיהוי גני המעורבים בauxotrophy, mutagenesis transposon יכול לשמש גם כדי ללמוד פנוטיפים assayed בקלות אחרים. Sp Enterobacter. YSU הוא זן חיידקים עמיד רב-מתכת שהוא גם 100 מק"ג / אמפיצילין עמיד מיליליטר (נתונים שלא פורסמו). ריכוזו של המינימלי המעכב (MIC) לHgCl 2 הוא 70 מיקרומטר, ZnCl 2 הוא 800 מיקרומטר, אגנו 3 הוא 80 מיקרומטר וNaAsO 2 הוא 14 9 מ"מ. לאחר שהציג transposome לזן זה וgridding transformants על צלחות LB-קאן, מושבות gridded ניתן העתק מצופים על מתכות בינוניות המכיל בריכוזים נמוכים MIC של bacte זהזן ריאל. הצלה ורצף של גן שהופסק ממוטציה עם MIC הוריד עשויה לחשוף גן שמקנה עמידות לאחת מהמתכות אלה.
בנוסף למוטציות יצירה, transposome יכול לשמש כוקטור במבחנה או in vivo לזהות רווח של גני פונקציה, כגון עמידות לאנטיביוטיקה או מתכת. לאסטרטגיה במבחנה, הדנ"א הגנומי מsp Enterobacter. YSU מתעכל עם endonuclease הגבלה שמכיר אתרים מחוץ לtransposon. ה- DNA ligated ומעורבב עם transposome במאגר המכיל Mg 2 +. לאחר רקומבינציה בין transposon ושברים הגנומי אקראיים, E. PIR ECD100D זן coli הופך עם DNA ולהתפשט על צלחות המכילות אמפיצילין או מלח מתכת. מושבות שתגדלנה יהיו בעלי פלסמיד חדש המכיל את transposon ממוקם בסמוך לגן ההתנגדות של המארח. לin vivo strategy, sp Enterobacter. YSU הופך עם transposome. ואז, כל תגובת השינוי הוא גדלה במדיום נוזלי LB-קאן כדי לבחור עבור אוכלוסייה גדולה עם מוסיף transposon אקראי. הדנ"א הגנומי מתעכל עם endonuclease הגבלה שמכיר אתרים שמחוץ לtransposome, ligated והפך לE. PIR ECD100D זן coli. כמו בשיטה במבחנה, transformants פרושות על צלחות אמפיצילין או מתכת. שוב, פלסמיד וכתוצאה מכך יהיה מורכב מtransposon הוכנס ליד גן התנגדות. שתי אסטרטגיות אלה יהיו מוצלחות רק אם ניתן לבטא את גן התנגדות היעד ופעיל בE. זן coli.
mutagenesis transposon יכול לשמש כדי לזהות את המספר המינימלי של גני זן חיידקים דורש עבור 15,16 צמיחה. שתי transposomes המכיל אתרי loxP וסמני עמידות לאנטיביוטיקה שונים הנדרשים לאסטרטגיה זו אניזן חיידקי na עם רצף הגנום ידוע. לאחר שני transposons לשלב, recombinase cre הביע מזרז תגובת רקומבינציה בין שני אתרי loxP, ביטול אזורי כרומוזומים בין הוספות transposon. ידע של רצף הגנום מאפשר לזהות אילו גנים בוטלו. היכולת לגדול מוכיחה כי הגנים שנכחד אינם נדרשים לצמיחה. טכניקה זו היא עבודה אינטנסיבית, והגנום מינימאלי לצמיחה באמצעות אסטרטגיה זו טרם הושלם. עם זאת, מחקר mutagenesis transposon אוטומטי של aeruginosa Pseudomonas באמצעות רצף PCR ההערכה היא כי 300-400 גנים הנדרשים לצמיחה של חיידק זה ב -14 בינוניים עשירים. מחקר זה לא להשתמש במערכת recombinase loxP / cre.
חיידקים עם הגנום מינימאלי שימושיים לביולוגיה סינתטית 17. זן חיידקים בהשקעה מינימאלי של גנום הוא especially שימושי לחיסול הייצור של תוצרי לוואי לא רצויים. לדוגמא, acetobutylicum Clostridium (acetobutylicum ג) משמש לייצור הדלק הביולוגי, butanol 18. במהלך הצמיחה שלה, זן זה מייצר butanol בסוף שלב הצמיחה המעריכית שלה רק לפני שהוא נכנס שלב נייח. בשלב זה, הוא הופך להיות רגיש למוצרי תסיסה אחרים butanol ויוצר endospores הרדום שהפסקה למוצר לסנתז. מאז transposomes היה בשימוש ללמוד perfringens Clostridium 3, ייתכן שניתן להשתמש במערכת recombinase transposome / loxP / cre דומה לבניית מתח של acetobutylicum ג שחסר את הגנים למוצרי תסיסה לא רצויים ונִבִיגָה, אך כולל גנים לגדולים יותר סובלנות butanol. זן זה יגדיל את תשואת המוצר עם מזהמים מינימאליים.
לסיכום, מאמר זה יומן וידאו מספק STE מלאp אחר צעד התיאור של הנהלים המשמשים ליצירת auxotrophs ידי mutagenesis transposon. זה מכסה מציג transposome ידי electroporation, בדיקות סקר לאיתור מוטציות בציפוי העתק, הצלת גנים שעברו מוטציה על ידי שיבוט טכניקות וזיהוי של גנים שהופסקו על ידי רצפי DNA. טכניקה זו יכולה לשמש לזיהוי הפעילות של גנים של לא ידועים או לבנייה אולי זן חיידקים שיכולים לשמש בתהליך תעשייתי.
Disclosures
המחבר יש מה למסור.
Acknowledgements
המחבר מבקש להודות לכל סטודנט לתואר ראשון שלי עצמאי תלמידי מחקר ואת כל הסטודנטים לתואר השני מיקרוביאלית הפיסיולוגיה שלי שנבדקו רעיונות mutagenesis transposon במהלך הסמסטרים אביב 2010-2014. עבודה זו מומנה על ידי המחלקה למדעי ביולוגיה באוניברסיטת מדינת יאנגסטאון.
Materials
| Name | Company | Catalog Number | Comments |
| EZ-Tn5 R6Kγori/KAN-2 Tnp Transposome Kit | Epicentre (Illumina) | TSM08KR | |
| EC100D pir+ Electrocompetent E. coli | Epicentre (Illumina) | ECP09500 | Capable of replicating plasmids with an R6Kγ replication origin at a low copy number |
| EC100D pir-116 Electrocompetent E. coli | Epicentre (Illumina) | EC6P095H | Capable of replicating plasmids with an R6Kγ replication origin at a high copy number |
| 5X M-9 Salts | Thermo Fisher | DF048517 | |
| Lennox LB Broth | Thermo Fisher | BP1427-2 | |
| Agar | Amresco, Inc. | J637-1KG | Solid media contained 1.6% (w/v) agar |
| Kanamycin Sulfate | Amresco, Inc. | 0408-25G | When required, media contained 50 μg/ml kanamycin sulfate |
| D-Glucose Monohydrate | Amresco, Inc. | 0643-1KG | |
| Yeast Extract | Amresco, Inc. | J850-500G | |
| Tryptone | Amresco, Inc. | J859-500G | |
| KCl | Sigma-Aldrich | P4504-500G | |
| NaCl | Amresco, Inc. | X190-1KG | |
| MgCl2 | Fisher Scientific | BP214-500 | |
| MgSO2 | Fisher Scientific | BP213-1 | |
| Super Optimal Broth with Catabolite Repression (SOC) medium | 0.5% (w/v) yeast extract, 2% (w/v) tryptone, 10 mM NaCl, 2.5 mM KCl, 10 mM MgCl2, 20 mM MgSO4 and 20 mM Glucose | ||
| BfuC I | NEB | R0636S | Partial digestion of genomic DNA |
| Xho I | NEB | R0146S | Plasmid digestion |
| T4 DNA Ligase | NEB | M0202S | |
| Nuclease Free Water | Amresco, Inc. | E476-1L | For dissolving precipitated DNA and restriction endonuclease reactions |
| GenomeLab DTCS - Quick Start Kit | Beckman Coulter | 608120 | DNA sequencing |
| Wizard Genomic DNA Purification Kit | Promega | A1120A | |
| Wizard Plus SV Minipreps DNA Purification System | Promega | A1460 | Plasmid purification |
| Replica Plating Block | Thermo Fisher | 09-718-1 | |
| Velveteen Squares | Thermo Fisher | 09-718-2 | Replica plating |
| PetriStickers | Diversified Biotech | PSTK-1100 | Grid for replica plating |
| Petri Dishes | Thermo Fisher | FB0875712 | |
| Gene Pulser II | BioRad | Electroporation | |
| Electroporation Cuvettes – 2 mm | BioExpress | E-5010-2 | |
| CentriVap DNA Vacuum Concentrator | Labconco | 7970010 | Drying DNA |
| CEQ 2000XL DNA Analysis System | Beckman Coulter | DNA sequencing | |
| Vector NTI Advance 11.5.0 | Life Technologies | 12605099 | DNA sequence analysis |
References
- Kim, B. H., Gadd, G. M. . Bacterial physiology and metabolism. , (2008).
- Hayes, F. Transposon-based strategies for microbial functional genomics and proteomics. Annual review of genetics. 37, 3-29 (2003).
- Hoffman, L. M. Random chromosomal gene disruption in vivo using transposomes. Methods in molecular biology. 765, 55-70 (2011).
- Goryshin, I. Y., Jendrisak, J., Hoffman, L. M., Meis, R., Reznikoff, W. S. Insertional transposon mutagenesis by electroporation of released Tn5 transposition complexes. Nature biotechnology. 18 (1), 97-100 (2000).
- Dower, W. J., Miller, J. F., Ragsdale, C. W. High Efficiency Transformation of E. coli by High Voltage Electroporation. Nucleic Acids Research. 16 (13), 6127-6145 (1988).
- Metcalf, W. W., Jiang, W., Wanner, B. L. Use of the rep technique for allele replacement to construct new Escherichia coli hosts for maintenance of R6Kγ origin plasmids at different copy numbers. Gene. 138 (1-2), 1-7 (1994).
- Morgulis, A., Coulouris, G., Raytselis, Y., Madden, T. L., Agarwala, R., Schäffer, A. a Database indexing for production MegaBLAST searches. Bioinformatics. 24 (16), 1757-1764 (2008).
- Zhang, Z., Schwartz, S., Wagner, L., Miller, W. A greedy algorithm for aligning DNA sequences. Journal of computational biology a journal of computational molecular cell biology. 7 (1-2), 203-214 (2000).
- Holmes, A., Vinayak, A., et al. Comparison of two multimetal resistant bacterial strains: Enterobacter sp. YSU and Stenotrophomonas maltophilia OR02. Current microbiology. 59 (5), 526-531 (2009).
- Hoffman, L. M., Jendrisak, J. J., Meis, R. J., Goryshin, I. Y., Reznikoff, W. S. Transposome insertional mutagenesis and direct sequencing of microbial genomes. Genetica. 108 (1), 19-24 (2000).
- Ausubel, F., Brent, R., et al. . Short Protocols in Molecular Biology. , (1997).
- Miller, J. H. . A short course in bacterial genetics: a laboratory manual and handbook for Escherichia coli and related bacteria. 2, (1992).
- Gibson, M. I., Gibson, F. Preliminary studies on the isolation and metabolism of an intermediate in aromatic biosynthesis: chorismic acid. The Biochemical journal. 90 (2), 248-256 (1964).
- Jacobs, M. A., Alwood, A., et al. Comprehensive transposon mutant library of Pseudomonas aeruginosa. Proceedings of the National Academy of Sciences of the United States of America. 100 (24), (2003).
- Reznikoff, W., Winterberg, K. Transposon-Based Strategies for the Identification of Essential Bacterial Genes. Microbial Gene Essentiality: Protocols and Bioinformatics SE. 2, 13-26 (2008).
- Suzuki, N., Inui, M., Yukawa, H. Random genome deletion methods applicable to prokaryotes. Applied Microbiology and Biotechnology. 79 (4), 519-526 (2008).
- Malley, M. A., Powell, A., Davies, J. F., Calvert, J. Knowledge-making distinctions in synthetic biology. BioEssays news and reviews in molecular, cellular and developmental biology. 30 (1), 57-65 (2008).
- Zheng, Y. -. N., Li, L. -. Z., et al. Problems with the microbial production of butanol. Journal of industrial microbiolog., & biotechnology. 36 (9), 1127-1138 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved