Method Article
Infusi carotide di farmacocinetica e di farmacodinamica Analisi dei taxani nei topi
In questo articolo
Riepilogo
Questo metodo è stato sviluppato con l'obiettivo di fornire una soluzione di droga costante attraverso l'arteria carotide, per valutare la farmacocinetica di nuovi farmaci in modelli murini.
Abstract
Nel proporre l'uso di un farmaco, combinazione di farmaci, o la somministrazione di farmaci in un nuovo sistema, si deve valutare la farmacocinetica del farmaco nel modello di studio. Poiché l'utilizzo di modelli murini sono spesso un passo fondamentale nella scoperta della droga preclinica e lo sviluppo di farmaci 1-8, è necessario progettare un sistema per introdurre la droga in topi in modo uniforme e riproducibile. Idealmente, il sistema dovrebbe consentire la raccolta di campioni di sangue a intervalli regolari per un corso di tempo impostato. La capacità di misurare concentrazioni di farmaco di spettrometria di massa, ha permesso agli investigatori di seguire le variazioni dei livelli plasmatici nel tempo nei topi individuale 1, 9, 10. In questo studio, paclitaxel è stata introdotta in topi transgenici in infusione arteriosa continua oltre tre ore, mentre i campioni di sangue sono stati prelevati simultaneamente da emorragie retro-orbitale in momenti insieme. Infusioni carotide sono una potenziale alternativa per infusioni vena giugulare, quando fattori cometumori mammari o altri ostacoli fanno infusi giugulari impraticabile. Usando questa tecnica, le concentrazioni di paclitaxel nel plasma e nel tessuto raggiunti livelli simili rispetto all'infusione giugulare. In questo tutorial, mostreremo come cateterizzare con successo l'arteria carotidea preparando un catetere ottimizzato per il singolo modello del mouse, quindi mostrare come inserire e fissare il catetere nell'arteria carotide del mouse, infilare l'estremità del catetere attraverso la parte posteriore del collo del mouse e collegare il mouse ad una pompa per fornire una velocità controllata di afflusso di droga. Sanguinamenti retro-orbitale a basso volume multipli consentono per l'analisi delle concentrazioni plasmatiche del farmaco nel tempo.
Introduzione
Infusione del farmaco attraverso la carotide può essere eseguito in modo affidabile e riproducibile ottimizzando attrezzature e tecniche. La procedura non è complicata, anche se richiede un controllo preciso e attenzione al dettaglio. Cura Superior e destrezza sono necessari per isolare l'arteria carotide e inserire il catetere, che può generalmente essere acquisita attraverso la pratica. La chirurgia da parte di un tecnico esperto non deve superare un'ora. Dopo l'intervento chirurgico di successo, il mouse dovrebbe apparire normale e sano (anche se il mouse può reagire con l'infusione effettivo droga), e di droga (s) può essere somministrato in una dose uniforme continua controllato. I campioni di sangue devono essere prelevati da un sito diverso da quello carotide; sanguinamenti retro-orbitale dimostrato facile da raccogliere e soddisfacente per l'analisi delle concentrazioni di droga.
Cateteri di dimensioni e la forma ottimale sono un bene prezioso per l'esecuzione di una infusione di successo 11. Abbiamo trovato il cateteri disponibili commercially spesso di essere troppo grandi e / o troppo flessibile per consentire un comodo accesso all'arteria carotide del mouse. Si è rivelato preferibile cateteri di moda dal tubo di polietilene utilizzato per collegare il mouse alla siringa di infusione. In questo modo, tutti i tubi, i connettori e gli aghi erano di dimensioni consistenti, che ha semplificato gruppo di infusione. Usando questa tecnica, non è necessario spingere la punta del catetere nell'arteria oltre il punto in cui è ancora visibile, e il flusso di sangue al carotide non viene ripristinato fino a dopo il catetere viene inizialmente fissato. Questo riduce i rischi di puntura dell'arteria o di avere il catetere spinto fuori dalla pressione del flusso sanguigno. Il design del catetere nel presente documento non incorpora un "bump" per tenerlo in posizione, in modo che fissano il catetere bene con punti di sutura e nastro adesivo chirurgico è una priorità.
Infusi può essere preferibile per le iniezioni comuni iv bolo, come una migliore mimica di gestione clinica difarmaci come taxani 3, 12, 13. La tecnica qui descritta è stata sviluppata in origine per consentire infusione in modelli murini in cui l'accesso alla vena giugulare o femorale è stata esclusa dalla crescita del tumore mammario e / o eccessiva vascolarizzazione della zona di inserimento. Questo metodo può spesso essere appropriato anche in topi privi di tumore: anche se isolando e CATETERISMO la carotide è un po 'più invasivo, abbiamo trovato preferibile alla giugulare, perché la propensione del muro giugulare per strappare portato a inserimenti più non riusciti e fallimenti per completare il periodo di tempo 3 ore.
Mentre i risultati qui riportati sono da C57BL / 6J (in-house di razza) topi, abbiamo utilizzato questa tecnica per infondere con successo paclitaxel in diversi ceppi di topi, tra cui FVB e misti-ceppi, a seguire la farmacocinetica in modelli murini transgenically manipolati di down-regolare le funzioni cellulari trasportatore. I campioni di sangue e di tessuto raccolti hanno mostrato livelli attesi di paclitaxel, nella gamma dei livelli osservati dopo infusioni giugulari 1. Questa tecnica può essere previsto per funzionare altrettanto bene in altri modelli di topo e con altre soluzioni per infusione.
Protocollo
Questo protocollo è stato approvato dal Cancer Center Institutional Animal Care and Use Committee Fox Chase e dal Fondo animali da laboratorio, ed è risultato essere in accordo con le linee guida istituzionali per il trattamento umano degli animali.
1. Preparazione preliminare
- Preparazione del catetere: Preparare un catetere da un breve tratto di tubo in polietilene, modificato per formare un assottigliata, estremità smussata (Figura 3A). Rendere più cateteri in anticipo e risparmiare tempo indeterminato.
- Accendi un becco Bunsen, e regolare di stabilire una fiamma bassa costante. Tenere tubi vicino alla fiamma per ammorbidire polietilene. Quando il tubo inizia a sciogliersi, lentamente separare le due estremità per creare una sezione assottigliata di tubo, circa 0,25 mm di diametro esterno.
- Tagliare un estremità smussata circa 0,75 cm lungo sezione sottile. Questo assicura tubo sufficiente per essere fissato in arteria, senza creare un catetere eccessivamente lunga.
NOTA: A fine sottile lungo su The il catetere ha una propensione a intasare. Un eccessivamente lungo termine può anche detenere abbastanza liquido per cambiare in modo significativo la capacità di volume del liquido del catetere. - Smussare l'estremità smussata passando rapidamente attraverso la fiamma - se correttamente riscaldato, alla fine diventa un po 'arrotondata e allargata. I ganci punta leggermente indietro, che aiuta ancorare il tubo durante l'inserimento nell'arteria.
- Tagliare il tubo 6,0 centimetri dal punto in cui inizia a sottile. Questo rende un catetere molto maneggevole, che è abbastanza a lungo per il filo attraverso per uscire dal collo e di tenere e lavorare con comodo, ma abbastanza breve per impedire che il mouse da rosicchiare tubo in eccesso o che richiedono troppo volume di infusione in più per cancellare salina iniziale .
- Preparare una siringa di circa 0,2 ml di soluzione di eparina, sormontato da un ago smussato. Inserire l'ago nella estremità larga del catetere (Figura 3B). Riempire il catetere con eparina, facendo attenzione al fine di garantire che non vi siano bolle inil tubo. Impostare la siringa eparina e il catetere parte su una zona sterile. Sterilizzare cateteri con raggi gamma, ponendo catetere (s) in una capsula di Petri, ed esponendo a 20 Gy di raggi gamma. Se non si ha accesso a una fonte di radiazioni gamma, controllare con il vostro impianto di animali per indagare altri mezzi di sterilizzazione, come ad esempio a gas o chimico-sterilizzazione. Non sterilizzare in autoclave, il polietilene non può essere sterilizzato a caldo.
- Creazione di un cavo salina (Figura 3B).
- Preparare una seconda siringa di circa 0,5 ml di soluzione fisiologica sterile, facendo attenzione al fine di garantire una linea priva di bolle.
- Tagliare un secondo pezzo di tubo, di circa 15 cm e scivolare sulla siringa smussata. Attaccare una porta del connettore all'estremità libera del tubo.
- Verificare che il flusso di soluzione salina è libera da intoppi avanzare un piccolo volume di soluzione salina attraverso il cavo. Utilizzare questo cavo salina dopo l'inserimento del catetere, per controllare il flusso attraversoil catetere, e lavare la linea di sangue. Impostare la siringa salina parte su una zona sterile.
- Prima di un intervento chirurgico, sterilizzare attrezzature in autoclave, o in alternativa alla sterilizzazione a gas o perle di vetro di sterilizzazione.
- Preparare area chirurgica sterile.
- Pulire le superfici da banco e microscopio con un disinfettante come ad esempio il 70% di etanolo o biossido di cloro. Coprire panchina e base del microscopio con una usa e getta, tampone assorbente pulita.
- Preparare una scheda chirurgico coprendo con due strati di pulito, carta assorbente, collegati in modo sicuro con nastro adesivo.
- Disporre tutte le forniture chirurgiche (come catalogato in Materials List) in modo che siano facilmente accessibili.
- Tagliare tre lunghezze di sutura sterile, a 8 cm ciascuno, e mettere da parte con altre forniture. Inserire un porto dove sarà facilmente disponibile (Figura 3B).
2. Chirurgia
- Preparazione dell'animale
- AnesthMouse etize dall'esposizione al 2-3% isoflurano nella camera anestesia collegata alla precisione vaporizzatore. Estrarre il mouse dalla camera, e radersi i capelli dal collo / parte superiore del busto del topo, e sotto l'orecchio destro (sito di uscita del catetere). Somministrare veterinaria vaselina pomata oftalmica per gli occhi per prevenire la secchezza mentre sotto anestesia. Assicurarsi che l'animale non svegliare durante preparazioni chirurgiche consentendo topo tempo sufficiente nella camera di inalazione prima prep (almeno due minuti), o somministrando isoflurano al topo mediante un cono di naso durante prep. Ritorna mouse per camera di anestesia.
- Quando il mouse è sufficientemente inerte, spostarsi in area chirurgica sterile, collocare cono anestesia sopra il naso e la bocca del topo, e deviare il flusso di isoflurano a cono. Verificare che l'anestesia pizzicando zampa con una pinza; quando il mouse non reagisce, procedere al passaggio successivo.
- Posizionare il mouse sul dorso, con la testa rivolta verso ilinvestigatore. Fissare le orecchie, le zampe anteriori e posteriori, zampe a bordo chirurgico con nastro adesivo o altro apparecchio di contenzione per mantenere costante il mouse. Pulire l'area di incisione con povidone-iodio e il 70% di etanolo.
- Isolamento di carotide
- Fai da 1 cm longitudinale tagliato leggermente a destra della linea mediana del collo. Usare pinze per separare grasso e muscolo per esporre la trachea (Figura 4A). Individuare la carotide che corre parallela alla trachea (Figura 4B).
- Usare con cautela pinze a fascia separato sovrastante l'arteria (Figura 4C). Leggermente tirare il nervo vago parte la carotide e inserire pinze nello spazio tra. Pinza delicatamente aperte per creare un vuoto nella fascia, e tirare accuratamente lontano nervo dalla arteria, dalla forcella nell'arteria vicino alla laringe (estremità anteriore), alto (posteriore) per quanto possibile (almeno 3 mm) ( Figura 4D).
- Sgombrare il campo da qualsiasi rerimanente fascia fino a quando l'arteria è ben isolato (Figura 4E). Aggiungere una goccia di soluzione salina all'area chirurgico occasionalmente per mantenere il tessuto umido, e quindi meno fragile e meno soggetto a strappi casuale.
- Sutura e preparazione arteria per l'inserimento del catetere (figure 4, 5).
- Usare pinze per disegnare un filo di sutura di seta sotto l'arteria. Legare un nodo sicuro per chiudere l'arteria fino verso la parte anteriore il più possibile (Figura 4F).
- Disegnare un secondo filo sotto l'arteria. Fare un nodo a scomparsa per chiudere temporaneamente l'arteria fino verso la parte posteriore il più possibile (Figura 4F).
- Disegnare un terzo filo sotto l'arteria. Un nodo molto sciolto tra i primi due punti di sutura, da utilizzare per fissare rapidamente il catetere dopo l'inserimento (Figura 4G).
- Tenere le estremità di tutte le suture fuori del modo bagnandoli con un po 'di etanolo al 70%.
- inserimento del catetere
- Con la sutura, afferrare il nodo in basso per tirare l'arteria leggermente teso. Nick l'arteria sopra, ma molto vicino, la sutura anteriore (Figura 4H). Fare attenzione a non tagliare troppo in profondità, ma controllare la fessura per assicurarsi che l'apertura è ostruita.
- Rimuovere il catetere eparina-riempita dall'ago della siringa, cercando di evitare di creare ampie sacche di aria alle due estremità. Manipolare il catetere per posizionare smussatura in un angolo comodo, generalmente verso il basso, e leggermente a destra (per giocatori destri).
- Tenendo al sutura per mantenere l'arteria restante leggermente teso, inserire delicatamente il catetere nella fessura (Figura 4I). Utilizzare le pinze per tenere la sutura anteriore e tirare l'arteria giù sopra catetere (spingendo eccessivamente con il catetere può causare l'estremità smussata per forare l'arteria). Staccare con cautela il catetere e anteriore sutura.
- Protezione di catetere e l'inizio del flusso sanguigno (Figure 4J, 5B).
- Fissare il catetere stringendo il nodo della sutura centrale, vicino all'ingresso del catetere nell'arteria. Fare un nodo triplo stretto, ma essere sicuri di non tirare così stretto da ostruire il flusso attraverso il catetere. Ulteriori fissare il catetere legando il basso con la sutura anteriore, sotto l'entrata all'arteria.
- Attaccare il cavo salina al catetere attraverso il connettore, sempre cercando di evitare l'introduzione di bolle d'aria nella linea.
- Afferrare le estremità della sutura posteriore e tirare delicatamente per rilasciare il nodo. Manovra la sutura giù l'arteria, sull'estremità del catetere (non rimuovere il filo). Il sangue deve scorrere nel catetere; se non c'è flusso di sangue, muovere delicatamente il catetere per tentare di rimuovere la costrizione.
- Quando il flusso appare ostruito, utilizzare l'ultimo filo (dalla sutura posteriore) per legare un nodo in più, un po 'al di sopra della sutura centrale.
- Tesigillatura mporary di catetere. Lavare il catetere di sangue, quindi utilizzare un emostatico per bloccare l'estremità del catetere vicino al connettore. Rimuovere il connettore e sostituirlo con il tappo per sigillare l'estremità del catetere, e rimuovere la pinza emostatica.
- Riposizionare il catetere per uscire dal retro del collo.
- Con pinze in ogni mano, utilizzare una coppia di pinze a mantenere il catetere appena sotto la sutura anteriore, e con l'altra, premere un nodo nel catetere quindi sarà facilmente piegare a lato. Ripetere la procedura per creare un secondo nodo. Questo permette l'estremità libera del catetere di essere tirato verso il retro della testa del topo, senza forzare la punta del catetere per girare lateralmente contro la parete dell'arteria.
- Capovolgere il mouse sulla sua (a sinistra) lato, mantenendo il cono posizionato sopra la bocca e il naso, e pulire l'area di incisione con il 70% di etanolo e povidone-iodio. Effettuare una piccola incisione (circa 4 mm) al di sotto e dietro l'orecchio destro.
- Usare pinze per tenere il lembo aperto di pelle, mentre lavora la sonda cava smussato sotto la pelle per creare un canale attraverso la guancia, alla cavità al collo. Si consiglia di portare la sonda intorno alla ghiandola salivare, invece di cercare di passare fra la boccola e la pelle. Usare pinze per liberare con cura uno spazio per la sonda per uscire.
- Infilare la spina della porta / catetere attraverso la sonda per uscire in collo. Non tirare troppo forte; essere sicuri che il catetere non schiaccia o costrizione dei vasi sanguigni o organi.
- Chiusura e recupero. Somministrare analgesico topico (ad esempio bupivacaina) per l'incisione spalla, e coprire la ferita con acqua-prova, nastro adesivo chirurgico. Applicare un secondo pezzo di nastro adesivo per fissare ulteriormente il catetere.
- Somministrare analgesico topico per l'incisione del torace, e chiudere ferita con seta o punti metallici.
- Rimuovere mouse da anestesia, e consentire all'animale di riprendersi in un ambiente pulito, riscaldato spazio (luogo gabbia in cima ad una piastra elettricao sotto una lampada di calore), per almeno 30 min.
3. Infusione
- Preparare aliquote di 5 mg / ml soluzione di paclitaxel / metanolo.
- Misura 50 mg di paclitaxel in una provetta da centrifuga da 15 ml. Aggiungere 10 ml di metanolo sterile. Tappare la provetta. Ruotare a mano o su un agitatore rotante a temperatura ambiente fino dissoluzione della polvere.
- Aliquota 500 ml di soluzione in 20 piccolo, congelatore tubi di sicurezza, e conservare a -20 ° C.
- Scongelare un'aliquota individuale a temperatura ambiente o 37 ° C bagnomaria, immediatamente prima dell'infusione.
- Preparare la pompa di infusione (Figura 6).
- Tagliare un lungo tratto di tubo di polietilene di circa 40 cm. Attaccare un ago smussato ad una estremità, ed una porta del connettore all'altra.
- Elaborare farmaco in una siringa con una nota interna di diametro (la maggior parte delle pompe programmabili richiederanno il diametro del corpo della siringa, per calcolare la velocità di the il braccio della pompa). Applicare l'ago alla siringa e caricare la droga attraverso l'ago e il tubo.
- Collocare la siringa nella pompa secondo le istruzioni del produttore. Primo la pompa in modo che il farmaco fluisce uniformemente la spina del connettore, ed è pronta per infusione.
- Collegare il mouse alla pompa.
- Tenere il mouse costante e usare la pinza emostatica per bloccare il catetere, vicino al tappo. Rimuovere il tappo e sostituire con il connettore attaccato alla siringa e il tubo.
NOTA: Il sangue può cominciare a scorrere indietro attraverso il tubo. - Somministrare rapidamente una pompa veloce per cancellare il volume del catetere (calcolato empiricamente osservando il volume di 6 cm di tubo), quindi passare immediatamente alla velocità di infusione desiderata.
- Tenere il mouse costante e usare la pinza emostatica per bloccare il catetere, vicino al tappo. Rimuovere il tappo e sostituire con il connettore attaccato alla siringa e il tubo.
- Continuare Paclitaxel infusione per il corso di tre ora.
- Monitorare tubi di tanto in tanto per controllare eventuali perdite in corrispondenza dei nodi come questo è spesso un segno di un blocco nel flusso al mouse.Guarda il mouse per reazioni attese o inattese per infusione (letargia o iperattività, segni di disagio).
- A seconda della durata e della natura del l'infusione, il mouse potrebbe non mangiare o bere, ma essere sicuri di fornire l'accesso al cibo e all'acqua in base alla politica stabilita dell'istituzione. Essere consapevoli del potenziale per disidratare il topo attraverso la raccolta di grandi quantità di sangue.
- Continuare a mantenere il caldo gabbia con una piastra elettrica o una lampada, a meno che il mouse sembra desiderare di stare lontano dal calore. Se l'animale non è eutanasia all'interno di diverse ore dopo l'intervento chirurgico, attuare il piano per il trattamento post-chirurgico di animali, tra cui le condizioni abitative sterili e di trattamento per il dolore post-operatorio.
- Mantenere una stretta vigilanza sul mouse, soprattutto nel primo pochi minuti, per assicurarsi che non tira fuori il tubo attraverso iperattività, o irritazione provocati dal tubo (che può essere un segno di un povero di inserimento). Se il mouse non è più attivo, monito costanteanello può non essere necessario, ma controllare il mouse regolarmente per essere sicuri che l'animale non venga aggrovigliato nel tubo. Imbracatura e sistema di cavezza sono disponibili in commercio, ma il loro uso è oltre lo scopo di questo protocollo.
- Prelievo di campioni.
- Raccogliere campioni di sangue a intervalli regolari da parte di sanguinamenti sottomandibolari o retro-orbitale (Se il protocollo non fa uso di modelli tumorali mammarie, prendere in considerazione la raccolta di sangue attraverso un catetere giugulare inserito nello stesso momento in cui il catetere carotideo). Fare attenzione a non tirare la linea di infusione. Se la raccolta di sanguinamenti retro-orbitale, anestetizzare leggermente il mouse con un anestetico per inalazione (ad esempio metossifluorano) così uno non ha bisogno di afferrare per la collottola per fissare il mouse.
- Spin sangue hemocrit centrifuga per separare le cellule del sangue dal plasma. Utilizzare una penna file o una punta di diamante per segnare il tubo a fronte della separazione di fase. Rompere il tubo e raccogliere il plasma solo, in piccolo, tubo freezer-safe. Conservare a -80 ° C fino all'analisi.
NOTA: Se una centrifuga hemocrit non è disponibile, trasferire il campione di sangue nella provetta micro-centrifuga, e centrifuga in una micro-centrifuga ad elevata velocità per separare le cellule del sangue dal plasma. Raccogliere il plasma in un secondo tubo, e conservare a -80 ° C. - Euthanize mouse CO 2 asfissia. Raccogliere tessuto (circa 20 - 50 mg) da organi di interesse e flash congelamento in azoto liquido. Conservare a -80 ° C fino al momento dell'analisi.
4. Analisi del campione
NOTA: Tutti i campioni di questo protocollo sono stati analizzati attraverso un laboratorio esterno mediante cromatografia liquida-spettrometria di massa tandem (LC - MS / MS), che ha calcolato le concentrazioni di paclitaxel nel modo seguente:
- Estratto paclitaxel da campioni. Omogeneizzare campione di tessuto nello 0,1% di acido acetico, metanolo al 50% prima dell'estrazione. Estrarre paclitaxel mediante estrazione liquido / liquido, usando metil ter-butil etere (MTBE) fortificato con uno standard di riferimento interno (docetaxel). Rimuovere MTBE e campioni secchi. Risospendere in 50% acetonitrile, soluzione allo 0,1% di acido acetico.
- Preparare gli standard di calibrazione. Aggiungere una concentrazione nota di paclitaxel appropriarsi C57BL / 6 matrice per ottenere una serie finale di standard (da 1 a 20000 ng / ml per campioni di plasma, da 0,1 a 5000 ng / ml per campioni di tessuto). Estrarre standard in duplicato, utilizzando lo stesso metodo per i campioni di studio sopra. Misurare picco paclitaxel in campioni mediante HPLC / MS / MS utilizzando la ionizzazione elettrospray.
- Calcolare la concentrazione utilizzando il rapporto di paclitaxel area standard interno. Utilizzare standard di calibrazione per creare una curva standard e campioni di studio interpolati dalla forma della curva. Normalizza concentrazione dei campioni di studio per il peso iniziale di campione prima omogeneizzazione.
Risultati
Distribuzione Paclitaxel segue schemi prevedibili nel corso di un regime di dosaggio 3 ore di 15 minuti di infusione ad alta velocità, seguita da una infusione di 165 min a bassa velocità.
La figura 1 mostra un confronto di vena-infusione concentrazioni di paclitaxel nel plasma giugulare e carotide-infusioni. Le concentrazioni di paclitaxel scendono rapidamente nei primi 15 min a seguito di un elevato volume di infusione iniziale e quindi si stabilizzano nel prossimo 150 min. In confronto, i livelli di paclitaxel in un povero infusione partono relativamente basso, e si librano su e giù durante tutta la seduta. Questo è stato probabilmente causato da un blocco in linea presto l'infusione. Le registrazioni dei test mostrano il mouse aveva poco a nessuna reazione esterno per l'infusione, che conferma l'idea di una amministrazione inferiore di farmaco. La Figura 2 mostra i livelli relativi di paclitaxel nel fegato e nel tessuto cerebrale, nonché plasma sanguigno, a fine l'infusione di 3 ore.
jove_content "fo: keep-together.within-page =" always ">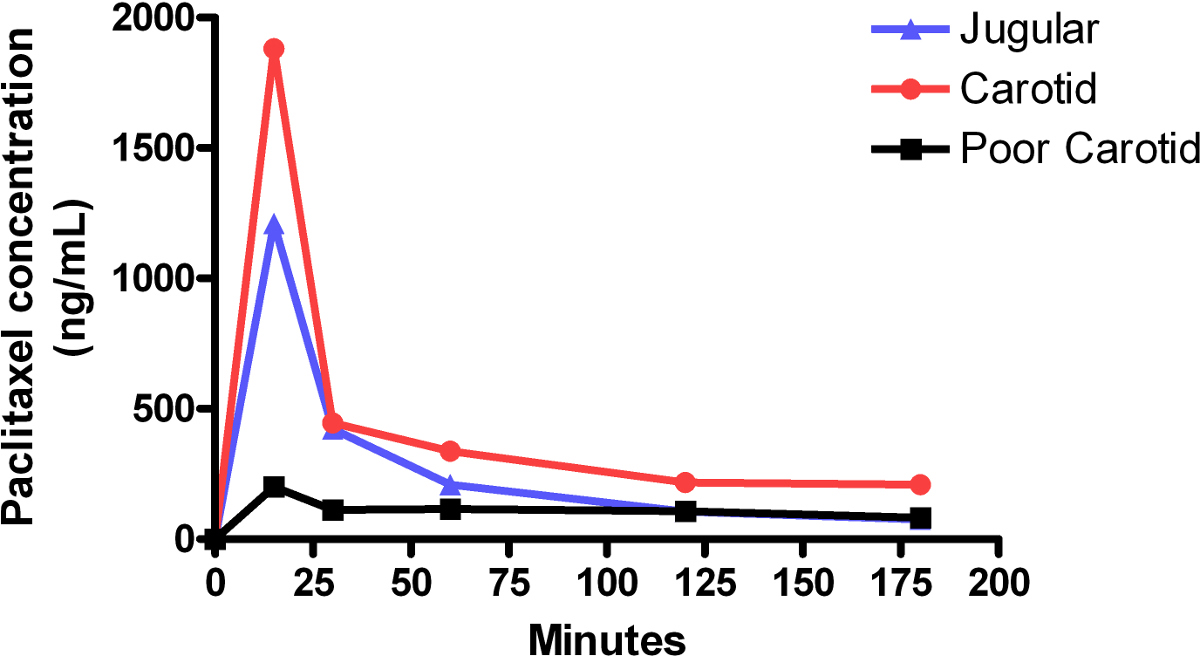
Figura 1:. I livelli di paclitaxel plasma durante la carotide e giugulare infusi curve rappresentano le concentrazioni plasmatiche di paclitaxel nei singoli topi. Ogni topo ha ricevuto un'infusione bifasico, costituito da una alta velocità iniziale, 15 min infusione di 0,42 mg / kg / min, seguita immediatamente da una bassa velocità, 165 min infusione di 0.021mg / kg / min. L'area sotto la curva (AUC) per carotidea infusione è stata di circa 59 mcg / ml ∙ min contro una AUC di infusione giugulare di circa 37 mcg / ml ∙ min. L'emivita di paclitaxel calcolato dalle curve generate per carotidea infusione era di 10 min e per infusione giugulare era 11 min. Infusione carotideo mostra circa i livelli di concentrazione del farmaco equivalenti rispetto all'infusione giugulare. Basse concentrazioni continue, o concentrazioni quel ciclo su e giù, spesso represent un povero infusione.

Figura 2:. Concentrazione di paclitaxel da tessuto Subito dopo il paclitaxel infusione di 3 ore e la raccolta dell'ultimo campione di sangue, il mouse è stato eutanasia, e campioni di fegato e tessuto cerebrale sono stati raccolti. Livelli di concentrazione paclitaxel nel plasma e nei tessuti sono stati acquisiti mediante analisi di massa-spec. Questi dati rappresentano campioni raccolti dalla carotide Infusion-Mouse in Figura 1.
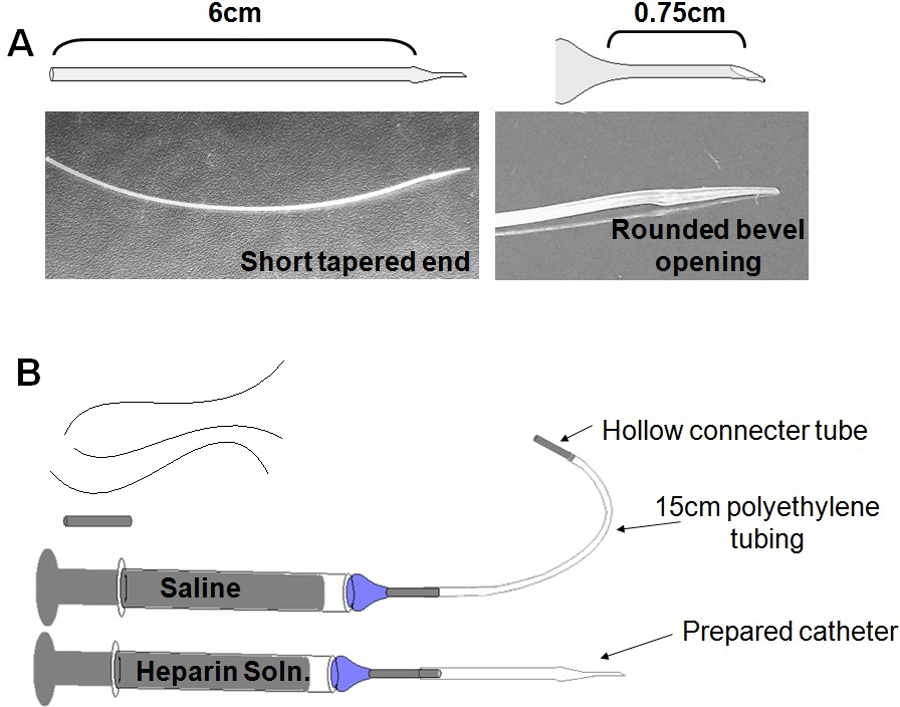
Figura 3: armamentario chirurgico. (A) Catetere di produzione: Tirare quelli propri cateteri continua giù spese materiali, permettendo la riricercatore di adattare le dimensioni e la forma del catetere per l'età e le dimensioni del mouse (B) Preparare prima dell'intervento:. Tre (3) punti di sutura in seta, di circa 8 cm ciascuno; Tappo sterile; Siringa Saline e piombo; Catetere, attaccato alla siringa di eparina.
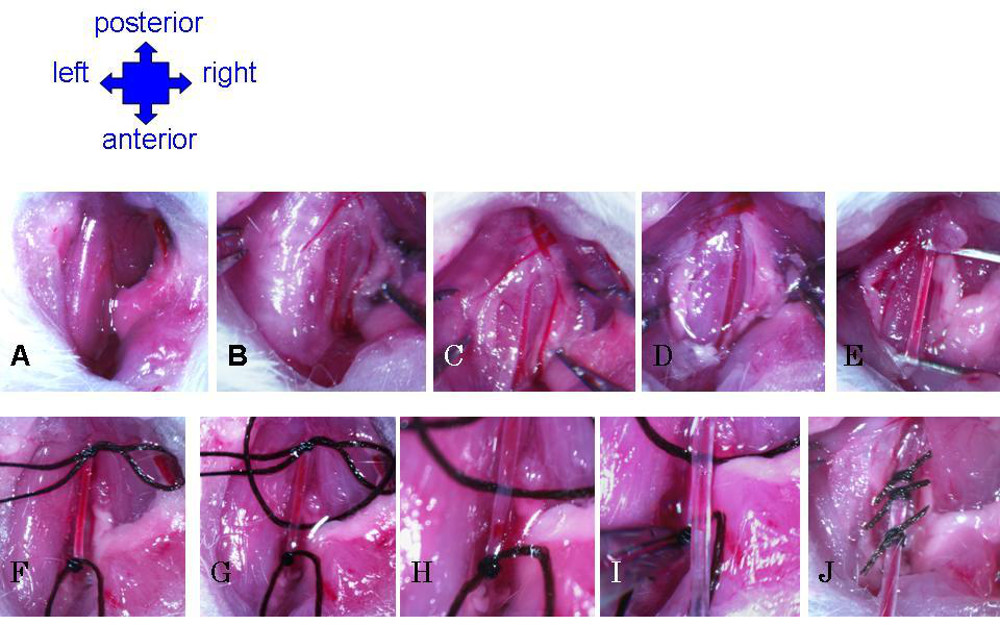
Figura 4: Preparazione della carotide e catetere. (A) Tagliare attraverso la pelle, si muove da parte delle ghiandole e utilizzare pinze per grossolanamente separato grasso per esporre il muscolo. (B) Utilizzare una pinza a delicatamente il muscolo separato per esporre lato destro della trachea. Carotide diventerà visibile come la più grande, vasi a pareti spesse, che corre parallela alla trachea. (C) Pausa fascia intorno all'arteria. (D) separata nervo vago dalla carotide. (E) Continuare a rimuovere fascia fino Carotid è completamente isolata lungo la cavità. (F) Sutura nodo permanente estremità anteriore e posteriore a slittamento nodo all'estremità. (G) Terzo sutura è infilato sotto carotide e molto liberamente annodato. (H) Arteria è scalfito appena sopra anteriore sutura. ( I) Inserire il catetere in nick in arteria. Afferra sutura anteriore con una pinza per tirare arteria giù sopra del catetere. (J) catetere sicura in carotide con tutti e tre i punti di sutura.
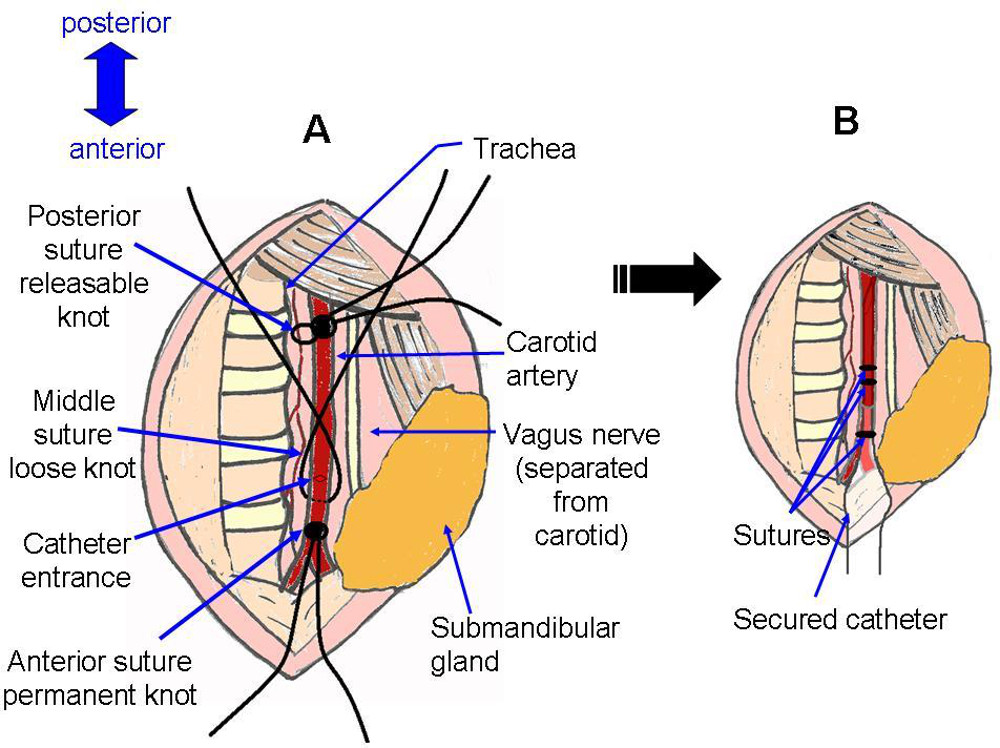
Figura 5:.. Sutura Rappresentazione schematica del sito chirurgico prima e dopo l'installazione del catetere Un corrisponde fotografia Figura 4G, con l'aggiunta di un nick nell'arteria, come in Figura 4H. B corrisponde alla fotografia figura 4J.
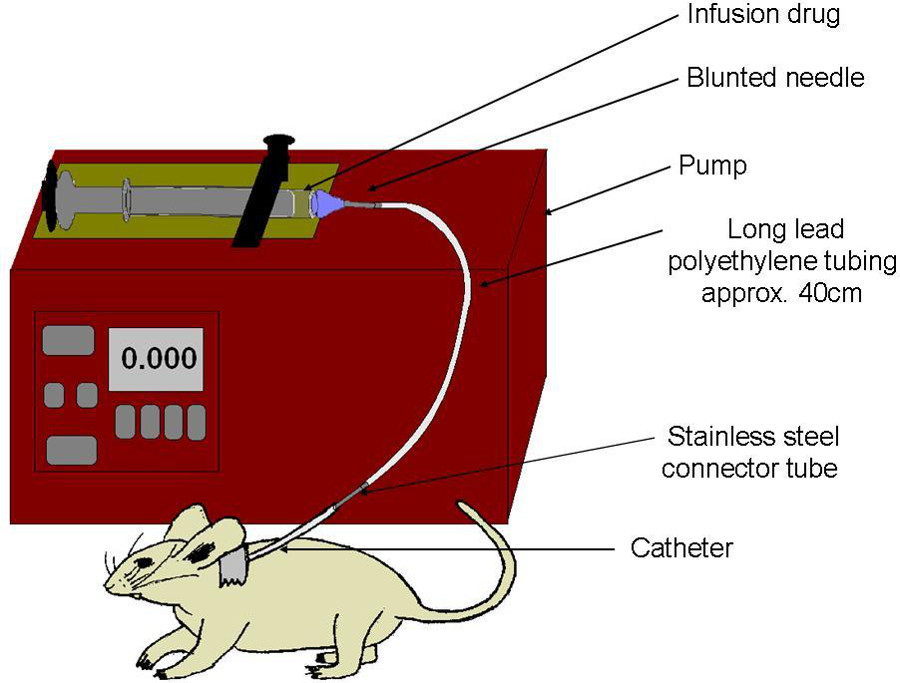
Figura 6:. Schema di infusione set-up siringa è pieno di droga, e ricoperto con un ago smussato. Linea polietilene attribuisce siringa catetere carotide. Pompa comprime lentamente la siringa, per fornire il dosaggio unico, direttamente nel flusso sanguigno.
Discussione
Carotide infusione è una tecnica notevole in questo studio di farmacocinetica di paclitaxel. Carotide infusione è un metodo per distribuire rapidamente farmaco nel sistema circolatorio 14. Il 3 ore di infusione è una più stretta mimica di somministrazione clinica di farmaci come taxani di iniezioni in bolo. L'intervento può essere eseguito in modo affidabile da un singolo individuo, il tempo di intervento è relativamente breve, e tassi di successo sono> 75%. Dopo che i campioni sono raccolti, devono essere analizzati con i metodi appropriati. Abbiamo usato spettrometria di massa per determinare la concentrazione di paclitaxel nei campioni di plasma e nei tessuti. Per convalidare ulteriormente questa tecnica, abbiamo inviato campioni di sangue e tessuti ad un laboratorio indipendente per l'analisi. Questi dati sono stati tracciati come singole curve di concentrazione di plasma-paclitaxel per ciascun animale testata (Figura 1), e la distribuzione di paclitaxel è stata confrontata in diversi tessuti (Figura 2). In ogni caso, è importante considerare il metodo migliore per analizzare la distribuzione e / o il metabolismo del farmaco, a seconda del farmaco e il sistema di interesse. Altre opzioni per la misurazione di diversi farmaci possono includere HPLC-UV o immunologici 2.
Due fattori primari essenziali per il successo della cateterizzazione carotidea sono ben cateteri stile e l'isolamento dell'arteria superiore. Modellare cateteri a seconda delle dimensioni del modello murino è fondamentale. Se il diametro del catetere è troppo spesso, inserimento nell'arteria sarà eccessivamente difficile, mentre un catetere troppo sottile sarà più difficile da ottenere e probabilità di intasamento prima o durante l'infusione. L'angolo e la nitidezza della punta del catetere deve essere anche in una gamma moderata; una punta che è troppo forte può forare la parete dell'arteria, mentre una punta che è troppo noioso sarà difficile inserire nell'arteria. Le misure qui riportati sono stati ottenuti con dieci settimane di età C57BL / 6J, circa 20 g, come un modello standard. Le misurazioni devono essere scalativerso l'alto o verso il basso per adattarsi empiricamente singoli modelli.
Isolamento della carotide deve essere un delicato processo deliberato per evitare danni inutili ai tessuti e prevenire emorragie larga scala. Sottocutaneo di grassi può generalmente essere facilmente separati con basso pinze taglienti medie. Il tessuto muscolare sopra la carotide devono essere separati con il mezzo per mettere a pinza con punta lungo la diagonale delle fibre muscolari. Se un più ampio gap è necessaria, il tecnico deve porre la massima attenzione per evitare la rottura piccoli vasi sanguigni. Una volta che la carotide è visibile, ci sarà ancora una discreta quantità di fascia che deve essere tweezed lontano dalla arteria con pinza sottile a punta. Infine, il nervo vago deve essere separato dalla carotide senza danneggiare né. Quando la carotide è adeguatamente isolato, dovrebbe essere possibile inserire la pinza sotto, con uno spazio vuoto su entrambi i lati dell'arteria (vedi figura 4E).
Quando troubili infusioni poveri tiro, inizia a rivedere le istruzioni della pompa per essere sicuri che il ricercatore ha programmato correttamente la pompa di consegnare il dosaggio previsto. Quindi, considerare attentamente la regolazione del volume che verrà introdotto nella sperimentazione animale. La diluizione del farmaco deve essere calcolata in modo che il volume di dosaggio è appropriato: il volume non deve essere troppo grande per l'animale tollerare, e idealmente non influenza significativamente la pressione sanguigna; ma il volume deve essere sufficientemente grande per la pompa per fornire in modo affidabile, e creerà un flusso costante per evitare zoccoli in corrispondenza dei nodi. Se gli zoccoli diventano un evento normale, passare ad un calibro più piccolo (diametro maggiore) ago e tubo. Inoltre, se il contenuto di farmaco nel plasma non raggiunga i livelli attesi, il ricercatore dovrebbe controllare i topi post mortem per determinare se il catetere rimane ben posizionata nell'arteria e scorrevole, e modificare la forma / dimensione del catetere se necessario.
Il usefulness di questo metodo può essere limitata da fattori quali la dimensione e la salute generale del soggetto, e la durata prevista del tempo di infusione. L'intervento e l'infusione possono affaticare un soggetto già in difficoltà. Anche in un animale sano, catetere dell'arteria carotide è appropriato solo per l'infusione a breve termine, in genere diverse ore a diversi giorni. Considerare ciò che i metodi di dolore-sollievo sarà utilizzato se i topi mostrano segni di disagio in risposta alla infusione del farmaco, come ad esempio ripetute applicazioni di anestesia topica per ferita siti, o analgesici sistemici preventivi. Sarà necessario disporre di tutti i lavori degli animali approvato dal animale organismo di regolamentazione locale o IACUC, per ottenere le autorizzazioni appropriate per eseguire questa procedura. Se è necessario disporre di un infuso più o trascorre il mouse sopravvivere l'infusione per un periodo di tempo prolungato, metodi alternativi di infusione devono essere esplorate.
Dopo aver imparato perfusione dell'arteria carotide nello studiodella farmacocinetica di paclitaxel, ci proponiamo di utilizzare questa tecnica in futuro per studiare gli effetti di altri farmaci, e modulatori Abcc10 in C57BL / 6J e topi FVB, e altri modelli murini.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Vorremmo riconoscere la struttura di laboratorio FCCC animali per il loro sostegno in questo progetto. Ringraziamo Wolfe Laboratories, Inc. per la loro assistenza nell'analisi dei livelli di paclitaxel nel plasma e nei tessuti. Questo lavoro è stato supportato dal National Institutes of Health sovvenzioni K01CA120091 a EHB, e CA06927 al Fox Chase Cancer Center.
Materiali
| Name | Company | Catalog Number | Comments |
| Polyethylene tubing 0.024” OD X 0.011” ID | Braintree Scientific, Inc. | PE10 | |
| 3 Blunted needles (30 gauge) | Braintree Scientific, Inc. | NB-30 | |
| Stainless steel port plug (28 gauge) | Braintree Scientific, Inc. | PP-28 | Slightly larger than PE tubing ID, to fit snugly and keep a tight seal. |
| 2 Stainless steel connector plugs (30 gauge) | Braintree Scientific, Inc. | C-30 | |
| Three 1 cc syringes | Becton, Dickinson and Co. | 309659 | |
| Sterile 0.9% Saline solution | Hospira | 0409-7984-37 | |
| Cath-Loc HGS Heparin/Glycerol Solution | Braintree Scientific, Inc. | HGS | |
| Silk suture | Braintree Scientific, Inc. | SUT-S 113 | |
| Vanna Scissors (micro-scissors) | World Precision Instruments | 14122 | This model has a curved tip, but straight-tip scissors work as well. |
| Hartman Mesquito Hemostatic Forceps | World Precision Instruments | 501705 | |
| Betadine Swabsticks | Perdue Products L.P. | BSWS1S | |
| Bupivacaine | Hospira | 0409-1160-01 | May be replaced with Lidocaine, or similar local anesthesia. |
| Paclitaxel | LC Laboratories | P-9600 | |
| Methanol | Sigma-Aldrich | 32213 | |
| Micro-Hematocrit Capillary Tubes, Heparinized | Fisher Scientific | 22-362-566 | |
| Micro Capillary Tube Sealant | Fisher Scientific | 02-678 | |
| C57BL/6J mice | Fox Chase Cancer Center, Laboratory Animal Facility in-house-bred | ||
| API 4000 Q-Trap mass spetrometer | Applied Biosystems |
Riferimenti
- Gallo, J. M., Li, S., Guo, P., Ma Reed, K., J, The Effect of P-Glycoprotein on Paclitaxel Brain and Brain Tumor Distribution in Mice. Cancer Research. 63 (16), 5114-5117 (2003).
- Sonnichen, D. S., Relling, M. V. Clinical Pharmacokinetics of Paclitaxel. Clinical Pharmacokinetics. 27 (4), 256-269 (1994).
- Gianni, L., et al. Nonlinear Pharmacokinetics and Metabolism of Paclitaxel and Its Pharmacokinetic / Pharmacodynamic Relationship in Humans. Journal Clinical Oncology. 13 (1), 180-190 (1995).
- Sparreboom, A., Van Tellingen, O., Nooijen, W. J., Beijnen, J. H. Nonlinear Pharmacokinetics of Paclitaxel in Mice Results from the Pharmaceutical Vehicle Cremophor EL. Cancer Research. 56 (9), 2112-2115 (1996).
- Sparreboom, A., Van Tellingen, O., Nooijen, W. J., Beijnen, J. H. Determination of paclitaxel and metabolites in mouse plasma, tissues, urine and faeces by semi-automated reversed-phase high-performance liquid chromatography. Journal of Chromatography B: Biomedical Sciences and Applications. 664, 383-391 (1995).
- Bradshaw-Peirce, E. L., Eckhardt, S. G., Gustafson, D. L. A Physiologically Based Pharmacokinetic Model of Docetaxel Disposition: from Mouse to Man. Clinical Cancer Research. 13, 2768-2778 (2007).
- Eiseman, J. L., et al. Plasma Pharmacokinetics and Tissue Distribution of Paclitaxel in CD2F1 Mice. Cancer Chemotherapy and Pharmacology. 34 (6), 465-471 (1994).
- Schinkel, A. H., et al. Normal Viability and Altered Pharmacokinetics in Mice Lacking mdr1-type (drug-transporting) P-glycoproteins. Proc. Nat. Acad. Sci. USA. 94, 4028-4033 (1997).
- Fraser, I. J., Dear, G. J., Plumb, R., L’Affineur, M., Fraser, D., Skippen, A. J. The Use of Capillary High Performance Liquid Chromatography with Electrospray Mass Spectrometry for the Analysis of Small Volume Blood Samples from Serially Bled Mice to Determine the Pharmacokinetics of Early Discovery Compounds. Rapid Communications in Mass Spectrometry. 13 (23), 2366-2375 (1999).
- Bateman, K. P., et al. Reduction of Animal Usage by Serial Bleeding of Mice for Pharmacokinetic Studies: Application of Robotic Sample Preparation and Fast Liquid Chromatography – Mass Spectrometry. Journal of Chromatography B: Biomedical Sciences and Applications. 754 (1), 245-251 (2001).
- Berndt, K., Vogel, J., Buehler, C., Vogt, P., Born, W., Fuchs, B. A new method for repeated drug infusion into the femoral artery of mice. J. Am. Assoc. Lab Animal Sci. 51 (6), 825-831 (2012).
- . Squibb & Sons, L.L.C.. Drug Information for TAXOL (Paclitaxel) Injection. , (2011).
- . Abraxis BioScience L.L.C. Full Prescribing Information ABRAXANE for Injectable suspension (paclitaxel protein-bound particles for injectable suspension) (albumin-bound). , (2013).
- Fergusson, G., Ethier, M., Zarrouki, B., Fontés, G., Poitout, V. A Model of Chronic Nutrient Infusion in the Rat. J. Vis. Exp. (78), (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon