Method Article
Infusiones de la arteria carótida para farmacocinéticas y farmacodinámicas Análisis de taxanos en ratones
En este artículo
Resumen
Este método fue desarrollado con el objetivo de ofrecer una solución de fármaco constante a través de la arteria carótida, para evaluar la farmacocinética de nuevos fármacos en modelos de ratón.
Resumen
Al proponer el uso de un fármaco, combinación de fármacos, o la administración de fármacos en un sistema novedoso, se debe evaluar la farmacocinética del fármaco en el modelo de estudio. Como el uso de modelos de ratón son a menudo un paso vital en el descubrimiento de fármacos y desarrollo de fármacos preclínica 1-8, es necesario diseñar un sistema para introducir fármacos en ratones en una manera uniforme, reproducible. Idealmente, el sistema debería permitir la recogida de muestras de sangre a intervalos regulares durante un curso de tiempo establecido. La capacidad de medir las concentraciones de fármaco por espectrometría de masas, ha permitido a los investigadores a seguir los cambios en los niveles de fármaco en plasma con el tiempo en ratones individuales 1, 9, 10. En este estudio, el paclitaxel se introdujo en ratones transgénicos como una infusión continua a lo largo de tres arterial hora, mientras que las muestras de sangre fueron tomadas simultáneamente por sangrados retro-orbital en los puntos de tiempo establecidos. Infusiones arteria carótida son una alternativa potencial para infusiones vena yugular, cuando factores tales comotumores mamarios u otros obstáculos hacen infusiones yugulares poco práctico. Usando esta técnica, las concentraciones de paclitaxel en el plasma y el tejido lograron niveles similares en comparación con la infusión yugular. En este tutorial, vamos a demostrar cómo cateterizar con éxito la arteria carótida mediante la preparación de un catéter optimizado para el modelo individual del ratón, a continuación, mostrar cómo insertar y asegurar el catéter en la arteria carótida del ratón, pase el extremo del catéter a través de la parte posterior del cuello del ratón, y conectar el ratón a una bomba para suministrar una velocidad controlada de afluencia de drogas. Múltiples bajo volumen hemorragias retro-orbital permiten el análisis de las concentraciones plasmáticas del fármaco a través del tiempo.
Introducción
Infusión de medicamentos a través de la carótida se puede realizar de forma fiable y reproducible por el equipo y la técnica la optimización. El procedimiento no es complicado, aunque sí requiere un control preciso y la atención al detalle. Superior cuidado y destreza se necesitan para aislar la arteria carótida e insertar el catéter, lo que generalmente se puede adquirir a través de la práctica. Cirugía por un técnico con experiencia no debe ser superior a una hora. Después de la cirugía con éxito, el ratón debe aparecer normal y saludable (aunque el ratón puede reaccionar a la infusión de fármaco real), y el fármaco (s) pueden administrarse en una forma controlada, la dosificación continua y uniforme. Las muestras de sangre deben tomarse de un punto que no sea el de la arteria carótida; hemorragias retro-orbital resultaron fáciles de recoger y satisfactoria para el análisis de las concentraciones de fármaco.
Los catéteres de tamaño y la forma óptima son un activo muy valioso en la realización de una infusión de éxito 11. Encontramos el catéteres commerciall disponibleY a menudo es demasiado grande y / o demasiado flexible como para permitir un cómodo acceso a la arteria carótida del ratón. Demostró preferible catéteres de moda de la tubería de polietileno se utiliza para conectar el ratón a la jeringa de infusión. Así, todos los tubos, conectores y agujas eran de dimensiones coherentes, que simplificó conjunto de infusión. Usando esta técnica, no es necesario empujar la punta del catéter en la arteria más allá del punto donde aún es visible, y el flujo sanguíneo a la arteria carótida no se restaura hasta después de que el catéter se fija inicialmente. Esto reduce los riesgos de punción de la arteria o de tener el catéter expulsados por la alta presión del flujo de sangre. El diseño del catéter en el presente documento no incorpora un "golpe" para mantenerla en su lugar, de modo asegurando el catéter bien con suturas y cinta quirúrgica es una prioridad.
Las infusiones pueden ser preferibles a las inyecciones en bolo iv comunes, como una mejor imitador de administración clínica defármacos tales como taxanos 3, 12, 13. La técnica descrita aquí fue desarrollado originalmente para permitir la infusión en modelos de ratón en el que el acceso a la vena yugular o femoral fue excluida por el crecimiento del tumor mamario y / o vascularización excesiva de la zona de inserción. Este método a menudo puede ser apropiado incluso en ratones libres de tumor: aunque el aislamiento y la cateterización de la arteria carótida es un poco más invasiva, nos pareció preferible a la yugular, porque la propensión de la pared yugular a rip resultó en inserciones y fracasos para completar más fallidos el curso de tiempo de 3 h.
Mientras que los resultados que se muestran aquí son de C57BL / 6J (in-house de raza) los ratones, hemos utilizado esta técnica para infundir éxito paclitaxel en varias cepas de ratones, incluyendo FVB y mixtos-cepas, para seguir la farmacocinética en modelos de ratones manipulados transgénicamente para regular a la baja las funciones transportadoras celulares. Las muestras de sangre y tejidos recogidos mostraron niveles esperados de paclitaxel, en el rango de los niveles observados después de las infusiones yugulares 1. Esta técnica se puede esperar que funcione igualmente bien en otros modelos de ratón y con otras soluciones para infusión.
Protocolo
Este protocolo ha sido aprobado por el Comité de Animales Cancer Center Institucional de Cuidado y Uso de Fox Chase y por el Fondo para los Animales de Laboratorio, y se encontró que de acuerdo con las directrices institucionales para el tratamiento humanitario de los animales.
1. Preparación Preliminar
- Preparación de catéter: Preparar un catéter de una longitud corta de tubo de polietileno, modificado para formar un adelgazada, el extremo romo (Figura 3A). Hacer múltiples catéteres con antelación y guardar indefinidamente.
- Enciende un mechero Bunsen, y ajuste para establecer una llama estable bajo. Sostenga el tubo cerca de la llama para suavizar polietileno. Cuando la tubería comienza a derretirse, tire lentamente aparte los dos extremos para crear una sección adelgazada de la tubería, de aproximadamente 0,25 mm de diámetro exterior.
- Corte un extremo biselado de aproximadamente 0,75 cm a lo largo de la sección delgada. Esto asegura suficiente tubería para ser asegurado en la arteria, sin crear un catéter demasiado largo.
NOTA: Un final largo y delgado en el the catéter tiene una propensión a obstruir. Un final demasiado largo también puede contener suficiente líquido para cambiar significativamente la capacidad de volumen de líquido del catéter. - Embotar el extremo biselado pasando rápidamente a través de la llama - cuando está debidamente climatizada, al final se convierte en ligeramente redondeada y ampliada. Los ganchos de punta ligeramente hacia atrás, lo que ayuda a anclar el tubo mientras se inserta en la arteria.
- Cortar el tubo de 6,0 cm alrededor del punto donde comienza a adelgazarse. Esto hace que un catéter muy manejable, que es el tiempo suficiente para enhebrar a través de la salida desde el cuello, y ocupar y trabajar con comodidad, pero lo suficientemente corto como para evitar que el ratón de roer en exceso de tubo o que requieren demasiado volumen de infusión extra para despejar salina inicial .
- Prepare una jeringa de aproximadamente 0,2 ml de solución de heparina, rematado con una aguja roma. Insertar la aguja en el extremo ancho del catéter (Figura 3B). Llenar el catéter con heparina, con cuidado para asegurarse de que no haya burbujas enel tubo. Ajuste la jeringa con heparina y el catéter a un lado en un área estéril. Esterilizar catéteres mediante irradiación gamma, mediante la colocación de catéter (s) en una placa de Petri, y exponiendo a 20 Gy de irradiación gamma. Si usted no tiene acceso a una fuente de radiación gamma, consulte con su instalación de animales para investigar otros medios de esterilización, tales como gas o químico-esterilización. No esterilice en autoclave, como el polietileno no se puede esterilizar calor.
- Creación de una ventaja de solución salina (Figura 3B).
- Preparar una segunda jeringa de aproximadamente 0,5 ml de solución salina estéril, con cuidado para asegurar una línea libre de burbujas.
- Cortar una segunda pieza de tubo, aproximadamente 15 cm, y el deslizamiento en la aguja de la jeringa roma. Adjuntar un puerto de conector en el extremo libre de la tubería.
- Prueba de que el flujo de solución salina no está obstruido por el avance sin problemas un pequeño volumen de solución salina a través de la iniciativa. Utilice este cable salina después de la inserción del catéter, para comprobar el flujo a través deel catéter, y para limpiar la línea de sangre. Ajuste la jeringa con solución salina a un lado en un área estéril.
- Antes de la cirugía, esterilizar el equipo en autoclave, o alternativamente por la esterilización por gas o esterilización de perlas de vidrio.
- Prepare el área quirúrgica estéril.
- Limpie banco y microscopio superficies con desinfectante como el 70% de etanol o dióxido de cloro. Cubra banco y base del microscopio con una almohadilla absorbente desechable limpio.
- Preparar una tabla quirúrgica cubriendo con dos capas de papel absorbente y limpia, con apego seguro con cinta adhesiva.
- Coloque todos los suministros quirúrgicos (como catalogada en la Lista de Materiales) de modo que sean fácilmente accesibles.
- Corte tres longitudes de sutura estéril, 8 cm cada una, y dejar de lado a otros suministros. Coloque un puerto donde será fácilmente disponible (Figura 3B).
2. Cirugía
- Preparación del animal
- Anesthetize ratón por la exposición a un 2-3% isoflurano en la cámara conectada a la anestesia vaporizador de precisión. Retirar del ratón de la cámara, y afeitar el pelo del cuello / parte superior del torso del ratón, y por debajo de la oreja derecha (sitio de salida del catéter). Administrar veterinaria vaselina pomada oftálmica para los ojos para evitar la sequedad, mientras que bajo anestesia. Asegúrese de que el animal no despertar durante las preparaciones quirúrgicas permitiendo ratón tiempo suficiente en la cámara de inhalación antes de la preparación de (al menos dos min), o mediante la administración de isoflurano al ratón por medio de un cono de la nariz durante la preparación. Ratón Vuelta a la cámara de la anestesia.
- Cuando ratón es suficientemente inerte, mover a la zona quirúrgica estéril, colocar cono de la nariz anestesia sobre la nariz del ratón y la boca, y desviar el flujo de isoflurano al cono de la nariz. Confirmar anestesia adecuada pellizcando la pata con fórceps; cuando el ratón no muestra ninguna reacción, proceder al siguiente paso.
- Coloque el ratón sobre la espalda, con frente a la cabeza en dirección a lainvestigador. Asegure las orejas, patas delanteras y patas traseras a bordo quirúrgica con cinta adhesiva u otro dispositivo de retención para mantener el ratón estacionario. Limpie el área de la incisión con povidona yodada y etanol al 70%.
- Aislamiento de la arteria carótida
- Hacer un corte longitudinal de 1 cm ligeramente a la derecha de la línea media del cuello. El uso de fórceps para separar la grasa y el músculo para exponer la tráquea (Figura 4A). Localice la arteria carótida paralela a la tráquea (Figura 4B).
- Utilizar con cuidado unas pinzas a la fascia separada que recubren la arteria (Figura 4C). Tirar ligeramente el nervio vago, aparte de la carótida, e insertar los fórceps en el espacio entre. Pinzas suavemente abiertos para crear un vacío en la fascia, y cuidadosamente se alejan del nervio de la arteria, desde el tenedor en la arteria cerca de la laringe (extremo anterior), hacia arriba (posterior) en la medida de lo posible (por lo menos 3 mm) ( Figura 4D).
- Desactive la basura cualquier refascia restante hasta que la arteria está bien aislado (Figura 4E). Añadir una gota de solución salina a la zona de la cirugía de vez en cuando para mantener el tejido húmedo, y por lo tanto menos frágil y menos propenso a la rotura al azar.
- Colocación de la sutura y la preparación para la inserción del catéter de la arteria (Figuras 4, 5).
- El uso de fórceps para extraer un hilo de sutura de seda debajo de la arteria. Ate un nudo seguro para cerrar la arteria en la medida hacia la parte anterior como sea posible (Figura 4F).
- Dibuja un segundo hilo por debajo de la arteria. Haga un nudo retráctil para cerrar temporalmente la arteria en la medida hacia la parte posterior de lo posible (Figura 4F).
- Dibuje un tercer hilo por debajo de la arteria. Haga un nudo muy suelto entre los dos primeros puntos de sutura, que se utiliza para asegurar rápidamente el catéter después de la colocación (Figura 4G).
- Mantenga todos los extremos de las suturas fuera del camino por mojar con un poco de etanol al 70%.
- La inserción del catéter
- Con la sutura, agarra el nudo inferior para tirar de la arteria un poco tensa. Nick la arteria por encima, pero muy cerca, la sutura anterior (Figura 4H). Tenga cuidado de no cortar demasiado profundamente, pero revise la ranura para asegurarse de que la apertura esté obstruido.
- Retire el catéter con heparina lleno de aguja de la jeringa, tratando de evitar la creación de grandes bolsas de aire en los extremos. Manipular el catéter hasta la posición de bisel a un ángulo cómodo, en general, a la baja, y ligeramente a la derecha (para los diestros).
- Mientras se aferra a la sutura para mantener la arteria queda ligeramente tenso, inserte suavemente el catéter en hendidura (Figura 4E). Utilice las pinzas para sujetar la sutura anterior y tire de la arteria hacia abajo sobre catéter (empujando hacia arriba en exceso con el catéter puede hacer que el extremo biselado para punzar la arteria). Libere cuidadosamente el catéter y anterior de la sutura.
- Aseguramiento de catéter y el inicio del flujo sanguíneo (Las figuras 4J, 5B).
- Asegurar el catéter apretando el nudo de la sutura media, cerca de la entrada del catéter en la arteria. Hacer un apretado nudo triple, pero asegúrese de no tirar tan fuerte como para obstruir el flujo a través del catéter. Además asegurar el catéter mediante la vinculación de abajo con la sutura anterior, debajo de la entrada a la arteria.
- Una el plomo solución salina al catéter por medio de la clavija del conector, de nuevo tratando de evitar la introducción de burbujas de aire en la línea.
- Sujete los extremos de la sutura posterior y tire suavemente para liberar el nudo. Maniobra de la sutura por la arteria, sobre el extremo del catéter (no quite el hilo). La sangre debe fluir en el catéter; si no hay flujo de sangre, mover suavemente el catéter para intentar eliminar la constricción.
- Cuando el flujo aparece sin obstrucciones, utilice el último hilo (de la sutura posterior) para atar un nudo adicional, ligeramente por encima de la sutura media.
- Temporary de sellado de catéter. Enjuague el catéter de la sangre, a continuación, utilizar una pinza hemostática para sujetar el extremo del catéter cerca de la clavija del conector. Retire el conector y sustituirlo por el tapón del puerto para sellar el extremo del catéter, y retire la pinza hemostática.
- Reposicionamiento catéter para salir de la parte posterior del cuello.
- Con fórceps en cada mano, utilizar un par de fórceps para mantener al catéter justo debajo de la sutura anterior, y con la otra, pulse un retorcimiento en el catéter de manera que se dobla fácilmente hacia un lado. Repita el procedimiento para crear una segunda torcedura. Esto permite que el extremo libre del catéter que se tire hacia la parte posterior de la cabeza del ratón, sin forzar la punta del catéter para girar lateralmente contra la pared de la arteria.
- Ponga el ratón sobre su lado (izquierda), manteniendo el cono de la nariz colocada sobre la boca y la nariz, y limpiar el área de la incisión con 70% de etanol y povidona yodada. Haga una pequeña incisión (aproximadamente 4 mm) por debajo y detrás de la oreja derecha.
- El uso de fórceps para sujetar la solapa abierta de la piel, mientras se trabaja la sonda hueca romo debajo de la piel para crear un canal a través de la mejilla, a la cavidad en el cuello. Es recomendable llevar la sonda alrededor de la glándula salival, en vez de tratar de ir entre la glándula y la piel. El uso de fórceps para liberar cuidadosamente un espacio para la sonda para salir.
- Pase puerto enchufe / catéter a través de la sonda para salir en el cuello. No tire demasiado duro; asegúrese de que el catéter no está aplastando o constricción de los vasos sanguíneos u órganos.
- El cierre y la recuperación. Administrar analgésico tópico (por ejemplo, bupivacaína) a la incisión del hombro, y cubrir la herida con a prueba de agua, cinta adhesiva quirúrgica. Aplicar un segundo trozo de cinta adhesiva para asegurar aún más el catéter.
- Administrar analgésico tópico para la incisión en el pecho, y cerca de la herida con seda o grapas.
- Eliminar de ratón de la anestesia, y permitir que los animales se recupere en un lugar limpio, calentado espacio (lugar jaula en la parte superior de una almohadilla térmicao bajo una lámpara de calor), durante al menos 30 min.
3. Infusión
- Preparar alícuotas de 5 mg / ml de solución de paclitaxel / metanol.
- Mida 50 mg de paclitaxel en un tubo de centrífuga de 15 ml. Añadir 10 ml de metanol estéril. Tubo Cap. Girar a mano o en un agitador rotatorio a temperatura ambiente hasta que se disuelva el polvo.
- Alícuota de 500 l de solución en tubos seguras 20 pequeño, congelador, y almacenar a -20 ° C.
- Alícuota individuo Descongelar a temperatura ambiente o en el baño a 37 ° C, inmediatamente antes de la infusión.
- Prepare la bomba de infusión (Figura 6).
- Corte un largo tramo de tubo de polietileno de aproximadamente 40 cm. Adjuntar una aguja roma en un extremo, y un puerto de conector a la otra.
- Elaborar drogas en una jeringa con un diámetro interior conocido (la mayoría de las bombas programables requerirán el diámetro del cilindro de la jeringa, con el fin de calcular la velocidad de ºbrazo de la bomba e). Coloque la aguja de la jeringa y cargar el fármaco a través de la aguja y el tubo.
- Situar la jeringa en la bomba de acuerdo a las instrucciones del fabricante. Cebar la bomba de manera que el fármaco está fluyendo sin problemas a cabo el enchufe del conector, y está listo para perfusión.
- Conecte el ratón para bombear.
- Mantenga el ratón estable y utilizar la pinza para sujetar el catéter, cerca del tapón del puerto. Retire el tapón y reemplazar con el conector unido a la jeringa y el tubo.
NOTA: La sangre puede comenzar a fluir de nuevo a través de la tubería. - Administrar rápidamente una bomba rápido como para borrar el volumen del catéter (calculado empíricamente mediante la observación de que el volumen de 6 cm de tubo), a continuación, cambiar inmediatamente a la velocidad de infusión deseada.
- Mantenga el ratón estable y utilizar la pinza para sujetar el catéter, cerca del tapón del puerto. Retire el tapón y reemplazar con el conector unido a la jeringa y el tubo.
- Continúe la infusión de paclitaxel para el curso de tres horas.
- Monitorear la tubería de vez en cuando para comprobar que no haya fugas en las uniones, ya que es a menudo un signo de una obstrucción en el flujo para el ratón.Mira el ratón para las reacciones esperadas o inesperadas a la infusión (letargo o hiperactividad, síntomas de malestar).
- Dependiendo de la duración y la naturaleza de la infusión, el ratón no puede comer o beber, pero asegúrese de proporcionar acceso a la alimentación y al agua de acuerdo con la política establecida de la institución. Sea consciente de la posibilidad de deshidratar el ratón a través de la recolección de grandes cantidades de sangre.
- Siga manteniendo la jaula caliente con una almohadilla térmica o una lámpara, a menos que el ratón parece desear que se mantenga alejado del calor. Si los animales no se practicó la eutanasia dentro de varias horas después de la cirugía, aplicar el plan de tratamiento post-quirúrgico de los animales, incluyendo las condiciones de vivienda estériles y tratamiento para el dolor post-quirúrgico.
- Mantenga una estrecha vigilancia sobre el ratón, sobre todo en los primeros minutos, para asegurarse de que no tire de la tubería a través de la hiperactividad, o irritación de la tubería (que puede ser un signo de una mala inserción). Si el ratón no está sobre-activa, monito constanteanillo puede no ser necesario, pero revise el ratón de forma rutinaria para asegurarse de que el animal no se enrede en el tubo. Arnés y sistema de sujeción están disponibles comercialmente, pero su uso está más allá del alcance de este protocolo.
- Recogida de muestras.
- Recoger muestras de sangre a intervalos regulares por hemorragias submandibular o retro-orbital (Si su protocolo no hace uso de modelos de tumores mamarios, considere la posibilidad de acumulación de sangre a través de un catéter yugular insertado al mismo tiempo que el catéter de la carótida). Tenga cuidado de no tirar de la línea de infusión. Si la recogida por hemorragias retro-orbital, ligeramente anestesiar el ratón con un anestésico por inhalación (por ejemplo, metoxiflurano) por lo que uno necesita no agarrar por el pescuezo para asegurar el ratón.
- Girar la sangre en la centrifugadora hematocrito para separar las células sanguíneas del plasma. Use una lima de diamante o la punta del lápiz para anotar tubo en la cara de la separación de fases. Rompe tubo y recoger el plasma sólo, en el tubo pequeño, con congelador seguro. Almacene en -80 ° C hasta el análisis.
NOTA: Si una centrífuga de hematocrito no está disponible, transferir la muestra de sangre en un tubo de microcentrífuga, y el giro en un micro-centrífuga a alta velocidad para separar las células sanguíneas del plasma. Recoger el plasma en un segundo tubo, y almacenar a -80 ° C. - La eutanasia ratón por asfixia de CO 2. Recoger tejido (alrededor de 20 - 50 mg) a partir de órganos de interés y la congelación de flash en nitrógeno líquido. Almacenar a -80 ° C hasta su análisis.
4. Análisis de la muestra
NOTA: Todas las muestras de este protocolo se analizaron a través de un laboratorio externo por cromatografía líquida-espectrometría de masas en tándem (LC - MS / MS), que calcula las concentraciones de paclitaxel de la siguiente manera:
- Extracto de paclitaxel a partir de muestras. Homogeneizar muestra de tejido en ácido acético al 0,1%, metanol al 50% antes de la extracción. Extracto de paclitaxel por extracción líquido / líquido, usando éter metil-terc-butilo (MTBE) fortificada con un estándar analógico interno (docetaxel). Retire MTBE y muestras secas. Resuspender en 50% de acetonitrilo, solución de ácido acético al 0,1%.
- Preparar los estándares de calibración. Añadir una concentración conocida de paclitaxel para apropiarse de C57BL / 6 para obtener una matriz de rango final de los estándares (de 1 a 20.000 ng / ml para muestras de plasma, de 0,1 a 5000 ng / ml para muestras de tejido). Extraer estándares por duplicado, utilizando el mismo método que para las muestras de estudio anteriores. Mida pico de paclitaxel en las muestras por HPLC / MS / MS utilizando ionización por electrospray.
- Calcular la concentración usando la relación de área de paclitaxel a patrón interno. Utilice estándares de calibración para crear una curva estándar, y muestras de estudio interpolados por ajuste de la curva. Normalizar la concentración de muestras de estudio por el peso inicial de la muestra antes de la homogeneización.
Resultados
Paclitaxel distribución sigue patrones predecibles durante un régimen de dosificación 3 h de una infusión de 15 min de alta velocidad, seguido de una infusión de 165 min a baja velocidad.
La Figura 1 muestra una comparación de la vena de la infusión de paclitaxel concentraciones de plasma yugular y la arteria carótida-infusiones. Las concentraciones de paclitaxel caen rápidamente en los primeros 15 minutos después de una infusión inicial de alto volumen, y luego se estabilizan durante la próxima 150 min. En comparación, los niveles de paclitaxel en una pobre perfusión comienzan relativamente baja, y oscilan arriba y abajo a lo largo del ensayo. Esta fue probablemente causado por una obstrucción en la línea de primera hora de la infusión. Actas de la ensayo de mostrar el ratón tenía poca o ninguna reacción externa a la infusión, lo que corrobora la idea de una administración de fármaco inferior. La Figura 2 muestra los niveles relativos de paclitaxel en el hígado y el tejido cerebral, así como plasma sanguíneo, al final de la infusión de 3 horas.
jove_content "fo: keep-together.within-page =" always ">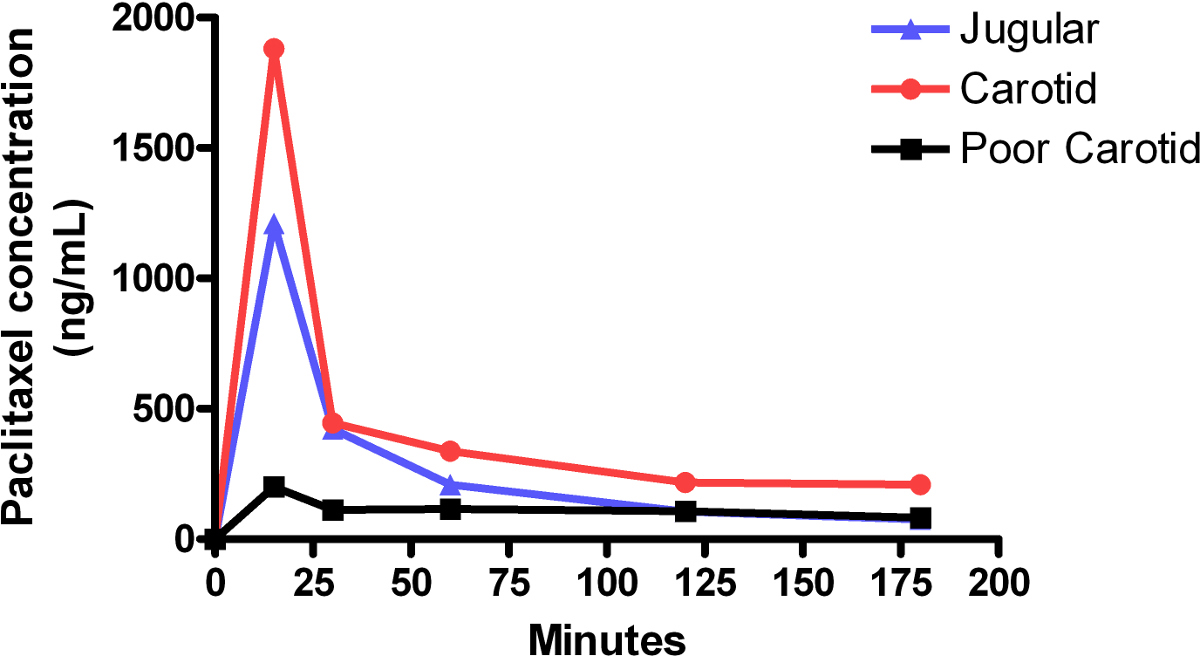
Figura 1:. Los niveles de paclitaxel en plasma durante carótida y la yugular infusiones curvas representan concentraciones de paclitaxel en plasma en ratones individuales. Cada ratón recibió una infusión bifásico, que consta de una alta velocidad inicial, 15 min de infusión de 0,42 mg / kg / min, seguida inmediatamente por una baja velocidad, 165 min infusión de 0.021mg / kg / min. El área bajo la curva (AUC) para la infusión de la carótida fue de aproximadamente 59 mg / ml ∙ min frente a un AUC para la infusión yugular de aproximadamente 37 mg / ml ∙ min. La vida media de paclitaxel calculada a partir de las curvas generadas para la infusión de la carótida fue de 10 min y la yugular para la infusión fue de 11 min. Infusión carótida muestra unos niveles equivalentes de concentración de fármaco en comparación con la infusión yugular. Bajas concentraciones continuos, o concentraciones ese ciclo arriba y hacia abajo, a menudo represent una pobre perfusión.

Figura 2:. La concentración de paclitaxel por el tejido Inmediatamente después de la infusión de paclitaxel 3 hr y la recolección de la última muestra de sangre, el ratón fue sacrificado, y se recogieron muestras de hígado y el tejido cerebral. Los niveles de concentración de paclitaxel en el plasma y los tejidos fueron adquiridos por análisis de masas-spec. Estos datos representan las muestras obtenidas de la carótida Infusión-Ratón en la Figura 1.
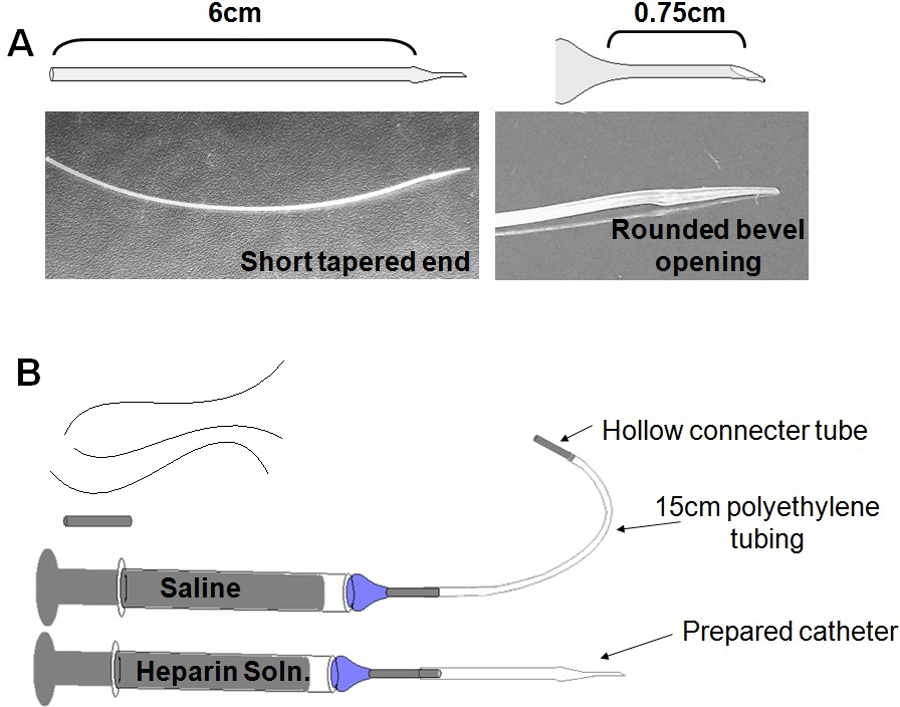
Figura 3: parafernalia quirúrgica. (A) Catéter de producción: Tirar los propios catéteres sigue abajo gastos de material, al tiempo que permite la rebuscador para adaptar el tamaño y la forma del catéter para la edad y el tamaño del ratón (B) Preparar antes de la cirugía:. Tres (3) puntos de sutura de seda, aproximadamente 8 cm cada una; Enchufe puerto estéril; Jeringa de solución salina y el plomo; Catéter, unido a la jeringa de heparina.
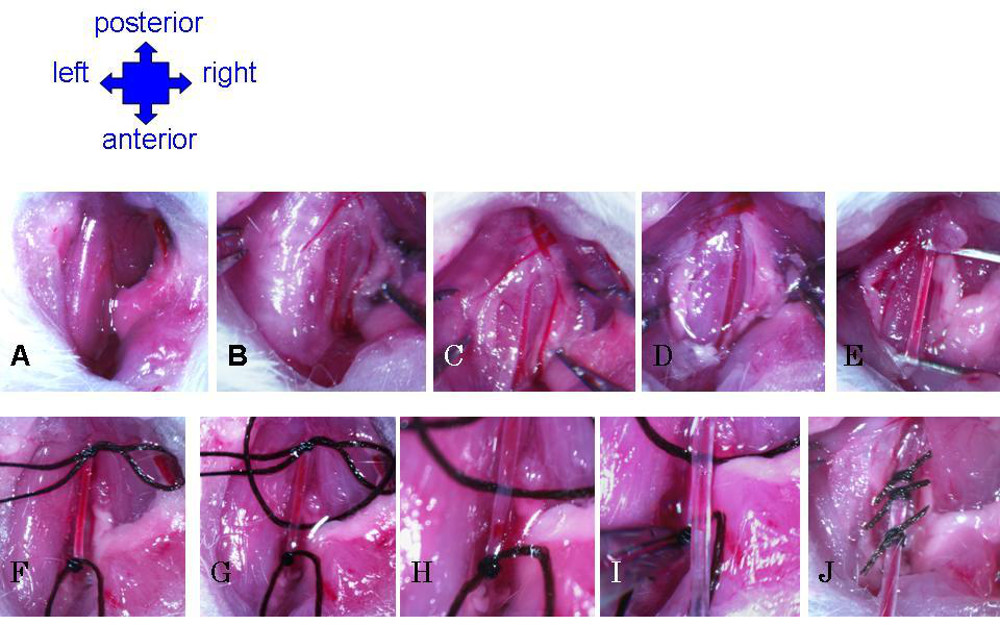
Figura 4: Preparación de la arteria carótida y de inserción del catéter. (A) Corte a través de la piel, se mueve a un lado las glándulas y el uso de fórceps para groseramente separada grasa para exponer el músculo. (B) Utilice pinzas para suavemente los músculos por separado para exponer el lado derecho de la tráquea. De la arteria carótida se hará visible como grande, vasos de paredes gruesas, que corre paralela a la tráquea. (C) fascia rotura alrededor de la arteria. (D) del nervio vago separada de la arteria carótida. (E) Continuar la eliminación de la fascia hasta Carotid está completamente aislada a lo largo de la cavidad. (F) Sutura nudo permanente en la extremidad anterior, y nudo corredizo en el extremo posterior. (G) En tercer lugar de la sutura se coloca debajo de la carótida y de manera muy informal con nudos. (H) de la arteria se mella justo por encima de la sutura anterior. ( I) Insertar catéter en nick en la arteria. Agarra sutura anterior con pinzas para tirar hacia abajo sobre la arteria catéter. (J) catéter segura en la arteria carótida con los tres puntos de sutura.
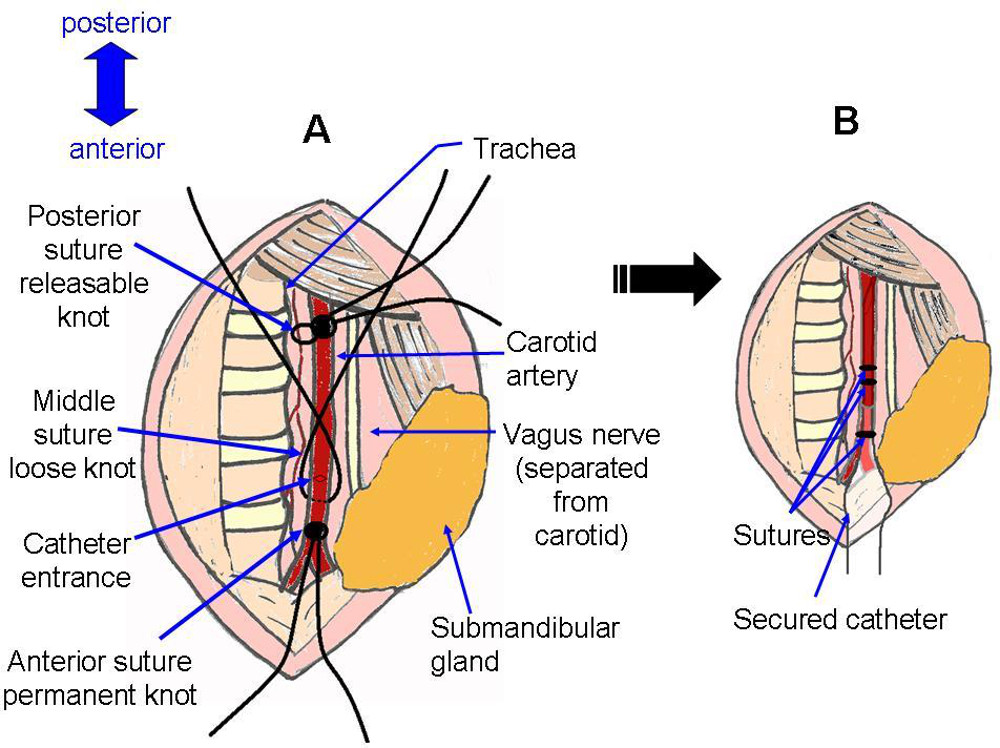
Figura 5:.. Colocación de la sutura Representación esquemática de la zona quirúrgica antes y después de la instalación del catéter A corresponde con la fotografía Figura 4G, con la adición de una incisión en la arteria, como en la Figura 4H. B corresponde con la fotografía figura 4J.
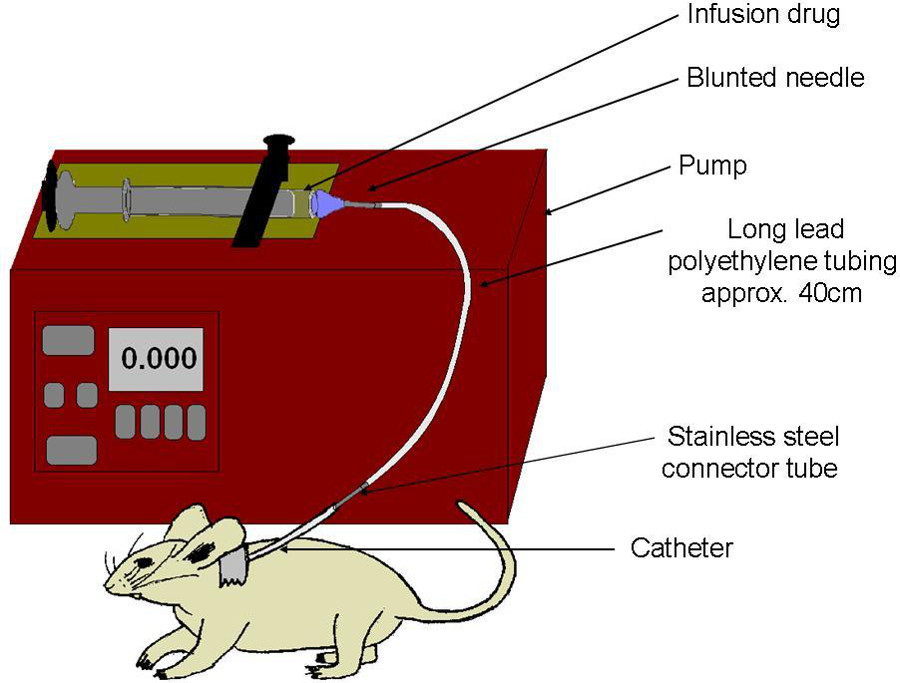
Figura 6:. Esquemática de infusión set-up jeringa se llena con el fármaco, y se tapa con una aguja de punta roma. Línea de polietileno se adhiere jeringa para catéter de la carótida. Bomba de jeringa comprime lentamente, para entregar dosificación uniforme directamente en el torrente sanguíneo.
Discusión
Infusión de la arteria carótida es una técnica importante en este estudio de farmacocinética de paclitaxel. Infusión de la arteria carótida es un método para distribuir rápidamente drogas en todo el sistema circulatorio 14. El 3 hr de infusión es un imitador más cerca de la administración clínica de los medicamentos tales como taxanos que las inyecciones en bolo. La cirugía se puede realizar de forma fiable por una sola persona, el tiempo de cirugía es relativamente corto, y las tasas de éxito son> 75%. Después se recogen las muestras, deben ser analizados por los métodos apropiados. Se utilizó espectrometría de masas para determinar la concentración de paclitaxel en muestras de plasma y tejidos. A fin de validar esta técnica, enviamos muestras de sangre y tejidos a un laboratorio independiente para su análisis. Estos datos se representan como curvas de concentración plasmática de paclitaxel individuales para cada animal probado (Figura 1), y la distribución de paclitaxel se comparó en diferentes tejidos (Figura 2). En cada caso, es importante a considerar el mejor método para analizar la distribución y / o el metabolismo de fármacos, dependiendo de la droga y el sistema de interés. Otras opciones para la medición de diferentes fármacos pueden incluir HPLC-UV o inmunoensayos 2.
Dos factores primarios esenciales para la cateterización de la carótida éxito son bien catéteres de moda y el aislamiento de la arteria superior. Fashioning catéteres de acuerdo con el tamaño del modelo de ratón es de suma importancia. Si el diámetro del catéter es demasiado gruesa, la inserción en la arteria será excesivamente difícil, mientras que un catéter demasiado delgada será más difícil de asegurar y propensos a obstruir antes o durante la infusión. El ángulo y la nitidez de la punta del catéter también deben estar en un rango moderado; una punta que es demasiado fuerte puede perforar la pared de la arteria, mientras que el dato de que es demasiado aburrido será difícil de insertar en la arteria. Las medidas indicadas aquí se obtuvieron utilizando diez semanas de edad, C57BL / 6J, de aproximadamente 20 g, como una plantilla modelo. Las mediciones deben ser escaladosarriba o hacia abajo para adaptarse empíricamente modelos individuales.
Aislamiento de la arteria carótida debe ser un proceso delicado, deliberada para evitar el daño innecesario al tejido y para prevenir el sangrado a gran escala. Subcutánea en grasa generalmente se puede separar fácilmente con fórceps afilados bajo a mediano. El tejido muscular sobre la carótida se debe separar con medio a fino fórceps de punta a lo largo del sesgo de las fibras musculares. Si una brecha más amplia es necesario, el técnico debe ser extremadamente cuidadoso para evitar la ruptura de pequeños vasos sanguíneos. Una vez que la carótida es visible, todavía habrá una buena cantidad de la fascia que necesita ser depiladas lejos de la arteria con una pinza de punta fina. Finalmente, el nervio vago debe ser separado de la arteria carótida sin dañar tampoco. Cuando la carótida se aísla adecuadamente, debería ser posible insertar la pinza por debajo, con un espacio vacío a ambos lados de la arteria (ver Figura 4E).
Cuando troutiro bles infusiones pobres, comienzan revisando las instrucciones de la bomba para asegurarse de que el investigador ha programado correctamente la bomba para suministrar la dosis prevista. Entonces, considere cuidadosamente cómo cambiar el volumen que se introduce en el animal de experimentación. La dilución de fármaco debe calcularse de modo que el volumen de dosificación es apropiado: el volumen no debe ser demasiado grande para que el animal tolere, e idealmente no afectará significativamente la presión arterial; sin embargo, el volumen debe ser lo suficientemente grande para la bomba para entregar de forma fiable, y se creará un flujo constante para evitar obstrucciones en los cruces. Si zuecos se convierten en una ocurrencia regular, considere la posibilidad de cambiar a un calibre más pequeño (diámetro más grande) de la aguja y el tubo. Además, si el contenido de fármaco en plasma no alcanza los niveles esperados, el investigador debe comprobar los ratones post mortem para determinar si el catéter se mantiene en buena posición en la arteria y de flujo libre, y modificar la forma / tamaño de catéter según sea necesario.
El usefulness de este método puede ser limitada por factores tales como el tamaño y la salud general del sujeto, y la duración prevista de tiempo de la infusión. La cirugía y la infusión pueden sobrecargar un tema ya en dificultades. Incluso en un animal sano, catéter en la arteria carótida sólo es apropiado para infusiones a corto plazo, generalmente varias horas a varios días. Considere lo que los métodos de alivio del dolor se utilizará si los ratones muestran signos de malestar en respuesta a la infusión de fármacos, tales como las aplicaciones repetidas de la anestesia tópica en heridas sitios, o analgésicos sistémicos preventivos. Será necesario disponer de todos los animales de trabajo aprobado por la organización reguladora de animales local o IACUC, para obtener los permisos correspondientes para llevar a cabo este procedimiento. Si es necesario disponer de una infusión más largo, o tener el ratón sobrevivió a la infusión durante un período prolongado de tiempo, los métodos de infusión alternativas deben ser exploradas.
Después de haber dominado la perfusión de la arteria carótida en el estudiode la farmacocinética de paclitaxel, tenemos la intención de utilizar esta técnica en el futuro para investigar los efectos de otras drogas, y moduladores ABCC10 en los otros modelos de ratones C57BL / 6J y ratones FVB, y.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Nos gustaría reconocer el Fondo FCCC Animales de Laboratorio, por su apoyo en este proyecto. Damos las gracias a Wolfe Laboratories, Inc. por su asistencia en el análisis de los niveles de paclitaxel en el plasma y el tejido. Esta labor fue apoyada por los Institutos Nacionales de Salud subvenciones K01CA120091 a EHB, y CA06927 a Fox Chase Cancer Center.
Materiales
| Name | Company | Catalog Number | Comments |
| Polyethylene tubing 0.024” OD X 0.011” ID | Braintree Scientific, Inc. | PE10 | |
| 3 Blunted needles (30 gauge) | Braintree Scientific, Inc. | NB-30 | |
| Stainless steel port plug (28 gauge) | Braintree Scientific, Inc. | PP-28 | Slightly larger than PE tubing ID, to fit snugly and keep a tight seal. |
| 2 Stainless steel connector plugs (30 gauge) | Braintree Scientific, Inc. | C-30 | |
| Three 1 cc syringes | Becton, Dickinson and Co. | 309659 | |
| Sterile 0.9% Saline solution | Hospira | 0409-7984-37 | |
| Cath-Loc HGS Heparin/Glycerol Solution | Braintree Scientific, Inc. | HGS | |
| Silk suture | Braintree Scientific, Inc. | SUT-S 113 | |
| Vanna Scissors (micro-scissors) | World Precision Instruments | 14122 | This model has a curved tip, but straight-tip scissors work as well. |
| Hartman Mesquito Hemostatic Forceps | World Precision Instruments | 501705 | |
| Betadine Swabsticks | Perdue Products L.P. | BSWS1S | |
| Bupivacaine | Hospira | 0409-1160-01 | May be replaced with Lidocaine, or similar local anesthesia. |
| Paclitaxel | LC Laboratories | P-9600 | |
| Methanol | Sigma-Aldrich | 32213 | |
| Micro-Hematocrit Capillary Tubes, Heparinized | Fisher Scientific | 22-362-566 | |
| Micro Capillary Tube Sealant | Fisher Scientific | 02-678 | |
| C57BL/6J mice | Fox Chase Cancer Center, Laboratory Animal Facility in-house-bred | ||
| API 4000 Q-Trap mass spetrometer | Applied Biosystems |
Referencias
- Gallo, J. M., Li, S., Guo, P., Ma Reed, K., J, The Effect of P-Glycoprotein on Paclitaxel Brain and Brain Tumor Distribution in Mice. Cancer Research. 63 (16), 5114-5117 (2003).
- Sonnichen, D. S., Relling, M. V. Clinical Pharmacokinetics of Paclitaxel. Clinical Pharmacokinetics. 27 (4), 256-269 (1994).
- Gianni, L., et al. Nonlinear Pharmacokinetics and Metabolism of Paclitaxel and Its Pharmacokinetic / Pharmacodynamic Relationship in Humans. Journal Clinical Oncology. 13 (1), 180-190 (1995).
- Sparreboom, A., Van Tellingen, O., Nooijen, W. J., Beijnen, J. H. Nonlinear Pharmacokinetics of Paclitaxel in Mice Results from the Pharmaceutical Vehicle Cremophor EL. Cancer Research. 56 (9), 2112-2115 (1996).
- Sparreboom, A., Van Tellingen, O., Nooijen, W. J., Beijnen, J. H. Determination of paclitaxel and metabolites in mouse plasma, tissues, urine and faeces by semi-automated reversed-phase high-performance liquid chromatography. Journal of Chromatography B: Biomedical Sciences and Applications. 664, 383-391 (1995).
- Bradshaw-Peirce, E. L., Eckhardt, S. G., Gustafson, D. L. A Physiologically Based Pharmacokinetic Model of Docetaxel Disposition: from Mouse to Man. Clinical Cancer Research. 13, 2768-2778 (2007).
- Eiseman, J. L., et al. Plasma Pharmacokinetics and Tissue Distribution of Paclitaxel in CD2F1 Mice. Cancer Chemotherapy and Pharmacology. 34 (6), 465-471 (1994).
- Schinkel, A. H., et al. Normal Viability and Altered Pharmacokinetics in Mice Lacking mdr1-type (drug-transporting) P-glycoproteins. Proc. Nat. Acad. Sci. USA. 94, 4028-4033 (1997).
- Fraser, I. J., Dear, G. J., Plumb, R., L’Affineur, M., Fraser, D., Skippen, A. J. The Use of Capillary High Performance Liquid Chromatography with Electrospray Mass Spectrometry for the Analysis of Small Volume Blood Samples from Serially Bled Mice to Determine the Pharmacokinetics of Early Discovery Compounds. Rapid Communications in Mass Spectrometry. 13 (23), 2366-2375 (1999).
- Bateman, K. P., et al. Reduction of Animal Usage by Serial Bleeding of Mice for Pharmacokinetic Studies: Application of Robotic Sample Preparation and Fast Liquid Chromatography – Mass Spectrometry. Journal of Chromatography B: Biomedical Sciences and Applications. 754 (1), 245-251 (2001).
- Berndt, K., Vogel, J., Buehler, C., Vogt, P., Born, W., Fuchs, B. A new method for repeated drug infusion into the femoral artery of mice. J. Am. Assoc. Lab Animal Sci. 51 (6), 825-831 (2012).
- . Squibb & Sons, L.L.C.. Drug Information for TAXOL (Paclitaxel) Injection. , (2011).
- . Abraxis BioScience L.L.C. Full Prescribing Information ABRAXANE for Injectable suspension (paclitaxel protein-bound particles for injectable suspension) (albumin-bound). , (2013).
- Fergusson, G., Ethier, M., Zarrouki, B., Fontés, G., Poitout, V. A Model of Chronic Nutrient Infusion in the Rat. J. Vis. Exp. (78), (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados