Method Article
Infusions de l'artère carotide pour pharmacocinétiques et pharmacodynamiques Analyse des taxanes chez la souris
Dans cet article
Résumé
Cette méthode a été développée dans le but de fournir une solution stable de médicament via l'artère carotide, pour évaluer la pharmacocinétique de nouveaux médicaments dans des modèles murins.
Résumé
Au moment de proposer l'utilisation d'un médicament, la combinaison de médicaments, ou l'administration de médicaments dans un nouveau système, il faut évaluer la pharmacocinétique du médicament dans le modèle d'étude. Parce que l'utilisation de modèles de souris sont souvent une étape essentielle dans la découverte de médicaments préclinique et le développement de médicaments 1-8, il est nécessaire de concevoir un système pour introduire des médicaments dans des souris dans une manière uniforme, reproductible. Idéalement, le système devrait permettre la collecte des échantillons de sang à intervalles réguliers au cours d'une évolution dans le temps de consigne. La capacité de mesurer les concentrations de médicament par spectrométrie de masse, a permis aux enquêteurs de suivre les changements dans les niveaux plasmatiques du médicament au fil du temps chez les souris individu 1, 9, 10. Dans cette étude, le paclitaxel a été introduit dans des souris transgéniques comme une perfusion artérielle continue sur trois heures, tandis que les échantillons de sang ont été prélevés en même temps par des saignements rétro-orbital à des instants de consigne. Infusions de l'artère carotide sont une alternative potentielle aux perfusions de veine jugulaire, lorsque des facteurs tels quetumeurs mammaires et d'autres obstacles infusions jugulaires impraticable. En utilisant cette technique, les concentrations de paclitaxel dans le plasma et les tissus ont atteint des niveaux similaires à celles obtenues à perfusion jugulaire. Dans ce tutoriel, nous allons démontrer comment son cathéter avec succès l'artère carotide par la préparation d'un cathéter optimisé pour chaque modèle de la souris, puis montrer comment insérer et fixer le cathéter dans l'artère carotide de souris, passer la fin du cathéter à travers l'arrière du cou de la souris, et brancher la souris à une pompe pour fournir une vitesse contrôlée de médicament afflux. Saignements rétro-orbital à faible volume multiples permettent l'analyse des concentrations plasmatiques du médicament au fil du temps.
Introduction
perfusion de médicament à travers la carotide peut être effectuée de manière fiable et reproductible en optimisant l'équipement et la technique. La procédure est complexe pas, même si elle ne nécessite un contrôle précis et une attention aux détails. Soins de qualité supérieure et la dextérité sont nécessaires pour isoler l'artère carotide et insérer le cathéter, qui peuvent généralement être acquis par la pratique. Chirurgie par un technicien expérimenté ne doit pas dépasser une heure. Après une chirurgie réussie, la souris doit être normal et en bonne santé (bien que la souris peut réagir à la perfusion réelle de la drogue), et la drogue (s) peut être administré dans un dosage continu uniforme contrôlée. Les échantillons de sang doivent être prélevés sur un site autre que l'artère carotide; saignements rétro-orbitaire été facile de recueillir et satisfaisante pour l'analyse des concentrations de médicament.
Cathéters de taille optimale et la forme sont un atout précieux dans la réalisation d'une perfusion de succès 11. Nous avons trouvé la cathéters disponible commercially souvent d'être trop grande et / ou trop souple pour permettre un accès facile à l'artère carotide de souris. Il est avéré préférable de cathéters de mode du tube de polyéthylène utilisé pour connecter la souris à la seringue de perfusion. Ainsi, tous les tubes, raccords et les aiguilles étaient de dimensions cohérentes, qui a simplifié ensemble d'infusion. En utilisant cette technique, il est nécessaire de pousser la pointe du cathéter dans l'artère au-delà du point où il est encore visible, et le flux sanguin dans l'artère carotide est pas restauré avant que le cathéter est initialement fixé. Cela réduit les risques de perforation de l'artère ou d'avoir le cathéter poussé par la haute pression du flux sanguin. La conception de cathéter document ne comporte pas de "bosse" pour le maintenir en place, en assurant ainsi le cathéter bien avec des sutures et ruban chirurgical est une priorité.
Infusions peuvent être préférables aux injections en bolus iv communs, comme un meilleur imitateur de l'administration clinique deles médicaments tels que les taxanes 3, 12, 13. La technique décrite ici a été initialement mis au point pour permettre une perfusion dans des modèles de souris, dans lequel l'accès à la veine jugulaire ou fémorale a été empêchée par la croissance de la tumeur mammaire et / ou la vascularisation excessive de la zone d'insertion. Cette méthode peut souvent être appropriée, même chez les souris sans tumeur: bien isoler et cathétérisme de la carotide est légèrement plus invasive, nous avons trouvé qu'il est préférable de la jugulaire, car la propension de la paroi jugulaire de ripper abouti à des insertions et des échecs pour mener à bien plus défaillants l'évolution dans le temps de trois heures.
Bien que les résultats présentés ici sont de C57BL / 6J (dans maison de race-) souris, nous avons utilisé cette technique pour insuffler avec succès paclitaxel dans plusieurs souches de souris, y compris FVB et mixtes souches, de suivre la pharmacocinétique chez des modèles de souris transgénique manipulés à réguler à la baisse fonctions transporteurs cellulaires. Les échantillons de sang et de tissus prélevés ont montré des niveaux attendus de paclitaxel, dans la gamme des niveaux observés après une perfusion jugulaire 1. Cette technique peut être appelé à travailler aussi bien dans d'autres modèles de souris et avec d'autres solutions pour perfusion.
Protocole
Ce protocole a été approuvé par le Comité institutionnel de protection Cancer Center et l'utilisation des animaux Fox Chase et par le Fonds des animaux de laboratoire, et jugée conformément aux directives institutionnelles pour le traitement sans cruauté des animaux.
1. Préparation préliminaire
- Préparation de la sonde: Préparer un cathéter à partir d'une courte longueur de tube en polyéthylène, modifié pour former un amincie, extrémité émoussée (figure 3A). Faire plusieurs cathéters à l'avance et économisez indéfiniment.
- Allumer un brûleur Bunsen, et ajuster à établir une faible flamme stable. Tenez tube à proximité de flamme pour adoucir polyéthylène. Quand tube commence à fondre, tirez lentement à part les deux extrémités pour créer une section amincie de tubes, d'environ 0,25 mm de diamètre extérieur.
- Couper une extrémité biseautée environ 0,75 cm le long de la section mince. Cela garantit suffisamment tube pour être fixé dans l'artère, sans créer une trop longue cathéter.
REMARQUE: Une fin longue et fine sur ee cathéter a une propension à se boucher. Une trop longue fin peut également détenir suffisamment de liquide pour modifier de façon significative la capacité de volume de liquide du cathéter. - Émousser l'extrémité biseautée en passant rapidement à travers la flamme - quand bien chauffée, la fin devient légèrement arrondie et élargie. Les crochets pointe légèrement vers l'arrière, ce qui contribue à ancrer le tube tout en insérant dans l'artère.
- Couper les 6,0 cm tube du moment où il commence à mince. Ce qui fait un cathéter très maniable, qui est assez long à enfiler grâce à la sortie de la nuque et de détenir et de travailler avec confortablement, mais assez court pour empêcher la souris de ronger sur l'excès de tubes ou nécessitant trop de volume de perfusion supplémentaire pour effacer saline initiale .
- Préparer une seringue d'environ 0,2 ml de solution d'héparine, surmonté d'une aiguille émoussée. Insérer l'aiguille dans la large extrémité du cathéter (figure 3B). Remplissez cathéter avec de l'héparine, en prenant soin de s'assurer qu'il n'y a pas de bulles dansle tube. Régler la seringue d'héparine et le cathéter de côté sur une zone stérile. Stériliser cathéters par irradiation gamma, en plaçant un cathéter (s) dans une boîte de Pétri, et l'exposition de 20 Gy de rayonnement gamma. Si vous ne disposez pas d'un accès à une source de rayonnement gamma, vérifiez auprès de votre animalerie pour étudier d'autres moyens de stérilisation, tels que gaz ou produits chimiques stérilisation. Ne autoclave, le polyéthylène peut pas être stérilisée à la chaleur.
- Création d'une solution saline de plomb (figure 3B).
- Préparer une deuxième seringue de 0,5 ml environ de solution saline stérile, en prenant soin de garantir une ligne sans bulles.
- Coupez un deuxième morceau de tube, environ 15 cm, et glisser sur l'aiguille de la seringue émoussée. Fixer un orifice de raccord à l'extrémité libre de la tubulure.
- Testez que le flux de solution saline est dégagée par douceur avancer un petit volume de solution saline à travers la tête. Utilisez cette solution saline plomb après l'insertion du cathéter, pour vérifier le débit à traversle cathéter, et pour rincer la ligne de sang. Régler la seringue de solution saline de côté sur une zone stérile.
- Avant la chirurgie, le matériel stériliser par autoclavage, ou encore par stérilisation au gaz ou la stérilisation à la bille de verre.
- Préparer zone chirurgicale stérile.
- Nettoyer les surfaces de banc et au microscope avec un désinfectant tel que l'éthanol 70% ou le dioxyde de chlore. Couvrir banc et base de microscope avec un tampon propre absorbant jetable.
- Préparer un conseil chirurgicale en couvrant avec deux couches de papier absorbant propre solidement fixés avec du ruban adhésif.
- Disposez toutes les fournitures chirurgicales (comme catalogué dans la liste des matériaux), de sorte qu'ils soient facilement accessibles.
- Coupez trois longueurs de suture stérile, 8 cm chaque, et mettre de côté d'autres fournitures. Placez un port où il sera facilement disponible (figure 3B).
2. Chirurgie
- Préparation de l'animal
- Anesthetize souris par exposition à 2-3% d'isoflurane dans la chambre anesthésie reliée à la précision vaporisateur. Retirer la souris de la chambre, et raser les poils du cou / torse de la souris, et au-dessous de l'oreille droite (site de sortie du cathéter). Administrer vétérinaire vaseline pommade ophtalmique pour les yeux pour prévenir la sécheresse alors que sous anesthésie. Assurer que l'animal ne se réveille pas pendant les préparatifs chirurgicales en permettant souris suffisamment de temps dans la chambre d'inhalation avant préparation (au moins deux minutes), ou par l'administration de l'isoflurane à la souris au moyen d'un cône de nez au cours de préparation. Retour à la souris chambre anesthésie.
- Lorsque la souris est suffisamment inerte, placer dans une zone chirurgicale stérile, placez nez anesthésie cône sur le nez et la bouche de la souris, et dévier le flux de l'isoflurane à cône. Confirmez anesthésie appropriée en pinçant la patte avec une pince; lorsque la souris ne montre aucune réaction, procéder à l'étape suivante.
- Placez la souris sur le dos, la tête tournée vers laenquêteur. Fixez les oreilles, les pattes de devant et de derrière-pattes à bord chirurgicale avec du ruban adhésif ou autre dispositif de retenue pour maintenir la souris stable. Nettoyez la zone d'incision avec de la povidone-iode et 70% d'éthanol.
- L'isolement de l'artère carotide
- Faire un 1 cm coupe longitudinale légèrement vers la droite de la ligne médiane du cou. Utiliser des pinces pour séparer la graisse et le muscle afin d'exposer la trachée (figure 4A). Localiser l'artère carotide parallèle à la trachée (figure 4B).
- Soigneusement utiliser une pince à fascia distinct recouvrant l'artère (figure 4C). Tirez légèrement le nerf vague en dehors de la carotide, et insérer une pince dans l'espace entre les deux. Pince doucement ouvertes pour créer une lacune dans le fascia, et tirez doucement loin le nerf de l'artère, de la fourche dans l'artère près du larynx (partie antérieure), jusqu'à (postérieur) autant que possible (au moins 3 mm) ( Figure 4D).
- Dégagez tout rerestant fascia jusqu'à l'artère est bien isolée (figure 4E). Ajouter une goutte de solution saline à la surface de la chirurgie de temps en temps pour maintenir un tissu humide, et donc moins fragile et moins sujet à la déchirure de façon aléatoire.
- placement de suture et de la préparation de l'artère pour l'insertion du cathéter (figures 4, 5).
- Utilisez une pince pour tirer un fil de suture de soie sous l'artère. Faire un nœud sécurisé à fermer l'artère autant vers la partie antérieure que possible (figure 4F).
- Dessinez un second fil sous l'artère. Faire un nœud rétractable de fermer temporairement l'artère autant vers le postérieur que possible (figure 4F).
- Dessinez un troisième fil sous l'artère. Faire un nœud très lâche entre les deux premiers points de suture, à être utilisé pour sécuriser rapidement le cathéter après le placement (figure 4G).
- Maintenir extrémités de tous les fils de suture à l'écart en les mouillant avec un peu d'éthanol à 70%.
- insertion du cathéter
- Avec la suture, prenez le noeud inférieur à tirer l'artère légèrement tendu. Nick l'artère au-dessus, mais très proche de la suture antérieure (Figure 4H). Veillez à ne pas couper trop profondément, mais vérifier la fente pour vous assurer que l'ouverture est dégagée.
- Retirer cathéter d'héparine-rempli de l'aiguille de la seringue, en essayant d'éviter la création de grandes poches d'air à chaque extrémité. Manipuler le cathéter à la coupe en biseau à un angle confortable, généralement vers le bas, et un peu à droite (pour les droitiers).
- Tout en tenant à la suture pour maintenir l'artère restant légèrement tendu, insérer doucement cathéter dans la fente (figure 4E). Utilisez la pince pour tenir la suture antérieure et tirez vers le bas sur l'artère un cathéter (poussant trop avec le cathéter peut provoquer l'extrémité biseautée pour percer l'artère). Relâcher doucement le cathéter et antérieure suture.
- Sécurisation de cathéter et l'initiation de la circulation sanguine (Les figures 4J, 5B).
- Fixer le cathéter en serrant le nœud de la suture médiane, à proximité de l'entrée du cathéter dans l'artère. Faire un nœud triple serré, mais veillez à ne pas tirer trop serré pour obstruer la circulation à travers le cathéter. Sécuriser davantage le cathéter en l'attachant vers le bas avec la suture antérieure, au-dessous de l'entrée de l'artère.
- Attacher le fil d'une solution saline au cathéter au moyen de la fiche de connecteur, à nouveau essayer d'éviter l'introduction de bulles d'air dans la ligne.
- Saisir les extrémités de la suture postérieure et tirez doucement pour le noeud. Manœuvrer la suture vers le bas de l'artère, sur l'extrémité du cathéter (ne pas enlever le fil). Le sang doit couler dans le cathéter; si il n'y a pas de flux de sang, remuer doucement cathéter pour tenter d'éliminer la constriction.
- Lorsque le débit semble dégagée, utiliser le dernier fil (de la suture postérieure) pour attacher un nœud supplémentaire, légèrement au-dessus de la suture milieu.
- Temporary étanchéité de cathéter. Rincer le cathéter de sang, puis utiliser une pince hémostatique pour serrer l'extrémité du cathéter à proximité de la fiche de connecteur. Retirez le connecteur et le remplacer par le bouchon de l'orifice à obturer l'extrémité du cathéter, et enlever la pince hémostatique.
- Repositionnement cathéter pour quitter l'arrière du cou.
- Avec des pinces dans chaque main, utiliser une paire de pinces pour tenir le cathéter juste en dessous de la suture antérieure, et de l'autre, appuyez sur un coude dans le cathéter de sorte qu'il sera facilement plier sur le côté. Répétez l'opération pour créer un deuxième coude. Cela permet à l'extrémité libre du cathéter d'être tiré vers l'arrière de la tête de la souris, sans forcer la pointe du cathéter à tourner latéralement contre la paroi de l'artère.
- Retournez la souris sur son (à gauche), en gardant le cône de nez positionné sur la bouche et le nez, et nettoyer la zone d'incision avec 70% d'éthanol et povidone-iode. Faire une petite incision (environ 4 mm) au-dessous et derrière l'oreille droite.
- Utilisez une pince pour maintenir le rabat ouvert de la peau, tout en travaillant la sonde creuse émoussé sous la peau pour créer un canal à travers la joue, à la cavité au niveau du cou. Il est conseillé d'apporter de la sonde autour de la glande salivaire, au lieu d'essayer d'aller entre la glande et la peau. Utiliser des pinces afin de libérer un espace pour le soin de la sonde pour sortir.
- Enfilez le port connecteur / cathéter par sonde à quitter dans le cou. Ne tirez pas trop fort; être sûr que le cathéter est pas écrasant ou la constriction des vaisseaux sanguins ou d'organes.
- Fermeture et la récupération. Administrer analgésique topique (par exemple de bupivacaïne) à l'incision de l'épaule, et recouvrir la plaie avec de l'eau à l'épreuve, ruban adhésif chirurgical. Appliquer une deuxième morceau de ruban adhésif pour sécuriser davantage le cathéter.
- Administrer analgésique topique à la poitrine incision, et près plaie avec de la soie ou des agrafes.
- Retirer la souris de l'anesthésie, et permet de récupérer l'animal dans un endroit propre, chauffée espace (lieu cage sur le dessus d'un coussin chauffantou sous une lampe de chaleur), pendant au moins 30 min.
3. Infusion
- Préparer des aliquots de 5 mg / ml de solution de paclitaxel / méthanol.
- Mesurer 50 mg de paclitaxel dans un tube de centrifugeuse de 15 ml. Ajouter 10 ml de methanol stérile. Tube Cap. Faire tourner à la main ou sur un agitateur rotatif à la température ambiante jusqu'à ce que la poudre soit dissoute.
- Aliquote de 500 pi de solution dans des tubes de sécurité 20 petit, congélateur, et conserver à -20 ° C.
- Aliquote ne décongeler à température ambiante ou à 37 ° C bain d'eau, immédiatement avant la perfusion.
- Préparation de la pompe à perfusion (Figure 6).
- Couper une grande longueur de tube en polyéthylène d'environ 40 cm. Attacher une aiguille émoussée à une extrémité, et un orifice de raccord à l'autre.
- Etablir médicament dans une seringue avec un diamètre intérieur connu (la plupart des pompes programmables, il faudra le diamètre du cylindre de la seringue, afin de calculer la vitesse de the bras de la pompe). Fixer l'aiguille de la seringue et de charger le médicament à travers l'aiguille et le tube.
- Situer la seringue dans la pompe conformément aux instructions du fabricant. Amorcer la pompe de sorte que le médicament est fluide à la fiche de connecteur, et il est prêt pour l'injection.
- Fixez la souris à la pompe.
- Maintenez la souris régulière et utiliser la pince hémostatique pour serrer cathéter, à proximité de la prise du port. Retirer le bouchon et remplacer le connecteur fixée à la seringue et le tube.
REMARQUE: Le sang peut commencer à refluer à travers un tube. - Administrer rapidement une pompe rapide pour effacer le volume du cathéter (calculé empiriquement en observant le volume de 6 cm de tube), puis passer immédiatement à la vitesse de perfusion souhaité.
- Maintenez la souris régulière et utiliser la pince hémostatique pour serrer cathéter, à proximité de la prise du port. Retirer le bouchon et remplacer le connecteur fixée à la seringue et le tube.
- Continuer Paclitaxel pour perfusion cours de temps de trois heures.
- Surveiller tube de temps en temps pour vérifier les fuites au niveau des jonctions comme cela est souvent le signe d'un blocage dans la circulation de la souris.Regardez la souris pour les réactions attendues ou inattendues à perfusion (léthargie ou hyperactivité, des signes d'inconfort).
- Selon la longueur et la nature de la perfusion, la souris peut ne pas manger ou boire, mais assurez-vous de fournir l'accès à la nourriture et de l'eau conformément à la politique établie de l'institution. Soyez conscient du risque de déshydratation de la souris grâce à la collecte de grandes quantités de sang.
- Continuer à garder la cage chaud avec un coussin chauffant ou une lampe, à moins que la souris semble vouloir rester à l'écart de la chaleur. Si l'animal est euthanasié pas au sein de plusieurs heures après la chirurgie, de mettre en œuvre un plan pour le traitement post-chirurgical de l'animal, y compris les conditions de logement stériles et de traitement de la douleur post-chirurgicale.
- Gardez un œil sur la souris, en particulier au cours des premières minutes, pour assurer qu'il ne tirez pas sur le tube à travers l'hyperactivité, ou l'irritation de tubes (qui peut être un signe d'une mauvaise insertion). Si la souris ne soit pas trop actif, monito constantanneau peut ne pas être nécessaire, mais il faut vérifier régulièrement la souris pour être sûr que l'animal ne soit pas emmêlé dans le tube. Harnais et système d'attache sont disponibles dans le commerce, mais leur utilisation est au-delà de la portée de ce protocole.
- La collecte d'échantillons.
- Prélever des échantillons de sang à intervalles réguliers par des saignements sous-maxillaires ou rétro-orbitaire (Si votre protocole ne fait pas usage de modèles de tumeurs mammaires, pensez collecte de sang via un cathéter jugulaire inséré en même temps que le cathéter de la carotide). Veillez à ne pas tirer sur la ligne de perfusion. Si la collecte par des saignements rétro-orbitaire, anesthésier légèrement la souris avec un anesthésique par inhalation (par exemple methoxyflurane) si on ne doit pas attraper par la peau pour assurer la souris.
- Produit dérivé du sang à hématocrite centrifugation pour séparer les cellules de sang du plasma. Utilisez un stylo de fichier ou pointe de diamant pour marquer le tube à face de séparation de phase. Pause tube et recueillir le plasma seulement, en petit tube, congélateur-coffre-fort. Stocker à -80 ° C jusqu'à l'analyse.
REMARQUE: Si une centrifugeuse à hématocrite ne sont pas disponibles, transférer l'échantillon de sang dans le tube de micro-centrifugeuse, et de spin dans une micro-centrifugeuse à haute vitesse pour séparer les cellules sanguines du plasma. Recueillir plasma dans un second tube, et stocker à -80 ° C. - Euthanasier souris par asphyxie au CO2. Recueillir tissu (environ 20 à 50 mg) à partir d'organes d'intérêt et gel rapide dans l'azote liquide. Conserver à -80 ° C jusqu'à l'analyse.
4. Analyse de l'échantillon
REMARQUE: Tous les échantillons de ce protocole ont été analysés par un laboratoire extérieur par chromatographie en phase liquide-spectrométrie de masse (LC - MS / MS), les concentrations de paclitaxel qui calcule comme suit:
- Extrait du paclitaxel à partir d'échantillons. Homogénéiser l'échantillon de tissu dans de l'acide acétique à 0,1%, methanol à 50% avant l'extraction. Extrait paclitaxel par extraction liquide / liquide, en utilisant de l'éther méthyl-tert-butyle (MTBE) fortifiée avec un analogue interne (docétaxel) standard. Retirer le MTBE et des échantillons secs. Remettre en suspension dans 50% d'acétonitrile, une solution d'acide acétique à 0,1%.
- Préparer des standards d'étalonnage. Ajouter une concentration connue de paclitaxel à affecter des souris C57BL / 6 pour obtenir une matrice finale gamme de standards (de 1 à 20000 ng / ml pour des échantillons de plasma, de 0,1 à 5000 ng / ml pour des échantillons de tissus). Extraire les normes en double, en utilisant la même méthode que pour les échantillons de l'étude ci-dessus. Mesurer paclitaxel pic dans les échantillons par HPLC / MS / MS en utilisant l'ionisation électrospray.
- Calculer la concentration en utilisant le rapport de surface de paclitaxel à étalon interne. Utilisation des étalons pour créer une courbe d'étalonnage et les échantillons d'étude interpolées par ajustement de la courbe. Normaliser concentration des échantillons de l'étude par le poids de départ de l'échantillon avant l'homogénéisation.
Résultats
Répartition de paclitaxel suit modèles prévisibles pendant 3 heures un schéma posologique d'une injection à grande vitesse 15 min, suivie d'une perfusion à faible vitesse de 165 min.
La figure 1 montre une comparaison de la veine-perfusion de paclitaxel concentrations de plasma jugulaire et l'artère carotide-infusions. Les concentrations de paclitaxel tombent rapidement dans les 15 premières minutes après une perfusion de grand volume initial, puis se stabilisent au cours de la prochaine 150 min. Par comparaison, les taux de paclitaxel dans une mauvaise perfusion commencent relativement faible, et oscillent de haut en bas tout au long de l'essai. Ceci a été probablement dû à une obstruction dans la conduite au début de la perfusion. Archives de l'essai montrent la souris avait peu ou pas de réaction externe à la perfusion, ce qui corrobore l'idée d'une administration inférieure du médicament. La figure 2 illustre les niveaux relatifs de paclitaxel dans le foie et les tissus du cerveau, ainsi que le plasma sanguin, à la fin de la perfusion de 3 heures.
jove_content "fo: keep-together.within page =" always ">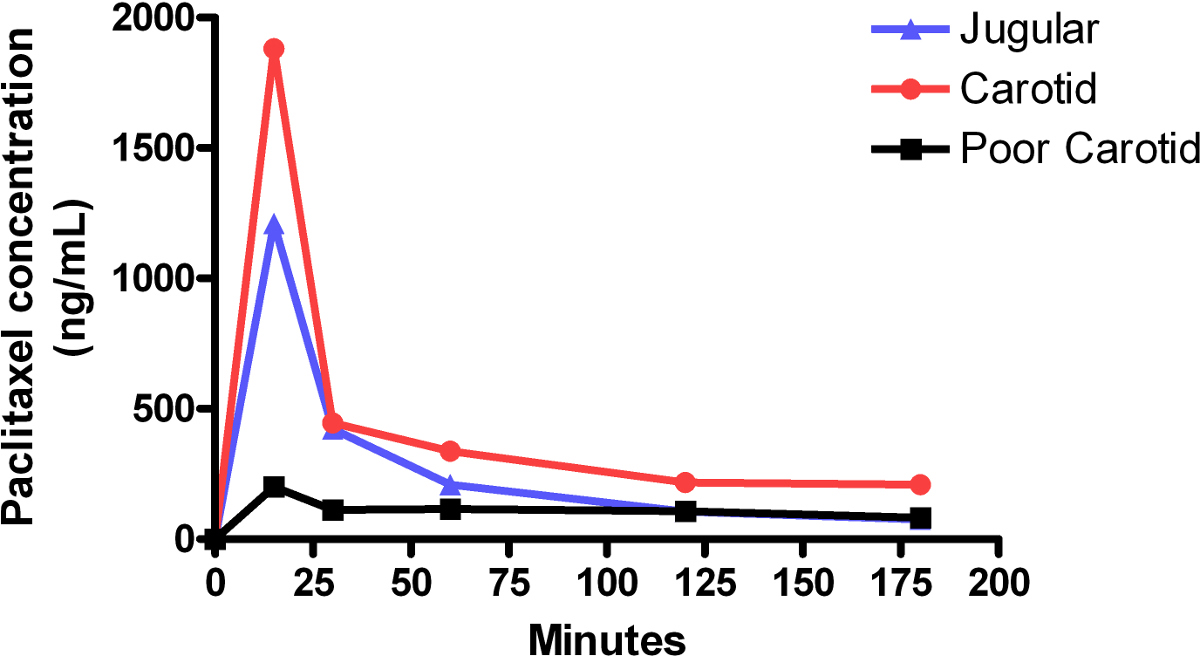
Figure 1:. Niveaux de paclitaxel plasma pendant la carotide et la jugulaire infusions courbes représentent les concentrations de paclitaxel plasmatiques chez des souris individuelles. Chaque souris a reçu une injection biphasique, constitué d'une grande vitesse initiale, 15 min de perfusion de 0,42 mg / kg / min, suivie immédiatement par une faible vitesse de perfusion de 165 min 0.021mg / kg / min. L'aire sous la courbe (AUC) pour la perfusion de la carotide a été d'environ 59 pg / ml ∙ min par rapport à une AUC pour perfusion jugulaire d'environ 37 pg / ml ∙ min. La demi-vie de paclitaxel calculé à partir des courbes obtenues pour la perfusion de la carotide a été de 10 min pour la perfusion et la jugulaire a été de 11 min. Perfusion carotidienne montre approximativement des niveaux équivalents de la concentration du médicament par rapport à perfusion jugulaire. De faibles concentrations en continu, ou les concentrations de ce cycle de haut en bas, souvent represent une perfusion pauvres.

Figure 2:. La concentration en paclitaxel tissu Immédiatement après la perfusion de 3 heures, le paclitaxel et la collecte de la dernière prise de sang, la souris a été euthanasiée, et des échantillons de foie et de tissu cérébral ont été recueillies. des niveaux de concentration de paclitaxel dans le plasma et les tissus ont été acquis par l'analyse de masse-spec. Ces données représentent des échantillons prélevés dans la carotide à la perfusion de la souris dans la figure 1.
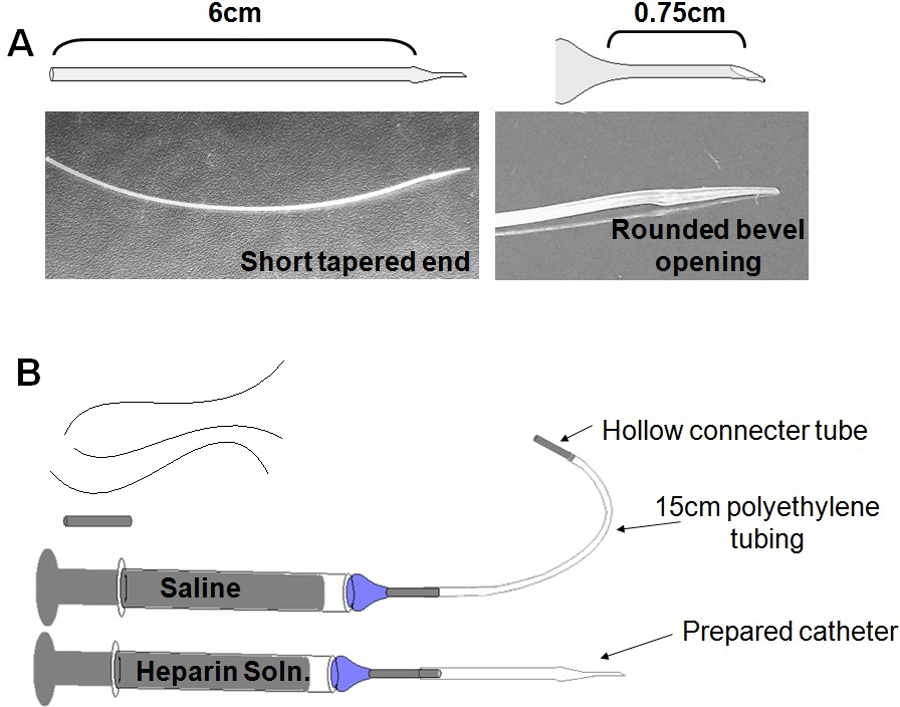
Figure 3: attirail chirurgical. (A) Cathéter Production: Tirer ceux propres cathéters ne cesse de descendre dépenses matérielles, tout en permettant la rechercheur à adapter la taille et la forme du cathéter à l'âge de la souris et la taille (B) Préparer avant la chirurgie. Trois (3) points de suture de soie, d'environ 8 cm chacun; Bouchon de l'orifice stérile; Saline seringue et le plomb; Cathéter, attaché à l'héparine seringue.
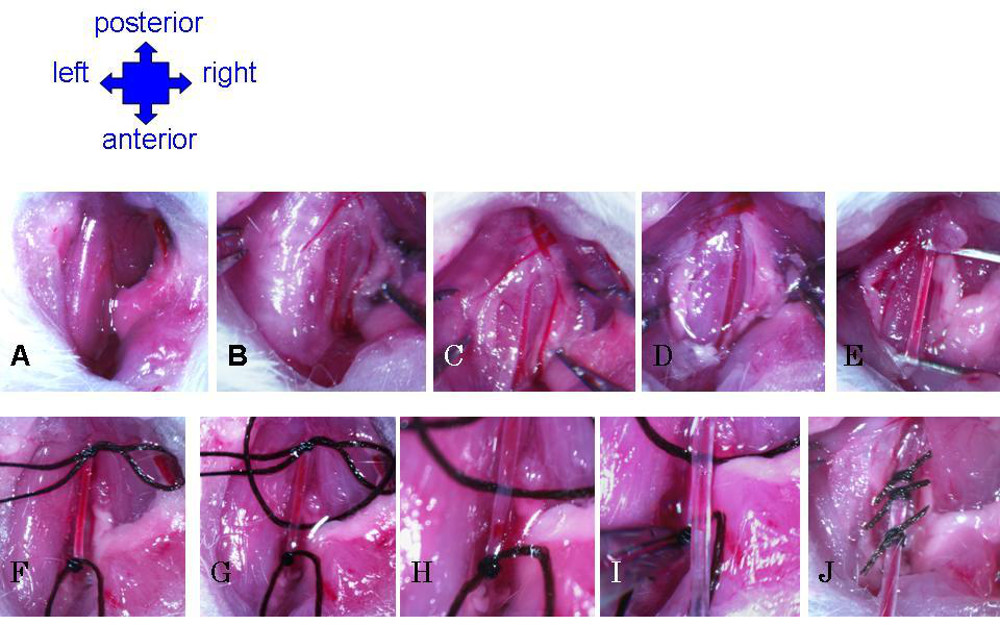
Figure 4: Préparation de l'artère carotide, et l'insertion du cathéter. (A) Couper à travers la peau, écarter les glandes et d'utiliser des pinces à grossièrement séparé graisse pour exposer le muscle. (B) l'utilisation des forceps pour doucement muscle séparé pour exposer côté droit de la trachée. L'artère carotide deviendra visible comme le plus grand, vaisseaux à parois épaisses, parallèle à la trachée. (C) Pause fascia autour de l'artère. (D) nerf vague séparée de l'artère carotide. (E) Continuez à supprimer fascia jusqu'à Carotid est complètement isolé le long de la cavité. (F) Suture noeud permanent à l'extrémité antérieure, et nœud coulant à l'extrémité postérieure. (G) Troisième suture est enfilé sous la carotide et très noué de manière lâche. (H) de l'artère est entaillé juste au-dessus antérieure suture. ( I) Insérez cathéter dans l'artère entaille dans. Prenez suture antérieure avec une pince pour tirer vers le bas sur l'artère un cathéter. (J) cathéter dans l'artère carotide sécurisé avec les trois points de suture.
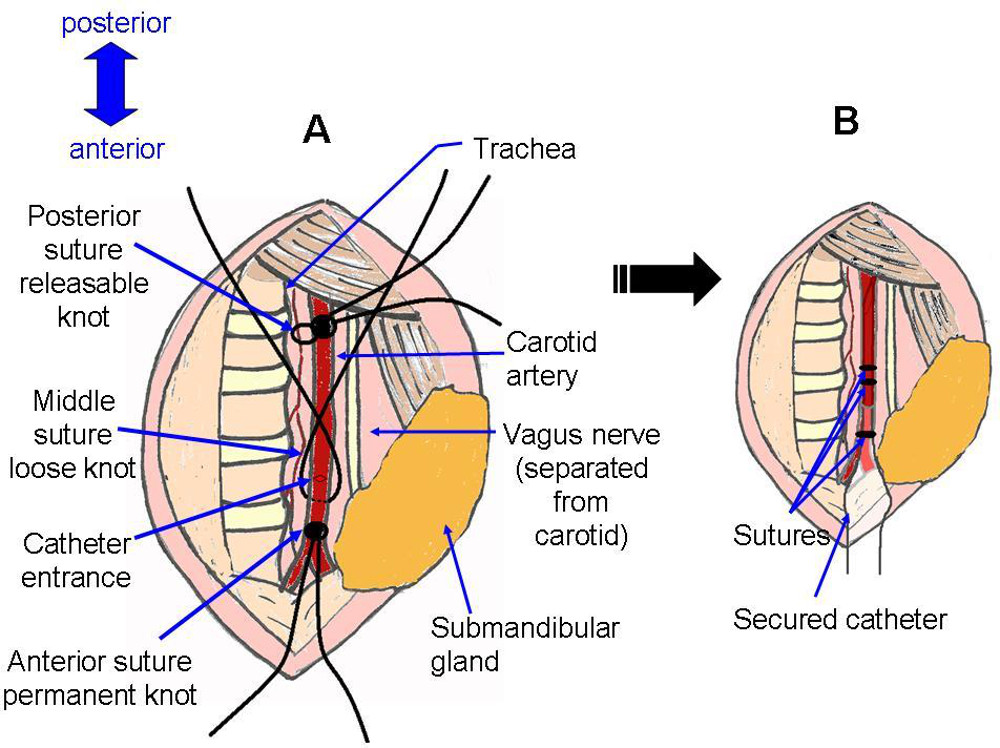
Figure 5:.. Placement de suture représentation schématique du site chirurgical avant et après l'installation, un cathéter correspond photo figure 4G, avec l'ajout d'une entaille dans l'artère, comme dans la figure 4H. B correspond photo figure 4J.
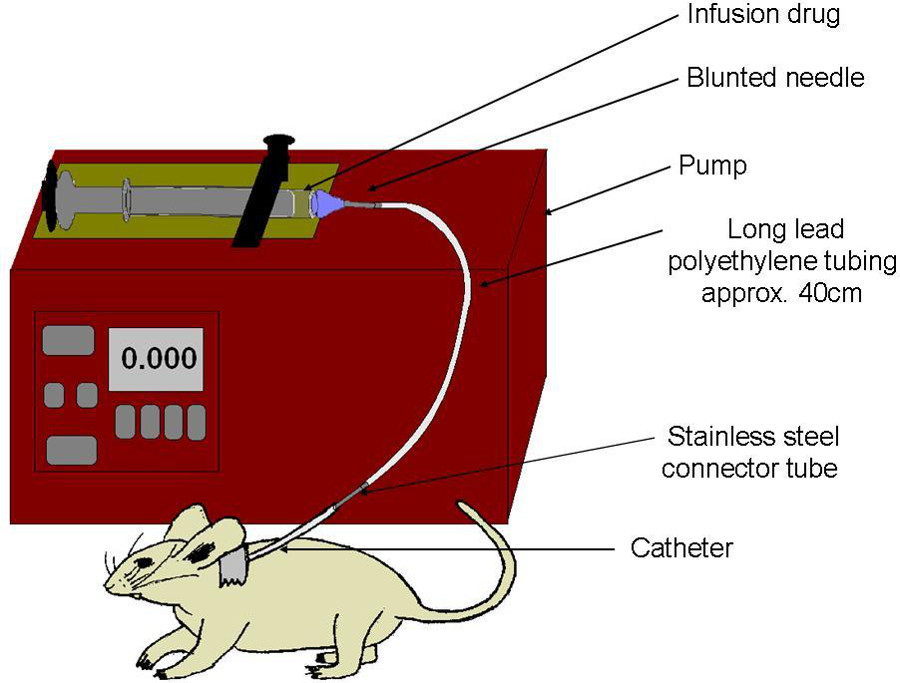
Figure 6:. Schéma de perfusion set-up seringue est remplie avec la drogue, et coiffé d'une aiguille émoussée. ligne de polyéthylène attache seringue à la carotide cathéter. Pompe comprime lentement seringue, à livrer dose unique, directement dans la circulation sanguine.
Discussion
Perfusion de l'artère carotide est une technique importante dans cette étude de pharmacocinétique du paclitaxel. Perfusion de l'artère carotide est une méthode pour distribuer rapidement drogue dans tout le système circulatoire 14. La perfusion de 3 heures est un synoptique plus proche de l'administration clinique des médicaments tels que les taxanes que les injections de bolus. La chirurgie peut être réalisée de manière fiable par une seule personne, le temps de chirurgie est relativement courte, et les taux de réussite sont> 75%. Après échantillons sont prélevés, ils doivent être analysés par les méthodes appropriées. Nous avons utilisé la spectrométrie de masse pour déterminer la concentration en paclitaxel dans des échantillons de plasma et de tissus. Afin de valider cette technique, nous avons envoyé des échantillons de sang et de tissus à un laboratoire indépendant pour analyse. Ces données ont été tracées sous forme de courbes individuelles de concentration plasmatique-paclitaxel pour chaque animal testé (figure 1), et la distribution du paclitaxel a été comparé dans les différents tissus (figure 2). Dans chaque cas, il est importante pour déterminer la meilleure méthode pour analyser la distribution et / ou le métabolisme de médicament, en fonction du médicament et d'un système d'intérêt. Autres options pour la mesure de différents médicaments peuvent inclure HPLC-UV ou des immunoessais 2.
Deux principaux facteurs essentiels pour la réussite de cathétérisme carotide sont bien cathéters façonné et l'isolement de l'artère supérieure. Façonner cathéters selon la taille du modèle de la souris est primordiale. Si le diamètre du cathéter est trop épaisse, l'insertion dans l'artère sera trop difficile, alors qu'un cathéter trop mince sera plus difficile à obtenir et susceptibles d'obstruer avant ou pendant la perfusion. L'angle et la netteté de l'extrémité du cathéter doivent également être dans une gamme modérée; une pointe qui est trop forte peut perforer la paroi de l'artère, tandis qu'une pointe qui est trop terne sera difficile à insérer dans l'artère. Les mesures indiquées ont été calculées à l'aide de dix semaines C57BL / 6J, environ 20 g, comme un modèle de modèle. Les mesures doivent être mises à l'échellehaut ou le bas de façon empirique pour ajuster des modèles individuels.
Isolement de l'artère carotide doit être un processus délibéré délicat pour éviter des dommages inutiles aux tissus et à prévenir les saignements à grande échelle. Sous-cutanée en gras peut généralement être facilement séparé de faible à pinces acérées moyennes. Le tissu musculaire sur la carotide doit être séparé avec moyenne à fine pince à pointe le long du biais des fibres musculaires. Si un écart plus large est nécessaire, le technicien doit être extrêmement prudent pour éviter la rupture de petits vaisseaux sanguins. Une fois la carotide est visible, il y aura encore une bonne quantité de fascia qui doit être tweezed loin de l'artère avec pince fine à pointe. Enfin, le nerf vague doit être séparé de l'artère carotide sans endommager soit. Lorsque la carotide est correctement isolé, il doit être possible d'insérer la pince en dessous, avec un espace libre de chaque côté de l'artère (voir Figure 4E).
Lorsque troubles de tir infusions pauvres, commencent par examiner les instructions sur la pompe pour être sûr que l'enquêteur a programmé correctement la pompe pour fournir la dose prévue. Ensuite, examiner attentivement l'évolution du volume qui sera introduit dans l'animal d'essai. La dilution de la drogue doit être calculée de sorte que le volume de dosage est approprié: le volume ne doit pas être trop grande pour que l'animal tolère, et, idéalement, ne sera pas affecter de manière significative la pression artérielle; encore le volume doit être suffisamment grand pour que la pompe fiable la livraison, et va créer un flux constant d'éviter les sabots au niveau des jonctions. Si sabots deviennent un événement régulier, envisager de passer à un plus petit calibre (diamètre supérieur) aiguille et tube. En outre, si la teneur en médicament de plasma ne possèdent pas les niveaux attendus, le chercheur doit vérifier les souris post mortem pour déterminer si le cathéter reste bien placé dans l'artère et à écoulement libre, et modifier la forme / taille de cathéter comme nécessaire.
Le usefulness de cette méthode peut être limitée par des facteurs tels que la taille et de la santé générale du sujet, et la longueur prévue du temps de la perfusion. La chirurgie et la perfusion peuvent surcharger un sujet déjà en difficulté. Même chez un animal en bonne santé, le cathéter de l'artère carotide est uniquement approprié pour des perfusions de courtes durée, généralement de plusieurs heures à plusieurs jours. Pensez à ce que les méthodes de soulagement de la douleur sera utilisé si les souris montrent des signes d'inconfort en réponse à la perfusion de médicaments, tels que des applications répétées de l'anesthésie topique pour les plaies sites, ou des analgésiques systémiques de préemption. Il sera nécessaire d'avoir tous les travaux animale approuvé par l'organisme de réglementation local pour animaux ou IACUC, pour obtenir les autorisations appropriées pour effectuer cette procédure. Si il est nécessaire d'avoir une infusion plus, ou à la souris ont survécu à la perfusion pendant une période de temps prolongée, des méthodes d'infusion de substitution doivent être explorées.
Après avoir maîtrisé les perfusions de l'artère carotide dans l'étudede la pharmacocinétique du paclitaxel, nous envisageons d'utiliser cette technique dans l'avenir pour étudier les effets d'autres médicaments, et des modulateurs Abcc10 dans le C57BL / 6J et souris FVB, et d'autres modèles de souris.
Déclarations de divulgation
Les auteurs ont rien à divulguer.
Remerciements
Nous tenons à remercier le Fonds FCCC des animaux de laboratoire pour leur soutien dans ce projet. Nous remercions Wolfe Laboratories, Inc. pour leur aide dans l'analyse des niveaux de paclitaxel dans le plasma et les tissus. Ce travail a été soutenu par les Instituts nationaux de la santé accorde K01CA120091 à EHB et CA06927 à Fox Chase Cancer Center.
matériels
| Name | Company | Catalog Number | Comments |
| Polyethylene tubing 0.024” OD X 0.011” ID | Braintree Scientific, Inc. | PE10 | |
| 3 Blunted needles (30 gauge) | Braintree Scientific, Inc. | NB-30 | |
| Stainless steel port plug (28 gauge) | Braintree Scientific, Inc. | PP-28 | Slightly larger than PE tubing ID, to fit snugly and keep a tight seal. |
| 2 Stainless steel connector plugs (30 gauge) | Braintree Scientific, Inc. | C-30 | |
| Three 1 cc syringes | Becton, Dickinson and Co. | 309659 | |
| Sterile 0.9% Saline solution | Hospira | 0409-7984-37 | |
| Cath-Loc HGS Heparin/Glycerol Solution | Braintree Scientific, Inc. | HGS | |
| Silk suture | Braintree Scientific, Inc. | SUT-S 113 | |
| Vanna Scissors (micro-scissors) | World Precision Instruments | 14122 | This model has a curved tip, but straight-tip scissors work as well. |
| Hartman Mesquito Hemostatic Forceps | World Precision Instruments | 501705 | |
| Betadine Swabsticks | Perdue Products L.P. | BSWS1S | |
| Bupivacaine | Hospira | 0409-1160-01 | May be replaced with Lidocaine, or similar local anesthesia. |
| Paclitaxel | LC Laboratories | P-9600 | |
| Methanol | Sigma-Aldrich | 32213 | |
| Micro-Hematocrit Capillary Tubes, Heparinized | Fisher Scientific | 22-362-566 | |
| Micro Capillary Tube Sealant | Fisher Scientific | 02-678 | |
| C57BL/6J mice | Fox Chase Cancer Center, Laboratory Animal Facility in-house-bred | ||
| API 4000 Q-Trap mass spetrometer | Applied Biosystems |
Références
- Gallo, J. M., Li, S., Guo, P., Ma Reed, K., J, The Effect of P-Glycoprotein on Paclitaxel Brain and Brain Tumor Distribution in Mice. Cancer Research. 63 (16), 5114-5117 (2003).
- Sonnichen, D. S., Relling, M. V. Clinical Pharmacokinetics of Paclitaxel. Clinical Pharmacokinetics. 27 (4), 256-269 (1994).
- Gianni, L., et al. Nonlinear Pharmacokinetics and Metabolism of Paclitaxel and Its Pharmacokinetic / Pharmacodynamic Relationship in Humans. Journal Clinical Oncology. 13 (1), 180-190 (1995).
- Sparreboom, A., Van Tellingen, O., Nooijen, W. J., Beijnen, J. H. Nonlinear Pharmacokinetics of Paclitaxel in Mice Results from the Pharmaceutical Vehicle Cremophor EL. Cancer Research. 56 (9), 2112-2115 (1996).
- Sparreboom, A., Van Tellingen, O., Nooijen, W. J., Beijnen, J. H. Determination of paclitaxel and metabolites in mouse plasma, tissues, urine and faeces by semi-automated reversed-phase high-performance liquid chromatography. Journal of Chromatography B: Biomedical Sciences and Applications. 664, 383-391 (1995).
- Bradshaw-Peirce, E. L., Eckhardt, S. G., Gustafson, D. L. A Physiologically Based Pharmacokinetic Model of Docetaxel Disposition: from Mouse to Man. Clinical Cancer Research. 13, 2768-2778 (2007).
- Eiseman, J. L., et al. Plasma Pharmacokinetics and Tissue Distribution of Paclitaxel in CD2F1 Mice. Cancer Chemotherapy and Pharmacology. 34 (6), 465-471 (1994).
- Schinkel, A. H., et al. Normal Viability and Altered Pharmacokinetics in Mice Lacking mdr1-type (drug-transporting) P-glycoproteins. Proc. Nat. Acad. Sci. USA. 94, 4028-4033 (1997).
- Fraser, I. J., Dear, G. J., Plumb, R., L’Affineur, M., Fraser, D., Skippen, A. J. The Use of Capillary High Performance Liquid Chromatography with Electrospray Mass Spectrometry for the Analysis of Small Volume Blood Samples from Serially Bled Mice to Determine the Pharmacokinetics of Early Discovery Compounds. Rapid Communications in Mass Spectrometry. 13 (23), 2366-2375 (1999).
- Bateman, K. P., et al. Reduction of Animal Usage by Serial Bleeding of Mice for Pharmacokinetic Studies: Application of Robotic Sample Preparation and Fast Liquid Chromatography – Mass Spectrometry. Journal of Chromatography B: Biomedical Sciences and Applications. 754 (1), 245-251 (2001).
- Berndt, K., Vogel, J., Buehler, C., Vogt, P., Born, W., Fuchs, B. A new method for repeated drug infusion into the femoral artery of mice. J. Am. Assoc. Lab Animal Sci. 51 (6), 825-831 (2012).
- . Squibb & Sons, L.L.C.. Drug Information for TAXOL (Paclitaxel) Injection. , (2011).
- . Abraxis BioScience L.L.C. Full Prescribing Information ABRAXANE for Injectable suspension (paclitaxel protein-bound particles for injectable suspension) (albumin-bound). , (2013).
- Fergusson, G., Ethier, M., Zarrouki, B., Fontés, G., Poitout, V. A Model of Chronic Nutrient Infusion in the Rat. J. Vis. Exp. (78), (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon