Method Article
Imaging di calcio di cattivi odori evocati risposte nel Drosophila Lobe antenne
In questo articolo
Riepilogo
Descriviamo una tecnica consolidata per misurare e analizzare i cattivi odori evocati risposte di calcio nel lobo antennale di vivere Drosophila melanogaster.
Abstract
Il lobo antenne è il centro principale olfattivo nel cervello insetti e rappresenta l'equivalente anatomica e funzionale del bulbo olfattivo vertebrato 1-5. Informazioni olfattivo nel mondo esterno viene trasmessa al lobo antennale da neuroni sensoriali olfattivi (OSN), che segregano per regioni distinte neuropilo chiamati glomeruli secondo il recettore specifico olfattivo esprimono. Qui, OSN assoni sinapsi con entrambe le interneuroni locali (LNS), i cui processi possono innervare molti glomeruli diversi, e neuroni di proiezione (PN), che trasmettono informazioni olfattive ai maggiori regioni del cervello olfattive.
Imaging ottico dell'attività di OSN, LNS e PNS nel lobo antennale - tradizionalmente mediante indicatori sintetici di calcio (es. calcio verde, FURA-2) o la tensione-sensibili (ad esempio coloranti RH414) - è stata a lungo una tecnica importante per capire come olfattiva gli stimoli sono rappresentati come modelli spaziali e temporalidell'attività glomerulare in molte specie di insetti 6-10. Sviluppo di geneticamente codificati reporter attività neurale, come gli indicatori di calcio fluorescenti G-Camp 11,12 e Cameleon 13, l'indicatore di calcio bioluminescente GFP-equorina 14,15, o un reporter di trasmissione sinaptica, Synapto-pHluorin 16 ha reso sistema olfattivo del moscerino della frutta, Drosophila melanogaster, particolarmente accessibile all'imaging neurofisiologico, integrando le sue proprietà complessivamente descritte-molecolari, elettrofisiologici e neuroanatomici 2,4,17. I giornalisti possono essere selettivamente espressa tramite binari sistemi di controllo trascrizionale (es. GAL4/UAS 18, LexA / LexAop 19,20, Q del sistema 21) in popolazioni di neuroni definiti all'interno del circuito olfattivo di sezionare con elevata risoluzione spaziale e temporale come odori evocati attività neurale è rappresentata, modulato e trasformato 22-24 </ Sup>.
Qui si descrivono i metodi di preparazione e di analisi per misurare i cattivi odori evocati risposte nel lobo antennale Drosophila utilizzando G-CAMP 25-27. La preparazione animale è minimamente invasiva e può essere adattato per l'imaging mediante microscopia a fluorescenza, confocale e due fotoni a grande campo.
Protocollo
1. Blocco di Montaggio
- Il blocco plexiglass montaggio (Figura 1A) dovrebbero essere apportate alle specifiche esatte espresse nella matrice (disponibile dalla
http://neuro.uni-konstanz.de/j ove_mountingblock_blueprint / ) Per consentire un facile montaggio e la dissezione di mosca. Filo attraverso le viti dal retro ma non li estendono oltre la parte anteriore del blocco; loro posizione sarà regolato durante la preparazione della animale (vedi 2,7). - Utilizzando un trapano precisione, intaccare il bordo superiore della camera circolare per la mosca, scavi sotto la superficie per fare spazio per il corpo della mosca, riducendo lo spessore del blocco a questo punto.
- Tagliare una griglia di rame con un bisturi e perpendicolare in prossimità del fondo della fessura di creare un "collo". Assicurarsi che i due lembi ottenuti sono di livello, in quanto ciò contribuirà l'inserimento della mosca.
- Con uno stuzzicadenti, mettere una piccola goccia di colla sul blocco di montaggio sopra la camera circolare per la mosca. Posizionare la griglia di rame sulla colla e posizione in modo che la fessura è centrata sul blocco (Figura 1A). Premere delicatamente e rimuovere ogni eccesso di colla. Con un paio di pinzette, aggiungere piccole gocce di colla alle alette su ciascun lato e piegare la griglia sul fronte del blocco in modo che la fessura è rivolta verso il basso diritte. Assicurarsi che la parte superiore della griglia è a livello con il blocco. Lasciare asciugare completamente.
- Assemblare un titolare di filo: tagliare un coprioggetto di plastica a metà e togliere un pezzo centrale per fare una forma a "U". Utilizzare cera d'api di incollare un pezzo di filo nella parte superiore della "U", non rendono il cavo troppo teso.
- Costruire lo scudo antennale: fare un buco in un vetrino di plastica con una carta hole-punch. Tagliare i bordi del coprioggetto a 0,5 x 0,7 cm. Incollare il vetrino di plastica forato per nastro adesivo e poi mettere una goccia di etanolo sul nastro esposto attraverso il foro dirimuovere l'adesivo.
2. Preparazione degli animali
- Le mosche del genotipo appropriata - cioè tenendo la combinazione desiderata di "driver" e l'attività-reporter transgeni - dovrebbe essere 1-3 settimane di età, la cuticola dei giovani mosche è troppo morbido e difficile da tagliare. Quando gli esperimenti richiedere che il confronto diretto di genotipi diversi, e al fine di corrispondere i livelli di espressione del transgene, mosche dovrebbe essere pari età al fine di evitare differenze fisiologiche legate all'età. Se il genere non è importante, preferiamo usare le mosche di sesso femminile poiché hanno più la testa e sono più facili da manipolare.
- Anestetizzare le mosche da raffreddamento su ghiaccio.
- Introdurre una mosca nel blocco di montaggio. Tenere la mosca dal giunto ala e farla scorrere, dorsale-prima superficie, lungo la fessura della griglia di rame in modo che sia sospesa dal suo collo (Figura 1B-C). Se necessario, si ruotare fino sta guardando.
- Posizionare una spina bel cactus di fronte alla fly testa per impedirne la fuoriuscita (Figura 1B-C). Posizionare la colonna vertebrale cactus davanti proboscide per impedire che si sposti. Fissare la colonna vertebrale cactus al blocco utilizzando cera d'api. Assicurarsi che la parte superiore della testa è a livello con la parte superiore del blocco.
- Fissare la testa della mosca al blocco con una piccola goccia di resina (sciolto in etanolo). Posizionare il blocco in una scatola umidificata e consentire la colofonia indurire per circa un'ora.
- Utilizzando pinze, tirare la piastra antennale in avanti e far cadere il filo sul supporto (cera-side out, vedi 1.5) nella piega cuticolare tra l'antenna e la testa. Fissare il supporto alla parte anteriore del blocco con cera d'api.
- Usando le viti costruito nel blocco, spingere delicatamente il titolare del filo in avanti per creare uno spazio tra la piastra antennale e la testa.
- Posizionare lo scudo antennale (vedi 1.6) sopra la parte superiore della testa della mosca con il foro posizionato centralmente. Fissare con cera d'api per la parte superiore del blocco di montaggio.
- Utilizzando una lama-splitter, cuta piccolo buco nel nastro sullo scudo esponendo la cuticola della testa della mosca dietro l'antenna. Il foro non dovrebbe estendersi oltre gli occhi per evitare che la preparazione di fuoriuscire.
- Sigillare il foro tra il nastro e la cuticola con due componenti di silicio. Rimuovere l'eventuale eccesso di silicone dalla parte superiore della testa della mosca.
- Mettere una goccia di Drosophila Ringer salina (130 mM NaCl, 5 mM KCl, 2 mM MgCl 2, 2 mM CaCl 2, 36 mM saccarosio, 5 mM di HEPES, pH 7,3) sulla testa. Assicurarsi che non vi siano perdite: le antenne dovrebbero rimanere completamente asciutto. Utilizzando una lama zaffiro, tagliato un buco nella cuticola. In primo luogo, leggermente punteggio lungo la piega cuticolare direttamente dietro l'antenna, quindi tagliati lungo gli occhi e attraverso il ocelli sul retro. Infine, piegare il pezzo di cuticola oltre il limite segnato e tagliare dalla parte inferiore per evitare di recidere i nervi antennali.
- Rimuovere con cautela ghiandole e trachea con le pinzette sottili. Sciacquare ripetutamente con Drosophila Ringer, lasciando una grossa goccia sulla testa.
3. Odore stimolo di consegna
- Siringhe odore: inserire un tampone di cellulosa in una siringa 2 ml di plastica con pinzette pulite e pipetta (usando punte filtro) 20 pl di odore, diluite come desiderato in un solvente appropriato, usando la punta della pipetta per spingere il pad in profondità nella canna . Plug e il tappo della siringa fino al momento. Diluizioni odore fresco deve essere preparato almeno ogni 3 mesi (o più frequentemente, per gli odori altamente volatili e / o di uso frequente), e pastiglie nuove devono essere preparati per siringhe odore appena prima di ogni sessione di registrazione. Non usare pagliette odori per più di tre stimoli, poiché la concentrazione di odore potrebbe decadere.
- Su misura olfattometro (Figura 2): un flusso di aria primaria (1 l / min) è diretto attraverso la tubazione Teflon (0,4 mm di diametro interno); 27 centimetri a monte della uscita di questo tubo, un flusso d'aria secondaria (1 l / min ) è aggiunto. Entrambi i flussi d'aria generati da pompe a membrana, ela portata viene regolata da due misuratori di portata indipendenti. I flussi d'aria può essere umidificata passando attraverso l'acqua in bottiglie di lavaggio di gas, anche se occorre prestare attenzione per evitare un'eccessiva umidificazione (vale a dire oltre il ~ 60%). Il flusso d'aria secondaria è diretta attraverso una siringa odore o una siringa vuota: siringhe sono connessi al flusso d'aria attraverso un ago di siringa (1,2 mm di diametro esterno) perforare lo stantuffo. Una valvola a tre vie magnetico controllato attraverso una unità di controllo della valvola (ad es VC6 Harvard Apparatus) è usato per passare l'aria pulita e stimolo odore.
4. Imaging in vivo
- Descriviamo qui di immagini utilizzando un microscopio a fluorescenza in posizione verticale (vale a dire diritto fisso fase Zeiss Axio D1 Examiner) dotata di un obiettivo 20x acqua (per es Zeiss W "Plan-Apochromat" 20x / 1,0 M27 DIC) (Figura 2). Per l'imaging con G-CAMP (eccitazione / emissione: 488/509 nm), utilizzare un blocco filtro con le seguenti proprietà: filtro di eccitazione 450-490 nm, Specchio dicroico (T495LP) e 500-550 nm filtro per le emissioni (Chroma ET). Posizionare il blocco di montaggio contenente la mosca al microscopio. Posizionare l'uscita dei circa 0,5 cm olfattometro di fronte antenne della mosca.
- Abbassare l'obiettivo fino a toccare la soluzione di Ringer sulla testa della mosca. Guardando attraverso il visualizzatore luminoso sotto-campo di illuminazione, la posizione preparazione modo che il foro nella capsula testa è centrato e suoi confini sono a fuoco. Passare a luce fluorescente e regolare la messa a fuoco fino a quando puoi vedere i neuroni marcati (risulta dal basale fluorescenza verde del G-cAMP).
- Fine Focus sul glomeruli di interesse con l'acquisizione di immagini con un Charge-Coupled Device (CCD) telecamera (ad esempio CoolSNAP-HQ2 sistema di fotocamera digitale) montata sul microscopio usando software appropriato ripresa (ad es Metafluor) (Figura 3A). Chiudere il diaframma nel percorso della luce di illuminazione per limitare la luce di eccitazione alla zona immaginata.
- Per la schedatura dei cattivi odori evocatiattività, impostare la velocità di acquisizione a 4 Hz e regolare il tempo di esposizione per ottenere valori di fluorescenza entro il campo dinamico di fotocamera CCD, ma non inferiore a 1000 (unità arbitrarie), con almeno 12-bit risoluzione dinamica. Il tempo di esposizione non deve superare i 100 ms, se possibile, di ridurre G-CAMP photobleaching. Se la risoluzione spaziale della fotocamera lo consente, è possibile aumentare il binning (numero di pozzi sul chip che verrà categorizzata in un pixel digitale) per ridurre il tempo di esposizione. Otteniamo le immagini di 350x225 pixel (con un binning di 2x2), corrispondenti a 210x135 micron presso la preparazione. Queste impostazioni sono ottimali per catturare odori glomerulari indotte risposte di G-CAMP con una buona risoluzione spaziale e temporale, limitando giornalista sbiancamento.
- Impostare i parametri di misura. Abbiamo tipicamente registrare per 10 secondi (cioè 40 fotogrammi), con stimolazione odore generalmente a partire 4 secondi dopo l'inizio del periodo di acquisizione (telaio 15) e una durata di un secondo (uino fotogramma 19). Una preparazione mosca può normalmente essere testati con un massimo di 25-30 stimoli odore diverso, spesso limitate da un declino irreversibile nel segnale fluorescente del reporter a causa di photobleaching. Il inter-stimolo intervallo dipenderà dalla forza della risposta osservata e il tasso di photobleaching. La lunghezza appropriata di intervallo inter-stimolo per evitare di adattamento sensoriale può essere determinata in modo approssimativo con la presentazione ripetuta di un odore controllo positivo (se conosciuto) in esperimenti di prova. L'inclusione di questo odore ogni ~ 10 stimoli di una stessa serie può consentire la verifica della continua vitalità e la reattività costante della preparazione.
5. Elaborazione dati e analisi
I dati vengono trattati con ImageJ (con Mac biofotonica plug-in, www.macbiophotonics.ca ) e personalizzati programmi scritti in Matlab e R come segue:
- Correggere per artefatti da movimento di esempio:allineare tutte le immagini corrispondenti ad una preparazione di animale (per esempio 30 misure di 40 fotogrammi ciascuna) con il "corpo rigido" modo di StackReg / TurboReg ( bigwww.epfl.ch / Thévenaz / stackreg ) in ImageJ. Questo passaggio è necessario per rimuovere spostamenti nella posizione dei neuroni marcati rispetto al telaio acquisizione entro e tra le misurazioni. Tuttavia, è solo possibile rimuovere spostamenti nel piano xy. I dati devono essere eliminata se i cambiamenti si verificano forti a fuoco.
- Segmento stack in singole misurazioni di 10 secondi (40 frame).
- Corretto per lo sbiancamento artefatti: l'esposizione alla luce fluorescente causerà fluorescenza a decadere nel corso di una singola misura 10. In alcuni casi, è importante per correggere questo decadimento prima di analizzare i dati. Per ciascuna misurazione calcolare un frame sfondo. Questo dovrebbe essere la media di diversi fotogrammi prima della comparsa dello stimolo (ad esempio frames 6-14). Dividere ogni fotogramma di questo backgintorno telaio per ottenere le modifiche relative fluorescenza. Calcolare il valore medio relativo fluorescenza per ogni fotogramma facendo la media di tutti i pixel all'interno dell'area marcato da G-CAMP. Montare un doppio esponenziale alla curva di fluorescenza media, attribuendo maggiore importanza ai telai prima stimolo e peso zero al tempo della risposta odore (20 fotogrammi dall'insorgenza stimolo nel nostro caso). Sottrarre la curva montato dalla curva relativa fluorescenza di ciascun pixel. Moltiplicare i frame corretti dalla cornice di fondo di ri-ottenere i dati grezzi. Questo tipo di correzione può portare ad una modifica la dinamica di risposta se il segnale non ritorna alla linea di base alla fine della misura (ad esempio se risposte eccitatorie inibitori o molto forti vengono evocati) (Figura 4). Mentre correzione di artefatti sbianca è utile in molti casi, l'interpretazione dei parametri temporali deve essere fatto con cautela se una correzione candeggiante è applicato.
- Calcolare la variazione relativa di fluorescenza (& DeLTA; F / F) per ciascun frame di ogni misurazione come (F i-F 0) / * 0 F 100, F dove 0 è il fotogramma di sfondo (vedi 5.3), e F i il valore di fluorescenza per l'i-esimo fotogramma di la misurazione.
- Calcolare la media Af / F all'interno di una regione circolare di interesse in un glomerulo (Figura 3B) con un diametro di 10 pixel per ottenere tracce di attività (Figura 5A). Se lo si desidera, trasformare queste tracce in mappe di calore che utilizzano ImageJ (Figura 5A).
- Calcolare l'ampiezza di picco della risposta sottraendo la media Af / F di quattro fotogrammi prima stimolazione dalla media Af / F di quattro frame durante il picco della risposta. La stessa procedura viene utilizzata sia per illustrare modelli di risposta spaziali (si veda la Figura 3B) e di quantificare l'ampiezza della risposta in specifiche regioni di interesse in tutta mosche (vedi Figura 5B). La risposta di picco può essere quantificato integrando l'area sotto la curva durante il tempo dello stimolo, o averaging le cornici intorno al massimo della risposta.
6. Risultati rappresentativi
Abbiamo usato i protocolli di cui sopra per registrare ed analizzare le risposte di acido propionico evocate di mosche che esprimono CaMP1.6 G-28 sotto il controllo del promotore per il co-recettore olfattivo IR8a, che è attiva in molti differenti popolazioni di OSN (29,30 Figure 3-5). La stimolazione con 1% di acido propionico provoca aumenti G-CAMP fluorescenza - indica aumenti del calcio intracellulare - in OSN innervano due glomeruli, DC4 e DP1l (Figura 3B). Si illustrano diversi modi di rappresentare dati provenienti da più mosche in figura 5: tracce di attività di linea, mappe di calore e una trama di risposte bar di picco. Risposte propionico-evocati hanno ampiezze dei picchi distinti e le dinamiche temporali e DC4 DP1l. Inoltre, anche se le risposte sono generalmente robusti, la variabilità tra i singoli animali possono essere osservati anche in entrambi i glomeruli (vedere cheatmaps in figura 5A). La quantificazione delle risposte di picco (Figura 5B) consente un semplice confronto statistico tra glomeruli diversi e odori diversi tra animali. Tuttavia, i cattivi odori evocati risposte di calcio può avere dinamica temporale non uniformi, e quantificare la loro grandezza con un singolo valore non tiene conto di questa complessità.

Figura 1. Schematica del blocco di montaggio (A) prima e (B) dopo l'introduzione della mosca, e (C) una vista dall'alto in primo piano (adattato da 31).

Figura 2. Schematica del set-up sperimentale.

Figura 3. (A) Vista dall'alto della preparazione dopo la fase fly 2.8 (riquadro a sinistra) e cruda immagine di fluorescenza delle antelobi NNAL etichettati con G-CaMP1.6 (genotipo: promoter IR8a: GAL4; UAS: G-CaMP1.6). DC4 e DP1l glomeruli si distinguono per la loro morfologia, dimensioni e la posizione e sono contrassegnati in rosso e blu, rispettivamente.
(B) con codice a colori immagine della risposta di acido propionico (1% v / v). L'immagine corrisponde al Af / F del picco della risposta calcolato come indicato nella fase 5,6 (vedi anche figura 5A). Il ColorScale a sinistra indica il Af / F% del valore. I cerchi neri indicano la posizione e la dimensione della regione di interesse utilizzato per quantificare le risposte (vedi figura 5).
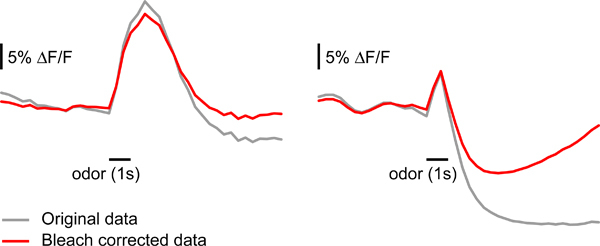
Figura 4. Correzione sbianca del segnale reporter fluorescente. Esempi di effetti di correzione candeggina, come descritto nel passaggio 5,3. Dati campione sul pannello di sinistra può essere corretta senza grandi cambiamenti nella forma della risposta. I dati si riferiscono sul pannello di destra è gravemente incidereed dalla correzione candeggina, probabilmente perché il segnale cade e viene mantenuta al di sotto baseline dopo la cessazione odore stimolo.
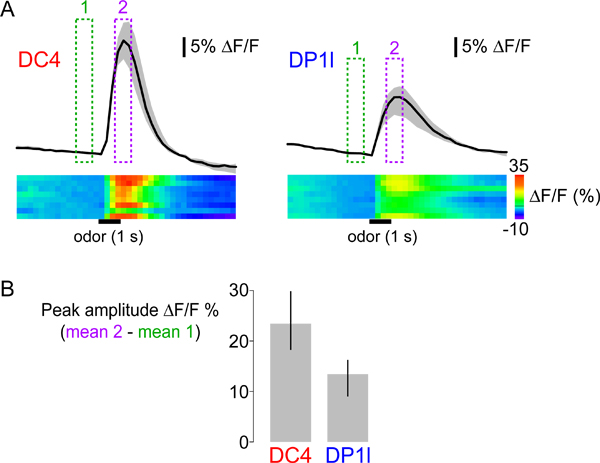
Figura 5 (A) Top:. Dinamica temporale di risposte di calcio di glomeruli DC4 (sinistra) e DP1l (destra) di acido propionico (1% v / v). Le tracce nere indicano la mediana della media Af / F all'interno della regione di interesse (vedi Figura 3B) in otto animali. La superficie grigia indica l'intervallo tra il primo e terzo quartile della distribuzione. Presentazione dei valori mediani e di quartile fornisce ulteriori informazioni sulla variabilità e la distribuzione delle risposte osservate di errore medio e standard. Le caselle verdi e magenta indicano i fotogrammi media per calcolare le risposte di picco mostrato in figura 3b, e quantificati nella Figura 5B. In basso: le mappe di calore mostrano i dati di risposta per tutti i singoli animali in file separati, con Af / F valori represented dal ColorScale (estrema destra). Le barre orizzontali neri indicano il tempo e la durata dello stimolo. (B) mediani risposte punta ad acido propionico in otto animali per DC4 e DP1l glomeruli. Le barre di errore indicano l'intervallo tra primo e terzo quartile della distribuzione.
Discussione
I metodi di preparazione e di analisi descritte qui può essere utilizzato per analizzare i cattivi odori evocati risposte in una popolazione di neuroni nel lobo antennale (OSN, LN e PN) per il quale un transgene corrispondente driver è disponibile. Mentre descrivere la sua applicazione utilizzando un microscopio a fluorescenza, imaging ottico di questa preparazione può anche essere effettuata usando la microscopia confocale a due fotoni o 22,32. Infatti, questi strumenti ultime alleviare il problema di scattering di luce ad ampio campo di microscopia, che può ridurre la risoluzione delle immagini, specialmente quando un gran numero di neuroni esprimono il reporter. Questa preparazione consente registrazioni di solito i cattivi odori evocati risposte per almeno mezz'ora, ma questa volta può essere significativamente più o meno lungo a seconda del numero e della lunghezza delle misurazioni registrate, il tempo di esposizione utilizzato per ogni fotogramma e la inter-stimolo intervallo. Inoltre, l'eccitazione a due fotoni può ridurre photobleaching del fluorescente reporter, nonché fototossicità cellulare, per consentire la misurazione per periodi più lunghi 22,32.
Indipendentemente dalla scelta del microscopio, il movimento del cervello mosca all'interno della capsula testa è il problema più ricorrente quando l'imaging in animali intatti. Mentre il movimento di correzione in grado di correggere problemi minori (passo 5.1), di solito è meglio solo per registrare dalle preparazioni altamente stabili. Strategie per ridurre gli artefatti di movimento includono: (i) corretto vincolare la proboscide della mosca con la spina dorsale cactus, (ii) immobilizzare le gambe del mosca fissando loro il palco con eicosane (prima al punto 2.6) (eicosane può essere fuso a ~ 37 ° C; usare un filo d'argento per estendere e perfezionare la punta del saldatore per questo scopo), (iii) intaccare l'esofago (visibile tra i nervi antennali) con le pinzette sottili.
Oltre a G-CaMP1.6 qui utilizzato, un numero di versioni ottimizzate di G-CAMP indicatori di calcio e altri sono disponibili,che si differenziano nel loro rapporto segnale-rumore, la fluorescenza basale e dinamica temporale 12,28,33. La scelta precisa del sensore dovrebbe tener conto di tutte queste proprietà, il tipo di neuroni da analizzare e la questione biologica affrontata. Sensori di corrente segnalare le modifiche di calcio che correlano abbastanza bene con l'azione potenziali 12,34, e la loro ulteriore miglioramento, insieme a un numero crescente di specifiche linee genetiche del driver 35 continuerà a migliorare il potenziale di imaging ottico di attività neurale in al volo intatto.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Noi riconosciamo Silke Sachse e Beate Eisermann nello sviluppo di questa metodologia, Pablo Traversa per disegnare i progetti di blocco di montaggio e Daniela Pelz per l'utilizzo dello schema in figura 1. Siamo grati a Silke Sachse, Pavan Ramdya e Raffaello Rytz per i commenti sul manoscritto. R. Bell è supportato da una Boehringer Ingelheim PhD Fellowship Foundation. La ricerca nel laboratorio di R. Benton è finanziato da un Consiglio europeo della ricerca a partire Independent Researcher Grant e il Fondo nazionale svizzero Science Foundation.
Materiali
| Name | Company | Catalog Number | Comments |
| Reagente | Fornitore | Numero di catalogo | Comments |
| Cactus colonna vertebrale | Giardinaggio, centro per | ~ 7 millimetri sottile lungo, non troppo flessibile | |
| Colofonia | Strumento a corda negozio | ||
| Due componenti di silicio | WPI | KWIK-SIL | |
| Custom made blocco di montaggio in plexiglass | Blueprints disponibili http://neuro.uni-konstanz.de/j ove_mountingblock_blueprint / | ||
| Griglie di rame | Athene Griglie | G220-5 | Normalmente utilizzato per i campioni di microscopia elettronica. |
| Viti | Ferramenta | 2 mm di diametro | |
| Coprioggetti plastica | Plano-em | L4193 | 22 X 22 mm |
| Punte di ferro di saldatura | Conrad Electronics | 830283-62 | |
| Alimentazione regolamentato | Conrad Electronics | 511407-62 | |
| Filo sottile | Isabellenhütte | Isa-ohm | 0,013 millimetri |
| Eicosane | Sigma | 21,927-4 | |
| Microscopio | Zeiss | Axioexaminer D1 | |
| CCD della fotocamera | Visitron | CoolSnap HQ | |
| Metafluor | Visitron | Acquisizione software | |
| Monocromatore | Visitron | Visichrome | |
| Lame fragili | Strumenti di Scienze Belle | 10050-00 | |
| Supporto per blade | WPI | 14134 | |
| Sapphire blade | WPI | 500314 | Lama a doppio taglio 1 millimetro |
| Pompe a membrana gas | KNF Neuberger AG | NMP 830 KVE | |
| Sapphire portalama | WPI | 500317 | |
| Valvola a tre vie | Lee Azienda | LFAA1200118H | Configurazione E |
| Rotametro 500 ml / min | Analyt-MTC | 112-08SA | |
| Rotametro 5 L / min | Analyt-MTC | 102-08SA | |
| Cera vergine | SILADENT Technik | 209212 | ; |
| Cellulosa pad | Kettenbach Medical | 31003 | |
| Pinzetta | Plano-em | T5130 | Dumont biologia # 5 |
| Siringhe | BD | 300928 | 2ml, Discardit II, 2pezzi |
| Aghi | Braun Sterican | 4665120 | 1,2 millimetri OD |
Riferimenti
- Galizia, C. G., Rossler, W. Parallel olfactory systems in insects: anatomy and function. Annu. Rev. Entomol. 55, 399-420 (2010).
- Vosshall, L. B., Stocker, R. F. Molecular Architecture of Smell and Taste in Drosophila. Annu. Rev. Neurosci. 30, 505-533 (2007).
- Wilson, R. I., Mainen, Z. F. Early events in olfactory processing. Annu. Rev. Neurosci. 29, 163-201 (2006).
- Masse, N. Y., Turner, G. C., Jefferis, G. S. Olfactory information processing in Drosophila. Curr. Biol. 19, 700-713 (2009).
- Hansson, B. S., Anton, S. Function and morphology of the antennal lobe: new developments. Annu. Rev. Entomol. 45, 203-231 (2000).
- Galizia, C. G., Joerges, J., Kuttner, A., Faber, T., Menzel, R. A semi-in-vivo preparation for optical recording of the insect brain. J. Neurosci. Methods. 76, 61-69 (1997).
- Galizia, C. G., Menzel, R., Holldobler, B. Optical imaging of odor-evoked glomerular activity patterns in the antennal lobes of the ant Camponotus rufipes. Naturwissenschaften. 86, 533-537 (1999).
- Okada, K., Kanzaki, R., Kawachi, K. High-speed voltage-sensitive dye imaging of an in vivo insect brain. Neurosci. Lett. 209, 197-200 (1996).
- Carlsson, M. A., Knusel, P., Verschure, P. F., Hansson, B. S. Spatio-temporal Ca2+ dynamics of moth olfactory projection neurones. The European journal of neuroscience. 22, 647-657 (2005).
- Galizia, C. G., Vetter, R. S., Christensen, T. A. . Methods in Insect Sensory Neuroscience (Frontiers in Neuroscience). 13, 349-392 (2005).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nat. Biotechnol. 19, 137-141 (2001).
- Tian, L. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat. Methods. 6, 875-881 (2009).
- Miyawaki, A., Griesbeck, O., Heim, R., Tsien, R. Y. Dynamic and quantitative Ca2+ measurements using improved cameleons. Proc. Natl. Acad. Sci. U.S.A. 96, 2135-2140 (1999).
- Martin, J. R., Rogers, K. L., Chagneau, C., Brulet, P. In vivo bioluminescence imaging of Ca signalling in the brain of Drosophila. PLoS One. 2, 275-275 (2007).
- Murmu, M. S., Stinnakre, J., Martin, J. R. Presynaptic Ca2+ stores contribute to odor-induced responses in Drosophila olfactory receptor neurons. The Journal of Experimental Biology. 213, 4163-4173 (2010).
- Yuste, R., Miller, R. B., Holthoff, K., Zhang, S., Miesenbock, G. Synapto-pHluorins: chimeras between pH-sensitive mutants of green fluorescent protein and synaptic vesicle membrane proteins as reporters of neurotransmitter release. Methods Enzymol. 327, 522-546 (2000).
- Benton, R. Sensitivity and specificity in Drosophila pheromone perception. Trends Neurosci. 30, 512-519 (2007).
- Elliott, D. A., Brand, A. H. The GAL4 system : a versatile system for the expression of genes. Methods Mol. Biol. 420, 79-95 (2008).
- Lai, S. L., Lee, T. Genetic mosaic with dual binary transcriptional systems in Drosophila. Nat. Neurosci. 9, 703-709 (2006).
- Yagi, R., Mayer, F., Basler, K. Refined LexA transactivators and their use in combination with the Drosophila Gal4 system. Proc. Natl. Acad. Sci. U.S.A. 107, 16166-16171 (2010).
- Potter, C. J., Tasic, B., Russler, E. V., Liang, L., Luo, L. The Q System: A Repressible Binary System for Transgene Expression, Lineage Tracing, and Mosaic Analysis. Cell. 141, 536-548 (2010).
- Wang, J. W., Wong, A. M., Flores, J., Vosshall, L. B., Axel, R. Two-photon calcium imaging reveals an odor-evoked map of activity in the fly brain. Cell. 112, 271-282 (2003).
- Fiala, A. Genetically expressed cameleon in Drosophila melanogaster is used to visualize olfactory information in projection neurons. Curr. Biol. 12, 1877-1884 (2002).
- Ng, M. Transmission of olfactory information between three populations of neurons in the antennal lobe of the fly. Neuron. 36, 463-474 (2002).
- Sachse, S. Activity-dependent plasticity in an olfactory circuit. Neuron. 56, 838-850 (2007).
- Pelz, D., Roeske, T., Syed, Z., de Bruyne, M., Galizia, C. G. The molecular receptive range of an olfactory receptor in vivo (Drosophila melanogaster Or22a). J. Neurobiol. 66, 1544-1563 (2006).
- Silbering, A. F., Galizia, C. G. Processing of odor mixtures in the Drosophila antennal lobe reveals both global inhibition and glomerulus-specific interactions. J. Neurosci. 27, 11966-11977 (2007).
- Reiff, D. F. In vivo performance of genetically encoded indicators of neural activity in flies. J. Neurosci. 25, 4766-4778 (2005).
- Abuin, L. Functional architecture of olfactory ionotropic glutamate receptors. Neuron. 69, 44-60 (2011).
- Benton, R., Vannice, K. S., Gomez-Diaz, C., Vosshall, L. B. Variant ionotropic glutamate receptors as chemosensory receptors in Drosophila. Cell. 136, 149-162 (2009).
- Pelz, D. . Functional characterization of Drosophila melanogaster Olfactory Receptor Neurons. , (2005).
- Ai, M. Acid sensing by the Drosophila olfactory system. Nature. 468, 691-695 (2010).
- Martin, J. R. In Vivo Brain Imaging: Fluorescence or Bioluminescence, Which to Choose?. Journal of Neurogenetics. , 1-23 (2008).
- Jayaraman, V., Laurent, G. Evaluating a genetically encoded optical sensor of neural activity using electrophysiology in intact adult fruit flies. Front. Neural Circuits. 1, 3-3 (2007).
- Pfeiffer, B. D. Tools for neuroanatomy and neurogenetics in Drosophila. Proc. Natl. Acad. Sci. U.S.A. 105, 9715-9720 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon