Method Article
Calcium Imaging von geruchs-evozierte Potentiale in der Drosophila Antennallobus
In diesem Artikel
Zusammenfassung
Wir beschreiben eine etablierte Technik zur Messung und Analyse Gerüche hervorgerufene Kalzium-Reaktionen im Antennallobus Lebensstandard Drosophila melanogaster.
Zusammenfassung
Die Antennallobus ist das primäre olfaktorische Zentrum im Gehirn der Insekten und stellt die anatomischen und funktionellen Äquivalent der Wirbeltiere Riechkolben 1-5. Olfaktorische Informationen in der äußeren Welt ist mit dem Antennallobus von Riechzellen (OSN), die unterschiedliche Regionen des Neuropil genannt Glomeruli je nach der spezifischen olfaktorischen Rezeptor sie ausdrücken zu trennen übertragen. Hier können OSN Axone Synapsen mit lokalen Interneuronen (LNS), deren Prozesse innervieren viele verschiedene Glomeruli, und Projektion Neuronen (PNS), die olfaktorische Information an höhere olfaktorische Hirnregionen zu vermitteln.
Die optische Bildgebung der Aktivität von OSN, LNS und PNS im Antennallobus - traditionell unter Verwendung von synthetischen Kalzium-Indikatoren (z. B. Calcium grün, Fura-2) oder spannungsabhängigen Farbstoffen (zB RH414) - ist seit langem eine wichtige Technik zu verstehen, wie olfaktorische Reize werden als räumliche und zeitliche Muster vertretender Glomeruliaktivität in vielen Insektenarten 10.06. Entwicklung genetisch kodierten neurale Aktivität Reporter, wie die fluoreszierende Calciumindikatoren G-CaMP 11,12 Cameleon 13, die Calcium-Indikator biolumineszierende Aequorin-GFP 14,15 oder ein Reporter der synaptischen Übertragung, hat im Gegensatz zu GFP Synaptosomen 16 die aus olfaktorische System der Fruchtfliege, Drosophila melanogaster, besonders zugänglich für neurophysiologische Imaging, ergänzt durch einen umfassend beschriebenen molekularen, elektrophysiologischen und neuroanatomischen Eigenschaften 2,4,17. Diese Reporter kann wahlweise über binäre Transkriptionskontrolle Systeme (z. B. GAL4/UAS 18, LexA / LexAop 19,20, Q-System 21) in definierten Populationen von Neuronen im olfaktorischen Schaltungen, um mit hoher räumlicher und zeitlicher Auflösung, wie Gerüche hervorgerufene sezieren ausgedrückt werden neurale Aktivität dargestellt wird, moduliert und verändert 22-24 </ Sup>.
Hier beschreiben wir die Herstellung und Analyse-Methoden, um Geruchs-evozierte Potentiale in der Drosophila Antennallobus mit G-CaMP 25-27 zu messen. Das Tier Vorbereitung ist minimal-invasiv und kann auf Bildgebung mit Weitfeld-Fluoreszenz, konfokale und Zwei-Photonen-Mikroskopie eingesetzt werden.
Protokoll
1. Montageblockanordnung
- Die Plexiglas-Montageblock (Abbildung 1A) sollte auf die genauen Spezifikationen in der Blaupause gegeben werden (erhältlich bei
http://neuro.uni-konstanz.de/j ove_mountingblock_blueprint / ) Zu ermöglichen eine einfache Montage und Zerlegung der Fliege. Faden durch die Schrauben von der Rückseite, sondern sie erstrecken sich nicht über die vor dem Block, ihre Position wird während der Vorbereitung des Tieres angepasst werden (siehe 2.7). - Mit einer Präzisions-Bohrmaschine, eine Delle in den oberen Rand der kreisförmigen Kammer für die Fliege, unter der Oberfläche graben, um Platz für Körper der Fliege zu machen, die Verringerung der Dicke des Blocks an dieser Stelle.
- Schneiden einer Kupfer-Gitter mit einem Skalpell senkrecht und in der Nähe der Unterseite des Schlitzes, um eine "Kragen" zu schaffen. Achten Sie darauf, die beiden entstehenden Klappen sind eben, wie dies Einsetzen der Fliege helfen.
- Mit einem Zahnstocher, platzieren Sie einen kleinen Tropfen Sekundenkleber auf den Montageblock oberhalb der runden Kammer für die Fliege. Platzieren Sie die Kupfer Gitter auf den Klebstoff und Position, so dass der Schlitz auf dem Block (1A) zentriert ist. Drücken Sie vorsichtig und entfernen Sie überschüssigen Leim. Mit einer Pinzette, fügen winzigen Tropfen Klebstoff unter den Klappen auf jeder Seite und falten Sie das Raster über die vor dem Block, so dass der Schlitz senkrecht nach unten. Achten Sie darauf, die oben am Tisch auf gleicher Höhe mit dem Block. Vollständig trocknen lassen.
- Montieren Sie einen Drahthalter: schneiden Sie ein Deckglas aus Kunststoff in zwei Hälften und entfernen Sie eine zentrale Stück, ein "U"-Form zu machen. Verwenden Bienenwachs zu kleben ein Stück Draht über den oberen Teil des "U"; nicht machen das Kabel zu straff.
- Konstruieren Sie die antennalen Schild: machen Sie ein Loch in einem Kunststoff-Deckglas mit einem Papier-Locher. Schneiden der Kanten des Deckglases bis 0,5 x 0,7 cm. Kleben Sie die durchbohrten Kunststoff Deckglas zu Klebeband und legen Sie dann einen Tropfen Ethanol auf dem Band durch das Loch an exponiertenentfernen Sie den Klebstoff.
2. Tierische Vorbereitung
- Fliegen des entsprechenden Genotyps - also tragen die gewünschte Kombination von "driver"-Reporter und Aktivität Transgene - sollte 1-3 Wochen alt, die Kutikula der jüngeren Fliegen ist zu weich und schwierig zu schneiden. Bei Experimenten direkten Vergleich verschiedener Genotypen erfordern, und um die Expression der Transgene übereinstimmen, sollte Fliegen sein Alter abgestimmt auf altersbedingte physiologische Unterschiede zu vermeiden. Wenn Geschlecht nicht wichtig ist, bevorzugen wir es, weibliche Fliegen verwenden, da sie einen größeren Kopf haben und sind leichter zu manipulieren.
- Anesthetize Fliegen durch Abkühlen auf Eis.
- Führen Sie eine Fliege in den Montageblock. Halten der Fliege durch die Flügel zu schieben und, Rücken-Oberfläche zunächst über den Schlitz des Kupfergitter so daß sie durch den Hals (1B-C) suspendiert. Wenn nötig, drehen ihn, bis er nach unten schaut.
- Legen Sie eine feine Kaktusstachel vor dem fly den Kopf, um es an der Flucht (Abbildung 1B-C) zu verhindern. Setzen Sie den Kaktus Wirbelsäule vor den Rüssel, um es zu Bewegung zu verhindern. Befestigen Sie den Kaktus Wirbelsäule auf den Block mit Bienenwachs. Stellen Sie sicher, dass die Oberseite des Kopfes mit der Oberseite des Blocks ist.
- Befestigen Sie den Kopf der Fliege auf den Block mit einem kleinen Tropfen von Kolophonium (gelöst in Ethanol). Den Block in einem befeuchteten Box und lassen Sie das Kolophonium zu verhärten für etwa eine Stunde.
- Mit einer Pinzette, ziehen Sie die Platte nach vorn antennalen-and-Drop den Draht an der Halterung (Wachs-Side-out, siehe 1.5) in der Kutikula Falte zwischen der Antenne und Kopf. Befestigen Sie die Halterung an der Vorderseite des Blocks mit Bienenwachs.
- Verwenden Sie die Schrauben in den Block gebaut, vorsichtig in das Drahthalter uns auf etwas Platz zwischen dem antennalen Platte und der Kopf zu schaffen.
- Setzen Sie den antennalen Schild (siehe 1.6) über den oberen Teil der Fliege Kopf mit dem Loch positioniert zentral. Fix mit Bienenwachs an der Spitze der Montageblock.
- Mit einem Messer-Splitter, cuta kleines Loch in der Band auf dem Schild Aussetzen der Kutikula der Fliege den Kopf hinter der Antenne. Das Loch sollte nicht über den Augen erstrecken, um die Herstellung auslaufen.
- Dichten Sie das Loch zwischen dem Band und die Nagelhaut mit Zwei-Komponenten-Silikon. Entfernen Sie überschüssiges Silikon von der Spitze der Fliege den Kopf.
- Geben Sie einen Tropfen von Drosophila Ringer-Kochsalzlösung (130 mM NaCl, 5 mM KCl, 2 mM MgCl 2, 2 mM CaCl 2, 36 mM Saccharose, 5 mM HEPES, pH 7,3) auf den Kopf. Stellen Sie sicher, dass keine Lecks vorhanden sind: die Antennen bleiben sollte vollständig trocken ist. Mit einem Saphir Messer, schnitt ein Loch in die Nagelhaut. Zuerst leicht Punktzahl entlang der Kutikula fach direkt hinter der Antenne, dann entlang den Augen und über den Ocellen geschnitten auf der Rückseite. Schließlich falten Sie das Blatt über die Kutikula erzielte Kante geschnitten und von der Unterseite zu vermeiden Durchtrennen der antennalen Nerven.
- Entfernen Sie vorsichtig Drüsen und der Luftröhre mit feinen Pinzette. Spülen Sie immer wieder mit Drosophila Ringer, so dass ein großer Tropfen auf den Kopf.
3. Geruch Stimulus Lieferung
- Geruch Spritzen: legen Sie eine Cellulose-Pad in ein 2 ml Kunststoff-Spritze mit sauberem Pinzette und Pipette auf sie (mit Filter tips) 20 ul Geruch, verdünnt wie in einem geeigneten Lösungsmittel gewünscht, mit der Pipettenspitze, um das Kissen tief in den Lauf schieben . Plug-and-Kappe der Spritze, bis sie benötigt. Frischer Geruch Verdünnungen sollten mindestens alle 3 Monate (oder häufiger bei sehr flüchtigen und / oder häufig verwendete Gerüche) werden, und neue Pads sollten für Geruch Spritzen direkt vor jeder Aufnahme-Session vorbereitet werden. Verwenden Sie keine Geruchs-Pads für mehr als drei Stimulationen, da der Geruch Konzentration könnte zerfallen.
- Maßgeschneiderte Olfaktometer (2): einen primären Luftstrom (1 l / min) durch Teflon-Schlauch (0,4 mm Innendurchmesser) gerichtet ist; 27 cm oberhalb vom Austritt des Rohres eine sekundäre Luftstrom (1 l / min ) zugegeben. Beide Luftströme werden durch Membranpumpen erzeugt wird, unddie Fließgeschwindigkeit wird durch zwei unabhängige Durchflussmesser geregelt. Die Luftströme können befeuchtet werden, indem es durch Wasser in Gaswaschflaschen, wobei darauf zu achten, um über-Befeuchtung zu vermeiden (dh mehr als ~ 60%) werden. Die sekundäre Luftstrom wird entweder durch eine Spritze oder Geruch einer leeren Spritze gerichtet: Spritzen werden, um den Luftstrom durch eine Spritzennadel (1,2 mm Außendurchmesser) Durchstechen des Kolbens verbunden ist. Ein Drei-Wege-Magnetventil über ein Ventil Steuereinheit (zB Harvard Apparatus VC6) gesteuert wird verwendet, um zwischen der sauberen Luft und Geruch Impulse zu wechseln.
4. In-vivo-Imaging
- Wir beschreiben hier eine aufrechte Bildgebung mit Fluoreszenz-Mikroskop (zB aufrecht feste Bühne Zeiss Axio Examiner D1) mit einem 20x Wasser Zielsetzung (z. B. Zeiss W "Plan-Apochromat" 20x / 1,0 M27 DIC) (Abbildung 2) ausgestattet. Für die Bildgebung mit G-Camp (Anregung / Emission: 488/509 nm), einen Filter verwenden, Block mit den folgenden Eigenschaften: 450-490 nm Anregungsfilter, Dichroitischen Spiegel (T495LP) und 500-550 nm Emission Filter (Chroma ET). Setzen Sie den Montageblock mit der Fliege unter dem Mikroskop. Positionieren Sie den Ausgang der Olfaktometer ca. 0,5 cm vor der Fliege Antennen.
- Senken Sie das Ziel, bis es der Ringer-Lösung auf der Fliege Kopf berührt. Beim Blick durch den Betrachter unter Hellfeldbeleuchtung, Position der Vorbereitung, so dass das Loch in der Kopfkapsel zentriert ist und seine Grenzen sind im Fokus. Wechseln Sie in fluoreszierendes Licht und stellen Sie den Fokus, bis Sie die markierten Neuronen (ergibt sich aus Basal-grüne Fluoreszenz der G-cAMP) sehen kann.
- Fein Fokus auf die Glomeruli von Interesse durch den Erwerb von Bildern mit einer Charge-coupled Device (CCD) Kamera (zB CoolSNAP HQ2-Digitalkamera-System) auf dem Mikroskop mit Hilfe geeigneter Software zur Erfassung (zB Metafluor) (Abbildung 3A) montiert. Schließen der Blende im Beleuchtungsstrahlengang um Anregungslicht zu dem abgebildeten Bereich zu begrenzen.
- Für die Aufzeichnung Gerüche hervorgerufeneAktivität, stellen Sie den Erwerb Rate bis 4 Hz und stellen Sie die Belichtungszeit auf Fluoreszenz-Werte innerhalb des dynamischen Bereichs des CCD-Kamera zu erhalten, aber nicht niedriger als 1000 (willkürliche Einheiten), mit mindestens 12-Bit-Auflösung dynamisch. Die Belichtungszeit sollte nicht länger als 100 ms, wenn möglich, zu G-CaMP Ausbleichen zu reduzieren. Wenn die räumliche Auflösung der Kamera erlaubt, können Sie erhöhen die Binning (Anzahl der Brunnen auf dem Chip, die in eine digitale Pixel-Binning werden), um die Belichtungszeit zu reduzieren. Man erhält Bilder der 350x225 Pixel (mit Binning 2x2), entsprechend 210x135 um bei der Herstellung. Diese Einstellungen sind optimal zur glomerulären Geruchs-induzierten Reaktionen des G-Camp mit guter räumlicher und zeitlicher Auflösung zu erfassen und beschränkt Reporter Bleichen.
- Stellen Sie die Messparameter. Wir in der Regel für 10 Sekunden (also 40 Frames) aufzeichnen, mit Duftstimulation sich zumeist in 4 Sekunden nach dem Beginn der Erfassungszeitraum (Bild 15) und einer Laufzeit von einem zweiten (until Frame 19). Eine Fliege Vorbereitung kann in der Regel mit getestet werden bis zu 25-30 verschiedenen Geruch Reize, die oft von einer irreversiblen Abnahme der Fluoreszenz-Signal des Reporters durch Ausbleichen begrenzt. Die Inter-Stimulus-Intervall wird von der Stärke der Reaktion beobachtet, und die von Photobleichen abhängen. Die entsprechende Länge der Inter-Stimulus-Intervall auf sensorische Anpassung vermeiden können, etwa durch wiederholte Vorlage einer positiven Kontrolle Geruch (falls bekannt) im Versuch ermittelt werden. Die Aufnahme dieses Geruchs alle ~ 10 Stimuli in einer bestimmten Serie können zulassen Überprüfung der Lebensfähigkeit und konsistente Reaktionsfähigkeit der Zubereitung.
5. Datenverarbeitung und-analyse
Daten werden mit ImageJ (mit Mac Biophotonik-Plug-in, www.macbiophotonics.ca ) und benutzerdefinierte Programme geschrieben in Matlab und R wie folgt:
- Korrigieren Sie für Probe Bewegungsartefakte:richten Sie alle Bilder, entsprechend einem Tier Zubereitung (zB 30 Messungen von 40 Bildern je) mit dem "starren Körper"-Modus der StackReg / TurboReg ( bigwww.epfl.ch / Thevenaz / stackreg ) in ImageJ. Dieser Schritt ist erforderlich, um Veränderungen der Position der markierten Neuronen in Bezug auf die Erfassungsfrequenz in und zwischen den Messungen zu entfernen. Es ist jedoch nur möglich, Verschiebungen in der xy-Ebene zu entfernen. Die Daten sollten verworfen werden, wenn starke Veränderungen in der Konzentration auftreten werden.
- Segment den Stapel in einzelne 10-Sekunden (40 Rahmen) Messungen.
- Richtig zum Bleichen von Artefakten: Belastung durch fluoreszierendes Licht führt dazu, Fluoreszenz, die während einer einzigen Messung 10 zerfallen. In einigen Fällen ist es wichtig, um für diese zerfallen, bevor die Analyse der Daten zu korrigieren. Für jede Messung Berechnung eines Hintergrundbildes. Dies sollte der Mittelwert aus mehreren Frames vor Beginn des Stimulus (zB Rahmen 6-14) sein. Unterteilen Sie jedes Bild von diesem backgrunder Rahmen um die relative Fluoreszenz Änderungen zu erhalten. Den Mittelwert der relativen Fluoreszenz für jeden Frame durch Mittelung aller Pixel innerhalb des von G-CaMP markiert. Setzen Sie einen Doppelklick auf die exponentielle mittlere Fluoreszenz-Kurve, ein stärkeres Gewicht geben den Rahmen vor dem Stimulus und null Gewicht auf die Zeit des Geruchs Antwort (20 Frames nach Reizbeginn in unserem Fall). Subtrahieren Sie die angepasste Kurve von der relativen Fluoreszenz-Kurve eines jeden Pixels. Multiplizieren Sie die korrigierten Bilder von der Hintergrund-Frame neu zu erhalten Rohdaten. Diese Art der Korrektur kann zu einer Veränderung in der Dynamik Reaktion führen, wenn das Signal nicht auf die Grundlinie zurückzusetzen, indem das Ende der Messung (z. B. wenn inhibitorischen oder exzitatorischen sehr starke Reaktionen hervorgerufen werden) (Abbildung 4). Während Korrektur zum Bleichen Artefakte ist in vielen Fällen sollte Auslegung der zeitliche Parameter mit Vorsicht durchgeführt werden, wenn ein Bleichmittel Korrektur angewendet.
- Berechnen der relativen Änderung in der Fluoreszenz (& Delta, F / F) für jedes Bild jeder Messung (F i-F 0) / F 0 * 100, wobei F 0 die Hintergrund-Frame (siehe 5.3), und F i die Fluoreszenz-Wert für den i-ten Vollbild die Messung.
- Berechnen Sie die mittlere &Dgr; F / F in einem kreisförmigen Bereich von Interesse in einer Glomerulus (3B) mit einem Durchmesser von 10 Pixel, um die Aktivität Spuren (5A) zu erhalten. Wenn gewünscht, diese Spuren zu wandeln Heatmaps mit ImageJ (5A).
- Berechnen Sie die Spitzenamplitude der Antwort durch Subtrahieren der mittleren &Dgr; F / F von vier Rahmen vor der Stimulation von der mittleren &Dgr; F / F von vier Rahmen in der Spitze der Antwort. Das gleiche Verfahren wird auch verwendet, um räumliche Antwortmuster (siehe Abbildung 3B) zu illustrieren und die Antwort Amplitude in bestimmten Regionen von Interesse über Fliegen zu quantifizieren (siehe Abbildung 5B). Die maximale Empfindlichkeit kann auch durch Integrieren der Fläche unter der Kurve während der Zeit des Reizes oder quantifiziert werden averaging die Rahmen um das Maximum der Reaktion.
6. Repräsentative Ergebnisse
Wir verwendeten die Protokolle über die Erfassung und Auswertung Propionsäure hervorgerufenen Reaktionen von Fliegen, welche G-28 unter CaMP1.6 der Kontrolle des Promotors für die olfaktorische Korezeptor IR8a, die aktiv ist in verschiedenen Populationen von OSN 29,30 ( Abb. 3-5). Stimulation mit 1% Propionsäure entlockt Anstieg der G-CaMP Fluoreszenz - was auf einen Anstieg der intrazellulären Calcium - in OSNs innervieren zwei Glomeruli, DC4 und DP1l (3B). Wir stellen verschiedene Arten der Darstellung von Daten aus mehreren Fliegen in Abbildung 5: Linie Aktivität Spuren, Heatmaps und eine Bar Grundstück von Peak Antworten. Propionsäure hervorgerufenen Reaktionen haben deutliche Spitzenamplituden und zeitliche Dynamik in DC4 und DP1l. Darüber hinaus, obwohl die Immunantworten generell sind robust, kann Variabilität zwischen den einzelnen Tieren auch in den beiden Glomeruli beobachtet werden (siehe eratmaps in 5A). Die Quantifizierung der Peak-Response (Abbildung 5B) ermöglicht eine einfache statistische Vergleich zwischen verschiedenen Glomeruli und verschiedener Riechstoffe über Tiere. Allerdings können Gerüche hervorgerufene Kalzium Antworten haben uneinheitliche zeitliche Dynamik und die Quantifizierung ihrer Größenordnung mit einem einzigen Wert wird diese Komplexität zu ignorieren.

1. Schaltplan der Montageblock (A) vor und (B) nach dem Einbringen der Fliege, und (C) einer Draufsicht in Nahaufnahme (aus 31).

Abbildung 2. Schematische Darstellung der Versuchsanordnung.

Abbildung 3. (A) Draufsicht der Fliege Vorbereitung nach der Stufe 2,8 (linkes Bild) und rohes Bild der Fluoreszenz-ante-NNAL Lappen mit G-CaMP1.6 (;: G-CaMP1.6:: IR8a Promoter GAL4 UAS Genotyp) beschriftet. DC4 und DP1l Glomeruli können durch ihre Morphologie, Größe und Position unterschieden werden und sind in rot und blau markiert, beziehungsweise.
(B) Farbe-codiertes Bild aus der Antwort auf Propionsäure (1% v / v). Das Bild entspricht der &Dgr; F / F des Peaks der Antwort berechnet, wie in Schritt 5.6 erläutert (siehe auch 5A). Die ColorScale auf der linken Seite zeigt den% &Dgr; F / F-Wert. Die schwarzen Kreise zeigen die Position und Größe der Region von Interesse verwendet werden, um die Antworten zu quantifizieren (siehe Abbildung 5).
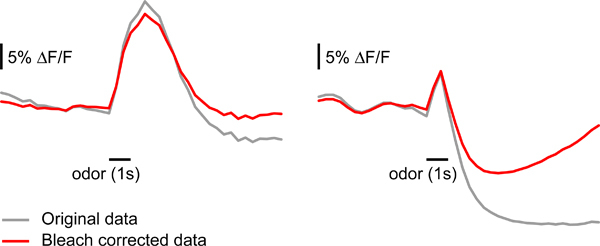
Abbildung 4. Korrektur Ausbleichen der fluoreszierenden Reporter-Signal. Beispiele für die Wirkung des Bleichmittels Korrektur wie in Schritt 5.3 beschrieben. Musterdaten auf der linken Seite kann ohne größere Änderungen in der Form der Antwort korrigiert werden. Sample-Daten auf der rechten Seite ist stark beeinflussenHrsg. v. Bleich-Korrektur, wahrscheinlich, weil das Signal abfällt und wird unter den Ausgangswert nach Beendigung Geruch Stimulus aufrechterhalten.
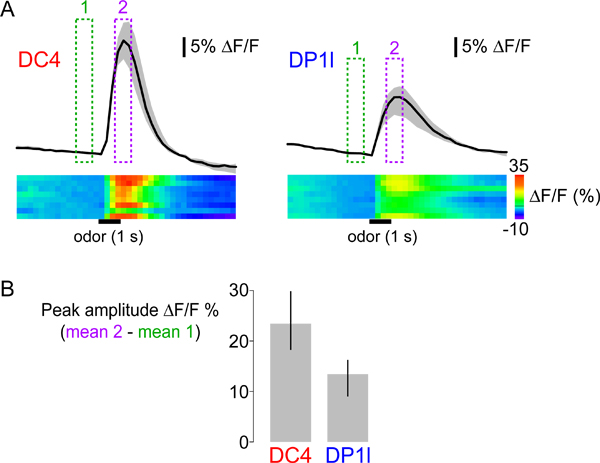
Abbildung 5 (A) Oben:. Zeitliche Dynamik von Kalzium Antworten der Glomeruli DC4 (links) und DP1l (rechts) zu Propionsäure (1% v / v). Die schwarzen Kurven zeigen den Median der Mittelwert &Dgr; F / F in der Region von Interesse (siehe Abbildung 3B) über acht Tieren. Die graue Fläche zeigt den Bereich zwischen dem ersten und dritten Quartil der Verteilung. Präsentation der Median und Quartil-Werte enthält weitere Informationen über die Variabilität und Verteilung der beobachteten Reaktionen als Mittelwert und Standardabweichung. Die Grün und Magenta Kästen zeigen die Rahmen gemittelt, um die Peak-Response in 3B gezeigt, und quantifiziert in 5B zu berechnen. Unten: die Heatmaps für die Antwortdaten für die einzelnen Tiere in getrennten Reihen mit &Dgr; F / F-Werte represented durch die ColorScale (ganz rechts). Die horizontalen schwarzen Balken zeigen die Uhrzeit und die Dauer des Reizes. (B) Median Gipfel Antworten auf Propionsäure in acht Tieren, die für DC4 und DP1l Glomeruli. Die Fehlerbalken geben den Bereich zwischen dem ersten und dritten Quartil der Verteilung.
Diskussion
Die Aufbereitung und die Analyse hier beschriebenen Methoden können verwendet werden, um Geruchs-evozierte Potentiale in jeder Population von Neuronen im Antennallobus (OSN, LN und PNS), für die ein entsprechender Treiber verfügbar ist Transgen zu analysieren. Während wir seine Anwendung mit einem Fluoreszenzmikroskop beschreiben, können optische Bildgebung dieser Zubereitung ebenso durchgeführt mittels konfokaler oder Zwei-Photonen-Mikroskopie 22,32 werden. In der Tat, lindern diese letztgenannten Instrumente der Licht streuenden Problem der Weitfeld-Mikroskopie, die die Auflösung von Bildern reduzieren können, insbesondere wenn eine große Zahl von Neuronen Express der Reporter. Diese Zubereitung Regel erlaubt Aufnahmen Geruch hervorgerufenen Reaktionen für mindestens eine halbe Stunde, aber dieses Mal kann erheblich länger oder kürzer in Abhängigkeit von der Anzahl und Länge der aufgezeichneten Messungen, die Belichtungszeit für jeden Rahmen und der Inter-Stimulus-Intervall verwendet. Darüber hinaus können zwei-Photonen-Anregung reduzieren Ausbleichen der Fluoreszenz-reporter, sowie zelluläre Phototoxizität, um die Messung über einen längeren Zeitraum 22,32 ermöglichen.
Unabhängig von der Wahl des Mikroskops ist die Bewegung der Fliege Gehirns im Kopf Kapsel die meisten immer wieder auftretendes Problem bei der Bildgebung bei gesunden Tieren. Während Bewegungskorrektur kleinere Probleme (Schritt 5.1) korrigieren kann, ist es meist besser nur aus sehr stabilen Vorbereitungen aufzunehmen. Strategien, um Bewegungsartefakte zu reduzieren sind: (i) richtig Einschränken der Rüssel der Fliege mit dem Kaktus Wirbelsäule, (ii) Immobilisierung der Fliege Beine durch Befestigung an der Bühne mit Eicosan (vor 2,6 Schritt) (Eicosan kann geschmolzen werden ~ 37 ° C; verwenden Sie einen Silberdraht zu erweitern und zu verfeinern, die Spitze des Lötkolbens für diesen Zweck), (iii) Nicking die Speiseröhre (sichtbar zwischen den Fühlern Nerven) mit feinen Pinzette.
Neben den G-CaMP1.6 hier verwendet, gibt eine Reihe von optimierten Versionen von G-CaMP Calcium und andere Indikatoren,Sie unterscheiden sich in ihrer Signal-zu-Rausch-Verhältnis, Fluoreszenzbasismesswert und zeitliche Dynamik 12,28,33. Die genaue Wahl des Sensors sollte berücksichtigt werden, alle diese Eigenschaften, die Art der Neuronen zu analysieren und die biologische Frage angesprochen. Aktuelle Sensoren melden Kalzium Veränderungen, die ziemlich gut korrelieren mit Aktionspotentiale 12,34, und ihre weitere Verbesserung, mit steigender Anzahl von spezifischen genetischen Fahrer Linien 35 gekoppelt wird auch weiterhin das Potenzial der optischen Bildgebung neuronaler Aktivität im intakten Fliege zu verbessern.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Wir erkennen an, Silke Sachse und Beate Eisermann in der Entwicklung dieser Methodik, Pablo Traversa für das Zeichnen der Montageblock Blaupausen und Daniela Pelz für die Verwendung des in Abbildung 1 schematisch. Wir danken Silke Sachse, Pavan Ramdya und Raphael Rytz für Anmerkungen zum Manuskript. R. Bell wird von einem Boehringer Ingelheim Stiftung PhD Fellowship unterstützt. Research in R. Benton-Labor wird von einem European Research Council Starting Independent Researcher Grant und die Swiss National Science Foundation finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagens | Lieferant | Katalog-Nummer | Kommentare |
| Cactus Wirbelsäule | Garten-Center | ~ 7mm langen, dünnen, nicht zu flexibel | |
| Kolophonium | Saiteninstrument Shop | ||
| Zweikomponenten-Silikon | WPI | KWIK-SIL | |
| Custom made Plexiglas Montageblock | Blueprints zur Verfügung http://neuro.uni-konstanz.de/j ove_mountingblock_blueprint / | ||
| Kupfergitter | Athene Grids | G220-5 | Normalerweise für die Elektronenmikroskopie Proben verwendet. |
| Schrauben | Eisenwarengeschäft | 2 mm Durchmesser | |
| Kunststoff-Deckgläschen | Plano-em | L4193 | 22 x 22 mm |
| Lötspitzen | Conrad Electronics | 830283-62 | |
| Geregelte Stromversorgung | Conrad Electronics | 511407-62 | |
| Dünner Draht | Isabellenhütte | Isa-Ohm- | 0,013 mm |
| Eicosan | Sigma | 21,927-4 | |
| Mikroskop | Zeiss | Axioexaminer D1 | |
| CCD-Kamera | Visitron | CoolSnap HQ | |
| Metafluor | Visitron | Acquisition Software | |
| Monochromator | Visitron | Visichrome | |
| Breakable Klingen | Fine Science Tools | 10050-00 | |
| Halter für Klinge | WPI | 14134 | |
| Sapphire Klinge | WPI | 500314 | Zweischneidige Klinge 1mm |
| Membran-Zapfsäulen | KNF Neuberger AG | NMP 830 KVE | |
| Saphir Klingenhalter | WPI | 500317 | |
| Drei-Wege-Ventil | Lee Company | LFAA1200118H | E-Konfiguration |
| Rotameter 500 ml / min | Analyt-MTC | 112-08SA | |
| Rotameter 5 l / min | Analyt-MTC | 102-08SA | |
| Bienenwachs | Siladent Technik | 209212 | ; |
| Cellulose-Pad | Kettenbach Medical | 31003 | |
| Pinzette | Plano-em | T5130 | Dumont Biologie # 5 |
| Spritzen | BD | 300928 | 2ml, Discardit II, 2Stück |
| Needles | Braun Sterican | 4665120 | 1,2 mm OD |
Referenzen
- Galizia, C. G., Rossler, W. Parallel olfactory systems in insects: anatomy and function. Annu. Rev. Entomol. 55, 399-420 (2010).
- Vosshall, L. B., Stocker, R. F. Molecular Architecture of Smell and Taste in Drosophila. Annu. Rev. Neurosci. 30, 505-533 (2007).
- Wilson, R. I., Mainen, Z. F. Early events in olfactory processing. Annu. Rev. Neurosci. 29, 163-201 (2006).
- Masse, N. Y., Turner, G. C., Jefferis, G. S. Olfactory information processing in Drosophila. Curr. Biol. 19, 700-713 (2009).
- Hansson, B. S., Anton, S. Function and morphology of the antennal lobe: new developments. Annu. Rev. Entomol. 45, 203-231 (2000).
- Galizia, C. G., Joerges, J., Kuttner, A., Faber, T., Menzel, R. A semi-in-vivo preparation for optical recording of the insect brain. J. Neurosci. Methods. 76, 61-69 (1997).
- Galizia, C. G., Menzel, R., Holldobler, B. Optical imaging of odor-evoked glomerular activity patterns in the antennal lobes of the ant Camponotus rufipes. Naturwissenschaften. 86, 533-537 (1999).
- Okada, K., Kanzaki, R., Kawachi, K. High-speed voltage-sensitive dye imaging of an in vivo insect brain. Neurosci. Lett. 209, 197-200 (1996).
- Carlsson, M. A., Knusel, P., Verschure, P. F., Hansson, B. S. Spatio-temporal Ca2+ dynamics of moth olfactory projection neurones. The European journal of neuroscience. 22, 647-657 (2005).
- Galizia, C. G., Vetter, R. S., Christensen, T. A. . Methods in Insect Sensory Neuroscience (Frontiers in Neuroscience). 13, 349-392 (2005).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nat. Biotechnol. 19, 137-141 (2001).
- Tian, L. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat. Methods. 6, 875-881 (2009).
- Miyawaki, A., Griesbeck, O., Heim, R., Tsien, R. Y. Dynamic and quantitative Ca2+ measurements using improved cameleons. Proc. Natl. Acad. Sci. U.S.A. 96, 2135-2140 (1999).
- Martin, J. R., Rogers, K. L., Chagneau, C., Brulet, P. In vivo bioluminescence imaging of Ca signalling in the brain of Drosophila. PLoS One. 2, 275-275 (2007).
- Murmu, M. S., Stinnakre, J., Martin, J. R. Presynaptic Ca2+ stores contribute to odor-induced responses in Drosophila olfactory receptor neurons. The Journal of Experimental Biology. 213, 4163-4173 (2010).
- Yuste, R., Miller, R. B., Holthoff, K., Zhang, S., Miesenbock, G. Synapto-pHluorins: chimeras between pH-sensitive mutants of green fluorescent protein and synaptic vesicle membrane proteins as reporters of neurotransmitter release. Methods Enzymol. 327, 522-546 (2000).
- Benton, R. Sensitivity and specificity in Drosophila pheromone perception. Trends Neurosci. 30, 512-519 (2007).
- Elliott, D. A., Brand, A. H. The GAL4 system : a versatile system for the expression of genes. Methods Mol. Biol. 420, 79-95 (2008).
- Lai, S. L., Lee, T. Genetic mosaic with dual binary transcriptional systems in Drosophila. Nat. Neurosci. 9, 703-709 (2006).
- Yagi, R., Mayer, F., Basler, K. Refined LexA transactivators and their use in combination with the Drosophila Gal4 system. Proc. Natl. Acad. Sci. U.S.A. 107, 16166-16171 (2010).
- Potter, C. J., Tasic, B., Russler, E. V., Liang, L., Luo, L. The Q System: A Repressible Binary System for Transgene Expression, Lineage Tracing, and Mosaic Analysis. Cell. 141, 536-548 (2010).
- Wang, J. W., Wong, A. M., Flores, J., Vosshall, L. B., Axel, R. Two-photon calcium imaging reveals an odor-evoked map of activity in the fly brain. Cell. 112, 271-282 (2003).
- Fiala, A. Genetically expressed cameleon in Drosophila melanogaster is used to visualize olfactory information in projection neurons. Curr. Biol. 12, 1877-1884 (2002).
- Ng, M. Transmission of olfactory information between three populations of neurons in the antennal lobe of the fly. Neuron. 36, 463-474 (2002).
- Sachse, S. Activity-dependent plasticity in an olfactory circuit. Neuron. 56, 838-850 (2007).
- Pelz, D., Roeske, T., Syed, Z., de Bruyne, M., Galizia, C. G. The molecular receptive range of an olfactory receptor in vivo (Drosophila melanogaster Or22a). J. Neurobiol. 66, 1544-1563 (2006).
- Silbering, A. F., Galizia, C. G. Processing of odor mixtures in the Drosophila antennal lobe reveals both global inhibition and glomerulus-specific interactions. J. Neurosci. 27, 11966-11977 (2007).
- Reiff, D. F. In vivo performance of genetically encoded indicators of neural activity in flies. J. Neurosci. 25, 4766-4778 (2005).
- Abuin, L. Functional architecture of olfactory ionotropic glutamate receptors. Neuron. 69, 44-60 (2011).
- Benton, R., Vannice, K. S., Gomez-Diaz, C., Vosshall, L. B. Variant ionotropic glutamate receptors as chemosensory receptors in Drosophila. Cell. 136, 149-162 (2009).
- Pelz, D. . Functional characterization of Drosophila melanogaster Olfactory Receptor Neurons. , (2005).
- Ai, M. Acid sensing by the Drosophila olfactory system. Nature. 468, 691-695 (2010).
- Martin, J. R. In Vivo Brain Imaging: Fluorescence or Bioluminescence, Which to Choose?. Journal of Neurogenetics. , 1-23 (2008).
- Jayaraman, V., Laurent, G. Evaluating a genetically encoded optical sensor of neural activity using electrophysiology in intact adult fruit flies. Front. Neural Circuits. 1, 3-3 (2007).
- Pfeiffer, B. D. Tools for neuroanatomy and neurogenetics in Drosophila. Proc. Natl. Acad. Sci. U.S.A. 105, 9715-9720 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten