Method Article
Imagerie de calcium des odeurs évoquées réponses dans le Drosophila Lobe antennaire
Dans cet article
Résumé
Nous décrivons une technique mis en place pour mesurer et analyser les odeurs évoquées réponses calciques dans le lobe antennaire de la vie Drosophila melanogaster.
Résumé
Le lobe antennaire est le centre olfactif primaire dans le cerveau des insectes et représente l'équivalent anatomique et fonctionnelle de l'ampoule olfactive des vertébrés 1-5. Olfactive informations dans le monde extérieur est transmise à l'lobe antennaire par olfactifs neurones sensoriels (ARS), qui séparent les régions distinctes de neuropile appelés glomérules selon au récepteur spécifique olfactive ils expriment. Ici, OSN axones font synapse avec les deux interneurones locaux (LNS), dont le processus peut innerver de nombreux glomérules différents, et les neurones de projection (SNP), qui véhiculent l'information olfactive à la hausse des régions du cerveau olfactif.
L'imagerie optique de l'activité de ARS, LNS et le PNS dans le lobe antennaire - traditionnellement en utilisant des indicateurs synthétiques de calcium (calcium, par exemple vert, FURA-2) ou la tension des colorants sensibles (par exemple RH414) - a longtemps été une technique importante pour comprendre comment olfactive stimuli sont représentés comme des modèles spatiaux et temporelsde l'activité glomérulaire chez de nombreuses espèces d'insectes 6-10. Développement des organismes génétiquement codés journalistes activité neuronale, comme les indicateurs de calcium fluorescents G-CAMP 11,12 et Cameleon 13, l'indicateur de calcium GFP-aequorine bioluminescente 14,15, ou un journaliste de la transmission synaptique, synapto-pHluorin 16 a fait l' système olfactif de la mouche des fruits, Drosophila melanogaster, particulièrement accessibles à l'imagerie neurophysiologique, complétant ses globale-décrites propriétés moléculaires, électrophysiologiques et neuroanatomiques 2,4,17. Ces journalistes peuvent être sélectivement exprimé par l'intermédiaire des systèmes binaires de contrôle transcriptionnel (par exemple GAL4/UAS 18, LexA / LexAop 19,20, Q le système 21) dans des populations définies de neurones au sein du circuit olfactif à disséquer avec une résolution spatiale et temporelle élevée comment odeur évoquée l'activité neuronale est représenté, modulé et transformé 22-24 </ Sup>.
Nous décrivons ici les méthodes de préparation et d'analyse pour mesurer les odeurs réponses évoquées dans le lobe antennaire chez la drosophile à l'aide du G-CAMP 25-27. La préparation animal est minimalement invasive et peut être adapté à l'imagerie en utilisant à grand champ microscopes, confocale et à deux photons.
Protocole
1. Assemblée Bloc de montage
- Le bloc de plexiglas de montage (figure 1A) doit être faite selon les spécifications exactes indiquées dans le plan (disponible auprès de
http://neuro.uni-konstanz.de/j ove_mountingblock_blueprint / ) Pour permettre un montage facile et une dissection de la mouche. Le fil à travers les vis de l'arrière, mais ne les s'étendent au-delà de la face du bloc; leur position est réglé pendant la préparation de l'animal (voir 2,7). - L'utilisation d'un semoir de précision, faire une brèche dans la frontière supérieure de la chambre circulaire de la mouche, à creuser sous la surface pour faire place à corps de la mouche, la réduction de l'épaisseur du bloc à ce point.
- Couper une grille de cuivre avec une perpendiculaire scalpel et à proximité du fond de la fente afin de créer un «collier». Assurez-vous que les deux volets qui en résultent sont au même niveau, car cela aidera l'insertion de la mouche.
- Avec un cure-dent, placez une petite goutte de superglue sur le bloc de montage ci-dessus de la chambre circulaire de la mouche. Placer la grille de cuivre sur la colle et la position de sorte que la fente est centrée sur le bloc (figure 1A). Appuyez doucement et retirer tout excès de colle. Avec une paire de pinces à épiler, ajouter quelques gouttes minuscules de colle sous les rabats de chaque côté et plier la grille sur la face avant du bloc de telle sorte que la fente est orientée vers le bas droite. Assurez-vous que le haut de la grille est de niveau avec le bloc. Laisser sécher complètement.
- Assembler un support de fil: couper une lamelle en plastique en deux et enlever une pièce centrale de faire un "U". Utilisez la cire d'abeille à coller un morceau de fil dans la partie supérieure du "U"; ne font pas le fil trop tendu.
- Construire le bouclier antennaire: faire un trou dans une lamelle en plastique avec un papier de perforation. Couper les bords de la lamelle à 0,5 x 0,7 cm. Collez la lamelle percée en plastique pour ruban adhésif, puis déposer une goutte d'éthanol sur la bande exposée à travers le trou deenlever l'adhésif.
2. Préparation des animaux
- Les mouches du génotype appropriée - c.-à-porter la combinaison souhaitée de "pilote" et l'activité-journaliste transgènes - devrait être de 1-3 semaines ancienne; la cuticule des mouches plus jeunes est trop mou et difficile à couper. Lorsque les expériences exigent une comparaison directe de différents génotypes, et afin de correspondre à l'expression du transgène niveaux, les mouches doivent être appariés pour l'âge afin d'éviter liées à l'âge des différences physiologiques. Si le genre n'est pas important, nous préférons utiliser des mouches femelles car ils ont une tête plus grosse et plus faciles à manipuler.
- Anesthésier mouches par refroidissement sur de la glace.
- Introduire une mouche dans le bloc de montage. Maintenir la volée par l'articulation de l'aile et le faire glisser, dorsale-première surface, le long de la fente de la grille de cuivre de manière à être suspendue par son col (figure 1B-C). Si nécessaire, le faire pivoter jusqu'à ce qu'il regarde vers le bas.
- Placez une épine de cactus bien en face de la fment la tête pour l'empêcher de s'échapper (Figure 1B-C). Placez le épine de cactus en face de la trompe pour l'empêcher de bouger. Fixer le épine de cactus pour le bloc en utilisant la cire d'abeille. Assurez-vous que le haut de la tête est au niveau du haut du bloc.
- Fixer la tête de la mouche sur le bloc avec une petite goutte de colophane (dissous dans de l'éthanol). Placer le bloc dans une zone de humidifié et permettre à la colophane durcir pendant environ une heure.
- En utilisant des pinces, tirez sur la plaque antennaire déposer et le fil sur le support (cire-latérale; voir 1.5) dans le pli cuticulaire entre l'antenne et la tête. Fixez le support à l'avant du bloc de cire d'abeille.
- En utilisant les vis construits dans le bloc, poussez doucement le support de fil avant pour créer un espace entre la plaque antennaire et la tête.
- Placer le bouclier antennaire (voir 1.6) au-dessus de la tête de la mouche avec le trou placé au centre. Fixer avec la cire d'abeille à la partie supérieure du bloc de montage.
- Utilisation d'une lame-séparateur, cuta petit trou dans la bande sur le bouclier d'exposer la cuticule de la tête de la mouche derrière l'antenne. Le trou ne doit pas s'étendre au-delà des yeux pour éviter la préparation de la fuite.
- Sceller le trou entre le ruban et la cuticule avec deux composants en silicium. Retirez tout excès de silicium à partir du dessus de la tête de la mouche.
- Déposer une goutte de solution saline de Ringer drosophile (130 mM NaCl, 5 mM de KCl, 2 mM de MgCl2, 2 mM de CaCl2, 36 mM de saccharose, 5 mM d'HEPES, pH 7,3) sur la tête. Assurez-vous qu'il n'y a pas de fuites: les antennes doivent rester complètement sec. En utilisant une lame de saphir, découpez un trou dans la cuticule. Tout d'abord, la légère note le long du pli cuticulaire directement derrière l'antenne, puis couper le long des yeux et à travers les ocelles sur le dos. Enfin, plier la pièce de la cuticule sur le bord marqué et coupé de la partie inférieure pour éviter la rupture des nerfs antennaires.
- Retirez délicatement les glandes et de la trachée avec des pincettes fines. Rincez à plusieurs reprises avec la drosophile de Ringer, en laissant une grosse goutte sur la tête.
3. Livraison de stimulation de l'odeur
- Odeur: seringues insérer un tampon de cellulose dans une seringue de 2 ml en plastique avec des pinces propres et pipette sur celui-ci (à l'aide des conseils de filtre) 20 pl de l'odeur, dilués comme vous le souhaitez dans un solvant approprié, en utilisant la pointe de la pipette à pousser la plaquette en profondeur dans le canon . Plug-and-bouchon de la seringue jusqu'à ce que nécessaire. Dilutions des odeurs fraîches doivent être préparées au moins tous les 3 mois (ou plus fréquemment des odeurs très volatiles et / ou souvent utilisé), et de nouvelles plaquettes doivent être préparés pour les seringues odeur juste avant chaque session d'enregistrement. Ne pas utiliser de tampons d'odeur pendant plus de trois stimulations, puisque la concentration d'odeur pourrait se désintégrer.
- Sur mesure olfactomètre (Figure 2): un courant d'air primaire (1 l / min) est dirigée à travers un tube en Téflon (0,4 mm de diamètre interne); 27 cm en amont de la sortie de ce tube, un courant d'air secondaire (1 l / min ) est ajouté. Les deux courants d'air sont générés par les pompes à membrane, etle débit est régulé par deux débitmètres indépendants. Les courants d'air peut être humidifié en passant par l'eau dans des bouteilles de gaz de lavage, même si les soins doivent être prises pour éviter la sur-humidification (soit plus de ~ 60%). Le courant d'air secondaire est dirigé soit par une seringue ou d'odeur une seringue vide: seringues sont reliés à l'écoulement d'air à travers une aiguille de seringue (1,2 mm de diamètre extérieur) perçant le piston. Une vanne à trois voies magnétique contrôlé par une unité de commande de soupape (VC6 par exemple Harvard Apparatus) est utilisé pour basculer entre l'air pur et le stimulus odeur.
4. L'imagerie in vivo
- Nous décrivons ici l'imagerie à l'aide d'un microscope fluorescent verticale (par exemple en position verticale fixe scène Zeiss Axio examinateur D1) équipé d'un objectif 20x de l'eau (p. ex Zeiss W "Plan-Apochromat" 20x / 1,0 M27 DIC) (Figure 2). Pour l'imagerie avec le G-CAMP (excitation / émission: 488/509 nm), utilisez un bloc filtre avec les propriétés suivantes: 450-490 nm filtre d'excitation, Miroir dichroïque (T495LP) et 500-550 nm filtre d'émission (Chroma HE). Placez le bloc de montage contenant la volée sous le microscope. Positionner la sortie des environ 0,5 cm à l'avant olfactomètre d'antennes de la mouche.
- Abaisser l'objectif jusqu'à ce qu'il touche la solution de Ringer sur la tête de la mouche. En regardant à travers le spectateur sous éclairage sur fond clair, la position de la préparation afin que le trou dans la capsule de la tête est centrée et ses frontières sont au point. Mettre à la lumière fluorescente et d'ajuster la mise au point jusqu'à ce que vous pouvez voir les neurones marqués (ressort de fluorescence verte basale de G-CAMP).
- Mise au point fine sur les glomérules d'intérêt par l'acquisition des images avec un dispositif à couplage de charge (CCD) (par exemple Coolsnap-HQ2 système de caméra numérique) monté sur le microscope en utilisant un logiciel d'acquisition approprié (par exemple Metafluor) (figure 3A). Fermer le diaphragme dans le trajet de lumière d'illumination pour limiter la lumière d'excitation à la zone imagée.
- Pour enregistrer odeur évoquéel'activité, définir la cadence d'acquisition à 4 Hz et ajuster le temps d'exposition pour obtenir des valeurs de fluorescence dans la plage dynamique de votre caméra CCD, mais pas inférieure à 1000 (unités arbitraires), avec au moins 12 bits de résolution dynamique. Le temps d'exposition ne doit pas dépasser 100 ms, si possible, pour réduire les G-CAMP photoblanchiment. Si la résolution spatiale de votre appareil photo le permet, vous pouvez augmenter le binning (nombre de puits sur la puce qui sera mis en cellule dans un pixel numérique) afin de réduire le temps d'exposition. On obtient des images des pixels (350x225 avec un binning de 2x2), correspondant à 210x135 um à la préparation. Ces paramètres sont optimales pour capturer l'odeur glomérulaires réponses induites par des G-Camp avec une résolution spatiale et temporelle tout en limitant bonne journaliste de blanchiment.
- Définissez les paramètres de mesure. En général, nous enregistrer pendant 10 secondes (soit 40 cadres), avec une stimulation odeur typique de départ de 4 secondes après le début de la période d'acquisition (cadre 15) et une durée d'une seconde (uusqu'à cadre 19). Une préparation à la mouche peut normalement être testés avec jusqu'à 25-30 stimuli odeurs différentes, souvent limitées par un déclin irréversible du signal fluorescent du reporter en raison de photoblanchiment. L'intervalle inter-stimulus dépendra de la force de la réponse observée et le taux de photoblanchiment. La longueur appropriée de l'intervalle inter-stimulus pour éviter l'adaptation sensorielle peut être déterminé de façon approximative par la présentation répétée d'une odeur de contrôle positif (s'il est connu) dans des expériences de première instance. L'inclusion de cette odeur toutes les ~ 10 stimuli dans une série donnée peut permettre la vérification de la viabilité et la réactivité constante de la préparation.
5. Traitement et analyse des données
Les données sont traitées à l'aide ImageJ (avec Mac biophotonique plug-in, www.macbiophotonics.ca ) et des programmes personnalisés écrits en Matlab et R comme suit:
- Corriger les artefacts de mouvement de l'échantillon:aligner toutes les images correspondant à une préparation des animaux (par exemple 30 mesures de 40 trames chacune) en utilisant le "corps rigide" mode de StackReg / TurboReg ( bigwww.epfl.ch / Thevenaz / stackreg ) dans ImageJ. Cette étape est nécessaire pour éliminer des changements dans la position des neurones marqués par rapport à la trame d'acquisition à l'intérieur et entre les mesures. Cependant, il est seulement possible de supprimer des changements dans le plan xy. Les données doivent être jetés s'ils ont de forts changements en bref se produire.
- Segment de la pile dans individuels mesures de 10 secondes (40-cadre).
- Corriger pour le blanchiment des artefacts: l'exposition à la lumière fluorescente provoquer la fluorescence à la pourriture lors d'une mesure unique de 10. Dans certains cas, il est important de corriger cette décadence avant d'analyser les données. Pour chaque mesure de calculer une trame de fond. Cela devrait être la moyenne de plusieurs trames avant le début du stimulus (p.ex. armatures 6-14). Divisez chaque trame par cette backgautour trame afin d'obtenir les changements relatifs de fluorescence. Calculer la valeur moyenne relative de fluorescence pour chaque trame en faisant la moyenne de tous les pixels dans la zone marquée par le G-CAMP. Monter une exponentielle double la courbe moyenne de fluorescence, donnant davantage de poids aux images avant le stimulus et un poids nul à l'époque de la réponse des odeurs (20 images après le début du stimulus dans notre cas). Soustraire la courbe ajustée de la courbe de rapport de fluorescence de chaque pixel. Multiplier les cadres corrigées par la trame de fond de ré-obtenir des données brutes. Ce type de correction peut conduire à une modification de la dynamique de réponse si le signal ne retourne pas à la ligne de base d'ici la fin de la mesure (par exemple, si inhibitrices ou très fort réponses excitatrices sont évoqués) (figure 4). Bien que la correction des artefacts de blanchiment est utile dans de nombreux cas, l'interprétation des paramètres temporels devraient être faites avec prudence, si une correction est appliquée l'eau de Javel.
- Calculer la variation relative de la fluorescence (& Delta; F / F) pour chaque trame de chaque mesure que (F i-F 0) / F 0 * 100, où F 0 est la trame de fond (voir 5.3), et F i la valeur de fluorescence pour la trame i-ième la mesure.
- Calculer la moyenne AF / F au sein d'une région circulaire d'intérêt dans un glomérule (figure 3B) avec un diamètre de 10 pixels pour obtenir des traces d'activité (figure 5A). Si vous le souhaitez, de transformer ces traces en utilisant heatmaps ImageJ (figure 5A).
- Calculer l'amplitude du pic de la réponse en soustrayant la moyenne AF / F de quatre cadres avant la stimulation de la moyenne AF / F de quatre cadres pendant le pic de la réponse. La même procédure est utilisée à la fois pour illustrer les schémas de réponse spatiale (voir figure 3B) et de quantifier l'amplitude de la réponse dans des régions spécifiques d'intérêt à travers les mouches (voir la figure 5B). La réponse de crête peut également être quantifié par l'intégration de la zone en dessous de la courbe du temps de l'impulsion, ou averaging les cadres autour du maximum de la réponse.
6. Les résultats représentatifs
Nous avons utilisé les protocoles ci-dessus pour enregistrer et analyser les réponses propionique acide évoqués de mouches exprimant G-28 CaMP1.6 sous le contrôle du promoteur pour le co-récepteur olfactif IR8a, qui est active dans plusieurs populations différentes de 29,30 ARS ( Figures 3-5). La stimulation par l'acide propionique à 1% provoque une augmentation du G-CAMP fluorescence - indiquant une augmentation du calcium intracellulaire - en ARS innervant deux glomérules, DC4 et DP1l (figure 3B). Nous illustrons différentes façons de représenter les données de mouches multiples de la figure 5: des traces d'activité en ligne, et une intrigue Heatmaps barre des réponses de pointe. Réponses acide propionique-évoqués ont des amplitudes de pointe distinctes et dynamiques temporelles dans DC4 et DP1l. En outre, bien que les réponses sont généralement robustes, la variabilité entre les animaux individuels peuvent également être observées à la fois dans les glomérules (il voiratmaps dans la figure 5A). Quantification des réponses de pointe (figure 5B) permet une comparaison statistique simple entre différents glomérules et odorants différents à travers les animaux. Cependant, les odeurs évoquées les réponses de calcium peut avoir non-uniformes dynamique temporelle, et de quantifier leur ampleur avec une seule valeur ne tient pas compte de cette complexité.

Figure 1. Schéma du bloc de montage (A) avant et (B) après l'introduction de la mouche, et (C) une vue de dessus en close-up (adapté à partir du 31).

Figure 2. Schéma du dispositif expérimental mis en place.

Figure 3. (A) Vue d'en haut de la préparation à la mouche après l'étape 2.8 (panneau de gauche) et des matières premières image de fluorescence de l'antelobes NNAL étiquetés avec le G-CaMP1.6 (génotype: promoteur IR8a: GAL4; UAS: G-CaMP1.6). DC4 et DP1l glomérules peuvent être distingués par leur morphologie, la taille et la position et sont marqués en rouge et bleu, respectivement.
(B) de couleur sur l'image codée en réponse à de l'acide propionique (1% v / v). L'image correspond à la AF / F du pic de la réponse calculée comme il est expliqué à l'étape 5.6 (voir aussi la figure 5A). Le ColorScale sur la gauche indique le% AF / F valeur. Les cercles noirs indiquent la position et la taille de la région d'intérêt utilisé pour quantifier les réponses (voir figure 5).
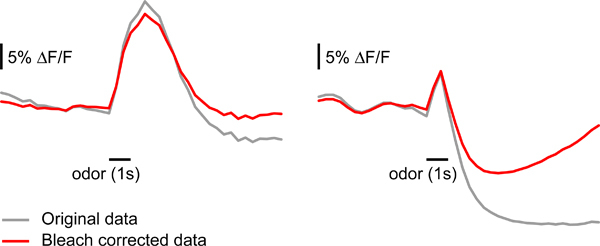
Figure 4. Correction de blanchiment du signal rapporteur fluorescent. Des exemples de l'effet de la correction de blanchiment tel que décrit à l'étape 5.3. Les données d'échantillon sur le panneau de gauche peuvent être corrigés sans changements majeurs dans la forme de la réponse. Les données d'échantillon sur le panneau de droite est sévèrement affectered par la correction eau de Javel, probablement parce que la chute du signal et est maintenue en dessous de référence après la fin de relance odeur.
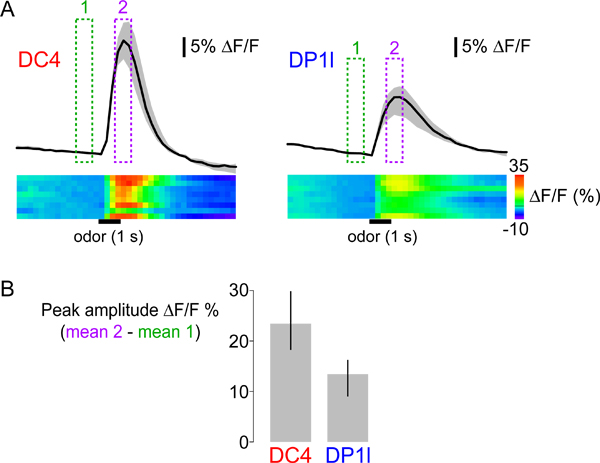
Figure 5 (A) Haut:. Dynamique temporelle de réponses calciques de glomérules DC4 (à gauche) et DP1l (à droite) à l'acide propionique (1% v / v). Les traces noires montrent la médiane de l'AF moyenne / F au sein de la région d'intérêt (voir figure 3B) à travers huit animaux. La surface grise indique l'écart entre les premier et troisième quartiles de la distribution. Présentation des valeurs médianes et quartile fournit plus d'informations sur la variabilité et la distribution des réponses observées que l'erreur moyenne et standard. Les cases vertes et magenta indiquent les cadres en moyenne pour calculer les réponses maximales indiquées sur la figure 3B, et quantifiés dans la figure 5B. En bas: les cartes thermiques montrent les données de réponse pour tous les animaux individuels dans des rangées séparées, avec AF / F des valeurs represented par le ColorScale (extrême droite). Les barres horizontales noires indiquent l'heure et la durée du stimulus. (B) médians des réponses maximales à l'acide propionique dans huit animaux pour DC4 et DP1l glomérules. Les barres d'erreur indiquent l'écart entre premier et troisième quartiles de la distribution.
Discussion
Les méthodes de préparation et d'analyse décrites ici peuvent être utilisées pour analyser les odeurs réponses évoquées dans une population de neurones dans le lobe antennaire (ARS, LN et PNS) pour lequel un transgène pilote correspondant est disponible. Alors que nous décrivons son application en utilisant un microscope à fluorescence, l'imagerie optique de cette préparation peut également être effectuée en utilisant la microscopie confocale à deux photons ou 22,32. En effet, ces derniers instruments d'atténuer le problème de la diffusion de la lumière à large champ microscopique, ce qui peut réduire la résolution des images, notamment lorsqu'un grand nombre de neurones expresse de la journaliste. Cette préparation permet généralement des enregistrements de mauvaises odeurs réponses évoquées pendant au moins une demi-heure, mais ce temps peut être plus ou moins longtemps selon le nombre et la longueur des mesures enregistrées, le temps d'exposition utilisé pour chaque trame et l'intervalle inter-stimulus. En outre, excitation à deux photons permet de réduire photoblanchiment de l'fluorescente représentantorter, ainsi que de phototoxicité cellulaire, pour permettre la mesure au cours des périodes plus longues 22,32.
Peu importe le choix d'un microscope, le mouvement du cerveau à la mouche au sein de la capsule céphalique est le problème le plus récurrent lorsque l'imagerie chez les animaux intacts. Alors que la correction du mouvement peut corriger les problèmes mineurs (étape 5.1), il est généralement préférable que d'enregistrer à partir de préparations très stables. Stratégies visant à réduire les artefacts de mouvement comprennent: (i) bien contraignant la trompe de la mouche avec la colonne vertébrale de cactus; (ii) à immobiliser les jambes de la mouche en les fixant à la scène avec eicosane (avant l'étape 2.6) (eicosane peut être fondu à ~ 37 ° C, utiliser un fil d'argent pour étendre et affiner la pointe du fer à souder à cet effet); (iii) d'entailler l'œsophage (visible entre les nerfs antennaires) avec des pincettes fines.
En plus du G-CaMP1.6 utilisé ici, un certain nombre de versions optimisées de G-Camp et indicateurs de calcium d'autres sont disponibles,qui diffèrent par leur rapport signal-bruit, la fluorescence de base et la dynamique temporelle 12,28,33. Le choix précis de la sonde devrait prendre en compte l'ensemble de ces propriétés, le type de neurones à être analysées et la question biologique abordée. Les capteurs de courant signaler les changements de calcium qui se corrèlent assez bien avec les potentiels d'action 12,34, et leur amélioration, associée à un nombre croissant de lignes spécifiques du pilote génétiques 35 continuera d'améliorer le potentiel de l'imagerie optique de l'activité neuronale chez la mouche intacte.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Nous reconnaissons Silke Sachse et Beate Eisermann dans le développement de cette méthodologie, Pablo Traversa pour dessiner les plans de blocs de montage et Daniela Pelz pour l'utilisation du schéma de la figure 1. Nous sommes reconnaissants à Silke Sachse, Pavan Ramdya et Raphaël Rytz pour les commentaires sur le manuscrit. R. Bell est soutenu par une bourse de la Fondation Boehringer Ingelheim doctorat. Recherche dans le laboratoire de R. Benton est financé par un Conseil européen de la recherche Starting Grant chercheur indépendant et le Fonds national suisse.
matériels
| Name | Company | Catalog Number | Comments |
| Réactif | Fournisseur | Numéro de catalogue | Commentaires |
| Cactus colonne vertébrale | Garden centre | ~ 7mm long et mince, pas trop souple | |
| Colophane | Instrument à cordes boutique | ||
| Deux silicium composante | WPI | KWIK-SIL | |
| Custom made bloc de plexiglas de montage | Blueprints disponibles à partir http://neuro.uni-konstanz.de/j ove_mountingblock_blueprint / | ||
| Des grilles de cuivre | Grilles Athene | G220-5 | Normalement utilisé pour les échantillons en microscopie électronique. |
| Vis | Quincaillerie | 2 mm de diamètre | |
| Lamelles en plastique | Plano-em | L4193 | 22 X 22 mm |
| Pointes de fer à souder | Conrad Electronics | 830283-62 | |
| Alimentation régulée | Conrad Electronics | 511407-62 | |
| Mince fil de fer | Isabellenhütte | Isa-ohm | 0,013 mm |
| Eicosane | Sigma | 21,927-4 | |
| Microscope | Zeiss | D1 Axioexaminer | |
| La caméra CCD | Visitron | Coolsnap HQ | |
| Metafluor | Visitron | Logiciel d'acquisition | |
| Monochromateur | Visitron | Visichrome | |
| Lames cassables | Outils belle science | 10050-00 | |
| Titulaire de la lame | WPI | 14134 | |
| Sapphire lame | WPI | 500314 | Double tranchant 1mm |
| Les pompes à essence à membrane | KNF Neuberger AG | NMP 830 KVE | |
| Porte-lame en saphir | WPI | 500317 | |
| Vanne à trois voies | Société Lee | LFAA1200118H | Configuration E |
| Rotamètre 500 ml / min | Analyt-MTC | 112-08SA | |
| Rotamètre 5 L / min | Analyt-MTC | 102-08SA | |
| Cire d'abeille | Siladent Technik | 209212 | ; |
| Cellulose pad | Kettenbach médicale | 31003 | |
| Pince à épiler | Plano-em | T5130 | Dumont biologie n ° 5 |
| Seringues | BD | 300928 | 2ml, Discardit II, 2pieces |
| Aiguilles | Braun Sterican | 4665120 | 1.2mm OD |
Références
- Galizia, C. G., Rossler, W. Parallel olfactory systems in insects: anatomy and function. Annu. Rev. Entomol. 55, 399-420 (2010).
- Vosshall, L. B., Stocker, R. F. Molecular Architecture of Smell and Taste in Drosophila. Annu. Rev. Neurosci. 30, 505-533 (2007).
- Wilson, R. I., Mainen, Z. F. Early events in olfactory processing. Annu. Rev. Neurosci. 29, 163-201 (2006).
- Masse, N. Y., Turner, G. C., Jefferis, G. S. Olfactory information processing in Drosophila. Curr. Biol. 19, 700-713 (2009).
- Hansson, B. S., Anton, S. Function and morphology of the antennal lobe: new developments. Annu. Rev. Entomol. 45, 203-231 (2000).
- Galizia, C. G., Joerges, J., Kuttner, A., Faber, T., Menzel, R. A semi-in-vivo preparation for optical recording of the insect brain. J. Neurosci. Methods. 76, 61-69 (1997).
- Galizia, C. G., Menzel, R., Holldobler, B. Optical imaging of odor-evoked glomerular activity patterns in the antennal lobes of the ant Camponotus rufipes. Naturwissenschaften. 86, 533-537 (1999).
- Okada, K., Kanzaki, R., Kawachi, K. High-speed voltage-sensitive dye imaging of an in vivo insect brain. Neurosci. Lett. 209, 197-200 (1996).
- Carlsson, M. A., Knusel, P., Verschure, P. F., Hansson, B. S. Spatio-temporal Ca2+ dynamics of moth olfactory projection neurones. The European journal of neuroscience. 22, 647-657 (2005).
- Galizia, C. G., Vetter, R. S., Christensen, T. A. . Methods in Insect Sensory Neuroscience (Frontiers in Neuroscience). 13, 349-392 (2005).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nat. Biotechnol. 19, 137-141 (2001).
- Tian, L. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat. Methods. 6, 875-881 (2009).
- Miyawaki, A., Griesbeck, O., Heim, R., Tsien, R. Y. Dynamic and quantitative Ca2+ measurements using improved cameleons. Proc. Natl. Acad. Sci. U.S.A. 96, 2135-2140 (1999).
- Martin, J. R., Rogers, K. L., Chagneau, C., Brulet, P. In vivo bioluminescence imaging of Ca signalling in the brain of Drosophila. PLoS One. 2, 275-275 (2007).
- Murmu, M. S., Stinnakre, J., Martin, J. R. Presynaptic Ca2+ stores contribute to odor-induced responses in Drosophila olfactory receptor neurons. The Journal of Experimental Biology. 213, 4163-4173 (2010).
- Yuste, R., Miller, R. B., Holthoff, K., Zhang, S., Miesenbock, G. Synapto-pHluorins: chimeras between pH-sensitive mutants of green fluorescent protein and synaptic vesicle membrane proteins as reporters of neurotransmitter release. Methods Enzymol. 327, 522-546 (2000).
- Benton, R. Sensitivity and specificity in Drosophila pheromone perception. Trends Neurosci. 30, 512-519 (2007).
- Elliott, D. A., Brand, A. H. The GAL4 system : a versatile system for the expression of genes. Methods Mol. Biol. 420, 79-95 (2008).
- Lai, S. L., Lee, T. Genetic mosaic with dual binary transcriptional systems in Drosophila. Nat. Neurosci. 9, 703-709 (2006).
- Yagi, R., Mayer, F., Basler, K. Refined LexA transactivators and their use in combination with the Drosophila Gal4 system. Proc. Natl. Acad. Sci. U.S.A. 107, 16166-16171 (2010).
- Potter, C. J., Tasic, B., Russler, E. V., Liang, L., Luo, L. The Q System: A Repressible Binary System for Transgene Expression, Lineage Tracing, and Mosaic Analysis. Cell. 141, 536-548 (2010).
- Wang, J. W., Wong, A. M., Flores, J., Vosshall, L. B., Axel, R. Two-photon calcium imaging reveals an odor-evoked map of activity in the fly brain. Cell. 112, 271-282 (2003).
- Fiala, A. Genetically expressed cameleon in Drosophila melanogaster is used to visualize olfactory information in projection neurons. Curr. Biol. 12, 1877-1884 (2002).
- Ng, M. Transmission of olfactory information between three populations of neurons in the antennal lobe of the fly. Neuron. 36, 463-474 (2002).
- Sachse, S. Activity-dependent plasticity in an olfactory circuit. Neuron. 56, 838-850 (2007).
- Pelz, D., Roeske, T., Syed, Z., de Bruyne, M., Galizia, C. G. The molecular receptive range of an olfactory receptor in vivo (Drosophila melanogaster Or22a). J. Neurobiol. 66, 1544-1563 (2006).
- Silbering, A. F., Galizia, C. G. Processing of odor mixtures in the Drosophila antennal lobe reveals both global inhibition and glomerulus-specific interactions. J. Neurosci. 27, 11966-11977 (2007).
- Reiff, D. F. In vivo performance of genetically encoded indicators of neural activity in flies. J. Neurosci. 25, 4766-4778 (2005).
- Abuin, L. Functional architecture of olfactory ionotropic glutamate receptors. Neuron. 69, 44-60 (2011).
- Benton, R., Vannice, K. S., Gomez-Diaz, C., Vosshall, L. B. Variant ionotropic glutamate receptors as chemosensory receptors in Drosophila. Cell. 136, 149-162 (2009).
- Pelz, D. . Functional characterization of Drosophila melanogaster Olfactory Receptor Neurons. , (2005).
- Ai, M. Acid sensing by the Drosophila olfactory system. Nature. 468, 691-695 (2010).
- Martin, J. R. In Vivo Brain Imaging: Fluorescence or Bioluminescence, Which to Choose?. Journal of Neurogenetics. , 1-23 (2008).
- Jayaraman, V., Laurent, G. Evaluating a genetically encoded optical sensor of neural activity using electrophysiology in intact adult fruit flies. Front. Neural Circuits. 1, 3-3 (2007).
- Pfeiffer, B. D. Tools for neuroanatomy and neurogenetics in Drosophila. Proc. Natl. Acad. Sci. U.S.A. 105, 9715-9720 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon