Method Article
Una lesione del nervo ottico Modello Crush murini per studiare la sopravvivenza delle cellule gangliari della retina
In questo articolo
Riepilogo
Questo protocollo mostra come etichetta retrogrado cellule gangliari della retina, e come fare successivamente un lesione da schiacciamento del nervo ottico al fine di analizzare la sopravvivenza delle cellule gangliari della retina e l'apoptosi. Si tratta di un modello di malattia sperimentale per diversi tipi di neuropatia ottica, compreso il glaucoma.
Abstract
Lesione al nervo ottico può portare alla degenerazione assonale, seguita da una morte graduale delle cellule gangliari della retina (RGCs), che si traduce in perdita di visione irreversibile. Esempi di questo tipo di malattie umane sono traumatiche neuropatia ottica e la degenerazione del nervo ottico nel glaucoma. E 'caratterizzato da cambiamenti tipici della testa del nervo ottico, progressiva degenerazione del nervo ottico, e la perdita delle cellule gangliari della retina, se non controllata, porta alla perdita della vista e cecità.
Schiacciare il nervo ottico (ONC) del modello lesioni mouse è un importante modello sperimentale di malattia traumatica neuropatia ottica, glaucoma, ecc In questo modello, la lesione da schiacciamento del nervo ottico conduce all'apoptosi delle cellule gangliari della retina graduale. Questo modello di malattia può essere usato per studiare i processi generali ed ai meccanismi di morte neuronale e la sopravvivenza, che è essenziale per lo sviluppo di misure terapeutiche. Inoltre, gli approcci farmacologici e molecolari può essere utilizzato in questo modello per individuare e testare i reagenti potenziale terapeutico per il trattamento di diversi tipi di neuropatia ottica.
Qui, mettiamo a disposizione una dimostrazione passo passo di (I) l'etichettatura di base retrograda di cellule gangliari della retina (RGCs) al giorno 1, (II) lesione da schiacciamento del nervo ottico al giorno 4, (III), raccogliere la retina e analizzare la sopravvivenza RGC al giorno 11, e (IV) risultato Rappresentante.
Protocollo
Tutte le attrezzature e reagenti utilizzati sono sterili. Tutti gli esperimenti sugli animali sono stati approvati dalla cura degli animali e utilizzo Comitato (ACUC) al NEI / NIH (protocollo di studio su animali NEI-570), e sono stati eseguiti secondo le linee guida NIH e regolamenti.
1. Baseline marcatura retrograda di cellule gangliari della retina (RGCs) al giorno 1
Lo scopo di questa procedura è quello di etichettare le cellule gangliari della retina retrogrado, iniettando un colorante tracciante neurale nel collicolo superiore dei topi tre giorni prima della lesione schiacciamento del nervo ottico. Il colorante sarà retrogrado ripreso dalle cellule gangliari della retina e fornisce un indicatore per la RGCs vita (Figura 1). Questo approccio produce etichettatura riproducibile di RGCs praticabile con piccole variazioni 1-5.
- Profondamente anestetizzare il mouse. Pulire i capelli sulla sommità della testa. Posizionare il mouse in un piccolo apparecchio stereotassico. Oinment protettiva viene applicata in entrambi gli occhi. Disinfettare la cute testa tre volte utilizzando un iodofori e una macchia di alcool al 70%.
- Fare un'incisione nella pelle per esporre il cranio, e tenerlo asciutto e pulito con acqua ossigenata al 3%.
- Identificare e contrassegnare il bregma. Praticare un foro al di sopra del collicolo superiore al 2,9 mm dietro il bregma e 0,5 mm lateralmente alla linea mediana di ciascun emisfero 7. Durante la perforazione, applicare soluzione salina per il sito in cui si è esercitato il buco per evitare lesioni secondarie di calore.
- Utilizzando un dispositivo stereotassico di misura e una siringa Hamilton, iniettare il FluoroGold neurale tracciante colorante (1 ml di Fluorocromo 3% in soluzione salina) molto lentamente nel collicolo superiore di ogni emisfero, ad una profondità di 1,6 mm dalla superficie ossea del cervello.
- Sutura del sito di incisione. Dare un iniezione sottocutanea di buprenorfina per l'analgesia.
- Muovi il mouse in una zona calda e secca e monitorare fino a quando non è in grado di mantenere una postura eretta, e tornare alla sua gabbia casa. Per i primi tre giorni dopo la procedura di etichettatura, analgesici sistemici (es. buprenorfina) e di attualità pomata antibiotica sono dati due volte al giorno e il mouse è strettamente monitorato.
2. Lesioni del nervo ottico Crush Al 4 ° giorno
In questa procedura, si applica una lesione da schiacciamento del nervo ottico per causare un danno primario al assoni (Figura 2), che porterà a una morte graduale delle cellule gangliari retiniche.
- Tre giorni dopo l'applicazione tracciante colorante, il mouse è profondamente anestetizzati. Utilizzando un microscopio da dissezione, la congiuntiva di un occhio è incisa a circa la posizione 04:00 con un paio di forbici primavera.
- Delicatamente deviare i muscoli orbitali e metterle da parte. Esporre il nervo ottico bianco alla sua uscita dal globo oculare. Fate attenzione a non danneggiare alcuna vasi sanguigni.
- Con l'aiuto di un paio di cross-azione forcipe, applicare una lesione da schiacciamento del nervo ottico a circa 2 mm dal bulbo oculare per circa 3 secondi. Fare molta attenzione a non danneggiare l'arteria oftalmica per causare sanguinamento.
- Dopo il completamento della lesione da schiacciamento, l'incisione viene suturata.
- Prima che il topo recupera da anestesia, dare una iniezione sottocutanea di buprenorfina per l'analgesia.
- Muovi il mouse in una zona calda e secca e monitorarlo, fino a quando non è in grado di mantenere una postura eretta e tornare alla sua gabbia casa. Per i primi tre giorni dopo la procedura di lesione da schiacciamento, analgesici sistemici (es. buprenorfina) e di attualità pomata antibiotica sono dati due volte al giorno e il mouse è strettamente monitorato.
3. Raccogliere i retina e analizzare sopravvivenza RGC Al Giorno 11
Lo scopo di questa procedura è quello di raccogliere le retinaeto analizzare la sopravvivenza delle cellule gangliari della retina.
- Al giorno 11 (giorno 7 dopo l'ONC), il mouse è eutanasia da CO 2 infusione e dislocazione cervicale.
- Gli occhi sono enucleato con l'aiuto di una pinza facendo pressione per l'orbita.
- Gli occhi sono fissi in soluzione di paraformaldeide al 4% per due ore e lavate in PBS per tre volte. Sezionare la retina. La procedura di dissezione retina è già stato pubblicato precedentemente da Giove nel 2010 da Gustmann, S. et al. 6, e quindi non sarà descritta qui.
- Le immagini delle cellule sopravvissute gangliari della retina sono effettuate utilizzando un microscopio a fluorescenza in regioni definite della retina, e la densità delle cellule gangliari della retina può essere contato. Un risultato rappresentante della fluorescenza marcata con cellule gangliari della retina, con o senza lesioni schiacciamento del nervo ottico è mostrato nella Figura 3.
4. Rappresentante dei risultati:
Per analizzare la sopravvivenza delle cellule gangliari della retina, sette giorni dopo l'infortunio schiacciamento del nervo ottico, la retina sono state raccolte, fisso, appiattita e montato. Immagini retiniche sono state scattate con un microscopio a fluorescenza. Rispetto al normale r illesoetina (a sinistra, Normale), il numero di RGCs vitali (verde, retrograda etichettato dal colorante FluoroGold neurale tracciante iniettato nel collicolo superiore) è significativamente più bassa nel retina con una ferita schiacciamento del nervo ottico (a destra, ONC) (Figura 3) .
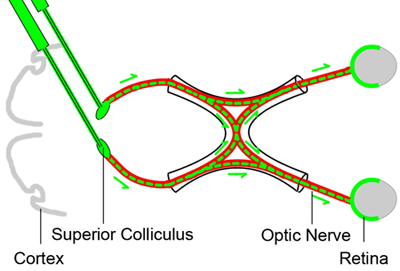
Figura 1. Baseline marcatura retrograda di cellule gangliari della retina
Al fine di contare le cellule vitali gangliari della retina in diversi momenti dopo l'infortunio schiacciamento del nervo ottico, le cellule gangliari della retina sono etichettati retrogrado iniettando una neurale tracciante colorante (colore verde) nel collicolo superiore del cervello tre giorni prima che il nervo ottico ( rosso) schiacciare lesioni. Dal momento che gli assoni delle cellule gangliari retiniche risiedono nel collicolo superiore, il colorante tracciante sarà ripresa dalla RGCs retrogrado e fornisce un indicatore per la RGCs vivere.

Figura 2. Lesione da schiacciamento del nervo ottico
Al fine di analizzare lo stato di sopravvivenza delle cellule gangliari della retina, una lesione da schiacciamento viene applicato al nervo ottico (rosso) per causare un danno primario al assoni. Questo porterà a una morte graduale delle cellule gangliari retiniche. Tre giorni dopo il colorante tracciante (verde) di iniezione, il mouse è anestetizzato. La congiuntiva di un occhio è incisa. Deviare i muscoli orbitali e metterle da parte. Esporre il nervo ottico alla sua uscita dal globo oculare. Applicare una lesione da schiacciamento del nervo ottico a circa 2 mm dal bulbo oculare per circa 3 secondi con un paio di cross-azione pinze.
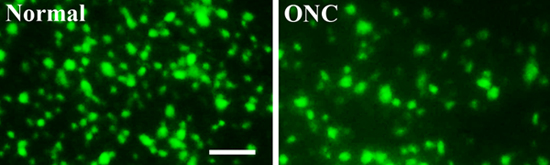
Figura 3. Fluorescenza etichettati cellule gangliari della retina, con o senza lesioni schiacciamento del nervo ottico
Per analizzare la sopravvivenza delle cellule gangliari della retina, sette giorni dopo l'infortunio schiacciamento del nervo ottico, la retina sono state raccolte, fisso, appiattita e montato. Immagini retiniche sono state scattate con un microscopio a fluorescenza. Rispetto alla retina indenne normale (a sinistra, Normale), il numero di RGCs vitali (verde, retrograda etichettato dalla neurali FluoroGold colorante tracciante iniettato nel collicolo superiore) è stata significativamente più bassa nel retina con una ferita schiacciamento del nervo ottico (a destra, ONC ) (Figura 3). Scala grafica: 50 micron
Discussione
L'ottica schiacciare modello murino lesione del nervo è utile per studiare il processo di morte RGC e sopravvivenza. Questo modello è anche spesso usato per studiare gli effetti di reagenti diversi e geni RGC apoptosi e la sopravvivenza. Un vantaggio di questo modello è che ha un alto grado di riproducibilità con minime varianti.
Tuttavia, particolare attenzione è richiesta in più fasi in questo modello. In primo luogo, al momento della lesione da schiacciamento del nervo ottico, è fondamentale non usare troppa forza e non schiacciare troppo a lungo, perché possono causare danni all'arteria oftalmica e quindi conseguente ischemia della retina. Inoltre, quando si cerca di esporre il nervo ottico, si dovrebbe prestare molta attenzione a non danneggiare i vasi sanguigni che circonda l'occhio di altri mouse.
Divulgazioni
Riconoscimenti
La nostra ricerca è sostenuta dal programma di ricerca intramurale del NIH, National Eye Institute.
Materiali
| Name | Company | Catalog Number | Comments |
| Stereotaxic apparatus | ASI Instruments | SAS-4100 | |
| Dissecting microscope | World Precision Instruments, Inc. | PZMIV-BS | |
| Scalpel handle | Fine Science Tools | 10003-12 | |
| Scalpel Blades #15 | Fine Science Tools | 10015-00 | |
| Microdrill | Fine Science Tools | 18000-17 | |
| Suture needle | Fine Science Tools | 12050-03 | |
| Spring scissors | Fine Science Tools | 16144-13 | |
| Dumont #5 forceps | Fine Science Tools | 11252-50 | |
| Hamilton syringe | Hamilton Co | 88400 | |
| Gauze sponges | Office Depot | 674889 | |
| Fluorochrome | Sigma-Aldrich | 39286 | |
| Alcohol | Sigma-Aldrich | 459844 | 70% |
| H2O2 | Sigma-Aldrich | H3410 | 3% |
Riferimenti
- Yoles, E. GM1 reduces injury-induced metabolic deficits and degeneration in the rat optic nerve. Investigative ophthalmology & visual science. 33, 3586-3591 (1992).
- Fisher, J. Vaccination for neuroprotection in the mouse optic nerve: implications for optic neuropathies. J Neurosci. 21, 136-142 (2001).
- Levkovitch-Verbin, H. RGC death in mice after optic nerve crush injury: oxidative stress and neuroprotection. Investigative ophthalmology & visual science. 41, 4169-4174 (2000).
- Li, Y. VEGF-B inhibits apoptosis via VEGFR-1-mediated suppression of the expression of BH3-only protein genes in mice and rats. The Journal of clinical investigation. 118, 913-923 (2008).
- Tang, Z. Survival effect of PDGF-CC rescues neurons from apoptosis in both brain and retina by regulating GSK3beta phosphorylation. The Journal of experimental medicine. 207, 867-880 (2010).
- Gustmann, S., Dunker, N. In vivo-like organotypic murine retinal wholemount culture. J Vis Exp. , (2010).
- Franklin, K., Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (1997).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon