Method Article
Ein Optic Nerve Crush Injury Mausmodell zur retinalen Ganglienzellen Survival Study
In diesem Artikel
Zusammenfassung
Dieses Protokoll zeigt, wie man retrograd Label retinalen Ganglienzellen, und wie man später machen ein Sehnerv Quetschverletzung um retinalen Ganglienzellen Überleben und Apoptose zu analysieren. Es ist eine experimentelle Krankheit Modell für verschiedene Arten von Optikusneuropathie, einschließlich Glaukom.
Zusammenfassung
Eine Verletzung des Sehnervs kann die axonale Degeneration führen, gefolgt von einer allmählichen Tod von retinalen Ganglienzellen (RGC), die zu einer irreversiblen Verlust der Sehkraft führt. Beispiele für solche Krankheiten in menschlichen gehören traumatische Optikusneuropathie und Sehnerv-Degeneration bei Glaukom. Es ist durch die typischen Veränderungen im Sehnervenkopf, progressive Degeneration des Sehnervs und der Verlust von retinalen Ganglienzellen, wenn unkontrolliert, was zu Sehverlust und Erblindung aus.
Der Sehnerv crush (ONC) Verletzungen Mausmodell ist eine wichtige experimentelle Krankheit Modell für traumatische Optikusneuropathie, Glaukom, etc. In diesem Modell das Gedränge Verletzung des Sehnervs führt zur allmählichen retinalen Ganglienzellen Apoptose. Diese Krankheit Modell kann verwendet werden, um die allgemeinen Prozesse und Mechanismen der neuronalen Tod und Überleben, die wesentlich für die Entwicklung von therapeutischen Maßnahmen ist zu studieren. Darüber hinaus können pharmakologische und molekularbiologische Ansätze in diesem Modell verwendet werden, um zu identifizieren und zu testen potenzielle therapeutische Reagenzien für verschiedene Arten von Optikusneuropathie zu behandeln.
Hier bieten wir Ihnen eine Schritt für Schritt Demonstration von (I) Baseline retrograde Markierung von retinalen Ganglienzellen (RGC) am Tag 1, (II) Sehnerv Quetschverletzung am Tag 4, (III) Ernte der Netzhaut und zu analysieren RGC Überleben am Tag 11, und (IV) repräsentatives Ergebnis.
Protokoll
Alle Geräte und Reagenzien sind steril. Alle Tierversuche wurden von der Animal Care genehmigt und Verwenden Committee (ACUC) an der NEI / NIH (Tier Studienprotokoll NEI-570), und wurden nach den NIH-Richtlinien und Vorschriften durchgeführt.
1. Baseline Retrograde Markierung von retinalen Ganglienzellen (RGC) Am Tag 1
Der Zweck dieses Verfahrens ist es, die retinalen Ganglienzellen retrograd Etikett durch die Injektion eines neuronalen Markierungsfarbstoff in den Colliculus superior der Mäuse drei Tage vor dem Sehnerv Quetschverletzung. Der Farbstoff wird retrograd entnommen werden von den retinalen Ganglienzellen und bietet ein Marker für die Lebenden RGCs (Abbildung 1). Dieser Ansatz führt zu reproduzierbaren Kennzeichnung von lebensfähigen RGCs mit wenig Variation 1-5.
- Tief betäuben die Maus. Reinigen Sie das Haar am Oberkopf. Platzieren Sie die Maus in einem kleinen stereotaktischen Apparat. Protective Salbe ist an beiden Augen angewendet. Desinfizieren Sie die Kopfhaut jeweils dreimal mit einem Iodophor und einem 70% igem Alkohol zu schrubben.
- Machen Sie einen Schnitt in der Haut am Schädel freizulegen, und halten Sie sie trocken und sauber mit 3% Wasserstoffperoxid.
- Identifizieren und markieren Sie die Bregma. Bohren Sie ein Loch über dem Colliculus superior bei 2,9 mm hinter dem Bregma und 0,5 mm lateral der Mittellinie jeder Hemisphäre 7. Während des Bohrens, gelten Kochsalzlösung auf der Stelle, wo das Loch gebohrt, um sekundäre Wärme Verletzungen zu vermeiden ist.
- Mit Hilfe eines stereotaktischen Messgerät und einem Hamilton Spritze die Fluorogold neuronalen Markierungsfarbstoff (1 ul von 3% Fluorochrom in Kochsalzlösung) sehr langsam in den Colliculus superior jeder Hemisphäre in einer Tiefe von 1,6 mm von der knöchernen Oberfläche des Gehirns.
- Suture die Inzisionsstelle. Geben Sie eine subkutane Injektion von Buprenorphin zur Analgesie.
- Bewegen Sie die Maus an einen warmen und trockenen Ort und zu überwachen, bis es in der Lage, eine aufrechte Haltung zu bewahren, und senden es an seinen eigenen Käfig ist. Für die ersten drei Tage nach der Kennzeichnung Verfahren, sind systemische Analgetika (zB Buprenorphin) und topische Antibiotika-Salbe zweimal täglich verabreicht und die Maus wird streng überwacht.
2. Optic Nerve Crush Injury An Tag 4
In diesem Verfahren werden wir ein Auge Verletzung des Sehnervs gelten für eine primäre Schädigung der Axone (Abb. 2), was zu einem allmählichen Absterben der retinalen Ganglienzellen führt zu verursachen.
- Drei Tage nach der Markierungsfarbstoff Anwendung ist die Maus tief narkotisiert. Mit einem Binokular ist der Bindehaut eines Auges an über die 4-Uhr-Position mit einem Paar Frühling Schere eingeschnitten.
- Sanft lenken den orbitalen Muskeln und legte sie beiseite. Setzen Sie die weiße Sehnerv an seiner Austrittsstelle aus dem Auge Globus. Achten Sie besonders darauf, keine Blutgefäße beschädigen.
- Mit Hilfe eines Paares von cross-action Zange, gelten verknallt Verletzung des Sehnervs bei etwa 2 mm vom Augapfel für ca. 3 Sekunden. Achten Sie besonders darauf nicht an die A. ophthalmica Schäden an Blutungen verursachen.
- Nach Abschluss der Quetschverletzungen, wird der Einschnitt vernäht.
- Bevor Sie die Maustaste wieder aus der Narkose, eine subkutane Injektion von Buprenorphin zur Analgesie.
- Bewegen Sie die Maus an einen warmen und trockenen Ort und überwachen sie, bis sie in der Lage, eine aufrechte Haltung zu bewahren und senden es an seinen eigenen Käfig ist. Für die ersten drei Tage nach dem Quetschverletzung Verfahren, sind systemische Analgetika (zB Buprenorphin) und topische Antibiotika-Salbe zweimal täglich verabreicht und die Maus wird streng überwacht.
3. Ernte der Netzhaut und Analysieren RGC Überleben an Tag 11
Der Zweck dieses Verfahrens ist die Ernte der retinaeto analysieren retinalen Ganglienzellen Überleben.
- Am Tag 11 (Tag 7 nach ONC), wird die Maus durch CO 2-Infusion und Genickbruch getötet.
- Die Augen sind mit Hilfe einer Pinzette durch Druck auf die Bahn entkernte.
- Die Augen sind in 4% Paraformaldehyd-Lösung für 2 Stunden fixiert und gewaschen in PBS dreimal. Präparieren Sie die Netzhaut. Das Verfahren der Netzhaut Dissektion wurde bereits zuvor von JoVE im Jahr 2010 veröffentlicht durch Gustmann, S. et al. 6, und wird daher hier nicht beschrieben werden.
- Bilder der überlebenden retinalen Ganglienzellen getroffen werden mit Hilfe eines Fluoreszenz-Mikroskops in definierten Regionen der Netzhaut und des retinalen Ganglienzellen Dichte gezählt werden können. Ein repräsentatives Ergebnis der Fluoreszenz-markierten retinalen Ganglienzellen mit oder ohne Sehnerv Quetschverletzung ist in Abbildung 3 dargestellt.
4. Repräsentative Ergebnisse:
Zur Analyse retinalen Ganglienzellen Überleben, sieben Tage nach der Sehnerv Quetschverletzung wurden die Netzhäute geerntet, fixiert, abgeflacht und montiert. Netzhautbilder wurden mit einem Fluoreszenz-Mikroskop. Verglichen mit dem unverletzten normalen retina (links, Normal), ist die Anzahl der lebensfähigen RGCs (grün, retrograd durch die Fluorogold neuronale Tracer Farbstoff in den Colliculus superior injiziert beschriftet) signifikant niedriger in der Netzhaut mit einer Sehnerv Quetschverletzung (rechts, ONC) (Abbildung 3) .
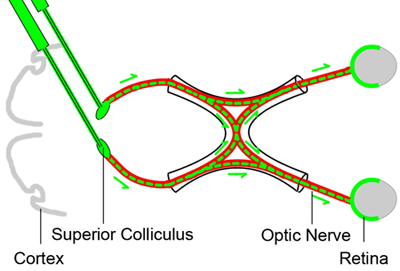
Abbildung 1. Baseline retrograde Markierung von retinalen Ganglienzellen
Um die lebensfähigen retinalen Ganglienzellen zu verschiedenen Zeitpunkten nach der Sehnerv Quetschverletzung zählen, sind die retinalen Ganglienzellen retrograd durch die Injektion eines neuronalen Markierungsfarbstoff (grüne Farbe) in den Colliculus superior im Gehirn drei Tage vor dem Sehnerv markierten ( rot) Quetschverletzung. Da die Axone der retinalen Ganglienzellen in den Colliculus superior befinden, wird der Tracer-Farbstoff durch die RGCs retrograd entnommen werden und stellt einen Marker für die Lebenden RGCs.

Abbildung 2. Sehnerv Quetschverletzung
Um den Status der retinalen Ganglienzellen das Überleben der Zelle zu analysieren, ist eine Quetschverletzung des Sehnervs (rot), die auf eine primäre Schädigung der Axone bewirken. Dies führt zu einer allmählichen Absterben der retinalen Ganglienzellen führen. Drei Tage nach der Tracer-Farbstoff (grün) Injektion, ist die Maus narkotisiert. Die Bindehaut eines Auges ist eingeschnitten. Auslenken Orbital Muskeln und legte sie beiseite. Setzen Sie den Sehnerv an seiner Austrittsstelle aus dem Auge Globus. Tragen Sie einen Quetschverletzung des Sehnervs bei etwa 2 mm vom Augapfel für etwa 3 Sekunden unter Verwendung eines Paares von Cross-Aktion Pinzette.
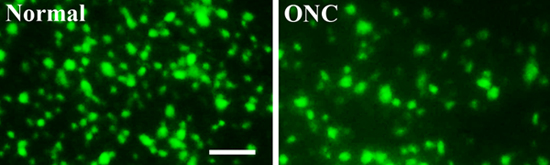
Abbildung 3. Fluoreszenz-markierten retinalen Ganglienzellen mit oder ohne Sehnerv Quetschverletzung
Zur Analyse retinalen Ganglienzellen Überleben, sieben Tage nach der Sehnerv Quetschverletzung wurden die Netzhäute geerntet, fixiert, abgeflacht und montiert. Netzhautbilder wurden mit einem Fluoreszenz-Mikroskop. Verglichen mit dem unverletzten normalen Netzhaut (links, Normal), wurde die Anzahl der lebensfähigen RGCs (grün, retrograd durch die Fluorogold neuronale Tracer Farbstoff in den Colliculus superior injiziert beschriftet) signifikant niedriger in der Netzhaut mit einer Sehnerv Quetschverletzung (rechts, ONC ) (Abbildung 3). Maßstabsbalken: 50 um
Diskussion
Der Sehnerv Quetschverletzung Mausmodell ist nützlich, um den Prozess der RGC Tod und Überleben zu untersuchen. Dieses Modell ist auch oft verwendet, um die Auswirkungen der verschiedenen Reagenzien und Gene auf RGC Apoptose und Überleben zu untersuchen. Ein Vorteil dieses Modells ist, dass es ein hohes Maß an Reproduzierbarkeit bei minimalen Variationen hat.
Allerdings ist besondere Sorgfalt in mehreren Schritten in diesem Modell erforderlich. Erstens, wenn was den Sehnerv Quetschverletzungen, ist es wichtig, nicht zu viel Gewalt anzuwenden und nicht zu lange zu vernichten, weil sie führen kann, um die A. ophthalmica und somit spätere Netzhautischämie Schäden. Darüber hinaus, wenn sie versuchen, um den Sehnerv aussetzen, sollte man große Sorgfalt nicht auf andere Blutgefäße rund um die Maus Augenschäden.
Offenlegungen
Danksagungen
Unsere Forschung wird durch die Interne Research Program des NIH, National Eye Institute unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Stereotaxic apparatus | ASI Instruments | SAS-4100 | |
| Dissecting microscope | World Precision Instruments, Inc. | PZMIV-BS | |
| Scalpel handle | Fine Science Tools | 10003-12 | |
| Scalpel Blades #15 | Fine Science Tools | 10015-00 | |
| Microdrill | Fine Science Tools | 18000-17 | |
| Suture needle | Fine Science Tools | 12050-03 | |
| Spring scissors | Fine Science Tools | 16144-13 | |
| Dumont #5 forceps | Fine Science Tools | 11252-50 | |
| Hamilton syringe | Hamilton Co | 88400 | |
| Gauze sponges | Office Depot | 674889 | |
| Fluorochrome | Sigma-Aldrich | 39286 | |
| Alcohol | Sigma-Aldrich | 459844 | 70% |
| H2O2 | Sigma-Aldrich | H3410 | 3% |
Referenzen
- Yoles, E. GM1 reduces injury-induced metabolic deficits and degeneration in the rat optic nerve. Investigative ophthalmology & visual science. 33, 3586-3591 (1992).
- Fisher, J. Vaccination for neuroprotection in the mouse optic nerve: implications for optic neuropathies. J Neurosci. 21, 136-142 (2001).
- Levkovitch-Verbin, H. RGC death in mice after optic nerve crush injury: oxidative stress and neuroprotection. Investigative ophthalmology & visual science. 41, 4169-4174 (2000).
- Li, Y. VEGF-B inhibits apoptosis via VEGFR-1-mediated suppression of the expression of BH3-only protein genes in mice and rats. The Journal of clinical investigation. 118, 913-923 (2008).
- Tang, Z. Survival effect of PDGF-CC rescues neurons from apoptosis in both brain and retina by regulating GSK3beta phosphorylation. The Journal of experimental medicine. 207, 867-880 (2010).
- Gustmann, S., Dunker, N. In vivo-like organotypic murine retinal wholemount culture. J Vis Exp. , (2010).
- Franklin, K., Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (1997).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten