Method Article
אופטימיזציה של טכניקות פוטו-נוירומודולציה כדי להעריך את תפקידן של דיודות פולטות אור ירוק בניהול כאב
* These authors contributed equally
In This Article
Summary
ההתפתחויות האחרונות בחקר הכאב מדגישות את הפוטנציאל של פוטונוירומודולציה באמצעות דיודות פולטות אור ירוק (GLED) כטיפול לא תרופתי. GLED מווסת את מסלולי הכאב, ומציע הקלה יעילה בכאב. מאמר זה נועד לתקנן ולחדד את פרוטוקולי החשיפה ל-GLED, לשפר את העקביות במחקרים ולקדם את היישום הקליני של טיפול זה.
Abstract
למרות מחקר מקיף וזיהוי מטרות משככות כאבים רבות, מגוון הטיפולים התרופתיים הזמינים לכאב נותר מוגבל. עם זאת, שינוי פרדיגמה פוטנציאלי יכול להציג גל חדש של טיפולי כאב לא תרופתיים עם בטיחות, יעילות וסבילות יוצאות דופן. תחום מחקר מבטיח אחד הוא פוטונוירומודולציה באמצעות דיודות פולטות אור ירוק (GLED, 525 ננומטר), שהראו פוטנציאל להקל על כאב במצבים אקוטיים וכרוניים כאחד, מה שהוביל למחקרים פרה-קליניים וקליניים רבים הבוחנים את יעילות הטיפול הזה. פרויקטים מחקריים אלה הדגימו כיצד חשיפה ל-GLED משפרת את הפעילות של מערכת האופיואידים האנדוגנית במוח ובחוט השדרה לאחר הפעלת חרוט M ברשתית. הממצאים מצביעים על כך ש-GLED עשוי להקל על הכאב על ידי ויסות מסלול הכאב היורד. לאור ההשפעות המשכנעות של GLED, ריבוי חקירות הפוטו-נוירומודולציה מדגיש את החשיבות של ביסוס עקביות בפרוטוקולי חשיפה מוגדרים וסטנדרטיים לניסויים פרה-קליניים וקליניים. במחקרים פרה-קליניים, נצפו השפעות מועילות לאחר מינימום של יומיים של חשיפה, עם פרוטוקולים הכוללים 8 שעות אור ב-100 לוקס במהלך שלב האור של 12 שעות. בניסויים קליניים, פרוטוקולי החשיפה מותאמים לפתולוגיה הספציפית הנחקרת. חשיפה למשך 15 דקות הוכחה כחיובית באפנון כאב חריף לאחר ניתוח. לצורך ויסות כאב כרוני, המטופלים מונחים להשתמש ב-GLED בבית למשך שעה עד שעתיים ביום במשך 10 שבועות. מאמר זה מפרט פרוטוקולים פרה-קליניים וקליניים לשיפור יכולת השחזור והעקביות במחקרים השונים המעריכים את יתרונות הפוטונוירומודולציה. על ידי קביעת פרוטוקולים סטנדרטיים אלה, עבודה זו שואפת לקדם את התרגום הקליני של פוטותרפיה GLED כטיפול לא תרופתי בר קיימא לכאב.
Introduction
טיפולים תרופתיים, במיוחד אופיואידים, ממשיכים להיות מסתמכים במידה רבה לניהול מצבי כאב חריפים וכרונייםכאחד. יעילות הטיפול בכאב יכולה להיות מושפעת באופן משמעותי מתדירות וחומרת תופעות הלוואי הקשורות לשימוש באופיואידים2. מסיבה זו, כמות ניכרת של מטופלים המטופלים בטיפול באופיואידים אינם משיגים טיפול מוצלח בכאב3. לפיכך, רופאי כאב וקהילת המטופלים מחפשים יותר ויותר טיפולים לא תרופתיים המונעים את תופעות הלוואי הקשורות לתרופות כאב מסורתיות. פוטונוירומודולציה התגלתה כפתרון מבטיח וטיפול בטוח לניהול כאב.
פוטונוירומודולציה (PNM) היא טכניקה לא פולשנית המשתמשת בדיודות פולטות אור (LED) כדי לווסת תהליכים ביולוגיים4. פוטותרפיה הוקמה לפני אלפי שנים באמצעות אור השמש, או הליותרפיה, לטיפול במצבי עור5. לאחר מכן, המושג של אור המשפיע על רקמות ביולוגיות התרחב, מה שהוביל לפיתוח המונח פוטונוירומודולציה. מחקר PNM מתרחב כעת ברחבי העולם והראה את יעילותו במגוון יישומים קליניים, כולל טיפול בכאב 6,7,8,9, שיפור איכות השינה בחולים עם מחלת אלצהיימר 10 ושליטה בדיכאון11.
ישנו דגש הולך וגובר על מחקר פרה-קליני וניסויים קליניים שמטרתם לחקור את המנגנונים והפוטנציאל הטיפולי של פוטונוירומודולציה לניהול כאב. בין הגישות הללו, טיפול בדיודות פולטות אור ירוק (GLED), באמצעות גירוי באורך גל של 525 ננומטר, הראה יעילות מבטיחה בהפחתת סוגים שונים של כאב, כולל מיגרנות, פיברומיאלגיה וכאבים לאחר ניתוח 12,13,14,15,16. ניסויים קליניים הראו כי טיפול באור ירוק מועיל באופן עקבי לחולים הסובלים ממיגרנה במספר מחקרים 12,17,18, על ידי הפחתת כאבי ראש ועוצמת פוטופוביה במהלך התקפי מיגרנה פעילים19, כמו גם הפחתת התדירות ומשך אפיזודות המיגרנה 12. מחקרים פרה-קליניים הראו גם כי חשיפה ל-GLED יכולה להפוך רגישות יתר תרמית ומכנית במודל פגיעה עצבית של כאב נוירופתי20. יתר על כן, מחקרים פרה-קליניים חקרו את המנגנונים שדרכם GLED משפיע על תפיסת הכאב והסף החושי 13,21,22,23,24. מחקרים אלה מדגישים את מעורבותם של חרוטי M ואת האפנון שלאחר מכן של גרעין הגניקולאט הצדדי הגחוני (vLGN), מה שמגביר את הפעילות של נוירונים אנקפלינרגיים המקרינים לגרעין הראפ הגבי (DRN)22. מחקר נוסף הדגיש גם את התפקיד הקריטי של המדולה הוונטרומדיאלית הרוסטרלית (RVM)21, מווסת מרכזי של אפנון כאב יורד. באופן קולקטיבי, ממצאים אלה מצביעים על כך ש-GLED משנה את תפיסת הכאב על ידי ויסות מעגלי הראייה הפועלים על מסלולי הכאב היורדים20,25. עם זאת, נדרש מחקר נוסף כדי להקל על תרגומו לשימוש קליני.
במאמר זה, אנו מפרטים מתודולוגיה מקיפה ליישום PNM מבוסס GLED, במטרה לספק מסגרת ניתנת לשחזור לשימוש ניסיוני וקליני כאחד. אנו מתארים את התכנון והתפעול של חשיפה ל-GLED, מתארים פרוטוקולי יישום סטנדרטיים ודנים בשיקולים מרכזיים להבטחת יעילות ושחזור. בנוסף, אנו מספקים פרוטוקול מפורט להערכת הפעילות של מסלולי כאב עולים ויורדים, המאפשר חקירה מעמיקה יותר של תפקידם בוויסות משככי כאבים הנגרמים על ידי GLED. על ידי שיתוף גישה זו, אנו שואפים לקדם את המחקר בטיפול בכאב לא תרופתי ולתרום לפיתוח טיפולים נגישים, יעילים ובטוחים יותר.
Protocol
כל ההליכים בבעלי חיים אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של אוניברסיטת אריזונה ותואמים את ההנחיות לשימוש בחיות מעבדה של המכונים הלאומיים לבריאות. חולדות ספראג דולי בוגרות נטולות פתוגנים (משקל בבדיקה: 275-330 גרם) שוכנו בכלובי חולדות ויווריום סטנדרטיים (3 חולדות בכלוב) בחדרים מבוקרי אקלים במחזור אור/חושך של 12 שעות והורשו לקבל גישה חופשית למזון ומים. כל הניסויים ההתנהגותיים נערכו על ידי נסיינים עיוורים לתנאי הטיפול. כל ההליכים האנושיים קיבלו אישור ממועצת הביקורת המוסדית של אוניברסיטת אריזונה (IRB) תחת מספר פרוטוקול (STUDY00000370). מחקר זה רשום אצל ClinicalTrials.gov תחת NCT05295225.
1. פרוטוקול חשיפה לאור בבעלי חיים
- אופטימיזציה של החשיפה לאור והכנת דיור לבעלי חיים
- השג פסי גמישות של דיודות פולטות אור בספקטרום גלוי (LED) עם המאפיינים הבאים: (i) נוריות LED ירוקות (טבלת חומרים), אורך גל של 525 ננומטר, הספק של 8 W, מתח של 120 V וזווית אלומה של 120°. (ii) נוריות LED לבנות (טבלת חומרים), הספק של 9.6 וואט, מתח של 120 וולט וזווית אלומה של 120°.
- ודא את הדיוק של ספקטרום האור באמצעות ספקטרומטר (למחקר זה השתמשנו בשירות אב טיפוס של מכשירים ביו-רפואיים ממכון BIO5 באוניברסיטת אריזונה).
הערה: נורית ירוקה צריכה להיות באורך גל מרכזי של 525 ± 10 ננומטר (נקודת הפליטה הבהירה ביותר), חצי מקסימום ברוחב מלא (FWHM) המשתרע על פחות מ-40 ננומטר, וירידת עוצמת שיא (שבה עוצמת האור יורדת ל-50% מהמקסימום) שצריכה להיות ב-500 ±-5 ננומטר ו-530 ±-5 ננומטר21. LED לבן FWHM צריך להשתרע על פני יותר מ-90 ננומטר. ניתן להשתמש במקורות מרובים של אור לבן. על הנסיינים להבטיח את העוצמה הנמוכה של אורך גל של 525 ננומטר וטווח גדול של הספקטרום, המכסה אורכי גל מרובים21. - השתמש במד לוקס (טבלת חומרים) כדי למדוד ולייעל את עוצמת האור. כסו את נוריות הלד בסרט שחור (טבלת חומרים) לפי הצורך כדי להשיג את העוצמה הרצויה.
הערה: זה חיוני למדוד ולאמת את עוצמת האור, מכיוון שעוצמות שונות יכולות להשפיע על ספי החישה בדרכים שונות (איור 1). אם העוצמה אינה מדויקת, כסה או חשוף חלק מהנוריות עד שתגיע לעוצמה הרצויה. - אבטח את פסי ה-LED לקצוות העליונים של מדפי התיל בחדר חשוך (טבלת חומרים) כדי להבטיח שכל מדף מצויד במקור חשיפה ייעודי לאור. הנח טיימרים (טבלת חומרים) על פסי ה-LED כדי לחשוף את הכלובים למשך 8 שעות ביום בין השעות 6:00-14:00.
- התקן כלובים סטטיים שקופים על המדפים. סגור את המדפים במלואם ביריעות כהות מכל הצדדים (טבלת חומרים) כדי לייעל את החשיפה תוך מזעור הפרעות אור.
- השתמש במד לוקס כדי להשיג את האופטימיזציה הסופית של עוצמת האור בתוך הכלוב על ידי כיסוי או חשיפה של חלק מנורות ה-LED (100 לוקס במרכז כל כלוב) (איור משלים 1).
- התמודדות עם התנהגות חושית בסיסית ותחילת חשיפה
- עם ההגעה, אפשרו לחולדות להתאקלם במתקן בעלי החיים למשך שבוע אחד. לאחר תקופת הסתגלות זו, הרגילו את החולדות לטיפול הנסיין למשך 7 ימים לפחות.
- סווגו את החיות לשלוש קבוצות ניסוי על סמך תנאי הטיפול שלהן: (1) חשיפה לאור ירוק (GLED) בשילוב עם התערבות כירורגית, (2) חשיפה לאור לבן (WLED) בשילוב עם התערבות כירורגית, ו-(3) קבוצת ביקורת WLED עם ניתוח דמה.
- אקלמו את החולדות בקופסאות פרספקס שקופות על רשת תיל (טבלת חומרים) למשך שעה אחת לפני הבדיקה, באותו חדר כמו אזור הבדיקה, כאשר הנסיין רצוי נוכח.
- כדי להעריך את הספים לפני הניתוח, מדוד את סף משיכת הכפות בשיטת דיקסון למעלה ולמטה עם חוטי פון פריי26 בכפה האחורית השמאלית (טבלת חומרים), החל מהחוט 4.31 (19.6 mN) כדי לקבוע את סף נסיגת הכפות הבסיסי.
הערה: יש להעריך את הרגישות המכנית בשיטת "למעלה ולמטה" על ידי קביעת סף הנסיגה. אם החיה אינה מגיבה לחוט ה-4.31 (19.6 mN), השתמש בחוט ה-4.56 העבה יותר (39.2 mN) (תגובה מצוינת חזותית כנסיגה, ניעור או ליקוק של הכפה הפגועה). אם החיה מגיבה לחוט 4.31, השתמש בחוט הדק יותר 4.08 (9.8 mN).- החל כל נימה בניצב למשטח הצמח של הכפה האחורית בזמן שבעלי החיים ממוקמים בכלובי רשת תיל תלויים.
- התאם את לחץ הנימה, גדל או יורד, בהתבסס על גודל החוט הקודם.
- המשך להשתמש בחוטים עבים או דקים יותר בהדרגה, תלוי אם לחיה היו תגובות חיוביות או שליליות לאחר מכן, בהתאמה.
- רשום תגובות שליליות וחיוביות בגיליון הנתונים המסופק בטבלה משלימה 1.
הערה: יש ליישם כל נימה בזה אחר זה באופן רציף. לאחר התגובה החיובית הראשונה, בדוק את אותה כפה 4 פעמים נוספות עם חוטים שונים. כדי להבטיח תוצאות אמינות בכל בעלי החיים, על הנסיין להימנע מהנחת החוט על כריות כף הרגל.
- אקלמו את החולדות בקופסאות פרספקס שקופות במכשיר Hargreaves (טבלת החומרים) למשך שעה אחת לפני הבדיקה באותו חדר כמו אזור הבדיקה כדי למדוד את קו הבסיס של רגישות תרמית באמצעות מבחן Hargreaves.
הערה: מבחן הרגריבס דורש מהחולדות להישאר דוממות למשך כמה שניות. אם החולדות עדיין פעילות יתר על המידה לאחר תקופת ההתרגלות הראשונית של שעה, האריכו את זמן ההתאקלמות לפי הצורך. ודאו שהחולדות רגועות ונייחות אך ערניות מספיק כדי להימנע מלהירדם. לפני ביצוע מבחן Hargreaves (טבלת חומרים), חיוני להגדיר את עוצמת האור האינפרא אדום כדי לקבוע קו בסיס למדידת רגישות לכאב. המטרה היא שהשהיית הנסיגה תהיה בממוצע בסביבות 20 שניות עבור קו הבסיס, מה שמספק מספיק רגישות כדי לזהות שינויים בתגובת הכאב, כגון היפר/היפואלגיזיה. עם נסיגת כפות, גלאי תנועה עוצר גם את הגירוי וגם את הטיימר. כדי למנוע נזק לרקמות, מוחל חתך מקסימלי של 33.5 שניות. - כדי להעריך את הסף ההתנהגותי לפני הניתוח, הנח את הלייזר האינפרא אדום מתחת למרכז הכף האחורית השמאלית של החיה (באמצעות הקווים המנחים של פולט האינפרא אדום).
- התחל את גירוי החום כדי למדוד את הזמן שלוקח לבעל החיים למשוך את כפו בתגובה לחום (חביון נסיגה).
הערה: אם חביון הנסיגה הממוצע אינו קרוב ל-20 שניות, התאם את העוצמה וחזור על הבדיקה עד לקביעת הממוצע הרצוי. לאחר מכן העוצמה נשמרת קבועה למשך שארית הניסוי. במחקר זה, השתמשנו בעוצמת גירוי של 30 (50 וואט). אם יש צורך לחזור על הבדיקה, אפשר מרווחים של 5 דקות לפני שתחזור על הבדיקה על אותה חיה. - רשום את חביון המשיכה בגיליון הנתונים המופיע בטבלה משלימה 2.
הערה: כדי להימנע מהשפעה על הטמפרטורה של גירוי החום, נקה כל שתן במהלך הניסויים.
- התחל את גירוי החום כדי למדוד את הזמן שלוקח לבעל החיים למשוך את כפו בתגובה לחום (חביון נסיגה).
- לאחר רכישת התנהגויות חושיות בסיסיות, שיכנו את בעלי החיים בכלובים סטטיים לחשיפה לאור עם גישה רציפה למזון ומים במשך 4 ימים לפני הניתוח (8 שעות ביום, מ-6 בבוקר עד 14:00).
- אינדוקציה של מודל כאב והערכה לאחר ניתוח של סף חושי
- לאחר סיום החשיפה בשעה 14:00 ביום הרביעי, בצע ניתוח חתך לפי מודל ברנן בכף האחורית השמאלית כדי לגרום לכאב לאחר הניתוח27,28.
- המשך את החשיפה ביום 5. לאחר סיום החשיפה בשעה 14:00 ביום החמישי, בצע את בדיקות פון פריי והרגריבס, כפי שתואר קודם לכן, כדי להעריך רגישות יתר תרמית ומכנית יום אחד לאחר הניתוח.
- המשך את החשיפה ביום 6. לאחר סיום החשיפה בשעה 14:00 ביום השישי, בצע את בדיקות פון פריי והרגריבס, כפי שתואר קודם לכן, כדי להעריך רגישות יתר תרמית ומכנית יומיים לאחר הניתוח.
הערה: אל תכלול כל בעל חיים במחקר אם הוא מגיע לקריטריוני הקצה שנקבעו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים. - לבצע המתת חסד בבעלי החיים בהתאם לפרוטוקולים שהותוו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים לאחר השלמת הבדיקות ההתנהגותיות.
- ניתוח נתונים מבעלי חיים
- הזן את דפוסי המשיכה המכניים של תשובות לתוכנת Allodynia (National Instruments, LabView 2015) כדי להעריך סף חושי מכני29.
הערה: התוכנה משתמשת בשיטת דיקסון הלא-פרמטרית, כפי שמפורט על ידי Chaplan et al.30. - דווח על חביון המשיכה בגיליון אלקטרוני לניתוח סטטיסטי עוקב של אלודיניה תרמית.
- צור תרשים המציג את הרגישות הממוצעת (ספים או חביות) כפונקציה של זמן.
- הזן את דפוסי המשיכה המכניים של תשובות לתוכנת Allodynia (National Instruments, LabView 2015) כדי להעריך סף חושי מכני29.
2. פרוטוקול חשיפה לאור בבני אדם
- הקמת חדר חשיפה להערכת נבדקים אנושיים
- התחל בהכנת חדר החשיפה, וודא שהוא נקי לחלוטין מכל מקורות אור חיצוניים כדי למנוע הפרעות פוטנציאליות.
הערה: שלב זה חיוני כדי לבודד את ההשפעות של נורות ה-LED. - מקם את נורות ה-LED במרחק של 3-6 רגל מכיסא המצולמים.
הערה: טווח זה מבוסס על ניסויים קליניים קודמים כדי להבטיח עוצמת אור עקבית וחשיפה יעילה. - התקן את פסי ה-LED באורך 2 מ', והבטיח את טווח עוצמת האור הרצוי של 90-100 לוקס באמצעות לוקסמטר (טבלת חומרים ואיור משלים 2).
- מטב את עוצמת האור על ידי מיקום מחדש של פסי האור או כיסוי חלק מנורות הלד, והבטח שהנבדקים יקבלו 90-100 לוקס באזור העיקרי שבו הם יושבים.
- התחל בהכנת חדר החשיפה, וודא שהוא נקי לחלוטין מכל מקורות אור חיצוניים כדי למנוע הפרעות פוטנציאליות.
- שלבי היכרות לבדיקת הערכת סיכום זמני מכני
- לפני ביצוע הערכה כלשהי, הקפידו על היגיינת ידיים נאותה על ידי שטיפת ידיים יסודית, ולאחר מכן חבישת כפפות.
- נקה וחטא את חוט פון פריי המכויל (6.65 mN, שווה ערך ל-300 גרם כוח) כדי להבטיח סטריליות לפני הערכת הרגישות המכנית.
- בקש רשות לחשוף את שריר הטרפז להערכה הקרובה.
- הודע למטופל כי נימה פון פריי תוחל על הצד הלא דומיננטי של שריר הטרפז עד שהחוט יתכופף.
- הנחו את המטופל לדרג את הכאב שלו בסולם של 0 עד 10, כאשר 0 מייצג ללא כאב, ו-10 מייצג את הכאב הגרוע ביותר שניתן להעלות על הדעת מיד לאחר שהמפעיל אומר "עכשיו".
הערה: ודא שהמטופל מספק תגובה מהירה ומדויקת כאשר המפעיל אומר "עכשיו". - החל את החוט 3 פעמים בשלוש נקודות שונות (במרחק של 1 סנטימטר זה מזה) על שריר הטרפז הלא דומיננטי, מה שמאפשר מרווח של 5 שניות בין כל יישום.
- הודע לנבדק כי נימה פון פריי תוחל 10 פעמים על אותה נקודה פעם בשנייה אחת ובקש מהנבדק לדרג את הכאב של היישום האחרון.
הערה: השתמש באותה נקודה בשריר הטרפז עבור כל 10 השימושים. - מדוד את אפקט הסיכום הזמני על ידי מריחת החוט 10 פעמים על הטרפז הלא דומיננטי ובקש מהנבדק לדרג את הכאב בסוף הגירויים.
- בדיקת סיכום זמני מכני
- לאחר שלבי ההיכרות, אפשר הפסקה של 3 דקות והודע למטופל כי חוט פון פריי יוחל על הצד הדומיננטי של שריר הטרפז.
- נקה וחטא את חוט פון פריי המכויל.
- הנחו את המטופל לדרג את הכאב שלו בסולם של 0 עד 10 מיד לאחר שהמפעיל אומר "עכשיו".
- מרחו את החוט 3 פעמים ב-3 נקודות שונות (במרחק של 1 סנטימטר זה מזה) על שריר הטרפז הדומיננטי, מה שמאפשר מרווח של 5 שניות בין כל יישום. רשום את תגובת המטופל בגיליון הרשומות (טבלה משלימה 3).
- הודע לנבדק כי חוט פון פריי יוחל 10 פעמים על אותה נקודה פעם בשנייה אחת ובקש מהנבדק לדרג את הכאב של היישום האחרון.
- מדוד את אפקט הסיכום הזמני על ידי החלת החוט 10 פעמים על הטרפז הדומיננטי. רשום את תגובת הנבדק בגיליון הרשומות (טבלה משלימה 3).
- חזור על התהליך פעמיים במרווחים של 3 דקות ורשום את תגובות הנבדקים בגיליון הרשומות (טבלה משלימה 3).
- שלבי היכרות להערכת אפנון כאב מותנה
- הכן אמבט מים קרים בטמפרטורה של 12 מעלות צלזיוס (איור משלים 3).
הערה: ודא את הטמפרטורה לפני הבדיקה באמצעות המדחום (טבלת החומרים). יש קרח נוסף במידת הצורך כדי להתאים את הטמפרטורה במהלך תקופת הבדיקה. - נקה וחטא את האלגומטר.
- השתמש בתוכנת Medoc להערכת CPM (טבלת חומרים).
- בחר באפשרות AlgoMed (איור משלים 4). במסך הבית, מצא ולחץ על התקן האלגומטר כדי להפעיל אותו.
- בחר את המטופל הנכון מהרשימה ובחר את תוכנית הבדיקה.
- בחר את האתר להחלת ההתקן. עבור שלב היכרות זה, בחר את שריר הטרפז הלא דומיננטי מתרשים הגוף (איור משלים 5).
הערה: לאחר לחיצה על עבור לבדיקה, אחד יופנה למסך הבדיקה. לפני הפעלת לחץ כלשהו, התוכנה תדרוש לבצע בדיקה מוקדמת, שבה המכשיר עדיין לא מפעיל לחץ. יש להשלים בדיקה מוקדמת זו בכל פעם שמתחילה בדיקה חדשה. - התחל בדיקה ופסק זמן של 5 שניות.
- יידע את המטופל כי המכשיר מודד את כמות הלחץ המופעל, והוא ישמש להפעלת לחץ על הצד הלא דומיננטי של שריר הטרפז. בקש מהמטופל לומר "עצור" ברגע שהוא מתחיל להרגיש כאב כלשהו.
- לחץ על התחל. המערכת תטיל המתנה של 5 שניות לפני שתתחיל ליישם את המכשיר.
- הפעל את האלגומטר על הטרפז על ידי הגדלת הכוח בקצב של 30 kPa/s (איור משלים 6).
- רשום את תגובת המטופל בגיליון הרשומות (טבלה משלימה 3).
הערה: עבור מחקר זה, הלחץ המרבי המופעל הוא 650 kPa. מחקר זה מעריך באופן ספציפי את הופעת הכאב, ולא מעריך את הסבילות לכאב. - הודע למשתתפים שהם ישתמשו באמבט מי קרח לצורך ההערכה.
- בדוק את טמפרטורת המים באמצעות המדחום (טבלת החומרים) בסביבות 12 מעלות צלזיוס. הגדר טיימר ל -10 שניות.
- הנחו את המשתתף לטבול את ידו הדומיננטית במים עד פרק כף היד, וודא שהיד רפויה והאצבעות מפושקות.
- בקשו מהמשתתף לדרג את הכאב שלו בסולם מ-0 עד 10 כאשר המפעיל אומר "עכשיו" עד סוף 10 שניות.
- בקש את דירוג הכאב בסוף 10 השניות ורשום את תגובת המטופל בגיליון הרשומה (טבלה משלימה 3).
- הכן אמבט מים קרים בטמפרטורה של 12 מעלות צלזיוס (איור משלים 3).
- בדיקת אפנון כאב מותנה
- בדוק את טמפרטורת המים באמצעות המדחום (טבלת חומרים).
- נקה וחטא את האלגומטר.
- לאחר הפסקה של 3 דקות, התחל את ההערכה של אפנון כאב מותנה (CPM) על ידי בקשת רשות לחשוף את שריר הטרפז הדומיננטי להערכה הקרובה.
- בקש מהמטופל לומר "עצור" ברגע שהוא מתחיל להרגיש כאב כלשהו. לחץ על התחל בתוכנה.
- החל את האלגומטר על הטרפז על ידי הגדלת הכוח בקצב של 30 kPa/s ורשום את תגובת המטופל בגיליון הרשומות (טבלה משלימה 3).
- חזור על היישום פעמיים נוספות באתרים שונים של שריר הטרפז הדומיננטי, עם מרווח של 3 דקות בין כל אחד מהם.
- ודא שהאלגומטר מנוקה ומחוטא ביסודיות לפני כל מריחה כדי למנוע החלקה הנגרמת מהצטברות שומני עור מהנבדקים.
- רשום את תגובת המטופל בגיליון הרשומות (טבלה משלימה 3). המתן 5 דקות לפני המעבר לבדיקת הגירוי המותנה.
- לחץ על התחל. המערכת תטיל המתנה של 5 שניות לפני שתתחיל ליישם את המכשיר.
- נקה וחטא את האלגומטר.
- הנחו את המטופל לטבול את ידו הלא דומיננטית עד פרק כף היד באמבט מי הקרח.
- החל את האלגומטר על הטרפז על ידי הגדלת הכוח בקצב של 30 kPa/s ורשום את תגובת המטופל בגיליון הרשומות (טבלה משלימה 3).
- חזור על המריחה פעמיים נוספות על אתרים שונים של שריר הטרפז, עם מרווח של 5 דקות בין כל אחד מהם.
הערה: הפסק את המחקר אם זוהה מצב רפואי שלא התגלה בעבר לאחר הבדיקה הראשונית, במיוחד אם למצב יש פוטנציאל להפריע למחקר. - לאחר רכישת ערכי הבסיס לפני החשיפה, התחל לחשוף את המטופל למצב האור שהוקצה לו.
- הנחו את המתנדבים להימנע מבהייה ישירה במקור האור.
הערה: במקום זאת, עליהם לאפשר לאור להיכנס לראייה ההיקפית שלהם כפי שהיו עושים עם כל מקור אור סביבתי בביתם (איור משלים 7). - חשוף את נושאי הצילום לתאורת LED למשך שעה וחצי.
הערה: לטיפול ממושך באור, הנבדקים מבצעים חשיפה עצמית בבית למשך עד 10 שבועות. סקרים, כגון שאלון ההשפעה על פיברומיאלגיה (FIQ), HIT-6 (מבחן השפעת כאב ראש), PSQI (מדד איכות השינה של פיטסבורג) ו-EQ-5D-5L (להערכת הבריאות הכללית), יחד עם שאלוני כאב, יכולים לשמש לניטור השפעות הטיפול לאורך זמן. - במהלך החשיפה עודדו את המתנדבים לעסוק בפעילויות שאינן דורשות מקורות אור נוספים, כגון קריאה או כתיבה.
הערה: עוצמות של 4-100 לוקס מספקות תאורה מספקת. - הימנעו משינה במהלך תקופת החשיפה כדי להבטיח הקפדה מלאה על הפרוטוקול.
- לאחר טיפול בחשיפה לאור, חזור על כל המדידות שהושלמו בקו הבסיס.
- ניתוח נתונים אנושיים
- לסיכום זמני מכני, חשב את הממוצע של 3 המדדים הבסיסיים ואת הממוצע של 3 הגירויים החוזרים על עצמם.
- חשב את אחוז הסיכום הזמני המכני על-ידי חלוקת דירוג הכאב הממוצע לאחר הגירויים החוזרים על עצמם בדירוג הכאב הבסיסי הממוצע והכפלת התוצאה ב-100 כדי לבטא אותה באחוזים.
הערה: אחוז גדול מ-100% מצביע על עלייה בתפיסת הכאב עם גירויים חוזרים ונשנים, מה שמרמז על נוכחות של סיכום זמני. - עבור אפנון כאב מותנה מכני (CPM), חשב את הממוצע של 2 ספי הכאב הבסיסיים האחרונים (ב-kPa) שהתקבלו במהלך הגירויים הבלתי מותנים (ללא אמבטיה קרה).
- חשב את הממוצע של 2 ערכי סף הכאב האחרונים (ב- kPa) במהלך גירוי ההתנייה.
- השתמש במשוואה הבאה כדי לחשב עלות לאלף חשיפות:

הערה: ערך CPM של 0 מציין שאין שינוי בתפיסת הכאב, ערך שלילי מציין עיכוב חושי כאב במהלך הגירוי המותנה, וערך חיובי מציין הקלה על הכאב במהלך הגירוי המותנה. - העריכו את השינויים הן בסיכום הזמן והן בעלות לאלף הופעות לפני ואחרי החשיפה לאור כדי להעריך כיצד הטיפול משפיע על פעילות מסלולי הכאב העולים והיורדים, בהתאמה.
תוצאות
חשיפה לאור ירוק מגדילה את השהיית נסיגת הכפות באופן תלוי מינון
איור 1A מדגים כי חשיפה לדיודות פולטות אור ירוק (GLED) בעוצמות שונות (4, 50, 100 ו-200 לוקס) הגדילה באופן משמעותי את השהיית נסיגת הכפות במודל חולדה נאיבי לאורך תקופת חשיפה של 7 ימים, מה שמעיד על השפעה אנטי-נוציספטיבית של GLED. השהיות הבסיס לפני החשיפה לאור היו דומות בין הקבוצות. החל מהיום הראשון, הקבוצות שטופלו ב-GLED החלו להראות עלייה הדרגתית בהשהיות הגמילה בהשוואה לקבוצת הביקורת של דיודות פולטות אור לבן (WLED), כאשר ההבדל הפך מובהק סטטיסטית ביום הרביעי (עמ' < 0.04). העלייה בהשהיות הגמילה הייתה בקורלציה חיובית עם עוצמת החשיפה ל-LED, כאשר העוצמה הגבוהה ביותר (200 לוקס) הניבה את ההשפעה האנטי-נוציספטיבית הגדולה ביותר, בעוד שעוצמות נמוכות יותר (4 לוקס) עדיין הראו השפעה ניכרת, אך לא משמעותית, בהשוואה לקבוצת הביקורת.
ההשפעה האנטי-נוציספטיבית של GLED תלויה בעוצמה
ניתוח השטח מתחת לעקומה (AUC) באיור 1B מאשר עוד יותר כי חשיפה ל-GLED גורמת לתגובה נוגדת כאבים תלוית עוצמה. ניתוח AUC של חביון נסיגת כפות רגליים במהלך תקופה של 7 ימים מראה כי עוצמת ה-GLED הגבוהה ביותר (200 לוקס) עוררה תגובה נוגדת כאב חזקה משמעותית בהשוואה לקבוצת הביקורת WLED (p = 0.0015). עוצמות ביניים של GLED (100 ו-50 לוקס) הביאו גם הן לעלייה משמעותית ב-AUC (p = 0.0068 ו-p = 0.0472, בהתאמה), בעוד שהעוצמה הנמוכה ביותר (4 לוקס) לא הגיעה למובהקות סטטיסטית בהשוואה ל-WLED (p = 0.7033). תוצאות אלו מצביעות על קשר ברור בין מינון לתגובה, עם עוצמות GLED גבוהות יותר וכתוצאה מכך השפעות משככות כאבים גדולות יותר.
חשיפה לאור ירוק מקלה על רגישות יתר לאחר הניתוח בחולדה
חשיפה ל-GLED ב-100 לוקס הפכה את רגישות היתר המכנית במודל כאב המושרה על ידי ניתוח כפות. לפני הניתוח, סף נסיגת כפות הרגליים הבסיסי היה עקבי בין הקבוצות. עם זאת, לאחר הניתוח, חולדות הראו ירידה ניכרת בסף נסיגת הכפות, מה שמעיד על רגישות יתר מכנית מוגברת. רגישות יתר זו התהפכה ביעילות לאחר 8 שעות של חשיפה יומית ל-LED ירוק ב-100 לוקס במשך 4 ימים לפני הניתוח (איור 2A,B). כמו כן הוערכה רגישות יתר תרמית, והדגימה ירידה משמעותית בחביון נסיגת הכפות לאחר הניתוח. בדומה להערכות המכניות, רגישות היתר התהפכה עם 8 שעות של חשיפה יומית ל-GLED (איור 2C,D). ממצאים אלה מדגימים את היעילות של חשיפה ל-GLED כהתערבות נוגדת כאב במודל כאב חריף לאחר הניתוח.
סיכום זמני ואפנון כאב מותנה בנבדקים אנושיים
בנבדקים בריאים, השתמשנו בסיכום זמני מכני (TS) כדי להעריך את הפעילות של מסלול הכאב העולה ובאפנון כאב מותנה מכני (CPM) כדי להעריך את הפעילות של מסלול הכאב היורד. הנבדקים הראו עלייה משמעותית ברגישות המכנית במהלך סיכום זמני (איור 3A). אחוז העלייה ברגישות המכנית בתגובה לגירויים חוזרים היה גבוה באופן ניכר, מה שמצביע על הקלה מרכזית מוגברת של כאב (p = 0.0039). ממצא זה משקף רגישות מוגברת לקלט נוסיספטיבי חוזר, העולה בקנה אחד עם סיכום זמני מוגבר. התוצאות ממבחן CPM מראות ירידה משמעותית ברגישות המכנית במהלך שלב הגירוי המותנה בהשוואה לשלב הגירוי הלא מותנה (איור 3B). הנבדקים הראו ירידה משמעותית ברגישות המכנית, עם ירידה ממוצעת של 37.32% (p = 0.0039). זה מצביע על הפעלה יעילה של מסלולי מעכבי הכאב היורדים, כפי שמעיד דיכוי תפיסת הכאב במהלך הגירוי המותנה. הערכות אלו מציעות פוטנציאל מבטיח לחשיפת המנגנונים הבסיסיים של אפנון כאב הנגרם על ידי חשיפה לאור ירוק בבני אדם.
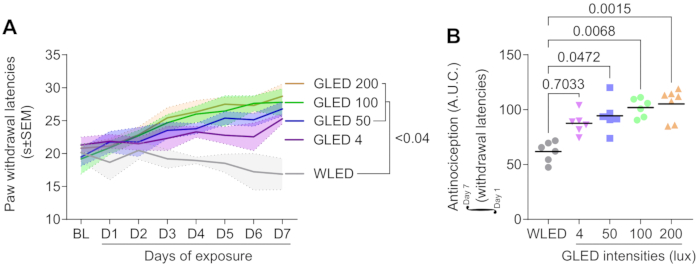
איור 1. עוצמת האור משפיעה על נוגדי כאב תרמיים בחולדות. חולדות זכרים נחשפו לאור LED ירוק (λ = 525 ננומטר) או LED לבן (8 שעות ביום, 100 לוקס) במשך 7 ימים רצופים, עם הערכות יומיות של רגישות תרמית באמצעות מבחן Hargreaves. ארבע עוצמות של LED ירוק (GLED) הוערכו (4, 50, 100 ו-200 לוקס). (A) רגישות תרמית נמדדה לפני חשיפה לאור (BL), ובמשך 7 ימים של חשיפה. ביום השביעי, 50 עד 200 לוקס של GLED מעלה את הסף החושי התרמי (ANOVA דו-כיווני ואחריו מבחן הפוסט-הוק של טוקי, n = 6-7, 0.192 < p < 0.392). (B) האזור מתחת לניתוח העקומה (ימים 1-7) בוצע כדי להעריך את ההשפעה הגלובלית של עוצמת האור במשך 7 ימים. משרעת ההשפעה האנטי-נוציספטיבית עולה עם עוצמת האור (מבחני הפוסט-הוק של קרוסקל-וואליס ודאן, n = 6-7). הנתונים מוצגים כממוצע ± SEM. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2. חשיפה ל-GLED הופכת היפרלגזיה תרמית ואלודינייה מכנית שנצפתה במודל חולדה של כאב חריף לאחר הניתוח. חולדות זכרים נחשפו לאור LED ירוק (λ = 525 ננומטר, GLED) או LED לבן (8 שעות ביום, 100 לוקס, WLED) 4 ימים לפני ניתוח חתך (משולש אדום, Sx) ויומיים לאחר הניתוח. אלודיניה מכנית והיפרלגזיה תרמית הוערכו באמצעות חוטי פון פריי ובדיקות הרגריבס, בהתאמה. (A) רגישות יתר מכנית הוערכה לפני הניתוח ויומיים אחריו. חולדות הראו ירידה משמעותית בסף נסיגת הכפות לאחר הניתוח. רגישות יתר זו התהפכה על ידי 8 שעות של חשיפה יומית ל-GLED (ANOVA דו-כיווני ואחריו מבחן הפוסט-הוק של Tukey, n=12-14). (B) ניתוחי שטח מתחת לעקומה (מיום 1 עד 2) עבור פאנל A. חשיפה ל-GLED הדגימה הנחתה של רגישות יתר מכנית (Kruskal Wallis ואחריו מבחן הפוסט-הוק של דאן). (C) רגישות יתר תרמית הוערכה לפני ויומיים לאחר הניתוח. חשיפה ל-GLED הגדילה את חביון נסיגת הכפות שנצפה בניתוח כפות בהשוואה למצב WLED (ANOVA דו-כיווני ואחריו מבחן הפוסט-הוק של Tukey, n = 14-15). (D) ניתוחי שטח מתחת לעקומה (מיום 1 עד 2) עבור פאנל C. לא נצפו הבדלים משמעותיים בין GLED וחיות ביקורת שלא עברו ניתוח, כמו גם חיות שעברו ניתוח אך נחשפו ל-WLED (מבחן הפוסט-הוק של Kruskal Wallis and Dunn). הנתונים מוצגים כממוצע±SEM. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3. סיכום זמני מכני ואפנון כאב מותנה שנצפה בנבדקים בריאים. ניתן למדוד סיכום זמני (TS) ואפנון כאב מותנה (CPM) בבני אדם כדי להעריך את הפעילות של מסלולי הכאב העולים והיורדים, בהתאמה. (A) TS מכני עבור כל נבדק, מבוטא כאחוז מהגירוי הראשוני. רצף של 10 גירויים מגביר משמעותית את תפיסת הכאב בהשוואה לגירוי בודד (מבחן דירוג Wilcoxon, n = 9).(B) CPM מכני, שמראה את הירידה בסף הכאב כאשר הגירוי מופעל במהלך גירוי מזיק אחר (אמבט מים קרים בטמפרטורה של 12 מעלות צלזיוס שימש כגירוי מותנה). הנבדקים הראו ירידה ברגישות לכאב במהלך CPM (מבחן Wilcoxon signed-rank, n = 10). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור משלים 1: מערך למגורים לבעלי חיים וחשיפה לאור. תמונה זו מציגה את מערך הדיור האופטימלי עבור חולדות במהלך ניסויי חשיפה לאור. ההתקנה כוללת מקורות אור קבועים הממוקמים מעל כל כלוב כדי להבטיח חשיפה עקבית. כדי למזער הפרעות אור ממקורות חיצוניים ובין כלובים, המדפים סגורים לחלוטין ביריעות כהות מכל הצדדים, מה שיוצר סביבה מבוקרת. סידור זה מבטיח חשיפה מדויקת וללא הפרעה לאור עבור בעלי החיים, ומאפשר הערכה מדויקת של השפעות החשיפה ל-GLED. אנא לחץ כאן להורדת איור זה.
איור משלים 2: מערך GLED לחשיפה של נבדקים אנושיים. תמונה זו ממחישה את ההתקנה של פסי LED ירוקים (GLED) באורך 2 מטר המשמשים לחשיפה לנושא אנושי. פסי ה-LED נבדקים כדי להבטיח טווח עוצמת אור עקבי של 90-100 לוקס, הנמדד ומאומת באמצעות לוקסמטר. סביבה מבוקרת זו מותאמת להערכת ההשפעות של אור ירוק על נבדקים אנושיים בניסויים קליניים. אנא לחץ כאן להורדת איור זה.
איור משלים 3: אמבט מים קרים לבדיקת אפנון כאב מותנה (CPM). תמונה זו מציגה את ההגדרה להערכת אפנון הכאב המותנה (CPM), הכוללת אמבט מים קרים הנשמר ב-12 מעלות צלזיוס. הטמפרטורה מאומתת בקפידה באמצעות מדחום לפני כל בדיקה כדי להבטיח דיוק. קרח נוסף נשמר בהישג יד כדי להתאים ולשמור על טמפרטורת המים לפי הצורך במהלך הבדיקה. אנא לחץ כאן להורדת איור זה.
איור משלים 4: צילום מסך של תוכנת מערכות רפואיות מתקדמות של Medoc. תמונה זו מציגה את צילום המסך של תוכנת המערכות הרפואיות המתקדמות של Medoc. מסך הבית מציג את בחירת מכשיר האלגומטר, המופעל על ידי לחיצה על הסמל המתאים. אנא לחץ כאן להורדת איור זה.
איור משלים 5: צילום מסך של תוכנת מערכות רפואיות מתקדמות של Medoc (בחירת מיקום הבדיקה). תמונה זו לוכדת את ממשק תוכנת המערכות הרפואיות המתקדמות של Medoc, ומדגישה במיוחד את דיאגרמת הגוף המשמשת לבחירת מיקום הבדיקה. תהליך בחירה זה חיוני להבטחת הערכת כאב מדויקת במהלך הערכות אפנון כאב מותנה (CPM), המאפשר מדידה ממוקדת של סף הכאב באזור השריר המיועד. אנא לחץ כאן להורדת איור זה.
איור משלים 6: ממשק במהלך הפעלת האלגומטר על שריר הטרפז. תמונה זו מציגה את ממשק התוכנה למערכות רפואיות מתקדמות של Medoc בזמן שמכשיר האלגומטר מופעל על שריר הטרפז. הממשק מציג נתונים בזמן אמת כאשר הכוח מוגבר בקצב של 30 קילופסקל לשנייה, מה שמבטיח שהכוח המופעל לא יעלה על 650 קילופסקל לשנייה. אנא לחץ כאן להורדת איור זה.
תרשים משלים 7: חשיפה ל-GLED וחדר בדיקות. תמונה זו מתארת את ההגדרה של חדר החשיפה והבדיקה של דיודה פולטת אור ירוק (GLED). סידור הישיבה נועד להבטיח למשתתפים נוחות וערנות, למזער את הסיכון להירדם תוך מתן חשיפה מלאה לאור. אנא לחץ כאן להורדת איור זה.
טבלה משלימה 1: גיליון איסוף נתונים לבדיקת פון פריי. טבלה זו מאפשרת לנסיינים למלא דפוסי תגובות בעת שימוש בחוטי פון פריי. אנא לחץ כאן להורדת טבלה זו.
טבלה משלימה 2: גיליון איסוף נתונים למבחן הרגריבס. טבלה זו מאפשרת לנסיינים לתעד ולתעד דפוסי תגובה שנצפו במהלך מבחן הרגריבס. אנא לחץ כאן להורדת טבלה זו.
טבלה משלימה 3: גיליון איסוף נתונים לרישום תגובות הנבדקים במהלך סיכום זמני ואפנון כאב מותנה (CPM). טבלה זו מספקת פורמט מובנה לנסיינים לתיעוד תגובות כאב שנצפו במהלך הערכות של סיכום זמני ואפנון כאב מותנה. אנא לחץ כאן להורדת טבלה זו.
Discussion
מחקרים אחרונים חקרו את המנגנונים העומדים בבסיס משככי כאבים באור ירוק (GLED) 13,21,22,23,24. עם זאת, יש צורך בסטנדרטיזציה נוספת של המתודולוגיה כדי לשפר את התרגום שלה לפרקטיקה קלינית. ההשפעות האנטי-נוציספטיביות תלויות המינון שנצפו במודלים פרה-קליניים מדגישות את החשיבות של אופטימיזציה של פרמטרי החשיפה כדי למקסם את התוצאות הטיפוליות. עם זאת, יש לאשר את ההשפעות הללו שנצפו במודלים של מכרסמים במסגרות קליניות. כדי לחקור את ההשפעות של GLED בבני אדם, הערכת סיכום זמני (TS) ואפנון כאב מותנה (CPM) מאפשרת לחוקרים לנתח את הפעילות של מסלולי הכאב העולים והיורדים, בהתאמה. CPM מבוסס על תופעה של גירוי נגדי, כאשר גירוי מזיק המופעל על חלק אחד של הגוף יכול לעכב כאב בחלק אחר על ידי הפעלת מערכת העיכוב היורדת31. TS מתייחס לעלייה בתפיסת הכאב בעקבות יישום סדרה של גירויים מזיקים, הניתנים בתדירות גבוהה ובאותה עוצמה, כדי להעריך את המסלול העולה להקלה על הכאב32. חוזק ייחודי של מחקר זה טמון בשילוב של פרוטוקולים פרה-קליניים וקליניים, המספקים מסגרת מקיפה המגשרת על הפער בין מחקר מעבדה לטיפול בחולים. על ידי שימוש במתודולוגיות סטנדרטיות על פני מודלים של בעלי חיים ובני אדם כאחד, עבודה זו מבטיחה עקביות והשוואה בהערכת ההשפעות של פוטותרפיה GLED. הכללת מודלים פרה-קליניים מאפשרת חקירה מבוקרת של מנגנונים העומדים בבסיס משככי כאבים הנגרמת על ידי GLED, כגון אפנון מסלולי כאב עולים ויורדים. ממצאים אלה ניתנים לתרגום ישיר למחקרים בבני אדם, שבהם הערכות של סיכום זמני (TS) ואפנון כאב מותנה (CPM) מספקות תובנות מכניסטיות חשובות לגבי אפנון כאב במטופלים.
בהתבסס על היתרונות המבטיחים של פוטונוירומודולציה (PNM), מספר מחקרים התמקדו באפיון המנגנונים העומדים בבסיס משככי כאבים הנגרמת על ידי GLED. במודלים פרה-קליניים, בעלי חיים נחשפו בדרך כלל ל-100 לוקס של GLED במשך 8 שעות ביום 13,20,21,33. עם זאת, היפוך רגישות היתר השתנה בהתאם למודל הכאב ודרש משכי חשיפה שונים. לדוגמה, במודל של נוירופתיה הנגרמת על ידי HIV, רגישות יתר מכנית התהפכה לאחר 3 ימי חשיפה, בעוד שהיפוך היפרלגזיה תרמית דרש 5 ימים13. באופן דומה, היפרלגזיה תרמית במודלים של כאב דלקתי התהפכה לאחר יומיים של חשיפה22. תוצאות אלה עולות בקנה אחד עם הממצאים שלנו, המדגימים את חשיבות המינון ומשך הזמן בהשגת השפעות נוגדות כאב אופטימליות. יש לציין כי המחקר המתואר כאן מרחיב את העבודה הקודמת הזו על ידי הדגשת הקשר בין עוצמת GLED לשיכוך כאבים, כאשר עוצמות גבוהות יותר מעוררות השפעות חזקות יותר. זה היה בולט במיוחד בבעלי חיים שנחשפו לפגיעת התכווצות כרונית, שהראו שיפור לאחר 3 ימים, אך עם עצימות מוגברת (200 לוקס) וחשיפה יומית קצרה יותר (4 שעות)23. במודל קשירת העצב הסיאטי החלקי, נצפו יתרונות לאחר יום אחד בלבד של חשיפה של שעתיים, מה שמצביע על כך שטיפול ב-GLED יכול להיות יעיל גם עם משכי חשיפה קצרים יותר24. בניגוד למודלים אלה של כאב כרוני, מודל דלקת מפרקים ניוונית בברך דרש 12 ימי חשיפה ב-8 שעות ביום כדי להפוך את רגישות היתר המכנית36. לבסוף, מחקר אחד על כאב לאחר ניתוח הראה מתאם חיובי בין משך החשיפה ל-GLED לבין נוגדי כאב, מה שמצביע על כך שמספר ימי החשיפה השפיע באופן משמעותי על האפקט משכך הכאבים21. ממצאים אלה מדגישים את החשיבות של התאמת משך החשיפה לפתולוגיה הספציפית ומדגישים את הצורך בפרוטוקולים סטנדרטיים כדי לאפשר השוואות עקביות של השפעות PNM על פני הפרעות חושיות שונות.
בבני אדם, טיפול ב-GLED הראה השפעות משככות כאבים במצבים כמו מיגרנה, פיברומיאלגיה וכאבים לאחר ניתוח 17,34,35,36. ניסויים קליניים על מצבים כרוניים מצביעים על כך שחשיפה ארוכת טווח היא הכרחית, כאשר מטופלים מדווחים בדרך כלל על הקלה בכאב לאחר שבועיים של חשיפה יומית (שעה עד שעתיים ביום). לעומת זאת, חשיפה לטווח קצר, כגון שימוש במשקפיים מסנני אור ירוק, הדגימה השפעות משככות כאבים תוך 15 דקות בלבד לאחר ניתוח שיניים36. זה עולה בקנה אחד עם תוצאות הספרות, המדגישות את היעילות המהירה של GLED במצבי כאב חריפים לצד היתרונות המתמשכים שלו בניהול כאב כרוני. מחקר זה גם שונה מכמה מחקרים קודמים על ידי שילוב הערכות TS ו-CPM כדי לחקור את הפעילות של מסלולי כאב עולים ויורדים. הערכות סטנדרטיות אלה יכולות לספק הבנה מכניסטית של האופן שבו GLED מווסת את תפיסת הכאב, תכונה שלעתים קרובות חסרה במחקרים קליניים קודמים. למרות שמחקרים פרה-קליניים מצביעים על מעורבות של מסלולי הכאב היורדים, יש צורך במחקר נוסף כדי לאשר את הממצאים הללו הן במסגרות פרה-קליניות והן במסגרות קליניות. בעוד שניסויים קליניים יכולים להסתמך על הערכת CPM, מחקרים פרה-קליניים יכולים גם לנתח שליטה יורדת בכאב כקריאה התנהגותית של עיכוב כאב יורד 37,38,39,40. מדידות עקביות וסטנדרטיות של פעילות מסלול הכאב חיוניות כדי להבהיר את המנגנונים הבסיסיים של משככי כאבים הנגרמת על ידי GLED.
ישנם מספר שלבים קריטיים בפרוטוקול זה. ראשית, מערך חשיפה מדויק לאור חשוב ביותר הן עבור בעלי חיים והן עבור בני אדם. הקפדה על אופטימיזציה נכונה של עוצמת החשיפה ל-GLED ומאומתת כראוי באמצעות לוקסמטר לפני תחילת הניסוי היא קריטית, שכן שינויים בעוצמת האור יכולים להשפיע באופן משמעותי על סף חושי ותוצאות משככות כאבים. בנוסף, יש לאמת את ספקטרום האור באמצעות ספקטרומטר כדי להבטיח שאורכי הגל של GLED נופלים בטווח שצוין ליעילות טיפולית. בידוד אזורי החשיפה על ידי ביטול מקורות אור חיצוניים חשוב כדי לוודא שאין הפרעות אור ולשמור על חשיפה אחידה בכל נושאי הצילום. בנוסף, יש חשיבות עליונה להשאיר את הנבדק האנושי ער בזמן החשיפה על ידי כך שהוא יעסוק בפעילויות שאינן דורשות מקור אור כלשהו, שכן הטיפול מסתמך על חשיפה חזותית עקיפה. במהלך בדיקות TS ו-CPM, כיול וחיטוי נכון של מכשירים כגון חוטי פון פריי (הימנע משימוש באחד שכבר כפוף) ואלגומטר חיוניים כדי להבטיח מדידות אמינות. חשוב לטפל בהסחות דעת על ידי מזעור רעש סביבתי במהלך הבדיקות. יתר על כן, טיפול זהיר והתאקלמות של נבדקים בעלי חיים עוזרים להפחית מתח ושונות, ומשפרים את יכולת השחזור של התוצאות. באופן דומה, יצירת סביבה מסבירת פנים ונוחה למשתתפים אנושיים היא קריטית, שכן סביבת מעבדה סטרילית או לא מוכרת עלולה להיות מאיימת ומלחיצה, מה שעלול לשנות את העיבוד החושי ולהשפיע על דיוק הערכות הכאב. הקפדה על אווירה מרגיעה ותומכת יכולה לעזור למשתתפים להרגיש בנוח, ולשפר את אמינות התוצאות. הסבירו לנבדקים בבירור את ההבדל בין שלב ההיכרות הראשונית לשלב הבדיקה השני, בו עליהם להתמקד. לבסוף, שמירה על עקביות בסולמות דירוג הכאב על פני הערכות היא חיונית. שימוש בסולמות שונים, כגון סולם 1-100 עבור CPM וסולם 1-10 עבור TS באותו מחקר, עלול לבלבל את המשתתפים ולהוביל לדירוגים לא מדויקים או לא אמינים. גישה סטנדרטית מבטיחה בהירות למשתתפים והשוואה של תוצאות בין מחקרים.
לשיטות מחקר קודמות יש מגבלות מסוימות, במיוחד בנוגע למחויבות הזמן הנדרשת מהנבדקים הקליניים, שחייבים להישאר במקום במשך שעתיים ביום במהלך מפגשי החשיפה. אילוץ זה מדגיש את הצורך בבחינה נוספת של שיטות חשיפה חלופיות. פיתוח מכשירים ניידים המספקים טיפול ב-GLED מבלי להגביל את הנבדקים לזמנים או מיקומים ספציפיים יכול לא רק לשפר את היענות המשתתפים אלא גם להקל על מחקרים בקנה מידה גדול יותר. חידושים כאלה יאפשרו חקירות מקיפות יותר לגבי היעילות והבטיחות ארוכות הטווח של טיפול באור ירוק.
לסיכום, הפרוטוקול המפורט המתואר בדוח זה מספק מסגרת לחקירת ההשפעות של GLED על רגישות לכאב. המשך המחקר והניסויים הקליניים יהיו חיוניים באימות משככי כאבים הנגרמים על ידי GLED ואופטימיזציה של טיפול זה ליישומים קליניים רחבים יותר.
Disclosures
ד"ר איברהים חשף עניין חיצוני ב-Luxxon Therapeutics לאוניברסיטת אריזונה. ניגודי אינטרסים הנובעים מאינטרס זה מנוהלים על ידי אוניברסיטת אריזונה בהתאם למדיניותה. לכל המחברים האחרים אין ניגוד אינטרסים לדווח. אף אחד ממחברי כתב היד לא קיבל כל תגמול, החזר או כבוד בכל דרך אחרת. המחברים אינם קשורים לאף ספק או חברת תרופות הקשורים למחקר זה. אף אחד מהמחקרים, כתב היד או התקציר הזה לא הוצג בעבר ואינו נשקל לפרסום על ידי אף כתב עת אחר.
Acknowledgements
מחקר זה נתמך על ידי המרכז המקיף לכאב והתמכרות - אוניברסיטת אריזונה (M.M.I., L.F.M.), מחלקת ההרדמה באוניברסיטת אריזונה (L.F.M.), והתוכנית להכשרת מדענים רפואיים (MSTP) באוניברסיטת אריזונה, המכללה לרפואה, טוסון.
Materials
| Name | Company | Catalog Number | Comments |
| 24 h Mechanical mini timer for LED strips | bn-link | BND-60/U47 | https://www.bn-link.com/products/bn-link-indoor-24-hour-mechanical-outlet-timer-3-prong-2-pack?variant=42704897245237¤cy= USD&utm_medium=product_sync& utm_source=google&utm_content= sag_organic& utm_campaign= sag_organic&gad_source=1& gclid=Cj0KCQjwurS3BhCGARI sADdUH50dy8sYj4Ku2ZmM14-3Yp3iajSY 4TgRze8UvSuyhq81-h 1E6GChOXgaAhwYEALw_wcB |
| AC 5050 SMD LED Tape Rope Strip Lighting | LED Supply Co | LS-AC50-GR | https://www.ledsupply.com/led-strips/ac-power-5050-led-strips Green Strip Lighting for all exposure rooms 120V AC, 60Hz |
| AC 5050 SMD LED Tape Rope Strip Lighting | LED Supply Co | LS-AC50-WH | https://www.ledsupply.com/led-strips/ac-power-5050-led-strips White Strip Lighting for all exposure rooms 120V AC, 60Hz |
| Allodynia Software | National Instruments, LabView 2015 | https://www.ni.com/en-us/shop/product/labview.html | |
| Amazon Basics Lightweight Super Soft Easy Care Microfiber 4-Piece Bed Sheet Set with 14-Inch Deep Pockets, Queen, Black, Solid | Amazon Basics Store | Amazon.com: Amazon Basics Lightweight Super Soft Easy Care Microfiber 4-Piece Bed Sheet Set with 14-Inch Deep Pockets, Queen, Black, Solid : Amazon Basics: Home & Kitchen | |
| Computerized Pressure Pain Algometer | Medoc advanced medical systems | ID 00186 | https://www.medoc-web.com/algomed |
| Digital Lux Meter | Edmund Optics | 52270 | https://www.edmundoptics.com/ |
| Elevated metal mesh stand for Von Frey | Bioseb | BIO-STD2-EVF | https://www.bioseb.com/en/pain-mechanical-allodynia_hyperalgesia/1689-elevated-metal_mesh-stand-30-cm-height-to-fit-up_to-2-pvf-cages.html |
| Fisherbrand Thermometers | Fischer Scientific | 13-201-577 | https://www.fishersci.com/shop/products/fisherbrand-10-30-ground-joint-thermometers-6/13201927 |
| Medline Autoclavable Plastic Washbasins | Truway Health | 42141606 | https://truwayhealth.com/medline-autoclavable-plastic-washbasins/?cmp_id=21122060336&adg_id= &kwd=&device=c& gad_source=1&gclid= CjwKCAjw0aS3BhA3EiwAKaD2ZTHY8_ 7W__ gXC7Wf3Kv3jJa6KQrNI-4JrdYqKM9IO v8moeW6ylEpzRoCnZ8QAvD_BwE |
| Modular holder cages for rats and mice | Bioseb | BIO-PVF | https://bioseb.com/en/pain-mechanical-allodynia-hyperalgesia/1206-modular-holder-cages-for-rats-and-mice.html |
| Plantar Test for Thermal Stimulation - Hargreaves Apparatus | Ugo Basile | 37570 | https://ugobasile.com/products/categories/pain-and-inflammation/plantar-test-for-thermal-stimulation includes semi-transparent glass panel and individual animal enclosures for 6 rats/12 mice |
| Scotch 700 Electrical Tape, 3/4 in. x 66 ft. x 0.007 in. | 3M | https://www.3m.com/3M/en_US/p/d/cbgnawus1596/ | |
| Touch Test Sensory Evaluators (von Frey Filaments) | North Coast Medical and Rehabilitation Products | NC12775-99 | https://www.ncmedical.com/products/touch-test-sensory-evaluators_1278.html |
| Touch Test Sensory Evaluators (von Frey Filaments) | North Coast Medical and Rehabilitation Products | NC12775-20 | https://www.ncmedical.com/products/touch-test-sensory-evaluators_1278.html |
| TRINITY EcoStorage 5-Tier , 48 x 24 x 72, Commercial Wire Shelving | Trinity | 952471 | https://trinityii.com/ecostorage-5-tier-48x24x72-wire-shelving-nsf-with-wheels-chrome/ |
References
- Alorfi, N. M. Pharmacological methods of Narrative review of medication used. Int J Gen Med. 16, 3247-3256 (2023).
- Cherny, N., et al. Strategies to manage the adverse effects of oral morphine: an evidence-based report. J Clin Oncol. 19 (9), 2542-2554 (2001).
- Hanks, G. W., et al. Morphine in cancer pain: modes of administration. Expert Working Group of the European Association for Palliative Care. BMJ. 312 (7034), 823-826 (1996).
- de Freitas, L. F., Hamblin, M. R. Proposed mechanisms of photobiomodulation or low-level light therapy. IEEE J Sel Top Quantum Electron. 22 (3), 7000417 (2016).
- Pathak, M. A., Fitzpatrick, T. B. The evolution of photochemotherapy with psoralens and UVA (PUVA): 2000 BC to 1992 AD. J Photochem Photobiol B. 14 (1), 3-22 (1992).
- Kemper, K. J. ."Let there be light." Research on phototherapy, light therapy, and photobiomodulation for healing - Alternative therapy becomes mainstream. Complement Ther Med. 41, A1-A6 (2018).
- Olesen, J., et al. Headache Classification Committee of the International Headache Society(IHS), The International Classification of Headache Disorders, 3rd edition. Cephalalgia. 38 (1), 1-211 (2018).
- Santiago, R., Gomes, S., Ozsarfati, J., Zitney, M. Photobiomodulation for modulation of neuropathic pain and improvement of scar tissue. Scars Burn Heal. 8, 20595131221134052 (2022).
- González-Muñoz, A., et al. Efficacy of photobiomodulation therapy in the treatment of pain and inflammation: A literature review. Healthcare (Basel). 11 (7), 938 (2023).
- Figueiro, M. G., et al. Tailored lighting intervention improves measures of sleep, depression, and agitation in persons with Alzheimer's disease and related dementia living in long-term care facilities. Clin Interv Aging. 9, 1527-1537 (2014).
- Eastman, C. I., Young, M. A., Fogg, L. F., Liu, L., Meaden, P. M. Bright light treatment of winter depression: A placebo-controlled trial. Arch Gen Psychiatry. 55 (10), 883-889 (1998).
- Martin, L. F., et al. Evaluation of green light exposure on headache frequency and quality of life in migraine patients: A preliminary one-way cross-over clinical trial. Cephalalgia. 41 (2), 135-147 (2021).
- Martin, L. F., et al. light antinociceptive and reversal of thermal and mechanical hypersensitivity effects rely on endogenous opioid system stimulation. J Pain. 22 (12), 1646-1656 (2021).
- Nelli, A., Wright, M. C., Gulur, P. Green light-based analgesia - novel non-pharmacological approach to fibromyalgia pain: A pilot study. Pain Physician. 26 (4), 403-410 (2023).
- Martin, L., et al. light exposure improves pain and quality of life in fibromyalgia patients: A preliminary one-way crossover clinical trial. Pain Med. 22 (1), 118-130 (2021).
- Qaiser, H., Uzair, M., Arshad, M., Zafar, A., Bashir, S. Evaluating the potential of green light exposure on nociception-A mini review. CNS Neurol Disord Drug Targets. 23 (6), 675-679 (2024).
- Lipton, R. B., et al. Narrow band green light effects on headache, photophobia, sleep, and anxiety among migraine patients: an open-label study conducted online using daily headache diary. Front Neurol. 14, 1282236 (2023).
- Posternack, C., Kupchak, P., Capriolo, A. I., Katz, B. J. Targeting the intrinsically photosensitive retinal ganglion cell to reduce headache pain and light sensitivity in migraine: A randomized double-blind trial. J Clin Neurosci. 113, 22-31 (2023).
- Noseda, R., et al. Migraine photophobia originating in cone-driven retinal pathways. Brain. 139 (7), 1971-1986 (2016).
- Ibrahim, M. M., et al. Long-lasting antinociceptive effects of green light in acute and chronic pain in rats. Pain. 158 (2), 347-360 (2017).
- Martin, L. F., et al. light exposure elicits anti-inflammation, endogenous opioid release and dampens synaptic potentiation to relieve post-surgical pain. J Pain. 24 (3), 509-529 (2023).
- Tang, Y. L., et al. Green light analgesia in mice is mediated by visual activation of enkephalinergic neurons in the ventrolateral geniculate nucleus. Sci Transl Med. 14 (674), eabq6474 (2022).
- Cao, P., et al. light induces antinociception via visual-somatosensory circuits. Cell Rep. 42 (4), 112290 (2023).
- Wu, X. Q., et al. Glutamatergic and GABAergic neurons in the vLGN mediate the nociceptive effects of green and red light on neuropathic pain. Neurobiol Dis. 183, 106164 (2023).
- Sprenger, C., Eichler, I. C., Eichler, L., Zöllner, C., Büchel, C. Altered signaling in the descending pain-modulatory system after short-term infusion of the µ-opioid agonist remifentanil. J Neurosci. 38 (10), 2454-2470 (2018).
- Zahn, P. K., Brennan, T. J. Primary and secondary hyperalgesia in a rat model for human postoperative pain. Anesthesiology. 90 (3), 863-872 (1999).
- Brennan, T. J., Zahn, P. K., Pogatzki-Zahn, E. M. Mechanisms of incisional pain. Anesthesiol Clin North Am. 23 (1), 1-20 (2005).
- Martin, L., et al. Conotoxin contulakin-G engages a neurotensin receptor 2/R-type calcium channel (Cav2.3) pathway to mediate spinal antinociception. Pain. 163 (9), 1751-1762 (2022).
- Korah, H. E., et al. Partial sciatic nerve ligation: A mouse model of chronic neuropathic pain to study the antinociceptive effect of novel therapies. J VIs Exp. (188), e64555 (2022).
- Chaplan, S. R., Bach, F. W., Pogrel, J. W., Chung, J. M., Yaksh, T. L. Quantitative assessment of tactile allodynia in the rat paw. J Neurosci Methods. 53 (1), 55-63 (1994).
- Lockwood, S., Dickenson, A. H. What goes up must come down: insights from studies on descending controls acting on spinal pain processing. J Neural Transm (Vienna). 127 (4), 541-549 (2020).
- Staud, R., Robinson, M. E., Price, D. D. Temporal summation of second pain and its maintenance are useful for characterizing widespread central sensitization of fibromyalgia patients. J Pain. 8 (11), 893-901 (2007).
- Ventura, L., et al. light exposure reduces primary hyperalgesia and proinflammatory cytokines in a rodent model of knee osteoarthritis: Shedding light on sex differences. Biomedicines. 12 (9), 2005 (2024).
- Cheng, K., Martin, L. F., Slepian, M. J., Patwardhan, A. M., Ibrahim, M. M. Mechanisms and pathways of pain photobiomodulation: A narrative review. J Pain. 22 (7), 763-777 (2021).
- Cheng, K., Martin, L. F., Calligaro, H., Patwardhan, A., Ibrahim, M. M. Case report: Green light exposure relieves chronic headache pain in a colorblind patient. Clin Med Insights Case Rep. 15, 11795476221125164 (2022).
- Takemura, Y., et al. Effects of green color exposure on stress, anxiety, and pain during peripheral intravenous cannulation in dental patients requiring sedation. Int J Environ Res Public Health. 18 (11), 5939 (2021).
- Berkley, K. J., Hubscher, C. H. Are there separate central nervous system pathways for touch and pain. Nat Med. 1 (8), 766-773 (1995).
- Bannister, K., Kucharczyk, M. W., Graven-Nielsen, T., Porreca, F. Introducing descending control of nociception: a measure of diffuse noxious inhibitory controls in conscious animals. Pain. 162 (7), 1957-1959 (2021).
- Millan, M. J. Descending control of pain. Prog Neurobiol. 66 (6), 355-474 (2002).
- Ossipov, M. H., Morimura, K., Porreca, F. Descending pain modulation and chronification of pain. Curr Opin Support Palliat Care. 8 (2), 143-151 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved