Method Article
הערכת ההשפעות של ביוטוקסינים על תפקודי תאי החיסון בדגי הזברה
In This Article
Summary
פרוטוקול זה מתאר בדיקות זרימה ציטומטריות שיכולות להעריך את ההשפעות של חשיפה לרעלנים על התפקודים האנדוציטיים של תת-אוכלוסיות שונות של לויקוציטים של דג הזברה. השימוש במעכבים פונקציונליים ספציפיים בבדיקה מאפשר בידול של המנגנונים האנדוציטיים שהשתנו.
Abstract
מגוון רעלים ביולוגיים יכולים להיות נוכחים ברמות מזיקות בסביבה המימית. ציאנובקטריה הם קבוצה מגוונת של מיקרואורגניזמים פרוקריוטיים המייצרים ציאנוטוקסינים בסביבה המימית. ביוטוקסינים אלה יכולים להיות הפטוטוקסינים, דרמטוקסינים או נוירוטוקסינים ויכולים להשפיע על דגים ויונקים. ברמות גבוהות, תרכובות אלה קטלניות. ברמות לא קטלניות, הם פועלים בערמומיות ומשפיעים על תפקודי תאי החיסון. ביוטוקסינים המיוצרים על ידי אצות כוללים מיקרוציסטין ואנטוקסין A. בעלי חיים ימיים יכולים גם לבלוע חומר מזוהם בבוטולינום נוירוטוקסין E (BoNT/E) המיוצר על ידי קלוסטרידיום בוטולינום, מה שגורם גם למוות או לירידה בתפקוד החיסוני. ניתן להשתמש בדג הזברה כדי לחקור כיצד רעלים משפיעים על תפקודי תאי החיסון. במחקרים אלה, חשיפה לרעלנים יכולה להתבצע in vivo או in vitro. מחקרי in vivo חושפים את דג הזברה לרעלן, ואז התאים מבודדים. שיטה זו מדגימה כיצד סביבת הרקמה יכולה להשפיע על תפקוד הלויקוציטים. מחקרי המבחנה מבודדים תחילה את התאים, ולאחר מכן חושפים אותם לרעלן בבארות תרבית. הלויקוציטים מתקבלים על ידי מיצוי מח כליה, ואחריו צנטריפוגה של שיפוע צפיפות. האופן שבו לויקוציטים מפנימים פתוגנים נקבע על ידי מנגנונים אנדוציטיים. מבחני פגוציטוזיס של זרימה ציטומטרית מדגימים אם מנגנונים אנדוציטיים השתנו על ידי חשיפה לרעלנים. חסרים מחקרים שבהם משתמשים בלויקוציטים מבודדים כדי לקבוע כיצד רעלנים גורמים להפרעות בתפקוד מערכת החיסון. ההליכים המתוארים במאמר זה יאפשרו למעבדות להשתמש בדגי זברה כדי לחקור את המנגנונים המושפעים כאשר רעלן סביבתי מפחית את התפקודים האנדוציטיים של תאי החיסון.
Introduction
ישנם סוגים רבים של רעלנים ביולוגיים סביבתיים וחומרים מדכאי חיסון. פריחת אצות שמכילה רעלנים חיידקיים מתרחשת במים הפנימיים, ויכולה להתרחש גם כביופילמים1. ציאנובקטריה (אצות כחולות-ירוקות) מופיעות באופן טבעי בכל המערכות האקולוגיות של מים מתוקים. פריחת ציאנובקטריאליות גדלה באופן משמעותי במערכות מים מתוקים2. בזמנים מסוימים, הציאנובקטריה יכולים לייצר רעלים המזיקים לבעלי חיים ימיים ויבשתיים. רעלנים אלה יכולים להשפיע על הכבד, העור והריריות, ו/או על מערכת העצבים. שתי תרכובות המיוצרות על ידי ציאנובקטריה הן מיקרוציסטין ואנטוקסין A. מיקרוציסטין הוא הפטפפטיד מחזורי3. אנטוקסין A הוא אלקלואיד4. בוטולינום נוירוטוקסין E (BoNT/E) הוא רעלן נוסף המופיע במערכות ימיות. הוא מיוצר על ידי Clostridium botulinum וניתן לבלוע אותו על ידי בעלי חיים ימיים5.
חשיפה לרעלים סביבתיים משפיעה על דגים ויכולה גם להשפיע על בריאות בעלי החיים ולהגביר את הופעת המחלות6. הבנת האופן שבו רעלנים אלה משפיעים על תאי החיסון היא בסיסית לקביעת הסיכונים הכרוכים בחשיפה לחומרים אלה. דג הזברה הוא מודל מצוין לחקר ההשפעות של רעלים סביבתיים על תאי חיסון7. פיתוח שיטה המשתמשת בציטומטריית זרימה ולויקוציטים של דג הזברה מועיל מאוד. לדגי הזברה יש רלוונטיות פיזיולוגית לבני אדם, וניתן ליישם שיטה זו במגוון רחב של תחומי מחקר, החל מטוקסיקולוגיה ואימונולוגיה בסיסית ועד לגילוי תרופות וביולוגיה התפתחותית. מכיוון שהם אורגניזמים מימיים, דגי הזברה מתאימים במיוחד לחקר ההשפעות של רעלים סביבתיים הנישאים במים7. השימוש בדגי זברה זול יותר מדגמי בעלי חוליות אחרים, והשימוש בהם מעלה פחות חששות אתיים.
תאי דם לבנים, או לויקוציטים, הם קו ההגנה הראשון של התאים מפני אורגניזמים הגורמים למחלות. אנדוציטוזיס הוא תהליך של תא שקולט או מפנים נוזל או חלקיק חיצוני לתא. זה מושג על ידי התא הסוגר את התרכובת בשלפוחית8. לויקוציטים משתמשים בתהליך זה כצעד ראשון בהרג פתוגנים והכנת הגנה מפני מחלות. פגוציטוזיס היא סוג של אנדוציטוזיס והייתה אחת השיטות הראשונות ששימשו לחקירת ההשפעות של מזהמים סביבתיים על בריאות הדגים9. מעבדת פטרי-הנסון פיתחה שיטות המשתמשות בלויקוציטים של דג הזברה כדי לסנן ביוטוקסינים ליכולתם הפוטנציאלית להפריע לתפקודים האנדוציטיים והפגוציטים של לויקוציטים ולהשפיע על ההגנות החיסוניות. סוגי האנדוציטוזיס הכלולים בשיטות אלה הם פינוציטוזיס, פגוציטוזיס, פגוציטוזיס בתיווך קולטן תלוי סידן ופגוציטוזיס בתיווך קולטן מאנוז. שימוש בשיטות ציטומטריית זרימה עם דג זברה תוארו לראשונה במעבדת פטרי-הנסון9 ומשמשות באופן שגרתי לחקירת רעלנים ופתוגנים מימיים. לדג הזברה המוטנטי Rag1-/- אין תאי T ו-B10 וניתן להשתמש בהם כדי לחקור באופן ספציפי מנגנוני תאי חיסון מולדים.
ציטומטריית זרימה מבוססת לייזר וניתן להשתמש בה כדי לקבוע את התכונות הפיזיקליות של התאים. ערך הפיזור קדימה או FSC משורטט על ציר X ומייצג את גודל התא. פיזור הצד, או SSC, משורטט על ציר Y ומייצג את הגרעיניות הציטופלזמית של התא. התרשים המתקבל מדגים אוכלוסיות של תאים בעלי מאפיינים פיזיים דומים מקובצים יחד, כאשר סוגי התאים השונים מופיעים במיקומים שונים בחלקת פיזור. אוכלוסיות אלה יכולות לשנות את מיקומן בתרשים הפיזור כאשר המאפיינים הפיזיים של התאים משתנים9. שימוש בטכניקה זו עם לויקוציטים של דג הזברה מאפשר לחוקרים להעריך שינויים באוכלוסיות התאים בתגובה לגירויים שונים, כולל רעלים סביבתיים.
ציטומטר הזרימה הוא רב מימדי, וניתן להשתמש במספר סוגים של פלואורופורים בהערכה כדי לאפיין עוד יותר את התאים ואת פעילותם. במבחנים המתוארים בפרוטוקול זה, אנדוציטוזיס מאופיינת במדידת כמות החומר הפלואורסצנטי שהתא הפנים. אם וכיצד חשיפה לרעלן משפיעה על מנגנונים אנדוציטיים ניתן לקבוע על ידי השוואת היכולת של תאים שנחשפו לרעלן לקלוט את החומר בהשוואה ליכולתם של תאים שאינם חשופים לרעלנים באמצעות ציטומטריית זרימה. התהליכים האנדוציטיים שניתן להעריך בדרך זו כוללים פינוציטוזיס, אנדוציטוזיס בתיווך קולטן ופגוציטוזיס.
פינוציטוזיס היא ספיגה של רכיבים מסיסים, והיא אינה משתמשת בקולטני תאים. הספיגה כוללת סידור מחדש ציטופלזמי על ידי מיקרו-פילמנטים ומיקרו-צינורות ליצירת ואקואולים קטנים. לוציפראז צהוב (LY) הוא צבע פלואורסצנטי המשמש למדידת ספיגת נוזלים על ידי פינוציטוזיס לא סלקטיבי11. אנדוציטוזיס בתיווך קולטנים כרוך בספיגה סלקטיבית של מולקולות גדולות. ניתן להשתמש ב-Fluorescein (FITC) עם התווית דקסטרן (DX) 40 כדי להעריך תהליך זה. פגוציטוזיס היא צורה של אנדוציטוזיס הבולעת חלקיקים גדולים מ- 0.5 מיקרומטר. תהליך זה נחקר על ידי נהלים המשתמשים ב-FITC-DX70 ו-FITC-Eschericia coli. ל-DX40 ו-DX70 יש משקל מולקולרי של 40,000 ו-70,000, בהתאמה. FITC-E. coli הוא זן המעבדה הסטנדרטי של E. coli הקשור לפלואור שניתן למדוד על ידי ציטומטר הזרימה. צורות רבות של אנדוציטוזיס בתיווך הקולטן דורשות סידן כמולקולת איתות ולסידור מחדש של השלדהציטולוגי 9. סוג נוסף של אנדוציטוזיס בתיווך קולטנים הוא אנדוציטוזיס מתווך קולטן מנוז (MR). קולטני מנוז הם חלבונים טרנסממברניים המזהים צורות של מנאן על משטחי תאים מיקרוביאליים9. כדי לייעל את ההליכים הללו, יש ליצור עקומת תגובת מינון עם כל רעלן כדי לקבוע את המינונים שיש להשתמש בהם. יש לבצע עקומת רוויה עבור LY, FITC-DX40, FITC-DX70 ו- FITC-E. coli כדי להעריך את הריכוז הנכון לשימוש.
המנגנונים המשמשים את הלויקוציטים להפנמת חלקיקים שונים עשויים להשתנות. כדי להציע איזה מרכיב בתהליך עשוי להיות מושפע מחשיפה לרעלנים, ניתן להוסיף מעכבים כדי לחסום את המנגנונים הפגוציטים. ציטוכלזין D (CCD) יעכב את תנועת המיקרו-צינוריות ולכן פינוציטוזיס. CCD אינו משפיע על אנדוציטוזיס בתיווך קולטנים11. EDTA חוסם אנדוציטוזיס תלוי סידן (Ca2+) בתיווך קולטן. Mannan הוא ליגנד טבעי עבור MR. Mannan משמש כמעכב קולטן מנוז כדי להעריך אם פגוציטוזיס או פינוציטוזיס הם קולטן מנוזמתווך 9.
מטרת פרוטוקול זה היא להדגים את הנהלים לקביעה אם חשיפה לרעלנים השפיעה על יכולתם של לויקוציטים פגוציטים לספוג פתוגנים. פרוטוקולים אלה עשויים גם להבחין אם מנגנון אנדוציטי ספציפי מושפע. ביצוע בדיקות אלה על ציטומטר הזרימה מאפשר אפליה נוספת על ידי בחירת אוכלוסיות לויקוציטים על סמך גודל וגרעיניות ציטופלזמית כדי לקבוע אם תת-אוכלוסיות לויקוציטים הושפעו באופן דיפרנציאלי. שיטה זו מסתמכת על שער אלקטרוני של אוכלוסיות תאים.
Protocol
פרוטוקול זה אושר על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של אוניברסיטת מיסיסיפי סטייט (MSU-IACUC). כל דגי הזברה ששימשו במחקר זה גודלו ממושבה הומוזיגוטית של דג זברה מוטנטי שהוקם בעבר במדגרה הספציפית נטולת הפתוגנים במכללה לרפואה וטרינרית, אוניברסיטת מיסיסיפי סטייט (MSU)10. דגי זברה מסוג בר הופצו גם במדגרה זו. במחקרים אלה, חשיפה לרעלנים יכולה להתבצע in vivo או in vitro. מחקרי in vivo חושפים את דג הזברה לרעלן, ולאחר מכן מבודדים את הלויקוציטים, מה שמצביע על האופן שבו הרעלן והמיקרו-סביבה של הרקמה עשויים לקיים אינטראקציה ולהשפיע על תפקוד הלויקוציטים. מחקרי המבחנה מבודדים את הלויקוציטים ואז חושפים את התאים לרעלן בבארות תרבית.
1. הכנת ריאגנטים ותמיסה
- מאגר מיון תאים פעילים פלואורסצנטיים (FACS): (תמיסת מלח מאוזנת של הנקס ללא סידן או מגנזיום (HBSS) + 0.05% אלבומין סרום בקר (BSA)) (ראה טבלת חומרים). הכן את זה טרי לפני בידוד התאים.
- מצע תרבית רקמות (TCM): השתמש ב-RPMI-1640 בתוספת גלוטמקס ו-10% סרום בקר עוברי (ראה טבלת חומרים).
- ציטוכלזין D (CCD): הכן את תמיסת המלאי על ידי השעיית המוצר הזמין מסחרית (ראה טבלת חומרים) ב-1 מ"ל של אתנול מוחלט של 200 הוכחה. הכן את פתרון העבודה על ידי הוספת 20 מיקרוליטר של CCD מלאי ל-980 מיקרוליטר של מאגר FACS, כדי לקבל את הריכוז הסופי של 2.5 מיקרוגרם/מ"ל.
- EDTA: תמיסת המלאי היא 1 מ"ג/מ"ל. הכן את פתרון העבודה על ידי הוספת 100 μL של תמיסת המלאי ל-900 μL של מאגר FACS, כדי לקבל את הריכוז הסופי של 1 מ"מ.
- מנאן: הכן תמיסת מלאי של 1 מ"ג/מ"ל (ראה טבלת חומרים). לאחר מכן, הכינו את פתרון העבודה על ידי הוספת 100 מיקרוליטר מתמיסת המלאי ל-900 מיקרוליטר של מאגר FACS, כדי לקבל את הריכוז הסופי 500 מיקרוגרם/מ"ל.
- הכן צהוב לוציפר (10 מיקרוגרם/מ"ל) (LY, צבע פלורסנט), דקסטרן-40 (DX-40, 500 מיקרוגרם/מ"ל) ודקסטרן-70 (DX-70, 500 מיקרוגרם/מ"ל) בנפרד על ידי יצירת תמיסה של 1 מ"ג/מ"ל של כל אחד על ידי השעיית הריאגנטים הזמינים מסחרית (ראה טבלת חומרים) במים סטריליים.
- חיידקי פלואורסצאין (FITC): גדל Escherichia coli DH5α (ראה טבלת חומרים) עם טלטול במדיה של 100 מ"ל Luria Bertani (LB) בתוספת 50 מיקרוגרם/מ"ל FITC למשך הלילה ב-37 מעלות צלזיוס בסביבה מוגנת אור קבל צפיפות אופטית (OD) של 0.8 ב-540 ננומטר.
- שטפו חיידקים (3x) עם מי מלח חוצץ פוספט (PBS) על ידי צנטריפוגה למשך 10 דקות ב-1000 x גרם ולאחר מכן חימום ב-60 מעלות צלזיוס למשך 20 דקות. שטפו פעם נוספת, ולאחר מכן התאימו את ריכוזי החיידקים ל-OD540 0.8. זה יהיה פתרון המלאי.
- הכן את פתרון העבודה על ידי ביצוע דילול של 1:100 של תמיסת המלאי (מלאי 1 מ"ל: 99 מ"ל מאגר FACS). התאם את הריכוז הסופי ל-1.8 x 108 תאים/מ"ל.
2. טיפול בדגי זברה
- שמור על דג הזברה במערכת זרימה חד פעמית על מים עירוניים נטולי כלור והאכיל קמח דגים עשיר בחלבון וארטמיה חיה לשובע.
- בגיל 6 חודשים, הוציאו דגי זברה מעורבים מהמכלים שלהם והעבירו אותם למעבדת המחקר לשימוש בניסוי. זהו הגיל הטוב ביותר לשימוש לבידוד המספר האופטימלי של לויקוציטים ממח הכליה9.
3. בידוד תאים
- המתת חסד של 10 דגי זברה בטריקאין (~100 מ"ל 4 מ"ג/מ"ל פוספט טריקאין מתאן סולפונאט לליטר מי דגים) (ראה טבלת חומרים) בהתאם לשיטות שנקבעו9.
- הנח מסננת תאים של 40 מיקרומטר לתוך צינור צנטריפוגה חרוטי של 50 מ"ל.
- הסר את רקמות מח הכליה9 והנח אותן בצינור C עם 3 מ"ל של מצע תרבית רקמה והומוגניזציה של הרקמה באמצעות דיסוציאטור רקמות. זהו ההליך המועדף.
- לחלופין, יש לשבש את הרקמות עם קצה הגומי של מזרק של 3 מ"ל במסננת תאים. לאחר שהרקמה הומוגנית (או משובשת), שפכו את התרחיף דרך מסננת תאים של 40 מיקרומטר המונחת על גבי צינור חרוטי של 50 מ"ל.
- צנטריפוגה את המתלה המסונן ב-500 x גרם למשך 5 דקות ב-16 מעלות צלזיוס. יוצקים את הסופרנטנט. השעו מחדש את התאים ב-3 מ"ל של הרפואה הסינית המסורתית. חזור על שלב זה פעמיים.
- שכבו בזהירות את התאים על מדיום שיפוע צפיפות של 3 מ"ל מסונן סטרילי (1.077 גרם/מ"ל) בטמפרטורת החדר.
- לאחר מכן, צנטריפוגה ב-800 x גרם למשך 20 דקות ב-16 מעלות צלזיוס. ודא שהבלם נמצא בהגדרה הנמוכה ביותר, כך שהתאים לא יושעו מחדש כאשר הצנטריפוגה נעצרת.
- הסר את שכבת האפי האטומה מהממשק לצינור תחתון עגול של 14 מ"ל.
- שטפו את התאים על ידי הוספת 5 מ"ל של TCM וערבוב עם פיפטה פסטר. צנטריפוגה ב-300 x גרם למשך 5 דקות ב-16 מעלות צלזיוס.
- חזור על השלב, השליך את הסופרנטנט והשהה מחדש את כדורית התא ברפואה הסינית המסורתית כדי להניב כ-1 x 106 תאים/מ"ל.
4. בדיקת כדאיות תאים
- כדי לנטר את כדאיות התאים, העריכו את מוות התאים באמצעות צביעת פרופידיום יודיד (PI).
- הוסף PI (200 מיקרוגרם/מ"ל) בריכוז של 5 מיקרוליטר/מ"ל של תאים לניתוח. קרא בערוץ PE/Texas Red.
הערה: פרופידיום יודיד מתפזר דרך החורים בקרומים של תאים מתים, ובכך מכתים אותם. הכדאיות המוערכת הייתה 85% במחקר הנוכחי.
- הוסף PI (200 מיקרוגרם/מ"ל) בריכוז של 5 מיקרוליטר/מ"ל של תאים לניתוח. קרא בערוץ PE/Texas Red.
5. דגירה של רעלים
- 200 מיקרוליטר של תאים מתרחיף התא המבודד לכל באר של צלחת תרבית רקמה בת 6 בארות (3 בארות לבקרה ו-3 בארות לחשיפה לרעלנים). זה מאפשר להריץ שכפולים בשלוש עותקים.
- הוסף 2 מ"ל TCM לכל באר.
- הוסף רעלן (~2.5 מיקרוגרם/מ"ל) לשלוש הבארות.
הערה: יש לייעל את ריכוז הרעלן לפני תחילת הניסוי ויהיה תלוי ברעלן המשמש לבדיקה. - דגירה של צלחת תרבית רקמות לזמן החשיפה הרצוי. יש לייעל את זמן החשיפה הרצוי לפני תחילת הניסוי ויהיה תלוי ברעלן המשמש לבדיקה. במחקר הנוכחי, זמן החשיפה היה ~1 שעה.
- לאחר זמן החשיפה, הניחו צלחת תרבית רקמות על קרח למשך 10 דקות.
- תאי פיפטה בכל באר למעלה ולמטה תוך הקפדה על הסרת כל התאים הדבקים מהצלחת.
- מוציאים תאים מהצלחת לצינור צנטריפוגה תחתון עגול בנפח 14 מ"ל.
- צנטריפוגה את התאים ב-300 x גרם למשך 5 דקות ב-16 מעלות צלזיוס. השעיה מחדש של תאים ב-3 מ"ל של מאגר FACS. חזור על השלב פעמיים.
- השעו מחדש את התאים ב-1.5 מ"ל של מאגר FACS.
הערה: עבור מחקרי in vivo , חשוף את דג הזברה לרעלן (בריכוז דומה כפי שהוזכר לעיל), ולאחר מכן בודד את התאים.
6. בדיקת אנדוציטוזיס
- Aliquot 100 מיקרוליטר של תאים לצינורות ציטומטריית זרימה של 5 מ"ל. סמן את הצינורות באופן הבא עם ארבעה צינורות שכפול מכל באר: (1) LY, (2) DX40, (3) DX70, (4) FITC-E. coli.
- הוסף צבע פלואורסצנטי כאמור בשלב 1.6 ושלב 1.7 לצינורות המתאימים: 50 מיקרוליטר של LY לצינור (1), 50 מיקרוליטר DX40 לצינור (2); 50 מיקרוליטר DX70 לצינור (3); 50 מיקרוליטר FITC-E. קולי לצינור (4).
- דגירה למשך שעה. הוסף 200 מיקרוליטר של מאגר FACS לכל צינור.
- צנטריפוגה את התאים ב-400 x גרם למשך 5 דקות ב-16 מעלות צלזיוס. שפכו את הסופרנטנט והשעו מחדש את התאים ב-200 מיקרוליטר של מאגר FACS. חזור על שלב זה שלוש פעמים. בצע את הניתוח הציטומטרי של הזרימה.
7. ציטומטריית זרימה
- בצע ציטומטריית זרימה כדי לדמיין את אוכלוסיות התאים ולאסוף נתונים. עיין ב-Hohn et al.9 לפרטים.
- זהה את אוכלוסיות תאי היעד בשלב הראשון. השתמש בפיזור צדדי (SSC) (בדרך כלל הציר האנכי) כדי להסיר פסולת ותאים פיקנוטיים קטנים בצד השמאלי הקיצוני ופיזור קדימה (FSC) (בדרך כלל הציר האופקי) כדי להסיר את אותו פסולת בתחתית החלקה.
- בטל את הקריאות הכפולות (תאים נספרים פעמיים). זה מבוצע על ידי שימוש בשער גיאומטריית דופק (FSC-H x FSC-A).
- קבע את אות הרקע. הפעל תאים בלבד בקרת פלואורסצנטיות ובקרת פלואורסצנציה איזוטיפית עבור כל פלואורוכרום בשימוש, כדי לזהות רמות פלואורסצנטיות ברקע.
הערה: לכל פלואורוכרום יש רמה ייחודית משלו של פלואורסצנציה ברקע, המושפעת מאוטופלואורסצנציה של תאים וקשירה לא ספציפית. זה מבחין בין אותות חיוביים אמיתיים לבין פלואורסצנטיות ברקע. בעת זיהוי ושער אוכלוסיות תאים על סמך פלואורסצנטיות, ערכי בקרה אלה מופחתים ממספר האירועים החיוביים, והמספר המתקבל הוא המספר המשמש לניתוח. - הפעל את הדגימות וזהה אוכלוסיות תאים שיש לסגור. השתמש ב-FSC וב-SSC כדי לאפיין ולזהות מורפולוגית אוכלוסיות תאים שונות בתוך תערובת של תאים.
הערה: FSC קשור בעיקר לגודל התא. תאים גדולים יותר יפזרו יותר אור בכיוון קדימה, וכתוצאה מכך ערכי FSC גבוהים יותר, בעוד שתאים קטנים יותר יפזרו פחות אור ובעלי ערכי FSC נמוכים יותר. גדלים שונים של תאים יתקבצו באשכולות. לדוגמה, לימפוציטים, בהיותם קטנים יותר, עשויים להופיע כאשכול נפרד עם ערכי FSC נמוכים יותר בהשוואה לגרנולוציטים. SSC קשור לגרעיניות, למורכבות ולמבנה הפנימי של התא. לתאים עם גרגיריות ציטופלזמית יותר יהיו ערכי SSC גבוהים יותר. תאים דומים יתקבצו יחד. לדוגמה, לנויטרופילים יש גרגירים ציטופלזמיים והם יתקבצו בערך SSC גבוה יותר מאשר לימפוציטים. - הפעל את כל הדגימות, ובהתבסס על FSC/SSC, החל שערים על אוכלוסיות תאים לניתוח נוסף. אזורים מגודרים מיושמים על סמך צפיפות תאים ואוכלוסיות מעניינות.
- שרטט אזורים מגודרים על היסטוגרמות כדי לנתח את עוצמת הקרינה הממוצעת (MFI) של FITC בכל שער עבור פלואורסצנטיות ב-495 ננומטר / 519 ננומטר עם הלייזר הכחול.
- ייצא את ספירת התאים כפי שנקבעה על ידי התוכנה כדי להצטיין בתוכנית הניתוח.
- לנתח את הנתונים בחבילת תוכנה סטטיסטית (ראה טבלת חומרים).
- השווה MFI של כל אוכלוסייה של תאי ביקורת ל-MFI של אוכלוסיות תאים שנחשפו לרעלן.
8. השפעת הרעלן על מנגנונים אנדוציטיים והשפעות מעכבי CCD, EDTA ומנאן על מנגנונים אנדוציטיים
הערה: כדי לספוג נוזלים או חלקיקים, ציטופלזמת התא נעה באופן פעיל. תנועה זו דורשת מספר אלמנטים מבניים ומסלולי איתות. ביוטוקסינים יכולים להשפיע על כל אחד מהאלמנטים או המסלולים הללו. השוואת ההשפעות של מעכבים מאופיינים ספציפיים יכולה לשמש כדי לסייע בהבחנה כיצד הביוטוקסין עשוי לפעול11.
- בצע בידודי תאים כמתואר בשלב 3.
- Aliquot 100 מיקרוליטר של תאים לצינורות ציטומטריית זרימה של 5 מ"ל (עם ארבעה צינורות משוכפלים מכל באר).
הערה: סמן שפופרות באופן הבא: (5) CCD + LY (CCD מעכב פינוציטוזיס על ידי עיכוב סידור מחדש של מיקרופילמנטים ומיקרו-צינורות; LY משמש להערכת ספיגת נוזלים על ידי מיקרופינוציטוזיס)9. (6) EDTA + DX40 (EDTA חוסם פגוציטוזיס ומיקרופינוציטוזיס בתיווך קולטן Ca2+ ; מדידה אם הספיגה כרוכה במנגנון תלוי סידן). (7) EDTA + DX70. (8) EDTA + FITC-E. coli. (9) מנאן + DX40 (מנאן מעכב ספיגה ספציפית על ידי קולטן המנוז, ומודד את האנדוציטוזיס התלוי ב-MR9). (10) מנאן + DX70. (11) Mannan + FITC-E. coli. - הוסף מעכבים: 1 מיקרוליטר CCD לשפופרת (5); 10 מיקרוליטר EDTA לצינורות (6-8); 100 מיקרוליטר מנאן לצינורות (9-11). עקוב אחר הריכוזים כפי שהוזכר בשלב 1. דגירה למשך 5 דקות.
- הוסף פלואורסצנטי משני לצינורות המתאימים: 50 מיקרוליטר של LY לצינור (1) ו-(5); 50 מיקרוליטר של DX40 לצינור (2), (6) ו-(9); 50 מיקרוליטר של DX70 לצינור (3), (7) ו-(10); 50 מיקרוליטר של FITC-E. coli לצינור (4), (8) ו-(11). דגירה למשך 30 דקות.
- הוסף 200 מיקרוליטר של מאגר FACS לכל צינור. צנטריפוגה ב-400 x גרם ב-16 מעלות צלזיוס למשך 5 דקות.
- שפכו את הסופרנטנט והשעו מחדש את התאים ב-200 מיקרוליטר של מאגר FACS. חזור על שלבים 8.5-8.6 פעמיים.
- הפעל את הדגימות על ציטומטר הזרימה לפי שלב 7.
תוצאות
בדיקות אנדוציטוזיס משתמשות בלויקוציטים מעורבים שבודדו משיפועים ומגודרים עבור פגוציטים ולימפוציטים כדי לקבוע אם מנגנונים תאיים ספציפיים השתנו על ידי חשיפה לרעלנים. ראשית, התאים מגודרים על סמך גודל וגרגיריות10. תאים מתים, מקוטעים או גוססים מוצגים בפינה השמאלית התחתונה של תרשים הפיזור ומסולקים, ולא מנותחים לפגוציטוזיס. שער הפגוציטים כולל מקרופאגים, תאי הרג טבעי (תאי NK) וגרנולוציטים, בעוד ששער הלימפוציטים כולל לימפוציטים, תאי B פגוציטים ותאים ציטוטוקסיים לא ספציפיים (NCCs) (איור 1).
פגוציטוזיס נקבע על ידי ספיגת חלקיקים המסומנים ב-FITC, כפי שמוצג על ידי קריאת הקרינה ב-495 ננומטר / 519 ננומטר עם הלייזר הכחול. אוטופלואורסצנטיות רקע ופלואורסצנטיות קשירה לא ספציפית מתבטלות על ידי התחשבות בעוצמת הקרינה הממוצעת (MFI) הנפלטת מתאי הבקרה ובקרת האיזוטיפ. יש לבצע עקומת מינון-תגובה עם כל מעכב כדי לקבוע את הריכוזים שיש להשתמש בהם. אם תוצאות ציטומטריית הזרימה של תאים שנחשפו לרעלן הנבדק זהות לתוצאות של תאים שנחשפו למעכב, אז הרעלן גורם להשפעה דומה ועשוי לעכב את המנגנון האנדוציטי הזה. אם התגובות של הרעלן והמעכב הן תוספות, זה מצביע על כך שהרעלן עשוי לעכב אנדוציטוזיס על ידי מנגנון שונה מהמעכב.
השוואות נעשות בין תאים שלא טופלו לבין תאים שטופלו ברעלן שנבדק (איור 2), תאים שטופלו ברעלן או במעכב (איור 3A), ותאים שטופלו במעכב בלבד (איור 3B). התוצאות המייצגות מראות כי תאים שטופלו במיקרוציסטין עוכבו, בדומה לתאים שטופלו ב-CCD. תוצאות אלו מדגימות כי מיקרוציסטין עיכב את ספיגת הנוזלים על ידי מיקרופינוציטוזיס. תאים מגודרים מנותחים על ידי ANOVA חד כיווני, ויש לדווח על התוצאות כמספר הממוצע של תאים חיוביים ל-FITC.

איור 1: תרשים פיזור ציטומטריית זרימה מייצגת של לויקוציטים שבודדו מרקמת כליה של דג זברה מסוג בר בהתבסס על מאפייני פיזור קדימה (FSC) ופיזור צד (SSC). שער הפגוציטים כולל מקרופאגים/מונוציטים וגרנולוציטים (23% מהתאים המגודרים. שער הלימפוציטים כולל לימפוציטים, תאי B פגוציטים ותאים ציטוטוקסיים לא ספציפיים (NCCs) (26% מהתאים המגודרים). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
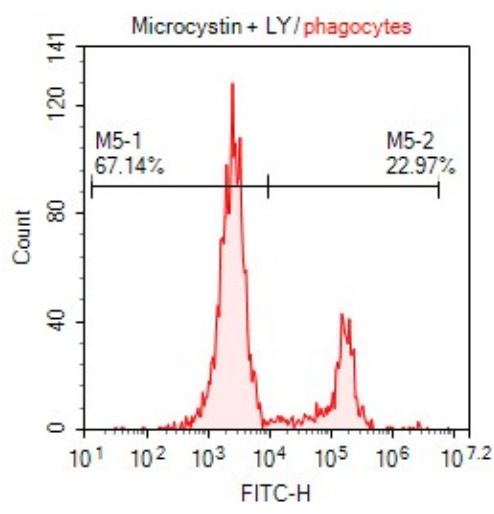
איור 2: עוצמת הקרינה הממוצעת (MFI) של תאים פגוציטים מגודרים באיור 1 לאחר חשיפה לרעלן. שפופרת (1) מציגה תאים לא מוכתמים בעוד שתאים בשפופרת (2) פולטים פלואורסצנטיות באמצעות קליטת LY. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: עוצמת הקרינה הממוצעת (MFI) של פגוציטים מגודרים באיור 1. ספיגה של לוציפר צהוב (LY) ללא נוכחות מעכב ציטוכלזין D (CCD) (A); קליטה של LY עם נוכחות CCD. שפופרת (1) מציגה תאים לא מוכתמים, בעוד שתאים בשפופרת (2) פולטים פלואורסצנטיות באמצעות קליטת LY. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: סקירה כללית של השלבים הכרוכים בפרוטוקול. *משך והיקף החשיפה של הדגים לביוטוקסין ישתנו בהתאם לביוטוקסין הספציפי בו נעשה שימוש ולתקנות ולפרוטוקולים של טיפול בבעלי חיים ובטיחות ביולוגית של מוסדות שונים. **יש לייעל את הריכוז הרצוי בשימוש ואת זמן החשיפה בו נעשה שימוש לפני הניסוי ויהיה תלוי ברעלן בו נעשה שימוש. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
שימוש בזרימה ציטומטרית עם לויקוציטים של דג הזברה מציע גישה רבת עוצמה ורב-תכליתית לחקר מערכת החיסון בפירוט, הערכת ההשפעה של רעלים סביבתיים והקלה על מחקר טוקסיקולוגי. הוא מספק דרך להעריך במהירות וביעילות את ההשפעה של רעלנים על תאי החיסון ועל התגובה החיסונית. התוצאות חושפות גורמים הומורליים מעורבים ומצביעות על האופן שבו הפיזיולוגיה וחילוף החומרים של הדג מתקשרים עם ביוטוקסינים סביבתיים. הסקירה הכללית של הפרוטוקול מתוארת באיור 4.
עם זאת, ישנן מגבלות לשיטות אלה. הכנת לויקוציטים של דג הזברה לציטומטריית זרימה יכולה להיות מורכבת יותר בהשוואה למודלים אחרים. גודלו הקטן של דג הזברה יכול להגביל את כמות הדם ואת מספר הלויקוציטים הזמינים לניתוח 9,10. הליכים אלה דורשים דיסוציאציה של רקמות כדי להשיג תרחיפים של תא בודד, וכדאיות התא יכולה להשפיע על דיוק התוצאות. בהשוואה למודלים כמו עכברים, מגוון הכלים האימונולוגיים הזמינים, כגון נוגדנים ספציפיים לסמני תאי דג הזברה, מוגבל יותר עבור דג הזברה. מגבלה זו יכולה להגביל את עומק הניתוח שניתן לבצע על לויקוציטים של דג הזברה. יתרה מכך, פרשנות נתוני ציטומטריית זרימה דורשת מומחיות, במיוחד כאשר עוסקים בתגובות חיסוניות מורכבות. פרשנות שגויה של נתונים עלולה להוביל למסקנות שגויות, במיוחד בהקשר של השפעות רעלנים סביבתיים.
ניתן להשוות תוצאות של דגימות תאים ללא תוספת מעכבים לדגימות תאים עם המעכבים. יש להשוות תוצאות של דגימות תאים עם תוספת הרעלן לדגימות תאים עם המעכבים. אם הסידור מחדש של השלד הציטולוגי הושפע, תהיה קליטה מוגבלת של LY. אם הרעלן מעכב את ספיגת DX-40 או DX-70, גדלים שונים של חלקיקים לא יעברו פגוציטוזה. אם התאים אינם קולטים את ה-FITC-E. coli, אז הרעלן עיכב פגוציטוזיס.
לסיכום, דג הזברה משמש מודל מצוין לחקר ההשפעות של רעלים סביבתיים על תאי החיסון. פרוטוקול זה מתאר שיטה המשתמשת בזרימה ציטומטרית ולויקוציטים של דג הזברה כדי לסנן ביוטוקסינים, עם דגש מיוחד על תהליכי אנדוציטוזיס ופגוציטוזיס11. מטרת מחקר זה היא לברר האם חשיפה לרעלנים משפיעה על יכולתם של לויקוציטים פגוציטים לספוג פתוגנים ולהבחין בהשפעות פוטנציאליות על מנגנונים אנדוציטיים ספציפיים.
Disclosures
למחברים אין ניגודי אינטרסים לחשוף.
Acknowledgements
המחברים מודים לאיזק הנסון על התחזוקה היומיומית של דג הזברה בו נעשה שימוש, ולטרווה ביליארד וסטרלינג ביילי על הסיוע בהגהה ובעיצוב כתב היד הזה.
Materials
| Name | Company | Catalog Number | Comments |
| 10% fetal bovine serum | Gibco | A3160501 | |
| 14 mL round bottom centrifuge tubes | BD Biosciences | 352059 | |
| 40 µm cell straininer | Corning | 07-201-430 | |
| 5 mL flow cytometry tubes | BD Biosciences | 352235 | |
| 50 mL conical centrifuge tube | Corning | 14-959-49A | |
| Absolute ethanol | Fisher | BP2818-500 | |
| Automated cell counter | Life Technologies Countess II FL | for studying cell viability | |
| Bovine serum albumin (BSA) | Sigma | A3059 | |
| cytochalasin D (CCD) | Sigma | C8273-5MG | |
| Dextran 40 | Sigma | FD40-100MG | |
| Dextran 70 | Sigma | 46945-100MG-F | |
| Escherichia coli DH5α (or other lab bacterial strain) | New England Biolabs | C29871 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma | ED4SS | |
| Flow analysis software | Novoacea software | ||
| Flow cytometer | Novocyte 3000 | ||
| Fluorescein | Fluka BioChemica | 46950 | |
| hanks balanced salt solution without calcium or magnesium | Sigma | H4891 | |
| Histopaque 1077 | Sigma | 10771-100ML | |
| Lucifer Yellow | Sigma | L0259-25MG | |
| Mannan | Sigma | M7504-250MG | |
| Phosphate buffered saline | Sigma | P3813 | |
| RPMI-1640 with GlutaMax | Gibco | 61870036 | |
| Statistical software | SPSS | ||
| Toxin | |||
| Tricaine | Western Chemical Inc | NC0342409 |
References
- Vincent, W. F. Cyanobacteria. Encyclopedia of Inland Waters. Likens, G. E. , Academic Press. 226-232 (2009).
- Paerl, H. W., Huisman, J. Climate change: A catalyst for global expansion of harmful cyanobacterial blooms. Environmental Microbiology Reports. 1 (1), 27-37 (2009).
- Yáñez-Sedeño, P., Agüí, L., Villalonga, R., Pingarrón, J. M. Biosensors in forensic analysis. A review. Analytica Chimica Acta. 823, 1-19 (2014).
- Solter, P. F., Beasley, V. R. Chapter 38 - Phycotoxins. Haschek and Rousseaux's handbook of toxicologic pathology (Third Edition). Haschek, W. M., Rousseaux, C. G., Wallig, M. A. , Academic Press. 1155-1186 (2022).
- Espelund, M., Klaveness, D. Botulism outbreaks in natural environments - an update. Frontiers Microbiology. 5, 287(2014).
- Sánchez, C. A., et al. Landscape-level toxicant exposure mediates infection impacts on wildlife populations. Biology Letters. 16 (11), 20200559(2020).
- Traver, D., et al. The zebrafish as a model organism to study development of the immune system. Advances in Immunology. 81, 253-330 (2003).
- Weeks, S. A., Warinner, J. E. Functional evaluation of macrophages in fish from a polluted estuary. Veterinary Immunology and Immunopathology. 12, 313-320 (1986).
- Hohn, C., Lee, S. R., Pinchuk, L. M., Petrie-Hanson, L. Zebrafish kidney phagocytes utilize macropinocytosis and Ca2+-dependent endocytic mechanisms. PLOS One. 4 (2), e4314(2009).
- Petrie-Hanson, L., Hohn, C. M., Hanson, L. A. Characterization of rag1 mutant zebrafish leukocytes. BMC Immunology. 10 (8), (2009).
- Watts, C., March, M. Endocytosis: what goes in and how. Journal of Cell Science. 103, 1-8 (1992).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved