Method Article
Evaluación de los efectos de las biotoxinas en las funciones de las células inmunitarias en el pez cebra
En este artículo
Resumen
Este protocolo describe ensayos de citometría de flujo que pueden evaluar los efectos de la exposición a toxinas en las funciones endocíticas de diferentes subpoblaciones de leucocitos de pez cebra. El uso de inhibidores funcionales específicos en el ensayo permite diferenciar los mecanismos endocíticos alterados.
Resumen
Una variedad de toxinas biológicas pueden estar presentes en niveles dañinos en el medio acuático. Las cianobacterias son un grupo diverso de microorganismos procariotas que producen cianotoxinas en el medio acuático. Estas biotoxinas pueden ser hepatotoxinas, dermatoxinas o neurotoxinas y pueden afectar a peces y mamíferos. En niveles altos, estos compuestos son fatales. A niveles no letales, actúan de forma insidiosa y afectan a las funciones de las células inmunitarias. Las biotoxinas producidas por las algas incluyen la microcistina y la anatoxina A. Los animales acuáticos también pueden ingerir material contaminado con la neurotoxina botulínica E (BoNT/E) producida por Clostridium botulinum, lo que también provoca la muerte o la disminución de las funciones inmunitarias. El pez cebra se puede utilizar para estudiar cómo las toxinas afectan las funciones de las células inmunitarias. En estos estudios, las exposiciones a toxinas se pueden realizar in vivo o in vitro. Los estudios in vivo exponen al pez cebra a la toxina y luego se aíslan las células. Este método demuestra cómo el entorno tisular puede influir en la función de los leucocitos. Los estudios in vitro aíslan primero las células y luego las exponen a la toxina en pozos de cultivo. Los leucocitos se obtienen mediante extracción de médula renal, seguida de centrifugación en gradiente de densidad. La forma en que los leucocitos internalizan los patógenos está determinada por mecanismos endocíticos. Los ensayos de fagocitosis por citometría de flujo demuestran si los mecanismos endocíticos se han visto alterados por la exposición a toxinas. Faltan estudios que utilicen leucocitos aislados para determinar cómo las toxinas causan disfunción inmunitaria. Los procedimientos descritos en este artículo permitirán a los laboratorios utilizar el pez cebra para estudiar los mecanismos que se ven afectados cuando una toxina ambiental disminuye las funciones endocíticas de las células inmunitarias.
Introducción
Hay muchos tipos de biotoxinas ambientales y agentes inmunosupresores. Las floraciones de algas que contienen toxinas bacterianas ocurren en aguas continentales y también pueden ocurrir comobiopelículas. Las cianobacterias (algas verdeazuladas) se encuentran de forma natural en todos los ecosistemas de agua dulce. Las floraciones de cianobacterias han aumentado sustancialmente en los sistemas de agua dulce2. En ciertos momentos, las cianobacterias pueden producir toxinas que son dañinas para los animales acuáticos y terrestres. Estas toxinas pueden afectar el hígado, la piel y las membranas mucosas, y/o el sistema nervioso. Dos compuestos producidos por las cianobacterias son la microcistina y la anatoxina A. La microcistina es un heptapéptido cíclico3. La anatoxina A es un alcaloide4. La neurotoxina botulínica E (BoNT/E) es otra toxina que se encuentra en los sistemas acuáticos. Es producida por Clostridium botulinum y puede ser ingerida por animales acuáticos5.
La exposición a toxinas ambientales afecta a los peces y también puede afectar la salud de los animales y aumentar la aparición de enfermedades6. Comprender cómo estas toxinas afectan a las células inmunitarias es fundamental para determinar los riesgos asociados con la exposición a estas sustancias. El pez cebra es un excelente modelo para estudiar los efectos de las toxinas ambientales en las células inmunitarias7. El desarrollo de un método que utilice citometría de flujo y leucocitos de pez cebra es muy beneficioso. El pez cebra tiene relevancia fisiológica para los seres humanos, y este método se puede aplicar a una amplia gama de áreas de investigación, desde la toxicología básica y la inmunología hasta el descubrimiento de fármacos y la biología del desarrollo. Debido a que son organismos acuáticos, los peces cebra son particularmente adecuados para estudiar los efectos de las toxinas ambientales transmitidas por el agua7. El uso del pez cebra es menos costoso que otros modelos de vertebrados, y su uso plantea menos preocupaciones éticas.
Los glóbulos blancos, o leucocitos, son la primera línea de defensa celular contra los organismos causantes de enfermedades. La endocitosis es el proceso por el cual una célula absorbe o internaliza un líquido o partícula externa a la célula. Esto se logra mediante la célula que encierra el compuesto en una vesícula8. Los leucocitos utilizan este proceso como el primer paso para matar patógenos y preparar una defensa contra las enfermedades. La fagocitosis es un tipo de endocitosis y fue uno de los primeros métodos utilizados para investigar los efectos de los contaminantes ambientales en la salud de los peces9. El laboratorio de Petrie-Hanson ha desarrollado métodos que utilizan leucocitos de pez cebra para analizar las biotoxinas por su posible capacidad para interferir con las funciones endocíticas y fagocíticas de los leucocitos y afectar las defensas inmunitarias. Los tipos de endocitosis incluidos en estos métodos son la pinocitosis, la fagocitosis, la fagocitosis mediada por receptores dependientes de calcio y la fagocitosis mediada por receptores de manosa. El uso de métodos de citometría de flujo con pez cebra se describieron por primera vez en el laboratorio de Petrie-Hanson9 y se utilizan de forma rutinaria para investigar toxinas y patógenos acuáticos. El pez cebra mutante Rag1-/- no tiene células T y B10 y se puede utilizar para investigar específicamente los mecanismos de las células inmunitarias innatas.
La citometría de flujo se basa en láser y se puede utilizar para determinar las propiedades físicas de las células. La dispersión hacia adelante, o valor FSC, se traza en el eje X y representa el tamaño de la celda. La dispersión lateral, o SSC, se traza en el eje Y y representa la granularidad citoplasmática de la célula. El diagrama resultante muestra poblaciones de células con características físicas similares agrupadas, con los diferentes tipos de celdas apareciendo en varias ubicaciones en un diagrama de dispersión. Estas poblaciones pueden cambiar de ubicación en el diagrama de dispersión a medida que cambian las características físicas de las celdas9. El uso de esta técnica con leucocitos de pez cebra permite a los investigadores evaluar los cambios en las poblaciones celulares en respuesta a diversos estímulos, incluidas las toxinas ambientales.
El citómetro de flujo es multidimensional y se pueden utilizar múltiples tipos de fluoróforos en la evaluación para caracterizar aún más las células y su actividad. En los ensayos descritos en este protocolo, la endocitosis se caracteriza por la medición de la cantidad de material fluorescente que una célula ha interiorizado. Si la exposición a toxinas afecta a los mecanismos endocíticos, y cómo lo hace, puede determinarse comparando la capacidad de las células expuestas a toxinas para absorber el material en comparación con la capacidad de las células no expuestas a toxinas mediante citometría de flujo. Los procesos endocíticos que se pueden evaluar de esta manera incluyen la pinocitosis, la endocitosis mediada por receptores y la fagocitosis.
La pinocitosis es la absorción de componentes solubles y no utiliza receptores celulares. La absorción implica el reordenamiento citoplasmático por microfilamentos y microtúbulos para formar pequeñas vacuolas. El amarillo de luciferasa (LY) es un colorante fluorescente que se utiliza para medir la absorción de líquidos por pinocitosis no selectiva11. La endocitosis mediada por receptores implica la absorción selectiva de moléculas grandes. La fluoresceína (FITC) dextrano (DX) 40 marcada se puede utilizar para evaluar este proceso. La fagocitosis es una forma de endocitosis que ingiere partículas de más de 0,5 micrómetros. Este proceso se investiga mediante procedimientos que utilizan FITC-DX70 y FITC-Eschericia coli. DX40 y DX70 tienen pesos moleculares de 40.000 y 70.000, respectivamente. FITC-E. coli es la cepa estándar de laboratorio de E. coli unida a un fluor que puede ser medida por el citómetro de flujo. Muchas formas de endocitosis mediada por receptores requieren calcio como molécula de señalización y para el reordenamiento del citoesqueleto9. Otro tipo de endocitosis mediada por receptores es la endocitosis mediada por receptores de manosa (MR). Los receptores de manosa son proteínas transmembrana que reconocen formas de manano en las superficies celulares microbianas9. Para optimizar estos procedimientos, se debe crear una curva de dosis-respuesta con cada toxina para establecer las dosis a utilizar. Se debe realizar una curva de saturación para LY, FITC-DX40, FITC-DX70 y FITC-E. coli para evaluar la concentración correcta a utilizar.
Los mecanismos utilizados por los leucocitos para internalizar diferentes partículas pueden variar. Para sugerir qué componente del proceso puede verse afectado por la exposición a toxinas, se pueden agregar inhibidores para bloquear los mecanismos fagocíticos. La citocalasina D (CCD) inhibirá el movimiento de los microtúbulos y, por lo tanto, la pinocitosis. La CCD no influye en la endocitosis mediada por receptores11. El EDTA bloquea la endocitosis mediada por receptores dependientes de calcio (Ca2+). El manano es un ligando natural para la RM. El manano se utiliza como inhibidor del receptor de manosa para evaluar si la fagocitosis o pinocitosis está mediada por el receptor de manosa9.
El propósito de este protocolo es demostrar los procedimientos para determinar si la exposición a toxinas ha afectado la capacidad de los leucocitos fagocíticos para absorber patógenos. Estos protocolos también pueden discernir si un mecanismo endocítico específico está afectado. La realización de estos ensayos en el citómetro de flujo permite una mayor discriminación mediante la selección de poblaciones de leucocitos en función del tamaño y la granularidad citoplasmática para determinar si las subpoblaciones de leucocitos se han visto afectadas diferencialmente. Este método se basa en la compuerta electrónica de las poblaciones de células.
Protocolo
Este protocolo ha sido aprobado por el Comité Institucional de Cuidado y Uso de Animales de la Universidad Estatal de Mississippi (MSU-IACUC). Todos los peces cebra utilizados en este estudio se criaron a partir de una colonia homocigota de pez cebra mutante rag1-/- previamente establecida en el criadero libre de patógenos específicos en la Facultad de Medicina Veterinaria de la Universidad Estatal de Mississippi (MSU)10. El pez cebra de tipo salvaje también se propagó en este criadero. En estos estudios, las exposiciones a toxinas se pueden realizar in vivo o in vitro. Los estudios in vivo exponen al pez cebra a la toxina, después de lo cual se aíslan los leucocitos, lo que indica cómo la toxina y el microambiente tisular pueden interactuar e influir en la función de los leucocitos. Los estudios in vitro aíslan los leucocitos y luego exponen las células a la toxina en pozos de cultivo.
1. Preparación de reactivos y soluciones
- Tampón de clasificación de células activadas fluorescentes (FACS): (Solución salina equilibrada de Hanks sin calcio ni magnesio (HBSS) + 0,05% de albúmina sérica bovina (BSA)) (ver Tabla de Materiales). Prepáralo fresco antes del aislamiento de la celda.
- Medios de cultivo de tejidos (MTC): Utilice RPMI-1640 suplementado con glutamax y suero fetal bovino al 10% (consulte la tabla de materiales).
- Citocalasina D (CCD): Prepare la solución madre resuspendiendo el producto disponible comercialmente (ver Tabla de Materiales) en 1 mL de etanol absoluto de 200 grados. Prepare la solución de trabajo añadiendo 20 μL de CCD de stock a 980 μL de tampón FACS, para obtener la concentración final de 2,5 μg/mL.
- EDTA: La solución madre es de 1 mg/mL. Preparar la solución de trabajo añadiendo 100 μL de la solución madre a 900 μL de tampón FACS, para obtener la concentración final de 1 mM.
- Manano: Prepare una solución madre de 1 mg/mL (ver Tabla de Materiales). A continuación, prepare la solución de trabajo añadiendo 100 μL de la solución madre a 900 μL de tampón FACS, para obtener la concentración final de 500 μg/mL.
- Prepare Lucifer Yellow (10 μg/mL) (LY, un colorante fluorescente), Dextran-40 (DX-40, 500 μg/mL) y Dextran-70 (DX-70, 500 μg/mL) por separado haciendo una solución de 1 mg/mL de cada uno resuspendiendo los reactivos disponibles comercialmente (ver Tabla de Materiales) en agua estéril.
- Bacterias fluoresceína (FITC): Cultive Escherichia coli DH5α (ver Tabla de Materiales) con agitación en medios Luria Bertani (LB) de 100 mL suplementados con 50 μg/mL de FITC durante la noche a 37 °C en un entorno protegido de la luz para obtener una densidad óptica (OD) de 0,8 a 540 nm.
- Lavar las bacterias (3x) con solución salina tamponada con fosfato (PBS) mediante centrifugación durante 10 min a 1000 x g seguido de calentamiento a 60 °C durante 20 min. Lave 1 vez más, luego ajuste las concentraciones bacterianas a OD540 0.8. Esta será la solución estándar.
- Prepare la solución de trabajo haciendo una dilución 1:100 de la solución madre (1 mL de stock: 99 mL de tampón FACS). Ajuste la concentración final a 1,8 x 108 células/mL.
2. Cuidado del pez cebra
- Mantenga el pez cebra en un sistema de flujo de un solo paso en agua municipal declorada y alimente con harina de pescado con alto contenido de proteínas y Artemia viva hasta la saciedad.
- A los 6 meses de edad, retire el pez cebra de sexo mixto de sus tanques y transpórtelo al laboratorio de investigación para su uso en el experimento. Esta es la mejor edad a utilizar para el aislamiento del número óptimo de leucocitos de la médula renal9.
3. Aislamiento celular
- Eutanasia de 10 peces cebra en tricaína (~100 mL 4 mg/mL de sulfonato de metano tricaína tamponado con fosfato/litro de agua de pescado) (ver Tabla de Materiales) siguiendo los métodos establecidos9.
- Coloque un filtro de células de 40 μm en un tubo de centrífuga cónico de 50 mL.
- Extraer los tejidos de la médula renal9 y colocarlos en un tubo C con 3 mL de medio de cultivo de tejidos y homogeneizar el tejido utilizando un disociador de tejidos. Este es el procedimiento preferido.
- Alternativamente, rompa los tejidos con el extremo de goma de una jeringa de 3 ml en un colador de células. Después de homogeneizar (o interrumpir) el tejido, vierta la suspensión a través de un filtro de células de 40 μm colocado encima de un tubo cónico de 50 mL.
- Centrifugar la suspensión filtrada a 500 x g durante 5 min a 16 °C. Vierte el sobrenadante. Vuelva a suspender las células en 3 mL de MTC. Repita este paso dos veces.
- Coloque cuidadosamente las células en capas sobre 3 mL de medio de gradiente de densidad estéril filtrado (1,077 g/mL) a temperatura ambiente.
- A continuación, centrifugar a 800 x g durante 20 min a 16 °C. Asegúrese de que el freno esté en la posición más baja, para que las celdas no se vuelvan a suspender cuando se detenga la centrífuga.
- Retire la capa opaca de leucemia de la interfaz a un tubo de fondo redondo de 14 ml.
- Lave las células añadiendo 5 mL de TCM y mezclando con una pipeta Pasteur. Centrifugar a 300 x g durante 5 min a 16 °C.
- Repita el paso, desechando el sobrenadante y resuspendiendo el pellet de células en TCM para producir aproximadamente 1 x 106 células/mL.
4. Ensayo de viabilidad celular
- Para controlar la viabilidad celular, evalúe la muerte celular mediante la tinción con yoduro de propidio (PI).
- Añadir PI (200 μg/mL) a la concentración de 5 μL/mL de las células a analizar. Lea en el canal PE/Texas Red.
NOTA: El yoduro de propidio se difunde a través de los orificios de las membranas de las células muertas, tiñéndolas. La viabilidad evaluada fue del 85% para el presente estudio.
- Añadir PI (200 μg/mL) a la concentración de 5 μL/mL de las células a analizar. Lea en el canal PE/Texas Red.
5. Incubación de toxinas
- Alícuota 200 μL de células de la suspensión celular aislada en cada pocillo de una placa de cultivo de tejidos de 6 pocillos (3 pocillos para control y 3 pocillos para exposición a toxinas). Esto permite que las réplicas se ejecuten por triplicado.
- Agregue 2 mL de TCM a cada pocillo.
- Agregue toxina (~2.5 μg/mL) a los tres pocillos.
NOTA: La concentración de toxina debe optimizarse antes de comenzar el experimento y dependerá de la toxina utilizada para el ensayo. - Incubar la placa de cultivo de tejidos para el tiempo de exposición deseado. El tiempo de exposición deseado debe optimizarse antes de comenzar el experimento y dependerá de la toxina utilizada para el ensayo. En el presente estudio, el tiempo de exposición fue de ~1 h.
- Después del tiempo de exposición, coloque la placa de cultivo de tejidos en hielo durante 10 minutos.
- Pipetee las células de cada pocillo hacia arriba y hacia abajo con cuidado para eliminar las células adheridas de la placa.
- Retire las celdas de la placa y colóquelas en un tubo de centrífuga de fondo redondo de 14 ml.
- Centrifugar las células a 300 x g durante 5 min a 16 °C. Vuelva a suspender las células en 3 mL de tampón FACS. Repita el paso dos veces.
- Vuelva a suspender las células en 1,5 mL de tampón FACS.
NOTA: Para los estudios in vivo , exponga el pez cebra a la toxina (a una concentración similar a la mencionada anteriormente) y luego aísle las células.
6. Ensayo de endocitosis
- Alícuota de 100 μL de células a tubos de citometría de flujo de 5 mL. Etiquete los tubos de la siguiente manera con cuatro tubos replicados de cada pocillo: (1) LY, (2) DX40, (3) DX70, (4) FITC-E. coli.
- Agregue colorante de fluorescencia como se indica en los pasos 1.6 y 1.7 a los tubos apropiados: 50 μL de LY al tubo (1), 50 μL DX40 al tubo (2); 50 μL DX70 al tubo (3); 50 μL de coli a tubo (4).
- Incubar durante 1 h. Agregue 200 μL de tampón FACS a cada tubo.
- Centrifugar las células a 400 x g durante 5 min a 16 °C. Vierta el sobrenadante y vuelva a suspender las células en 200 μL de tampón FACS. Repita este paso tres veces. Realizar el análisis de citometría de flujo.
7. Citometría de flujo
- Realice citometría de flujo para visualizar las poblaciones celulares y recopilar datos. Consulte Hohn et al.9 para obtener más detalles.
- Identifique las poblaciones de células objetivo en el primer paso. Utilice la dispersión lateral (SSC) (normalmente el eje vertical) para eliminar los residuos y las celdas picnóticas pequeñas en el extremo izquierdo y la dispersión frontal (FSC) (normalmente el eje horizontal) para eliminar los mismos residuos en la parte inferior de la gráfica.
- Elimine las lecturas de doblete (celdas contadas dos veces). Esto se realiza mediante el uso de una puerta de geometría de pulso (FSC-H x FSC-A).
- Determine la señal de fondo. Ejecute solo celdas de control de fluorescencia y un control de fluorescencia de isotipo para cada fluorocromo utilizado, para identificar los niveles de fluorescencia de fondo.
NOTA: Cada fluorocromo tiene su propio nivel único de fluorescencia de fondo, influenciado por la autofluorescencia celular y la unión no específica. Esto distingue entre señales positivas verdaderas y fluorescencia de fondo. Al identificar y controlar las poblaciones celulares en función de la fluorescencia, estos valores de control se restan del número de eventos positivos, y el número resultante es el número utilizado para el análisis. - Ejecute las muestras e identifique las poblaciones celulares que se van a controlar. Utilice FSC y SSC para caracterizar e identificar morfológicamente diferentes poblaciones celulares dentro de una mezcla de células.
NOTA: FSC está relacionado principalmente con el tamaño de la celda. Las celdas más grandes dispersarán más luz en la dirección de avance, lo que dará como resultado valores FSC más altos, mientras que las celdas más pequeñas dispersarán menos luz y tendrán valores FSC más bajos. Los diferentes tamaños de celdas se agruparán en grupos. Por ejemplo, los linfocitos, al ser más pequeños, pueden aparecer como un grupo separado con valores de FSC más bajos en comparación con los granulocitos. El SSC está relacionado con la granularidad, la complejidad y la estructura interna de la célula. Las células con más granularidad citoplasmática tendrán valores de SSC más altos. Las células similares se agruparán. Por ejemplo, los neutrófilos tienen gránulos citoplasmáticos y se agrupan a un valor de SSC más alto que los linfocitos. - Ejecute todas las muestras y, en función de FSC/SSC, aplique puertas a las poblaciones de células para analizarlas más a fondo. Las áreas cerradas se aplican en función de la densidad de celdas y las poblaciones de interés.
- Traza áreas cerradas en histogramas para analizar la intensidad media de fluorescencia (MFI) de FITC en cada puerta para fluorescencia a 495 nm / 519 nm con el láser azul.
- Exporte los recuentos de celdas según lo determine el software para sobresalir en el programa de análisis.
- Analice los datos en un paquete de software estadístico (ver Tabla de Materiales).
- Compare la MFI de cada población de células de control con la MFI de las poblaciones de células expuestas a la toxina.
8. Efecto de la toxina sobre los mecanismos endocíticos y efectos de los inhibidores CCD, EDTA y manano sobre los mecanismos endocíticos
NOTA: Para absorber líquidos o partículas, el citoplasma de la célula se mueve activamente. Este movimiento requiere múltiples elementos estructurales y vías de señalización. Las biotoxinas pueden afectar a cualquiera de estos elementos o vías. La comparación de los efectos de inhibidores caracterizados específicos puede utilizarse para ayudar a discernir cómo puede estar actuando la biotoxina11.
- Realice los aislamientos de celdas como se describe en el paso 3.
- Alícuota de 100 μL de células a tubos de citometría de flujo de 5 mL (con cuatro tubos replicados de cada pocillo).
NOTA: Etiquete los tubos de la siguiente manera: (5) CCD + LY (CCD inhibe la pinocitosis al inhibir el reordenamiento de microfilamentos y microtúbulos; El LY se utiliza para evaluar la absorción de líquidos por micropinocitosis)9. (6) EDTA + DX40 (EDTA bloquea la fagocitosis y la micropinocitosis mediadas por el receptor dependiente de Ca2+ ; midiendo si la absorción implica un mecanismo dependiente del calcio). (7) EDTA + DX70. (8) EDTA + FITC-E. coli. (9) Manano + DX40 (el manano inhibe la captación específica por el receptor de manosa, midiendo la endocitosis dependiente de RM9). (10) Manán + DX70. (11) Manano + FITC-E. coli. - Añadir inhibidores: 1 μL de CCD al tubo (5); 10 μL de EDTA a tubos (6-8); 100 μL de manano a tubos (9-11). Siga las concentraciones mencionadas en el paso 1. Incubar durante 5 min.
- Añadir fluorescente secundario a los tubos apropiados: 50 μL de LY a los tubos (1) y (5); 50 μL de DX40 a los tubos (2), (6) y (9); 50 μL de DX70 a los tubos (3), (7) y (10); 50 μL de FITC-E. coli al tubo (4), (8) y (11). Incubar durante 30 min.
- Agregue 200 μL de tampón FACS a cada tubo. Centrifugar a 400 x g a 16 °C durante 5 min.
- Vierta el sobrenadante y vuelva a suspender las células en 200 μL de tampón FACS. Repita los pasos 8.5-8.6 dos veces.
- Ejecute las muestras en el citómetro de flujo siguiendo el paso 7.
Resultados
Los ensayos de endocitosis utilizan leucocitos mixtos aislados de gradientes y activados para fagocitos y linfocitos para determinar si la exposición a toxinas ha alterado mecanismos celulares específicos. En primer lugar, las celdas se limitan en función del tamaño y la granularidad10. Las células muertas, fragmentadas o moribundas se visualizan en la esquina inferior izquierda del diagrama de dispersión y se eliminan, no se analizan para detectar fagocitosis. La puerta de los fagocitos incluye macrófagos, células asesinas naturales (células NK) y granulocitos, mientras que la puerta de los linfocitos incluye linfocitos, células B fagocíticas y células citotóxicas inespecíficas (NCC) (Figura 1).
La fagocitosis está determinada por la absorción de partículas marcadas con FITC, como se muestra mediante la lectura de la fluorescencia a 495 nm / 519 nm con el láser azul. La autofluorescencia de fondo y la fluorescencia de unión inespecífica se eliminan teniendo en cuenta la intensidad media de fluorescencia (MFI) emitida por las células de control y el control de isotipo. Se debe realizar una curva dosis-respuesta con cada inhibidor para establecer las concentraciones que se utilizarán. Si los resultados de la citometría de flujo de las células expuestas a la toxina que se está analizando son los mismos que los resultados de las células expuestas a un inhibidor, entonces la toxina está causando un efecto similar y puede estar inhibiendo ese mecanismo endocítico. Si las respuestas de la toxina y el inhibidor son aditivas, esto sugiere que la toxina puede estar inhibiendo la endocitosis por un mecanismo diferente al del inhibidor.
Se realizan comparaciones entre las células no tratadas y las células tratadas con la toxina que se está analizando (Figura 2), las células tratadas con toxina o inhibidor (Figura 3A) y las células tratadas con el inhibidor solo (Figura 3B). Los resultados representativos muestran que las células tratadas con microcistina fueron inhibidas, de manera similar a las células tratadas con CCD. Estos resultados demuestran que la microcistina inhibió la absorción de líquidos por micropinocitosis. Las células controladas se analizan mediante ANOVA de un factor, y los resultados deben informarse como el número medio de células positivas para FITC.

Figura 1: Diagrama de dispersión representativo de citometría de flujo de leucocitos aislados de tejido de riñón de pez cebra de tipo salvaje basado en las características de dispersión directa (FSC) y dispersión lateral (SSC). La puerta de los fagocitos incluye macrófagos/monocitos y granulocitos (23% de las células controladas. La puerta de los linfocitos incluye linfocitos, células B fagocíticas y células citotóxicas (NCC) inespecíficas (26% de las células controladas). Haga clic aquí para ver una versión más grande de esta figura.
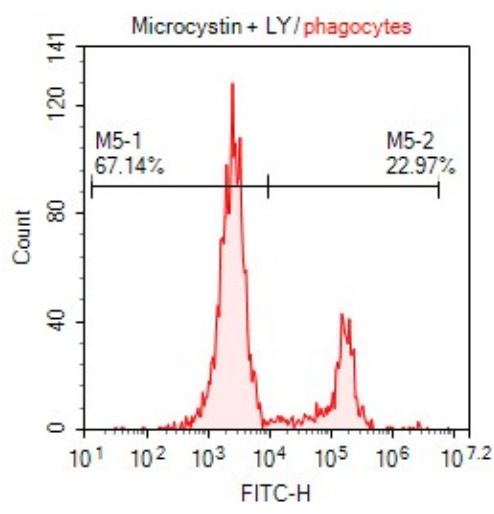
Figura 2: Intensidad media de fluorescencia (MFI) de las células fagocíticas activadas en la Figura 1 después de la exposición a la toxina. El tubo (1) muestra células sin teñir, mientras que las células del tubo (2) emiten fluorescencia a través de la absorción de LY. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Intensidad media de fluorescencia (MFI) de los fagocitos registrados en la Figura 1. Absorción de amarillo Lucifer (LY) sin la presencia de inhibidor de la citocalasina D (CCD) (A); captación de LY con la presencia de CCD. El tubo (1) muestra células sin teñir, mientras que las células del tubo (2) emiten fluorescencia a través de la absorción de LY. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Resumen de los pasos involucrados en el protocolo. *La duración y el grado de exposición de los peces a una biotoxina variarán dependiendo de la biotoxina específica utilizada y de las normas y protocolos de cuidado animal y bioseguridad de las diferentes instituciones. ** La concentración deseada utilizada y el tiempo de exposición utilizado deben optimizarse antes del experimento y dependerán de la toxina que se utilice. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El uso de la citometría de flujo con leucocitos de pez cebra ofrece un enfoque potente y versátil para estudiar el sistema inmunitario en detalle, evaluar el impacto de las toxinas ambientales y facilitar la investigación toxicológica. Proporciona una forma de evaluar de forma rápida y eficaz el impacto de las toxinas en las células inmunitarias y la respuesta inmunitaria. Los resultados revelan los factores humorales involucrados y sugieren cómo la fisiología y el metabolismo de los peces interactúan con las biotoxinas ambientales. La descripción general del protocolo se muestra en la Figura 4.
Sin embargo, estos métodos tienen limitaciones. La preparación de leucocitos de pez cebra para la citometría de flujo puede ser más compleja en comparación con otros modelos. El pequeño tamaño del pez cebra puede limitar la cantidad de sangre y el número de leucocitos disponibles para el análisis 9,10. Estos procedimientos requieren la disociación de tejidos para obtener suspensiones unicelulares, y la viabilidad celular puede afectar la precisión de los resultados. En comparación con modelos como los ratones, la gama de herramientas inmunológicas disponibles, como los anticuerpos específicos para los marcadores celulares del pez cebra, es más limitada para el pez cebra. Esta limitación puede restringir la profundidad del análisis que se puede realizar en los leucocitos del pez cebra. Además, la interpretación de los datos de citometría de flujo requiere experiencia, especialmente cuando se trata de respuestas inmunitarias complejas. La interpretación errónea de los datos puede llevar a conclusiones incorrectas, especialmente en el contexto de los impactos de las toxinas ambientales.
Los resultados de las muestras de células sin inhibidores añadidos se pueden comparar con las muestras de células con los inhibidores. Los resultados de las muestras de células con la toxina añadida deben compararse con las muestras de células con los inhibidores. Si el reordenamiento del citoesqueleto se ha visto afectado, habrá una captación limitada de LY. Si la toxina inhibe la absorción de DX-40 o DX-70, los diferentes tamaños de partículas no serán fagocitados. Si las células no absorben la FITC-E. coli, entonces la toxina ha inhibido la fagocitosis.
En resumen, el pez cebra sirve como un excelente modelo para estudiar los efectos de las toxinas ambientales en las células inmunitarias. Este protocolo describe un método que utiliza citometría de flujo y leucocitos de pez cebra para detectar biotoxinas, con un enfoque particular en los procesos de endocitosis y fagocitosis11. El objetivo de este estudio es determinar si la exposición a toxinas afecta la capacidad de los leucocitos fagocíticos para absorber patógenos y discernir los posibles impactos sobre mecanismos endocíticos específicos.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Los autores agradecen a Izak Hanson por el mantenimiento diario del pez cebra utilizado, y a Treva Billyard y Sterling Bailey por su ayuda en la revisión y el formato de este manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| 10% fetal bovine serum | Gibco | A3160501 | |
| 14 mL round bottom centrifuge tubes | BD Biosciences | 352059 | |
| 40 µm cell straininer | Corning | 07-201-430 | |
| 5 mL flow cytometry tubes | BD Biosciences | 352235 | |
| 50 mL conical centrifuge tube | Corning | 14-959-49A | |
| Absolute ethanol | Fisher | BP2818-500 | |
| Automated cell counter | Life Technologies Countess II FL | for studying cell viability | |
| Bovine serum albumin (BSA) | Sigma | A3059 | |
| cytochalasin D (CCD) | Sigma | C8273-5MG | |
| Dextran 40 | Sigma | FD40-100MG | |
| Dextran 70 | Sigma | 46945-100MG-F | |
| Escherichia coli DH5α (or other lab bacterial strain) | New England Biolabs | C29871 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma | ED4SS | |
| Flow analysis software | Novoacea software | ||
| Flow cytometer | Novocyte 3000 | ||
| Fluorescein | Fluka BioChemica | 46950 | |
| hanks balanced salt solution without calcium or magnesium | Sigma | H4891 | |
| Histopaque 1077 | Sigma | 10771-100ML | |
| Lucifer Yellow | Sigma | L0259-25MG | |
| Mannan | Sigma | M7504-250MG | |
| Phosphate buffered saline | Sigma | P3813 | |
| RPMI-1640 with GlutaMax | Gibco | 61870036 | |
| Statistical software | SPSS | ||
| Toxin | |||
| Tricaine | Western Chemical Inc | NC0342409 |
Referencias
- Vincent, W. F. Cyanobacteria. Encyclopedia of Inland Waters. Likens, G. E. , Academic Press. 226-232 (2009).
- Paerl, H. W., Huisman, J. Climate change: A catalyst for global expansion of harmful cyanobacterial blooms. Environmental Microbiology Reports. 1 (1), 27-37 (2009).
- Yáñez-Sedeño, P., Agüí, L., Villalonga, R., Pingarrón, J. M. Biosensors in forensic analysis. A review. Analytica Chimica Acta. 823, 1-19 (2014).
- Solter, P. F., Beasley, V. R. Chapter 38 - Phycotoxins. Haschek and Rousseaux's handbook of toxicologic pathology (Third Edition). Haschek, W. M., Rousseaux, C. G., Wallig, M. A. , Academic Press. 1155-1186 (2022).
- Espelund, M., Klaveness, D. Botulism outbreaks in natural environments - an update. Frontiers Microbiology. 5, 287(2014).
- Sánchez, C. A., et al. Landscape-level toxicant exposure mediates infection impacts on wildlife populations. Biology Letters. 16 (11), 20200559(2020).
- Traver, D., et al. The zebrafish as a model organism to study development of the immune system. Advances in Immunology. 81, 253-330 (2003).
- Weeks, S. A., Warinner, J. E. Functional evaluation of macrophages in fish from a polluted estuary. Veterinary Immunology and Immunopathology. 12, 313-320 (1986).
- Hohn, C., Lee, S. R., Pinchuk, L. M., Petrie-Hanson, L. Zebrafish kidney phagocytes utilize macropinocytosis and Ca2+-dependent endocytic mechanisms. PLOS One. 4 (2), e4314(2009).
- Petrie-Hanson, L., Hohn, C. M., Hanson, L. A. Characterization of rag1 mutant zebrafish leukocytes. BMC Immunology. 10 (8), (2009).
- Watts, C., March, M. Endocytosis: what goes in and how. Journal of Cell Science. 103, 1-8 (1992).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados