Method Article
评估生物毒素对斑马鱼免疫细胞功能的影响
摘要
该方案描述了流式细胞术测定,可以评估毒素暴露对斑马鱼白细胞不同亚群内吞功能的影响。在测定中使用特定的功能抑制剂可以区分改变的内吞机制。
摘要
各种生物毒素在水生环境中可能以有害水平存在。蓝细菌是一组多样化的原核微生物,可在水生环境中产生蓝藻毒素。这些生物毒素可以是肝毒素、皮肤毒素或神经毒素,可以影响鱼类和哺乳动物。在高水平下,这些化合物是致命的。在非致命水平上,它们起作用阴险并影响免疫细胞功能。藻类产生的生物毒素包括微囊藻毒素和鱼腥毒素 A。水生动物还可以摄入被 肉毒杆菌产生的肉毒杆菌神经毒素 E (BoNT/E) 污染的材料,也会导致死亡或免疫功能下降。斑马鱼可用于研究毒素如何影响免疫细胞功能。在这些研究中,毒素暴露可以在 体内 或 体外进行。 体内 研究将斑马鱼暴露于毒素中,然后分离细胞。该方法展示了组织环境如何影响白细胞功能。 体外 研究首先分离细胞,然后将它们暴露于培养孔中的毒素中。通过肾骨髓提取,然后进行密度梯度离心获得白细胞。白细胞如何内化病原体取决于内吞机制。流式细胞术吞噬作用测定可显示毒素暴露是否改变了内吞机制。目前缺乏使用分离的白细胞来确定毒素如何导致免疫功能障碍的研究。本文中描述的程序将使实验室能够使用斑马鱼来研究当环境毒素降低免疫细胞的内吞功能时受影响的机制。
引言
环境生物毒素和免疫抑制剂的种类很多。含有细菌毒素的藻类大量繁殖发生在内陆水域,也可能以生物膜的形式发生1。蓝藻(蓝绿藻)天然存在于所有淡水生态系统中。淡水系统中的蓝藻大量繁殖大幅增加2.在某些时候,蓝藻会产生对水生和陆生动物有害的毒素。这些毒素会影响肝脏、皮肤和粘膜,和/或神经系统。蓝藻产生的两种化合物是微囊藻毒素和鱼氧毒素 A。微囊藻毒素是一种环状七肽3。Anatoxin A 是一种生物碱4。肉毒杆菌神经毒素 E (BoNT/E) 是另一种发生在水生系统中的毒素。它由 肉毒杆菌 产生,可被水生动物摄入5。
接触环境毒素会影响鱼类,还会影响动物健康并增加疾病发生率6。了解这些毒素如何影响免疫细胞是确定与接触这些物质相关的风险的基础。斑马鱼是研究环境毒素对免疫细胞影响的极好模型7。开发一种利用流式细胞术和斑马鱼白细胞的方法是非常有益的。斑马鱼与人类具有生理相关性,这种方法可应用于广泛的研究领域,从基础毒理学和免疫学到药物发现和发育生物学。因为它们是水生生物,所以斑马鱼特别适合研究水生环境毒素的影响7。斑马鱼的使用比其他脊椎动物模型便宜,而且它们的使用引起的道德问题较少。
白细胞或白细胞是细胞抵御致病微生物的第一道防线。内吞作用是细胞吸收或内化细胞外部液体或颗粒的过程。这是通过将化合物包裹在囊泡中的细胞8 来实现的。白细胞将这个过程作为杀死病原体和准备防御疾病的第一步。吞噬作用是内吞作用的一种,是最早用于研究环境污染物对鱼类健康影响的方法之一9。Petrie-Hanson 实验室开发了使用斑马鱼白细胞来筛选生物毒素的方法,以了解它们可能干扰白细胞内吞和吞噬功能并影响免疫防御的能力。这些方法中包括的内吞作用类型是胞饮作用、吞噬作用、钙依赖性受体介导的吞噬作用和甘露糖受体介导的吞噬作用。对斑马鱼使用流式细胞术方法最早是在 Petrie-Hanson 实验室9 中描述的,并通常用于研究水生毒素和病原体。 Rag1-/- 突变斑马鱼没有 T 细胞和 B 细胞10 ,可用于特异性研究先天免疫细胞机制。
流式细胞术是基于激光的,可用于确定细胞的物理特性。前向散射或 FSC 值绘制在 X 轴上,表示像元的大小。侧向散射或 SSC 绘制在 Y 轴上,代表细胞的细胞质粒度。结果图显示了将具有相似物理特征的细胞群分组在一起,不同的细胞类型出现在散点图上的不同位置。这些群体可以随着细胞的物理特征的变化而改变散点图上的位置9。将这项技术与斑马鱼白细胞结合使用,使研究人员能够评估细胞群对各种刺激(包括环境毒素)的反应变化。
流式细胞仪是多维的,在评估中可以使用多种类型的荧光团来进一步表征细胞及其活性。在本方案中描述的测定中,内吞作用的特征是测量细胞内化的荧光物质的量。通过使用流式细胞术比较毒素暴露的细胞吸收物质的能力与非毒素暴露细胞的能力,可以确定毒素暴露是否以及如何影响内吞机制。可以通过这种方式评估的内吞过程包括胞饮作用、受体介导的内吞作用和吞噬作用。
胞饮作用是可溶性成分的摄取,它不利用细胞受体。摄取涉及微丝和微管的细胞质重排以形成小液泡。荧光素酶黄 (LY) 是一种荧光染料,用于测量非选择性胞饮作用11 的液体摄取。受体介导的内吞作用涉及大分子的选择性摄取。荧光素 (FITC) 标记的葡聚糖 (DX) 40 可用于评估此过程。吞噬作用是内吞作用的一种形式,它吞噬大于 0.5 微米的颗粒。通过使用 FITC-DX70 和 FITC-大肠杆菌的程序来研究这个过程。DX40 和 DX70 的分子量分别为 40,000 和 70,000。FITC-大肠杆菌 是与荧光结合的标准实验室大 肠 杆菌菌株,可通过流式细胞仪测量。许多形式的受体介导的内吞作用需要钙作为信号分子和细胞骨架重排9。另一种受体介导的内吞作用是甘露糖受体 (MR) 介导的内吞作用。甘露糖受体是跨膜蛋白,可识别微生物细胞表面的甘露聚糖形式9。为了优化这些程序,应为每种毒素创建剂量反应曲线,以确定要使用的剂量。应对 LY、FITC-DX40、FITC-DX70 和 FITC-E. 大肠 杆菌进行饱和曲线,以评估要使用的正确浓度。
白细胞用于内化不同颗粒的机制可能会有所不同。为了表明该过程的哪个组成部分可能受到毒素暴露的影响,可以添加抑制剂以阻断吞噬机制。细胞松弛素 D (CCD) 会抑制微管运动,从而抑制胞饮作用。CCD 不影响受体介导的内吞作用11。EDTA 阻断钙 (Ca2+) 依赖性受体介导的内吞作用。甘露聚糖是 MR 的天然配体。甘露聚糖用作甘露糖受体抑制剂,以评估吞噬作用或胞饮作用是否是甘露糖受体介导的9。
该方案的目的是展示确定毒素暴露是否影响吞噬白细胞吸收病原体能力的程序。这些方案还可以辨别特定的内吞机制是否受到影响。在流式细胞仪上进行这些分析,可以通过根据大小和细胞质粒度选择白细胞群来确定白细胞亚群是否受到差异影响,从而进一步区分。该方法依赖于细胞群的电子门控。
研究方案
该协议已获得密西西比州立大学机构动物护理和使用委员会 (MSU-IACUC) 的批准。本研究中使用的所有斑马鱼均来自先前在密西西比州立大学 (MSU) 兽医学院特定无病原体孵化场建立的 rag1-/- 突变斑马鱼纯合菌落10。野生型斑马鱼也在这个孵化场繁殖。在这些研究中,毒素暴露可以在 体内 或 体外进行。 体内 研究将斑马鱼暴露于毒素中,然后分离出白细胞,表明毒素和组织微环境如何相互作用并影响白细胞功能。 体外 研究分离白细胞,然后将细胞暴露于培养孔中的毒素中。
1. 试剂和溶液制备
- 荧光活化细胞分选 (FACS) 缓冲液:(不含钙或镁的 Hanks 平衡盐溶液 (HBSS) + 0.05% 牛血清白蛋白 (BSA))(参见 材料表)。在细胞分离之前准备新鲜的。
- 组织培养基 (TCM):使用补充有谷氨酰胺和 10% 胎牛血清的 RPMI-1640(参见 材料表)。
- 细胞松弛素 D (CCD):通过将市售产品(参见 材料表)重悬于 1 mL 200 标准无水乙醇中来制备储备液。通过将 20 μL 的 CCD 储备液添加到 980 μL 的 FACS 缓冲液中来制备工作溶液,以获得 2.5 μg/mL 的最终浓度。
- EDTA:储备溶液为 1 mg/mL。通过将 100 μL 储备溶液添加到 900 μL FACS 缓冲液中来制备工作溶液,以获得最终浓度 1 mM。
- 甘露聚糖:制备 1 mg/mL 储备液(参见 材料表)。接下来,通过将 100 μL 储备液添加到 900 μL FACS 缓冲液中来制备工作溶液,以获得 500 μg/mL 的最终浓度。
- 通过将市售试剂(参见 材料表)重悬于无菌水中,制备 1 mg/mL 溶液,分别制备荧光素黄 (10 μg/mL)(LY,一种荧光染料)、右旋糖酐-40(DX-40,500 μg/mL)和右旋糖酐-70(DX-70,500 μg/mL)。
- 荧光素 (FITC) 细菌:在补充有 50 μg/mL FITC 的 100 mL Luria Bertani (LB) 培养基中振荡培养大 肠杆菌 DH5α(参见 材料表),在 37 °C 下在光照保护环境中过夜,在 540 nm 处获得 0.8 的光密度 (OD)。
- 用磷酸盐缓冲盐水 (PBS) 洗涤细菌 (3x),以 1000 x g 离心 10 分钟,然后在 60 °C 下加热 20 分钟。再洗涤 1 次,然后将细菌浓度调节至 OD540 0.8。这将是库存解决方案。
- 通过以 1:100 的比例稀释储备溶液(1 mL 原液:99 mL FACS 缓冲液)来制备工作溶液。将终浓度调整为 1.8 x 108 个细胞/mL。
2. 斑马鱼护理
- 在脱氯市政用水上将斑马鱼维持在单通道流通系统中,并喂食高蛋白鱼粉和活卤虫至饱腹感。
- 在 6 个月大时,从鱼缸中取出混合性别斑马鱼,并将它们运送到研究实验室用于实验。这是从肾骨髓中分离最佳白细胞数量的最佳年龄9.
3. 细胞分离
- 按照既定方法在三卡因(~100 mL 4 mg/mL 磷酸盐缓冲三卡因甲烷磺酸盐/升鱼水)中对 10 只斑马鱼实施安乐死(参见 材料表)9.
- 将 40 μm 细胞过滤器放入 50 mL 锥形离心管中。
- 取出肾骨髓组织9 并将它们放入装有 3 mL 组织培养基的 C 管中,并使用组织解离器对组织进行匀浆。这是首选过程。
- 或者,在细胞过滤器中用 3 mL 注射器的橡胶端破坏组织。组织匀浆(或破碎)后,将悬浮液倒入放置在 50 mL 锥形管顶部的 40 μm 细胞过滤器中。
- 将过滤后的悬浮液在 16 °C 下以 500 x g 离心 5 分钟。 倒出上清液。将细胞重悬于 3 mL TCM 中。重复此步骤两次。
- 在室温下,小心地将细胞分层到 3 mL 无菌过滤的密度梯度培养基 (1.077 g/mL) 上。
- 接下来,在 16 °C 下以 800 x g 离心 20 分钟。 确保制动器处于最低档,这样当离心机停止时细胞就不会重悬。
- 从 14 mL 圆底管的界面上去除不透明的血沉棕黄层。
- 通过加入 5 mL TCM 并用巴斯德移液管混合来洗涤细胞。在 16 °C 下以 300 x g 离心 5 分钟。
- 重复该步骤,弃去上清液,将细胞沉淀重悬于 TCM 中,以产生约 1 x 106 个细胞/mL。
4. 细胞活力测定
- 为了监测细胞活力,使用碘化丙啶 (PI) 染色评估细胞死亡。
- 添加浓度为 5 μL/mL 待分析细胞的 PI (200 μg/mL)。在 PE/Texas Red 频道上阅读。
注:碘化丙啶通过死细胞膜上的孔扩散,从而对死细胞进行染色。本研究评估的存活率为 85%。
- 添加浓度为 5 μL/mL 待分析细胞的 PI (200 μg/mL)。在 PE/Texas Red 频道上阅读。
5. 毒素孵化
- 将 200 μL 细胞从分离的细胞悬液中分装到 6 孔组织培养板的每个孔中(3 个孔用于对照,3 个孔用于毒素暴露)。这允许重复一式三份运行。
- 向每个孔中加入 2 mL TCM。
- 向三个孔中加入毒素 (~2.5 μg/mL)。
注:在开始实验之前,应优化毒素浓度,并取决于用于测定的毒素。 - 孵育组织培养板以获得所需的曝光时间。在实验开始之前,应优化所需的暴露时间,并取决于用于测定的毒素。在本研究中,曝光时间为 ~1 小时。
- 暴露时间后,将组织培养板置于冰上 10 分钟。
- 小心地上下移液每个孔中的细胞,以从板中去除任何贴壁细胞。
- 将细胞从板中取出到 14 mL 圆底离心管中。
- 将细胞在 16 °C 下以 300 x g 离心 5 分钟。 在 3 mL FACS 缓冲液中重悬细胞。重复该步骤两次。
- 将细胞重悬于 1.5 mL 的 FACS 缓冲液中。
注意:对于 体内 研究,将斑马鱼暴露于毒素中(浓度与上述相似),然后分离细胞。
6. 内吞作用测定
- 将 100 μL 细胞分装到 5 mL 流式细胞仪管中。用每个孔的四个重复管标记试管如下:(1) LY,(2) DX40,(3) DX70,(4) FITC-E. coli。
- 按照步骤 1.6 和步骤 1.7 中的说明将荧光染料添加到适当的试管中:50 μL LY 到试管 (1) 中,50 μL DX40 到试管 (2) 中;50 μL DX70 至试管 (3);50 μL FITC-E. 大肠杆菌 到试管中 (4)。
- 孵育 1 小时。向每个试管中加入 200 μL 的 FACS 缓冲液。
- 将细胞在 16 °C 下以 400 x g 离心 5 分钟。 倒出上清液,将细胞重悬于 200 μL FACS 缓冲液中。重复此步骤 3 次。执行流式细胞术分析。
7. 流式细胞术
- 进行流式细胞术以可视化细胞群并收集数据。有关详细信息,请参阅 Hohn et al.9 。
- 第一步确定目标细胞群。使用侧向散射 (SSC)(通常为纵轴)去除最左侧的碎片和小的 Pycnotic 细胞,使用前向散射 (FSC)(通常是水平轴)去除图底部的相同碎片。
- 消除双联读数(细胞计数两次)。这是通过使用脉冲几何门 (FSC-H x FSC-A) 来实现的。
- 确定背景信号。针对所使用的每种荧光染料,仅运行细胞荧光对照和同种型荧光对照,以鉴定背景荧光水平。
注:每种荧光染料都有其独特的背景荧光水平,受细胞自发荧光和非特异性结合的影响。这区分了真阳性信号和背景荧光。当基于荧光识别和设门细胞群时,从阳性事件的数量中减去这些对照值,得到的数字是用于分析的数字。 - 运行样品并鉴定要设门的细胞群。使用 FSC 和 SSC 对细胞混合物中的不同细胞群进行形态学表征和鉴定。
注意:FSC 主要与细胞的大小有关。较大的单元将在向前方向上散射更多的光,从而导致更高的 FSC 值,而较小的单元将散射较少的光并且具有较低的 FSC 值。不同大小的细胞将成簇分组。例如,与粒细胞相比,淋巴细胞较小,可能表现为单独的簇,FSC 值较低。SSC 与细胞的粒度、复杂性和内部结构有关。细胞质颗粒度更高的细胞将具有更高的 SSC 值。相似的细胞将聚集在一起。例如,中性粒细胞具有细胞质颗粒,并且会以比淋巴细胞更高的 SSC 值聚集。 - 运行所有样品,并根据 FSC/SSC,将门应用于要进一步分析的细胞群。根据细胞密度和感兴趣的群体应用门控区域。
- 将门控区域绘制到直方图上,以分析蓝色激光在每个门中 FITC 在 495 nm / 519 nm 处的荧光平均荧光强度 (MFI)。
- 将软件确定的细胞计数导出到分析程序中。
- 在统计软件包中分析数据(参见 材料表)。
- 将每个对照细胞群的 MFI 与暴露于毒素的细胞群的 MFI 进行比较。
8. 毒素对内吞机制的影响以及抑制剂 CCD 、 EDTA 和甘露聚糖对内吞机制的影响
注意:为了吸收液体或颗粒,细胞质会主动移动。这种运动需要多个结构元件和信号通路。生物毒素可以影响这些元素或途径中的任何一个。比较特定特征抑制剂的作用可用于帮助辨别生物毒素可能如何发挥作用11。
- 按照步骤 3 中的说明进行细胞分离。
- 将 100 μL 细胞分装到 5 mL 流式细胞仪管中(每个孔有四个复制管)。
注意:按如下方式标记试管:(5) CCD + LY(CCD 通过抑制微丝和微管重排来抑制胞饮作用;LY 用于评估微胞饮作用对液体的吸收)9。(6) EDTA + DX40 (EDTA 阻断 Ca2+ 依赖性受体介导的吞噬作用和小胞饮作用;测量摄取是否涉及钙依赖性机制)。(7) EDTA + DX70。(8) EDTA + FITC-大肠杆菌。(9) 甘露聚糖 + DX40(甘露聚糖抑制甘露糖受体的特异性摄取,测量 MR 依赖性内吞作用9)。(10) 甘露聚糖 + DX70。(11) 甘露聚糖 + FITC-大肠杆菌。 - 添加抑制剂:向试管中加入 1 μL CCD (5);10 μL EDTA 到试管 (6-8);100 μL 甘露聚糖加入试管 (9-11)。遵循步骤 1 中提到的浓度。孵育 5 分钟。
- 将荧光二抗添加到适当的试管中:向试管 (1) 和 (5) 中加入 50 μL LY;将 DX40 50 50 加入试管 (2)、(6) 和 (9);将 DX70 50 加入试管 (3)、(7) 和 (10);将 50 μL FITC-E. 大肠杆菌 添加到试管 (4)、(8) 和 (11) 中。孵育 30 分钟。
- 向每个试管中加入 200 μL 的 FACS 缓冲液。在 16 °C 下以 400 x g 离心 5 分钟。
- 倒出上清液,将细胞重悬于 200 μL FACS 缓冲液中。重复步骤 8.5-8.6 两次。
- 按照步骤 7 在流式细胞仪上运行样品。
结果
内吞作用测定使用从梯度中分离并设门的吞噬细胞和淋巴细胞的混合白细胞,以确定毒素暴露是否改变了特定的细胞机制。首先,根据大小和粒度对细胞进行门控10。死亡、碎片化或垂死的细胞在散点图的左下角可视化并被消除,而不是进行吞噬作用分析。吞噬细胞门包括巨噬细胞、自然杀伤(NK 细胞)和粒细胞,而淋巴细胞门包括淋巴细胞、吞噬细胞 B 细胞和非特异性细胞毒性细胞 (NCC)(图 1)。
吞噬作用由FITC标记颗粒的摄取决定,如用蓝色激光读取495 nm / 519 nm处的荧光所示。通过考虑对照细胞和同种型对照发出的平均荧光强度 (MFI) 来消除背景自发荧光和非特异性结合荧光。应对每种抑制剂进行剂量反应曲线,以确定要使用的浓度。如果暴露于被测毒素的细胞的流式细胞术结果与暴露于抑制剂的细胞的结果相同,则毒素会引起类似的作用,并可能抑制这种内吞机制。如果毒素和抑制剂的反应是相加的,则表明毒素可能通过与抑制剂不同的机制抑制内吞作用。
在未处理的细胞和用被测毒素处理的细胞(图 2)、用毒素或抑制剂处理的细胞(图 3A)和单独用抑制剂处理的细胞(图 3B)之间进行比较。代表性结果表明,用微囊藻毒素处理的细胞受到抑制,类似于用 CCD 处理的细胞。这些结果表明,微囊藻毒素抑制了微胞饮作用对液体的吸收。通过单因素方差分析分析门控细胞,结果应报告为 FITC 阳性的平均细胞数。

图 1:基于前向散射 (FSC) 和侧向散射 (SSC) 特性,从野生型斑马鱼肾组织中分离的白细胞的代表性流式细胞术散点图。 吞噬细胞门包括巨噬细胞/单核细胞和粒细胞(占门控细胞的 23%。淋巴细胞门包括淋巴细胞、吞噬细胞 B 细胞和非特异性细胞毒性细胞 (NCC)(占门控细胞的 26%)。 请单击此处查看此图的较大版本。
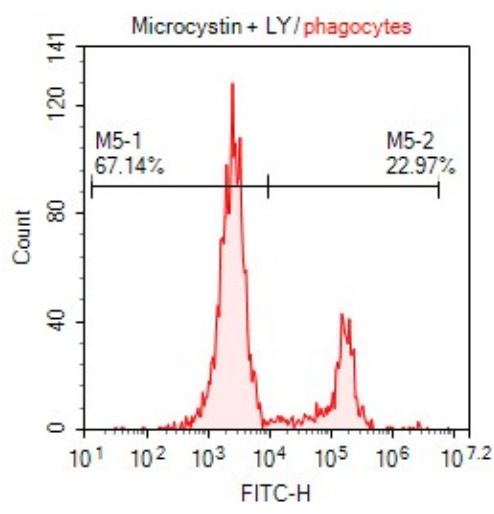
图 2:暴露于毒素后图 1 中设门的吞噬细胞的平均荧光强度 (MFI)。 试管 (1) 显示未染色的细胞,而试管 (2) 中的细胞通过摄取 LY 发出荧光。 请单击此处查看此图的较大版本。

图 3: 图 1 中设门的吞噬细胞的平均荧光强度 (MFI)。 在没有细胞松弛素 D (CCD) 抑制剂的情况下摄取荧光素黄 (LY) (A);存在 CCD 的情况下摄取 LY。试管 (1) 显示未染色的细胞,而试管 (2) 中的细胞通过摄取 LY 发出荧光。 请单击此处查看此图的较大版本。

图 4:方案中涉及的步骤概述。 *鱼暴露于生物毒素的持续时间和程度会有所不同,具体取决于所使用的特定生物毒素以及不同机构的动物护理和生物安全法规和方案。**所需的浓度和使用的暴露时间应在实验前进行优化,具体取决于所使用的毒素。 请单击此处查看此图的较大版本。
讨论
将流式细胞术与斑马鱼白细胞结合使用,为详细研究免疫系统、评估环境毒素的影响和促进毒理学研究提供了一种强大而通用的方法。它提供了一种快速有效地评估毒素对免疫细胞和免疫反应的影响的方法。结果揭示了所涉及的体液因素,并表明了鱼的生理和新陈代谢如何与环境生物毒素相互作用。该协议的概述如图 4 所示。
但是,这些方法存在局限性。与其他模型相比,制备用于流式细胞术的斑马鱼白细胞可能更复杂。斑马鱼的小尺寸会限制可用于分析的血液量和白细胞数量 9,10。这些程序需要解离组织以获得单细胞悬液,并且细胞活力会影响结果的准确性。与小鼠等模型相比,斑马鱼可用的免疫工具范围(例如斑马鱼细胞标志物特异性抗体)对斑马鱼来说更加有限。这种限制会限制可以对斑马鱼白细胞进行的分析深度。此外,流式细胞术数据的解释需要专业知识,尤其是在处理复杂的免疫反应时。对数据的误解可能导致错误的结论,尤其是在环境毒素影响的情况下。
未添加抑制剂的细胞样品的结果可以与添加抑制剂的细胞样品进行比较。应将添加毒素的细胞样品的结果与添加抑制剂的细胞样品的结果进行比较。如果细胞骨架重排受到影响,则 LY 摄取将受到限制。如果毒素抑制 DX-40 或 DX-70 的摄取,则不同大小的颗粒不会被吞噬。如果细胞没有吸收 FITC-E. 大肠杆菌,则毒素抑制了吞噬作用。
总之,斑马鱼是研究环境毒素对免疫细胞影响的极好模型。该方案概述了一种利用流式细胞术和斑马鱼白细胞筛选生物毒素的方法,特别关注内吞作用和吞噬作用过程11。本研究的目的是确定毒素暴露是否会影响吞噬白细胞吸收病原体的能力,并辨别对特定内吞机制的潜在影响。
披露声明
作者没有需要披露的利益冲突。
致谢
作者感谢 Izak Hanson 对所用斑马鱼的日常维护,并感谢 Treva Billyard 和 Sterling Bailey 在校对和排版这份手稿时提供的帮助。
材料
| Name | Company | Catalog Number | Comments |
| 10% fetal bovine serum | Gibco | A3160501 | |
| 14 mL round bottom centrifuge tubes | BD Biosciences | 352059 | |
| 40 µm cell straininer | Corning | 07-201-430 | |
| 5 mL flow cytometry tubes | BD Biosciences | 352235 | |
| 50 mL conical centrifuge tube | Corning | 14-959-49A | |
| Absolute ethanol | Fisher | BP2818-500 | |
| Automated cell counter | Life Technologies Countess II FL | for studying cell viability | |
| Bovine serum albumin (BSA) | Sigma | A3059 | |
| cytochalasin D (CCD) | Sigma | C8273-5MG | |
| Dextran 40 | Sigma | FD40-100MG | |
| Dextran 70 | Sigma | 46945-100MG-F | |
| Escherichia coli DH5α (or other lab bacterial strain) | New England Biolabs | C29871 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma | ED4SS | |
| Flow analysis software | Novoacea software | ||
| Flow cytometer | Novocyte 3000 | ||
| Fluorescein | Fluka BioChemica | 46950 | |
| hanks balanced salt solution without calcium or magnesium | Sigma | H4891 | |
| Histopaque 1077 | Sigma | 10771-100ML | |
| Lucifer Yellow | Sigma | L0259-25MG | |
| Mannan | Sigma | M7504-250MG | |
| Phosphate buffered saline | Sigma | P3813 | |
| RPMI-1640 with GlutaMax | Gibco | 61870036 | |
| Statistical software | SPSS | ||
| Toxin | |||
| Tricaine | Western Chemical Inc | NC0342409 |
参考文献
- Vincent, W. F., Likens, G. E. Cyanobacteria. Encyclopedia of Inland Waters. , 226-232 (2009).
- Paerl, H. W., Huisman, J. Climate change: A catalyst for global expansion of harmful cyanobacterial blooms. Environmental Microbiology Reports. 1 (1), 27-37 (2009).
- Yáñez-Sedeño, P., Agüí, L., Villalonga, R., Pingarrón, J. M. Biosensors in forensic analysis. A review. Analytica Chimica Acta. 823, 1-19 (2014).
- Solter, P. F., Beasley, V. R., Haschek, W. M., Rousseaux, C. G., Wallig, M. A. Chapter 38 - Phycotoxins. Haschek and Rousseaux's handbook of toxicologic pathology (Third Edition). , 1155-1186 (2022).
- Espelund, M., Klaveness, D. Botulism outbreaks in natural environments - an update. Frontiers Microbiology. 5, 287 (2014).
- Sánchez, C. A., et al. Landscape-level toxicant exposure mediates infection impacts on wildlife populations. Biology Letters. 16 (11), 20200559 (2020).
- Traver, D., et al. The zebrafish as a model organism to study development of the immune system. Advances in Immunology. 81, 253-330 (2003).
- Weeks, S. A., Warinner, J. E. Functional evaluation of macrophages in fish from a polluted estuary. Veterinary Immunology and Immunopathology. 12, 313-320 (1986).
- Hohn, C., Lee, S. R., Pinchuk, L. M., Petrie-Hanson, L. Zebrafish kidney phagocytes utilize macropinocytosis and Ca2+-dependent endocytic mechanisms. PLOS One. 4 (2), e4314 (2009).
- Petrie-Hanson, L., Hohn, C. M., Hanson, L. A. Characterization of rag1 mutant zebrafish leukocytes. BMC Immunology. 10 (8), (2009).
- Watts, C., March, M. Endocytosis: what goes in and how. Journal of Cell Science. 103, 1-8 (1992).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。
我们使用 cookie 来增强您在我们网站上的体验。
继续使用我们的网站或单击“继续”,即表示您同意接受我们的 cookie。
