Method Article
טריפוספורילציה כימית של אוליגונוקלאוטידים
In This Article
Summary
אוליגונוקלאוטיד 5′-טריפוספטים הם מרכיבים הנמצאים בכל מקום במסלולים ביולוגיים חיוניים וראו שימוש הולך וגובר ביישומי ביוטכנולוגיה. כאן אנו מתארים טכניקות לסינתזה וטיהור שגרתיים של אוליגונוקלאוטיד 5′-טריפוספטים, החל מאוליגונוקלאוטידים שהוכנו על ידי טכניקות סינתזה אוטומטיות סטנדרטיות.
Abstract
5′-triphosphate הוא שינוי חיוני בחומצת גרעין שנמצא לאורך כל החיים ומשמש יותר ויותר כשינוי פונקציונלי של אוליגונוקלאוטידים בביוטכנולוגיה ובביולוגיה סינתטית. אוליגונוקלאוטיד 5′-טריפוספטים הוכנו באופן היסטורי במבחנה בשיטות אנזימטיות. עם זאת, שיטות אלה מוגבלות לאוליגונוקלאוטידים RNA טבעיים, יש העדפות רצף חזקות, והן נוטות לייצר מוצרים הטרוגניים. שיטות חדשות של טריפוספורילציה כימית משלימות הן את העלות המופחתת של סינתזת אוליגונוקלאוטידים אוטומטית על ידי כימיה של זרחן-אמידיט והן את המגוון המגוון של שינויים בנוקלאוטידים הזמינים כיום. לפיכך, הסינתזה של טריפוספטים אוליגונוקלאוטידים של רצף ואורך שרירותיים, ובאופן אופציונלי המכילה שינויים לא טבעיים שונים, נגישה כעת.
מאמר זה מציג את השיטות והטכניקות המתאימות לטריפוספורילציה כימית של אוליגונוקלאוטידים באמצעות סליציל פוספורוכרידיט ופירופוספט. שיטה זו משתמשת בריאגנטים זמינים מסחרית, תואמת לרוב האוליגונוקלאוטידים שהוכנו בשיטות סינתזה סטנדרטיות של פאזה מוצקה, וניתן להשלים אותה תוך 2 שעות לאחר סינתזת אוליגונוקלאוטידים, לפני ההגנה והטיהור. שני שימושים של אוליגונוקלאוטידים טריגונוקלאוטידים בעלי טריפוספוריה כימית כסובסטרטים לאנזימי RNA קטליטיים, כולל סינתזה של גרסת תמונת מראה של ריבוזים של ראש הפטיש מטריפוספטים לא-ביולוגיים מסוג L-RNA טריפוספטים.
Introduction
הצורה 5′-triphosphorylated של RNA נמצאת בכל מקום בביולוגיה מכיוון שהיא נוצרת על ידי שעתוק RNA בכל תחומי החיים ועל ידי שכפול RNA במהלך מחזור החיים של נגיפי RNA רבים. טריפוספטים אלה משמשים כמצע להיווצרות של mRNA מכוסה 7-מתילגואנילט באאוקריוטים, ולכן ממלאים תפקיד חיוני בביטוי חלבונים1. לעומת זאת, הטריפוספט נשמר בחיידקים ובווירוסים; לפיכך, RNA 5′-triphosphates מוכרים על ידי מווסתי תגובת חסינות מולדת באאוקריוטים 2,3,4,5,6,7. מחוץ לביולוגיה, שורה של RNA ligase ribozymes פותחו כדי להשתמש במבחנה 5′-triphosphate 8 ושונו לשימוש במבחני אבחון 9,10,11,12,13,14,15. ריבוזים אחד כזה יכול לשמש לסינתזה תלוית תבנית של L-RNA, האננטיומר הלא-ביולוגי של "תמונת המראה" של D-RNA טבעי, מ-L-RNA קטן אוליגונוקלאוטיד 5′-טריפוספטים 16,17,18. ההכנה השגרתית של אוליגונוקלאוטידים טריפוספוריים בעלי רצף משתנה והרכב עמוד שדרה חיונית לחקר מערכות אלה.
השיטה הנפוצה והנגישה ביותר להכנת RNA 5′-triphosphates במעבדה היא על ידי שעתוק חוץ גופי. עם זאת, RNA המיוצר על ידי שיטה זו מוגבל ברצף ובגודל על ידי דרישות מקדם וסובסטרט של אנזים RNA פולימראז. T7 RNA פולימראז ונגזרות מיוחדות הם הפולימראזות הנפוצות ביותר המשמשות למטרה זו 19,20,21,22. רנ"א מתועתק במבחנה שהוכן עם אנזימים אלה חייב להיות יזום עם פורין 5′-terminal והוא מוטה מאוד כלפי פורינים ב-10 הנוקלאוטידים הראשונים23,24. יתר על כן, שילוב אנזימטי של נוקלאוטידים שעברו שינוי בסיס או עמוד שדרה הוא במקרה הטוב לא יעיל ולעתים קרובות יותר בלתי אפשרי עם פולימראזות טבעיות, ומגביל את ההזדמנות לייצר אוליגונוקלאוטיד 5′-טריפוספטים המורכבים מכל דבר מלבד D-RNA טבעי. גורם מגביל נוסף הוא שרנ"א שנוצר על ידי שעתוק חוץ גופי יכול להכיל הטרוגניות משמעותית של 5′ו-3′, והוא מיוצר כתוצרים הטרוגניים ביותר כאשר הוא קצר מ-20 nt 23,24,25,26,27.
לעומת זאת, טריפוספורילציה כימית של אוליגונוקלאוטידים שהוכנה על ידי סינתזת פוספוראמידיט בפאזה מוצקה 28,29,30,31,32,33,34,35 יכולה לשמש להכנת אוליגונוקלאוטיד 5′-טריפוספטים באורך 3-50 nt, מכל רצף. בנוסף, ניתן להוסיף מגוון עצום של שינויים בחומצות גרעין הנגישים לסינתזת פוספורמידיט לאוליגונוקלאוטידים לפני 5′-טריפוספורילציה 14,15,16,17,18,29,36. רבות משיטות אלה משתמשות בריאגנט הפוספילציה סליצ'יל פוספורוכלורידיט, אשר פותח על ידי לודוויג ואקשטיין עבור טריפוספורילציה בשלב התמיסה של מונונוקלאוזידים37. טריפוספורילציה של אוליגונוקלאוטידים עם מגיב זה מושגת על הפאזה המוצקת על ידי פוספטיצלציה של האוליגונוקלאוטיד 5′-הידרוקסיל, המרה לטריפוספט על ידי תגובה עם פירופוספט וחמצון, ולאחר מכן נהלים סטנדרטיים לביקוע של האוליגונוקלאוטיד מהתמיכה המוצקה, ההגנה והטיהור (איור 1)28.
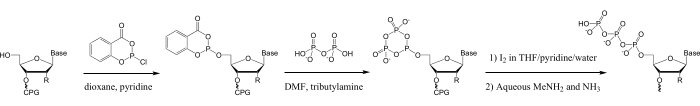
איור 1: סכימה לטריפוספורילציה של אוליגונוקלאוטידים סינתטיים. בשלב הראשון, האוליגונוקלאוטיד 5ʹ-הידרוקסיל הוא פוספטיזציה עם SalPCl. בשלב הבא, הפוספיט 5ʹ-salicyl sphite מגיב עם TBAP כדי ליצור את המטפוספיט המחזורי, ואז בשלב השלישי מחומצן כדי ליצור את 5ʹ-טרימטפוספט מחזורי בתמיסת חמצון DNA/RNA סינתיסייזר (0.1 M יוד/פירידין/H2O/THF), שעובר הידרוליזה מהירה כדי להניב את ה-5ʹ-טריפוספט הליניארי באותה תמיסה28,33, 37. ביקוע אלקליין עוקב מתמיכת CPG מוצקה והגנה על האוליגונוקלאוטיד ב- MeNH2/אמוניה מימית תבצע הידרוליזה של כל טרימטפוספט מחזורי שיורי לצורה הליניארית. קיצורים: SalPCl = salicyl phosphorochloridite; TBAP = טריבוטילמוניום פירופוספט; THF = טטרהידרופורן; CPG = זכוכית נקבובית מבוקרת; MeNH2 = מתילאמין. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
למרות שדוחות שפורסמו מוקדם באמצעות שיטה זו סבלו לעתים קרובות מתפוקות גרועות וממוצרי צד לא רצויים 28,37,38, תחזוקה קפדנית של תנאי מים היא כל מה שנדרש להשגת תפוקות גבוהות באופן שגרתי. זה יכול להיות מושגת על ידי הכנה זהירה של ריאגנטים ושימוש במכשיר תגובה פשוטה המורכבת מרכיבי פלסטיק סטנדרטיים. כאן אנו מדגימים את השלבים המתאימים לטריפוספורילציה כימית של אוליגונוקלאוטידים, כולל הכנת ריאגנטים, הרכבת תא התגובה, תגובת הטריפוספורילציה, ולאחר מכן הגנה וטיהור של אוליגונוקלאוטידים הטריפוספוריים. כמו כן נכלל השימוש הייצוגי באוליגונוקלאוטידים של 5′-טריפוספוריים כמצעים לריבוזימים של ליגאז לסינתזה של תוצרי חומצות גרעין גדולות יותר עם עמודי שדרה טבעיים של D-RNA ו-L-RNA אביוטי.
Protocol
1. סינתזה אוטומטית של פאזה מוצקה של 5′-הידרוקסיל אוליגונוקלאוטידים על תמיכה מוצקה
- הכינו את הסינתיסייזר האוטומטי של DNA/RNA עם ריאגנטים וזרחנים על פי הרכב האוליגונוקלאוטידים של המטרה והוראות המכשיר.
- טען עמודת סינתזה המכילה תמיכה מוצקה על הסינתיסייזר וסנתז אוליגונוקלאוטידים על פי פרוטוקולי מכשיר הסינתיסייזר.
הערה: הליך הטריפוספורילציה הותאם לאוליגונוקלאוטידים שהוכן בקנה מידה של 1 מיקרומול. - הסר את קבוצת ההגנה 5′-dimethoxytrityl כדי להניב את האוליגונוקלאוטיד הנתמך על ידי מוצק 5′-הידרוקסיל כחלק מסינתזת האוליגונוקלאוטידים בשלב הקודם, או על ידי ביצוע שלב דטריטילציה סופני על פי פרוטוקולי מכשיר הסינתיסייזר.
- הסר את העמודה המכילה את 5′-הידרוקסיל אוליגונוקלאוטיד על תמיכה מוצקה מהסינתיסייזר, ייבש מתחת לוואקום ביתי במשך 10 דקות כדי להסיר ממס שיורי, והמשך לטריפוספורילציה (סעיפים 3 ו-4) לאחר הכנת חומרים לטריפוספורילציה (סעיף 2).
הערה: אם לא נעשה שימוש מיידי, ניתן לאחסן את העמודה המיובשת תחת אווירה רגילה במיכל פלסטיק אטום עם חומר ייבוש בטמפרטורה של -20 מעלות צלזיוס. בשלב זה אין צורך בייבוש נוסף, שכן הטור מיובש היטב לפני הטריפוספורילציה בסעיף 3.
2. הכנת חומרים לטריפוספורילציה
- חברו מקור ארגון יבש עם לחץ מתכוונן לסעפת גז עם שני קווים לפחות והתחברו לבועה. ודא שהקווים מסתיימים במזרקי פלסטיק של 1 מ"ל כדי להקל על החיבור למנגנון התגובה.
- לאסוף ציוד לשימוש במהלך triphosphorylation, כולל מזרקי פלסטיק 1 מ"ל, סטופקוק פוליפרופילן תלת כיווני, מחטים ללא ניקוד, צינורות פוליפרופילן 1.5 מ"ל, ומרית מתכת קטנה. יש לאחסן אותם במיכל אטום או במייבש ייבוש עם חומר ייבוש בטמפרטורת החדר למשך יום אחד לפחות לפני השימוש.
- הכינו 30 מ"ל כל אחד של 1,4-דיוקסן נטול מים, 3:1 דיוקסן:פירידין לפי נפח, N,N-דימתילפורמיד (DMF) ואצטוניטריל (ACN) בבקבוקי זכוכית מיובשים של 30 מ"ל עם מלכודות ייבוש (4 מסננות מולקולריות Å בחבילות ממברנה אטומות) לפחות יום אחד לפני השימוש. אוטמים עם ספטה מגומי, ומאחסנים במייבש כביסה עם חומר ייבוש.
- אחסן מוצק 2-כלורו-4H-1,3,2-בנזודיוקספוספורין-4-אחד (salicyl phosphorochloridite, SalPCl) במיכל המקורי שלו בתוך צנצנת אטומה עם חומר ייבוש ב 4 °C (66 °F). תמיד לשטוף את המיכל עם ארגון בין שימושים.
- הכינו תמיסת טריבוילאמוניום פירופוספט (TBAP) לפחות 5 ימים לפני תגובת הטריפוספוריה:
- שוקלים 1-5 גרם של TBAP מוצק בבקבוק זכוכית מיובש של 30 מ"ל ומתמוססים ב-1 מ"ל של DMF ו-0.5 מ"ל של טריבוטילאמין לכל גרם של TBAP.
- מוסיפים שלוש מלכודות ייבוש, אוטמים את הבקבוק עם מחיצת גומי מתחת לארגון, ומבעבעים עם ארגון למשך 30 דקות לדגה.
- יש לאחסן בתוך צנצנת אטומה עם חומר ייבוש בטמפרטורה של 4 מעלות צלזיוס למשך 5 ימים כדי לאפשר למסננות המולקולריות לספוג את כל מי העקבות. אחסנו את הצנצנת בטמפרטורה של -20 מעלות צלזיוס והכינו טריים לאחר 6 חודשים.
3. הרכבה ושימוש במנגנון הטריפוספורילציה
- אפשר לעמודת הסינתזה להתחמם לטמפרטורת החדר אם נשלף מהאחסון בטמפרטורה של -20 מעלות צלזיוס.
- הרכיבו את תא התגובה המוצג באיור 2:
- מכינים את האנטקמבר: מוציאים את הבוכנה ממזרק יבש של 1 מ"ל, חותכים את החלק העליון של המזרק באמצעות מספריים או סכין גילוח, ומחברים את המזרק לעמוד הסינתזה. חברו את ה-stopcock התלת-כיווני לחלק העליון של המזרק והצמידו את הכניסה הצדדית של ה-stopcock למקור הארגון היבש עם הבועה, כך שהכניסה העליונה של ה-stopcock היא יציאת הזרקת הריאגנטים.
- הצמידו את המנגנון הזה למעמד עם מלחציים ואטמו את כל המפרקים במעלה הזרם עם סרט איטום שעווה. התאם את ה-stopcock כך שיציאת ההזרקה תהיה סגורה, והמנגנון יהיה פתוח למקור הארגון. סגור את הבועה, ואפשר לארגון בלחץ נמוך (<10 psi) לזרום דרך תא התגובה במשך 5 דקות.
הערה: ניתן להגדיר תאי תגובה מרובים במקביל לטריפוספורילט 2-4 אוליגונוקלאוטידים. עם זאת, שורה אחת מהסעפת צריכה להיות שמורה לאספקת ארגון לבקבוקי הריאגנטים. - פתחו מחדש את הבועה והצמידו מזרק לתחתית עמודת הסינתזה, שיהיה מזרק הפסולת. למשוך ארגון דרך העמוד שוב ושוב באמצעות מזרק הפסולת; לאחר מכן, חבר מחדש את המזרק עם הבוכנה שנדחפה במלואה פנימה.
הערה: אלא אם כן טעינת ריאגנטים, יש להגדיר את ה-stopcock כך שיציאת ההזרקה תהיה סגורה והמנגנון ייפתח למקור הארגון, כפי שמוצג באיור 2A. באופן דומה, יש לחבר את מזרק הפסולת ואת המפרק לעמוד הסינתזה אטום בסרט איטום שעווה אלא אם כן מסירים ריאגנטים באופן פעיל.
- כדי להוסיף מגיב או ממס:
- הצמידו מחט למקור הארגון היבש והכניסו אותה למחיצה של הריאגנט או הבקבוק הממס, תוך הקפדה שלא לטבול את המחט בתכולת הבקבוק.
- מרכיבים מזרק יבש עם מחט ומחדירים אותו לתוך מחיצת הריאגנט או בקבוק הממס, מבלי לטבול אותו בתכולת הבקבוק. מלאו את המזרק בארגון, משכו את המחט מהמחיצה וגירשו את הארגון. מלאו את המזרק בארגון וגירשו שוב; לאחר מכן, מלא את המזרק בנפח הנדרש של ממס או מגיב תחת לחץ ארגון.
- התאם את ה-stopcock במנגנון כך שמקור הארגון יהיה סגור, ויציאת ההזרקה תהיה פתוחה (איור 2B). הסר במהירות את המזרק והמחט הממולאים מבקבוק המקור, נגב כל ממס שנדבק לצד או לקצה המחט, והכנס את המחט ליציאת ההזרקה. הוציאו את המגיב לתוך האנטקמבר של המנגנון, הסירו את המחט וסגרו את יציאת ההזרקה, ופתחו מחדש את המנגנון למקור הארגון.
- משכו בעדינות את הנוזל מהאנטקמבר לאורך כל עמודת הסינתזה באמצעות מזרק הפסולת, כך שכל הנוזלים מוחזקים כעת במזרק הפסולת. כעת, דחפו באיטיות את התמיסה בחזרה למעלה אל עמודת הסינתזה, תוך הבטחה שאין בועות גז בעמודה. כדי לערבב או להתסיס, משכו בעדינות את התמיסה למעלה ולמטה מעל העמודה עם מזרק הפסולת.
הערה: הזיזו תמיד נוזל לאט ובעדינות דרך תא התגובה כדי לוודא שאין אטמים שבורים, מה שמאפשר לאוויר להיכנס למנגנון.
- כדי להסיר מגיב או ממס מהעמודה:
- לאט לאט למשוך את הפתרון לתוך מזרק הפסולת. לאחר שעיקר התמיסה עברה למזרק הפסולת, משכו את ארגון דרך כדי לשטוף את הממס הנותר מהעמודה.
- מסירים את סרט איטום השעווה סביב מפרק מזרק הפסולת, ואז מסירים את המזרק ומשליכים את תמיסת הפסולת. החליפו את מזרק הפסולת במזרק חדש ויבש, ואטמו מחדש את המפרק בסרט איטום שעווה.

איור 2: מנגנון טריפוספורילציה. במהלך ערבוב או תגובות, המכשיר (A) פתוח למקור הארגון (i) ונסגר לאוויר על ידי התאמת הסטופקוק התלת-כיווני (ii). ריאגנטים נמשכים מהאנטקמבר (iii) לתוך עמודת הסינתזה (iv) באמצעות מזרק הפסולת (v). ריאגנטים מוסרים על ידי משיכת כל הנוזל לתוך מזרק הפסולת (v) והשלכתו. בעת העמסת ריאגנטים (B), ה-stopcock התלת-כיווני (ii) פתוח לאטמוספרה, והריאגנט נטען לתוך האנטקמבר (iii) באמצעות מזרק ומחט (vi). (C) תצלום של המנגנון המורכב שנקבע כ-(A) לערבוב ריאגנטים ולתגובה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
4. טריפוספורילציה על עמודה של אוליגונוקלאוטיד סינתטי 5′-הידרוקסיל
- הסר את פתרון SalPCl ו- TBAP מהאחסון בטמפרטורה של -20 °C (75 °F) ואפשר להם להתחמם לטמפרטורת החדר לפני השימוש.
- הוסיפו 200 μL של פירידין/דיוקסן לאנטקמבר, על פי שלבים 3.3.1-3.3.3. עם זאת, אין לטעון ממס על עמודת הסינתזה עד שלב 4.4.
- השתמשו במרית מתכת יבשה כדי לשקול 6-12 מ"ג של SalPCl לתוך צינור מיקרו-צנטריפוג' יבש של 1.5 מ"ל, והתמוססו ב-100 מיקרול' של דיוקסן על ידי סחיטת עדינה של הממס למעלה ולמטה בתוך צינור המיקרוצנטריפוגה.
- הוסף את ה- SalPCl המומס לאנטקמבר וטען אותו על עמודת הסינתזה, לאחר שלב 3.3. תן לו להגיב במשך 15 דקות, להתסיס את הפתרון כל 5 דקות. הסר והשליך את פתרון SalPCl בהתאם לשלב 3.4.
הערה: SalPCl מתווסף בעודף גדול ויגזול את כל המים שנספגו במהלך ההכנה וההעמסה לתוך תא התגובה. עם זאת, הכנסת לחות כלשהי במהלך שלבים 4.5 ו-4.6 תפגע בתפוקת האוליגונוקלאוטיד הסופית 5′-triphosphate. - הוסף 250 μL של פתרון TBAP ל- antechamber וטען אותו על עמודת הסינתזה, לאחר שלב 3.3. תן לו להגיב במשך 20 דקות, להתסיס כל 5 דקות. הסר והשלך את פתרון ה- TBAP בהתאם לשלב 3.4.
- לשטוף את העמודה עם 0.5 מ"ל של DMF, ולאחר מכן 0.5 מ"ל של ACN, הסרת הממס לאחר כל תוספת על פי שלבים 3.3 ו 3.4.
- הוסיפו 250 μL של תמיסת מחמצן (0.1 M יוד בטטרהידרופורן (THF)/פירידין/מים, 88:10:2) לאנטקמבר וטענו אותו לעמודת הסינתזה, לאחר שלב 3.3. תן לו להגיב במשך 30 דקות, להתסיס כל 10 דקות. הסר והשליכו את תמיסת המחמצן בהתאם לשלב 3.4.
- לשטוף את העמודה עם 0.5 מ"ל של ACN ולהסיר, על פי שלבים 3.3 ו 3.4.
- לפרק את מנגנון התגובה. לשטוף את עמודת הסינתזה עם 5 מ"ל של ACN ולייבש את העמודה.
5. מחשוף מתמיכה מוצקה, הגנה וטיהור
- הסר את שרף התמיכה המוצק המיובש מעמודת הסינתזה והעביר אותו לצינור אטום בעל יכולת איטום פוליפרופילן בגודל 1.5 מ"ל עם טבעת סיליקון o.
- יש להשעות את השרף ב-1 מ"ל של תערובת של 1:1 של 28%-30% אמוניה מימית ו-40% מתילאמין מימי (AMA) ולאטום את הצינור בחוזקה. דגירה בטמפרטורה של 65 מעלות צלזיוס למשך 10 דקות עם ערבוב לסירוגין על ידי היפוך עדין39. השתמש בטיפול מתון יותר בטמפרטורת החדר במשך 2 שעות עבור oligonucleotides ארוך יותר מ 40 nt.
אזהרה: חימום של פתרון AMA יכניס את הצינור ללחץ גבוה. אם הצינור אינו אטום היטב או אינו משתמש בטבעת o תואמת אמוניה (סיליקון), הצינור עלול לאוורר גז או ממס דליפה, מה שעלול לפגוע בבטיחות או בתפוקת המוצר הסופית. לעולם אל תפתח את הצינור כל עוד הוא מעל טמפרטורת הסביבה, מכיוון שתמיסת AMA חמה יכולה לפתח גז באלימות. - מצננים את הצינור על הקרח ומכניסים אותו לזמן קצר לצנטריפוגה (6,000-12,000 × גרם במשך 10 שניות). מוציאים את ה-supernatant מהשרף, מסננים דרך מזרק המצויד במסנן של 0.2 מיקרומטר, ומעבירים לצינור פוליפרופילן חדש וסטרילי. מאדים את התמיסה ליובש באמצעות צנטריפוגת ואקום המצוידת במלכודת כימית מנטרלת אמוניה.
הערה: אם האוליגונוקלאוטיד הסינתטי אינו מכיל נוקלאוטידים של RNA עם קבוצות הגנה של 2′-סיליל, דלג לשלב 5.8. - הסר קבוצות הגנה על סיליל על ידי המסת החומר המיובש ב-1 מ"ל של 1 M טטרבוטילמוניום פלואוריד (TBAF) ב-THF, חימום ל-55 מעלות צלזיוס, ניעור במידת הצורך כדי להמיס את האוליגונוקלאוטיד במלואו, ודגירה בטמפרטורת החדר למשך 16-24 שעות40,41.
- מרווים את פתרון ה-TBAF עם 1 מ"ל של מאגר 1 M Tris, pH 7.5, והסירו THF באמצעות צנטריפוגת ואקום.
- הסר מלחי TBAF באמצעות עמודת אי-הכללה של גודל חד-פעמי, בהתאם להוראות היצרן. עבור אוליגונוקלאוטידים קצרים מ-15 nt, אשרו את ההארה של המוצר על ידי איסוף ההקלה בשברים, וזיהוי שברי המוצר העיקריים על ידי ספיגה ב-260 ננומטר בספקטרופוטומטר UV-Vis.
- לרכז את ה-RNA oligonucleotide המוגן על ידי ליופיליזציה או צנטריפוגת ואקום אם היא קטנה מ-15 nt, או על ידי משקעי אתנול אם הם גדולים מ-15 nt.
- הכינו סולם הכנה של 10%-20% פוליאקרילאמיד/8 M urea/1x TBE ג'ל באמצעות 19:1 מונו:bis acrylamide stock, על פי הפרוטוקולים המתאימים לגודל אוליגונוקלאוטיד, צלחת ג'ל ומעמד. הרכיבו את צלחת הג'ל במעמד הג'ל עם 1x TBE במאגרים והריצו מראש ב-35 ואט (או לפי הצורך בפורמט צלחת ג'ל) למשך 30 דקות לפחות.
- ממיסים את האוליגונוקלאוטיד המוצק במאגר העמסת ג'ל אוריאה (8 M אוריאה, 10% סוכרוז, 50 mM Tris, pH 8, 1 mM EDTA עם צבעי ברומופנול וקסילן ציאנול) ומחממים ל-80 מעלות צלזיוס. טענו על ג'ל הפוליאקרילאמיד ורצו במשך 1-2 שעות ב-25-35 ואט (או בהתאם לפורמט צלחת הג'ל ולגודל אוליגונוקלאוטיד).
הערה: יש לכלול את כחול ברומופנול או קסילן ציאנול ממאגר העמסת הג'ל עבור אוליגונוקלאוטידים קצרים מ-15 nt אם אחד מהם נודד יחד עם המוצר, מכיוון שקשה להסיר צבעים אלה מהאוליגונוקלאוטיד הבוקע ללא משקעי אתנול. - לאחר השלמת האלקטרופורזה של הג'ל, הסירו את צלחת הג'ל מעמד הג'ל, פירקו את צלחת הג'ל ועטפו את הג'ל בסרט פוליווינילכלוריד. זהה את רצועות המוצר על-ידי הצללה אחורית עם אור UV של 254 ננומטר, והבלו את רצועת המוצרים העיקרית באמצעות סכין גילוח.
- מוציאים את האוליגונוקלאוטיד מהג'ל הנכרת בשיטת הריסוק וההשריה42.
- מרסקים את הג'ל הכריתה על ידי הוצאתו דרך מזרק פלסטיק או מכני.
- עבור אוליגונוקלאוטידים ארוכים מ-15 nt:
- Elute ב 3x נפחים של ריסוק וטבילה חיץ (300 mM NaCl; 10 mM Tris, pH 8; 1 mM EDTA) במשך 12 שעות לפחות עם תסיסה או רעידות.
- הסר חתיכות ג'ל מוצקות על ידי העברת התמיסה דרך מזרק המצויד במסנן של 0.2 מיקרומטר ותרכז את האוליגונוקלאוטיד על ידי משקעי אתנול.
- עבור אוליגונוקלאוטיד קצר מ-15 nt:
- הקפידו על נפחים של פי 3 של מים נטולי נוקלאז במשך 12 שעות לפחות עם תסיסה או רעידות.
- הסר חתיכות ג'ל מוצקות על ידי העברת התמיסה דרך מזרק המצויד במסנן 0.2 מיקרומטר והתרכז על ידי ליופיליזציה.
- הסר שאריות מלחים ומומסים באמצעות עמודת הרחקה בגודל חד פעמי כמו בשלב 5.6. להתרכז על ידי ליופיליזציה.
- אחסן אוליגונוקלאוטידים מטוהרים בטמפרטורה של -20 מעלות צלזיוס במאגר TE (10 mM Tris, pH 8; 1 mM EDTA) או במאגר אחסון אוליגונוקלאוטיד דומה.
- קבע את ריכוז האוליגונוקלאוטיד על ידי מדידת הספיגה ב-260 ננומטר באמצעות ספקטרופוטומטר UV-Vis.
הערה: מקדם ההכחדה המשוער של האוליגונוקלאוטיד לא אמור להיות מושפע ממצב ה-5′-phosphorylation שלו, וניתן לחשב אותו מהרצף שלו באמצעות מחשבון מקדם הכחדה של אוליגונוקלאוטידים. - אמת טריפוספורילציה על ידי ספקטרומטריית מסות. חפשו מסה צפויה של +239.94 Da ביחס לזו של 5′-הידרוקסיל אוליגונוקלאוטיד.
הערה: ספקטרומטריית מסת יינון לייזר בסיוע מטריצה או ספקטרומטריית מסת יינון אלקטרוספריי (MALDI-MS או ESI-MS, בהתאמה) מתאימים לזיהוי מצב הטריפוספורילציה של האוליגונוקלאוטיד בעת שימוש בפרוטוקולים הממוטבים לחומצות גרעין. עם זאת, ESI-MS מספק תוצאות עקביות יותר, בשל שיעורים נמוכים יותר של פיצול יונים; שירות מסחרי מייצג מסופק בטבלת החומרים.
- קבע את ריכוז האוליגונוקלאוטיד על ידי מדידת הספיגה ב-260 ננומטר באמצעות ספקטרופוטומטר UV-Vis.
6. אוליגונוקלאוטידים טריפוספוריים כמצעים לשכפול עצמי של ריבוזים
אזהרה: 32P הוא איזוטופ רדיואקטיבי והצעדים הבאים צריכים להתבצע באמצעות פרוטוקולי בטיחות סטנדרטיים לעבודה עם חומרים רדיואקטיביים במעבדה ועל ידי חוקר שהוסמך לשימוש בחומרים רדיואקטיביים על ידי מחלקות הבריאות והבטיחות הסביבתית הרלוונטיות. כחלופה, ניתן להכין את מצע הריבוזים A המשכפל את עצמו באופן סינתטי עם תווית 5′-פלואורסציין14 ולדמותו באופן פלואורסצנטי, כמו בשלב 7.9.
- הכן תמיסה A כתערובת של ריבוזים משכפלים עצמיים E ו- 5′-32מצע RNA מסומן PA 14 לריכוזים של 0.30 μM ו- 30 μM, בהתאמה. הכן פתרונות B-מתועתקים ו-B-סינתטיים עם מצע RNA משולש של 15 μM B, שהוכן על ידי שעתוק במבחנה 14 או טריפוספוריה כימית כנ"ל, בהתאמה, במאגר EPPS של 75 mM, pH 8.5 ו- 37.5 MgCl2. הביאו את שני הפתרונות ל-42 מעלות צלזיוס.
הערה: כל רכיבי ה- RNA רשומים בטבלת החומרים. - כדי ליזום שכפול עצמי, ערבבו במהירות 5 μL של תמיסה A עם 10 μL של תמיסה מתועתקת B או B-סינתטית לריכוז סופי של 0.1 μM E, 10 μM A, 10 μM B, 25 mM MgCl2, ו-50 mM מאגר EPPS, pH 8.5. דגירה של תערובת התגובה בטמפרטורה של 42 מעלות צלזיוס.
- במרווחי זמן קבועים, יש ליטול 0.5 μL aliquots ולרווה ב-9.5 μL של מאגר טעינת ג'ל פורמיד (95% פורמיד; 10 mM EDTA, pH 8).
- מכינים פוליאקרילאמיד אנליטי/8 M urea/1x ג'ל TBE, על פי הפרוטוקולים המתאימים לצלחת הג'ל ולמעמד. הרכיבו את הג'ל והצלחת יצוקים במעמד ג'ל, מלאו את המאגרים ב-1x TBE, והריצו מראש ב-40 W (או בהתאם ללוחות ומעמדי ג'ל שונים) למשך 30 דקות.
- מחממים את דגימות התגובה המרוות ל-80 מעלות צלזיוס, מעמיסים 5 μL מהדגימה בכל באר, ומפעילים את הג'ל ב-40 W במשך כ-40 דקות (או לפי הצורך לצלחות ג'ל ומעמדים שונים).
- מוציאים את צלחת הג'ל מעמד הג'ל, מפרקים ועוטפים את הג'ל בסרט פוליווינילכלוריד. מכסים את הג'ל במסך זרחן וחושפים במשך שעה אחת (או לפי הצורך ב-32P cpm); סרוק את המסך באמצעות סורק ג'ל פלואורסצנטי/זרחני.
- לכמת את תפוקת התגובה באמצעות תוכנת כימות תמונות ג'ל.
- פתח את תמונת הג'ל באמצעות ארגז הכלים לניתוח, בחר ניתוח | הגדרת צורה, בחר אזורים | צורת המלבן, וצייר מלבנים באותו גודל סביב רצועות המתאימות ל- A ולמוצר E שלא תוקנו עבור כל פעם ושתי התגובות.
- בחר ניתוח | חיסור רקע, בחר אזורים | צורת המלבן וצייר מלבן באותו גודל בחלק ריק של תמונת הג'ל. שנה את שיטת חיסור הרקע עבור כל המלבנים למלבן תמונה.
- בחר חלון | חלון 2 אזור ולאחר מכן ערוך | ייצא ל- Excel כדי לייצא את אמצעי האחסון של פיקסלי הפסים המכומתים לקובץ גיליון אלקטרוני.
- להתוות את הריכוז של מוצר E לעומת זמן, ולהתאים את הנתונים לצמיחה הלוגיסטית Eq (1) באמצעות תוכנה להתאמת נתונים סטטיסטיים:
[E] =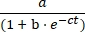 (1)
(1)
כאשר a הוא היקף התגובה המרבי, b הוא דרגת הסיגמוידיות, ו-c הוא קצב הצמיחה האקספוננציאלי.- בגיליון האלקטרוני המיוצא, חלקו את נפח E של המכפלה בסכום נפחי המצע A והמכפלה E כדי לקבוע את התשואה החלקית של המכפלה עבור כל זמן ושתי התגובות. הכפל בריכוז ההתחלתי של מצע A (10 μM) כדי לקבוע את התשואה של מכפלה E כפונקציה של זמן.
- בתוכנת התאמת נתונים סטטיסטיים, בחר קובץ | ניו | קובץ פרוייקט חדש, בחר XY תחת טבלה וגרף חדשים ולחץ על צור. הזן את זמני התגובה ואת תפוקת המוצר E עבור שתי התגובות בעמודות סמוכות, ועמודות התוויות המתאימות (לדוגמה, "זמן", "מתומלל B", "סינתטי B").
- בחר הוסף | ניתוח חדש, בחר ניתוחי XY | רגרסיה לא ליניארית (התאמת עקומה) ולאחר מכן לחץ על אישור. בחר עקומות צמיחה | צמיחה לוגיסטית ולחץ על אישור; אל תתאים פרמטרים אחרים. שימו לב לפרמטרים ולרווחי סמך של ההתאמה תחת תוצאות ובהתוויית נקודות נתונים ועקומות מותאמות תחת גרפים.
7. העתקה צולבת כיראלית של L-RNA
- הכן 10 μL של תמיסת RNA המכילה 20 μM D-RNA 27.3t פולימראז חוצה כיראלי, 2 μM 5′-פלואורסציין עם תווית L-RNA פריימר, 4 μM ביוטינילטית L-RNA תבנית ראש פטיש, ו 20 μM כל אחד של L-RNA pppCUG, pppAUG, pppAGG ו- pppCGC, ב- 10 μL של 50 mM Tris, pH 8.3. לחמש את הרנ"א על ידי חימום ל-90 מעלות צלזיוס למשך דקה אחת וקירור ל-23 מעלות צלזיוס ב-0.2 מעלות צלזיוס לשנייה בתרמוצילר PCR. עיין בטבלת החומרים לקבלת פרטים על הפולימראז, הפריימר והתבנית.
- דגירה של תמיסת ה-RNA ב-17°C והתחל את התגובה על-ידי הוספת 10 μL של מאגר התחלה של 2x (400 mM MgCl2, 500 mM NaCl ו-50 mM Tris, pH 8.3). ודא שהריכוזים הסופיים של כל מרכיבי התגובה הם 10 μM פולימראז, פריימר 1 μM, תבנית 2 μM, 10 μM כל טרינוקלאוטיד 5′-טריפוספט, 200 mM MgCl2, 250 mM NaCl ו- 50 mM Tris, pH 8.3.
- ככל שהתגובה מתקדמת, קח 10 μL aliquots ומרווה עם 5 μL של 0.5 M EDTA, pH 8.
- לכל דגימת תגובה מרווה, הוסיפו 0.1 מ"ג של חרוזים מגנטיים מצופים סטרפטווידין (קיבולת קשירה של 20 pmol biotin-oligonucleotide) התלויים ב-10 μL של 1 M NaCl במאגר TE עם חומר ניקוי נייטרלי של 0.05% כדי ללכוד פריימרים מורחבים של טרימר באמצעות התבנית הביוטינילציה ולדגירה למשך 30 דקות בטמפרטורת החדר עם רעידות.
- ללכוד את החרוזים על מגנט ללכידת חרוזים, להסיר ולהשליך נוזל, ולהוסיף 50 μL של תמיסת שטיפה (250 mM NaCl ב- TE עם 0.05% חומר ניקוי נייטרלי). מערבבים את החרוזים, לוכדים אותם שוב ומסירים את תמיסת הכביסה. חזור על הפעולה פעם נוספת.
- כדי ללקט פריימרים מורחבים מחרוזים, הוסיפו 50 μL של תמיסת elution (25 mM NaOH עם 0.05% חומר ניקוי נייטרלי), וערבבו את החרוזים. לכבוש מחדש את החרוזים, להסיר את תמיסת האלוטיון, להרוות עם 100 mM Tris (pH 7.5), ולזרז עם אתנול.
- מכינים פוליאקרילאמיד אנליטי/8 M urea/1x ג'ל TBE, על פי הפרוטוקולים המתאימים לצלחת הג'ל ולמעמד. הרכיבו את הג'ל והצלחת יצוקים במעמד ג'ל, מלאו את המאגרים ב-1x TBE, והריצו מראש ב-40 W (או בהתאם ללוחות ומעמדי ג'ל שונים) למשך 30 דקות.
- ממיסים את הרנ"א המואץ ב-10 μL של מאגר העמסת ג'ל פורמיד, ומכינים פריימר עם תווית קצה לא מתוקנת ב-0.5 μM במאגר טעינת ג'ל פורמיד. מחממים דגימות ל-80 מעלות צלזיוס, מעמיסים 5 μL מהדגימה בכל באר, ומפעילים את הג'ל ב-40 W במשך כ-40 דקות (או בהתאם ללוחות ומעמדי ג'ל שונים).
- מוציאים את צלחת הג'ל מהמעמד, וסורקים באמצעות סורק ג'ל פלואורסצנטי/זרחני כדי להמחיש תוצרי הרחבה חוצי כיראליות של L-RNA.
תוצאות
יש לסנתז את האוליגונוקלאוטידים באמצעות פרוטוקולים סטנדרטיים המתאימים לזרחנים ולסינתיסייזר דנ"א/רנ"א אוטומטי, ולהשאיר את המוצר אוליגונוקלאוטיד מנותק מהתמיכה המוצקה בעמודת הסינתזה הפלסטית המקורית, כאשר קבוצת ה-5ʹ-terminal dimethoxytrityl הוסרה כדי להניב את ה-5ʹ-הידרוקסיל החופשי (סעיף 1). כל האוליגונוקלאוטידים ששימשו בהדגמה זו הוכנו באמצעות 1,000 שרף זכוכית נקבובית מבוקרת Å (CPG) כתמיכה המוצקה ונעשו בקנה מידה של 0.2 או 1 מיקרומול. דוגמאות מייצגות של עמודות סינתיסייזר, שרפים, ריאגנטים וזרחנים מסופקות בטבלת החומרים. עבור תגובות בקנה מידה גדול יותר, ייתכן שיהיה צורך להתאים את אמצעי האחסון והזמנים המשמשים בשלבים הבאים.
תגובת הטריפוספוריה מתבצעת על עמודה בתא תגובה שנבנה בהתאמה אישית (איור 2, סעיף 3) תוך שימוש ברכיבים סטנדרטיים וזמינים מסחרית המפורטים בטבלת החומרים ועוקבת אחר הסכימה המתוארת באיור 1 (סעיף 4)28. חיוני שהתנאים יישמרו נטולי מים לחלוטין במהלך הטריפוספורילציה, ושכל הממסים והריאגנטים יוכנו מראש על מסננות מולקולריות ויאפשרו להם להתייבש באופן מלא לפני השימוש (סעיף 2). טריפוספורילציה בדרך כלל לוקחת 2 שעות להתרחש, ולאחר מכן, ניתן לטפל בעמודה השטופה והמיובשת על פי הליכי הגנה וטיהור אוליגונוקלאוטידים סטנדרטיים (סעיף 5).
לאחר הסרת ההגנה, טריפוספטים אוליגונוקלאוטידים מטוהרים על ידי דנטורציה של אלקטרופורזה של ג'ל פוליאקרילאמיד (PAGE), המציגה רצועת תוצר עיקרית אחת על ידי הצללה אחורית של UV שניתן לכרות ולהתרומם מהג'ל. המוצר 5′-triphosphate מופרד בקלות ממוצרי צד תגובה עבור אוליגונוקלאוטידים קצרים, כפי שמוצג עבור דנ"א טרינוקלאוטיד 5ʹ-טריפוספטים, pppAAA ו-pppCCC, ו-L-RNA טרינוקלאוטיד 5ʹ-טריפוספט pppGAA באיור 3A,B. גם המוצרים 5′-hydroxyl וגם 5′-triphosphate עבור גוזמי הדנ"א AAA וה-CCC נכרתו וזוהו על-ידי ספקטרומטריית מסות וסומנו בהתאם באיור 3A. רצועות נוספות, כפי שהן נראות לעין עבור גוזם הדנ"א AAA, בדרך כלל אינן מכילות מספיק חומר כדי לשחזר ולזהות. עם זאת, נוכחותם של פסים אלה מתואמת עם מסות מכפלה נוספות בתוצרי התגובה הלא-מזוהים (איור 3C), המייצגים בדרך כלל תוצרי צד של 5′-דיפוספט, מונופוספט ו-H-פוספונט, כפי שיפורט להלן.
לאחר טיהור PAGE, ניתן להבהיר אוליגונוקלאוטידים גדולים יותר באמצעות שיטת הריסוק והטבילה42 ומשקעי האתנול הבאים. עם זאת, אוליגונוקלאוטידים הקטנים מ-15 nt אינם יכולים להיות אתנול מזרזים ביעילות, ולכן דורשים הליך שונה לאליטיון ג'ל (שלב 5.11.3). עמודת אי הכללת הגודל החד-פעמי המופיעה בטבלת החומרים מדורגת רק לשימוש עם אוליגונוקלאוטידים הארוכים מ-10 nt. עם זאת, מצאנו כי אוליגונוקלאוטידים קצרים כמו טרימרים יכולים להיות מותפלים ביעילות באמצעות הפרוטוקול המומלץ של היצרן. עם זאת, מומלץ בעת התפלת אוליגונוקלאוטידים קצרים (כמו בשלבים 5.6 ו- 5.11.3) כי העמודה eluate תיאסף בשברים, ושברי המוצר יזוהו על ידי ספיגה ב 260 ננומטר באמצעות ספקטרופוטומטר UV-Vis. עמודת אי-הכללת גודל המותאמת לאוליגונוקלאוטידים קצרים יותר מסופקת בטבלת החומרים כבחירה חלופית. התשואה הסופית מסינתזת אוליגונוקלאוטיד בקנה מידה של 1 מיקרומול לאחר הטיהור היא 50-300 ננומול.
טריפוספורילציה יכולה להיות מאושרת על ידי ספקטרומטריית מסה, שבה למכפלה הטריפוספורית יש מסה +239.94 Da גדולה יותר מ-5′-הידרוקסיל אוליגונוקלאוטיד, אם כי נוכחותם של חומרים המתאימים ל-5′-di ומונופוספט (+159.96 ו-+79.98 Da, בהתאמה) נצפית לעתים קרובות. ניתן לראות גם מכפלת צד של 5′-H-פוספונט עם מסה +63.98 Da ממסת 5′-OH, ורמות גבוהות של מוצר זה מצביעות על כך שהתנאים במהלך הטריפוספורילציה לא היו נטולי מים מספיק. לפני הטיהור, אוליגונוקלאוטידים מוגן בדרך כלל יציגו את כל המוצרים האלה (איור 3C), בעוד שחומר מטוהר יראה שיא המתאים לתוצר 5′-triphosphate יחד עם 5′-di- ומונופוספטים (איור 3D,E).
ספקטרומטריית מסות לבדה בדרך כלל לא תיתן מידה קפדנית של טוהר 5′-triphosphate עקב קצב דיפרנציאלי של יינון ופיצול של הטריפוספט במהלך היינון. כדי למדוד את טוהר המוצר הסופי, מומלץ כרומטוגרפיה נוזלית בפאזה הפוכה וטנדם ESI-MS (RP-LC/ESI-MS), במיוחד עבור אוליגונוקלאוטידים ארוכים יותר. ניתוח של D-RNA 5ʹ-triphosphates pppACGAGG ו-pppGAGACCGCAACUUA על ידי RP-LC/ESI-MS (איור 4A,B, בהתאמה) מראה טוהר תוצר סופי טיפוסי, המכיל 20% 5ʹ-דיפוספט מכיוון שקשה להפריד בין שני מינים אלה כאשר הם נמצאים על אוליגונוקלאוטידים ארוכים יותר.
אוליגונוקלאוטידים סינתטיים 5′-triphosphate מתפקדים בדרך כלל טוב או טוב יותר מחומרים שהוכנו באופן אנזימטי במחקרים ביוכימיים. בסעיף 6, כדוגמה, הושוו בין מצעי RNA 5′-triphosphate 14 nt שהוכנו באופן סינתטי או על ידי שעתוק במבחנה בתגובת שכפול עצמי 14,15,43,44,45. ריבוזים E מזרזים צירוף של מצעים A ו-B כדי להניב עותק חדש של E בתגובה אוטוקטליטית המסוגלת לצמיחה מעריכית (איור 5A). רכיבי E ו-32P עם תווית A הוכנו על ידי תעתיק חוץ גופי, ומצע משולש B הוכן באופן סינתטי, כמתואר לעיל, או על ידי תעתיק חוץ גופי 14. התקדמות התגובה לשכפול עצמי נוטרה על ידי לקיחת דגימות תקופתיות שנותחו על ידי DENATURING PAGE וכומתו באמצעות סורק ג'ל פלואורסצנטי/זרחני. הנתונים שהתקבלו, המתאימים לפונקציית גדילה לוגיסטית, גילו כי מצע B מתועתק או סינתטי תומך בצמיחה מעריכית, אך B סינתטי נותן כמות מעט גדולה יותר של מוצרים (איור 5B). תוצאה זו עשויה לשקף הטרוגניות קומפוזיציונית בקצה 5′של RNA שהוכן על ידי שעתוק חוץ גופי 23,24.
טריפוספורילציה כימית מאפשרת גם סינתזה של טריפוספטים אוליגונוקלאוטידים שלא ניתן להכין ביולוגית, לא במבחנה ולא בתאים. בחלק 7, טריפוספטים אוליגונוקלאוטידים לא-ביולוגיים המורכבים מ-L-RNA, האננטיומר של D-RNA טבעי, שהוכן כמו בסעיפים 1-5, שימשו כסובסטרטים עבור פולימראז ריבוזים 27.3t "חוצה כיראליות" של D-RNA, המזרז את הפילמור המכוון תבנית של תוצר L-RNA ארוך יותר מ-L-RNA קצר אוליגונוקלאוטיד 5′-טריפוספטים באופן כללי ברצף כללי. לדוגמה, הריבוזים יכולים לסנתז גרסת L-RNA של מוטיב המחשוף העצמי של ראש הפטיש (איור 6B)18. טריפוספטים מטוהרים של L-RNA trinucleotide שולבו עם פריימר L-RNA בעל התווית פלואורסצין ותבנית L-RNA (איור 6C) והגיבו עם הליגאז הבין-כיראלי. דגימות במהלך התגובה נותחו על ידי PAGE והצטלמו באמצעות סורק ג'ל פלואורסצנטי/זרחני כדי להדגים סינתזה של גרסת L-RNA של ריבוזים ראש הפטיש המקודדת על ידי התבנית (איור 6D).
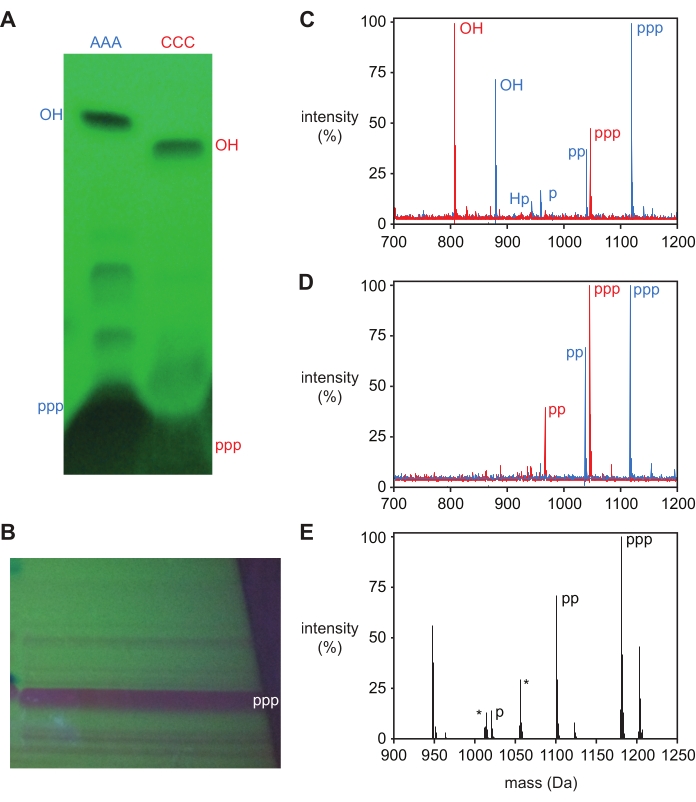
איור 3: טיהור טרינוקלאוטיד 5ʹ-טריפוספטים. (A) ניתוח דף (שהודגם על ידי הצללה אחורית של UV) של טריפוספורילציה של טרינוקלאוטידים של דנ"א טרינוקלאוטידים טרי-דאוקסיאדנוסין (AAA, כחול) וטרי-דאוקסיציטידין (CCC, אדום), עמוס בכוונה כדי לדמיין תוצרי לוואי קלים. גם תוצר ה-5ʹ-טריפוספט (ppp) וגם החומר ההתחלתי 5ʹ-הידרוקסיל (OH) נכרתו וזוהו על-ידי MALDI-MS. (B) דף הכנה של טריפוספורילציה של L-RNA טרינוקלאוטיד GAA, עם רצועת מוצרים עיקרית שנכרתה וזוהתה כ-5ʹ-טריפוספט (ppp) על ידי ESI-MS. (C) MALDI-MS של מוצרי תגובה גולמית לאחר הגנה ו-(D) מוצרים מטוהרים מ-(A). 5ʹ-טריפוספט (ppp; pppAAA צפוי 1,119 Da, נצפה 1,118 Da; pppCCC צפוי 1,047 Da, נצפה 1,046); 5ʹ-דיפוספט (עמ'), 5ʹ-מונופוספט (p), 5ʹ-הידרוקסיל (OH) ו-5ʹ-H-פוספונט (Hp) מסומנים. (E) ספקטרום מסה מנותק מהזרקה ישירה של ESI-MS של תוצר מבודד של 5ʹ-טריפוספט מ-(B), עם פסגות מזוהות המסומנות (צפויות 1,181.6 Da, שנצפו 1,181.0 Da). כמו כן נצפו 5ʹ-דיפוספט (pp), כמו גם שיאי יונים של נתרן הן עבור תוצרי הטריפוספט והן עבור מוצרי הפוספטים (+22 Da). פסגות מזהמים נפוצות מסומנות בכוכבית. כדי להקל על ההשוואה, ספקטרום המסה מנורמל לעוצמה הגבוהה ביותר שנמדדה בכל ספקטרום ומדווחים כאחוז ביחס לערך זה. קיצורים: PAGE = אלקטרופורזה של ג'ל פוליאקרילאמיד; MALDI-MS = ספיגה/יינון לייזר בסיוע מטריצה; ESI-MS = ספקטרומטריית מסת יינון אלקטרוספריי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
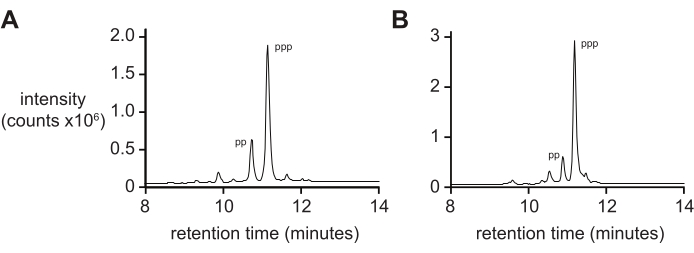
איור 4: RP-LC אנליטי של 6 nt ו-14 nt D-RNA אוליגונוקלאוטיד טריפוספטים. (A) 5ʹ-pppACGAGG-3ʹ ו-(B) 5ʹ-pppGAGACCGCAACUUA-3ʹ. טנדם ESI-MS זיהה את השיא העיקרי של שניהם (כ-70%) כ-5ʹ-טריפוספט (ppp), עם כמויות נמוכות יותר של 5ʹ-דיפוספט (pp). קיצורים: RP-LC = כרומטוגרפיה נוזלית בפאזה הפוכה; nt = נוקלאוטידים; ESI-MS = ספקטרומטריית מסת יינון אלקטרוספריי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 5: השוואה בין מצעי אוליגונוקלאוטיד 5ʹ-טריפוספט שהוכנו על ידי סינתזה כימית או תעתיק במבחנה. (A) הריבוזים המשכפלים את עצמם E ligates RNA A ו-5′-triphosphorylated RNA B. (B) השוואה בין תגובות שכפול עצמי באמצעות 10 μM A ו-10 μM B, סינתטיים (מעגלים פתוחים) או מתועתקים במבחנה (עיגולים מלאים). (B) הנתונים היו מתאימים למשוואת הצמיחה הלוגיסטית: [E] = a / (1 + b e-ct), כאשר a היא התשואה הסופית, b היא דרגת הסיגמוידיות, ו- c הוא קצב הצמיחה האקספוננציאלי. שיעורי הצמיחה של שתי התגובות היו זהים, ב-1.14 h-1, בעוד שההיקף הסופי היה גבוה ב-10% עבור תגובות עם B סינתטי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 6: פילמור L-RNA חוצה כיראליות עם ריבוזים. (A) D-RNA 27.3t פולימראז ריבוזים, המזרז קשירת L-RNA תלוית תבנית של L-RNA. (B) מוצר ה-L-RNA המסונתז ב-27.3t מהווה חלק ממוטיב אנדונוקלאז של ראש פטיש. (C) פילמור L-RNA מזורז על ידי 27.3t באמצעות תבנית L-RNA שעברה ביוטינילציה (חום), פריימר L-RNA (מג'נטה) המסומן בסוף, וארבעה טרינוקלאוטידים טרינוקלאוטידים (ציאן) בעלי תווית קצה, וארבעה טרינוקלאוטידים טרינוקלאוטידים (ציאן) בעלי תווית קצה, המוכנים באופן סינתטי. (D) ניתוח דף של מכפלות הרחבה של (B) ב-4 שעות ו-24 שעות, המראה כל שילוב של טרינוקלאוטיד עד מכפלה באורך מלא (נקודה שחורה). פריימר L-RNA שלא שוחזר נכלל כסמן ייחוס. קיצורים: PAGE = אלקטרופורזה של ג'ל פוליאקרילאמיד; M = סמן ייחוס. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Discussion
הליך הטריפוספורילציה המתואר כאן תואם באופן נרחב לסינתזת אוליגונוקלאוטידים באמצעות כימיה סטנדרטית של פוספוראמידיט. נוקלאוזידים זרחניים צריכים להיות בעלי קבוצות הגנה על בסיס-לבילה התואמות להגנה מהירה ב-AMA39, כולל β-ציאנואתיל הסטנדרטי על הפוספיט, ואיזובוטיריל, דימתילפורמידיל, אצטיל, פנוקסיאצטיל או 4-איזופרופילפנוקסיאצטיל על האמינים האקסוציקליים של הנוקליאובסיסים. קבוצות ריבוז 2'-הידרוקסיל צריכות להיות מוגנות על ידי קבוצות הגנה על סיליל, או t-butyldimethylsilyl (TBDMS) או tri-iso-propylsilyloxymethyl (TOM)40,41. כמו כן דווח כי קבוצת הפיוואלויליאוקסימתיל הבסיסית (PivOM) תואמת לטריפוספורילציה כימית30.
שיטות רבות תוארו עבור הטריפוספורילציה הכימית של אוליגונוקלאוטידים סינתטיים 28,29,30,31,32,33,34,35. מצאנו כי טריפוספוריה באמצעות ריאגנט לודוויג-אקשטיין37 היא אחת הנגישות ביותר, ואינה דורשת סינתזה מיוחדת של ריאגנטים וללא ציוד מיוחד. Oligonucleotide 5′-triphosphates שהוכנו בשיטה זו שימשו באופן שגרתי כמצעים עבור RNA ligase ribozymes, כולל שימוש ב- L-RNA oligonucleotide triphosphates בלתי נגישים מבחינה אנזימטית כדי להשיג סינתזה ושכפול תלויי תבנית של חומצת גרעין "תמונת מראה" זו 14,16,17,18 . השיטה מתאימה גם להכנת רנ"א קטנים של 5′-triphosphorylated לולאת גזע, שהם מפעילים חזקים של התגובה החיסונית המולדת אצל בעלי חוליות 6,7.
הריאגנט לודוויג-אקשטיין, salicyl phosphorochloridite37, הוא תגובתי מאוד למים, ולמעשה מנקה כל מים שהוכנסו בעת המסת הריאגנט לפני ההעמסה על עמוד האוליגונוקלאוטיד. עם זאת, לאחר נקודה זו, אוליגונוקלאוטיד 5′-phosphitylated יגיב באופן מועדף עם כל מים המוחדרים למערכת על פני פירופוספט, ויצר תוצר צד של 5′-H-phosphonate לאחר עבודה 28,37,38. הכנה מדוקדקת של ריאגנטים של טריפוספורילציה ותא התגובה של הטריפוספוריה מבטיחים שמוצר צד זה לא נוצר. לייבוש ממסים, מסננות מולקולריות מסוג 4 Å נמכרות ארוזות מראש בשקיות טפלון התואמות לרוב הממסים האורגניים תחת שמות מותגים שונים על ידי רוב חברות הריאגנטים לסינתזה של אוליגונוקלאוטידים. אמצעי זהירות נוספים, כגון ביצוע טריפוספורילציה בתא כפפות תחת אטמוספירה נטולת מים, בדרך כלל אינם נחוצים.
התגובה של 5′-phosphitylated oligonucleotide עם TBAP יוצרת ביניים מחזורי 5′-trimetaphosphite, אשר לאחר מכן מחומצן למחזור 5′-trimetaphosphate באמצעות תמיסת מחמצן סינתזה של אוליגונוקלאוטידים (יוד במים/פירידין/THF). יש לציין כי פתרונות מחמצנים מסחריים משתמשים בכמויות משתנות של יוד, וחיוני להשתמש בריכוז היוד הגבוה של 0.1 M כדי להבטיח חמצון מלא לטריפוספט. המכפלה המחזורית עוברת הידרוליזה ל-5′-triphosphate הליניארית הסופית באותה תמיסה37, ויש להשתמש בתמיסות מחמצנות חלופיות נטולות מים אם יש צורך בלינאריזציה עם נוקלאופילים שאינם מים (ראו בהמשך יישומים)33. כל טרימטפוספט מחזורי שיורי, לעומת זאת, יהיה ליניארי במהלך ההגנה האלקליין שלאחר מכן של האוליגונוקלאוטיד. הידרוליזה של 5′-טרימטפוספט מחזורי מניבה רק את הטריפוספט הליניארי, ולא המסתעף37,46.
בדרך כלל אין צורך לשנות את ההגנה של אוליגונוקלאוטיד כך שתתאים ל-5′-triphosphorylation, אך יש לנקוט כמה אמצעי זהירות. הטריפוספט יציב יחסית לחשיפה קצרה לתנאים אלקליין, אך יש להיזהר שלא לחשוף את הטריפוספט ל-AMA זמן רב מהנדרש. יש להימנע מהגנה על קבוצות הדורשות טיפול ממושך יותר באמוניה או ב- AMA במשך יותר מ -10 דקות בטמפרטורה של 65 מעלות צלזיוס. טיפולים עדינים יותר, כגון 2 שעות באמוניה בטמפרטורת החדר מקובלים כאשר הם תואמים לקבוצות הגנה אחרות על זרחן-אמידיט. שיטת הגנה נפוצה ומהירה עבור אוליגונוקלאוטידים RNA סינתטיים המוגנים על ידי סיליל משתמשת בטריאתילמין טריהידרופלואוריד ובטמפרטורה גבוהה47; עם זאת, יש להימנע מכך בעת הכנת RNA 5′-triphosphates מכיוון שנמצא כי התנאים החומציים הממושכים מאיצים הידרוליזה של טריפוספט31,32.
דף הכנה הוכיח את עצמו כשיטה הפשוטה והאמינה ביותר לטיהור לאחר ההגנה של אוליגונוקלאוטידים 5′-טריפוספוריים (איור 3 ואיור 4). עם זאת, HPLC הכנה בפאזה הפוכה יכול לשמש גם לטיהור מוצרים משולשים. נוכחותם של 5′-דיפוספט, ובמידה פחותה יותר, 5′-מוצרים מונופוספטים נצפית באופן שגרתי בעת אימות טריפוספורילציה על ידי ספקטרומטריית מסה. צפינו בפיצול של 5′-triphosphate במהלך ספקטרומטריית מסה מחומר טהור מאוד שהוכן על ידי סינתזה כימית או שעתוק, במיוחד אם המכשיר אינו מותאם לניתוח של אוליגונוקלאוטידים. אף על פי כן, ניתוח RP-LC מראה לעתים קרובות ש-10%-20% מתוצר הצד של 5′-דיפוספט קיים באוליגונוקלאוטידים ארוכים יותר של 5′-טריפוספורלאטים (איור 4). תכשירים מסחריים של tributylammonium pyrophosphate יכול להיות מזוהם עם עד 20% מונופוספט, אשר יניב 5′-דיפוספט כמוצר צד במהלך triphosphorylation30,31. הכנה מדוקדקת של מגיב זה בתוך הבית יכולה להניב הרבה יותר מניות TBAP טהורות31. עם זאת, מצאנו שאוליגונוקלאוטידים טריפוספוריים באמצעות מקורות מסחריים של TBAP עדיין מראים תגובתיות דומה או גדולה יותר כאשר משתמשים בהם כמצעים בתגובות אנזימטיות (איור 5B), בהשוואה לחומר שהוכן על ידי שעתוק חוץ גופי.
שימוש נוסף ראוי לציון אחד בטריפוספוריה אוליגונוקלאוטיד עם ריאגנט לודוויג-אקשטיין מנצל את הטרימטופוספיט המחזורי ביניים33. אם שלב החמצון הבא מתנהל עם 1 M t-butyl peroxide בהקסנס, המשמש לעתים קרובות לחמצון אוליגונוקלאוטיד בתנאים נטולי מים, חמצון של הפוספיט מתרחש ללא הידרוליזה של פתיחת טבעת, המניבה את הטרימטפוספט המחזורי. לאחר מכן ניתן להגיב על ביניים זה עם נוקלאופילים ראשוניים של אמין או אלכוהול כדי להניב 5′-triphosphates עם שינויים γ-פוספט. שינויים אלה כוללים הוספת תג ליפופילי המקושר על ידי קשר פוספורמידאט, המאפשר טיהור מהיר של טריפוספט ספציפי על ידי RP-LC, ואחריו הידרוליזה חומצית של התג מהטריפוספט33. שינויים פלואורסצנטיים בעמדת γ-פוספט יכולים גם להיות מוצגים לשימוש ככתבים פלואורסצנטיים בזמן אמת לתגובות קשירת ריבוזים-מזורזות15,33.
Disclosures
המחברים מצהירים כי אין להם אינטרסים כלכליים מתחרים.
Acknowledgements
המחברים מודים לגרג ספרינגסטין, נטשה פול, צ'ארלס אולה ג'וניור, ג'ונתן סצ'פנסקי וקטרינה טג'ונג על דיונים שימושיים על שיטות עבודה מומלצות לתגובות טריפוספוריות כימיות ולג'רלד ג'ויס על הערות מועילות. עבודה זו נתמכה על ידי מענק MCB 2114588 מהקרן הלאומית למדע.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 µm polyethersulfone syringe filter | MilliporeSigma | SLMP025SS | Syringe filter for removing crushed polyacrylamide gel particles (Section 5) |
| 0.22 µm PTFE syringe filter | MilliporeSigma | SLLG013SL | Syringe filter for removing CPG resin (Section 5) |
| 1 mL plastic syringes | ThermoFisher Scientific | 14-823-434 (BD 309659) | Components of triphosphorylation apparatus (sections 2–4) |
| 1,4-Dioxane, anhydrous | MilliporeSigma | 296309 | Triphosphorylation solvent (sections 2–4) |
| 2-Chloro-4H-1,3,2-benzodioxaphosphorin-4-one, Salicyl Phosphorochloridite (SalPCl) | MilliporeSigma | 324124 | Triphosphorylation reagent (sections 2–4) |
| 30 mL glass bottles | MilliporeSigma | 23232 | Bottles for preparing triphosphorylation solvents and TBAP solution (section 2) |
| 3-way Stopcock, polycarbonate/polypropylene | Bio-Rad Laboratories | 7328103 | Component of triphosphorylation apparatus (sections 2–4) |
| 40% acrylamide/bis-acrylamide solution, 19:1 | Bio-Rad Laboratories | 1610144 | For PAGE (sections 5–7) |
| Acetonitrile, anhydrous, 100 mL | Glen Research | 40-4050-50 | Triphosphorylation solvent (sections 2–4) |
| Ammonia-neutralizing Trap | ThermoFisher Scientific | ANT100 and ANS121 | For use with Speedvac DNA130 (section 5) |
| Ammonium persulfate (APS) | Bio-Rad Laboratories | 1610700 | For PAGE, catalyst for acrylamide polymerization (sections 5–7) |
| Aqueous ammonia, 28% | MilliporeSigma | 338818 | For preparing AMA deprotection reagent (section 5) |
| Aqueous methylamine, 40% | TCI America | TCI-M0137 | For preparing AMA deprotection reagent (section 5) |
| Automated DNA/RNA oligonucleotide synthesizer | PerSeptive Biosystems | Expedite 8909 DNA/RNA Synthesizer | any column-based synthesizer is acceptable (section 1) |
| Bead-capture magnet | ThermoFisher Scientific | 12320D | For streptavidin bead capture (section 7) |
| Bromophenol blue | Bio-Rad Laboratories | 1610404 | For PAGE urea loading buffer (section 5) |
| Deep vacuum oil pump | ThermoFisher Scientific | VLP200-115 | For use with lyophilizer (section 5) |
| Drierite dessicant, 10-20 mesh | MilliporeSigma | 737828 | Desiccant for storing triphosphorylation chemicals and equipment (sections 1–2) |
| D-RNA 27.3t cross-chiral polymerase | prepared in house18 | 5′-GGUGGUGGAC GUGAUCAUUA CGGAUCACUA ACUCGUCAGU GCAUUGAGAA GGAGAAUAAA AUGCACAUAG GUCGAAAGAC CUUAUACAAG AACUGUAUCA CCGGAGGGCG AGCACCACC-3′ | For cross-chiral ribozyme reactions (section 7) |
| D-RNA CPG solid supports, 1,000Å, prepackaged 1 µmole synthesis columns | Glen Research | 20-3404-41E, 20-3415-41E, 20-3424-41E, 20-3430-41E | representative, for D-RNA oligonucleotide synthesis (section 1) |
| D-RNA TOM-protected phosphoramidites | ChemGenes | ANP-3201, 3202, 3203, 3205 | representative, for D-RNA oligonucleotide synthesis (section 1) |
| Empty Expedite Synthesis Columns, 1µm | Glen Research | 20-0021-01 | Synthesis columns for use with Expedite DNA/RNA synthesizer (section 1) |
| EPPS, N-(2-Hydroxyethyl)piperazine-N′-(3-propanesulfonic acid), solid | MilliporeSigma | E1894 | Ribozyme reaction buffer component (section 6) |
| Ethylenediaminetetraacetic acid (EDTA), solid | MilliporeSigma | EDS | Divalent metal ion chelator for use in various buffers (sections 5–7) |
| Filters for Expedite synthesis columns | Glen Research | 20-0021-0F | Expedite-style synthesis column filters, for use with empty synthesis columns (section 1) |
| Fluorescent/phosphorescent gel scanner | Cytiva | Amersham Typhoon RGB, 29187193 | For visualizing analytical PAGE (sections 6–7) |
| Formamide, deionized | VWR Life Science | 97062 | For PAGE formamide gel loading buffer (sections 6–7) |
| Gel image quantitation software | Cytiva | ImageQuant TL | For quantifying scanned gel images (section 6) |
| Glass desiccator | MilliporeSigma | CLS3121150 | Triphosphorylation solvent storage (section 2) |
| L-RNA CPG solid supports, 1,000Å, bulk | ChemGenes | N-4691-10, N-4692-10, N-4693-10, N-4694-10 | L-RNA oligonucleotide synthesis (section 1) |
| L-RNA hammerhead template | prepared in house18 | 5′-GCGCCUCAUC AGUCGAGCC-3′ | For cross-chiral ribozyme reactions (section 7) |
| L-RNA primer | prepared in house18 | 5′-fluorescein-GGCUCGA-3′ | For cross-chiral ribozyme reactions (section 7) |
| L-RNA TOM-protected phosphoramidites | ChemGenes | OP ANP-5201, 5202, 5203, 5205 | L-RNA oligonucleotide synthesis (section 1) |
| Lyophilizer/Freeze Dryer | VirTis | Benchtop K | For concentrating oligonucleotides (section 5) |
| Magnesium Chloride Hexahydrate, solid | MilliporeSigma | M2670 | For ribozyme reactions (sections 6–7) |
| N,N-Dimethylformamide, anhydrous | MilliporeSigma | 227056 | Triphosphorylation solvent (section 2) |
| NAP-25 Desalting column (Sephadex G-25 resin) | ThermoFisher Scientific | 45000150 | Disposable gravity-flow size exclusion chromatography columns containing Sephadex G-25 resin (section 5) |
| Non-coring stainless steel needle, 20 G | ThermoFisher Scientific | 14-815-410 | Needles for piercing rubber septa (sections 2–4) |
| Oligonucleotide extinction coefficient calculator | Integrated DNA Technologies | OligoAnalyzer Tool | Nearest-Neighbor Model Short Oligonucleotide 260nm extinction coefficient calculator (section 5) |
| Oxidizer solution, 0.1 M Iodine in THF/pyridine/water | ChemGenes | RN-1456 | Triphosphorylation reagent (section 4) |
| PAGE plates | Timberrock/CBS | NGP-250-BO and NO | For PAGE (sections 5–7) |
| PAGE power supply | Bio-Rad Laboratories | PowerPac HV 1645056 | For PAGE (sections 5–7) |
| PAGE spacers and combs (analytical) | Timberrock/CBS | VGS-0725 and VGC-0714 | For PAGE (sections 6–7) |
| PAGE spacers and combs (preparative) | Timberrock/CBS | VGS-3025R and VGC-3001 | For PAGE (section 5) |
| PAGE stand | Timberrock/CBS | ASG-250 | For PAGE (sections 5–7) |
| Parafilm M | ThermoFisher Scientific | 13-374-12 (Bemis PM999) | Wax sealing film for triphosphorylation apparatus (sections 2–4) |
| PCR thermocycler | Bio-Rad Laboratories | C1000 Touch Thermalcycler | For cross-chiral ribozyme reactions (section 7) |
| PD 10 Desalting column (Sephadex G-10 resin) | MilliporeSigma | GE17-0010-01 | Disposable gravity-flow size exclusion chromatography columns containing Sephadex G-10 resin, for oligonucleotides < 15 nt (section 5) |
| Phosphor screens | Cytiva | 28956480 | For visualizing 32P-labeled RNA (section 6) |
| Phosphoramidite synthesis reagents | Glen Research | 30-3142-52, 40-4050-53, 40-4012-52, 40-4122-52, 40-4132-52, 40-4060-62 | representative, for standard RNA/DNA synthesis (section 1) |
| Polypropylene screw-cap sealable tube | MilliporeSigma | BR780752 | 1.5 mL microcentrifuge tubes with screw-cap and silicone O-ring, for safe AMA deprotection (section 5) |
| Pyridine, anhydrous | MilliporeSigma | 270970 | Triphosphorylation solvent (section 2) |
| Reverse-phase liquid chromatography/electrospray ionization mass spectrometry (RP-LC/ESI-MS) | Novatia | n/a | Commercial service for LC/MS specializing in oligonucleotides (section 5) |
| Rubber Septa (ID x OD 7.9 mm x 14 mm), white | MilliporeSigma | Z564702 | Septa for preparing triphosphorylation solvents and TBAP (section 2) |
| Self-replicator ribozyme E | prepared in house14 | 5′-GGAAGUUGUG CUCGAUUGUU ACGUAAGUAA CAGUUUGAAU GGUUGAAGUA UGAGACCGCA ACUUA-3′ | For self-replicator ribozyme reactions (section 6) |
| Self-replicator substrate A | prepared in house14 | 5′-32P-GGAAGUUGUG CUCGAUUGUU ACGUAAGUAA CAGUUUGAAU GGUUGAAGUA U-3′-OH | For self-replicator ribozyme reactions (section 6) |
| Self-replicator substrate B, transcribed | prepared in house14 | 5′-pppGAGACCGCAA CUUA-3′ | For self-replicator ribozyme reactions (section 6) |
| Small Drying Traps, 4 Å molecular sieves | ChemGenes | DMT-1975 | Drying traps for DNA/RNA synthesizer phosphoramidites and triphosphorylation reagents (sections 1–2) |
| Sodium Chloride (NaCl), solid | MilliporeSigma | S7653 | Salt for use in various buffers (sections 5–7) |
| Sodium Hydroxide (NaOH), solid | MilliporeSigma | S8045 | Salt for use in various buffers (sections 5–7) |
| Statistical data-fitting software | GraphPad | Prism | For fitting data from analytical PAGE to kinetic models (section 6) |
| Streptavidin-coated magnetic beads | ThermoFisher Scientific | 65002 | For capturing biotin-labeled RNA in cross-chiral ribozyme reactions (section 7) |
| Sucrose | MilliporeSigma | 84097 | For PAGE urea loading buffer (section 5) |
| TBE running buffer, 10x | ThermoFisher Scientific | AAJ62788K3 | For PAGE (sections 5–7) |
| Tetrabutylammonium Fluoride, 1.0 M solution in Tetrahydrofuran | Aldrich | 216143 | For removing 2′-silyl protecting groups (section 5) |
| Tetramethylethylenediamine (TEMED) | Bio-Rad Laboratories | 1610801 | For polymerizing acrylamide for PAGE (sections 5–7) |
| Tributylamine | MilliporeSigma | 90781 | Triphosphorylation reagent (section 2) |
| Tributylammonium pyrophosphate (TBAP) | MilliporeSigma | P8533 | Triphosphorylation reagent (section 2) |
| Tris base | MilliporeSigma | T6666 | Buffering agent for use in various buffers (sections 5–7) |
| TWEEN20 polysorbate detergent | MilliporeSigma | P7949 | Neutral detergent for use with magnetic beads (Section 7) |
| Urea | MilliporeSigma | U5378 | For PAGE and gel loading buffer (sections 5–7) |
| UV-Vis spectrophotometer | ThermoFisher Scientific | NanoDrop 2000, ND2000 | For measuring oligonucleotide concentrations (section 5) |
| Vacuum centrifuge | ThermoFisher Scientific | Savant Speedvac DNA130-115 Vacuum Concentrator | For removing AMA and THF (section 5) |
| Xylene cyanol | Bio-Rad Laboratories | 1610423 | For PAGE urea loading buffer (section 5) |
References
- Shuman, S. What messenger RNA capping tells us about eukaryotic evolution. Nature Reviews. Molecular Cell Biology. 3 (8), 619-625 (2002).
- Pichlmair, A., et al. RIG-I-mediated antiviral responses single-stranded RNA bearing 5'-phosphates. Science. 314 (5801), 997-1001 (2006).
- Hornung, V., et al. 5'-Triphosphate RNA is the ligand for RIG-I. Science. 314 (5801), 994-997 (2006).
- Myong, S., et al. Cytosolic viral sensor RIG-I is a 5'-triphosphate-dependent translocase on double-stranded RNA. Science. 323 (5917), 1070-1074 (2009).
- Takeuchi, O., Akira, S. Pattern recognition receptors and inflammation. Cell. 140, 805-820 (2010).
- Wang, Y., et al. Structural and functional insights into 5'-ppp RNA pattern recognition by the innate immune receptor RIG-I. Nature Structural & Molecular Biology. 17 (7), 781-787 (2010).
- Goubau, D., et al. Antiviral immunity via RIG-I-mediated recognition of RNA bearing 5'-diphosphates. Nature. 514 (7522), 372-375 (2014).
- Joyce, G. F. Forty years of in vitro evolution. Angewandte Chemie. 46 (34), 6420-6436 (2007).
- Robertson, M. P., Ellington, A. D. In vitro selection of an allosteric ribozyme that transduces analytes to amplicons. Nature Biotechnology. 17 (1), 62-66 (1999).
- Robertson, M. P., Hesselberth, J. R., Ellington, A. D. Optimization and optimality of a short ribozyme ligase that joins non-Watson-Crick base pairings. RNA. 7 (4), 513-523 (2001).
- Hesselberth, J. R., Robertson, M. P., Knudsen, S. M., Ellington, A. D. Simultaneous detection of diverse analytes with an aptazyme ligase array. Analytical Biochemistry. 312 (2), 106-112 (2003).
- Lam, B. J., Joyce, G. F. Autocatalytic aptazymes enable ligand-dependent exponential amplification of RNA. Nature Biotechnology. 27 (3), 288-292 (2009).
- Lam, B. J., Joyce, G. F. An isothermal system that couples ligand-dependent catalysis to ligand-independent exponential amplification. Journal of the American Chemical Society. 133 (9), 3191-3197 (2011).
- Olea, C., Horning, D. P., Joyce, G. F. Ligand-dependent exponential amplification of a self-replicating L-RNA enzyme. Journal of the American Chemical Society. 134 (19), 8050-8053 (2012).
- Olea, C., Joyce, G. F. Real-Time Detection of a Self-Replicating RNA Enzyme. Molecules. 21 (10), (2016).
- Sczepanski, J. T., Joyce, G. F. A cross-chiral RNA polymerase ribozyme. Nature. 515 (7527), 440-442 (2014).
- Tjhung, K. F., Sczepanski, J. T., Murtfeldt, E. R., Joyce, G. F. RNA-catalyzed cross-chiral polymerization of RNA. Journal of the American Chemical Society. 142 (36), 15331-15339 (2020).
- Bare, G. A. L., Joyce, G. F. Cross-chiral, RNA-catalyzed exponential amplification of RNA. Journal of the American Chemical Society. 143 (45), 19160-19166 (2021).
- Milligan, J. F., Groebe, D. R., Witherell, G. W., Uhlenbeck, O. C. Oligoribonucleotide synthesis using T7 RNA polymerase and synthetic DNA templates. Nucleic Acids Research. 15 (21), 8783-8798 (1987).
- Chelliserrykattil, J., Ellington, A. D. Evolution of a T7 RNA polymerase variant that transcribes 2'-O-methyl RNA. Nature Biotechnology. 22 (9), 1155-1160 (2004).
- Ibach, J., et al. Identification of a T7 RNA polymerase variant that permits the enzymatic synthesis of fully 2′-O-methyl-modified RNA. Journal of Biotechnology. 167 (3), 287-295 (2013).
- Esvelt, K. M., Carlson, J. C., Liu, D. R. A system for the continuous directed evolution of biomolecules. Nature. 472 (7344), 499-503 (2011).
- Pleiss, J. A., Derrick, M. L., Uhlenbeck, O. C. T7 RNA polymerase produces 5' end heterogeneity during in vitro transcription from certain templates. RNA. 4 (10), 1313-1317 (1998).
- Schenborn, E. T., Mierendorf, R. C. A novel transcription property of SP6 and T7 RNA polymerases: dependence on template structure. Nucleic Acids Research. 13 (17), 6223-6236 (1985).
- Martin, C. T., Muller, D. K., Coleman, J. E. Processivity in early stages of transcription by T7 RNA polymerase. Biochemistry. 27 (11), 3966-3974 (1988).
- Gholamalipour, Y., Karunanayake Mudiyanselage, A., Martin, C. T. 3' end additions by T7 RNA polymerase are RNA self-templated, distributive and diverse in character-RNA-Seq analyses. Nucleic Acids Research. 46 (18), 9253-9263 (2018).
- Vasilyev, N., Serganov, A. Preparation of short 5′-triphosphorylated oligoribonucleotides for crystallographic and biochemical studies. Nucleic Acid Crystallography: Methods and Protocols. , 11-20 (2016).
- Lebedev, A. V., Koukhareva, I. I., Beck, T., Vaghefi, M. M. Preparation of oligodeoxynucleotide 5'-triphosphates using solid support approach. Nucleosides, Nucleotides & Nucleic Acids. 20 (4-7), 1403-1409 (2001).
- Paul, N., Springsteen, G., Joyce, G. F. Conversion of a ribozyme to a deoxyribozyme through in vitro evolution. Chemistry & Biology. 13 (3), 329-338 (2006).
- Zlatev, I., et al. Efficient solid-phase chemical synthesis of 5'-triphosphates of DNA, RNA, and their analogues. Organic Letters. 12 (10), 2190-2193 (2010).
- Zlatev, I., Manoharan, M., Vasseur, J. -. J., Morvan, F. Solid-phase chemical synthesis of 5'-triphosphate DNA, RNA, and chemically modified oligonucleotides. Current Protocols in Nucleic Acid Chemistry. , (2012).
- Zlatev, I., et al. Automated parallel synthesis of 5'-triphosphate oligonucleotides and preparation of chemically modified 5'-triphosphate small interfering RNA. Bioorganic & Medicinal Chemistry. 21 (3), 722-732 (2013).
- Goldeck, M., Tuschl, T., Hartmann, G., Ludwig, J. Efficient solid-phase synthesis of pppRNA by using product-specific labeling. Angewandte Chemie. 53 (18), 4694-4698 (2014).
- Sarac, I., Meier, C. Efficient automated solid-phase synthesis of DNA and RNA 5′-triphosphates. Chemistry-A European Journal. 21 (46), 16421-16426 (2015).
- Sarac, I., Meier, C. Solid-phase synthesis of DNA and RNA 5'-O-triphosphates using cycloSal chemistry. Current Protocols in Nucleic Acid Chemistry. 64 (1), 4-67 (2016).
- Perez, J. T., et al. Influenza A virus-generated small RNAs regulate the switch from transcription to replication. Proceedings of the National Academy of Sciences of the United States of America. 107 (25), 11525-11530 (2010).
- Ludwig, J., Eckstein, F. Rapid and efficient synthesis of nucleoside 5'-0-(1-thiotriphosphates), 5'-triphosphates and 2',3'-cyclophosphorothioates using 2-chloro-4H-1,3,2-benzodioxaphosphorin-4-one. The Journal of Organic Chemistry. 54 (3), 631-635 (1989).
- Gaur, R. K., Sproat, B. S., Krupp, G. Novel solid phase synthesis of 2'-o-methylribonucleoside 5'-triphosphates and their α-thio analogues. Tetrahedron Letters. 33 (23), 3301-3304 (1992).
- Reddy, M. P., Hanna, N. B., Farooqui, F. Fast cleavage and deprotection of oligonucleotides. Tetrahedron Letters. 35 (25), 4311-4314 (1994).
- Hogrefe, R. I., McCaffrey, A. P., Borozdina, L. U., McCampbell, E. S., Vaghefi, M. M. Effect of excess water on the desilylation of oligoribonucleotides using tetrabutylammonium fluoride. Nucleic Acids Research. 21 (20), 4739-4741 (1993).
- Pitsch, S., Weiss, P. A., Jenny, L., Stutz, A., Wu, X. Reliable chemical synthesis of oligoribonucleotides (RNA) with 2′-O-[(Triisopropylsilyl)oxy]methyl(2′-O-tom)-protected phosphoramidites. Helvetica Chimica Acta. 84 (12), 3773-3795 (2001).
- Green, M. R., Sambrook, J. Isolation of DNA fragments from polyacrylamide gels by the crush and soak method. Cold Spring Harbor Protocols. 2019 (2), (2019).
- Paul, N., Joyce, G. F. A self-replicating ligase ribozyme. Proceedings of the National Academy of Sciences of the United States of America. 99 (20), 12733-12740 (2002).
- Lincoln, T. A., Joyce, G. F. Self-sustained replication of an RNA enzyme. Science. 323 (5918), 1229-1232 (2009).
- Robertson, M. P., Joyce, G. F. Highly efficient self-replicating RNA enzymes. Chemistry & Biology. 21 (2), 238-245 (2014).
- Singh, J., et al. Synthesis of modified nucleoside oligophosphates simplified: fast, pure, and protecting group free. Journal of the American Chemical Society. 141 (38), 15013-15017 (2019).
- Bellon, L. Oligoribonucleotides with 2'-O-(tert-butyldimethylsilyl) groups. Current Protocols in Nucleic Acid Chemistry. , (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved