Method Article
שיטת בדיקה אופטוקינטית חדשה למדידת ראיית חולדות
In This Article
Summary
שיטת הבדיקה ההתנהגותית ניסטגמוס אופטוקינטית (OKN) משמשת להערכת חדות הראייה במכרסמים. כאן מודגמת שיטה פשוטה שניתן להגדיר בקלות במעבדות מחקר להערכה אמינה של תפקוד הראייה בחולדות רגילות וניסיוניות כאחד.
Abstract
ניסטגמוס אופטוקינטי (OKN) היא תנועת עיניים רפלקסיבית המופעלת על ידי תנועה של גירויים חזותיים בשדה הראייה. תנועת מעקב הראש הקשורה ל-OKN משמשת בדרך כלל כמדד לתפקוד הראייה במכרסמים. כדי לתעד תגובות OKN בחולדות רגילות וניסיוניות, פותח מכשיר פשוט וזול. הגדרה זו משתמשת בשני מסכי טאבלט כדי להציג את הגירוי החזותי של OKN המורכב מפסים שחורים ולבנים בעלי ניגודיות גבוהה שנוצרו באמצעות יישום האינטרנט OKN Stripes Visualization, תוכנה זמינה בחינם. החולדה ממוקמת בתוך מחזיק פרספקס שקוף המגביל את התנועה כך שראש החולדה פונה ברציפות למסך התצוגה OKN. ניתן לשנות את מיקום מחזיק החולדה כדי להתאים את המרחק בין החולדה למסך התצוגה. מיקרו-מצלמה הממוקמת מעל מחזיק החולדה משמשת להקלטת הפעילויות החזותיות של החולדה. ניתן להשתמש בהקלטות אלה להערכות כמותיות. בהתבסס על נוכחות או היעדר מעקב ראש ברור, ניתן לקבוע את תגובות ה-OKN בתדרים מרחביים שונים. הנתונים שנאספו מדגימים טכניקה חדשה למדידה אמינה של חדות הראייה בחולדות נורמליות ומנוונות רשתית.
Introduction
כאשר העין נחשפת לתנועה חזותית מתמשכת בשדה מלא, דפוס מובהק של מעקב אחר תנועות עיניים מהירות וחלקות ותנועות ראש בתאוצה נמוכה מופיע בכיוון התנועה החזותית, הנקרא ניסטגמוס אופטוקינטי (OKN)1,2. המסלול הנוירולוגי של OKN עובר מהרשתית לגוף הגניקולט הרוחבי, האונה העורפית ופקק המוח הקטן ומתחבר לנוירונים המוטוריים של העין3. נזק עצבי בכל מקום לאורך מסלולים עצביים אלה עלול להוביל לשינויים בתגובות OKN. תגובת OKN משמשת ככלי להערכת סימטריה מוחית, עיוורון פסיכוגני וחדות ראייה בחולים אנושיים 4,5. חדות הראייה מוערכת על ידי כימות תגובות תפקודיות, שיכולות להיות חלק בלתי נפרד בקביעת הצלחת הטיפולים והניסויים המתמקדים בשיקום הראייה שאבדה עקב מחלות ניווניות 3,6,7. בבעלי חיים, ניתן להשתמש בתגובות OKN כדי להעריך במדויק את חדות הראייה, מה שמספק לחוקרים את היכולת לאסוף נתונים כמותיים ואיכותיים לגבי תפקוד הראייה. במכרסמים ניתן למדוד את חדות הראייה של העין השמאלית והימנית באופן עצמאי על סמך כיוון הסיבוב של הפסים הן בכיוון השעון והן נגד כיוון השעון8. תנועה זו נגד כיוון השעון ועם כיוון השעון חושפת כל עין לתנועה אף-טמפורלית (N-T) או טמפו-אף(T-N) 9, בהתאמה. גירוי ה-T-N מביא לתגובה גבוהה משמעותית בהשוואה לגירוי N-T מכיוון שמכרסמים רגישים יותר לסכנות המגיעות מאחור או מהצד.
בעבר, תפקוד הראייה בחולדות מעבדה רגילות ובחולדות מנוונות ברשתית נבדק באמצעות שיטות בדיקה שונות של OKN 6,10,11,12,13. עם זאת, שונות מסוימת בציוני חדות הראייה נצפות בין מחקרים שונים, כולל הנתונים המוצגים במחקר הנוכחי. ניתן לייחס שונות זו בעיקר להבדלים במערך הבדיקה בו נעשה שימוש. הבדלים בגודל זירת הבדיקה ובסוג הגירויים החזותיים של OKN בשימוש 6,10 יכולים להיות הגורמים העיקריים. הגירויים ששימשו בניסויים אלה כוללים סורגי גלי סינוס להופעת גליל וירטואלי14, גלילים מסתובבים מתחלפים15 ופסים בעלי ניגודיות גבוהה (שחור ולבן) המוצגים על ארבעה צגי מחשב10. המגבלות העיקריות הקשורות למכשירי ושיטות הבדיקה הללו של OKN כוללות את הגודל הגדול של הציוד, תנועת בעלי החיים בזירת הניסוי ושכיחות תכופה של נפילת בעל חיים מפלטפורמת הבדיקה 7,11,12.
כדי למזער את המגבלות הנ"ל, פותח מנגנון חדש לבדיקת OKN בחולדות. מכשיר זה הוא זול יחסית, הוכח כיעיל, קל לתפעול ומאפשר הערכה של תפקוד הראייה (איור 1). המכשיר משתמש בשני מסכי טאבלט כדי להציג את הגירויים החזותיים OKN (תוכנת הדמיה) בתדרים מרחביים שונים. מיקרו-מצלמה משמשת לתיעוד פעילויות החיה במהלך הבדיקה לניתוח מאוחר יותר של הנתונים. במטרה ליצור מכשיר OKN קל להתקנה במעבדות מחקר, הגדרה חדשה זו מתארת שינויים קריטיים במנגנון הבדיקה הקיים של OKN. גירוי ה-OKN המשמש כאן מורכב מפסים שחורים ולבנים בתדרים מרחביים שונים וכיווני סיבוב שונים (משמאל לימין או מימין לשמאל). המרכיב העיקרי של מכשיר הבדיקה OKN כולל שני מסכי טאבלט עם מסך מגע (7.9 אינץ') המשמשים להצגת גירוי OKN (איור 2). שני מחזיקים מתכווננים משמשים להחזקת מסכי הטאבלט במיקום הרצוי. המחזיקים מחוברים היטב לקצה שולחן הליכים המאפשר התאמת גובהו וזוויתו. החולדות מונחות במחזיק חולדות הפונה למסכי התצוגה. מחזיקי החולדות עשויים צינור פלסטיק שקוף (פולימתיל מתאקרילט). המחזיק מחובר לכן ולמעמד מתכת כדי להבטיח מיקום יציב על שולחן ההליכים. גודל צינורות האחיזה נע בין 4 ל-6 אינץ' אורך וקוטר 2.5 עד 3 אינץ', תלוי בגודל החולדות המשמשות. המרחק בין החולדה למסך התצוגה מותאם על ידי שינוי המיקום של מחזיק החולדה. מחזיק החולדה מסייע בשמירה על חשיפה רציפה של ראש החולדה לעבר מסכי התצוגה ומפחית את תנועותיה במהלך הבדיקה. מיקרו-מצלמה משמשת להקלטת תגובות מעקב הראש. החסרונות של הגדרה חדשה זו כוללים קצבי רענון שונים למסך ואפשרות לאשליות אופטיות בעת שימוש בפסים צרים. עם זאת, ניתן להתייחס לבעיות אלה כבעיות נפוצות הקשורות להגדרת OKN מבוססת מחשב. בנוסף לבעיות לעיל, בהגדרה הנוכחית, חולדות אינן נבדקות באמצעות גליל וירטואלי14 המשפיע על תגובת OKN האופטימלית. החידוש בשיטה זו טמון בטכניקה ובמנגנון שבהם משתמשים בשיטה. ניתן להגדיר טכניקה זו בקלות במעבדות מחקר למדידת חדות ראייה אמינה במכרסמים.
Protocol
כל ההליכים בבעלי חיים בוצעו בהתאם להנחיות הניסוי שאושרו על ידי הרשויות האזוריות והתקבלו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC) באוניברסיטת דרום קליפורניה (USC), ותואמות את הצהרת האגודה לחקר הראייה והעיניים (ARVO) לשימוש בבעלי חיים במחקר עיניים וראייה וההנחיה האירופית 2010/63/EU בנושא הגנה על בעלי חיים המשמשים למטרות מדעיות.
הערה: החולדות ששימשו במחקר זה הן חולדות מנוונות רשתית פיגמנטיות (RCS) וחולדות Long Evans (LE). איור 3 מציג איור סכמטי המציג שלבים שונים של בדיקה וניתוח OKN.
1. נהלים
- הכנת ההתקנה
- שמור את החולדה בכלוב ולמשך 30 דקות בתוך חדר הבדיקה כשאורות החדר כבויים.
הערה: זה עוזר למזער את הלחץ המתרחש במהלך ההובלה ומספק תנאי תאורה אחידים לכל הניסויים. - הגדר את המיקום של מסכי הטאבלט זה מול זה ב-155° כדי להציג את OKN Stripes Visualization Web Application.
- הנח את מחזיק החולדה באמצע שני מסכי טאבלט במרחק של 4.5 אינץ' מהמרכז.
הערה: במצב זה, ראש החולדה יהיה במרחק של כ-3.5 אינץ' ממסך התצוגה. - לחץ על OKN Stripes Visualization Web Application משולחן העבודה של הטאבלט כדי להציג גירויים חזותיים (פסים בשחור ולבן) החל מהתדר המרחבי הנמוך ביותר.
הערה: נעשה שימוש בתדרים מרחביים 0.08, 0.15, 0.2, 0.24, 0.28, 0.33, 0.38 מחזורים למעלות (c/d), החל מהתדר המרחבי הנמוך ביותר (0.08c/d) ומשתנה לתדרים מרחביים גבוהים יותר (עד 0.38 c/d). בכל תדר מרחבי, חולדות נבדקות הן בכיוון השעון והן נגד כיוון השעון בסיבוב של פסים (דקה אחת כל אחד).
- שמור את החולדה בכלוב ולמשך 30 דקות בתוך חדר הבדיקה כשאורות החדר כבויים.
- נוהל בדיקת OKN
- בחר מחזיק חולדה בגודל מתאים.
- הביאו את החולדה לכיוון פתח מחזיק החולדה והובילו בזהירות את החולדה פנימה.
- אפשר לחולדה להתיישב בתוך המחזיק (1-2 דקות) לפני הבדיקה.
הערה: על ידי טיפול נכון, ניתן לשמור על החולדה בתוך המחזיק ברוב המקרים; במידת הצורך, מחזיק החולדה מוחזק גבוה (עד 2 רגל מעל השולחן) למשך מספר שניות עד שהחולדה מתייצבת. נמצא כי הפחד מהגובה מפחית את הנטייה של החולדה לרדת ממחזיק החולדה. זמן נוסף (1-2 דקות) ניתן לחולדה להתיישב, במידת הצורך. - הכנס את הדום של מחזיק החולדה למעמד המתכת למיקומו היציב.
הערה: הגדרה זו מאפשרת לשנות את החולדה viewמרחק ממסך הטאבלט. - הפעל את המצלמה כדי להתחיל בהקלטת וידאו.
- לחץ על OKN Stripes Visualization Web Application משולחן העבודה של מסך הטאבלט והתחל להפעיל את התוכנית.
- הפעל את גירוי ה-OKN בכיוון שמאל לימין או מימין לשמאל.
הערה: סיבוב הפסים בכיוון השעון מפעיל את העין השמאלית, ואילו סיבוב נגד כיוון השעון מפעיל את העין הימנית. כיוון הסיבוב הראשוני נבחר באופן אקראי כדי למנוע התרגלות פוטנציאלית. - שימו לב להתנהגות מעקב הראש של החולדה.
- התחל לבדוק באמצעות התדר המרחבי הנמוך ביותר (0.08 c/d), ולאחר מכן הגדל את התדר המרחבי בסדר צעד (בסדר עולה).
- שים לב לנוכחות או היעדר תגובות OKN.
- המשך בדיקה, לא ניתנת תקופת מנוחה בין תדרים מרחביים שונים.
- הפסק את הקלטת הווידאו לאחר השלמת כל התדרים המרחביים, ושמור את הנתונים באמצעות מספר זיהוי החולדה.
- הוציאו את החולדה מהמחזיק והניחו אותה בכלוב למשך כ-30 דקות מנוחה בין בדיקות עוקבות.
- חזור על הבדיקות שלוש פעמים לכל חולדה.
2. ניתוח נתונים
- סקור את הסרטון המוקלט וקבע את חדות הראייה של כל חולדה על ידי מציאת התדרים המרחביים שבהם החולדה הגיבה.
- רשום את כל התגובות (נוכחות או היעדר מעקב ברור אחר הראש) בגיליון אלקטרוני.
- מצאו את התדירות המרחבית הגבוהה ביותר שאליה הגיבה חולדה משלושת הבדיקות. זה נחשב לחדות הראייה הסופית.
הערה: מכיוון שמדידת חדות הראייה היא סובייקטיבית, הנתונים יוערכו על ידי שני אנשי מחקר עצמאיים כדי לאשר את ציון חדות הראייה עבור כל חולדה12. התוצאות נבדקות עד להסכמה על הציון הסופי. תגובת OKN חיובית מוגדרת כנוכחות של פעילות מעקב ראש ברורה ומתמשכת. מעקב ראש אקראי (שאינו קשור לגירויים החזותיים של OKN) או היעדר תנועת ראש כלשהי נחשבים לתגובת OKN שלילית. - לבצע ניתוח סטטיסטי להשוואה בין קבוצות או בין שתי העיניים (עין שמאל לעומת עין ימין).
הערה: סקור את הקלטות הווידאו כדי להבהיר שתגובות חיוביות או שליליות מתבצעות לפי הצורך.
תוצאות
בדיקת OKN בוצעה באמצעות חולדות מנוונות רשתית (RD) של הקולג' המלכותי למנתחים (RCS) וחולדות לונג אוונס (LE) רגילות תואמות גיל. חולדות LE (n = 4), שימשו לקביעת נתוני הבסיס לקביעת ציוני חדות הראייה בחולדות רגילות באמצעות ההגדרה החדשה. הניתוח הסטטיסטי בוצע באמצעות מיקרוסופט אקסל (ממוצע ± סטיית תקן). חולדות LE הפגינו מעקב ראש חזק בתדרים מרחביים מ-0.15 c/d עד 0.33 c/d. כדי להעריך את האמינות והיעילות של מכשיר OKN החדש במדידת חדות הראייה בחולדות RD, בוצעו בדיקות באמצעות חולדות RCS (n = 9) בחמש נקודות זמן שונות בין הגילאים שלאחר הלידה (P) 35 ו-P100 (איור 4). חולדות ה-RCS הראו תגובות חזקות ומתמשכות למעקב אחר הראש עד גיל P50. לאחר P50, היה אובדן ניכר של חדות הראייה. לאחר גיל P80, רגישות הראייה בחולדות RCS ירדה בחדות. לאחר P100, תפקוד הראייה בחולדות RCS נפגע קשות, כפי שניכר מהיעדר תגובות מעקב ראש אפילו בתדרים מרחביים נמוכים. רק תגובות חלשות ואקראיות של מעקב אחר הראש נצפו ב-RCS כאשר נבדקו בנקודות זמן מאוחרות יותר. דפוס זה של אובדן חדות הראייה שנצפה בחולדות RCS התקדם באופן דומה בשתי העיניים. בדיקת OKN באמצעות מכשיר חדש זה הציעה גם כי חדות הראייה בחולדות יכולה להיות מושפעת מהמרחק בין גירוי הראייה לעין החולדה. בניסויי הפיילוט שלנו שהשתמשו בחולדות LE, נצפו תגובות OKN חזקות כאשר ראש החולדה היה ממוקם במרחק של כ-3.5 אינץ' ממסך התצוגה.

איור 1: סקיצה דיאגרמטית ותמונה מייצגת של מערך OKN החדש. (A) סקיצה דיאגרמטית של מחזיק החולדה המחובר לכן ומעמד מתכת המונח על משטח ישר, (B) מידות של מחזיק חולדה ומעמד המשמשים עבור חולדה בת 6 חודשים, (C) תמונה של מערך OKN החדש. מסכי הטאבלט הפונים זה לזה ממוקמים בזווית של 155 מעלות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: מכשיר בדיקה חדש של OKN. חולדה מוחזקת בתוך צינור הפלסטיק השקוף לבדיקה. (A-C) תמונה שצולמה מזוויות שונות שמראה את החולדה צופה בגירוי OKN. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: איור סכמטי המציג שלבים שונים של בדיקה וניתוח OKN. הוראות שלב אחר שלב המתארות שלבים שונים של הליך בדיקת OKN וניתוח נתונים באמצעות מכשיר OKN החדש. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
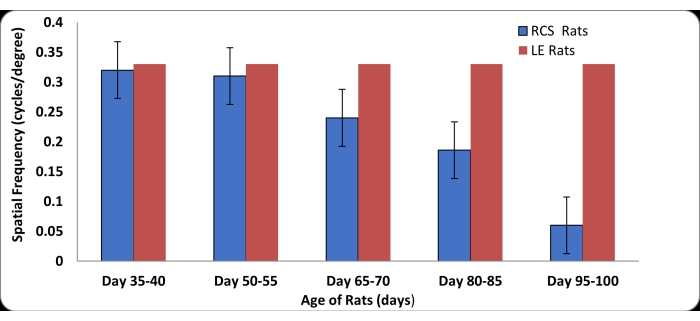
איור 4: מדידות חדות ראייה (±SD) בחולדות LE רגילות ובחולדות מנוונות רשתית (RD) של הקולג' המלכותי למנתחים (RCS) בשלבים שונים של מחלת ניוון הרשתית. חולדות LE רגילות הראו יכולת לעקוב אחר הפסים בכל התדרים המרחביים (0.15 c/d עד 0.33 c/d). חולדות RCS בגילאים שבין P35 ל-P95 (n = 9) עברו בדיקת OKN בחמש נקודות זמן שונות. ב-P35, רוב החולדות עקבו בכל התדרים המרחביים לעיל. ירידה דרסטית בחדות הראייה נצפתה בחולדות RCS בין הגילאים 2 ל-3 חודשים. אחרי גיל P100, אף אחת מהחולדות לא הצליחה להראות התנהגות חזקה של מעקב אחר הראש. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
OKN היא תנועת שן מסור רפלקסיבית של העיניים בתגובה לגירוי נסחף, המשמש ככלי להערכת חדות הראייה אצל נבדקים אנושיים3. בבעלי חיים, כולל פרימטים ומכרסמים, בדיקת OKN משמשת כמדידה כמותית של תפקוד הראייה. המחקר הנוכחי מתאר מכשיר OKN חדשני וזול שניתן להקים בקלות במעבדות מחקר לבדיקת התנהגות OKN בחולדות. הערכות OKN במכרסמים בוצעו בגישות שונות. בעבר נעשה שימוש בתוף OKN להחלפה המחובר למנוע לסיבוב הסורגים6. לאחרונה, נעשה שימוש בבדיקות OKN באמצעות מסכי מחשב כדי להציג את הגירויים החזותיים10, כולל אלה שתוכנתו ליצירת גליל וירטואלי,14. מכשירי בדיקת OKN הזמינים מסחרית שימשו חוקרים שונים להערכת שינויים תפקודיים חזותיים במודלים של בעלי חיים מנוונים נורמלייםורשתית 16,17,18. חדות הראייה של החיה נמדדת לאחר הנחתם בתא בדיקה המצויד בארבעה מסכי מחשב המציגים את גירוי OKN 7,15,19. בעבר, החולדה או העכבר מונחים על גבי פלטפורמה באמצע תא הבדיקה. מיקרו-מצלמה המחוברת למעלה מתעדת את תנועות החולדה. הנתונים שנאספו מוערכים ומנותחים סטטיסטית עבור מדדים של מעקב אחר ראש 11,14,16 עבור יישומים שונים. אדם מיומן המסוגל לזהות את תנועות מעקב הראש מבצע את ניתוח הנתונים בצורה מוסווית.
המחקר הנוכחי הדגים את האמינות של שימוש במנגנון בדיקה חדש של OKN, שקל לבנות במעבדות להערכת תפקוד הראייה בחולדות. המכשיר הוכח כמתאים להערכת חדות הראייה בחולדות נורמליות ומנוונות רשתית. פרסומים אחרונים ממעבדה זו12,20 הראו גם כי נתונים משיטת OKN חדשה זו הם אמינים וניתנים להשוואה לנתונים שהתקבלו ממערכות OKN שהוקמו בעבר. במערך הבדיקה החדש של OKN, מלבד השינויים בתכנון הציוד, נהלי הבדיקה התבססו בעיקר על התיאור שסופק במחקרים הקודמים 6,11,12,21. השלבים הקריטיים הדרושים הם מיקום החולדות בתוך מרסן למחצה (כדי למזער את תנועות החולדה במהלך הבדיקה) והפעלת תוכנת ההדמיה OKN בצורה אקראית (סיבוב הפסים יכול להיות משמאל לימין או מימין לשמאל). בנוסף לשינוי רוחב הפסים, התוכנה מאפשרת גם שינוי הניגודיות בין הפסים השחורים והלבנים ומהירות הסיבוב של הפסים. במחקר זה נמדדו רק ציוני חדות הראייה של OKN (בהתבסס על שינוי רוחב הפס). לשם כך, חולדות נבדקו באמצעות הניגודיות הגבוהה ביותר (פסים שחורים לעומת לבנים). בעלי חיים נבדקו ברמת הניגודיות המקסימלית (305.50 cd/m2 לעומת 15.75 cd/m2 נמדד באמצעות מד כוח אופטי 371 R, Graseby Optronics, Orlando, FL). כל הניסויים בוצעו בחדר חשוך כדי למזער את השפעת התאורה החיצונית בגירוי OKN ולספק סביבת בדיקה אחידה לכל הניסויים. במהלך הבדיקות נעשה שימוש בפסים השחורים והלבנים בתדרים המרחביים הבאים: 0.08, 0.15, 0.2, 0.24, 0.28, 0.33, 0.38. כיוון הסיבוב של הפסים (ימין מול שמאל או שמאלה מול ימין) התחיל באופן אקראי כדי למנוע התרגלות פוטנציאלית של התנהגות מעקב הראש. החולדות הורשו לנוח בין ניסויים עוקבים (כ-30 דקות) כדי להבטיח שההערכות לא יושפעו מהמבחן הקודם. ניתוח הווידאו דורש הכשרה מספקת לחוקר כדי להבחין בין תגובות מעקב ראש לעומת תנועות ראש אקראיות.
ברוב מכשירי ה-OKN הקודמים, החולדות הונחו על פלטפורמה שאפשרה את תנועתן החופשית (כולל הראש). זה עלול להוביל לשינויים קבועים במרחק הצפייה (המרחק בין העין לגירוי הראייה). מכיוון שראייתה של החולדה רגישה לשינויים במרחק הראייה22, תנועתה החופשית בתוך תא הבדיקה עלולה לגרום לשינויים בציוני חדות הראייה. שונות גבוהה בציון חדות הראייה באותה קבוצת בעלי חיים או באותה חיה בין מבחנים שונים עלולה לגרום לקשיים בהשגת הסקה סטטיסטית משמעותית. בהתבסס על זה, במחקר הנוכחי, במהלך הבדיקה, החולדות נשמרו בחצי ריסון כדי למזער תנועות לעבר גירוי OKN או הרחק מהם. על ידי הגבלת התנועה החופשית של החולדה, השונות במרחק הצפייה ממוזערת. מכיוון שראש החולדה מופנה לפינה שבה נפגשים הקצוות של שני הלוחות, שתי העיניים חשופות באופן שווה לפסים (מרחק הראייה נשאר קבוע ברובו). בסך הכל, הגדרה חדשה זו עשויה לספק הזדמנות לחוקרים להשיג נתונים פונקציונליים חזותיים עקביים. יש צורך בחקירות נוספות המבוססות על שינוי מרחק הצפייה והשוואת הנתונים עם הגדרות אחרות כדי להגיע למסקנה חזקה מהתצפיות לעיל.
כדי לבסס את האמינות של המערך החדש, נבדקו גם חולדות LE רגילות וגם חולדות RCS מנוונות ברשתית. חדות הראייה שנמדדה באמצעות מערך חדש זה הייתה 0.33 c/d בחולדות LE. בחולדות RCS, ציון חדות הראייה השתנה בהתאם להתקדמות מחלת ניוון הרשתית. בחולדות RCS, ניוון קולטני אור מתרחש עקב תפקוד לקוי של תאי אפיתל פיגמנט רשתית (RPE), מה שמוביל להצטברות של פסולת קולטני אור בחלל התת-רשתית המעוררת את המחלה הניוונית22,23. מספר מחקרים קודמים24,25 קבעו כי התקדמות המחלה בחולדות RCS איטית בהתחלה. זה הופך דרסטי יותר בגיל חודשיים בזמן שבו מדווח על נזק חמור לקולטני האור. כדי לאמת את ההגדרה החדשה, נערכו בדיקות חדות ראייה ב-RCS בנקודות זמן שונות לאחר הלידה (איור 3). בהתבסס על מחקר זה, אובדן מתקדם של חדות הראייה בחולדות RCS מתרחש עד גיל חודשיים. עד גיל 3 חודשים, חדות ה-OKN בחולדות RCS נפגעה קשות, מה שמקביל לאובדן קולטני האור26,27.
המחקר הנוכחי הדגים תכנון ומנגנון חדשים, יעילים ומועילים מבחינה כלכלית להערכת פעילויות חזותיות מבוססות OKN בחולדות מנוונות רגילות ורשתית. מכיוון שהמרחק בין עין החולדה לגירויים חזותיים הוא משתנה אינטגרלי שיכול להשפיע על ההערכה המדויקת של חדות הראייה בחולדות, ציוד חדש זה יכול למזער את השונות בתוצאות המחקר. לסיכום, מכשיר OKN חדש זה הוכיח את עצמו כטכניקת סינון אמינה עבור חוקרים להשוואת תפקוד הראייה בחולדות במגוון יישומי מחקר המתמקדים בבדיקות טיפוליות.
Disclosures
למחברים אין ניגודי אינטרסים לדווח.
Acknowledgements
מחקר זה נתמך על ידי מענקי CIRM (המכון לרפואה רגנרטיבית של קליפורניה) (DISC1-09912 PI- Thomas, DR3-07438- PI- Humayun), מענק בלתי מוגבל למחלקת העיניים ממחקר למניעת עיוורון, ניו יורק, ניו יורק, ותמיכה מקרן Bright Focus (M2016186, Thomas, PI). המחקר המדווח בפרסום זה נתמך על ידי מכון העיניים הלאומי של המכונים הלאומיים לבריאות תחת פרס מספר P30EY029220.
Materials
| Name | Company | Catalog Number | Comments |
| iPad Mini | Apple | A1489 | Two iPad Minis are used to display the OKN Stripes Visualization Software. |
| Micro-camera/Micro-Camera Attachment | Lanon | B097H6WWDS | The micro-camera is used to record the experiment. The micro-camera attachment connects to the desk and holds the camera facing the rat. The head tracking responses are recorded and assessed at varying distances, spatial frequencies, and directions. |
| Plexiglass Tube/Rat Holder | Best Acrylics | B07KMF31MC | The Plexiglass Tube is used to restrain the rat, with their head exposed, for the duration of the experiment. The tube is attached to another vertical plexiglass tube attachment to stabilize the rat holder during the experiment. The entire apparatus was designed and constructed in the lab. |
| Plexiglass Tube Attachment | Best Acrylics | B07KMF31MC | This attachment holds the rat holder in front of the iPad screens, and allows the distance between the rat and iPads to be manipulated. |
| Screen Holders | Kabcon | B08JLRPKQ1 | Two screen holders are used to hold the iPads up in order to display the OKN Stripes Visualization Software to the rat. |
| OKN Stripes Visualization Web Application | The MIT License (MIT) Copyright (c) 2016 Anton Yakushin | https://antonyakushin.github.io/okn-stripes-visualization/ | This application is a freely available softeware to display visual stimuli (black and white stripes) at different frequencies |
References
- Mustari, M. J., Ono, S. Optokinetic eye movements. Encyclopedia of Neuroscience. , 285-293 (2009).
- Gottlob, I. Ups and downs of optokinetic nystagmus. British Journal of Ophthalmology. 84, 445-447 (2000).
- Wester, S. T., Rizzo, J. F., Balkwill, M. D., Wall, C. Optokinetic nystagmus as a measure of visual function in severely visually impaired patients. Investigative Ophthalmology & Visual Science. 48 (10), 4542-4548 (2007).
- Daroff, R., Aminoff, M. . Encyclopedia of the Neurological Sciences. , (2014).
- Squire, L., et al. . Fundamental Neuroscience. , (2008).
- Thomas, B. B., Seiler, M. J., Sadda, S. R., Coffey, P. J., Aramant, R. B. Optokinetic test to evaluate visual acuity of each eye independently. Journal of Neuroscience Methods. 138 (1-2), 7-13 (2004).
- Cahill, H., Nathans, J. The optokinetic reflex as a tool for quantitative analyses of nervous system function in mice: Application to genetic and drug-induced variation. PLOS One. 3 (4), 2055 (2008).
- Segura, F., et al. Development of optokinetic tracking software for objective evaluation of visual function in rodents. Scientific Reports. 8, 10009 (2018).
- Lev-Ari, T., Katz, H., Lustig, A., Katzir, G. . Visual acuity and optokinetic directionality in the common chameleon (Chamaeleo chamaeleon). , (2017).
- Thomas, B. B., Shi, D., Khine, K., Kim, L. A., Sadda, S. R. Modulatory influence of stimulus parameters on optokinetic head-tracking response. Neuroscience Letters. 479 (2), 92-96 (2010).
- Shi, D. S., et al. Characterization of optokinetic response in normal and retinal degenerate rats and mice using a computer-based testing apparatus. Investigative Ophthalmology & Visual Science. 49 (13), 4422 (2008).
- Thomas, B. B., et al. Co-grafts of human embryonic stem cell derived retina organoids and retinal pigment epithelium for retinal reconstruction in immunodeficient retinal degenerate royal college of surgeons rats. Frontiers in Neuroscience. 15, 752958 (2021).
- Thomas, B. B., et al. A new immunodeficient retinal dystrophic rat model for transplantation studies using human-derived cells. Graefe's Archive for Clinical and Experimental Ophthalmology. 256 (11), 2113-2125 (2018).
- Prusky, G. T., Alam, N. M., Beekman, S., Douglas, R. M. Rapid quantification of adult and developing mouse spatial vision using a virtual optomotor system. Investigative Ophthalmology & Visual Science. 45 (12), 4611-4616 (2004).
- Cameron, D., et al. The optokinetic response as a quantitative measure of visual acuity in zebrafish. Journal of Visualized Experiments. (80), e50832 (2013).
- Tabata, H., Shimizu, N., Wada, Y., Miura, K., Kawano, K. Initiation of the optokinetic response (OKR) in mice. Journal of Vision. 10 (1), 13 (2010).
- Huang, Y. -. Y., Neuhauss, S. C. F. The optokinetic response in zebrafish and its applications. Frontiers in Bioscience: A Journal and Virtual Library. 13, 1899-1916 (2008).
- Sirkin, D. W., Hess, B. J., Precht, W. Optokinetic nystagmus in albino rats depends on stimulus pattern. Experimental Brain Research. 61 (1), 218-221 (1985).
- Dietrich, M., et al. Using optical coherence tomography and optokinetic response as structural and functional visual system readouts in mice and rats. Journal of Visualized Experiments. (143), e58571 (2019).
- Rajendran Nair, D. S., et al. Long-term transplant effects of iPSC-RPE monolayer in immunodeficient RCS rats. Cells. 10 (11), 2951 (2021).
- Kretschmer, F., Sajgo, S., Kretschmer, V., Badea, T. C. A system to measure the Optokinetic and optomotor response in mice. Journal of Neuroscience Methods. 256, 91-105 (2015).
- Lin, T. -. C., et al. Assessment of safety and functional efficacy of stem cell-based therapeutic approaches using retinal degenerative animal models. Stem Cells International. 2017, 9428176 (2017).
- Ryals, R. C., et al. Long-term characterization of retinal degeneration in Royal College of Surgeons Rats using spectral-domain optical coherence tomography. Investigative Ophthalmology & Visual Science. 58 (3), 1378-1386 (2017).
- Di Pierdomenico, J., et al. Early events in retinal degeneration caused by rhodopsin mutation or pigment epithelium malfunction: Differences and similarities. Frontiers in Neuroanatomy. 11, 14 (2017).
- McGill, T. J., Douglas, R. M., Lund, R. D., Prusky, G. T. Quantification of spatial vision in the Royal College of Surgeons Rat. Investigative Ophthalmology & Visual Science. 45 (3), 932-936 (2004).
- Hetherington, L., Benn, M., Coffey, P., Lund, R. Sensory capacity of the Royal College of Surgeons rat. Investigative Ophthalmology & Visual Science. 41, 3979-3983 (2000).
- Sauvé, Y., Pinilla, I., Lund, R. D. Partial preservation of rod and cone ERG function following subretinal injection of ARPE-19 cells in RCS rats. Vision Research. 46 (8), 1459-1472 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ISSN 1940-087X
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.