Method Article
אוטומציה של כימות מצטבר ב - Caenorhabditis elegans
In This Article
Summary
הפרוטוקול הבא מתאר את הפיתוח והאופטימיזציה של זרימת עבודה בתפוקה גבוהה עבור גידול תולעים, הדמיה פלואורסצנטית ועיבוד תמונה אוטומטי כדי לכמת אגרגטים של פוליגלוטמין כהערכה של שינויים בפרוטאוסטזיס.
Abstract
עלייה בשכיחות של מחלות קונפורמציה של חלבונים נוירודגנרטיביים (PCDs) טיפחה עניין רב בנושא זה לאורך השנים. תשומת לב מוגברת זו קראה לגיוון ולשיפור של מודלים של בעלי חיים המסוגלים לשחזר פנוטיפים של מחלות שנצפו בבני אדם עם PCDs. אף על פי שמודלים של מורין הוכיחו את עצמם כבעלי ערך רב, הם יקרים וקשורים לשיטות מייגעות ותפוקה נמוכה. השימוש במודל הנמטודה Caenorhabditis elegans לחקר PCDs הוצדק על ידי קלות התחזוקה היחסית שלו, העלות הנמוכה וזמן הייצור המהיר, המאפשרים יישומים בתפוקה גבוהה. בנוסף, שימור גבוה בין ה-C. elegans לבין הגנומים האנושיים הופך את המודל הזה לכלי גילוי שלא יסולא בפז. נמטודות המבטאות דרכי פוליגלוטאמין (polyQ) ספציפיות לרקמות המתויגות באופן פלואורסצנטי מפגינות צבירה תלוית גיל ופולי-Q המאופיינת במוקדים פלואורסצנטיים. כתבים כאלה משמשים לעתים קרובות כפרוקסים כדי לעקוב אחר שינויים בפרוטאוסטזיס על פני רקמות. כימות צבירה ידני גוזל זמן רב, ומגביל את התפוקה הניסויית. יתר על כן, כימות מוקדים ידני יכול להציג הטיה, שכן זיהוי מצרפי יכול להיות סובייקטיבי מאוד. כאן, פרוטוקול המורכב מחקלאות תולעים, רכישת תמונה ועיבוד נתונים תוקן כדי לתמוך בכימות מצטבר בתפוקה גבוהה באמצעות C. elegans המבטאים polyQ ספציפי למעי. על ידי יישום צינור עיבוד תמונה מבוסס C. elegans באמצעות CellProfiler, תוכנה לניתוח תמונות, שיטה זו הותאמה להפרדה ולזיהוי של תולעים בודדות ולמנות את הצברים שלהן בהתאמה. למרות שהמושג אוטומציה אינו ייחודי לחלוטין, הצורך לתקנן נהלים כאלה לצורך שכפול, ביטול ההטיה מספירה ידנית והגדלת התפוקה הוא גבוה. הצפי הוא ששיטות אלה יכולות לפשט באופן דרסטי את תהליך הסינון של ספריות חיידקים, גנומיות או תרופות גדולות באמצעות מודל C. elegans .
Introduction
מחלות קונפורמציה של חלבונים נוירודגנרטיביים תלויי גיל (PCDs) כגון אלצהיימר, פרקינסון ומחלות הנטינגטון, או טרשת אמיוטרופית צידית, מאופיינות בקיפול שגוי של חלבונים שמוביל לצבירה, למוות תאי ולניוון רקמות1. בעוד קיפול שגוי של חלבונים מוכר כאשם, האטיולוגיה של מחלות אלה אינה ברורה. ככזה, פיתוח טיפולים יעילים הופרע על ידי חוסר ידע לגבי הגורמים והתנאים התורמים להופעת המחלה והתקדמותה. מחקרים אחרונים מצביעים על כך ששינויים במיקרוביום משפיעים על ההתחלה, ההתקדמות והחומרה של PCDs 2,3,4. עם זאת, המורכבות של המיקרוביום האנושי, או אפילו של מורין, מקשה על ביצוע מחקרים שיחשפו את ההשפעה המדויקת של מיקרובים על הפונדקאי שלהם. לכן, אורגניזמים פשוטים יותר, כגון Caenorhabditis elegans, משמשים לעתים קרובות ככלי גילוי 5,6,7,8. מחקרים אחרונים השתמשו ב-C. elegans כדי לחקור את ההשפעה של חיידקים על פרוטאוסטזיס של המארח ועל פתוגנזה של מחלות 9,10. התיישבות חיידקית, הורמזיס ושינויים גנומיים הם בין התנאים המופתיים המשפיעים על צבירה של דרכי פוליגלוטמין (polyQ) 9,11,12. בנוסף, צבירי חלבונים מקופלים באופן שגוי אלה מציגים הצטברות תלוית אורך וגיל של polyQ בתוך הפונדקאי, והם קשורים לפגיעה בתנועתיות 9,13. הגישה הפשוטה יחסית של כימות פונקטה עם תווית פלואורסצנטית יכולה להפיק נתונים חשובים על תנאים, גורמים או תרופות המשפיעים על קיפול וצבירת חלבונים.
אף על פי שכימות של פונקטה פלואורסצנטית הוכח כהליך אמין ופשוט יחסית, האתגר נותר לפתח פרוטוקול שיאפשר סינון בקנה מידה גדול של תרכובות, חיידקים או מצבים המשפיעים על צבירת חלבונים. הרעיון של עיבוד תמונה אוטומטי של C. elegans וכימות פונקטה אינו חדש לחלוטין, שכן פותחו מספר כלי תמיכה מעשיים14,15. עם זאת, השילוב של תרבות, רכישת תמונה וצינור עיבוד חיוניים לביטול השונות בתוצאות ומאפשרים מסכים בעלי תפוקה גבוהה יותר.
ככזה, כוונתו של כתב יד זה היא לתקנן את הפרוצדורה המשמשת לכימות צבירה של polyQ ב- C. elegans כמייצג לזיהוי שינויים בפרוטאוסטזיס. משימה זו הושגה על ידי שימוש ב-CellProfiler, תוכנת ניתוח תמונות בקוד פתוח16 המסוגלת לזהות תולעים וצברים אוטומטיים, והיא משולבת בפרוטוקול גדול יותר ללכידת תולעים, רכישת תמונות ועיבוד נתונים.
Protocol
כל הנהלים פעלו בהתאם להנחיות הבטיחות שנבדקו ואושרו על ידי הוועדה המוסדית לבטיחות ביולוגית של אוניברסיטת פלורידה. ננקטו צעדי בטיחות ביולוגית מתאימים כדי להפחית את הסיכון לחשיפה לחיידקי בטיחות ביולוגית ברמה 2.
הערה: עבור כל הניסויים, יש להפיץ את C. elegans ולשמור אותם על לוחות גדילת נמטודות (NGM) שנזרעו עם Escherichia coli OP50.
1. הכנת לוחות NGM 10 ס"מ
- שלבו 3 גרם של NaCl, 2.5 גרם של טריפטיקאז-פפטון ו-17 גרם אגר לתוך בקבוקון 2 ליטר, ומלאו עד 1 ליטר במים מזוקקים כפולים (ddH2O). הוסיפו מוט ערבוב מגנטי לפני האוטוקלבינג.
- Autoclaew את התערובת במשך 45 דקות ב 121 °C ולחץ של 21 psi. תנו לתערובת להתקרר ל-50 מעלות צלזיוס באמבט מים.
- באמצעות טכניקות אספטיות, הוסף את הפתרונות הסטריליים הבאים: 1 מ"ל של 1 M CaCl2· 2H2O, 1 מ"ל של 1 M MgSO4· 7H2O, 1 מ"ל של 5 מ"ג / מ"ל כולסטרול מומס ב 100% אתנול (מחומם לטמפרטורת החדר), ו 25 מ"ל של 1 M KH2PO4 (pH = 6.0). מערבבים באמצעות צלחת ערבוב מגנטית. ניתן לבצע ערבוב במשך דקה אחת ב-700 סל"ד.
- יוצקים עד שהתערובת ממלאת את כל הצלחת באורך 10 ס"מ. לחלופין, השתמשו בפיפטה סרולוגית מדורגת כדי להוסיף כ-20 מ"ל של תערובת לצלחת.
- אפשרו לצלחות להתייבש במשך 24 שעות בטמפרטורת החדר לפני הזריעה עם חיידקים או לאחסן את הצלחות הפשוטות בטמפרטורה של 4 מעלות צלזיוס לאחר הייבוש.
הערה: כל רכיבי המדיה מטופלים באמצעות טכניקות אספטיות. שלבים 1.3-1.4 צריכים להתבצע במכסה זרימה למינרי.
2. הכנת אגר NGM עם FUDR בלוחות 24 באר
- בצע את השלבים 1.1-1.3.
- יש להשלים את NGM עם 5-Fluoro-2′-deoxyuridine (FUDR) ולערבב כדי להגיע לריכוז סופי של 100 מיקרוגרם/מ"ל.
הערה: FUDR מעכב שכפול דנ"א, וכתוצאה מכך, חוסם את רביית C. elegans על ידי התמקדות בחיידקים ובאמבריוגנזה, ובסופו של דבר משפיע על תוחלת החיים. לכן, חשוב לאפשר לתולעים להתפתח באופן מלא למבוגרים צעירים לפני שהן עוברות לצלחות המכילות FUDR.
אזהרה: FUDR הוא רעיל ויש לטפל בו על פי גיליון נתוני הבטיחות של היצרן. - באמצעות אקדח פיפטה, מחלקים 1 מ"ל של NGM-FUDR לכל באר.
הערה: ניתן להקל על תהליך זה על ידי שימוש במערכת מזיגת צלחות אוטומטית. - תנו לצלחת להתייבש במשך 24 שעות בטמפרטורת החדר לפני זריעה עם חיידקים או אחסון צלחות רגילות בטמפרטורה של 4 מעלות צלזיוס.
3. זריעת צלחות: OP50 וחיידקי בדיקה נוספים
- כדי להכין תרבית E. coli OP50 למשך הלילה, הוסיפו 200 μL של אליקוט חיידקי ממלאי קפוא לבקבוקון Erlenmeyer בגודל 500 מ"ל המכיל 250 מ"ל של ציר לוריה טרי וסטרילי (LB).
הערה: נפח המדיה תלוי במספר הלוחות שיש לזרוע. כדי להכין תרביות חיידקים אחרות, חסן צינור תרבית של 16 מ"ל המכיל 5 מ"ל של מדיום גדילה עם חיידקים ממלאי קפוא באמצעות קצה מיקרופיפט סטרילי. - דגירה למשך הלילה באינקובטור של 37 מעלות צלזיוס, רועדת ב-220 סל"ד (סיבובים לדקה).
הערה: השתמש בצלוחיות מעוקרות עם נפח עבודה של לפחות פי שניים של מדיה ואטימה עם רדיד אלומיניום אוטוקלבי. בצע את שלב החיסון ואת חלוקת החיידקים באמצעות טכניקות אספטיות. - מחלקים 1-2 מ"ל של תרבית E. coli OP50 למשך הלילה למרכז של כל צלחת NGM בגודל 10 ס"מ. תרבות זו אינה צריכה להיות מפוזרת סביב צלחת NGM.
- אפשרו לצלחות להתייבש בטמפרטורת החדר לפני השימוש/האחסון.
הערה: ניתן למקם צלחות שנזרעו עם מכסים על מכסה המנוע עם זרימת אוויר כדי להקל על הייבוש.
4. גידול וזריעה של צלחות: צלחות 24 באר
- הכינו תרבית לילה של זני חיידקים רצויים, תוך הקפדה על הוראות התרבות שנמצאות בשלבים 3.1-3.2.
- מעבירים 200 μL של כל תרבית חיידקים לכל באר של צלחת של 24 בארות המכילה אגר NGM. נפח של 200 μL של חיידקים יכסה את כל אזור האגר, וימקסם את כמות המזון כדי להבטיח שהתולעים לא יימנעו ממשחת החיידקים.
- השאירו את הצלחות סדוקות פתוחות בארון בטיחות ביולוגי (BSC) כדי להקל על הייבוש. בדוק את הצלחות מעת לעת כדי למנוע התייבשות מוגזמת ולשנות את כיוון הצלחת כדי לקדם זרימת אוויר וייבוש אחידים. הצלחות צריכות להתייבש תוך 5 שעות.
הערה: כל עבודה עם חיידקי בטיחות ביולוגית ברמה 2 חייבת להתבצע ב- BSCs מוסמכים ומאושרת על ידי ועדת הבטיחות הביולוגית המוסדית.
5. סנכרון גיל
הערה: יש לבצע את כל השלבים באמצעות טכניקות אספטיות מתאימות (כלומר, עבודה קרוב ללהבה או בתוך BSC).
- רחיצת הרמפרודיטים של גרבידים מלוחות OP50 בגודל 10 ס"מ באמצעות תמיסת M9 מעוקרת במסנן (5.8 גרם של Na2HPO4· 7H2O, 3.0 גרם של KH2PO4, 5 גרם של NaCl, 0.25 גרם של MgSO4·7H2O, ב-1 L של ddH2O).
- פיפטה M9 תמיסה על הצלחת מספר פעמים באמצעות זכוכית סטרילית או פיפטה סרולוגית פלסטית להרמת תולעים ממדשאת החיידקים.
- אספו את תרחיף התולעת והעבירו את התמיסה לצינור חרוטי פוליסטירן 15 מ"ל.
- צנטריפוגה ב 270 x גרם, טמפרטורת החדר (RT, ~ 23 ° C), למשך 2 דקות.
- לשאוף באמצעות בקבוקון מלכודת ואקום ולהשליך את supernatant, משאיר את כדור התולעת ללא הפרעה.
- יש לבצע החייאה של הכדור ב-5-10 מ"ל של M9 כדי לשטוף את התולעים ולחזור על שלבים 5.2-5.3 פעמיים.
- הוסף 5 מ"ל של תמיסת הלבנה של 20% (8.25 מ"ל של ddH2O, 3.75 מ"ל של 1M NaOH, 3.0 מ"ל של אקונומיקה לא חיידקית) לצינור והתהפך ברציפות כדי להמיס את התולעים. תולעים מוכנות לצנטריפוגה ברגע שהן התמוססו כמעט לחלוטין.
הערה: זמני ההלבנה ונפח תמיסת ההלבנה יהיו תלויים בגודל המדגם. הלבנת יתר ותת-הלבנה הן טעויות נפוצות. ככזה, תהליך זה דורש בדרך כלל אופטימיזציה כדי לקבוע מתי המדגם מוכן לצנטריפוגה. - צנטריפוגה במשך 2 דקות ב 423 x g ולהשליך את supernatant.
- מוסיפים 10 מ"ל של M9 סטרילי כדי להחיות את גלולת הביצה.
- צנטריפוגה את הצינור במשך 2 דקות ב 423 x g כדי לכדור את הביצים. הסר את הסופרנאטנט עם בקבוקון שאיפה.
- חזור על שלבים 5.6-5.6.1.
- יש להחיות את גלולת הביצה ב-5 מ"ל של M9 סטרילי ולהניח אותה על מחט במשך הלילה בטמפרטורה הרצויה.
הערה: זחלי L1 מסונכרנים לגיל יהיו מוכנים להעברה לצלחות למחרת.
6. הכנת תולעת לאחר סנכרון גיל
- צנטריפוגה התולעים המסונכרנות לגיל ב-270 x g למשך 3 דקות ב-RT (~23 °C)."
- שאפו את הסופרנטנט בסביבה נקייה, כגון מכסה מנוע זרימה או ליד מבער בונזן. השאירו כ-200 מיקרול'ל של הסופרנאטנט ובצעו החייאה של התולעים.
- באמצעות מיקרופיפט, העבירו את תרחיף התולעת המרוכז ללוחות NGM בקוטר 10 ס"מ שנזרעו בעבר עם OP50.
הערה: כל צלחת יכולה לתמוך ב-1,500 תולעים מבלי שייגמר לו המזון; עם זאת, ריכוז זה עשוי לדרוש התאמה בהתאם לצפיפות מדשאת החיידקים וטמפרטורת הגדילה. מומלץ להשתמש בצלחות מרובות כדי למנוע מתולעים לגווע ברעב. חשוב לציין כי לוחות אלה לא חייבים להכיל FUDR. - אפשרו לצלחות להתייבש; לאחר מכן הפוך ואחסן בטמפרטורה של 25 מעלות צלזיוס למשך 48 שעות.
הערה: בהתאם למצב המסך, ניתן למקם תולעים משלב 6.1 ישירות על צלחות בדיקה (המכילות חיידקים, תרופות או תרכובות בדיקה). אם מצב הבדיקה הרצוי משפיע על ההתפתחות, יש תרבית של תולעים על NGM המכיל OP50 עד למבוגרים צעירים (כ-48 שעות) לפני חשיפתן לתנאי בדיקה. - לאחר הדגירה של 48 שעות, שטפו את התולעים מהצלחות בתמיסת M9 סטרילית והניחו אותן בצינורות חרוטיים.
הערה: תולעים בוגרות ישקעו לתחתית הצינור. הזמן המדויק ישתנה בהתאם למספר התולעים שהתאוששו מלוחות 10 ס"מ. בתנאים אלה, התולעים מתיישבות תוך 10 דקות. - בצע בדיקה חזותית כדי לקבוע את משך זמן ההתיישבות כך שכל שאריות הביצים או הזחלים הבוקעים יוסרו.
- הוסיפו 10 מ"ל נוספים של M9 כדי לשטוף את שאריות החיידקים מגופי התולעים.
- צנטריפוגה התולעים במשך 2-3 דקות ב 270 x g ב 23 °C (76 °F).
- בצעו את שלב הכביסה 3 פעמים נוספות. לקבלת התוצאות הטובות ביותר, השאירו כ-1-1.5 מ"ל של תמיסת M9 בצינור לאחר הכביסה הסופית.
- מעבירים 10 μL של תרחיף התולעת על מגלשת זכוכית וסופרים את מספר התולעים.
- התאימו את צפיפות התולעת לכ-150 תולעים לכל 10 מיקרול' של M9. ניתן לכוונן את ריכוז התולעים בתרחיף על ידי הסרה או הוספה של תמיסת M9 לאחר צנטריפוגה.
- אשרו כי הריכוז הרצוי נקבע על ידי ספירות ממוצעות ממספר טיפות שונות. מומלץ לספור ממוצע מלפחות שלוש טיפות.
- באמצעות טכניקות אספטיות, מעבירים 10 μL של תרחיף התולעת המכיל כ-150 תולעים לכל באר של צלחת הבדיקה.
- בדוק את הבארות תחת מיקרוסקופ כדי לוודא שלכל אחת מהן יש מספר מספיק של תולעים. ניתן להוסיף תולעים נוספות לפני הדגירה.
- אפשרו לצלחות להתייבש במשך כ-10 דקות; ולאחר מכן להפוך ולהעביר לחממה של 25 °C למשך 72 שעות.
הערה: ניתן להתאים את תקופת הדגירה הסופית כך שתתאים לצרכי הניסוי. זמן הדגירה של 72 שעות מספיק כדי לתמוך בצמיחה של 150 בעלי חיים הניזונים מחיידקים של 200 μL בצלחת של 24 בארות בטמפרטורה של 25 מעלות צלזיוס.
7. הכנת תולעים להדמיה
- כדי להקל על התיישבות יעילה יותר ולמזער את אובדן הדגימה, שתקו את התולעים לפני הכביסה כדי למנוע שחייה.
הערה: אם עובדים עם מעט דגימות, ניתן להשיג זאת באמצעות חשיפה ללבמיזול (100 μM). עם זאת, אם עובדים עם מספר רב של דגימות, תולעים יכול להיות משותק על ידי הקפאה. בנוסף, הקפאה ממושכת (18-24 שעות) תמנע פיתוח נוסף של אגרגטים פולי-Q במהלך ההכנה.- הניחו צלחות מרובות בארות בטמפרטורה של -20 מעלות צלזיוס למשך 15-20 דקות או עד שהתולעים כבר לא זזות.
- מוציאים את הדגימות מהמקפיא ומניחים להן לשבת במשך 5 דקות.
- באמצעות micropipette, להוסיף 1 מ"ל של M9, מצונן ל 4 מעלות צלזיוס, לבאר של עניין, שוב ושוב ללחוץ ולדכא את הבוכנה 4-6 פעמים כדי לשטוף את התולעים בכל באר.
הערה: לפעמים, תולעים יכולות להיצמד לקצות מיקרופיפט. ככזה, יש להשתמש בטיפים שונים בין כל באר כדי למנוע ערבוב של תולעים. - מעבירים את תרחיף התולעת לצינור מיקרו-צנטריפוג ומאפשרים לתולעים לשקוע לקרקעית.
- לשאוף ולהשליך את ה-supernatant. לשטוף את הדגימה בסך הכל שלוש פעמים.
- לאחר שהתולעים התיישבו לתחתית במהלך השטיפה הסופית, שאפו 500 μL של סופרנאטנט, והשאירו 500 μL לתולעים resuspend.
- העבירו את מתלי התולעת הנותרים לצלחת חדשה בעלת תחתית שטוחה בת 24 בארות והניחו אותה במקפיא של -20 מעלות צלזיוס למשך 48 שעות.
הערה: הקפאת תולעים מפחיתה את הפלואורסצנציה ברקע ומאפשרת הדמיה טובה יותר של אגרגטים.
8. הדמיה
- מוציאים את הצלחות מהמקפיא ומניחים להפשיר, מנגבים את עודפי העיבוי ומסירים את המכסה לפני ההדמיה.
הערה: פרטי לכידת התמונה ישתנו בהתאם לציוד ולתוכנה שבהם נעשה שימוש. פרוטוקולים עבור סעיף זה צריכים לשמש רק כמדריך, ויש לצפות לשינויים. זה נדרש גם כדי לצלם תמונות בפורמט קובץ tiff. - במהלך לכידת התמונה, השתמש בהגדרות המיקרוסקופ הבאות: זמן חשיפה, 500 אלפיות השנייה; הגדלה של פי 40 עם מתאם מצלמה 0.63x (25.2x), עוצמת GFP מוגדרת ל-100%.
הערה: תצורות ומערכות מיקרוסקופיות שונות יכולות להשיג תמונות שונות מאלו המופיעות בסעיף התוצאות. כדי להשיג תיאור אוניברסלי יותר של התמונות הנדרשות, מסופקים פרטים אובייקטיביים יותר לגבי תמונות. הצברים חייבים להיות בקוטר של בין 1.0-10.0 פיקסלים עם עוצמה פלואורסצנטית של 0.10-1.0 (יחידות שרירותיות, קנה מידה 0-1) כדי להיות מזוהים כראוי על ידי CellProfiler. הרקע הפלואורסצנטי של תמונות מצטברות אלה הוא בדרך כלל מתחת לסף 0.10. עבור תמונות בשדה בהיר, עוצמת התולעת נעה בין 0.7-1.0 עם עוצמת רקע של 0.1-0.2. האורך הממוצע של התולעים בתמונות שדה בהיר נע בין 250 פיקסלים ל-350 פיקסלים באורך מהראש ועד הזנב. - התאם את פקדי האור המועברים עד שהתולעים ייראו מוארות בבהירות בהשוואה לרקע הכהה. הימנעו מחשיפת יתר; זה יגדיל את גודל התולעת.
- ייתכן שיהיה צורך לשנות את מיקומן של התולעים בתוך הבאר כדי למנוע גוש יתר. פזרו תולעים מגושמות באמצעות קצה פיפטה.
- הגדר את הערוץ ל- GFP כדי ליצור מישור מוקד עבור שתי התמונות.
הערה: חיוני שמישור המוקד ייקבע בערוץ GFP. כל שינוי במיקוד שנעשה תוך כדי לכידת תמונות בשדה בהיר יגרום לחוסר התאמה של אגרגטים ותולעים במהלך ניתוח תמונות. - צלם תמונה של שדה בהיר ומיד צלם את התמונה הפלואורסצנטית המתאימה לה מבלי להפריע לצלחת.
- הפעל תמונות בדיקה דרך הצינור כדי לקבוע ערכי עוצמה וגודל עבור אובייקטים בתמונה בהתאם ל-"NOTE" לאחר שלב 8.2.
הערה: CellProfiler יכול לספק את כל המידע הדרוש לגבי העוצמה והאורך של אובייקטים לפני הניתוח. - כדי להעריך תמונות, ראשית, הורד את CellProfiler17. פתח את התוכנה וגרור ושחרר תמונות מעניינות לתוך התיבה תמונות.
- לחץ על התמונות ברשימת הקבצים כדי לפתוח אותן.
- בפינה השמאלית העליונה של המסך מופיעים מספר סמלים; השתמש בהם כדי למדוד את גודל האובייקטים או להגדיל אזור מסוים. בחר את זכוכית המגדלת כדי להדגיש אזור עניין.
- בחר את סמל החץ כדי למדוד את אורך התולעים והאגרגטים.
- רחף מעל האובייקט הרצוי כדי לקבוע את ערך העוצמה שלו שניתן לראות בחלק התחתון של המסך.
הערה: מאחר שכל התמונות צולמו בגווני אפור, כל ערכי הפיקסלים בצבעי אדום, כחול וירוק יהיו זהים.
9. ניתוח תמונות
- כדי לנצל את צינור ניתוח התמונות CellProfiler, תן שם לצמדי התמונות כראוי. השתמש בתבנית הבאה: P1_A01_S1_C1, כאשר P1 מתייחס ללוח הספציפי ולייעוד המספרי המתאים לו; "A", מתייחס לשורה ו-"01" לעמודה; "S" מתייחס לצמד תמונות מסוים עבור באר אחת; "C" מתייחס לערוץ, שבו "1" משמש לציון תמונות שדה בהיר ו-"2" עבור תמונות פלואורסצנטיות.
- הורד את CellProfiler (גרסה 4.1.3 ומעלה) מהאתר הרשמי17.
- הורד את הצינור (קובץ משלים 1). העלה את הצינור (צינור) לתוך CellProfiler על-ידי בחירה בקובץ > ייבוא צינור > מקובץ.
הערה: מודולים 2 ו- 3 הושבתו מכיוון שהם נחשבו מיותרים. ניתן לשחזר את תפקידם אם ניתוח התמונה אינו מניב הפרדה וזיהוי משביעי רצון של תולעים; עם זאת, נדרש שינוי של הצינור. - כדי לשלב מודולים אלה, בחר את התיבות הממוקמות משמאל לכל מודול. שנה את שם התמונה הבינארית של הקלט עבור מודול "UntangleWorms" לתמונת הפלט ממודול "convertobjectstoimage".
- הודעת שגיאה עשויה להופיע במהלך השימוש הראשוני הקשור למודול 2. אם זה קורה, המשך עם הניתוח.
- העלה ערכת אימונים המשמשת לזיהוי תולעים למודול "UntangleWorms". ערכת הדרכה זו ניתן למצוא בקובץ משלים 2.
- בחר במודול התרת סבך תולעים כדי לפתוח את ההגדרות שלו.
- זהה את שם קובץ ערכת ההדרכה ובחר את סמל קובץ ההעלאה.
- העלה קובץ משלים 2 (ערכת אימונים).
- העלה תמונות על-ידי בחירה במודול תמונות בפינה השמאלית העליונה. גרור ושחרר תמונות בעלות שם תקין כמתואר בשלב 9.1.
- לפני ניתוח התמונות, בחר את תיקיית הפלט הרצויה שתשמש לאחסון התוצאות.
- לחץ על לחצן הגדרות פלט הממוקם ליד הפינה השמאלית התחתונה של התוכנית.
- בחר את סמל התיקיה מימין לפלט ברירת המחדל כדי לבחור את מיקום הפלט הרצוי.
- בחר בסמל ניתוח תמונות כדי להתחיל בניתוח תמונות.
- אם הניתוח לוקח יותר מדי זמן להשלים והוא תקוע בעיבוד תמונה בודדת, סביר להניח שזה נובע מבעיות מרכישת תמונה. במקרה כזה, בטל את הריצה והמשך לזהות את התמונות הלא מעובדות על-ידי מיון תיקיית הפלט וציון שמות התמונות שלא נמצאו.
הערה: התמונות עשויות לדרוש עיבוד נוסף כדי להסיר חפצים גדולים או מוארים מאוד שלא ניתן לעבדם על ידי הצינור. במקרים מסוימים, ייתכן שיהיה צורך להוציא תמונות כאלה מהניתוח. - לאחר ניתוח מלא, התוכנה תארגן את התוצאות לגיליון אלקטרוני של Excel המכיל תולעים בודדות (עמודה N) ומספר הצברים שלהן בהתאמה (עמודה K).
הערה: ריצה מוצלחת תפיק גיליון אלקטרוני של Excel המכיל את מספר הצברים לכל תולעת מזוהה עבור כל באר. ניתן לתמרן נתונים אלה באופן שנקבע על ידי הנסיין. - הורד מארגן מטא-נתונים (ממשק משתמש גרפי) מקובץ משלים 3 (Windows) או מקובץ משלים 4 (Mac) כדי לארגן בנוחות נתונים מקובץ ה- CSV של הפלט מ- CellProfiler.
הערה: לתוכנה זו אין רישיון רשמי והיא לא תיפתח באופן אוטומטי לאחר ההורדה. - בצע את השלבים 9.14-9.17 אם אתה משתמש ב- Windows OS 64 סיביות. התוכנה לא תעבוד על Windows 32 סיביות. בצע את השלבים 9.18-9.20 אם אתה משתמש ב- Mac OS. שלבים 9.21-9.22 זהים עבור שתי מערכות ההפעלה.
- עבור מערכת ההפעלה Windows, אתר את הקובץ שהורדת וחלץ אותו למיקום הרצוי.
- אתר ופתח את התיקיה שחולצה בשם gui_windowsOS_64x והפעל את היישום על ידי לחיצה על סמל היישום "gui".
- בקשה עשויה להיפתח ולבקש הרשאה לפעול. בחר מידע נוסף ולאחר מכן לחץ על אמון בכל מקרה.
- מארגן המטא-נתונים מוכן לגרור ולשחרר קבצי CSV של פלט CellProfiler. המשך לשלב 9.21.
- עבור Mac OS, אתר את הקובץ שהורדת ופתח את gui_macOS_64x.zip. שלב זה אמור לחלץ באופן אוטומטי את כל הקבצים.
- פתח את התיקיה שחולצה ונמצאה ב"הורדות ".
- לחץ לחיצה ימנית על היישום "gui" ובחר פתח. תופיע הנחיה המבקשת רשות לפתוח בשל היעדר רישיון רשמי. בחר פתח והמשך לשלב 9.21.
- לחץ על העלה את הקבצים שלך כאן או גרור ושחרר את קבצי ה- CSV הרצויים של CellProfiler.
- לחץ על לחצן ארגן , אשר יביא את המשתמש למסך חדש באמצעות לחצן הורד קבצים . לחץ על הלחצן ובחר את המיקום הרצוי כדי לשמור את קובץ הפלט. קובץ הפלט יופיע כשם הקובץ המקורי עם הסיומת "_organized" שתתווסף לשם הקובץ.
תוצאות
להלן תהליך עבודה של C. elegans הכולל פרוטוקולי culturing, רכישת תמונה ועיבוד המאפשרים הערכה של צבירת polyQ בנוכחות חיידקים שונים באמצעות פורמט צלחת של 24 בארות כפלטפורמת התרבות וההדמיה (איור 1). ניתן להתאים פרוטוקול זה כדי לחקור את ההשפעה של חיידקים, תנאים ספציפיים, מולקולות קטנות, תרופות או מניפולציות גנומיות על פרוטאוסטזיס מארח. השיטה המתוארת עברה אופטימיזציה באמצעות תולעים המבטאות באופן מכונן את הפולי-Q במעיים שהתמזגו לחלבון פלואורסצנטי צהוב (vha6p::p olyQ44::YFP); עם זאת, מודלים אחרים המדווחים על פרוטאוסטזיס בשרירים או בתאי עצב יכולים לשמש גם עם אופטימיזציה נוספת. לדוגמה, ניסויים ראשוניים מדגימים את היישום של שיטות אלה בכימות אגרגטים של חלבונים ברקמות אחרות כגון PolyQ שריר (איור משלים 1). עם זאת, יידרש שינוי בצינור כדי להתאים כראוי את גודל הצבירה ואת הבהירות, כאמור בסעיף 8 הערה.

איור 1: ייצוג חזותי של זרימת עבודה. השלבים העיקריים של הפרוטוקול כוללים חמישה שלבים נפרדים: הכנת תולעים וסנכרון גיל (שלבים 1-5), התיישבות מעיים/טיפול בתולעים (שלב 6), הכנת דגימה להדמיה (שלב 7), רכישת תמונה (שלב 8) ועיבוד תמונה (שלב 9). "הסעיפים" של הפרוטוקול מוזכרים כ"שלבים " באיור. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
ניסויי האופטימיזציה הראשוניים חשפו קשיים שונים הקשורים לצפיפות יתר עקב מספר רב של צאצאים, וכתוצאה מכך דלדול מזון מהיר יותר. התוספת של FUDR בלוחות NGM המתוארת בסעיף 2 פתרה בעיה זו (איור 2). בנוסף, בנוכחות FUDR, לתולעים שניזונו מחיידקים שונים היה גודל גוף עקבי יותר, מה שאיפשר זיהוי תולעים אחיד ומדויק יותר.

איור 2: השימוש ב-FUDR משפר את איכות התמונה על-ידי הפחתת הצאצאים. צלחות עם תוספת FUDR מבטלות את צאצאי C. elegans בהשוואה לתולעים שגדלו על צלחות NGM שאינן בשליטת FUDR שנזרעו עם E. coli OP50. התמונות נרכשו בהגדלה של פי 25.2 (הגדלה של פי 40 עם מתאם מצלמה של 0.63x). סרגלי קנה מידה = 500 μm. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
פלואורסצנציה ברקע תרמה לזיהוי חיובי כוזב של אגרגטים של polyQ. כדי להפחית אות פלואורסצנטי כזה במערכת העיכול ולשפר את הזיהוי האוטומטי של אגרגטים, היה צורך להקפיא תולעים לפני ההדמיה. הקפאת תולעים בטמפרטורה של -20 מעלות צלזיוס למשך 18-48 שעות שיפרה באופן משמעותי את זיהוי הצבירה של PolyQ על-ידי ביטול פלואורסצנציה ברקע (איור 3A). העין האנושית מסוגלת להבחין בין אגרגטים לפלואורסצנציה של הרקע; מכאן שהספירה הידנית לפני ואחרי ההקפאה זהה (איור 3B). עם זאת, ספירה אוטומטית אינה מדויקת באותה מידה, אך הקפאת ספירות אוטומטיות משופרות באופן משמעותי עם דיוק הדומה לספירה ידנית (איור 3B).

איור 3: הקפאה משפרת את זיהוי הצבירה. (A) תמונות פלואורסצנטיות של C. elegans המבטאות פולי-Q44 במעיים::YFP לפני ואחרי ההקפאה. ההוספה מייצגת תמונות תקריב של האזור שנבחר. סרגלי קנה מידה = 500 μm. (B) המספר הממוצע של אגרגטים לכל מעי בתולעים המיושבות עם P. aeruginosa MPAO1 לפני ואחרי הקפאה באמצעות כימות צבירה ידני או אוטומטי (צינור). הנתונים מייצגים שני שכפולים ביולוגיים (n = 60-109). המובהקות הסטטיסטית חושבה באמצעות מבחן t של סטודנט (**** p < 0.0001). פסי שגיאה מייצגים את שגיאת התקן של הממוצע (SEM). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
תאורת שדה בהיר הפוכה שימשה כדי לזהות את כל ה-C. elegans (איור 4A) ואת ערוץ GFP לתמונה של אגרגטים polyQ44::YFP (איור 4B). זיהוי תולעים, דה-סבך וכימות צבירה עבור כל תולעת נעשו על-ידי החלת צינור עיבוד תמונה ממוטב של CellProfiler (קובץ משלים 1), המאפשר קבלת מספר האגרגטים לכל תולעת בודדת (איור 4C-D). כדי לבחון את ההיתכנות של גישה זו ואת הדיוק של זיהוי וכימות האגרגטים האוטומטיים, תולעים המבטאות polyQ44::YFP ספציפיות למעי עברו תרבית והוכנו להדמיה על פי הפרוטוקולים שנקבעו (סעיפים 1-7). מספר הצברים לכל תולעת הוערך באמצעות הצינור האוטומטי (סעיפים 8-9) או ספירה ידנית. כל ניסוי בוצע בשלושה ניסויים עצמאיים תוך שימוש ב-90-571 תולעים לכל מצב. בעוד שלמספר האגרגטים הממוצע לכל מעי שהתקבלו בשני ניסויים לא היה הבדל משמעותי, לתולעים בניסוי השלישי היו הרבה פחות אגרגטים כאשר כימתו אותם באמצעות הגישה האוטומטית (איור 5A). המספר הממוצע של אגרגטים משלושת הניסויים הביא למעט, אך הרבה פחות אגרגטים כאשר הכימות נעשה באמצעות צינור CellProfiler (סעיפים 8-9) (איור 5B). עם זאת, ההבדל בין שתי הגישות היה מזערי, מה שמעיד על כך שניתן ליישם את השיטה האוטומטית על מסכים בקנה מידה גדול.
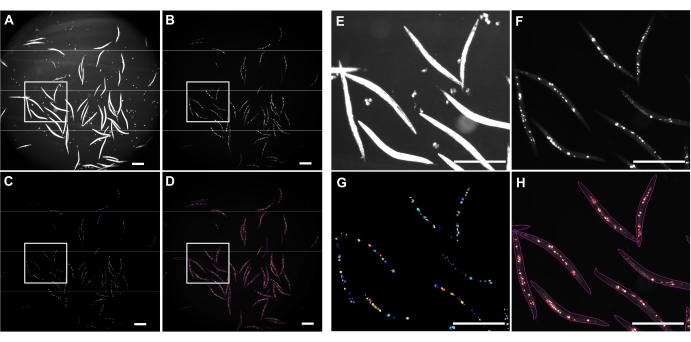
איור 4: זיהוי צבירה באמצעות CellProfiler. (A) תמונת ברייטפילד המשמשת לזיהוי גופי תולעים. (B) תמונה פלואורסצנטית מקורית שנרכשה באמצעות ערוץ GFP ומשמשת לזיהוי וכימות מספר כולל של אגרגטים של פולי-Q44::YFP במעיים. (C) אגרגטים שזוהו באמצעות CellProfiler. (D) מספר כולל של אגרגטים מזוהים שהונחו על גבי התמונה הפלואורסצנטית המקורית עם קווי מתאר של תולעים וצברים. לכידת התמונה ועיבודה בוצעו באמצעות ההגדרות המתוארות בסעיפים 8-9. חלוניות E-H מייצגות תמונות תקריב של האזורים בעלי קווי המתאר המתאימים בתמונות A-D. התמונות נרכשו בהגדלה של פי 25.2 (הגדלה של פי 40 עם מתאם מצלמה של 0.63x). סרגלי קנה מידה = 500 μm. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
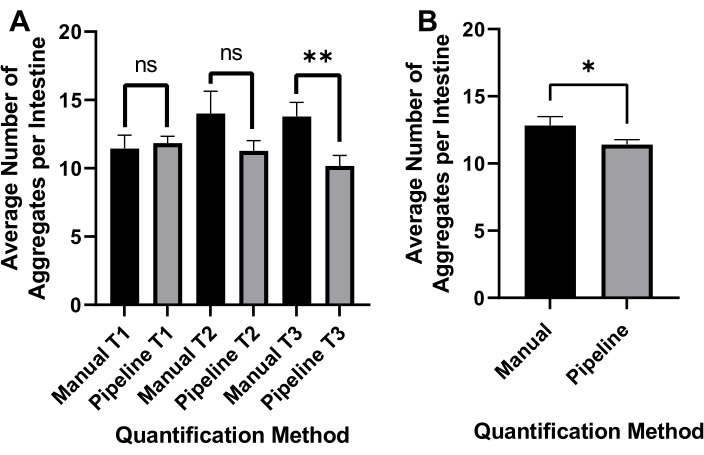
איור 5: יעילות של כימות מצרפי אוטומטי. (A) מספר צבירה ממוצע לכל מעי בתולעים המיושבות עם שליטה E. coli OP50 באמצעות ספירה ידנית (ידנית) וכימות אוטומטי מבוסס CellProfiler (צינור). התוצאות מייצגות נתונים שנותחו בשלושה ניסויים נפרדים (T1-T3) (n = 90-571). (B) המספר הממוצע של אגרגטים לכל מעי הושג באמצעות כימות צבירה ידני או אוטומטי (צינור). המובהקות הסטטיסטית חושבה באמצעות מבחן t של התלמיד (* p < 0.05, ** p < 0.01). פסי שגיאה מייצגים את SEM. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
כדי להעריך את יכולת השכפול של התוצאות בקרב נסיינים שונים, תמונות מצלחת המכילה שש בארות של תולעים שניזונו מ-Pseudomonas aeruginosa MPAO1 או Escherichia coli OP50, נרכשו על ידי שלושה פרטים, שלשניים מהם לא היה ניסיון קודם בהדמיית תולעים באמצעות פרוטוקולים אלה. תמונות שנאספו מכל באר הכילו בין 30-115 תולעים שזוהו. הבדל לא משמעותי בצבירה זוהה בתולעים מאותן בארות שצולמו על ידי שלושת הנסיינים. בעוד שהמספר הממוצע של אגרגטים לכל מעי נותר עקבי מאוד בין שלושת הנסיינים של תולעים שניזונו מ-MPAO1 ו-OP50, היו כמה הבדלים מובהקים סטטיסטית במספר האגרגטים הממוצע, אך רק בתולעים שיושבו על-ידי MPAO1 (איור משלים 2). תוצאות אלה מדגישות את יכולת השכפול של התוצאות גם בין נסיינים חסרי ניסיון.
כדי להבטיח כי יכולת השחזור של כימות הצבירה לא תושפע באופן משמעותי ממיקום התולעת, נבחרה קבוצה של 15 תולעים וצולמה 15 פעמים נפרדות לאחר תסיסה בין כל לכידת תמונה באמצעות קצה פיפטה. תמונות של אגרגטים בתולעים שניזונו מ - E. coli OP50 ו- P. aeruginosa MPAO1 נאספו ונותחו באמצעות CellProfiler. המספר הממוצע של אגרגטים מכל אחת מקבוצות התמונות השונות הללו היה שונה במקצת אך לא באופן משמעותי, מה שתמך עוד יותר ביכולת השכפול של גישה זו (איור משלים 3).
התיישבות של המעי C. elegans עם פתוגנים אנטריים גראם שליליים הוכחה כמשבשת פרוטאוסטזיס על פני רקמות, כאשר P. aeruginosa הוא בין הגורמים החזקים ביותר של צבירת polyQ9. כדי לקבוע אם הפרוטוקולים הממוטבים האלה יצליחו לזהות ולכמת שיפור בצבירה בתיווך P. aeruginosa, נערכו תולעים המבטאות פוליQ במעיים עם E. coli OP50 (חיידקי בקרה), ו- P. aeruginosa MPAO1, נערכו סעיפים 1-8. התמונות שנרכשו נותחו באמצעות CellProfiler (סעיף 9, קובץ משלים 1). התוצאות של כימות אוטומטי מראות עלייה משמעותית במספר האגרגטים המושרים על-ידי P. aeruginosa MPAO1, וכתוצאה מכך נוצר שיפור של פי שניים בהשוואה לתולעים המוזנות בבקרה E. coli OP50 (איור 6).

איור 6: המספר הממוצע של אגרגטים לכל מעי בתולעים המתיישבות עם שליטה E. coli OP50 ו - P. aeruginosa MPAO1. מספר האגרגטים לכל מעי הוערך באמצעות CellProfiler (סעיפים 8-9). הנתונים מיוצגים כמספר הממוצע של אגרגטים לכל מעי בתולעים המתיישבות עם OP50 (n = 1068) ו- MPAO1 (n = 1557). המובהקות הסטטיסטית חושבה באמצעות מבחן t של סטודנט (**** p < 0.0001). פסי שגיאה מייצגים את SEM. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
הצינור הממוטב תוכנן לתמוך במסכים בקנה מידה גדול עבור תנאים המשפיעים על פרוטאוסטזיס. כדי לבחון את ההיתכנות של גישה זו בסינון ספריות גדולות של חיידקים על השפעתם על פרוטאוסטזיס מארח, נעשה שימוש בצינור המתואר כאן (סעיפים 1-9) כדי לבחון את ההשפעה של 90 P. aeruginosa זנים מוטנטיים שאינם חיוניים על צבירה של גנים לא חיוניים על צבירת polyQ18. מסך פיילוט זה הוא חלק מפרויקט גדול יותר שנועד לסנן את כל הזנים המוטנטיים הלא חיוניים של P. aeruginosa עבור יכולתם להשפיע על פרוטאוסטזיס מארח. מתוך 90 זני חיידקים שנבדקו, התיישבות במעי C. elegans עם מועמד אחד הראתה ירידה משמעותית במספר האגרגטים (איור 7). ניסויי המשך להערכת הרגישות של בדיקה זו בוצעו באמצעות ספירות מצטברות ידניות מתוך בחירה אקראית של שישה מוטציות P. aeruginosa שהיו שונות באופן לא משמעותי מבקרת MPAO1. ניסויים אלה בוצעו באמצעות לוחות NGM מסורתיים יותר בקוטר 6 ס"מ, והעבירו תולעים לזני בדיקה כ-L1 כדי לשחזר שיטותמבוססות 9 שנקבעו בעבר. ניסויי האישור על ידי ספירה ידנית גילו שאף אחד מהמוטאנטים, כולל זה שהפחית באופן משמעותי את מספר האגרגטים (איור 7), לא השפיע על צבירה של polyQ (איור משלים 4). בנוסף, השינויים העדינים בצבירה שנצפו במסך של 90 הזנים המוטנטיים לא זוהו בקרב ספירות ידניות של מועמדים נבחרים, מה שמצביע על כך ששינויים כאלה יכולים להיווצר בגלל השתנות ביולוגית וניסויית, כגון ערך n נמוך. באופן קולקטיבי, התוצאות מצביעות על כך שבעוד שהשיטה שלנו יכולה לקלוט באופן אמין שינויים משמעותיים, עדינים ככל הנראה יחסרו, וכל המועמדים הפוטנציאליים יצטרכו להיות מאושרים בנפרד.

איור 7: מספר הצברים לכל מעי במדגם מייצג של תולעים מיושב על ידי 92 זני חיידקים. הנתונים מיוצגים כמספר הממוצע של אגרגטים לכל מעי המנורמל לזה של תולעים המתיישבות עם MPAO1. קווים מנוקדים מייצגים את המספר הממוצע של אגרגטים בתולעים המיושבות ב-MPAO1 (עיגול עליון, פתוח) ובקרת OP50 (למטה, ריבוע פתוח). סמלים מוצקים מייצגים 90 זנים מוטנטיים מובהקים של P. aeruginosa MPAO1. המספר הממוצע של אגרגטים לכל תולעת בין תולעים שהתיישבו עם MPAO1 לבין מוטציה בודדת היה מובהק סטטיסטית. עיגולים אפורים מייצגים דגימות שאושרו באופן ידני (איור משלים 4). המובהקות הסטטיסטית חושבה באמצעות ניתוח חד-כיווני של שונות (ANOVA) ואחריו השוואה מרובה המבחן שלאחר ההוק של דאנט (** p < 0.01, **** p < 0.0001). פסי שגיאה מייצגים את SEM. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
כדי לנהל את כמות הנתונים הגדולה שנוצרה על-ידי CellProfiler, פותח ממשק משתמש גרפי (GUI) כדי להפוך את עיבוד הנתונים והארגון לאוטומטיים (איור 8). ממשק המשתמש הגרפי פותח באמצעות Tkinter, ערכת כלים של ווידג'טים חוצי פלטפורמות של Python בקוד פתוח. מהמטא-נתונים הנתונים הנתונים, היישום מחלץ את מספר האגרגטים (עמודה K) מכל באר (עמודה J) הנמצאת בלוח. ספריית טיפול בנתונים של Python בשם "פנדות" שימשה לביצוע התהליך הנ"ל. יישום GUI מספק תמיכה בגרירה ושחרור למשתמשים כדי להעלות קבצי נתונים. הנתונים בכל קובץ מאוחסנים בצורה של מבנה טבלאי דו-ממדי הנקרא מסגרת נתונים. זוג מילונים ריקים מאותחל עבור כל באר ייחודית שנמצאת במסגרת הנתונים. לאחר מכן, האגרגטים המובהקים שנמצאים בכל באר נספרים ונספחים לזוגות המילונים המתאימים להם. העמודה עם הנתונים הפחותים מרופדת במחרוזות ערכיות ריקות כדי להבטיח שכל עמודה תהיה אחידה בגודלה. לבסוף, המבנה מומר למסגרת נתונים המיוצאת בצורה של גיליון אלקטרוני לספרייה שצוינה על-ידי המשתמש.

איור 8: ממשק משתמש גרפי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
איור משלים 1: זיהוי של אגרגטים פולי-Q ספציפיים לשריר. תולעים המבטאות polyQ35::YFP ספציפיות לשריר צויפו כ-L1s ותורתו ב-OP50 במשך 48 שעות. ברגע שהתולעים התפתחו למבוגרים צעירים, הן הועברו לצלחות NGM של 24 בארות, בתוספת 100 מיקרוגרם/מ"ל FUDR ונזרעו עם MPAO1 למשך 72 שעות נוספות לפני ההדמיה. (A) תמונת ברייטפילד המשמשת לזיהוי גופות תולעים. (B) תמונה פלואורסצנטית מקורית שנרכשה באמצעות ערוץ GFP. (C) אגרגטים שזוהו באמצעות CellProfiler. (D) מספר כולל של אגרגטים מזוהים שהונחו על גבי התמונה הפלואורסצנטית המקורית עם קווי מתאר של תולעים וצברים. לכידת התמונה ועיבודה בוצעו באמצעות ההגדרות המתוארות בסעיפים 8-9. חלוניות E-H מייצגות תמונות תקריב של האזורים בעלי קווי המתאר המתאימים בתמונות A-D. סרגלי קנה מידה = 500 μm. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים 2: שכפול של כימות מצרפי בין נסיינים שונים. מספר ממוצע של אגרגטים שכומתו באמצעות CellProfiler עבור שש בארות של תולעים שהתיישבו עם P. aeruginosa MPAO1 (פסים שחורים) ושש בארות של תולעים שהתיישבו עם שליטה E. coli OP50 (פסים אפורים). כל באר צולמה על ידי שלושה נסיינים (AVS, DMC, RDH). הנתונים מיוצגים כמספר הממוצע של אגרגטים לכל מעי (n = 30-115). המובהקות הסטטיסטית חושבה באמצעות ANOVA חד-כיווני ואחריו מבחן ההשוואות המרובות של Tukey (* p < 0.05, ** p < 0.01). סרגלי שגיאות מייצגים את SEM. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים 3: ההשפעה של מיקום התולעת על יכולת השכפול של כימות הצבירה. מספר מצטבר ממוצע לכל מעי בתולעים המתיישבות עם שליטה E. coli OP50 (פסים אפורים) ו - P. aeruginosa MPAO1 (פסים שחורים). התוצאות מייצגות את המספר הממוצע של אגרגטים לכל מעי (15≥n≥12) המכומתים באמצעות CellProfiler. מיקומן של התולעים בתוך הבארות השתנה על ידי תסיסה בין כל רכישה. באף אחת מהקבוצות לא נמצאו הבדלים מובהקים סטטיסטית. המובהקות הסטטיסטית חושבה באמצעות ANOVA חד-כיוונית ולאחר מכן מבחן ההשוואות המרובות של טוקי. סרגלי שגיאות מייצגים את SEM. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים 4: אישור מסך הפיילוט באמצעות ספירה ידנית. המספר הממוצע של אגרגטים לכל מעי כומת באופן ידני. הנתונים מייצגים פרופילי צבירה של תולעים המיושבות בשישה מוטציות נוק-אאוט MPAO1 (עיגולים אפורים איור 7) בהשוואה לבקרות MPAO1 ו-OP50 מסוג פראי (n = 30). המובהקות הסטטיסטית חושבה באמצעות ANOVA חד-כיוונית ולאחר מכן השוואה מרובת השוואות מבחן הפוסט-הוק של דאנט (**** p < 0.0001). סרגלי שגיאות מייצגים את SEM. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים 5: ההשפעה של FUDR על צבירה של פולי-Q במעיים. הנתונים מיוצגים כמספר הממוצע של צבירי polyQ44::YFP לכל מעי (n = 20). התולעים הועברו ללוחות בקרה (ללא FUDR) או FUDR המכילים FUDR (100 מיקרוגרם/מ"ל) לאחר 48 שעות של צמיחה ב-25 מעלות צלזיוס ב-E. coli OP50. ספירות ידניות נאספו לאחר 48 שעות נוספות. המובהקות הסטטיסטית חושבה באמצעות מבחן t של סטודנט (ns = לא משמעותי). סרגלי שגיאות מייצגים את SEM. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 1: צינור פרוטאוסטזיס. צינור ניתוח תמונות להורדה לשימוש ב- CellProfiler. הוראות להגשת מועמדות ניתן למצוא בסעיף 9. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 2: סט אימון להתיר תולעת מסתבכת. קובץ שיש להעלות למודול "להתיר תולעים סבך". ערכת אימונים מסוימת זו היא ספציפית לתולעים ששימשו בגישה הראשונית. שינויים בגודל ובצורת התולעת ישנו את הדיוק והאיכות של הזיהוי. ייתכן שיהיה צורך ליצור קובץ הדרכה מותאם אישית יותר. הוראות ליצירת ערכת אימונים חדשה ניתן למצוא באתר הרשמי של CellProfiler17. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 3: ממשק משתמש גרפי עבור מערכת ההפעלה Windows. gui_windowsOS_64x.zip. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 4: ממשק משתמש גרפי למערכת ההפעלה Mac. gui_MacOS_64x.zip. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
הפרוטוקול המתואר מתווה נהלים עבור גידול, הדמיה ועיבוד תמונה של C. elegans המשלבים את CellProfiler, תוכנה לניתוח תמונות בקוד פתוח. התוצאות הייצוגיות מדגימות יכולת שכפול, הפחתת הטיה ומדרגיות. הליך סטנדרטי זה ישפר את אסטרטגיות הסינון המופעלות בספריות חיידקים, גנומיות או תרופות גדולות. בעוד ששיטות אוטומטיות אחרות של C. elegans לזיהוי אובייקטים קיימות, הטכניקה המתוארת מציעה צינור סטנדרטי בעל תפוקה גבוהה יותר המשלב תרבות, רכישת תמונה וניתוח.
היה צורך לבחון מספר וריאציות של גידול תולעים כדי לייעל את הפרוטוקול המתואר כאן. בתחילה, תולעים הועברו לדגימת חיידקים מיד לאחר סנכרון הגיל (שלב L1). עם זאת, גישה כזו הביאה לאוכלוסייה של תולעים בגדלים משתנים, אפילו בקרב תולעים בתוך אותה באר. C. elegans ידועים בהימנעות מפתוגנים19, מה שיכול היה לתרום לשונות הנצפית בגודל ובסופו של דבר להשפיע על זיהוי תולעי הדמיה במורד הזרם, בפרט. כדי למנוע שונות כזו, כל אזור ה-NGM בכל באר כוסה בחיידקי בדיקה. יתר על כן, תולעים הוזנו E. coli OP50 והותר להן להתפתח באופן מלא למבוגרים צעירים במשך 48 שעות בטמפרטורה של 25 מעלות צלזיוס. מתן אפשרות לתולעים להגיע לבגרות על E. coli OP50 לפני העברתן לחיידקי בדיקה הביא לגודל גוף עקבי יותר. בנוסף, צפיפות יתר ודלדול מזון מהיר על ידי צאצאים בוטלו על ידי תוספת NGM אגר עם FUDR. היישום של FUDR הסיר את הצאצאים ושיפר את זיהוי התולעים האוטומטי, שהוסתר על ידי התערבבות צאצאים עם אוכלוסיית ההורים. עם זאת, חשוב להיות זהירים ולהשתמש בבקרות מתאימות בעת שימוש ב- FUDR, שכן ידוע כי התרכובת משפיעה על C. elegans proteostasis ועל תוחלת החיים20,21. בתנאים המתוארים בפרוטוקול זה, FUDR לא השפיע על צבירה של פולי-Q במעיים (איור משלים 5); לכן, השימוש בו היה מתאים ומועיל לשיטה המתוארת.
הקפאת דגימות לפני ההדמיה התבררה כשלב קריטי בהעסקה מוצלחת של הצינור. הספירות המצטברות לפני ההקפאה היו גבוהות משמעותית מהספירה הידנית (איור 3B). שמירה על תולעים בטמפרטורה של -20 מעלות צלזיוס למשך 18-48 שעות לפני ההדמיה הפחיתה את הפלואורסצנציה ברקע ובסופו של דבר שיפרה את זיהוי הצבירה (איור 3A). ההשפעות של הקפאה על זיהוי צבירה נחקרו רק עבור polyQ ואין להכליל אותן למודלים אחרים ללא חקירה נוספת של השפעות כאלה.
למרות שכל התנאים נשמרו זהים, נצפה כי המספר הממוצע של אגרגטים לכל תולעת יכול להשתנות בין ריצות שונות, בעוד שהיחס בין מספר האגרגטים בבעלי חיים המיושבים עם OP50 לעומת MPAO1 נשאר עקבי (איור 6, איור משלים 2, איור משלים 5). לכן, חיוני לכלול תמיד פקד E. coli OP50, או כל פקדי ייחוס מתאימים נוספים, בכל ריצה. שונות כזו בספירה המצטברת בין הניסויים עשויה להיות מושפעת מתנאי הסביבה (טמפרטורה, לחות)22,23 או מרקע גנטי8. למעשה, נצפה כי לאחר תרבית ממושכת, פלואורסצנציה במעיים ירדה באופן דרסטי או אבדה לחלוטין, מה שדרש הפשרת זן חדש ממלאי קפוא. הירידה הנצפית בפלואורסצנציה יכולה להיות תוצאה של שינויים גנטיים המדכאים טרנסגנים רעילים, כמו אלה המבטאים פולי-קיו. עם זאת, יכולת השחזור יוצאת הדופן של התוצאות שנצפו בין נסיינים שונים (איור משלים 2), בין שכפולים ביולוגיים (איור 5), ובתוך אותה דגימה (איור משלים 3) מדגישה את חוזקה של גישה זו.
דיווחים רבים השתמשו בפולי-Q במעיים כדי לחקור פרוטאוסטזיס 9,11,12,13,24,25. עם זאת, השוואה ישירה בין התוצאות אינה יכולה להיעשות בשל שונות בין גישות ניסיוניות ושיטות קריאה. עם זאת, כמה תוצאות מנתונים שפורסמו בעבר מסוכמות על ידי הכימות האוטומטי המתואר כאן, כולל אינדוקציה חיידקית של צבירה 9,13 ומספר דומה של אגרגטים11. באופן קולקטיבי, הצינור המתואר מציע כלי רב ערך לחקר פרוטאוסטזיס.
לשיטה המתוארת כאן יש כמה אתגרים מובנים. לדוגמה, זה דורש מספיק זמן כדי לשלוט בכל הרכיבים של פרוטוקול זה, וזה נכון במיוחד עבור סעיף 8 של הפרוטוקול, אשר דורש היכרות עם הבדיקה כדי לקבוע אם התמונות שנרכשו מתאימות לניתוח צינור. סטיות מהגדרות רכישת התמונה המשמשות בפרוטוקול זה אפשריות; עם זאת, סביר להניח שיידרש שינוי של ההגדרות וערכת האימונים של התולעים. צינור זה יכול להבחין בין אגרגטים בגדלים שונים לבין אלה שנוגעים בהם, מה שמגביל את "המיזוג" של אגרגטים ובסופו של דבר מגביר את רגישות הזיהוי. עם זאת, בעיות עלולות להתעורר בעת ניסיון לזהות אגרגטים גדולים החורגים מטווח הגודל המקובל, שכן הרחבת סף הגודל העליון עלולה להוביל לשגיאות הנגרמות על ידי זיהוי לקוי, כגון חוסר היכולת להבחין בין אגרגטים שנוגעים ללב. יש למצוא איזון בין דיוק, גודל ועוצמה לפני ניתוח התמונה. ניתן לשפר עוד יותר את היעילות של זיהוי הצבירה על ידי שילוב למידת מכונה ליצירת רשת עצבית המסוגלת לשפר את זיהוי הצבירה. שיפורים כאלה נבחנים כעת ויסייעו מאוד לטפל בבעיות אקטואליות כגון זיהוי אגרגטים הנמצאים במישורי מוקד שונים או בעלי צורות חריגות.
אחת החולשות הבולטות של השיטה המתוארת היא השונות בספירת אגרגטים אוטומטית, שכן הן לא תמיד משוחזרות על ידי ספירות ידניות בתולעים הניזונות מזני חיידקים שונים. לדוגמה, בהתבסס על ספירות אוטומטיות, לתולעים שניזונו ממוטציה P. aeruginosa 53 (M53) היו הרבה פחות אגרגטים בהשוואה לזן מסוג בר (MPAO1) (איור 7); עם זאת, אישור הפגיעה לא הראה הבדל משמעותי (איור משלים 4). באופן כללי, למסכי סמים בעלי תפוקה גבוהה יש שיעור גבוה של זיהוי פגיעות חיוביות כוזבות, והשיטה המתוארת אינה יוצאת דופן26. לפיכך, זהו חלק קריטי בפרוטוקול כדי לאשר את כל הפגיעות הפוטנציאליות.
בעוד שפרוטוקול זה הותאם כך שיתאים לאסטרטגיית סינון לזיהוי חיידקים המשפיעים על פרוטאוסטזיס מארח, ניתן לשנות כל שלב עוד יותר כדי לבחון את ההשפעה של ספריות RNAi גנומיות, מולקולות קטנות או תנאים אחרים. ניתן לבצע שינויים נוספים בכל שלב כדי להתאים לדרישות של אסטרטגיית סינון ספציפית. יתר על כן, טכניקה זו מספקת רמה של גמישות המאפשרת אופטימיזציה של כל שלב כך שתתאים למודל מסוים. לדוגמה, ניתן להרחיב גישה זו לצבירת polyQ ברקמות אחרות או לחילוץ תכונות אחרות שזוהו בתמונות כגון ניטור ביטוי גנים באמצעות כתבים פלואורסצנטיים בלתי ניתנים להשראה (למשל, גנים של הלם חום), הערכת לוקליזציה תת-תאית של חלבונים (למשל, לוקליזציה גרעינית של DAF-16), חקר צבירה במודלים אחרים של מחלות (Aβ1-42, α-סינוקלאין, TDP-43 וכו ') או הערכת פנוטיפים פיזיולוגיים, כגון גודל תולעת.
Disclosures
המחברים הצהירו כי לא קיימים ניגודי עניינים.
Acknowledgements
עבודה זו נתמכה על ידי המכונים הלאומיים לבריאות (1RO3AG069056-01) והאגודה למחלות זיהומיות של אמריקה המממנת ל- DMC. למממנים לא היה כל תפקיד בתכנון המחקר, באיסוף וניתוח הנתונים, בהחלטה על פרסום או בהכנת כתב היד. אנו מודים לחברי מעבדת Czyz על ההגהה של כתב היד. דמויות מצוירות נוצרו באמצעות רישיון בתשלום של BioRender.
Materials
| Name | Company | Catalog Number | Comments |
| 1.7 mL Microtubes | Olympus Plastics | Cat#24-282 | Microcentrifuge tubes |
| 10 mL Serological Pipettes | GenClone | Cat#12-104 | Plastic pipettes |
| 15 mL Centrifuge Tubes, Racked | Olympus Plastics | Cat#28-101 | Conical tubes |
| 5-Fluoro-2′-deoxyuridine | Fisher Scientific | D2235100MG | FUDR |
| Accu-jet Pro Pipette Controller | Genesee Scientific | 91-600RB | Pipette gun |
| Agar | Fisher Scientific | Cat#BP1423-2 | Granulated agar |
| BioRender | BioRender | Graphical figure generator | |
| Bleach (Regular) | Clorox | Bar# 044600324111, Splash-less Bleach | 4.5% sodium hypochlorite |
| C. elegans: AM140: rmIs132 [unc-54p::q35::yfp] | Morimoto Lab (Northwestern University) | AM140, Q35::YFP | Muscle polyQ |
| C. elegans: AM738: rmIs297[vha-6p::q44::yfp; rol-6(su1006)] | Morimoto Lab (Northwestern University) | AM738, Q44::YFP | Intestinal polyQ |
| CaCl2·2H2O | Fisher Scientific | Cat#C79-500 | Calcium chloride dihydrate |
| CellProfiler | Broad Institute | Image analysis software | |
| Cholesterol | Fisher Scientific | Cat#ICN10138201 | Cholesterol |
| Circulating Water Bath Head | Lauda | 26LE | Lauda E 100 |
| CoolLED pE300lite 365 dir mount STEREO | CoolLED | 8114931 | Fluorescent light control and emitter |
| 16 mL Culture Tubes | Olympus Plastics | 21-129 | Culture tubes, 17 mm x 100 mm |
| Escherichia coli OP50 | Caenorhabditis Genetics Center | OP50 | E. coli control strain |
| Ethanol, 200 Proof | Decon Labs, Inc. | 2701 | |
| Eyepiece 10x/23B, adjustable, 3d gen | Leica Microsystems | 10450910 | Eyepiece set |
| Filter Set ET GFP - MZ10F | Leica Microsystems | 10450588 | Filter cube |
| GraphPad Prism v9.2.0 | GraphPad Software, Inc. | Statistical analysis tool | |
| Heratherm Incubator IMP180 | Thermo | 51031562 | Refrigerated incubator |
| Innova 4000 | New Brunswick Scientific | M1192-0000 | Shaking incubator |
| K5 Camera | Leica Microsystems | 11547112 | Stereomicroscope camera |
| KH2P04 | Fisher Scientific | Cat#P285-3 | Potassium phosphate monobasic |
| LAS X Imaging Software | Leica Microsystems | Microscope imaging software | |
| Leica MZ10 F Optics Carrier | Leica Microsystems | 10450103 | Stereomicroscope |
| Levamisole | Fisher Scientific | Cat#0215522805 | Levamisole hydrochloride |
| Luria Broth (Lennox) | Apex Bioresearch Products | Cat#11-125 | LB |
| Magnetic Stir Plate | Fisher Scientific | 11-100-49S | Stir plate |
| MgSO4·7H2O | Alfa Aesar | A14491 | Magnesium sulfate heptahydrate |
| Microscope Slides | Premiere | 8205 | Single frosted microscope slides |
| Na2HPO4·7H2O | Fisher Scientific | Cat#S373-500 | Sodium phosphate dibasic heptahydrate |
| NaCl | Fisher Scientific | Cat#S671-500 | Sodium chloride |
| NaOH | Fisher Scientific | Cat#S318-3 | Sodium hydroxide pellets |
| Objective Achromat, f = 100 mm | Leica Microsystems | 10411597 | Objective microscope lens |
| Petri Dishes | Genesee Scientific | Cat#32-107G | 100 mm x 15 mm |
| Pseudomonas aeruginosa Mutant Library | Manoil Lab (University of Washington) | P. aeruginosa mutant library | |
| Suspension Culture Plate 24-Well, Flat Bottom | Olympus Plastics | 25-102 | Used for worm growth and imaging |
| Trinocular Tube 100% M-series | Leica Microsystems | 10450043 | |
| Trypticase Peptone | ThermoFisher, Difco | Cat#211921 | |
| TX-400 Rotor | Thermo Scientific | Cat#75003181 | Swing bucket rotor |
| Vacuum Driven Filter System | GenClone | Cat#25-227 | 500 mL, PES Membrane, .22 µm |
| Video Objective with C-Mount | Leica Microsystems | 10447367 | 0.63x camera adapter tube |
References
- Soto, C. Unfolding the role of protein misfolding in neurodegenerative diseases. Nature Reviews Neuroscience. 4 (1), 49-60 (2003).
- Fang, P., Kazmi, S. A., Jameson, K. G., Hsiao, E. Y. The microbiome as a modifier of neurodegenerative disease risk. Cell Host & Microbe. 28 (2), 201-222 (2020).
- Kundu, P., Blacher, E., Elinav, E., Pettersson, S. Our gut microbiome: The evolving inner self. Cell. 171 (7), 1481-1493 (2017).
- Sherwin, E., Dinan, T. G., Cryan, J. F. Recent developments in understanding the role of the gut microbiota in brain health and disease. Annals of the New York Academy of Sciences. 1420 (1), 5-25 (2018).
- Mondal, S., et al. Large-scale microfluidics providing high-resolution and high-throughput screening of Caenorhabditis elegans poly-glutamine aggregation model. Nature Communications. 7 (1), 13023(2016).
- Guisbert, E., Czyz, D. M., Richter, K., McMullen, P. D., Morimoto, R. I. Identification of a tissue-selective heat shock response regulatory network. PLoS Genetics. 9 (4), 1003466(2013).
- Silva, M. C., et al. A genetic screening strategy identifies novel regulators of the proteostasis network. PLoS Genetics. 7 (12), 1002438(2011).
- Nollen, E. A., et al. Genome-wide RNA interference screen identifies previously undescribed regulators of polyglutamine aggregation. Proceedings of the National Academy of Sciences of the United States of America. 101 (17), 6403-6408 (2004).
- Walker, A. C., et al. Colonization of the Caenorhabditis elegans gut with human enteric bacterial pathogens leads to proteostasis disruption that is rescued by butyrate. PLOS Pathogens. 17 (5), 1009510(2021).
- Goya, M. E., et al. Probiotic Bacillus subtilis protects against α-Synuclein aggregation in C. elegans. Cell Reports. 30 (2), 367-380 (2020).
- Kumsta, C., Chang, J. T., Schmalz, J., Hansen, M. Hormetic heat stress and HSF-1 induce autophagy to improve survival and proteostasis in C. elegans. Nature Communications. 8, 14337(2017).
- Prahlad, V., Morimoto, R. I. Neuronal circuitry regulates the response of Caenorhabditis elegans to misfolded proteins. Proceedings of the National Academy of Sciences of the United States of America. 108, 14204-14209 (2011).
- Mohri-Shiomi, A., Garsin, D. A. Insulin signaling and the heat shock response modulate protein homeostasis in the Caenorhabditis elegans intestine during infection. Journal of Biological Chemistry. 283 (1), 194-201 (2008).
- Hakim, A., et al. WorMachine: machine learning-based phenotypic analysis tool for worms. BMC Biology. 16 (1), 8(2018).
- Wählby, C., et al. An image analysis toolbox for high-throughput C. elegans assays. Nature Methods. 9 (7), 714-716 (2012).
- Jones, T. R., et al. CellProfiler Analyst: data exploration and analysis software for complex image-based screens. BMC Bioinformatics. 9 (1), 482(2008).
- CellProfiler: an open-source image analysis software. , Available from: http://www.cellprofiler.org (2021).
- Held, K., Ramage, E., Jacobs, M., Gallagher, L., Manoil, C. Sequence-verified two-allele transposon mutant library for Pseudomona aeruginosa PA01. Journal of Bacteriology. 194 (23), 6387-6389 (2012).
- Schulenburg, H., Ewbank, J. J. The genetics of pathogen avoidance in Caenorhabditis elegans. Molecular Microbiology. 66 (3), 563-570 (2007).
- Feldman, N., Kosolapov, L., Ben-Zvi, A. Fluorodeoxyuridine improves Caenorhabditis elegans proteostasis independent of reproduction onset. PLoS One. 9 (1), 85964(2014).
- Van Raamsdonk, J. M., Hekimi, S. FUdR causes a twofold increase in the lifespan of the mitochondrial mutant gas-1. Mechanisms of Ageing and Development. 132 (10), 519-521 (2011).
- Haldimann, P., Muriset, M., Vígh, L., Goloubinoff, P. The novel hydroxylamine derivative ng-094 suppresses polyglutamine protein toxicity in Caenorhabditis elegans. Journal of Biological Chemistry. 286 (21), 18784-18794 (2011).
- Shinn-Thomas, J. H. Wrapping culture plates with Parafilm M® increases Caenorhabditis elegans growth. BMC Research Notes. 12 (1), (2019).
- Alexander-Floyd, J., et al. Unexpected cell type-dependent effects of autophagy on polyglutamine aggregation revealed by natural genetic variation in C. elegans. BMC Biology. 18 (1), 18(2020).
- Moronetti Mazzeo, L. E., Dersh, D., Boccitto, M., Kalb, R. G., Lamitina, T. Stress and aging induce distinct polyQ protein aggregation states. Proceedings of the National Academy of Sciences of the United States of America. 109 (26), 10587-10592 (2012).
- Sink, R., Gobec, S., Pecar, S., Zega, A. False positives in the early stages of drug discovery. Current Medicinal Chemistry. 17 (34), 4231-4255 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved