Method Article
ניתוח כיח מבוקר איכות לפי ציטומטריית זרימה
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מתאר שיטה יעילה לניתוק כיח למתלה תא בודד ואת האפיון הבא של תת-קבוצות סלולריות בפלטפורמות ציטומטריות סטנדרטיות של זרימה.
Abstract
כיח, בשימוש נרחב כדי ללמוד את התוכן התאי ותכונות מיקרו-ויברונמנטליות אחרות כדי להבין את בריאות הריאה, מנותח באופן מסורתי באמצעות מתודולוגיות מבוססות ציטולוגיה. השירות שלה מוגבל כי קריאת השקופיות גוזלת זמן רב ודורש כוח אדם מיוחד מאוד. יתר על כן, פסולת נרחבת ונוכחות של יותר מדי תאי אפיתל קשקשיים (SECs), או תאי הלחי, לעתים קרובות הופך מדגם לא מספיק לאבחון. לעומת זאת, ציטומטריית הזרימה מאפשרת פנוטיפינג בעל תפוקה גבוהה של אוכלוסיות הסלולר ובו זמנית למעט פסולת ו- SECs.
הפרוטוקול המוצג כאן מתאר שיטה יעילה לניתוק כיח לתוך מתלה תא יחיד, כתם נוגדנים ותיקון אוכלוסיות הסלולר, ולרכוש דגימות על פלטפורמה ציטומטרית זרימה. אסטרטגיית גטינג המתארת את הדרת הפסולת, תאים מתים (כולל SECs) ומכפילי תאים מוצגת כאן. יתר על כן, עבודה זו מסבירה גם כיצד לנתח תאי כיח יחיד קיימא המבוססים על אשכול של בידול (CD)45 אוכלוסיות חיוביות ושליליות כדי לאפיין תת-קבוצות שושלת hematopoietic ושושלת אפיתל. אמצעי בקרת איכות מסופק גם על ידי זיהוי מקרופאגים ספציפיים לריאות כראיה לכך שדגימה נגזרת מהריאה ואינה רוק. לבסוף, הוכח כי שיטה זו יכולה להיות מיושמת על פלטפורמות ציטומטריות שונות על ידי מתן פרופילי כיח מאותו חולה שנותח על שלושה ציטומטרים זרימה; Navios EX, LSR II, וליריק. יתר על כן, פרוטוקול זה ניתן לשנות כדי לכלול סמנים סלולריים נוספים של עניין. שיטה לניתוח דגימת כיח שלמה על פלטפורמה ציטומטרית זרימה מוצגת כאן מה שהופך את הליחה למקובלת לפיתוח אבחון בעל תפוקה גבוהה של מחלת ריאות.
Introduction
ההתקדמות הטכנית בחומרה ובתוכנה של ציטומטרי זרימה אפשרה לזהות אוכלוסיות תאים נפרדות רבות בו זמנית1,2,3,4. הניצול של cytometer הזרימה במחקר תאים hematopoietic, למשל, הוביל להבנה הרבה יותר טובה של המערכת החיסונית2 ואת ההיררכיה התאית של המערכת hematopoietic5, כמו גם הבחנה אבחונית של שפע של סרטן דם שונים6,7,8. למרות שרוב תאי הכיח הם ממוצא hematopoietic9,10,11, ציטומטריית זרימה לא יושם באופן נרחב על ניתוח כיח למטרות אבחון. עם זאת, מספר מחקרים מראים כי ההערכה של אוכלוסיות תאי מערכת החיסון בליחה (תת קבוצת התאים המשמעותית ביותר) עשויה לעזר רב באבחון ו/או ניטור מחלות כגון אסתמה ומחלת ריאות חסימתית כרונית (COPD)12,13,14,15. יתר על כן, קיומם של סמנים ספציפיים לאפיתל שניתן להשתמש בהם בציטומטריית זרימה מאפשר לחקור את תת-קבוצה משמעותית ביותר של תאים בליחה, תאי אפיתל ריאות.
בנוסף ליכולת לנתח אוכלוסיות תאים נפרדות רבות ממקורות רקמות שונות, cytometer זרימה יכול להעריך מספר גדול של תאים בתקופה קצרה יחסית. לשם השוואה, סוגים ציטולוגיים מבוססי שקופיות של ניתוחים דורשים לעתים קרובות כוח אדם ו / או ציוד מיוחדים מאוד. ניתוחים אלה יכולים להיות עתירי עבודה, מה שמוביל רק לחלק ממדגם הכיח המנותח16.
שלוש בעיות קריטיות מגבילות את השימוש הנרחב בליחה בציטומטריית הזרימה. הגיליון הראשון מתייחס לאוסף הליחה. כיח נאסף באמצעות שיעול שאף המסלק ריר מהריאות לחלל הפה, ולאחר מכן יורק לתוך אוסף. מאז הריר נע דרך חלל הפה, יש סיכוי גבוה של זיהום SEC. זיהום זה מסבך את ניתוח הדגימה, אך הבעיה מתוקנת בקלות על פלטפורמה ציטומטרית זרימה, כפי שמוצג במחקר זה.
לא כל אחד יכול לייצר כיח באופן ספונטני; לכן, מספר מכשירים פותחו כדי לסייע עם אוסף כיח באופן לא פולשני17. הנבולייזר הוא מכשיר אחד כזה והוכח כמפיק דגימות כיח אמינות18,19,20. למרות nebulizer היא דרך יעילה מאוד של איסוף כיח באופן לא פולשני, השימוש בו עדיין דורש הגדרה במתקן רפואי עם כוח אדם מיוחד21. לעומת זאת, ניתן להשתמש במכשירי כף יד כגון חליל הריאה22,23,24 והאקפלה16,25 בבית מכיוון שהם ידידותיים מאוד למשתמש. התקני סיוע אלה בטוחים וחסכוניים כאחד.
עבורנו, האקפלה נתנה תוצאות טובות יותר באופן עקבי מאשר חליל הריאות16, ולכן, מכשיר acapella נבחר עבור אוספי כיח. דגימת איסוף של 3 ימים הוחלט כי המטרה העיקרית לשימוש בליחה היא לפתח בדיקת גילוי סרטן ריאות16. הוכח כי מדגם של 3 ימים מגביר את הסבירות לגילוי סרטן ריאות בהשוואה לדגימה של יום או יומיים26,27,28. עם זאת, שיטות אחרות של איסוף כיח עשויות להיות עדיפות למטרות שונות. אם נעשה שימוש בשיטת איסוף כיח שונה מזו המתוארת כאן, מומלץ לתבל בקפידה כל נוגדן או צבע המשמשים לניתוח ציטומטרי של זרימה; מעט מאוד נתונים זמינים על האופן שבו שיטות שונות לאיסוף כיח משפיעות על החלבונים הממוקדים לציטומטריית זרימה.
הנושא השני שמדכא את ההתלהבות משימוש בליחה לאבחון, הקשור בעיקר לציטומטריית הזרימה, הוא מספר התא. הבעיה היא איסוף של תאים ברי קיימא מספיק לניתוח אמין. שני מחקרים הראו כי דגימות כיח שנאספו בשיטות לא פולשניות, בעזרת מכשיר סיוע, מכילות מספיק תאים בני קיימא שניתן להשתמש בהם באבחון קליני או במחקרים16,24. עם זאת, אף אחד מהמחקרים הללו לא התייחס לנושא מספרי התאים בנוגע לציטומטריית הזרימה.
עבור המחקרים המהווים את הבסיס לפרוטוקול זה, נאספו דגימות כיח ממשתתפים בסיכון גבוה לפתח סרטן ריאות בעקבות הנחיות מוסדיות מאושרות לכל אתר מחקר. משתתפים בסיכון גבוה הוגדרו בין 55-75 שנים, לאחר שעישנו 30 שנות חבילה ולא הפסיקו לעשן ב -15 השנים האחרונות. המטופלים הראו כיצד להשתמש במכשיר אקפלה על פי הוראות היצרן29 ונאספו כיח במשך שלושה ימים רצופים בבית. הדגימה נשמרה במקרר עד האוסף האחרון. ביום האיסוף האחרון, הדגימה נשלחה למעבדה בלילה עם חבילה קרה קפואה. הדגימות עובדו לתוך השעיית תא אחד ביום שהם התקבלו. בשיטה זו של איסוף כיח, יותר ממספיק תאים קיימא מתקבלים לניתוח ציטומטרי זרימה אמין.
לבסוף, וקשור לבעיה הקודמת של מספר התא, היא השאלה כיצד לשחרר את תאי הכיח מסביבתו המוסינית. כיצד ניתן לשמור על התאים בני קיימא וליצור השעיית תא בודד שאינו סותם את ציטומטר הזרימה? מבוסס על עבודה ראשונית של פיצ'יני ואח' 30 ומילר ואח' 31, פרוטוקול זה מתאר שיטה קלה ואמינה לעיבוד כיח לתוך מתלה תא בודד המתאים לניתוח ציטומטרי של זרימה. שיטה זו השתמשה בהנחיות מבוססות היטב בציטומטריה של זרימה32,33,34 כדי לפתח אסטרטגיית תיוג נוגדנים יעילה לזיהוי תאים המטויים ואפיתל בליחה ולספק הגדרות מכשיר, אמצעי בקרת איכות והנחיות ניתוח התקנון ניתוח כיח בפלטפורמה ציטומטרית של זרימה.
Protocol
כל שלבי עיבוד הכיח מבוצעים בארון בטיחות ביולוגי עם ציוד מגן אישי מתאים.
1. הכנת ריאגנט לפני תחילת דיסוציאציה של כיח
- מפשירים 1% Paraformaldehyde (PFA), 25 מ"ל לדגימה על קרח, ולשמור על קור עד השימוש.
אזהרה: PFA רעיל על ידי שאיפה ומגע עור. הכן את הקיבעון על פי הוראות היצרן ולהקפיא ב -20 °C ב 25 mL aliquots עד השימוש. - משוער את המשקל של המדגם להפשיר מספיק 0.1% Dithiothreitol (DTT) לשלב 2.2 ולהביא אותו ל 37 °C (50 °F). (עליקות של DTT צריך להיות מאוחסן ב -20 °C (70 °F) לפני השימוש.)
- להביא מספיק 0.5% N-אצטיל- L-ציסטאין (NAC) עד 37 °C (5 °F) לשלב 2.2. (NAC צריך להיות טרי שבועי ומאוחסן ב 4 °C (7 °F) לפני השימוש.)
2. דיסוציאציה של כיח
- שקול את דגימת הכיח כדי לקבוע את הנפחים של ריאגנטים דיסוציאציה.
הערה: מדגם נחשב קטן אם המשקל ההתחלתי הוא ≤3 גרם, בינוני אם >3 גרם אבל ≤8 גרם, גדול אם >8 אבל ≤16 גרם, וגדול במיוחד אם מדגם שוקל >16 גרם. האינדיקציות קטנות, בינוניות, גדולות וגדולות במיוחד ישמשו לאורך הפרוטוקול. כמות ריאגנטים הנדרשים לדיסוציאציה ותיוג שונה בהתאם לגודל דגימת הליחה. - העבר מדגם קטן לצינור חרוט נקי 50 מ"ל, מדגם בינוני לבקבוק חד פעמי פלסטיק נקי 250 מ"ל, או מדגם גדול וגדול במיוחד לבקבוק חד פעמי פלסטיק 500 מ"ל נקי. הוסף 1 מ"ל / גרם משקל מדגם של 0.5% NAC ו 4 מ"ל / גרם משקל מדגם של 0.1% DTT.
- מערבולת במהירות המרבית (עבור 15 s), ולאחר מכן רוק בטמפרטורת החדר (במהירות המרבית) במשך 15 דקות.
- לדלל את המדגם עם ארבעה כרכים של פתרון מלח מאוזן של האנק (HBSS) (בהתבסס על הנפח הכולל של מדגם + ריאגנטים) כדי לנטרל את NAC ו- DTT; מערבולת במהירות המרבית וסלע בטמפרטורת החדר במשך 5 דקות במהירות המרבית.
- סנן את מתלה התא באמצעות מסננת תאי רשת ניילון 100 מיקרומטר לתוך צינור צנטריפוגה חרוטי אחד או יותר של 50 מ"ל כדי ליצור מתלה של תא יחיד.
- צנטריפוגות התאים ב 800 x g במשך 10 דקות ב 4 °C (70 °F). לשאוף את supernatant, לשלב את כל הכדורים בצינור חרוט אחד 15 מ"ל, ולאחר מכן לשטוף את הכדורים עם HBSS באמצעות אותם תנאים.
- resuspend גלולה התא בנפח של חוצץ נקבע על ידי המשקל הראשוני של דגימת כיח.
הערה: מדגם קטן הוא respended ב 250 μL של HBSS. מדגם בינוני הוא respended ב 760 μL של HBSS. דגימות גדולות וגדולות במיוחד נותנות מחדש ב- 1460 μL של HBSS. - קח aliquot של השעיית התא לספירת תאים חיים / מתים באמצעות טריפאן כחול.
הערה: עבור מדגם קטן, השתמש 5 μL. לקבלת מדגם בינוני, גדול או גדול במיוחד, השתמש ב- 10 μL. לדלל 1:10 עם HBSS.- לערבב 10 μL של דילול כיח עם 30 μL של 0.4% טריפן כחול כדי להשיג דילול מדגם סופי של 1:40. טען לתוך תאי הספירה של hemocytometer לספירת תאים.
הערה: ייתכן שיהיה צורך להתאים את הדילול הסופי אם מספרי התאים נמוכים מדי או גבוהים מדי כדי להשיג ספירה מדויקת. מומלץ מאוד להתייעץ עם Guiot et al.20 להבחנה נכונה של תאי כיח לבין SECs ופסולת. זה חיוני לספירת תאים מדויקת.
- לערבב 10 μL של דילול כיח עם 30 μL של 0.4% טריפן כחול כדי להשיג דילול מדגם סופי של 1:40. טען לתוך תאי הספירה של hemocytometer לספירת תאים.
- מתוך המדגם הגדול במיוחד, להסיר 50 x 106 תאים מהסכום הכולל ולהוסיף צינור חדש עם מספיק HBSS הוסיף כדי ליצור נפח כולל של 1700 μL.
הערה: שקול זאת כדוגמה גדולה עבור שאר הפרוטוקול. ניתן להשליך או להשתמש בשאריות דגימות למטרות אחרות.
3. כתמי נוגדנים וצביעת קיימא
- בחירה של נוגדנים וצבע מכתים
הערה: טבלה 1 מציגה את הנוגדנים ואת צבע הכדאיות המשמשים בפרוטוקול זה ואת אוכלוסיות התאים שהם מזהים.- סמן את הצינורות המכילים את תאי הכיח (ראה טבלה 2 עבור תוויות).
- השתמש בצינורות ציטומטריה של זרימה 5 מ"ל (תואם לציטומטר הזרימה המשמש) עבור צינור הדגימה עם התאים הלא מזוהמים והצינור עם בקרת האיזוטיפ. השתמש 15 mL צינורות חרוט עבור הדם ודגימות צינור אפיתל.
הערה: דגימות אלה יועברו צינורות ציטומטריה זרימה בעקבות כתמי נוגדנים קיבעון.
- סמן את צינורות הפיצוי (טבלה 3).
הערה: השתמש בצינורות ציטומטריה של זרימה 5 מ"ל התואמים לציטומטר הזרימה הנמצא בשימוש. - הוסף את כמות HBSS, נוגדן ו / או צבע לכל אחד צינורות תא כיח וצינורות פיצוי כפי שצוין בטבלה 2 ושולחן 3, בהתאמה.
הערה: הוסף חוצץ (HBBS), נוגדנים וצבע לכל הצינורות לפני הוספת תאים או חרוזי פיצוי כדי להבטיח שזמן ההכתמה של כל הצינורות עקבי. - הוסף את כמויות נפח תא הליחה המפורטות בטבלה 2 לצינורות ה- assay.
- הוסף חרוזי פיצוי לצינורות הפיצוי כמפורט בטבלה 3.
- לדגור את כל הצינורות (צינורות מבחנה ופיצוי) על קרח, מוגן מפני אור, במשך 35 דקות. לאחר מכן, מלא את הצינורות עם HBSS קר כקרח וצנטריפוגה ב 4 °C (50 °F) במשך 10 דקות ב 800 x g.
- עבור צינורות הפיצוי, לשאוף את supernatant קרוב לכדורים ככל האפשר ולהעיף את הכדורים להשתחרר.
- הוסף 0.5 מ"ל של HBSS קר לצינורות הפיצוי, לאחסן אותם על הקרח ב 4 °C (75 °F) ולהגן עליהם מפני אור עד הצורך לניתוח ציטומטריית זרימה.
- שאפו את הסופרנט מהצינורות האיזוטיפים, הדם והאפיתל הלא מזוהים לאחר הצנטריפוגה (שלב 3.6 ממקטע הכתמת הנוגדנים) ושחררו את הכדורים על ידי הבהוב הצינורות.
4. קיבעון עם 1% Paraformaldehyde (PFA)
- הוסף PFA קר 1% (אשר צריך להיות מופשר על ידי החברה) צינורות לא נגועים, איזוטיפ, דם, אפיתל; 2 מ"ל לצינורות האיזוטיפים הלא מזוהמים, ו-10 מ"ל לצינורות הדם והאפיתל.
- לדגור על הצינורות על קרח, מוגן מפני אור במשך 1 שעה. מערבולת במהירות המרבית לאחר 30 דקות.
- מלאו את הצינורות ב-HBSS קר כקרח. לאחר מכן, צינורות צנטריפוגה ב 4 °C (55 °F) במשך 10 דקות ב 1600 x g.
- שאפו כמה שיותר סופר-טבעי מבלי להפריע לכדור התא והעבירו את הצינור עם האצבעות כדי לשחרר את התאים.
- הוסף 200 μL של HBSS קר לצינורות איזוטיפ לא נגועים.
- חשב את הנפח של HBSS עבור resuspension של הדם ואת צינור האפיתל על פי ספירת התאים הכוללת.
הערה: נפח התחדשות = 0.15 x [ספירת תאים כוללת (שלב 8 של פירוק כיח) / 106]. השתמש ב- 50 x 106 כספירת התאים עבור מדגם גדול במיוחד. - לאחסן את כל מדגם צינורות פיצוי, מוגן מפני אור על הקרח ב 4 °C (50 °F) עד ניתוח ציטומטריית זרימה מבוצע.
הערה: פרוטוקול זה לא נבדק לאחסון במשך יותר מ- 24 שעות.
5. רכישת נתונים על ציטומטר הזרימה
- החל הליכי אתחול מתאימים עבור cytometer הזרימה בשימוש.
הערה: סעיף זה בפרוטוקול מניח כי האדם המפעיל את cytometer הזרימה מאומן בשימוש במכשיר העומד לרשותם, במיוחד לגבי נהלים יומיים כולל בדיקת היציבות של מערכות אופטיקה ו fluidics, טכניקות לתקנן פיזור אור ועוצמת פלואורסצנטיות, כמו גם חישוב והחלת מטריצת הפיצוי הנכונה. - השתמש בתערובת של חרוזים של המכון הלאומי לתקנים וטכנולוגיה (NIST) כדי להבטיח כי מתחי פיזור וזרימת צד קדימה מוגדרים למקם את חרוזי NIST כדי להתפרש על כל החלקה מבלי למקם את החרוזים קרוב מדי לצירים.
הערה: שלב זה חיוני כדי להבטיח כי פסולת קטנה מ 5 מיקרומטר ניתן לבטל על ידי ניתוח לאחר הרכישה. בהתאם לציטומטר הזרימה המשמש, שים לב כי החרוזים הקטנים ביותר אינם נכללים עם הסף (בעת שימוש LSR II או הליריקה) או עם המפלה הגבוהה (באמצעות Cytometer זרימה Navios EX). עבור Navios EX, רווח של 2 שימש עבור פיזור קדימה וצד, מתח של 236 עבור פיזור קדימה, ו 250 עבור פיזור צד. עבור LSR II, מתח פיזור קדימה של 165 ומתח פיזור צדדי של 190 שימש. - הגדר את קצב הזרימה לבינוני (LSR II) או גבוה (Navios EX).
הערה: קצב הזרימה הבינוני או הגבוה עבור רוב המכשירים יכול לשמש לרכישת צינורות כיח. חשוב לציין כי שימוש איטי מדי של קצב זרימה או לדלל מדי של המדגם עלול לגרום לתאים להתיישב, וכתוצאה מכך מערבולת מוגברת אשר אינו הרצוי. לכן, היצמדות לנפח ההשתתפות המחושבת בשלב 4.6 אמורה לגרום לצפיפות תאית שניתן לרכוש במהירות אך לא לסתום את המכונה. - התאם את המתחים עבור כל פרמטר המשמש לפרמטרים של פיזור ופלואורסצנטי כדי למקם את אוכלוסיות התאים בסולם. השתמש בנתונים עם אסטרטגיית הגטינג כהדרכה כיצד להתאים את המתחים בהתאם.
הערה: ודא שכל הפרמטרים הדרושים נבחרים בחלון בחירת הפרמטרים לפני הרכישה או שהנתונים לא יירכשו. - לרכוש נתונים עבור דגימת כיח נגוע תחילה, ואחריו מדגם מוכתם איזוטיפ, ולאחר מכן צינור הדם ואת צינור האפיתל.
הערה: אם ההשעיה של התא מרוכזת מדי כדי לאפשר לציטומטר הזרימה להפעיל את הדגימות מבלי לסתום, הדגימות עשויות להיות מדוללות עוד יותר עם HBSS.
תוצאות
פרוטוקול זה פותח תוך התחשבות במעבדה קלינית. ההתמקדות במהלך פיתוח הפרוטוקול הייתה על פשטות, יעילות ושחזור. נמצא כי השלב הגוזל זמן רב ביותר בעיבוד של כיח היה לספור את התאים. לכן, הפרוטוקול מוגדר באופן כזה כי עיבוד כיח ותיוג תאים ניתן לבצע בנפרד מספירת תאים ללא אובדן זמן. ספירת תאים מדויקת, שעדיין נחוצה כדי לדלל את הדגימה כראוי לריצה ללא הפרעה, ניתן להשיג במהלך תקופת הדגירה של תיוג הנוגדנים.
פרוטוקול זה משתמש במדידה של משקל כיח במקום ספירת תאים כאינדיקציה לכמה נוגדנים/צבע להשתמש לתיוג תאים אופטימלי. עם זאת, יש מידה רבה של שונות במשקל של דגימות כיח; מתוך 126 הדגימות שניתחו, המשקל נע בין 0.57 גרם ל- 38.30 גרם. איור 1A מראה כי הקשר בין משקל הליחה לתפוקת התא אינו חזק. לכן, הדגימות חולקו לארבע קטגוריות; המשקלים החציוניים של הדגימות היו 2.1 גרם עבור דגימות קטנות, 5.0 גרם עבור דגימות בינוניות, 11.2 גרם עבור דגימות גדולות, ו 22.0 גרם עבור דגימות גדולות במיוחד (איור 1B). עם זאת, עדיין היו דגימות שהניבו הרבה יותר תאים מהצפוי בהתבסס על משקלם (איור 1C), רוב הדגימות התקבצו יפה. עבור דגימות קטנות, תפוקת התא החציוני הייתה 8.0 x 106 תאים, עבור דגימות בינוניות 13.0 x 106, עבור דגימות גדולות 35.4 x 106, ודגימות גדולות במיוחד 93.0 x 106.
כל נוגדן בשימוש בפרוטוקול זה היה titrated. ריכוז בשלב הרמה (איור 2A) עם מדד הכתמים הגבוה ביותר (איור 2B) של עקומת ההטיה נבחר כריכוז העבודה. שינויים במספרי התאים לא ישנו באופן דרמטי את עוצמת הכתמים. טיטציה ובדיקה נוגדן זה הוא חיוני ויש להגדיר עם טיפול עבור כל נוגדן חדש או צבע המשמש בפרוטוקול זה34,35. כאשר נוגדן הוא titrated בזהירות, זה צריך להכתים 10 עד 50 פי 50 תאים יותר מאשר מספר התאים שבהם הנוגדן היה titrated34,35. דוגמה לעיקרון זה מסופקת בטבלה 4. נוגדן CD45-PE האנטי-אנושי היה titrated על 1 x 106 תאים בנפח כולל של 400 μL. אם נוגדן זה לאמצעי אחסון מכתימים מוערך לפרוטוקול (ראה טבלה 2, המציגה את כמות ה- CD45-PE ואמצעי אחסון מכתימים עבור כל גודל דגימה), עבור מדגם קטן, 0.625 x 106 תאים יוכתמו, 1.25 x 106 תאים יוכתמו עבור מדגם בינוני, ו- 2.5 x 106 תאים עבור מדגם גדול (עמודה A בטבלה 4). עודף של פי 50 במספר התא עבור כל קטגוריה מחושב להיות 31.25 x 106, 62.5 x 106 ו- 125 x 106 תאים, בהתאמה (עמודה B). כפי שמוצג בעמודות C ו- D, מספר התא החציוני של כל קטגוריית גודל והדוגמה הגדולה ביותר בכל קטגוריה נמצאים בטווח של פי 50.
למרות ההבדלים המסתערים בגודל ובתפוקת התא בין הגדלים השונים של דגימות הכיח, האחוז החציוני של זיהום SEC בכל קטגוריה דומה מאוד. איור 3A מציג את אחוז ה- SECs שנמצאו בדגימות בודדות, המשתרעים לפי קטגוריית משקל הליחה שלהם. הדאגה העיקרית הייתה עם SECs מאז תאים אלה אינם מייצגים רקמת ריאה אלא של חלל הפה. עם זאת, הזיהום הממוצע של ה- SEC הוא פחות מ -20% עבור כל הקטגוריות. איור 3B מציג את אחוז התאים בני-קיימא שנמצאו בדגימות אלה. בניכוי ה- SECs, הכדאיות הממוצעת הייתה כ- 72% עבור קטגוריות גודל הדגימה הקטנות, הבינוניות והגדולות. זה היה מעט גבוה יותר (79%) עבור הקטגוריה הגדולה במיוחד.
איור 4 מציג אסטרטגיית גטינג טיפוסית להפרדת תאי הכיח של עניין מפסולת, תאים מתים (הכוללים גם את ה- SECs36 המזהמים) וגושים של תאים. איור 4A מציג את השימוש של חרוזי NIST כדי להציב שערים כדי לחסל פסולת הקטנה מ-5 מיקרומטר או יותר מ-30 מיקרומטר, ואילו איור 4B מחיל שער זה על תאי כיח. איור 4C מציג פרופיל כיח טיפוסי כאשר הוא מוצג כרוחב פיזור צד (SSC-W) כנגד רוחב פיזור קדימה (FSC-W), שער הרוחב. פרופיל זה משמש לחיסול פסולת קטנה המציגה את עצמה לאורך צירי SSC-W ו- FSC-W. חיסול התאים המתים מוצג באיור 4D ובאיור 4E. הפקד הלא מזוהם (איור 4D) משמש לקביעת הניתוק עבור חיוביות FVS510; תאים הכתימים חיובי עבור FVS510 מעל השליטה השלילית נחשבים מתים ולא ישמשו בניתוח תאי הכיח (איור 4E). לבסוף, שער יחיד מוחל כדי להסיר מכפילי תא מהניתוח, המוצג באיור 4F. לפיכך, התאים שהגיעו דרך שערי הבחירה המוצגים באיורים 4B, איור 4C, איור 4E ואיור 4F מייצגים תאים חיים, ליחה יחידים המוכנים לניתוח הבא עם הנוגדנים המשמשים בפרוטוקול זה.
השימוש בנוגדן נגד CD45 בפרוטוקול תיוג זה מאפשר הפרדה של תאים חיים, ליחה יחיד לתא תא דם (CD45+) ותא תא שאינו דם (CD45-). הקטגוריה השנייה כוללת תאי אפיתל ותאי דם אחרים שאינם. הפרופיל העליון באיור 5A מציג את השימוש בדוגמת כיח לא מזוהה כדי להגדיר את הניתוק עבור חיוביות CD45, ועיבוד השערים ללכידת תאי CD45+ ותאי CD45. הפרופיל התחתון של איור 5A מראה ששני השערים האלה מוחלים על דגימת כיח מוכתמת בנוגדן נגד CD45. לאחר מכן מכתים בנוגדנים נוספים כדי לזהות אוכלוסיות ספציפיות לתאי דם בתוך שער ה-CD45+ (איור 5B) ואוכלוסיות אחרות שאינן תאי דם, כולל אוכלוסיות אפיתל בשער CD45 - gate (איור 5C). בשני הנתונים, הפרופילים העליונים מראים כיצד נעשה שימוש בליחה מוכתמת באיזוטיפ כדי להגדיר את האוכלוסיות השליליות הכפולות, בעוד שהפרופילים התחתונים מראים את תאי הכיח מוכתמים בנוגדנים. איור 5B (למטה) מציג שש אוכלוסיות תאים שונות מסוג CD45+ שנוצרו עם קוקטייל הנוגדנים הניתנים לזיהוי בערוץ הפלואורסצנטי (FL) 1 (נוגדני אנטי-CD66b, CD3, CD19) ואת נוגדני האנטי-CD206 הניתנים לזיהוי בערוץ FL3. ניסויי מיון גילו כי מקרופאגים ספציפיים לריאות שוכנים בשערים המזוהים עם M. נוכחות התאים בשערים אלה מצביעה אפוא על כך שדגימת הכיח נגזרה מהריאה ולא הייתה רוק (בדרקה ואח', כתב יד כהכנה). איור 5C (למטה) מציג את רבעי הגטינג שנוצרו עם אנטי-פאן-ציטוקרטין (panCK) שניתן לזהות בערוץ FL1 ומולקולת הידבקות תאים אנטי-אפיתל (EpCAM) הניתנים לזיהוי בערוץ FL3 בין תאי הכיח של ה-CD45.
פרוטוקול תיוג זה נבדק בהרחבה ב- Navios EX וב- LSR II. כמה ניסויים ראשוניים בוצעו על הליריק, אך ללא אופטימיזציה מכשיר נרחב שנעשה עבור שתי המכונות האחרות. לכן, הגדרות כלי מפורטות מסופקות עבור Navios EX ו- LSR II בגיליון חומרים, אך לא עבור הליריקה. להבנת הדמיון והשינויים בין שלוש פלטפורמות ציטומטריות זרימה אלה שניתן להשתמש בהן לניתוח תאי כיח, ניתן להשוות פרופילים המתקבלים מהמכונות השונות באיור 6 ובאיור 7. שתי דגימות כיח גדולות עובדו, אוגדו, תויגו, הופרדו לשלוש מנות שוות, ולאחר מכן נרכשו על כל ציטומטר זרימה שהוזכר לעיל. איור 6, הדומה לאיור 4, משווה את אסטרטגיית הגינג לחיסול פסולת, תאים מתים וגושים בתאים. איור 7, הזהה לאיור 5, משווה את פרופילי הדם והלא-דם מהנתונים שנרכשו בציטומטרי הזרימה השונים.
השוואת הפרופילים השונים המתקבלים משלושת מציטומטרי הזרימה השונים מראה כי ניתן לצפות באותם פרופילים בסיסיים עם כל מכשיר. ההבדלים שיש לשים לב אליו הם התוויות SSC-W/FSC-W (שער רוחב) (איור 6, שורה שנייה) והקשקשים הליניאריים של חלקות הפיזור (איורים 6 ו-7). החלקה רוחב הפיזור שנוצר על Navios EX מציג שער הכללה (תיבה אדומה), כלומר כל התאים הכלולים בשער מנותחים עוד יותר; האירועים לאורך הצירים בפינה השמאלית-תחתונה אינם נכללים. התוויות רוחב הפיזור ב- LSR II, ו- Lyric אינן מציגות הפקדה דומה של אירועים לאורך אותם צירים. אי התאמה זו נובעת ככל הנראה מהסף הרגיש מאוד המשמש ב-Navios EX, מה שמוביל לכמה פסולת קטנה בשער אי-הכללת הגודל הקודם (השורה העליונה באיור 6). לעתים, פסולת נראית לאורך הצירים בפרופיל רוחב הפיזור שנוצר ב- LSRII, אך היא נמצאת בפינה הימנית-תחתונה. במקרים אלה, שער אי-הכללה (כפי שצוין על-ידי התיבה האדומה המקווקות בפרופיל האמצעי בשורה 2 באיור 6) משמש לחיסול אירועים אלה מניתוח נוסף.
בעוד סולמות היומן נראים מעט שונים על העלילה בין Navios EX ואת ליריק ו LSR II cytometers, Navios EX יש את האפשרות לרכוש נתונים באמצעות עשורים נוספים. יישום עשורים נוספים תלוי בהקשר של הניסוי וברגישות הרצויה להדמיית אוכלוסיות העניין.
הבדל בולט נוסף בין Navios EX ו LSR II ו cytometers ליריקה הוא המראה של הפרופיל של שער יחיד. הציטומטר של Navios EX מצויד בתא זרימה מלבני עם זווית איסוף שונה מזו של LSR II. Navios EX מכיל שלוש זוויות איסוף הנשלטות על ידי תוכנה כדי לייעל את פיזור האור בזווית הקדמית כדי להשיג את הרגישות המתאימה לגודל החלקיקים לניתוח. שער המצולע עבור Cytometer Navios EX יצטרך להיות מותאם לזווית נמוכה מעט יותר מאשר שער יחיד עבור LSRII. ניתן למטב את שער הסינגל עבור הליריקה כדי לקבל פרופיל דומה לזה שנראה עם LSR II. באמצעות מדגם הכיח, יש למטב את גורם קנה המידה של האזור עבור כל לייזר בליריקה כדי להשיג שער יחיד הדומה ל- LSR II.
כל הפרופילים המוצגים באיור 4 עד איור 7 נותחו באמצעות תוכנת FlowJo, גירסה 10.6. קבצי .fcs ניתן למצוא FlowRepository (https://flowrepository.org), תחת זהות FR-FCM-Z3LX, FR-FCM-Z3MJ, ו FR-FCM-Z3MM וניתן להשתמש בהם כדי לתרגל את ניתוח הכיח כפי שמודגם בנתונים אלה.
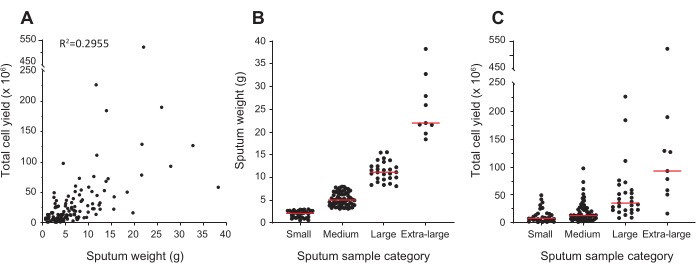
איור 1: משקולות כיח ותפוקת תאים. (א) המתואר הוא הקשר בין משקל כיח, שנקבע לפני העיבוד, לבין תפוקת התא הכוללת, שנקבע לאחר עיבוד באמצעות המוציטומטר. כל תבליט מייצג מדגם בודד, 126 בסך הכל. (B) דגימות כיח היו מרובד לארבע קטגוריות בהתבסס על המשקל שלהם: קטן עבור דגימות במשקל של עד 3 גרם, בינוני עבור דגימות במשקל של יותר מ 3 גרם עד 8 גרם, גדול עבור דגימות במשקל של יותר מ 8 גרם עד 16 גרם, ודגימות גדולות במיוחד עבור אלה במשקל של יותר מ 16 גרם (C) מוצג הוא התפלגות של תפוקת התא עבור הדגימות בכל קטגוריה. הפסים האדומים ב- (B) ו- (C) מייצגים את הערכים החציוניים בכל קטגוריה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: טיטציה נוגדנית ל-CD45-PE אנטי-אנושי. (A) עקומת התיוג CD45-PE (IgG1) עם עוצמת הפלואורסצנטיות הממוצעת (MFI) של האוכלוסייה החיובית שותנתה לעומת הריכוז של רמות הנוגדנים CD45-PE ב- 1 מיקרוגרם / מ"ל. (B) עקומת טיטריון המתארת את מדד הכתמים לעומת ריכוז הנוגדנים מראה מדד הכתמים הגבוה ביותר הוא ב 1 מיקרוגרם / מ"ל. מדד הכתמים חושב כ: [CD45 MFI חיובית - אוכלוסייה שלילית CD45 MFI] / [2 * סטיית תקן]. בהתבסס על איור 2A ואיור 2B, 1 מיקרוגרם/מ"ל נבחר כריכוז האופטימלי לנוגדן CD45-PE. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: חלקם של ה-SECs והתאים המתים בדגימות כיח עקבי בין ארבע קטגוריות המשקל. (A) שיעור ה-SECs בדגימות כיח מסווג לפי קטגוריית המשקל שלהם. אחוז הזיהום של הרשות לניירות ערך נקבע על ידי המוציטומטר כחלק מספירת התאים הכוללת. (B) הכדאיות התאית של דגימות כיח למעט SECS, שנקבעו על ידי המוציטומטר ושיטת ההדרה הכחולה של טריפן. עבור כל גרף, הקווים האדומים מייצגים את הערכים החציוניים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
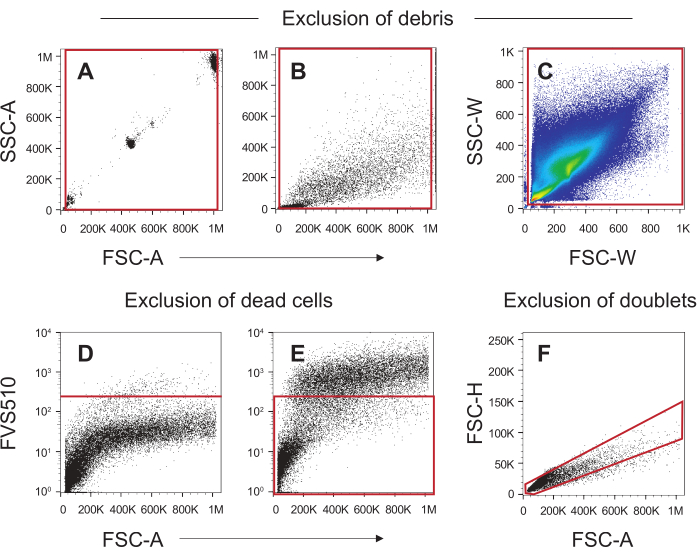
איור 4: אסטרטגיית גטינג להחרגת פסולת, תאים מתים והכפלות בדגימת כיח. (A) חרוזי NIST בגדלים 5 מיקרומטר, 20 מיקרומטר ו-30 מיקרומטר שימשו כדי להגדיר את השער המצוין על-ידי הקופסה האדומה כדי לא לכלול פסולת הקטנה מ-5 מיקרומטר ופסולת גדולה יותר מעל 30 מיקרומטר וקרובה לציר. (B) דגימת כיח נרכשה באמצעות אותם מתחים עבור הפיזור קדימה וצד כמו זה של חרוזי NIST. השער שנוצר ב- (A) הוחל כדי לא לכלול פסולת. (ג) פסולת קטנה הקרובה לציר לא נכללה בחלקה זו של רוחב הפיזור. (D) נעשה שימוש במדגם כיח לא מזוהם כדי להגדיר את הקו האדום (הקו האדום) עבור האוכלוסייה השלילית, לא מוכתמת עבור צבע הכדאיות. (ה) הניתוק שנוצר ב- D הוחל על דגימת הכיח המוכתמת כדי ליצור שער (תיבה אדומה) כדי לכלול תאים חיים, קיימא. (ו) השער היחיד המצוין על ידי המצולע האדום אינו כולל תאים שאינם נופלים באלכסון, ומבטל מכפילים ו/או גושים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
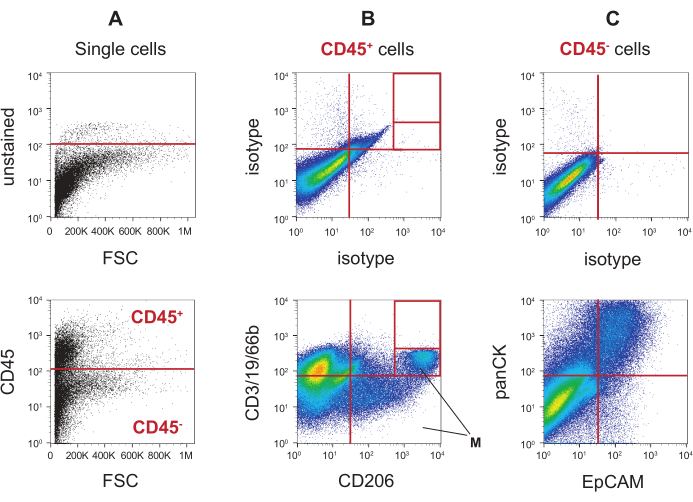
איור 5: אסטרטגיית גיטינג של תאי כיח לתאי דם ותאי דם שאינם דם. (A) תאי כיח לא נגועים הנגזרים משער יחיד משמשים כדי להגדיר את הקו האדום (הקו האדום) באוכלוסייה השלילית עבור CD45 (למעלה). הניתוק מהפרופיל העליון מוחל על דגימת הכיח המוכתמת (למטה) כדי להבדיל בין אוכלוסיות CD45 חיוביות (CD45+) לבין אוכלוסיות שליליות (CD45-). (B) CD45+ תאי כיח מוכתמים בנוגדני איזוטיפ עבור FITC /AF488 משמשים כדי להגדיר את השערים על האוכלוסייה השלילית (למעלה). אותם שערים מוחלים על תאי הכיח CD45+ המוכתמים בסמני תאי דם CD3, CD19, CD66b ו- CD206 (למטה). (C) שערי רבעים ממוקמים על CD45- תאי כיח מוכתמים בבקרות איזוטיפ (למעלה) ומוחלים על CD45 - תאים מדגימת הכיח מוכתמים בסמני האפיתל פאן-ציטוקרטין (panCK) ו- EpCAM (למטה). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 6: אסטרטגיית גיטינג להחריג פסולת, גושים ותאים מתים של תאי כיח מוכתמים בשלוש פלטפורמות ציטומטריות של זרימה. שתי דגימות כיח גדולות עובדו, אוגדו, תויגו וחולקו לשלוש מנות שוות לרכישה ב- Navios EX (A), LSR II (B) ובציטומטרי הזרימה הליריים (C). שורה עליונה: דגימות כיח היו מגודרות (תיבה אדומה) כדי לא לכלול פסולת קטנה וגדולה מאוד. שורה שנייה: התיבה האדומה הגדולה בחלקת Navios EX מייצגת שער הכללה הכולל את התאים אך אינו כולל פסולת. הקופסה האדומה הקטנה המקווקות הנראית בעלילת LSR II מייצגת שער הרחקה כדי לחסל פסולת מניתוח נוסף. דרוש אופטימיזציה נוספת עם הליריקה כדי לקבוע היכן יש צורך בהסרת פסולת. לכן, אין שער בחלקה זו. שורה שלישית: שערים מלבניים אדומים כוללים תאים חיים לניתוח נוסף. שורה תחתונה: בשער המצולע יש תאים בודדים על ידי אי הכללת מכפילים הנופלים מחוץ לאכסון של השער. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
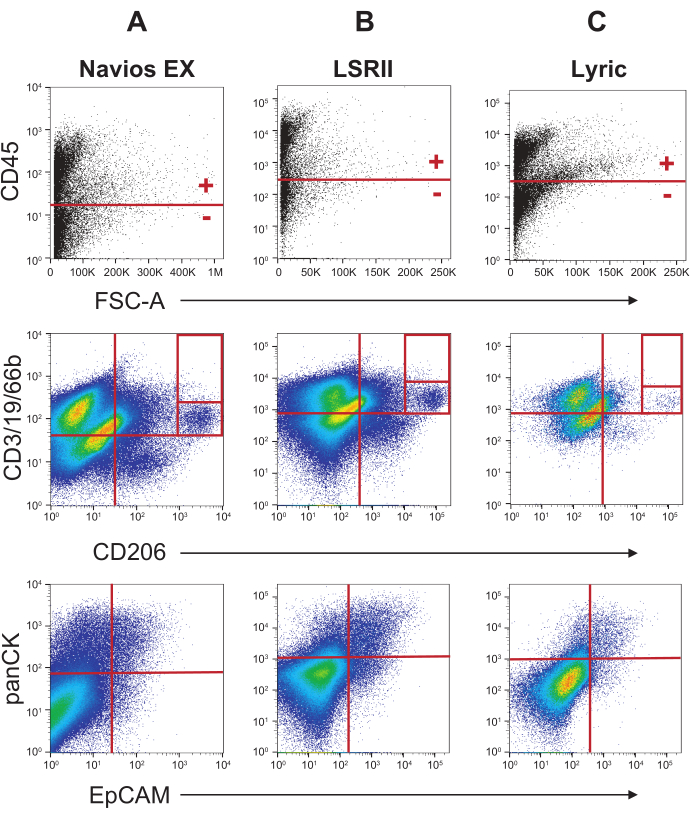
איור 7: אסטרטגיית גיטינג עבור כיח מוכתם בסמני דם ואפיתל בשלוש פלטפורמות ציטומטריות של זרימה. הניתוח המוצג באיור 6 נמשך באיור 7; כל התאים הבודדים (שורה תחתונה, איור 6) חולקו לאוכלוסיות CD45+ ו-CD45 (שורה ראשונה, איור 7), כך שסמנים ספציפיים לתאי דם וסמנים ספציפיים לתאי אפיתל יכולים לסמן עוד יותר אוכלוסיות אלה. שורה שנייה: פרופיל של סמני תאי דם CD3/CD19/CD66b ו- CD206 מתאי CD45+ . שורה שלישית: סמני תא אפיתל panCK ו- EpCAM מתאי CD45. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| נוגדן/כתם | תכלית |
| FVS510 | כתם כדאיות |
| CD45 אנטי-אנושי – PE | סמן פאן-לויקוציט; פיצוי PE |
| CD66b אנטי-אנושי – FITC | סמן גרנולוצייט |
| CD3 אנטי-אנושי – Alexa488 | סמן תא T |
| CD19 אנטי-אנושי – Alexa488 | סמן תא B; פיצוי FITC/Alexa488 |
| CD206 אנטי-אנושי – PE-CF594 | סמן מקרופאג' לריאות; פיצוי PE-CF594 |
| אפקאם אנטי-אנושי – PE-CF594 | סמן תא אפיתל; פיצוי PE-CF594 |
| פאן-ציטו-ציטוקרטין אנטי-אנושי (panCK) – Alexa488 | סמן תא אפיתל |
| IgG1κ – Alexa488 | פקד איזוטיפ CD3/CD19/panCK |
| IgG1κ – FITC | פקד איזוטיפ CD66b |
| IgG1κ – PE-CF594 | בקרת איזוטיפ CD206/EpCAM |
| CD45 אנטי-אנושי – BV510 | פיצוי FVS510 |
טבלה 1: נעשה שימוש בנוגדנים וכתמי כדאיות. רשימה של נוגדנים וצבע קיימא המשמש בפרוטוקול זה. מסומנות הן קבוצות המשנה הסלולריות שכל אחת מהן מזהה.
| שפופרת (תווית) | גודל לדוגמה* | HBSS (μL) | FVS510 (μL) | CD45 (μL) | נוגדנים אחרים (μL) | תאים § (μL) | |||
| לא נגוע | קטן | 80 | 20 | ||||||
| בינוני | 50 | 50 | |||||||
| גדול | 50 | 50 | |||||||
| IgG1κ - Alexa488 | IgG1κ- FITC | IgG1κ - PE-CF594 | |||||||
| בקרת איזוטיפ | קטן | 60.65 | 0.6 | 10 | 2 | 6 | 0.75 | 20 | |
| בינוני | 30.65 | 0.6 | 10 | 2 | 6 | 0.75 | 50 | ||
| גדול | 30.25 | 1 | 10 | 2 | 6 | 0.75 | 50 | ||
| CD206 | CD3 | CD19 | CD66b | ||||||
| דם | קטן | 92.875 | 1.5 | 25 | 1.875 | 5 | 1.25 | 7.5 | 115 |
| בינוני | 65.75 | 3 | 50 | 3.75 | 10 | 2.5 | 15 | 350 | |
| גדול | 102.5 | 10 | 100 | 7.5 | 20 | 5 | 30 | 725 | |
| EpCAM | פאנק | ||||||||
| אפיתל | קטן | 96.5 | 1.5 | 25 | 10 | 2 | 115 | ||
| בינוני | 73 | 3 | 50 | 20 | 4 | 350 | |||
| גדול | 117 | 10 | 100 | 40 | 8 | 725 | |||
| * דגימות נחשבות קטנות, בינוניות או גדולות בהתבסס על משקל שנקבע בשלב 1 של סעיף פירוק הליחה של הפרוטוקול. | |||||||||
| § יש להוסיף תאים לאחר שכל הריאגנטים חולקו, כולל אלה בצינורות הפיצוי (טבלה 3). | |||||||||
טבלה 2: תוכן של צינורות עם תאי כיח. השתמש בטבלה זו כפי שמתייחסים אליה בפרוטוקול כדי להוסיף את אמצעי האחסון שצוינו של נוגדנים וכתם הכדאיות עבור גודל המדגם המתאים.
| שפופרת (תווית) | ריאגנטים נוספו (μL) | ריאגנטים נוספו (טיפה) | ||||||
| HBSS | CD45-PE | CD206-PE-CF594 | EpCAM-PE-CF594 | CD19-Alexa488 | CD45-BV510 | CompBead (+) | CompBead * (-) | |
| PE comp. | 76 | 4 | x | x | x | x | 1 | 1 |
| PE-CF594 comp. | 72 | x | 4 | 4 | x | x | 1 | 1 |
| אלכסה488/פיטק comp. | 60 | x | x | x | 20 | x | 1 | 1 |
| BV510 comp. | 60 | x | x | x | x | 20 | 1 | 1 |
| * יש להוסיף את החרוזים החיוביים (+) והשליליים (-) לאחר שכל הריאגנטים הופצו והצינורות בטבלה 2 הוכנו. | ||||||||
| comp. = פיצוי | ||||||||
טבלה 3: תוכן צינורות פיצוי. השתמש בטבלה זו כפי שמתייחסים אליה בפרוטוקול כדי להוסיף את אמצעי האחסון שצוינו של נוגדנים לחרוזי הפיצוי.
| מספר תא (x 106) | ||||
| A | B | C | D | |
| גודל לדוגמה | בנפח הכתמים * | גישה פי 50 | דוגמה חציונית (קיפול גישה) # | הדגימה הגדולה ביותר (גישת קיפול) # |
| קטן | 0.625 | 31.25 | 8.0 (12.8) | 24.77 (39.6) |
| בינוני | 1.25 | 62.5 | 13.0 (10.4) | 48.87 (39.1) |
| גדול | 2.5 | 125 | 35.4 (14.2) | 113.5 (45.4) |
| * כרכים מכתימים המשמשים בפרוטוקול (טבלה 2). מספר התא מוערך מאופן ביצוע עקומת התיוג; 1 מיקרוגרם/מ"ל של CD45-PE ו- 1 x 106 תאים לכל 200 μL. | ||||
| ♪ גישה של פי 50 של מספרי תאים בעמודה A. | ||||
| # קיפול גישה בעמודות C ו- D מחושבים על-ידי חלוקת המספר המוצג בתאי העמודות C או D במספר בתא המתאים בעמודה A. | ||||
טבלה 4: ריכוז CD45-PE אנטי-אנושי עבור כל הדגימות בכל קטגוריית גודל מדגם.
Discussion
התוכן התאי של כיח כולל מגוון גדול של תאים רחבים, לעתים קרובות מלווה הרבה פסולת37. בנוסף, ניתוח כיח דורש בקרת איכות המאשרת את המדגם שנאסף מהריאה במקום מחלל הפה38. לכן, זה לא פשוט לנתח כיח על ידי ציטומטריה זרימה כפי שהוא עבור דם, למשל, אשר משחרר הרבה יותר נקי הומוגני השעיית תא. פרוטוקול זה התייחס לכל הבעיות הללו: מתן הגדרות מכשיר באמצעות חרוזי גודל ספציפיים כדי להבטיח שניתן יהיה לזהות את אוכלוסיות התאים הקטנות והגדולות ביותר, אסטרטגיית gating לחיסול פסולת, גושי תאים, SECs מזהמים ותאים מתים אחרים, ולבסוף, אמצעי בקרת איכות להבטחת דגימת כיח הוא מהריאה במקום להיות בעיקר רוק.
ישנם שלבים קריטיים בפרוטוקול בעבודה עם כיח שכדאי להצביע עליהם. ראשית, תפוקת התא יכולה להיות מושפעת באופן דרסטי על ידי מספר מסננות תאי ניילון המשמשים בשלב 2.5 של חלק דיסוציאציה כיח של הפרוטוקול. מסננים מרובים עשויים להידרש כדי למנוע אובדן תאים רבים מדי עקב סתימה של מסננת. כאשר הזרימה דרך מסננת הואטה באופן ניכר, מסננת חדשה יש להשתמש. שנית, גלולה התא של דגימות כיח יכול להיות רופף מאוד, במיוחד אם יש זיהום גבוה של SECs. לכן, זה חיוני לא לשאוף קרוב מדי לכדור בעת הסרת supernatant לאחר centrifuging הדגימות. שאיפה קרוב מדי לכדור עלולה לגרום לאובדן תאים, אם לא לאובדן הכדור כולו. שלישית, פרוטוקול זה דורש שלב קיבעון. זה משמר את התאים ואת פרופיל הכתמים שלהם ומשמש כאמצעי בטיחות כדי להגן על מפעיל cytometer הזרימה. הפעלת דגימות על ציטומטרים זרימה מסוימים עשוי להציג סיכונים ביולוגיים מוגברת בשל הפוטנציאל לייצור תרסיס39. קיבוע PFA מסייע להגן על המפעיל מפני פתוגנים פוטנציאליים במדגם הכיח. רביעית, ואולי ההיבט המאתגר ביותר בהכנת דגימות כיח לניתוח ציטומטרי של זרימה, הוא ספירת תאים. ספירת תאים מסובכת בגלל המגוון הגדול של סוגי תאים הנמצאים בליחה. מכונות ספירה מוגבלות לעתים קרובות על ידי טווח גודל התא שהם יכולים ללכוד ולכן הם פחות אמינים מאשר hemocytometer. עם זאת, ספירת תאים של דגימות כיח על ידי המוציטומטר, אשר מתואר מצוין על ידי Guiot et al.20, הוא מייגע ודורש בפועל להיות בקיא. מספר תא מדויק חיוני בקביעת נפח ההשתתפות הסופי של הדגימה כדי לאפשר קצב זרימה סביר ולמנוע קבקבים בציטומטר הזרימה. נוכחותם של ה- SECs הגדולים מאוד בליחה ובגושי התאים הקטנים הרבים שאינם מתפרקים על ידי מאגר הניתוק, ולא נתפסים על ידי המסננים, מגבירים את הסבירות לסתימת ציטומטר הזרימה. לכן, מומלץ להקדיש זמן לקביעת קצב ריכוז התאים / זרימה הטוב ביותר לרכישת נתונים באמצעות cytometer הזרימה זמין. בנוסף, ודא כי cytometer הזרימה יש את תא הזרימה המתאים ואת גודל זרבובית (או בדיקה) מסוגל למדוד את אוכלוסיות התאים הגדולים יותר נוכחים בליחה.
גם כאשר מיומנות בספירת תאים הושגה, זה עדיין תהליך גוזל זמן. לכן, הקביעה של ריאגנטים עבור תיוג תאים בפרוטוקול זה מבוססת על גודל המדגם (כפי שנפט לפי משקל) ולא על פי מספר תא. זה מאפשר שימוש יעיל יותר של זמן מאז ספירת התא הידני ניתן להשלים במהלך הזמן הדרוש עבור נוגדן וכתמים צבע קיימא. עם זאת, ישנם שלושה יוצאים מן הכלל בולטים לכך. אם מדגם הוא >16 גרם (מה שנקרא דגימות גדולות במיוחד), ספירת התאים הידנית צריכה להתרחש לפני הכתמת, כך ריאגנטים יקרים ניתן לשמר רק על ידי הכתמת 25 x 106 תאים כל אחד עבור צינורות הדם והאפיתל. מספר תא זה מספק פרופילים אמינים מאוד בהגדרות המתוארות בפרוטוקול זה. חריג פוטנציאלי נוסף הוא המקרה של מדגם קטן מאוד. ההערכה היא כי מינימום של 1-2 x 106 תאים נדרש עבור ניתוח cytometry הזרימה כפי שמוצג בפרוטוקול זה כדי ליצור פרופילים אמינים (נתונים לא מוצגים). לכן, אם מדגם מכיל פחות מ 1-2 x 106 תאים, זה לא יכול להיות שווה להמשיך עם ההליך מאז התוצאה הסופית סביר להניח לא מקובל.
ריאגנטים תיוג ספציפיים שעובדים היטב על תאי דם היקפיים או קווי תאים עשויים לעבוד בצורה שונה מאוד על תאי דם הכלולים בליחה (תצפיות שלא פורסמו). לכן, מומלץ לתייג כל נוגדן או ריאגנטים תיוג אחרים על פי פרוטוקולים מבוססים היטב34,35 לפני שהם משמשים בניסויים ציטומטריית זרימה. רוב טייטציות הנוגדנים אמורות לתת תוצאות דומות בעת הכתמת עד פי 10 עד פי 50; עם זאת, מומלץ לעשות titrations נוספים עם מספרי תאים גבוהים יותר מאשר טווח זה34. כאשר ריכוז ריאגנט נקבע, זה חיוני כדי לשמור על זמן הדגירה של ריאגנט זהה לניסוי בפועל. מסיבה זו, הפרוטוקול מדגיש הוספת כל החיץ ואת ריאגנטים לצינורות לפני התאים או חרוזי פיצוי מתווספים. סדר זה של הוספת ריאגנטים ותאים/חרוזים יחד מאפשר עקביות גבוהה יותר בזמני תיוג. אם, מסיבה כלשהי, זמן הדגירה הניסיונית לא ניתן לשמור דומה לזה המשמש עבור טיטציה נוגדנים / צבע, האחרון צריך לחזור על עצמו עם זמן דגירה כי הוא אפשרי במהלך ניסויים.
דגימות כיח שימשו באופן נרחב כדגימה אבחנתית לחקר הפתופיזיולוגיה של מחלות שונות המשפיעות על הריאה. שחפת40,41, COPD13,42, אסטמה43, סיסטיק פיברוזיס44,45, סרטן ריאות46,47,48, ודלקת מפרקים שגרונית49 הם בין המחלות הרבות שבהן נחקר כיח בשל היתרון של להיות דגימה שאינה מושגת באופן פולשני. לאחרונה, במהלך מגפת הקורונה, נעשה שימוש בליחה כדי לזהות שפיכה ויראלית ממושכת בחולים המאושפזים במחלת הקורונה 2019 (COVID-19)50.
טכנולוגיות שונות, כולל תגובת שרשרת פולימראז הפוך (RT-PCR), ניתוח חלבונים, מיקרוסקופיה, וציטומטריית זרימה, שימשו לזיהוי סמנים ספציפיים למחלה בליחה. שימוש בפלטפורמה ציטומטרית זרימה לניתוח דגימות כיח אינו נמצא בשימוש נרחב, אך השימוש בו גדל. עם ההתקדמות האחרונה בטכנולוגיה של זרימה cytometers3,51,52, כמו גם התקדמות בכימיה של פלואורופורים, ייצור של שיבוטים נוגדנים חדשים, ופיתוח של צבעים שונים כדי לזהות אוכלוסיות תאים מתים51,53,54, האפשרות של עיצוב לוחות נוגדנים שמטרתם לאבחן מחלות אנושיות גדל באופן דרמטי. יתר על כן, הדחיפה האחרונה לאוטומטיות של ניתוח נתונים ציטומטריים זרימה55,56 תחסל את ההטיה הפוטנציאלית בקריאה ידנית ופרשנות נתוני זרימה. התפתחויות חדשות אלה בציטומטריית הזרימה יקלו באופן משמעותי על חקר הכיח כאבחון קליני.
Disclosures
כל המחברים הם עובדים בעבר או בהווה של טכנולוגיות bioAffinity.
Acknowledgements
אנחנו רוצים להודות לדיוויד רודריגז על עזרתו בהכנת הדמות. דגימות כיח בוצעו על BD LSR II ב UT בריאות סן אנטוניו זרימה Cytometry משאבים משותפים מתקן, נתמך על ידי בריאות UT, NIH-NCI P30 CA054174-20 (CTRC ב UT Health) ו UL1 TR001120 (מענק CTSA).
Materials
| Name | Company | Catalog Number | Comments |
| 1% Paraformaldehyde Flow-Fix | Polysciences | 25037 | |
| 100 µM nylon cell strainers, Falcon #352360 | Fisher Scientific | 08-771-19 | |
| 3 M NaOH | EMD | SX0593-1 | |
| 50 mL conical falcon tube | Fisher Scientific | 14-432-22 | |
| Alexa488 anti-human CD19 | BioLegend | 302219 | |
| Alexa488 anti-human CD3 | BioLegend | 300415 | |
| Alexa488 anti-human cytokeratin | BioLegend | 628608 | |
| Alexa488 PanCK, CD3, and CD19 Isotype | BioLegend | 400129 | |
| BV510 anti-human CD45 | BioLegend | 304036 | |
| CD66b FITC isotype | BD Biosciences | 555748 | |
| CompBead Plus Compensation Beads | BD Biosciences | 560497 | |
| Corning Polystyrene dispoable sterile bottle 250 mL | Fisher Scientific | 09-761-4 | |
| Corning Polystyrene dispoable sterile bottle 500 mL | Fisher Scientific | 09-761-10 | |
| CS&T beads | BD Biosciences | 655051 | |
| DTT | Fisher Scientific | BP172-5 | |
| FITC anti-human CD66b | GeneTex | GTX75907 | |
| Fixable Viability Stain | BD Biosciences | 564406 | |
| FlowCheck | Beckman Coulter | A69183 | |
| FlowSet | Beckman Coulter | A69184 | |
| HBSS | Fisher Scientific | 14-175-095 | |
| NAC | Sigma-Aldrich | A9165 | |
| NIST Beads, 05 μM | Polysciences | 64080 | |
| NIST Beads, 20 μM | Polysciences | 64160 | |
| NIST Beads, 30 μM | Polysciences | 64170 | |
| PE anti-human CD45 | BioLegend | 304039 | |
| PE-CF594 anti-human EpCAM | BD Biosciences | 565399 | |
| PE-CF594 CD206/EpCAM Isotype | BD Biosciences | 562292 | |
| PE-CR594 anti-human CD206 | BD Biosciences | 564063 | |
| Sodium citrate dihydrate | EMD | SX0445-1 | |
| Trypan Blue solution, 0.4% | Fisher Scientific | 15250061 |
References
- Lugli, E., Roederer, M., Cossarizza, A. Data analysis in flow cytometry: the future just started. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 77 (7), 705-713 (2010).
- Perfetto, S. P., Chattopadhyay, P. K., Roederer, M. Seventeen-colour flow cytometry: unravelling the immune system. Nature Reviews. Immunology. 4 (8), 648-655 (2004).
- Chattopadhyay, P. K., Roederer, M. Cytometry: today's technology and tomorrow's horizons. Methods. 57 (3), San Diego, Calif. 251-258 (2012).
- Robinson, J. P., Roederer, M. History of science. Flow cytometry strikes gold. Science. 350 (6262), New York, N.Y. 739-740 (2015).
- Orfao, A., et al. Immunophenotypic dissection of normal hematopoiesis. Journal of Immunological Methods. 475, 112684(2019).
- Craig, F. E., Foon, K. A. Flow cytometric immunophenotyping for hematologic neoplasms. Blood. 111 (8), 3941-3967 (2008).
- Bento, L. C., et al. The use of flow cytometry in myelodysplastic syndromes: A review. Frontiers in Oncology. 7, 270(2017).
- Della Porta, M. G., Picone, C. Diagnostic utility of flow cytometry in myelodysplastic syndromes. Mediterranean Journal of Hematology and Infectious Diseases. 9 (1), 2017017(2017).
- Belda, J., et al. Induced sputum cell counts in healthy adults. American Journal of Respiratory and Critical Care Medicine. 161 (2), Pt 1 475-478 (2000).
- Spanevello, A., et al. Induced sputum cellularity. Reference values and distribution in normal volunteers. American Journal of Respiratory and Critical Care Medicine. 162 (3), Pt 1 1172-1174 (2000).
- Thomas, R. A., et al. The influence of age on induced sputum differential cell counts in normal subjects. Chest. 126 (6), 1811-1814 (2004).
- Hastie, A. T., et al. Mixed sputum granulocyte longitudinal impact on lung function in the severe asthma research program. American Journal of Respiratory and Critical Care Medicine. 203 (7), 882-892 (2021).
- Hastie, A. T., et al. Association of sputum and blood eosinophil concentrations with clinical measures of COPD severity: an analysis of the SPIROMICS cohort. The Lancet. Respiratory Medicine. 5 (12), 956-967 (2017).
- Kim, J., et al. Innate immune crosstalk in asthmatic airways: Innate lymphoid cells coordinate polarization of lung macrophages. The Journal of Allergy and Clinical Immunology. 143 (5), 1769-1782 (2019).
- Bai, Y., Zhou, Q., Fang, Q., Song, L., Chen, K. Inflammatory cytokines and T-Lymphocyte subsets in serum and sputum in patients with bronchial asthma and chronic obstructive pulmonary disease. Medical Science Monitor: International Medical Journal of Experimental and Clinical Research. 25, 2206-2210 (2019).
- Patriquin, L., et al. Early detection of lung cancer with meso tetra (4-Carboxyphenyl) porphyrin-labeled sputum. Journal of Thoracic Oncology. 10 (9), 1311-1318 (2015).
- Hristara-Papadopoulou, A., Tsanakas, J., Diomou, G., Papadopoulou, O. Current devices of respiratory physiotherapy. Hippokratia. 12 (4), 211-220 (2008).
- Fahy, J. V., Liu, J., Wong, H., Boushey, H. A. Cellular and biochemical analysis of induced sputum from asthmatic and from healthy subjects. The American Review of Respiratory Disease. 147 (5), 1126-1131 (1993).
- Alexis, N., Soukup, J., Ghio, A., Becker, S. Sputum phagocytes from healthy individuals are functional and activated: a flow cytometric comparison with cells in bronchoalveolar lavage and peripheral blood. Clinical Immunology. 97 (1), 21-32 (2000).
- Guiot, J., et al. Methodology for sputum induction and laboratory processing. Journal of Visualized Experiments: JoVE. (130), e56612(2017).
- Paggiaro, P. L., et al. Sputum induction. The European Respiratory Journal. Supplement. 37, 3-8 (2002).
- Anjuman, N., Li, N., Guarnera, M., Stass, S. A., Jiang, F. Evaluation of lung flute in sputum samples for molecular analysis of lung cancer. Clinical and Translational Medicine. 2, 15(2013).
- Sethi, S., Yin, J., Anderson, P. K. Lung flute improves symptoms and health status in COPD with chronic bronchitis: A 26 week randomized controlled trial. Clinical and Translational Medicine. 3, 29(2014).
- Su, J., et al. Analysis of lung flute-collected sputum for lung cancer diagnosis. Biomarker Insights. 10, 55-61 (2015).
- Naraparaju, S., Vaishali, K., Venkatesan, P., Acharya, V. A comparison of the Acapella and a threshold inspiratory muscle trainer for sputum clearance in bronchiectasis-A pilot study. Physiotherapy Theory and Practice. 26 (6), 353-357 (2010).
- Hinson, K. F., Kuper, S. W. The diagnosis of lung cancer by examination of sputum. Thorax. 18, 350-353 (1963).
- Johnston, W. W., Bossen, E. H. Ten years of respiratory cytopathology at Duke University Medical Center. I. The cytopathologic diagnosis of lung cancer during the years 1970 to 1974, noting the significance of specimen number and type. Acta Cytologica. 25 (2), 103-107 (1981).
- Ng, A. B., Horak, G. C. Factors significant in the diagnostic accuracy of lung cytology in bronchial washing and sputum samples. II. Sputum samples. Acta Cytologica. 27 (4), 397-402 (1983).
- Smiths Medical Videos. , Available from: https://videos.smiths-medical.com/search?q=acapella&page=1 (2021).
- Pizzichini, E., et al. Indices of airway inflammation in induced sputum: reproducibility and validity of cell and fluid-phase measurements. American Journal of Respiratory and Critical Care Medicine. 154 (2), 308-317 (1996).
- Miller, H. R., Phipps, P. H., Rossier, E. Reduction of nonspecific fluorescence in respiratory specimens by pretreatment with N-acetylcysteine. Journal of Clinical Microbiology. 24 (3), 470-471 (1986).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. Journal of Immunological Methods. 243 (1-2), 77-97 (2000).
- Maecker, H. T., Trotter, J. Flow cytometry controls, instrument setup, and the determination of positivity. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 69 (9), 1037-1042 (2006).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (second edition). European Journal of Immunology. 49 (10), 1457(2019).
- Stewart, C. C., Stewart, S. J. Titering antibodies. Current Protocols in Cytometry. , Chapter 4, Unit 4.1 (2001).
- Kasai, Y., et al. biopsy of human oral mucosal epithelial cells as a quality control of the cell source for fabrication of transplantable epithelial cell sheets for regenerative medicine. Regenerative Therapy. 4, 71-77 (2016).
- Kini, S. R. Color Atlas of Pulmonary Cytopathology. , Springer-Verlag New York, Inc. (2002).
- Papanicolaou Society of Cytopathology Task Force on Standards of Practice. Guidelines of the Papanicolaou Society of Cytopathology for the examination of cytologic specimens obtained from the respiratory tract. Diagnostic Cytopathology. 21 (1), 61-69 (1999).
- Holmes, K. L., et al. International Society for the Advancement of Cytometry cell sorter biosafety standards. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 85 (5), 434-453 (2014).
- Datta, S., Shah, L., Gilman, R. H., Evans, C. A. Comparison of sputum collection methods for tuberculosis diagnosis: a systematic review and pairwise and network meta-analysis. The Lancet Global Health. 5 (8), 760-771 (2017).
- Armstrong-Hough, M., et al. "Something so hard": a mixed-methods study of home sputum collection for tuberculosis contact investigation in Uganda. The International Journal of Tuberculosis and Lung Disease: The Official Journal of the International Union Against Tuberculosis and Lung Disease. 22 (10), 1152-1159 (2018).
- Freeman, C. M., et al. Design of a multi-center immunophenotyping analysis of peripheral blood, sputum and bronchoalveolar lavage fluid in the Subpopulations and Intermediate Outcome Measures in COPD Study (SPIROMICS). Journal of Translational Medicine. 13, 19(2015).
- Petsky, H. L., Li, A., Chang, A. B. Tailored interventions based on sputum eosinophils versus clinical symptoms for asthma in children and adults. The Cochrane Database of Systematic Reviews. 8, 005603(2017).
- Hisert, K. B., Liles, W. C., Manicone, A. M. A flow cytometric method for isolating cystic fibrosis airway macrophages from expectorated sputum. American Journal of Respiratory Cell and Molecular Biology. 61 (1), 42-50 (2019).
- Duncan, G. A., et al. Microstructural alterations of sputum in cystic fibrosis lung disease. Journal of Clinical Investigation Insight. 1 (18), 88198(2016).
- Kemp, R. A., Reinders, D. M., Turic, B. Detection of lung cancer by automated sputum cytometry. Journal of Thoracic Oncology: Official Publication of the International Association for the Study of Lung Cancer. 2 (11), 993-1000 (2007).
- Blandin Knight, S., et al. Progress and prospects of early detection in lung cancer. Open Biology. 7 (9), (2017).
- Gomperts, B. N., Spira, A., Elashoff, D. E., Dubinett, S. M. Lung cancer biomarkers: FISHing in the sputum for risk assessment and early detection. Cancer Prevention Research. 3 (4), Philadelphia, Pa. 420-423 (2010).
- Demoruelle, M. K., et al. Antibody responses to citrullinated and noncitrullinated antigens in the sputum of subjects with rheumatoid arthritis and subjects at risk for development of rheumatoid arthritis. Arthritis & Rheumatology. 70 (4), Hoboken, N.J. 516-527 (2018).
- Wang, K., et al. Differences of severe acute respiratory syndrome coronavirus 2 shedding duration in sputum and nasopharyngeal swab specimens among adult inpatients with coronavirus disease 2019. Chest. 158 (5), 1876-1884 (2020).
- Chattopadhyay, P. K., Hogerkorp, C. -M., Roederer, M. A chromatic explosion: the development and future of multiparameter flow cytometry. Immunology. 125 (4), 441-449 (2008).
- Chattopadhyay, P. K., Gierahn, T. M., Roederer, M., Love, J. C. Single-cell technologies for monitoring immune systems. Nature Immunology. 15 (2), 128-135 (2014).
- Perfetto, S. P., et al. Amine-reactive dyes for dead cell discrimination in fixed samples. Current Protocols in Cytometry. , Chapter 9, Unit 9.34 (2010).
- Chattopadhyay, P. K., et al. Quantum dot semiconductor nanocrystals for immunophenotyping by polychromatic flow cytometry. Nature Medicine. 12 (8), 972-977 (2006).
- Duetz, C., Bachas, C., Westers, T. M., Avan de Loosdrecht, A. A. Computational analysis of flow cytometry data in hematological malignancies: future clinical practice. Current Opinion in Oncology. 32 (2), 162-169 (2020).
- Saeys, Y., Van Gassen, S., Lambrecht, B. N. Computational flow cytometry: helping to make sense of high-dimensional immunology data. Nature Reviews. Immunology. 16 (7), 449-462 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved