Method Article
通过流式细胞术进行质量控制痰液分析
摘要
该协议描述了一种将痰液解离为单细胞悬浮液的有效方法,以及随后在标准流式细胞术平台上对细胞亚群的表征。
摘要
痰液广泛用于研究细胞含量和其他微环境特征,以了解肺部的健康,传统上使用基于细胞学的方法进行分析。它的效用有限,因为阅读幻灯片非常耗时,需要高度专业化的人员。此外,广泛的碎片和过多的鳞状上皮细胞(SEC)或脸颊细胞的存在往往使样本不足以诊断。相比之式细胞术允许对细胞群进行高通量表型分析,同时排除碎片和 SEC 。
这里介绍的方案描述了一种将痰液解离成单细胞悬浮液,抗体染色和固定细胞群以及在流式细胞术平台上获取样品的有效方法。这里介绍了一种门控策略,描述了排除碎片,死细胞(包括SEC)和细胞二倍体。此外,这项工作还解释了如何基于分化簇(CD)45阳性和阴性群体分析活的单个痰细胞,以表征造血和上皮谱系亚群。通过识别肺部特异性巨噬细胞作为样本来自肺部而不是唾液的证据,还可以提供质量控制措施。最后,已经证明该方法可以通过提供在三个流式细胞仪上分析的同一患者的痰液图谱应用于不同的细胞术平台;Navios EX,LSR II和Lyric。此外,可以修改该协议以包括感兴趣的其他细胞标记物。这里提出了一种在流式细胞术平台上分析整个痰液样本的方法,该方法使痰液适合于开发肺病的高通量诊断。
引言
流式细胞仪硬件和软件的技术进步使得同时识别许多不同的细胞群成为可能1,2,3,4。例如,流式细胞仪在造血细胞研究中的应用使人们对免疫系统2和造血系统的细胞层次结构5有了更好的了解,并区分了多种不同血癌的诊断方法6,7,8。虽然大多数痰细胞起源于造血9,10,11,但流式细胞术尚未广泛应用于用于诊断目的的痰液分析。然而,一些研究表明,评估痰液(最重要的细胞亚群)中的免疫细胞群可能对诊断和/或监测哮喘和慢性阻塞性肺病(COPD)等疾病有很大帮助12,13,14,15。此外,可用于流式细胞术的上皮特异性标志物的存在允许询问痰液中以下最重要的细胞亚群,肺上皮细胞。
除了能够分析不同组织起源的许多不同细胞群之外,流式细胞仪还可以在相对较短的时间内评估大量细胞。相比之下,基于载玻片的细胞学分析类型通常需要高度专业的人员和/或设备。这些分析可能是劳动密集型的,这导致只有一部分痰液样本被分析16。
三个关键问题限制了痰液在流式细胞术中的广泛使用。第一个问题涉及痰液的收集。痰液通过喘息咳嗽收集,将粘液从肺部排出到口腔中,然后吐入收集杯中。由于粘液穿过口腔,因此SEC污染的可能性很高。这种污染使标本分析复杂化,但如本研究所示,该问题在流式细胞仪平台上很容易纠正。
不是每个人都能自发产生痰液;因此,已经开发了几种设备来帮助以非侵入性方式收集痰液17。雾化器就是这样一种装置,已被证明可以产生可靠的痰液样本18,19,20。虽然雾化器是一种非常有效的非侵入性收集痰液的方法,但其使用仍然需要在有专业人员的医疗机构进行设置21。相比之下,手持设备,如肺笛22,23,24 和无伴奏合唱16,25 ,可以在家中使用,因为它们非常人性化。这些辅助设备既安全又经济高效。
对于我们来说,阿卡贝拉的效果一直比肺笛16更好,因此,阿卡贝拉装置已被选择用于痰液收集。决定使用3天的收集样本,因为使用痰液的主要目的是开发肺癌检测测试16。已经表明,与1天或2天的样本相比,3天的样本增加了肺癌检测的可能性26,27,28。然而,对于不同的目的,其他的痰液收集方法可能更可取。如果使用与此处描述的方法不同的痰液收集方法,建议仔细滴定用于流式细胞术分析的每种抗体或染料;关于不同的痰液收集方法如何影响流式细胞术的靶向蛋白质的数据很少。
抑制使用痰液进行诊断的热情的第二个问题是细胞数量,主要与流式细胞术有关。问题是收集足够的活细胞进行可靠的分析。两项研究表明,在辅助装置的帮助下,通过非侵入性方法收集的痰液样本含有足够的活细胞,可用于临床诊断或研究研究16,24。然而,这两项研究都没有解决流式细胞术的细胞数量问题。
对于构成该方案基础的研究,根据每个研究地点批准的机构指南,从患肺癌高风险的参与者中收集痰液样本。高危参与者被定义为55-75岁之间,吸烟30包年,过去15年内没有戒烟。向患者展示了如何根据制造商的说明使用阿卡贝拉装置29 ,并在家中连续三天收集痰液。样品保存在冰箱中,直到最后一次收集。在最后一个收集日,样品与冷冻冷藏袋一起连夜运往实验室。样品在收到当天被加工成单细胞悬浮液。使用这种痰液收集方法,可以获得足够的活细胞,以进行可靠的流式细胞术分析。
最后,与之前的细胞数问题相关的是如何将痰细胞从其粘液环境中释放出来的问题。如何保持细胞存活并产生不会堵塞流式细胞仪的单细胞悬浮液?基于Pizzichini等人30 和Miller等人的初步工作,该协议描述了一种简单可靠的方法,用于将痰液加工成适合流式细胞术分析的单细胞悬浮液。该方法在流式细胞术中使用了完善的指南32,33,34 来开发有效的抗体标记策略,以识别痰液中的造血细胞和上皮细胞,并提供仪器设置,质量控制措施和分析指南,在流式细胞术平台上标准化痰液分析。
研究方案
痰液处理的所有步骤都在带有适当个人防护设备的生物安全柜中进行。
1. 开始痰液解离前的试剂制备
- 在冰上解冻1%多聚甲醛(PFA),每个样品25 mL,并保持冷藏直至使用。
注意:PFA通过吸入和皮肤接触而有毒。根据制造商的说明准备固定剂,并在-20°C下冷冻在25 mL等分试样中直至使用。 - 近似样品的重量并解冻足够的0.1%二硫磷脂醇(DTT)用于步骤2.2,并将其降至37°C。 (DTT等分试样应在使用前储存在-20°C。
- 携带足够的0.5%N-乙酰基-L-半胱氨酸(NAC)至37°C进行步骤2.2。(NAC应每周新鲜一次,并在使用前储存在4°C。
2. 痰液解离
- 称量痰液样本以确定解离试剂的体积。
注:如果初始重量为≤3克,则认为样品较小;如果>3克但≤8克,则认为样品为中等;如果>8但≤16克,则样品量大;如果样品重量>16克,则样品量大。小,中,大和超大的适应症将在整个协议中使用。解离和标记所需的试剂量根据痰液样本的大小而不同。 - 将小样品转移到干净的50 mL锥形管中,将中等样品转移到干净的250 mL塑料一次性瓶中,或将大样品和超大样品转移到干净的500 mL塑料一次性瓶中。加入 1 mL/g 样品重量为 0.5% NAC 和 4 mL/g 样品重量为 0.1% DTT。
- 以最大速度(15秒)涡旋,然后在室温(以最大速度)下摇摆15分钟。
- 用四体积的Hank's平衡盐溶液(HBSS)稀释样品(基于样品+试剂的总体积)以中和NAC和DTT;以最大速度快速涡旋,以最大速度在室温下摇摆5分钟。
- 通过100μm尼龙网状细胞过滤器过滤细胞悬浮液到一个或多个50 mL锥形离心管中,以产生单细胞悬浮液。
- 在4°C下以800× g 离心细胞10分钟。 吸出上清液,将所有微丸混合在一个15 mL锥形管中,然后使用相同的条件用HBSS洗涤微丸。
- 将细胞沉淀重悬于由痰液样品的初始重量确定的缓冲液体积中。
注:将小样品重悬于250μL HBSS中。将培养基样品重悬于760μL HBSS中。将大样品和超大样品重悬于1460 μL HBSS中。 - 使用台盼蓝取细胞悬浮液的等分试样进行活/死细胞计数。
注意:对于小样品,使用5μL。对于中等、大或超大样品,使用10μL,用HBSS以1:10稀释。- 将10μL痰液稀释液与30μL0.4%台盼蓝混合,以达到1:40的最终样品稀释度。装入血细胞计数器的计数室进行细胞计数。
注意:如果细胞数太低或太高而无法实现准确的计数,则可能需要调整最终稀释度。强烈建议您咨询Guiot等人20 ,以正确区分痰细胞与SEC和碎片。这对于准确的细胞计数至关重要。
- 将10μL痰液稀释液与30μL0.4%台盼蓝混合,以达到1:40的最终样品稀释度。装入血细胞计数器的计数室进行细胞计数。
- 从超大样品中,从总数中取出50×10 6 个细胞,并加入到具有足够添加的HBSS的新管中,以产生1700μL的总体积。
注意:将此视为协议其余部分的大样本。剩余的样品可以丢弃或用于其他目的。
3. 抗体和活力染料染色
- 抗体和染色染料的选择
注: 表1 显示了该方案中使用的抗体和活力染料以及它们所鉴定的细胞群。- 标记含有痰细胞的管子(参见 表2 的标记)。
- 使用5 mL流式细胞术管(与所用流式细胞仪兼容)用于具有未染色细胞的样品管和具有同种型对照的试管。使用15 mL锥形管进行血液和上皮管样品。
注意:这些样品将在抗体染色和固定后转移到流式细胞术管中。
- 标记补偿管(表3)。
注:使用与所用流式细胞仪兼容的 5 mL 流式细胞术管。 - 将HBSS,抗体和/或染料的量分别添加到每个痰细胞管和补偿管中,如 表2 和 表3所示。
注意:在添加细胞或补偿珠之前,将缓冲液(HBBS),抗体和染料添加到所有试管中,以确保所有试管的染色时间一致。 - 将 表2 中列出的痰细胞体积的量加入测定管中。
- 将补偿珠添加到补偿管中,如 表3所示。
- 将所有试管(测定和补偿管)在冰上孵育,避光,35分钟。然后,用冰冷的HBSS填充管子,并在4°C下以800× g离心10分钟。
- 对于补偿管,吸出上清液尽可能靠近颗粒,然后轻拂颗粒以松动。
- 向补偿管中加入0.5 mL冷HBSS,将其储存在4°C的冰上,并保护它们免受光照,直到需要流式细胞术分析。
- 离心后(抗体染色部分的步骤3.6)从未染色的同种型,血液和上皮管中吸出上清液,并通过轻拂管子松开沉淀。
4. 用1%多聚甲醛(PFA)固定
- 将冷的1%PFA(现在应该解冻)添加到未染色的同种型,血液和上皮管中;2 mL 至未染色和同种型试管,10 mL 至血液和上皮管。
- 将管子在冰上孵育,避光1小时。30分钟后以最大速度快速涡旋。
- 用冰冷的哈佛商学院填充管子。然后,在4°C下离心管10分钟,以1600× g。
- 在不干扰细胞沉淀的情况下吸出尽可能多的上清液,并用手指轻拂管以松动细胞。
- 将200μL冷HBSS加入未染色的同种型管中。
- 根据总细胞计数计算用于血液和上皮管重悬的HBSS体积。
注意:重悬体积= 0.15 x [总细胞计数(痰液解离步骤8)/ 106]。使用50 x 106 作为超大样品的细胞计数。 - 储存所有样品和补偿管,在4°C下保护冰上避光,直到进行流式细胞术分析。
注意:此协议未经测试存储超过 24 小时。
5. 流式细胞仪上的数据采集
- 对正在使用的流式细胞仪应用适当的启动程序。
注意:该协议的这一部分假设操作流式细胞仪的人员接受过使用可用仪器的培训,特别是关于日常程序,包括检查光学和流体系统的稳定性,标准化光散射和荧光强度的技术,以及计算和应用正确的补偿矩阵。 - 使用美国国家标准与技术研究院 (NIST) 磁珠的混合物,确保将正向散射和侧向散射电压设置为将 NIST 磁珠放置在跨整个图中,而不会将磁珠放置在离轴太近的位置。
注:此步骤对于确保通过采集后分析门控消除小于5 μm的碎屑至关重要。根据所使用的流式细胞仪,请注意,最小的磁珠不会被阈值(使用LSR II或Lyric时)或高鉴别器(使用Navios EX流式细胞仪)排除。对于Navios EX,正向和侧向散射的增益为2,正向散射的电压为236,侧向散射的电压为250。对于LSR II,使用了165的正向散射电压和190的侧散射电压。 - 将流速设置为中等 (LSR II) 或高 (Navios EX)。
注意:大多数仪器的中高流速可用于获取痰管。重要的是要注意,使用太慢的流速或太稀的样品可能导致细胞沉降,从而导致涡旋增加,这是不希望的。因此,坚持步骤4.6中计算的重悬体积应导致可以快速获得但不堵塞机器的细胞密度。 - 调整用于散射和荧光参数的每个参数的电压,以将细胞群放置在刻度上。使用带有门控策略的数字作为如何相应地调整电压的指导。
注意:确保在采集之前在参数选择窗口中选择了所需的所有参数,否则不会获取数据。 - 首先获取未染色的痰液样本的数据,然后采集同种型染色的样本,然后是血管和上皮管。
注意:如果细胞悬浮液浓度过高,无法使流式细胞仪运行样品而不会堵塞,则可以用HBSS进一步稀释样品。
结果
该协议是在考虑临床实验室环境的情况下制定的。在协议开发过程中,重点是简单性,效率和可重复性。研究发现,处理痰液中最耗时的步骤是计数细胞。因此,该协议的设置方式使得痰液处理和细胞标记可以独立于细胞计数进行而不会浪费时间。然后,可以在抗体标记孵育期间获得准确的细胞计数,这对于适当稀释样品以进行无障碍运行仍然是必需的。
该协议使用痰液重量测量而不是细胞计数来指示使用多少抗体/染料进行最佳细胞标记。然而,痰液样本的重量有很大程度的变化;在分析的126个样品中,重量范围为0.57 g至38.30 g, 图1A 显示痰重与细胞产量的相关性不强。因此,样本分为四类;小样本的中位重量为2.1 g,中型样品为5.0 g,大样品为11.2 g,超大样品为22.0 g(图1B)。然而,仍然有一些样品产生的细胞远远超过其重量的预期(图1C),大多数样品都聚集在一起。对于小样品,中位细胞产量为8.0 x 106 个细胞,对于培养基样品为13.0 x 106,对于大样品为35.4 x 106,对于超大样品为93.0 x 106。
对该方案中使用的每种抗体进行滴定。选择具有滴定曲线最高染色指数(图2B)的平台相(图2A)浓度作为工作浓度。细胞数量的变化不会显著改变染色强度。该抗体滴定和测试是必不可少的,应谨慎设置本方案中使用的每种新抗体或染料34,35。当小心滴定抗体时,应染色的细胞数量比滴定抗体的细胞数量多10至50倍34,35。表 4 提供了此原则的示例。将抗人CD45-PE抗体滴定在1×10 6个细胞上,总体积为400μL。如果将这种针对染色体积的抗体外推到方案(见表2,其中显示了每个样品的CD45-PE量和染色体积),对于小样品,将染色0.625×106个细胞,对于培养基样品将染色1.25×106个细胞,对于大样品将染色2.5×106个细胞(表4中的A列)。计算出每个类别的单元格编号 50 倍多余分别为 31.25 x 106、62.5 x 106 和 125 x 106 单元格(B 列)。如C列和D列所示,每个大小类别的中位数和每个类别中的最大样本都在50倍范围内。
尽管各种大小的痰液样本在大小和细胞产量方面存在明显差异,但每个类别中SEC污染的中位数百分比非常相似。 图3A 显示了在单个样品中发现的SEC的百分比,根据其痰重类别进行分层。主要关注的是SEC,因为这些细胞不代表肺组织,而是代表口腔。然而,所有类别的平均SEC污染率都低于20%。 图3B 显示了在这些样品中发现的活细胞的百分比。不包括SEC,小型,中型和大型样本量类别的平均生存能力约为72%。对于超大类别,这一比例略高(79%)。
图4显示了将感兴趣的痰细胞与碎片,死细胞(其中还包括污染的SEC36)和细胞团块分离的典型门控策略。图4A显示了使用NIST磁珠设置门以消除小于5μm或大于30μm的碎片,而图4B则将此门应用于痰池。图4C显示了当被视为侧散射宽度(SSC-W)与前向散射宽度(FSC-W)(门的宽度)时的典型痰液剖面。该轮廓用于消除沿着SSC-W和FSC-W轴出现的小碎片。死细胞的消除如图4D和图4E所示。未染色的对照(图4D)用于确定FVS510阳性的截止值;FVS510阴性对照阳性的细胞被认为是死的,不会用于痰细胞分析(图4E)。最后,应用单线态栅极从分析中去除细胞双联体,如图4F所示。因此,通过图4B,图4C,图4E和图4F所示的选择门的细胞代表活的,单个痰细胞,准备使用该方案中使用的抗体进行后续分析。
在该标记方案中使用抗CD45抗体允许将活的单个痰细胞分离到血液(CD45 +)细胞室和非血液(CD45-)细胞室中。后一类包括上皮细胞和其他非血细胞。 图5A 中的顶部轮廓显示了使用未染色的痰液样本来设置CD45阳性的临界值,从而呈现捕获CD45 + 细胞和CD45-细胞的 门。 图5A 的底部轮廓显示了应用于用抗CD45抗体染色的痰液样本的这两个门。然后使用其他抗体染色以鉴定CD45 + 门内的血细胞特异性群体(图5B)和其他非血细胞群体,包括CD45- 门中的上皮群体(图5C)。在这两个图中,顶部的剖面图显示了如何使用同种型染色的痰液来设置双阴性群体,而底部的图谱显示了抗体染色的痰细胞。 图5B (底部)显示了使用在荧光(FL)1通道(抗CD66b,CD3,CD19抗体)和FL3通道中可检测到的抗CD206的抗体混合物创建的六种不同的CD45 + 细胞群。分选实验显示,肺特异性巨噬细胞位于与M一致的门中。因此,这些门中细胞的存在表明痰液样本来自肺部,而不是唾液(Bederka等人,手稿正在准备中)。 图5C (下图)显示了在CD45- 痰细胞之间FL1通道中可检测到的抗泛细胞角蛋白(panCK)和在FL3通道中可检测到的抗上皮细胞粘附分子(EpCAM)抗体产生的门控象限。
该标签协议已在Navios EX和LSR II上进行了广泛测试。在Lyric上进行了一些初步实验,但没有为其他两台机器进行广泛的乐器优化。因此,在"材料"表中为 Navios EX 和 LSR II 提供了详细的乐器设置,但没有为 Lyric 提供详细的乐器设置。为了理解可用于分析痰液细胞的这三种流式细胞术平台之间的相似性和变异性,可以从图6和图7中比较从各种机器获得的配置文件。处理两个大的痰液样品,混合,标记,分成三个相等的部分,然后在上面提到的每个流式细胞仪上获取。图6与图4类似,比较了消除碎屑、死细胞和细胞团块的门控策略。图7与图5相同,比较了从各种流式细胞仪上获得的数据中获得的血液和非血液剖面图。
比较从三种不同的流式细胞仪获得的各种轮廓表明,每种仪器都可以观察到相同的基本轮廓。需要注意的差异是SSC-W/FSC-W(宽度门)图(图6,第二行)和散点图的线性比例(图6 和 图7)。在Navios EX上生成的散点宽度图显示了一个包含门(红色框),这意味着进一步分析门中包含的所有单元格;沿左下角轴的事件将被排除。LSR II 和 Lyric 上的散点宽度图没有显示沿这些相同轴的类似事件沉积物。这种差异可能是由于Navios EX上使用的阈值非常敏感,导致之前的尺寸排除门( 图6的顶行)中出现一些小碎片。有时,在LSRII上生成的散射宽度剖面图中,沿着轴看到碎屑,但它位于右下角。在这些情况下,使用排除门(如图 6 第 2 行中间配置文件中的红色虚线框所示)从进一步分析中消除这些事件。
虽然Navios EX与Lyric和LSR II细胞仪之间的图上的对数尺度看起来略有不同,但Navios EX确实可以选择使用更多的十年来获取数据。实施更多的几十年取决于实验的背景和可视化感兴趣的人群所需的灵敏度。
Navios EX与LSR II和Lyric细胞仪之间的另一个显着区别是单线态栅极轮廓的外观。Navios EX 细胞仪配备了一个矩形流通池,其收集角度与 LSR II 不同。Navios EX 包含三个软件控制的收集角度,以优化前角光散射,从而实现适合于分析粒径的灵敏度。Navios EX 细胞仪的多边形门需要调整到比 LSRII 的单线态栅极略低的角度。Lyric的单线栅极可以进行优化,以获得类似于LSR II的轮廓。使用痰液样本,需要针对Lyric上的每个激光器优化面积缩放因子,以实现类似于LSR II的单线栅极。
图 4 至图 7 中所示的所有配置文件均使用 FlowJo 软件 10.6 版进行分析。.fcs 文件可以在 FlowRepository (https://flowrepository.org) 中找到,在 ID FR-FCM-Z3LX、FR-FCM-Z3MJ 和 FR-FCM-Z3MM 下,并可用于练习痰液分析,如图所示。
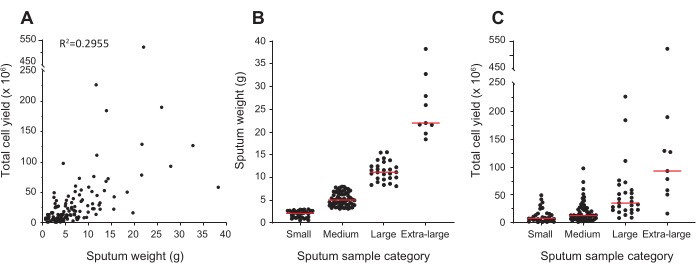
图1:痰重和细胞产量。(A)描述的是处理前确定的痰重与使用血细胞计数器处理后确定的总细胞产量之间的关系。每个项目符号代表一个单独的样本,总共 126 个样本。(B) 痰液样本根据其重量分为四类:重量不超过3克的样品为小样本,重量超过3克至8克的样品为中等,重量超过8克至16克的样品为大,重量超过16克的样品为大样品。(B) 和 (C) 中的红色条表示每个类别中的中值。请点击此处查看此图的放大版本。

图2:抗人CD45-PE的抗体滴定。 (A)CD45-PE(IgG1)滴定曲线与阳性人群的平均荧光强度(MFI)与CD45-PE抗体平台浓度在1μg/mL处的对比图。(B) 描述染色指数与抗体浓度的滴定曲线显示,最高染色指数为1 μg/mL。染色指数的计算公式为:[CD45 MFI阳性群体- CD45 MFI阴性人群]/[2*标准偏差]。根据 图2A 和 图2B,选择1μg/mL作为CD45-PE抗体的最佳浓度。 请点击此处查看此图的放大版本。

图3:痰液样本中SEC和死细胞的比例在四个重量类别中是一致的。 (A)痰液样本中SEC的比例根据其重量类别进行分类。SEC污染百分比由血细胞计数器确定,作为总细胞计数的一部分。(B)痰液样品的细胞活力,不含SECS,通过血细胞计数器和台盼蓝排除法测定。对于每个图形,红线表示中位数。 请点击此处查看此图的放大版本。
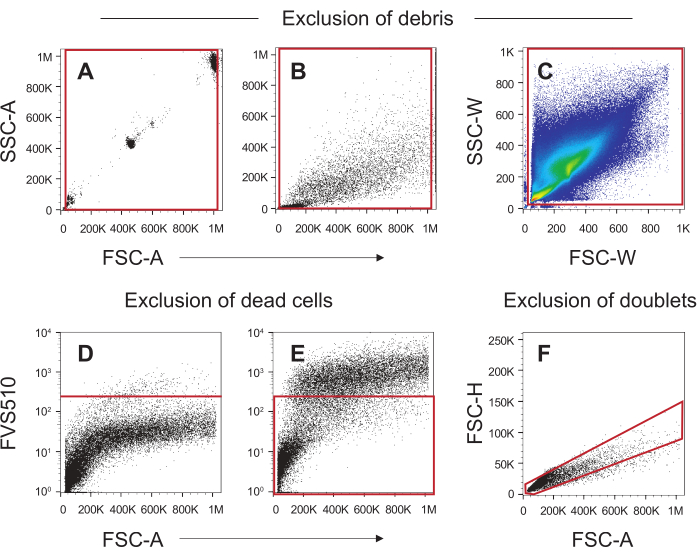
图4:用于排除痰液样本中碎屑、死细胞和双倍体的门控策略。 (A) 使用尺寸为5μm,20μm和30μm的NIST珠子来设置红色框指示的门,以排除小于5μm的碎片和高于30μm且靠近轴线的较大碎片。(B)使用与NIST磁珠相同的正向和侧面散射电压获取痰液样本。(A)中形成的门用于排除碎片。(C) 靠近轴线的小碎片在此散点宽度图中被排除在外。(D)使用未染色的痰液样本为活性染料的阴性,未染色的群体设置截止线(红线)。 (E) 将D中产生的截止值施加到染色的痰液样本上,以形成一个门(红色盒子),以包括活的,活的细胞。(F) 红色多边形指示的单线态门排除了不落在对角线上的像元,从而消除了双面和/或团块。 请点击此处查看此图的放大版本。
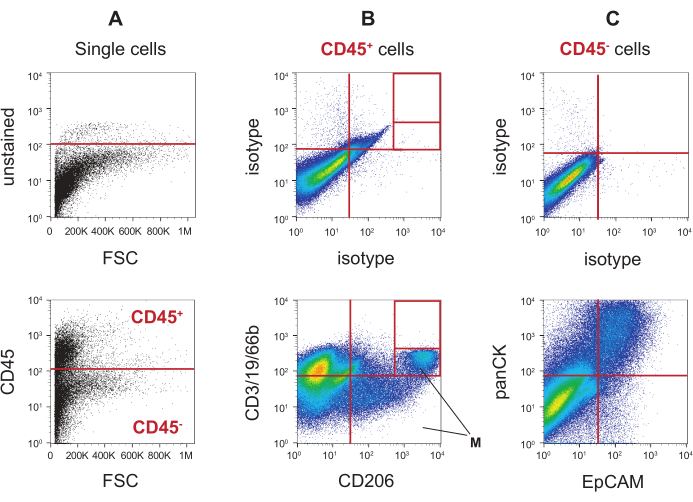
图5:将痰细胞门控策略放入血液和非血细胞区室。 (A)来自单线态门的未染色痰细胞用于设置CD45阴性群体的截止值(红线)(顶部)。将顶部轮廓的截止值应用于染色的痰液样本(底部),以区分CD45阳性(CD45 +)和阴性人群(CD45-)。(B)用FITC / AF488同种型抗体染色的CD45 + 痰细胞用于设置阴性群体的门(顶部)。相同的门应用于用血细胞标志物CD3,CD19,CD66b和CD206染色的CD45 + 痰细胞(底部)。(C)将象限门放置在用同种型对照染色的CD45- 痰细胞上(顶部),并应用于用上皮标志物泛细胞角蛋白(panCK)和EpCAM(底部)染色的痰液样本中的CD45- 细胞。 请点击此处查看此图的放大版本。

图6:在三个流式细胞仪平台上排除染色痰细胞碎片,团块和死细胞的门控策略。 对两个大痰液样本进行处理、合并、标记,并分成三个相等的部分,以便在 Navios EX (A)、LSR II (B) 和 Lyric (C) 流式细胞仪上进行采集。顶排:痰液样本被门控(红色盒子)以排除非常小和大的碎片。第二行:Navios EX 图中的红色大框表示包含细胞但排除碎片的夹杂物门。在LSR II图中看到的虚线小红框代表了一个排除门,用于消除进一步分析中的碎片。需要对 Lyric 进行进一步优化,以确定在何处需要碎片排除门控。因此,该图中没有门。第三行:红色矩形门包括活细胞,用于进一步分析。底行:多边形门具有单个像元,方法是排除落在栅极对角线外的双精度面。 请点击此处查看此图的放大版本。
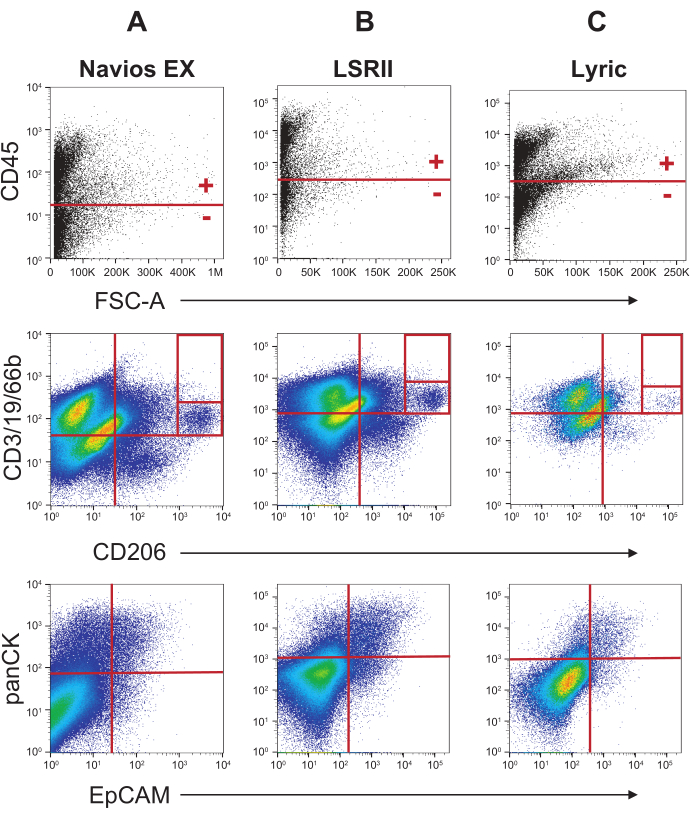
图7:在三个流式细胞术平台上对血液和上皮标志物进行痰液染色的门控策略。图6所示的分析在图7中继续;将所有有活力的单细胞(底排,图6)分为CD45+和CD45-群体(第一行,图7),以便血细胞特异性标志物和上皮细胞特异性标志物可以进一步描绘这些群体。第二行:来自CD45 +细胞的血细胞标志物CD3 / CD19 / CD66b和CD206的概况。第三行:来自CD45-细胞的上皮细胞标志物panCK和EpCAM。请点击此处查看此图的放大版本。
| 抗体/染色 | 目的 |
| FVS510系列 | 活性染色剂 |
| 反人 CD45 – PE | 泛白细胞标记; PE补偿 |
| 反人类CD66b – FITC | 粒细胞标记 |
| 反人类 CD3 – Alexa488 | T细胞标志物 |
| 反人类 CD19 – Alexa488 | B细胞标记物;FITC/Alexa488 补偿 |
| 反人类 CD206 – PE-CF594 | 肺巨噬细胞标志物; PE-CF594 补偿 |
| 反人类 EpCAM – PE-CF594 | 上皮细胞标志物; PE-CF594 补偿 |
| 抗人泛细胞角蛋白 (panCK) – Alexa488 | 上皮细胞标志物 |
| IgG1κ – Alexa488 | CD3/CD19/panCK 同种型对照 |
| IgG1κ – FITC | CD66b同种型对照 |
| IgG1κ – PE-CF594 | CD206/EpCAM 同种型对照 |
| 反人类 CD45 – BV510 | FVS510 补偿 |
表1:使用的抗体和活性染色剂。 本方案中使用的抗体和活性染料列表。指示的是它们各自识别的细胞子集。
| 管(标签) | 样本数量* | 哈佛商学院 (μL) | FVS510 (μL) | CD45 (μL) | 其他抗体(μL) | 细胞 § (μL) | |||
| 未染色 | 小 | 80 | 20 | ||||||
| 中等 | 50 | 50 | |||||||
| 大 | 50 | 50 | |||||||
| IgG1κ - Alexa488 | IgG1κ- FITC | IgG1κ - PE-CF594 | |||||||
| 同种型控制 | 小 | 60.65 | 0.6 | 10 | 2 | 6 | 0.75 | 20 | |
| 中等 | 30.65 | 0.6 | 10 | 2 | 6 | 0.75 | 50 | ||
| 大 | 30.25 | 1 | 10 | 2 | 6 | 0.75 | 50 | ||
| CD206 | 光盘3 | 光盘19 | CD66b | ||||||
| 血 | 小 | 92.875 | 1.5 | 25 | 1.875 | 5 | 1.25 | 7.5 | 115 |
| 中等 | 65.75 | 3 | 50 | 3.75 | 10 | 2.5 | 15 | 350 | |
| 大 | 102.5 | 10 | 100 | 7.5 | 20 | 5 | 30 | 725 | |
| 断续器 | 潘克 | ||||||||
| 上皮 | 小 | 96.5 | 1.5 | 25 | 10 | 2 | 115 | ||
| 中等 | 73 | 3 | 50 | 20 | 4 | 350 | |||
| 大 | 117 | 10 | 100 | 40 | 8 | 725 | |||
| *根据方案的痰液解离部分的步骤1中确定的重量,样品被认为是小,中或大的。 | |||||||||
| § 在分配所有试剂 后 应加入细胞,包括补偿管中的试剂(表3)。 | |||||||||
表2:带有痰细胞的管子的内容。 使用实验方案中引用的此表,为适当的样本量添加指定体积的抗体和活力染色剂。
| 管(标签) | 加入试剂(μL) | 添加试剂(滴) | ||||||
| 哈佛商学院 | 钙45-聚乙烯 | CD206-聚乙烯-CF594 | 爱普卡姆-PE-CF594 | CD19-亚历克488 | CD45-BV510 | CompBead (+) | CompBead * (-) | |
| PE comp. | 76 | 4 | x | x | x | x | 1 | 1 |
| PE-CF594 复合物 | 72 | x | 4 | 4 | x | x | 1 | 1 |
| Alexa488/FITC comp. | 60 | x | x | x | 20 | x | 1 | 1 |
| BV510 配套 | 60 | x | x | x | x | 20 | 1 | 1 |
| *在分配完所有试剂并制备表2中的试管 后 ,应加入阳性(+)和阴(-)珠。 | ||||||||
| 补偿 = 补偿 | ||||||||
表3:补偿管的内容。 使用实验方案中引用的此表将指定体积的抗体添加到代偿微球中。
| 单元格编号 (x 106) | ||||
| 一个 | B | C | D | |
| 样本数量 | 染色量 * | 50 倍访问 ¶ | 中位数样本(折叠访问) # | 最大样本(折叠访问) # |
| 小 | 0.625 | 31.25 | 8.0 (12.8) | 24.77 (39.6) |
| 中等 | 1.25 | 62.5 | 13.0 (10.4) | 48.87 (39.1) |
| 大 | 2.5 | 125 | 35.4 (14.2) | 113.5 (45.4) |
| *方案中使用的染色体积(表2)。 细胞数是从滴定曲线的执行方式推断出来的;1 μg/ mL CD45-PE和1 x 10 6 个细胞/ 200μL。 | ||||
| ¶ A 列中单元格编号的 50 倍访问。 | ||||
| # 列 C 和 D 中的折叠访问是通过将列 C 或 D 的单元格中显示的数字除以列 A 中相应单元格中的数字来计算的。 | ||||
表4:每个样本量类别中所有样品的反人CD45-PE浓度。
讨论
痰液的细胞含量包括种类繁多的宽范围细胞,往往伴有大量碎片37。此外,痰液分析需要质量控制,以确认样本是从肺部而不是口腔收集的38。因此,通过流式细胞术分析痰液并不像血液那样简单,例如,血液释放出更清洁和均匀的细胞悬浮液。该协议已经解决了所有这些问题:提供使用特定尺寸的微球的仪器设置,以确保可以检测到最小和最大的细胞群,门控策略以消除碎片,细胞团块,污染SEC和其他死细胞,最后,质量控制措施,以确保痰液样本来自肺部而不是大部分是唾液。
在处理痰液时,方案中有一些关键步骤值得指出。首先,细胞产量可能受到方案中痰液解离部分的步骤2.5中使用的尼龙细胞过滤器数量的急剧影响。可能需要多个过滤器,以避免由于过滤器堵塞而丢失太多细胞。当通过过滤器的流量明显减慢时,应使用新的过滤器。其次,痰液样本的细胞沉淀可能非常松散,特别是如果SEC污染程度很高。因此,在离心样品后除去上清液时,必须不要吸出太靠近沉淀。吸气太靠近沉淀可能导致细胞损失,如果不是整个沉淀的损失。第三,该协议需要固定步骤。这可以保留细胞及其染色特征,并作为保护流式细胞仪操作员的安全措施。由于产生气溶胶的可能性,在某些流式细胞仪上运行样品可能会增加生物危害39。PFA固定有助于保护操作者免受痰液样本中潜在病原体的侵害。第四,也许是制备痰液样品进行流式细胞术分析最具挑战性的方面是细胞计数。由于痰液中存在多种细胞类型,细胞计数很复杂。计数机通常受到它们可以捕获的细胞大小范围的限制,因此不如血细胞计数器可靠。然而,通过血细胞计数器对痰液样本进行细胞计数(Guiot等人20对此进行了出色的描述)是乏味的,需要实践才能熟练。准确的细胞数量对于确定样品的最终重悬体积至关重要,以实现合理的流速并防止流式细胞仪堵塞。痰液中存在非常大的SEC和许多较小的细胞团块,这些细胞团块没有被解离缓冲液分解,也没有被过滤器捕获,这增加了堵塞流式细胞仪的可能性。因此,建议花一些时间确定最佳细胞浓度/流速,以便使用可用的流式细胞仪进行数据采集。此外,确保流式细胞仪具有适当的流通池和喷嘴尺寸(或探针),能够测量痰液中存在的较大细胞群。
即使已经熟练掌握了细胞计数,这仍然是一个耗时的过程。因此,试剂在该协议中对细胞标记的测定基于样本数量(按重量判断)而不是细胞数量。这样可以更有效地利用时间,因为手动细胞计数可以在抗体和活性染料染色所需的时间内完成。但是,有三个值得注意的例外。如果样品>16g(所谓的超大样品),则在染色之前应进行手动细胞计数,以便通过仅染色25 x 10 6 个细胞来保存昂贵的试剂用于血液和上皮管。此小区号在此协议中描述的设置中提供了非常可靠的配置文件。另一个潜在的例外是样本非常小的情况。估计是,该方案中提供的流式细胞术分析至少需要1-2 x 10 6 个细胞才能生成可靠的图谱(数据未显示)。因此,如果样品含有少于1-2 x 106 个细胞,则可能不值得继续该过程,因为最终结果可能是不可接受的。
对外周血细胞或细胞系效果良好的特定标记试剂可能对痰液中含有的血细胞起作用非常不同(未发表的观察结果)。因此,建议在将每种抗体或其他标记试剂用于流式细胞术实验之前,根据完善的方案进行滴定34,35 。大多数抗体滴定在染色高达10至50倍时应给出可比的结果;但是,建议对高于该范围的细胞数进行额外的滴定34。确定试剂浓度后,必须保持该试剂的孵育时间与实际实验相同。因此,该协议强调在添加细胞或补偿微珠之前将所有缓冲液和试剂添加到试管中。这种将试剂和细胞/微球一起添加的顺序允许在标记时间上实现更高的一致性。如果由于某种原因,实验孵育时间不能与用于抗体/染料滴定的孵育时间相似,则应在实验期间可行的孵育时间重复后者。
痰液样本已被广泛用作诊断标本,以研究影响肺部的各种疾病的病理生理学。肺结核40,41,COPD13,42,哮喘43,囊性纤维化44,45,肺癌46,47,48和类风湿性关节炎49是研究痰液的许多疾病之一,因为它是非侵入性获得的标本。最近,在冠状病毒大流行期间,痰液已被用于检测2019年冠状病毒病(COVID-19)住院患者的病毒长期脱落50。
各种技术,包括逆转录聚合酶链反应(RT-PCR),蛋白质分析,显微镜检查和流式细胞术,已被用于鉴定痰液中的疾病特异性标志物。使用流式细胞术平台分析痰液样本并未被广泛使用,但其使用量增加。随着流式细胞仪技术的最新进展3,51,52,以及荧光团化学的进步,新抗体克隆的产生以及各种染料的开发以识别死细胞群51,53,54,设计旨在诊断人类疾病的抗体组合的可能性已大大增加。此外,最近推动流式细胞术数据分析自动化55,56 将消除手动读取和解释流数据的潜在偏差。流式细胞术的这些新发展将大大促进痰液作为临床诊断的探索。
披露声明
所有作者都是bioAffinity Technologies的过去或现在的员工。
致谢
我们要感谢大卫·罗德里格斯(David Rodriguez)对人物准备工作的协助。痰液样本在UT Health San Antonio流式细胞术共享资源设施的BD LSR II上运行,由UT Health,NIH-NCI P30 CA054174-20(UT Health的CTRC)和UL1 TR001120(CTSA授权)提供支持。
材料
| Name | Company | Catalog Number | Comments |
| 1% Paraformaldehyde Flow-Fix | Polysciences | 25037 | |
| 100 µM nylon cell strainers, Falcon #352360 | Fisher Scientific | 08-771-19 | |
| 3 M NaOH | EMD | SX0593-1 | |
| 50 mL conical falcon tube | Fisher Scientific | 14-432-22 | |
| Alexa488 anti-human CD19 | BioLegend | 302219 | |
| Alexa488 anti-human CD3 | BioLegend | 300415 | |
| Alexa488 anti-human cytokeratin | BioLegend | 628608 | |
| Alexa488 PanCK, CD3, and CD19 Isotype | BioLegend | 400129 | |
| BV510 anti-human CD45 | BioLegend | 304036 | |
| CD66b FITC isotype | BD Biosciences | 555748 | |
| CompBead Plus Compensation Beads | BD Biosciences | 560497 | |
| Corning Polystyrene dispoable sterile bottle 250 mL | Fisher Scientific | 09-761-4 | |
| Corning Polystyrene dispoable sterile bottle 500 mL | Fisher Scientific | 09-761-10 | |
| CS&T beads | BD Biosciences | 655051 | |
| DTT | Fisher Scientific | BP172-5 | |
| FITC anti-human CD66b | GeneTex | GTX75907 | |
| Fixable Viability Stain | BD Biosciences | 564406 | |
| FlowCheck | Beckman Coulter | A69183 | |
| FlowSet | Beckman Coulter | A69184 | |
| HBSS | Fisher Scientific | 14-175-095 | |
| NAC | Sigma-Aldrich | A9165 | |
| NIST Beads, 05 μM | Polysciences | 64080 | |
| NIST Beads, 20 μM | Polysciences | 64160 | |
| NIST Beads, 30 μM | Polysciences | 64170 | |
| PE anti-human CD45 | BioLegend | 304039 | |
| PE-CF594 anti-human EpCAM | BD Biosciences | 565399 | |
| PE-CF594 CD206/EpCAM Isotype | BD Biosciences | 562292 | |
| PE-CR594 anti-human CD206 | BD Biosciences | 564063 | |
| Sodium citrate dihydrate | EMD | SX0445-1 | |
| Trypan Blue solution, 0.4% | Fisher Scientific | 15250061 |
参考文献
- Lugli, E., Roederer, M., Cossarizza, A. Data analysis in flow cytometry: the future just started. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 77 (7), 705-713 (2010).
- Perfetto, S. P., Chattopadhyay, P. K., Roederer, M. Seventeen-colour flow cytometry: unravelling the immune system. Nature Reviews. Immunology. 4 (8), 648-655 (2004).
- Chattopadhyay, P. K., Roederer, M. Cytometry: today's technology and tomorrow's horizons. Methods. 57 (3), San Diego, Calif. 251-258 (2012).
- Robinson, J. P., Roederer, M. History of science. Flow cytometry strikes gold. Science. 350 (6262), New York, N.Y. 739-740 (2015).
- Orfao, A., et al. Immunophenotypic dissection of normal hematopoiesis. Journal of Immunological Methods. 475, 112684(2019).
- Craig, F. E., Foon, K. A. Flow cytometric immunophenotyping for hematologic neoplasms. Blood. 111 (8), 3941-3967 (2008).
- Bento, L. C., et al. The use of flow cytometry in myelodysplastic syndromes: A review. Frontiers in Oncology. 7, 270(2017).
- Della Porta, M. G., Picone, C. Diagnostic utility of flow cytometry in myelodysplastic syndromes. Mediterranean Journal of Hematology and Infectious Diseases. 9 (1), 2017017(2017).
- Belda, J., et al. Induced sputum cell counts in healthy adults. American Journal of Respiratory and Critical Care Medicine. 161 (2), Pt 1 475-478 (2000).
- Spanevello, A., et al. Induced sputum cellularity. Reference values and distribution in normal volunteers. American Journal of Respiratory and Critical Care Medicine. 162 (3), Pt 1 1172-1174 (2000).
- Thomas, R. A., et al. The influence of age on induced sputum differential cell counts in normal subjects. Chest. 126 (6), 1811-1814 (2004).
- Hastie, A. T., et al. Mixed sputum granulocyte longitudinal impact on lung function in the severe asthma research program. American Journal of Respiratory and Critical Care Medicine. 203 (7), 882-892 (2021).
- Hastie, A. T., et al. Association of sputum and blood eosinophil concentrations with clinical measures of COPD severity: an analysis of the SPIROMICS cohort. The Lancet. Respiratory Medicine. 5 (12), 956-967 (2017).
- Kim, J., et al. Innate immune crosstalk in asthmatic airways: Innate lymphoid cells coordinate polarization of lung macrophages. The Journal of Allergy and Clinical Immunology. 143 (5), 1769-1782 (2019).
- Bai, Y., Zhou, Q., Fang, Q., Song, L., Chen, K. Inflammatory cytokines and T-Lymphocyte subsets in serum and sputum in patients with bronchial asthma and chronic obstructive pulmonary disease. Medical Science Monitor: International Medical Journal of Experimental and Clinical Research. 25, 2206-2210 (2019).
- Patriquin, L., et al. Early detection of lung cancer with meso tetra (4-Carboxyphenyl) porphyrin-labeled sputum. Journal of Thoracic Oncology. 10 (9), 1311-1318 (2015).
- Hristara-Papadopoulou, A., Tsanakas, J., Diomou, G., Papadopoulou, O. Current devices of respiratory physiotherapy. Hippokratia. 12 (4), 211-220 (2008).
- Fahy, J. V., Liu, J., Wong, H., Boushey, H. A. Cellular and biochemical analysis of induced sputum from asthmatic and from healthy subjects. The American Review of Respiratory Disease. 147 (5), 1126-1131 (1993).
- Alexis, N., Soukup, J., Ghio, A., Becker, S. Sputum phagocytes from healthy individuals are functional and activated: a flow cytometric comparison with cells in bronchoalveolar lavage and peripheral blood. Clinical Immunology. 97 (1), 21-32 (2000).
- Guiot, J., et al. Methodology for sputum induction and laboratory processing. Journal of Visualized Experiments: JoVE. (130), e56612(2017).
- Paggiaro, P. L., et al. Sputum induction. The European Respiratory Journal. Supplement. 37, 3-8 (2002).
- Anjuman, N., Li, N., Guarnera, M., Stass, S. A., Jiang, F. Evaluation of lung flute in sputum samples for molecular analysis of lung cancer. Clinical and Translational Medicine. 2, 15(2013).
- Sethi, S., Yin, J., Anderson, P. K. Lung flute improves symptoms and health status in COPD with chronic bronchitis: A 26 week randomized controlled trial. Clinical and Translational Medicine. 3, 29(2014).
- Su, J., et al. Analysis of lung flute-collected sputum for lung cancer diagnosis. Biomarker Insights. 10, 55-61 (2015).
- Naraparaju, S., Vaishali, K., Venkatesan, P., Acharya, V. A comparison of the Acapella and a threshold inspiratory muscle trainer for sputum clearance in bronchiectasis-A pilot study. Physiotherapy Theory and Practice. 26 (6), 353-357 (2010).
- Hinson, K. F., Kuper, S. W. The diagnosis of lung cancer by examination of sputum. Thorax. 18, 350-353 (1963).
- Johnston, W. W., Bossen, E. H. Ten years of respiratory cytopathology at Duke University Medical Center. I. The cytopathologic diagnosis of lung cancer during the years 1970 to 1974, noting the significance of specimen number and type. Acta Cytologica. 25 (2), 103-107 (1981).
- Ng, A. B., Horak, G. C. Factors significant in the diagnostic accuracy of lung cytology in bronchial washing and sputum samples. II. Sputum samples. Acta Cytologica. 27 (4), 397-402 (1983).
- Smiths Medical Videos. , Available from: https://videos.smiths-medical.com/search?q=acapella&page=1 (2021).
- Pizzichini, E., et al. Indices of airway inflammation in induced sputum: reproducibility and validity of cell and fluid-phase measurements. American Journal of Respiratory and Critical Care Medicine. 154 (2), 308-317 (1996).
- Miller, H. R., Phipps, P. H., Rossier, E. Reduction of nonspecific fluorescence in respiratory specimens by pretreatment with N-acetylcysteine. Journal of Clinical Microbiology. 24 (3), 470-471 (1986).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. Journal of Immunological Methods. 243 (1-2), 77-97 (2000).
- Maecker, H. T., Trotter, J. Flow cytometry controls, instrument setup, and the determination of positivity. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 69 (9), 1037-1042 (2006).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (second edition). European Journal of Immunology. 49 (10), 1457(2019).
- Stewart, C. C., Stewart, S. J. Titering antibodies. Current Protocols in Cytometry. , Chapter 4, Unit 4.1 (2001).
- Kasai, Y., et al. biopsy of human oral mucosal epithelial cells as a quality control of the cell source for fabrication of transplantable epithelial cell sheets for regenerative medicine. Regenerative Therapy. 4, 71-77 (2016).
- Kini, S. R. Color Atlas of Pulmonary Cytopathology. , Springer-Verlag New York, Inc. (2002).
- Papanicolaou Society of Cytopathology Task Force on Standards of Practice. Guidelines of the Papanicolaou Society of Cytopathology for the examination of cytologic specimens obtained from the respiratory tract. Diagnostic Cytopathology. 21 (1), 61-69 (1999).
- Holmes, K. L., et al. International Society for the Advancement of Cytometry cell sorter biosafety standards. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 85 (5), 434-453 (2014).
- Datta, S., Shah, L., Gilman, R. H., Evans, C. A. Comparison of sputum collection methods for tuberculosis diagnosis: a systematic review and pairwise and network meta-analysis. The Lancet Global Health. 5 (8), 760-771 (2017).
- Armstrong-Hough, M., et al. "Something so hard": a mixed-methods study of home sputum collection for tuberculosis contact investigation in Uganda. The International Journal of Tuberculosis and Lung Disease: The Official Journal of the International Union Against Tuberculosis and Lung Disease. 22 (10), 1152-1159 (2018).
- Freeman, C. M., et al. Design of a multi-center immunophenotyping analysis of peripheral blood, sputum and bronchoalveolar lavage fluid in the Subpopulations and Intermediate Outcome Measures in COPD Study (SPIROMICS). Journal of Translational Medicine. 13, 19(2015).
- Petsky, H. L., Li, A., Chang, A. B. Tailored interventions based on sputum eosinophils versus clinical symptoms for asthma in children and adults. The Cochrane Database of Systematic Reviews. 8, 005603(2017).
- Hisert, K. B., Liles, W. C., Manicone, A. M. A flow cytometric method for isolating cystic fibrosis airway macrophages from expectorated sputum. American Journal of Respiratory Cell and Molecular Biology. 61 (1), 42-50 (2019).
- Duncan, G. A., et al. Microstructural alterations of sputum in cystic fibrosis lung disease. Journal of Clinical Investigation Insight. 1 (18), 88198(2016).
- Kemp, R. A., Reinders, D. M., Turic, B. Detection of lung cancer by automated sputum cytometry. Journal of Thoracic Oncology: Official Publication of the International Association for the Study of Lung Cancer. 2 (11), 993-1000 (2007).
- Blandin Knight, S., et al. Progress and prospects of early detection in lung cancer. Open Biology. 7 (9), (2017).
- Gomperts, B. N., Spira, A., Elashoff, D. E., Dubinett, S. M. Lung cancer biomarkers: FISHing in the sputum for risk assessment and early detection. Cancer Prevention Research. 3 (4), Philadelphia, Pa. 420-423 (2010).
- Demoruelle, M. K., et al. Antibody responses to citrullinated and noncitrullinated antigens in the sputum of subjects with rheumatoid arthritis and subjects at risk for development of rheumatoid arthritis. Arthritis & Rheumatology. 70 (4), Hoboken, N.J. 516-527 (2018).
- Wang, K., et al. Differences of severe acute respiratory syndrome coronavirus 2 shedding duration in sputum and nasopharyngeal swab specimens among adult inpatients with coronavirus disease 2019. Chest. 158 (5), 1876-1884 (2020).
- Chattopadhyay, P. K., Hogerkorp, C. -M., Roederer, M. A chromatic explosion: the development and future of multiparameter flow cytometry. Immunology. 125 (4), 441-449 (2008).
- Chattopadhyay, P. K., Gierahn, T. M., Roederer, M., Love, J. C. Single-cell technologies for monitoring immune systems. Nature Immunology. 15 (2), 128-135 (2014).
- Perfetto, S. P., et al. Amine-reactive dyes for dead cell discrimination in fixed samples. Current Protocols in Cytometry. , Chapter 9, Unit 9.34 (2010).
- Chattopadhyay, P. K., et al. Quantum dot semiconductor nanocrystals for immunophenotyping by polychromatic flow cytometry. Nature Medicine. 12 (8), 972-977 (2006).
- Duetz, C., Bachas, C., Westers, T. M., Avan de Loosdrecht, A. A. Computational analysis of flow cytometry data in hematological malignancies: future clinical practice. Current Opinion in Oncology. 32 (2), 162-169 (2020).
- Saeys, Y., Van Gassen, S., Lambrecht, B. N. Computational flow cytometry: helping to make sense of high-dimensional immunology data. Nature Reviews. Immunology. 16 (7), 449-462 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。