Method Article
זרימה Cytometric ניתוח של שלפוחית חוץ-תאית ממדיה ממוזגים-תא
In This Article
Summary
הפרוטוקול מתאר שיטה ישימה מיועד לשימוש עם תא תרבות supernatants לאתר epitopes משטח על שלפוחית קטנה חוץ-תאית (EV). הוא מנצל immunoprecipitation EV ספציפי באמצעות חרוזים בשילוב עם נוגדנים מזהה אנטיגן פני שטח CD9, CD63, CD81. השיטה ממוטבים לניתוח cytometry במורד הזרם.
Abstract
Cytometry זרימה (FC) היא שיטת הבחירה למדידה כמותית למחצה של סמני אנטיגן פני התא. לאחרונה, נעשה שימוש בטכניקה זו עבור ניתוחים פנוטיפי של שלפוחית חוץ-תאית (EV) כולל exosomes (מסכות) הדם ההיקפיים, נוזלי גוף אחרים. גודל קטן של EV מנדטים שימוש בכלים ייעודיים שיש סף גילוי סביב 50-100 ננומטר. לחלופין, EV יכולות להיות קשורות לטקס. גרגרי שניתן לאתר על ידי מועדון הכדורגל. . גרגרי, מצומדת עם נוגדנים מזהה EV-הקשורים סמני/אשכול של בידול CD63, CD9, CD81 יכול לשמש עבור EV לכידה. Exo מבודד ס מ ניתן לנתח עם או בלי העשרה מראש על-ידי ultracentrifugation. גישה זו מתאימה ניתוחים EV באמצעות מכשירים FC המקובלת. התוצאות שלנו להפגין מתאם ליניארי בין ערכי עוצמת קרינה פלואורסצנטית מתכוון (MFI) וריכוז EV. שיבוש EV דרך sonication באופן דרמטי ירד MFI, המציין כי השיטה אינו מזהה את קרום פסולת. . מדווחים שיטה מדויקת ואמינה עבור הניתוח של אנטיגנים משטח EV, אשר ניתן ליישם בקלות במעבדה כלשהי.
Introduction
תאים מפרישים חוץ-תאית שלפוחית (EV) בגדלים שונים, כולל שלפוחיות זעירות (MV) ו exosomes (מסכות). האחרון ניתן להבדיל בין MV גם בגודל וגם תא subcellular המקור. MV (200 – 1,000 ננומטר בגודל) משתחררים מתאי האב על ידי ששפך של קרום פלזמה. לעומת זאת, Exo (30-150 ננומטר) שמקורם ממברנות endosomal, משתחררים לחלל חוץ-תאית, כאשר הגופים multivesicular (MVB). להתמזג עם קרום התא1,2.
EV יותר ויותר משמש האבחון סמנים ביולוגיים כמו גם, באופן פוטנציאלי, כלים טיפוליים בתחומים רבים, לרבות אונקולוגיה, נוירולוגיה, קרדיולוגיה, מחלות שריר-שלד3,4,5. הרוב המכריע של מחקרים מתמשכת באמצעות EV כמו סוכני טיפולית לנצל את ניתוקה של שלפוחית מ תאים ממוזגים בינוני (ס מ) של תאים בתרבית במבחנה. גזע mesenchymal (MSCs) מפעילים השפעות מועילות בהקשרים מספר, MSC-derived EV הראו יתרונות במודלים של שריר הלב איסכמיה/פגיעה reperfusion פציעה6 ו במוח פציעה7. MSC-derived EV התערוכה גם המערכת החיסונית פעילויות modulatory, שעלולים להיות מנוצלים לרעה לטיפול הדחייה החיסונית, כפי שמתואר במודל של טיפול-חסיני אש שתל – מול – מארח מחלות8. תאי גזע נוזל מי השפיר (hAFS) להעשיר באופן פעיל ס מ עם MVs, מסכות, heterogeneously מופץ בגודלם (50 – 1,000 ננומטר), אשר לתווך מספר אפקטים ביולוגיים, כגון התפשטות של תאים, אנגיוגנזה, עיכוב של פיברוזיס, ו cardioprotection4. לאחרונה הראו לנו EV, במיוחד מסכות, מופרש על ידי האדם, נגזר הלב ובתאים (Exo-CPC) להקטין לאוטם שריר הלב ב חולדות5,9.
Exo שיתוף ערכה משותפת של חלבונים על פני השטח שלהם, כולל tetraspanins (CD63, CD81, CD9), מתחם מרכזי histocompatibility מחלקה אני (MHC-אני). בנוסף זו ערכה משותפת של חלבונים, Exo מכילים גם חלבונים ספציפיים עבור המשנה EV סוג התא מפיק. Exo סמני צוברות חשיבות עליונה כי הם לשחק תפקיד מכריע בתקשורת הבין-תאית, ובכך ויסות תהליכים ביולוגיים רבים5,10. בשל גודלם הקטן, מציאת דרך קלה כדי לנתח EV באמצעות זרימה קלאסית cytometry (FC) שרידים משימה מאתגרת.
כאן, אנו מציגים פרוטוקול פשוטה לניתוח EV באמצעות FC, אשר יכול להיות מיושם דגימות מראש מועשר שהושג דרך ultracentrifugation או ישירות ס"מ (איור 1). השיטה משתמשת חרוזים מצופים נוגדן ספציפי המאגד הקנוני Exo-הקשורים משטח epitopes (CD63, CD9, CD81) בלי שוטף נוספים. ניתוחים FC יכול להתבצע באמצעות cytometer המקובלת ללא צורך התאמות לפני מדידות. שיטות אפיון אנטיגנים על חלקיקים קטנים בודדים באמצעות זרימת cytometers תוארו על ידי קבוצות אחרות לגבי יישומים שונים11,12,13. כאן השתמשנו beads מגנטי functionalized ללכידתו של חלקיקים קטנים, מסכות, ואחריו phenotyping החלקיקים שנלכדו על ידי מועדון הכדורגל. אמנם ניתן להשתמש בשיטה זו כדי לאפיין את ההרכב antigenic של שלפוחית קטנה שפורסמו על ידי כל סוג התא במבחנה, כאן אנחנו סיפקנו התרבות תאים מסוים התנאים החלים על התרבות של האדם ובתאים הלב (CPC) ואת ביותר הסביבה המתאימה לייצור של EV על ידי תאים אלה.
Protocol
1. איסוף ועיבוד של מדיה ממוזגים
- מעיל 55 ס מ2 צלחות פטרי עם ג'לטין העור חזירי 0.02% ב- PBS.
- צלחת CPC (8,000/cm2) במנות מצופים מראש עם 7 מ של Iscove שונה Dulbecco בינוני (IMDM) בתוספת 20% FBS (סרום שור עוברית) ו- 1% פניצילין/סטרפטומיצין (P/S).
הערה: המונח "עלות לקליק" מתייחס לתאים אנושיים explant נגזר כי כבר תיאר במקום14. ס מ ניתן לאסוף מכל סוגי תאים שונים תרבותי בתנאים תרבות מסוימת. יש ללבוש כפפות ולעבוד תחת ברדס ביולוגי. - ברגע תאים להגיע על 80% הנהרות, להסיר את המדיום תרבות, לשטוף פעמיים עם Dulbecco PBS (PBS) Ca - ו Mg נטול תאים ולהחליף אותו עם 10 מ ל Exo-הייצור ללא סרום בינוני (ששינה הנשר של Dulbecco בינונית [DMEM] גלוקוז גבוהות, 4.5 g/mL).
הערה: להמשיך עם ירידה הדרגתית של סרום בריכוז בינוני תרבות, להסתגל בהדרגה התאים למצב ללא סרום (SF). עבור תאים הרגישים בינונית ללא סרום להכין למדיום המכיל FBS אך דלה של EV. להכין בינוני שיושלם עם כל החומרים המזינים, בתוספת 10% – 20% (v/v) FBS. Centrifuge המדיום בן לילה ב 100,000 × g, 4 מעלות צלזיוס. שימו לב כי הליך זה אינו מבטיח 100% הסרת FBS-derived EV. - לאחר 7 ימים, לאסוף את ס מ צינורות פוליפרופילן צנטריפוגה.
הערה: הזמן עבור מיזוג בינונית תלוי בסוג התא. עבור תאים הרגישים בינונית ללא סרום, להגביר את עוצמת הראשונית של מדיום, לקצר את הזמן לאוסף ס"מ ל 24-48 שעות. - ברור ס מ מפני פסולת התא על ידי צנטריפוגה ב x 3000 g למשך 20 דקות ב 4 – 10 ° C. לאסוף את תגובת שיקוע פנימה צינור מסנן 100 kDa צנטריפוגה.
- תתרכז מסומנת ס מ על ידי מסובב את הצינור ב x 2,000 g למשך 20 דקות ב 4 – 10 ° C.
הערה: שלב זה תפחית את הנפח הראשוני של ס מ המאפשר השימוש בנפח מצומצם צינורות עבור מהירות גבוהה צנטריפוגה שלבים, ויתרום לחסל אגרגטים חלבון קטן. - לאסוף את תרכיז צינור microcentrifuge. צנטריפוגה ב 10,000 x g למשך 15 דקות ב 4 – 10 ° C.
- לאסוף את תגובת שיקוע והמשך לסעיף 2 (EV העשרה). אם ultracentrifuge אינה זמינה להמשיך ישירות בסעיף 3 (כימות ניתוח מעקב ננו-חלקיק (נ)).
הערה: העשרת מראש של EV שבר משפר את read-out הסופית בעוצמתם קרינה פלואורסצנטית (ראה תוצאות נציג, איור 4). שנוקה ס מ (מנקודת 1.8) שניתן לאחסן ב 4 ° C ואז עוד 1-2 ימים או לחילופין-−80 ° C למשך מספר חודשים. 5 ס מ צריך להיות מאושר מראש כדי להסיר את כל פסולת הסלולר לפני האחסון ב- 80 ° C על מנת להבטיח כי פסולת בגודל exosome לא נוצר בתהליך ההקפאה-הפשרה.
2. חוץ-תאית שלפוחית העשרה על-ידי Ultracentrifuge (אופציונלי)
- מקם את תגובת שיקוע מהשלב 1.8 בשפופרת פוליקרבונט הקיר עבה ultracentrifuge. ממלאים את הצינור 1 x פוספט מאגר תמיסת מלח (PBS) עד שהוא מגיע הקיבולת המקסימלית (3.2 מ"ל).
- לטעון דוגמאות רוטור קבוע-זווית טיטניום (8 x 3.2 מ"ל, k-פקטור 13). לטעון את הרוטור ב ultracentrifuge השולחן. Ultracentrifuge ב x 100,000 g עבור h 3-4 – 10 מעלות צלזיוס.
- למחוק את תגובת שיקוע, resuspend בגדר ב 100 µL ל- 1 x PBS.
3. Nanoparticle מעקב ניתוח (נ) כמת
- למהול 1 µL של מדגם (משלב גם 2.3 או 1.8) µL 999 של PBS 1 x. לטעון את הדוגמה של מזרק 1 מ"ל, הימנעות היווצרות בועה. לטעון את המזרק בנמל כניסת לשכת בדיקה.
- להפעיל את הלייזר. פתח את המצלמה עם הכפתור ללכוד . התאם את המוקד.
- לרשום לפחות 3 מסגרות שונות של 60 s כל.
- לנתח את רכישות שונות 3 באמצעות האפשרות תהליך האצווה התוכנה.
הערה: אם הטכנולוגיה נ אינו זמין, בצע כימות של חלבונים על-ידי וזמינותו ברדפורד (חלקיקים8 עונה 1 פרק 10 תואמות 1 – 2 µg של חלבון הכולל לאחר ultracentrifugation או חלבון סה כ 50-60 µg אם כימות מתבצע ישירות עבור ס מ כ הוא כולל חלבונים מזהמים שונים EV; ראה טבלה 1)5.
4. הכנת הדוגמא
- להכין מאגר של 3 הסוגים של לכידת חרוזים (CD9 חרוזים, חרוזים CD63 ו- CD81 חרוזים ב- 1:1:1 יחס; ראה טבלה של חומרים) ו מערבולת.
הערה: הבריכה נבדקו כדי להיות יציבה במשך חודש. סוג אחד של לכידת חרוז עשוי לשמש, זה יאפשר את זיהוי אוכלוסיות משנה EV לא discriminable עם בריכה של חרוזים. באמצעות אנטיגן יחיד לכידת חרוזים, זה יהיה אפשרי עכשווי להפגין הנוכחות של חלבונים tetraspanin, כגון CD9, CD81 או CD63, וזוהה אנטיגן של עניין על ידי נוגדנים פלורסנט. חרוזים לייטקס אלדהיד חלופי-סולפט מסחרית זמינים גם הם. אלה חרוזים מציגים הידרופובי השטח עבור ספיחה של MV ו- EV. - צינור עגול התחתון, להוסיף את כמות האחסון המתאים חלקיקים8 עונה 1 פרק 10 בתוספת 1 µL של מאגר חרוז, המקביל ל 1.2 x 10 חרוזי5 סה כ (עבור כל בדיקה).
- להכין את שפופרת המכילה 1 µL של חרוזים בלי EV שישמש כפקד שלילי, בזאת היא כאל "חרוזים".
- לכוון את עוצמת הקול כדי µL 100 עם 1 x PBS. למקם את הצינור התרמו-מיקסר, וללחוץ על 400 סל ד בן לילה ב 4 – 10 ° c
- למחרת, להעביר את הדגימות צלחת 96-ובכן התחתון עגול (או צינורות FC).
- מוסיפים הנוגדן (µg/mL 10 של CD9_FITC, µg/mL 10 של CD63_PE ו- µg/mL 5 של CD81_PE).
- דגירה h 1-4 – 10 מעלות צלזיוס.
- להוסיף 100 µL ל- 1 x PBS מכל קידוח.
- המשך רכישה.
5. רכישה
- לפתוח את התוכנה רכישת ולהתחיל את המכשיר (Cytometer > תוכנית אתחול המערכת). פתח התנסות חדשה.
- ליצור תבנית ניסיוני ולאחר מכן בחר צלחת ולאחר מכן להוסיף את הצלחת. בחר את המיקום של הדגימות בצלחת ולאחר מכן הקש להגדיר בתור מדגם טוב.
- הזן את שמו מדגם (קרי ובקונגרס #1_CD9FITC) כללי מתן שמות. פתיחת הכרטיסיה ערוץ ולעבור על FITC ועל ערוצי PE.
- לטעון את הצלחת בכלי.
- לחץ על נקודה מגרש וליצור מגרש נקודה חדשה (P1). הגדר קדימה פיזור אזור (FSC-A) לעומת הצד פיזור-אזור (האס-A).
- בחר אתחול כדי להפעיל את הלייזר ואת פלואידיקה. הקש על רכוש כדי להפעיל את הרכישה.
- להתאים את קנה המידה כדי להציג את האוכלוסייה באמצע P1. ב- P1 לצייר את השער "חרוזים" סביב האוכלוסייה (למעט פסולת) (איור 2 א). לחץ על עצור.
- לחץ על נקודה מגרש וליצור מגרש נקודה חדשה (P2). הגדר קדימה פיזור-גובה (FSC-H) לעומת FSC-א שער העלילה נקודה חדשה על "חרוזים." P2 לצייר שער חדש סביב האוכלוסייה גדולה יותר, בשם "ללבישה" (איור 2 א).
הערה: אסטרטגיה זו נועדה כדי למנוע כמה שיותר ככל האפשר ההכללה של חרוזים אגרגטים בשלבי רכישת וניתוח. - לחץ על נקודה מגרש וליצור שני מגרשים שונים נקודה; FITC אחת נגד האס-A ו- PE אחד לעומת האס-א שער העלילה נקודה חדשה על "ללבישה."
- בחר מספר אירועים לרשום (למשל, 20,000). בחר רשומה ומתחילים את הניסוי.
6. ניתוח נתונים
- לטעון את הקבצים רכישה לתוך התוכנה ניתוח.
הערה: השלבים הבאים צריך להיות מיושם בכל מדגם כולל חרוזים בלבד בכל דגימה לא ידוע. - פתח את פרוטוקול חדש וליצור חלקות נקודה בעקבות האסטרטגיה אותה תיאר בשלב 5.
- הגדר צירים כל פיזור לקנה המידה ליניארי ואת כל הצירים זריחה כדי סולם לוגריתמי.
- הצג את קרינה פלואורסצנטית הגאומטרי (X-Gmean-MFI) ערוצי FITC ו- PE.
- לחשב את היחס בין X-Gמתכוון של הדגימות / X-Gמתכוון של החרוזים צבעונית עם נוגדן ללא exosome.
- להשוות את השינוי קיפול MFI של ההכנות EV שונים.
7. טיטור מספר שלפוחית חוץ-תאית
הערה: סעיפים 7 עד 10 יכול להתבצע כדי להגדיר את מספר החלקיקים, נוגדנים ריכוז, ירידה לפרטים, אבל ניתן לדלג אם סוג התא, שממנה נגזרים EV, הנוגדנים נשארים זהים.
- לדלל חלקיקים, המתקבל צעד 2.3, PBS 1 x כדי לקבל סדרה של המתלים ועד 5 x 105 2.5 x 108 חלקיקים.
- כל השעיה להוסיף צינור עגול התחתון µL 1 של לכידת חרוז הבריכה.
- בצע את הפרוטוקול משלב 4.3.
8. נוגדן טיטור
הערה: נוגדן טיטור מתבצע בדרך כלל על-ידי הוספה של נוגדן בודד לכל שפופרת.
- לשמור על המספר של EV (הכולל חלקיקים או תכולת החלבון) קבוע כל הדגימות.
הערה: המספר המתאים נקבע מדעית כפי שמתואר לעיל בסעיף 7. - לפי התקנון מצעדי 4.1-4.5.
- מבחן מגוון של נוגדן ריכוזים מעל ומתחת הסכום המומלצים על ידי הספק. לדוגמה, עבור נוגדן עם ריכוז המוצע של µg/mL 10 לכל מבחן, מבחן 1, 2, 5, 10, 20 ו- 50 µg/mL. כוללים מדגם עם "חרוזים בלבד", מוסיף את הריכוז הגבוה ביותר של נוגדן.
- תקופת דגירה של h 1-4 – 10 מעלות צלזיוס.
- להוסיף 100 µL ל- PBS 1 x עבור כל דגימה.
- רוכשים את הדגימות.
9. זמן הדגירה
- ודא זמן הדגירה ביצוע רכישות בנקודות זמן שונות (למשל, 1 h, 2 h ו- 5 שעות).
- לפי התקנון החל מסעיף 4.
- דגירה בדגימות ב 4 – 10 ° C עבור 1 h.
- רוכשים את הדגימות.
- דגירה בדגימות ב 4 – 10 מעלות צלזיוס במשך 3 שעות.
- רוכשים את הדגימות.
10. פרוטוקול אימות
-
איגוד EV
- צינור עגול התחתון, להוסיף את כמות האחסון המתאים עונה 1 פרק 108 חלקיקים או את כמות החלבון הכולל.
- לכוון את עוצמת הקול כדי µL 100 עם 1 x PBS.
- לשבש את הקרום EV מאת sonication (לחלופין צעד הלם חום יכול להיות מיושם) על פי הוראות היצרן. הגדרת תדירות ועוצמה. תקופת sonication ניתן מדעית להקים הגדרת ניסוי זמן-קורס (קרי, 0 s, 30 s, 1 דקות, 5 דקות, וכו '.).
- להוסיף 1 µL של הבריכה חרוז.
- לפי התקנון החל משלב 4.4.
-
נוגדן ירידה לפרטים
- להכין שפופרת אחת עבור כל IgG fluorochrome מצומדת ולהוסיף המתחם של חרוזים-EV כפי שמתואר בשלב 4.6.
הערה: Isotype fluorochrome מצומדת להתאים עם IgG של הנוגדן בשימוש.
- להכין שפופרת אחת עבור כל IgG fluorochrome מצומדת ולהוסיף המתחם של חרוזים-EV כפי שמתואר בשלב 4.6.
תוצאות
המספר הכולל של חלקיקים עבור צביעת יחיד
מאז חרוז אחד באפשרותך לאגוד יותר מחלקיק אחד, בדקנו תנאים שונים כדי לקבוע את הכמות הקטנה ביותר של EV הכולל (יחיד נוגדנים למחזור) כדי להגיע אל השלב מעריכי מוקדם של עקומת MFI. ריכוז קבוע של נוגדן שימש בזמן המספר הכולל של חלקיקים נע בין 5 x 105 2.5 x 108. כפי שמוצג באיור 3A, מספר החלקיקים מאפשר לנו להבטיח הנוגדן מבצעת בתוך MFI מתקבל על הדעת, הימנעות שימוש עודף של EV, הוא עונה 1 פרק 108 חלקיקים/מכתים.
טיטור נוגדן
בחרנו את הריכוז הנכון של נוגדן וכתוצאה מכך האות הגבוה ביותר במניעת האיגוד נוגדן ספציפי. בדיקה זו מוטבה עבור חלקיקים עונה 1 פרק 108 , כפי שנקבע בהגדרה הקודמת. Anti-CD9_FITC, אנטי-CD63_PE ו- anti-CD81_PE נבדקו עם ריכוזים בין 1 ל 50 µg/mL (איור 3B). נוגדנים אנטי-CD9_FITC ו- anti-CD63_PE נתן רזולוציה טובה של האות (7.5 ו- 130-fold להחלפה MFI לעומת חרוזים לבד, בהתאמה) כאשר נעשה שימוש בריכוז של µg/mL 10 תוך ריכוז שנבחר נוגדן anti-CD81_PE היה 5 µg/mL (קיפול 465.3 שינוי MFI).
שיטת אימות
על מנת לאשר כי השיטה שלנו מתאימה לנתח רק "בצורת גביע" שלפוחית חוץ-תאית ופסולת לא קרום, אנחנו להחיל צעדים sonication שונים, לפחות 10% של משרעת, על הפתרון המכיל חלקיקים. µL 100 1 x פתרון PBS המכיל חלקיקים8 עונה 1 פרק 10 עברה שלבים sonication שונה מ- 30 שניות ל- 5 דקות, ההכנה המתקבלת המכיל EV שבור והן בצורת נותחו כפי שתואר (נסיוני מנקודת 3.3). כתוצאה מכך, מצאנו כי 30 שניות של sonication להקטין MFI זה נזרק לגמרי אחרי דקה. Timepoint הזה, אין קרינה פלואורסצנטית הוא לזיהוי עבור כל סמני EV (דמות תלת-ממד).
אפיון cytometry זרימה של exosomes HEK293 ו- CPC-נגזר
תוצאות אלה נוצרו בעקבות פרוטוקול שהובאו לעיל בשיטת בידוד ultracentrifuge. Exosomes מבודדים לכמת על-ידי טכנולוגיית נ, טעון בין לילה עם µL 1 של חרוזים מעורבת (1 x אנטי-CD9:1 x אנטי-CD63:1 x אנטי-CD81). מורכבות חרוזים + מסכות היו מוכתמים את הכמות הנכונה של נוגדן anti-CD9_FITC, אנטי-CD63_PE ו- anti-CD81_PE (איור 3EF ו לטבלה 2).
יתר על כן, באמצעות EV-CPC אנחנו לעומת ניתוח FC עם או בלי העשרה מראש על-ידי ultracentrifugation. איור 4 מראה כי שתי השיטות הן מתאים לסמני משטח מסכות פרופיל. העשרת מראש של שלפוחית חוץ-תאית שבר משפר באופן משמעותי את עוצמת קרינה פלואורסצנטית במיוחד עבור CD63_PE ו- CD81_PE מכתימים (איור 4 , טבלה 3).

איור 1: מתווה לפרוטוקול, נ. ת. (א) ייצוג סכמטי של פרוטוקול נסיוני. (B) נציג נ חלקות עבור מדיה ממוזגים, Ultracentrifuge מראש, Ultracentrifuge שלאחר שלב. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 2: רכישת וניתוח הנתונים. (א) לזרום cytometry ניתוח מתחיל עם יצירת שער הראשון לכל חרוזים האוכלוסייה "חרוזים" (למעט פסולת), אז שנייה שער כדי להבחין בין אירועים "ללבישה". ללבישה הן פיקוח על מגרש לשדך FSC-H כמו ציר x ו- FSC-A כמו ציר y. (B-D) נקודה נציג חלקות מראה right shift של עוצמת קרינה פלואורסצנטית לאוכלוסיות חיובית של מתחמי חרוזים-exosomes (ירוק, CD9 + CD63 אדום +; CD81 חום +). Isotype הבקרה (סגול) חפיפה שלילית חרוזים בצבע אפור. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 3: עקומות טיטור עבור מספר החלקיקים (חיצים מראים את כמות החלקיקים, עונה 1 פרק 108הנבחרת). (א) ריכוז נוגדן (חיצים מראים ריכוז שנבחר עבור כל שימוש נוגדנים). (B) הן מספר חלקיקי, נוגדן ריכוז הן מגרש מול עוצמת קרינה פלואורסצנטית רשע (MFI). (ג) עקומת מציג 3 שונים רכישת התכשיר עם h 1 – 2 או 5 שעות של נוגדן דגירה. עקומת (D) מציג את הירידה של זריחה בעקבות sonication בנקודות זמן שונות. (E-F) מקפלים שינוי (זאת אומרת ± SD) MFI עבור vs CD9, CD63, CD81 שליטה שלילי (חרוזים + נוגדנים, אין EV) מוצגים עבור HEK293 EV (n = משכפל עצמאית 3) עבור CPC EV (n = 3 שורות התא העיקרי של 3 חולים שונים) אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
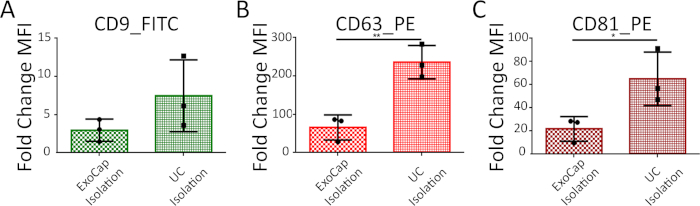
איור 4: MFI ניתוח והשוואה בין שני ההליכים: ישיר EV מחייב עם חרוזים (לכידת בידוד חרוזים) והעשרה מראש עם ultracentrifuge (Ultracentrifuge בידוד). הנתונים מוצגים כפי מקפלים שינוי (זאת אומרת ± SD) MFI עבור CD9 (א), (B) CD63 CD81 (ג) לעומת שליטה שלילי (חרוזים + נוגדנים, אין EV). N = 3 שורות התא העיקרי של 3 חולים שונים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
| עלות לקליק | ריכוז או משחק נ. ת. (חלק/µL) | ריכוז או משחק (µg/µL) |
| CPC #1 Ultracentrifuge מראש | 5.02E + 06 | 2.01 |
| CPC #1 פוסט-Ultracentrifuge | 6.10E + 07 | 1.04 |
| CPC #2 Ultracentrifuge מראש | 5.74E + 06 | 2.30 |
| CPC #2 פוסט-Ultracentrifuge | 7.43E + 07 | 0.79 |
| CPC #3 Ultracentrifuge מראש | 2.02E + 06 | 1.90 |
| CPC #3 Ultracentrifuge פוסט | 2.91E + 07 | 0.42 |
טבלה 1: השוואה בין ריכוז נ ריכוז חלבון לחולה שונים 3 נגזר עלות לקליק לפני ואחרי ultracentrifuge.
| מקפלים להחלפה MFI ± SD | CD9 | CD63 | CD81 |
| HEK293 | 24.44 ± 19.17 | 430.7 ± 344.9 | 535.2 ± 410.3 |
| CPC #1 | 14.15 ± 3.72 צד | 236.05 ± 43.40 | 353.30 ± 452.43 |
| CPC #2 | 15.76 ± 1.87 | 983.06 ± 195.63 | 374.45 ± 108.05 |
| CPC #3 | 8.94 ± 7.19 | 830.50 ± 184.73 | 60.05 ± 23.18 |
טבלה 2: הערך של קיפול שינוי (זאת אומרת ± SD) של MFI HEK293 EV (n = משכפל עצמאית 3) ו- CPC EV (n = 3 שורות התא העיקרי של 3 חולים שונים).
| מקפלים להחלפה MFI ± SD | CD9 | CD63 | CD81 |
| לכידת חרוזים בידוד | 2.96 ± 1.45 | 65.65 ± 18.87 | 21.85 ± 6.12 |
| בידוד ultracentrifuge | 7.47 ± 2.71 | 236.00 ± 25.06 | 65.05 ± 13.38 |
טבלה 3: הערך של שינוי קיפול MFI (זאת אומרת ± SD) עבור CPC EV (n = 3 שורות התא העיקרי של 3 חולים שונים) מבודדת על ידי לכידת חרוזים או ultracentrifuge.
טבלה 4: מפרט מוצר יחיד.
Discussion
טכניקת FC המקובלת נשאר השיטה האנליטית הברור ביותר לאפיון סמני הביע על גבי המשטח של EV. בהקשר זה, בחירת הפרוטוקול המתאים ביותר הוא חיוני כדי לקבל מידע שימושי בשברים חלקיקים בודדים של עניין על ידי הימנעות מגבלות עקב רגישות המכשיר. אנחנו תיאר שיטה באמצעות חלקיקים מגנטיים בשילוב עם נוגדנים מזהה Exo ו קטן EV אנטיגנים משטח אשר מתאימים ליישום FC במורד הזרם. אנחנו אומת השיטה באמצעות שני סוגי תאים שונים: CPC אנושי ראשוני זה מתגלים כמקור העיקרי תא על-מבוססות-Exo גישות טיפוליות למחלות לב; . ותאים HEK293, קו תא מונצחים בשימוש נרחב במחקר הביולוגיה תא בשל צמיחת תאים אמין פלסטיות
השיטה ניתן ליישם מועשר ultracentrifuge EV ו, לניתוח מהיר יותר, גם ישירות על הפריה תא נגזר ס מ עם אין העשרה מראש על-ידי ultracentrifugation. חומר המוצא חיוני בעת השוואת דוגמיות. הוספת לכידת חרוזים באופן ישיר ס מ יזרז את ההליך, אבל באותו הזמן להפחית עוצמת קרינה פלואורסצנטית, כפי שמוצג באיור 4A. חשוב גם להשתמש כמות מספקת של PBS לערבב EV ושרשרות במהלך השלב "לכידת" 4.4. בעת שימוש זמן הדגירה קבוע, אמצעי אחסון מוגברת יקטן עוצמת קרינה פלואורסצנטית עקב צימוד EV לא יעיל.
מגבלה של הפרוטוקול הוא חרוז לכידת יחיד יכול לאגד מספר חלקיקים EV/Exo על פני השטח שלו. זה יצמצם את האפשרות של זיהוי קבוצות משנה של EV לבטא שילוב מוזר של אנטיגנים באמצעות צביעת מרובים. השיטה מבוססת על חרוז ולכן מניבה נתונים כמותיים למחצה. שימוש חרוזים נושאת Ab לכידת יחיד (CD9, CD63 או CD81) יאפשר מקסימום אפיון החלקיקים המבטאים את שני epitopes: האחד על החרוז ומוכרים על ידי הנוגדן לכידת ואחד זוהה על ידי הנוגדן זה לאחר מכן הוסיף.
תקן הזהב הנוכחי עבור ניתוחים Exo באמצעות FC הוא פרוטוקול שפותח על ידי ואן דר Vlist et al. ב 201215. היא מאפשרת ניתוח ברזולוציה גבוהה של EV באמצעות של תצורת אופטימיזציה של FC high-end זמינים מסחרית (למשל, זרם BD). פרוטוקול זה מאוד מפורט ומועיל אך עדיין זקוק סביבה חומרה מורכבות עם כיול FC ספציפי לפני השימוש. כעבור שלוש שנים, Pospichalova et al.16 הציע פרוטוקול פשוטה לניתוח FC של Exo באמצעות של cytometer ייעודי שפותח במיוחד עבור ניתוח של חלקיקים קטנים (למשל, אפגיאה A50. מיקרו)17. פרוטוקול זה, אחרים בהם השתמשו הגדרת סף מיוחדים11, כאן אנו מציעים פרוטוקול בסיסי כדי לבצע phenotyping EV קטן באמצעות איגוד מגנטי חרוזים מתאימים לכלים FC המקובלת, אינו דורש שום הגדרה מיוחדת. פרוטוקולים שונים תיארו מבוסס-חרוז שיטות לאפיון EV קטנים נמצאו נוזלי הגוף-FC12. כאן, אנו מראים את immunocapture של דיסקרטית תת אוכלוסיות של שלפוחית חיובי עבור CD9, CD63 ו- CD81 הנפוצות Exo סמני18. אלדהיד-סולפט לייטקס19,20 ופוליסטירן12חרוזים נשארות אלטרנטיבות תקפות עבור איגוד של EV נוכח ס"מ ו פלזמה דם נוזלי; עם זאת, קבוצות אלדהיד נחשף על פני השטח של החלקיק פולימר לאפשר צימוד של חלבונים לא ספציפי וחומרים אחרים עם החלקיקים לייטקס, ובכך מגדילים את הסיכון של זיהום על-ידי גופים ליפופרוטאין או מוות במהלך בידוד וזיהוי תהליך21,22.
חרוזים בשימוש בפרוטוקול לאגד EV רק כולו, בצורת. אנחנו הציע לשבש את מבנה EV מאת sonication כדי להרוות את האות (סעיף 4, "פרוטוקול אימות"). אכן, דקה אחת של תוצאות sonication בעוצמה מופחתת פלורסצנטיות, ובכך מראה כי אות חיובי ניתן להשפיע על ידי קרום פסולת הספוחה על חרוזים.
Disclosures
אין לי מה להצהיר
Acknowledgements
L.B. נתמכה על ידי מענקי מחקר של הלמוט Horten Stiftung ו Velux Stiftung, ציריך (שווייץ). G.V. נתמך על ידי מענקי מחקר של קרן המדע הלאומית השוויצרית, קרן ססיליה-אוגוסטה, לוגאנו לדנציג SHK Stiftung את הרץ-und Kreislaufkrankheiten (שוויץ)
Materials
| Name | Company | Catalog Number | Comments |
| IMDM | Gibco | 12440061 | |
| Amicon Ultra-15, PLHK Ultracel-PL Membran, 100 kDa | Millipore | UFC910024 | |
| CytoFlex, Flow Cytometer Platform | Beckman Coulter | CytoFlex | |
| DMEM, high glucose, HEPES, no phenol red | Gibco | 21063045 | |
| Dulbecco's PBS (PBS) Ca- and Mg-free | Lonza | BE17-512F | |
| ExoCap CD63 Capture Kit | JSR Life Sciences | Ex-C63-SP | |
| ExoCap CD81 Capture Kit | JSR Life Sciences | Ex-C81-SP | |
| ExoCap CD9 Capture Kit | JSR Life Sciences | Ex-C9-SP | |
| Exosome-Depleted FBS | Thermofisher | A2720801 | |
| Exosome-depleted FBS Media Supplement | SBI | EXO-FBS-250A-1 | |
| FBS-Fetal Bovine Serum | Gibco | 10270106 | |
| FITC anti-human CD9 Antibody | Biolegend | 312104 RRID: AB_2075894 | |
| Flow Cytometer analysis software | Beckman Coulter | Kaluza | |
| NanoSight LM10 | Malvern | NanoSight LM10 | |
| NanoSight Software | Malvern | NTA 2.3 | |
| Optima Max-XP | Beckman Coulter | 393315 | |
| PE anti-human CD63 Antibody | Biolegend | 353004 RRID:AB_10897809 | |
| PE anti-human CD81 (TAPA-1) Antibody | Biolegend | 349505 RRID:AB_10642024 | |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Thermomixer C | Eppendorf | 5382 000 015 | |
| TLA-110 | Beckman Coulter | TLA-110 rotors |
References
- Barile, L., Vassalli, G. Exosomes: Therapy delivery tools and biomarkers of diseases. Pharmacology & Therapeutics. , (2017).
- Thery, C. Exosomes: secreted vesicles and intercellular communications. Molecular Biology Reports. 3, 15 (2011).
- Yadav, D. K., et al. Liquid biopsy in pancreatic cancer: the beginning of a new era. Oncotarget. 9, 26900-26933 (2018).
- Balbi, C., et al. First Characterization of Human Amniotic Fluid Stem Cell Extracellular Vesicles as a Powerful Paracrine Tool Endowed with Regenerative Potential. Stem Cells Translational Medicine. 6, 1340-1355 (2017).
- Andriolo, G., et al. Exosomes From Human Cardiac Progenitor Cells for Therapeutic Applications: Development of a GMP-Grade Manufacturing Method. Frontiers in Physiology. 9, (2018).
- Lai, R. C., et al. Exosome secreted by MSC reduces myocardial ischemia/reperfusion injury. Stem Cell Research. 4, (2009).
- Doeppner, T. R., et al. Extracellular Vesicles Improve Post-Stroke Neuroregeneration and Prevent Postischemic Immunosuppression. Stem Cells Translational Medicine. 4, 1131-1143 (2015).
- Kordelas, L., et al. MSC-derived exosomes: a novel tool to treat therapy-refractory graft-versus-host disease. Leukemia. 28, 970-973 (2014).
- Barile, L., et al. Extracellular vesicles from human cardiac progenitor cells inhibit cardiomyocyte apoptosis and improve cardiac function after myocardial infarction. Cardiovascular Research. 103, 530-541 (2014).
- Longatti, A., et al. High affinity single-chain variable fragments are specific and versatile targeting motifs for extracellular vesicles. Nanoscale. 10, 14230-14244 (2018).
- Menck, K., Bleckmann, A., Schulz, M., Ries, L., Binder, C. Isolation and Characterization of Microvesicles from Peripheral Blood. Journal of Visualized Experiments. , (2017).
- Inglis, H., Norris, P., Danesh, A. Techniques for the analysis of extracellular vesicles using flow cytometry. Journal of Visualized Experiments. , (2015).
- Arakelyan, A., et al. Flow Virometry to Analyze Antigenic Spectra of Virions and Extracellular Vesicles. Journal of Visualized Experiments. , (2017).
- Chimenti, I., et al. Isolation and expansion of adult cardiac stem/progenitor cells in the form of cardiospheres from human cardiac biopsies and murine hearts. Methods Molecular Biology. 879, 327-338 (2012).
- van der Vlist, E. J., Nolte-'t Hoen, E. N., Stoorvogel, W., Arkesteijn, G. J., Wauben, M. H. Fluorescent labeling of nano-sized vesicles released by cells and subsequent quantitative and qualitative analysis by high-resolution flow cytometry. Nature Protocols. 7, 1311-1326 (2012).
- Pospichalova, V., et al. Simplified protocol for flow cytometry analysis of fluorescently labeled exosomes and microvesicles using dedicated flow cytometer. Journal of Extracellular Vesicles. 4, 25530 (2015).
- van der Pol, E., et al. Particle size distribution of exosomes and microvesicles determined by transmission electron microscopy, flow cytometry, nanoparticle tracking analysis, and resistive pulse sensing. Journal of Thrombosis and Haemostasis. 12, 1182-1192 (2014).
- Witwer, K. W., et al. Updating the MISEV minimal requirements for extracellular vesicle studies: building bridges to reproducibility. Journal of Extracellular Vesicles. 6, 1396823 (2017).
- Thery, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Current Protocols in Cellular Biology. , (2006).
- Suarez, H., et al. A bead-assisted flow cytometry method for the semi-quantitative analysis of Extracellular Vesicles. Scientific Reports. 7, 11271 (2017).
- Sodar, B. W., et al. Low-density lipoprotein mimics blood plasma-derived exosomes and microvesicles during isolation and detection. Scientific Reports. 6, 24316 (2016).
- Sluijter, J. P. G., et al. Extracellular vesicles in diagnostics and therapy of the ischaemic heart: Position Paper from the Working Group on Cellular Biology of the Heart of the European Society of Cardiology. Cardiovascular Research. 114, 19-34 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved