Method Article
Análisis Cytometric del vesículas extracelulares de medios acondicionado de célula de flujo
En este artículo
Resumen
El protocolo describe un método reproducible diseñado para uso con sobrenadantes de cultivo celular para detectar epítopos superficiales en pequeñas vesículas extracelulares (EV). Utiliza específica inmunoprecipitación EV usando granos juntados con los anticuerpos que reconocen antígenos de superficie CD9, CD63 y CD81. El método está optimizado para el análisis de citometría de flujo aguas abajo.
Resumen
Citometría de flujo (FC) es el método de elección para la medición semicuantitativa de marcadores de antígeno de superficie celular. Recientemente, esta técnica se ha utilizado para los análisis fenotípicos de vesículas extracelulares (EV) incluyendo exosomas (Exo) en la sangre periférica y otros fluidos corporales. El pequeño tamaño de EV exige el uso de instrumentos dedicados tienen un umbral de detección alrededor de 50-100 nm. Por otra parte, EV se puede enlazar a microesferas de látex que pueden ser detectado por FC. Microesferas, conjugado con anticuerpos que reconocen EV asociado marcadores/Cluster de diferenciación CD63, CD9 y CD81 se pueden utilizar para la captura de EV. Exo de CM puede ser analizada con o sin enriquecimiento previo por ultracentrifugación. Este enfoque es adecuado para análisis EV usando instrumentos convencionales de FC. Nuestros resultados demuestran una correlación lineal entre los valores de la intensidad media de fluorescencia (IMF) y concentración de EV. Interrumpir EV mediante sonicación dramáticamente había disminuido MFI, indicando que el método no detecta restos de membrana. Divulgamos un método exacto y confiable para el análisis de antígenos de superficie de EV, que pueden aplicarse fácilmente en cualquier laboratorio.
Introducción
Las células secretan vesículas extracelulares (EV) de diferentes tamaños incluyendo microvesículas (MV) y exosomas (Exo). Este último puede distinguirse de MV por tamaño y el compartimento subcelular de origen. MV (200-1.000 nm de tamaño) se liberan de las células madre por desprendimiento de la membrana plasmática. Por el contrario, Exo (30 – 150 nm) originan endosomal membranas y se liberan en el espacio extracelular, cuando los cuerpos multivesicular (MVB) se fusionan con la membrana de la célula1,2.
EV son cada vez más utilizados como biomarcadores diagnóstico así como, potencialmente, herramientas terapéuticas en muchos campos como la oncología, Neurología, cardiología y enfermedades musculoesqueléticas3,4,5. Una gran mayoría de los estudios en curso con EV como agentes terapéuticos explotan el aislamiento de las vesículas de acondicionado celular medio (CM) de las células cultivadas in vitro. Las células madre mesenquimales (MSCs) ejercen efectos beneficiosos en varios contextos, y EV derivados de MSC han demostrado beneficios en modelos de isquemia/reperfusión miocardio lesión6 y cerebro lesión7. Derivados de MSC EV también exhiben actividades moduladores inmunes que pueden ser explotadas para el tratamiento de rechazo inmune, como se demostró en un modelo de terapia-refractario injerto - versus - host disease8. Células madre del líquido amniótico (hAFS) enriquecer activamente CM con MVs y Exo, heterogénea en tamaño (50-1.000 nm), que median varios efectos biológicos, tales como proliferación de células diferenciadas, angiogénesis, inhibición de la fibrosis, y cardioprotección4. Hemos demostrado recientemente que EV y particularmente de Exo, secretada por las células del progenitor de origen cardiaco humano (Exo-CPC) reducen el tamaño del infarto de miocardio en ratas5,9.
Exo de compartir un conjunto común de proteínas en su superficie, incluyendo tetraspaninas (CD63, CD81, CD9) y complejo mayor de histocompatibilidad clase I (MHC-I). Además de este conjunto común de proteínas, Exo contienen también proteínas específicas para el subconjunto de EV del tipo de la célula productora. Marcadores de Exo están ganando importancia primordial porque juegan un papel crucial en la comunicación entre celular, de tal modo regulación de muchos procesos biológicos5,10. Debido a su pequeño tamaño, encontrar una manera fácil de analizar EV usando clásico flujo cytometry (FC) sigue siendo una tarea difícil.
Aquí, presentamos un protocolo simplificado para el análisis de la EV con FC, que se puede aplicar a muestras previamente enriquecidas obtenidas mediante ultracentrifugación o directamente a CM (figura 1). El método utiliza bolas recubiertas con un anticuerpo específico que se une canónica asociada a Exo superficie epitopos (CD63, CD9, CD81) sin lavados adicionales. Análisis de la FC pueden realizarse usando un citómetro convencional sin necesidad de ajustes antes de las mediciones. Métodos para la caracterización de antígenos en las partículas pequeñas individuales con citómetros de flujo han sido descritos por otros grupos con respecto a varias aplicaciones11,12,13. Aquí, utilizamos granos magnéticos funcionalizados para la captura de partículas pequeñas y Exo, seguido por fenotipado de partículas captadas por el FC. Aunque este método puede utilizarse para caracterizar la composición antigénica de pequeñas vesículas por cualquier tipo de célula en vitro, aquí proporcionamos condiciones de cultivo de células específicas que se aplican para el cultivo de células progenitoras cardíacas humanas (CPC) y la más ambiente adecuado para la producción de EV por estas células.
Protocolo
1. recogida y tratamiento de medios condicionados
- Capa de 55 cm2 placas de Petri con gelatina de piel porcino 0,02% en PBS.
- CPC (8.000/cm2) en platos previamente recubiertos de la placa con 7 mL de medio de modificado Dulbecco de Iscove (IMDM) suplementado con 20% FBS (suero bovino Fetal) y 1% de penicilina/estreptomicina (P/S).
Nota: El término "CPC" se refiere a las células del explante humano derivado que han sido descritos en otra parte14. CM se puede recoger de diferentes tipos de células cultivados en condiciones de cultivo específicas. Utilice guantes y trabajar bajo una campana de biológica. - Una vez que las células llegan a sobre 80% de confluencia, quiten el medio de cultivo células dos veces con de Dulbecco PBS (PBS) Ca y Mg-libre y reemplazarlo con 10 mL de medio sin suero de la Exo-producción (modificado Eagle de Dulbecco mediana [DMEM] glucosa alta, 4,5 g/mL).
Nota: Proceder a una progresiva disminución de la concentración del suero en el medio de cultivo, poco a poco adaptar la condición libre de suero (SF) de las células. Para las células que son sensibles al medio libre de suero preparar un medio que contiene FBS, pero agotado de EV. Preparar el medio suplementado con todos los nutrientes, además de 10% – 20% (v/v) equipos. Centrifugar el medio de la noche a 100.000 x g, 4 º C. Tenga en cuenta que este procedimiento no garantiza 100% eliminación de EV derivados del FBS. - Después de 7 días, recoger el CM en un tubos de centrífuga de polipropileno.
Nota: El tiempo de acondicionado medio depende del tipo de célula. Para las células que son sensibles al medio libre de suero, aumentar el volumen inicial del medio y disminuir el tiempo para la colección de CM a 24-48 h. - Claro CM de restos celulares por centrifugar a 3.000 x g durante 20 min a 4 – 10 ° C. Recoger el sobrenadante en un tubo de filtro de centrífuga kDa 100.
- Concentrado despejó CM haciendo girar el tubo a 2.000 x g por 20 min a 4 – 10 ° C.
Nota: Este paso reduce el volumen inicial de CM permitiendo el uso de tubos de pequeño volumen para pasos de centrífuga de alta velocidad y contribuirá a eliminar agregados de proteína. - Recoger el concentrado en un tubo de microcentrífuga. Centrifugar a 10.000 x g durante 15 min a 4 – 10 ° C.
- Recoger el sobrenadante y proceder a la sección 2 (enriquecimiento de EV). Si no hay una ultracentrífuga proceder directamente a la sección 3 (cuantificación de análisis de seguimiento de nanopartículas (NTA)).
Nota: Pre enriquecimiento de EV fracción mejora la lectura final en la intensidad de fluorescencia (ver resultados representativos y figura 4). Autorizado CM (del punto 1.8) puede almacenarse a 4 ° C no más entonces 1-2 días o alternativamente en el ° C −80 durante varios meses. 5 CM debe ser previamente autorizado para quitar cualquier ruina celular antes de su almacenamiento a-80 ° C para asegurar que tamaño de exosomas escombros no está formado en el proceso de congelación y descongelación.
2. extracelular vesículas enriquecimiento por ultracentrífuga (opcional)
- Colocar el sobrenadante del paso 1.8 en un tubo de ultracentrífuga de grosor de la pared de policarbonato. Llenar el tubo con 1 x solución salina buffer fosfato (PBS) hasta que alcance la capacidad máxima (mL 3,2).
- Cargar las muestras en un rotor de ángulo fijo de titanio (8 x 3.2 mL, Factor k 13). Carga el rotor en una ultracentrífuga de sobremesa. Ultracentrífuga a 100.000 x g durante 3 h a 4 – 10 ° C.
- Deseche el sobrenadante y resuspender el precipitado en 100 μl de 1 x PBS.
3. nanopartículas seguimiento cuantificación de análisis (NTA)
- Diluir 1 μl de muestra (de cualquier paso 2.3 o 1.8) en 999 μl de PBS 1 x. Cargar la muestra en una jeringa de 1 mL, evitando la formación de burbujas. Cargue la jeringa en el orificio de entrada de la sala de examen.
- Encender el láser. Abrir la cámara con el botón de captura . Ajuste el enfoque.
- Grabar al menos 3 marcos distintos de 60 s cada uno.
- Analizar las adquisiciones diferentes 3 con la opción de Proceso por lotes en el software.
Nota: Si la tecnología NTA no está disponible, realizar una cuantificación de proteínas por el ensayo de Bradford (1 x 108 partículas corresponden a 1-2 μg de proteínas totales después de la ultracentrifugación o a 50 – 60 μg proteína total si la cuantificación se realiza directamente para el CM como incluye contaminantes proteínas diferentes de EV; Ver tabla 1)5.
4. preparación de la muestra
- Preparar un grupo de los 3 tipos de granos de la captura (CD9 granos, granos de CD63, CD81 de perlas en un 1: relación 1:1; véase Tabla de materiales) y vortex.
Nota: La piscina ha sido probada para ser estable durante 1 mes. Puede utilizar un solo tipo de captación de grano, esto permitirá la detección de subpoblaciones de EV no discriminable con piscina de bolas. Mediante el uso de antígeno único captura de cuentas, va a ser posible contemporáneo demuestran la presencia de proteínas tetraspanina, como CD9, CD81, CD63, y el antígeno de interés detectadas por anticuerpos fluorescentes. Gotas de látex alternativos aldehído sulfato también están comercialmente disponibles. Estas cuentas presentan superficie para la adsorción de MV y EV. - En un tubo de fondo redondo, introducir la cantidad de volumen correspondiente a 1 x 108 partículas más 1 μl de la piscina de bolas, correspondientes a 1.2 x 105 cuentas en total (para cada prueba).
- Preparar un tubo que contiene 1 μl de granos sin EV que servirá como control negativo, por la presente se refiere como "Granos".
- Ajustar el volumen a 100 μl con PBS x 1. Coloque el tubo en un termo-mezclador y agitar a 400 rpm durante la noche a 4 – 10 ° C.
- Al día siguiente, hacia las muestras a una placa de 96 pocillos de fondo redondo (o tubos FC).
- Añadir el anticuerpo (10 μg/mL de CD9_FITC, 10 μg/mL de CD63_PE y 5 μg/mL de CD81_PE).
- Incubar 1 h a 4 – 10 ° C.
- Añadir 100 μl de 1 x PBS a cada pocillo.
- Proceder a la adquisición.
5. adquisición
- Abra el software de adquisición y puesta en marcha del instrumento (citómetro > programa de inicio de sistema). Abra un nuevo experimento.
- Crear una plantilla de experimental y seleccione la placa y luego Añadir. Seleccione la posición de las muestras en la placa y luego pulse Establecer como muestra bien.
- Escriba el nombre de la muestra (es decir, CPC #1_CD9FITC) en las Reglas de nomenclatura. Abra la pestaña de canales y encienda el FITC y PE canales.
- Carga de la placa en el instrumento.
- Pulse Punto trama y crear un nuevo diagrama de punto (P1). Set adelante área de dispersión (FSC-A) versus el área de dispersión lateral (SSC-A).
- Seleccione iniciar para iniciar el láser y los fluidos. Prensa adquirir para iniciar la adquisición.
- Ajustar la escala para mostrar a la población en el medio de la P1. En P1 dibujar la puerta de "Granos" alrededor de toda la población (sin desechos) (figura 2A). Pulse Stop.
- Pulse Punto trama y crear un nuevo diagrama de punto (P2). Fijada delantero altura Scatter (FSC-H) versus la FSC-A. Puerta de la nueva trama de punto en "Granos." En P2 dibujar una puerta nueva en la población más grande y el nombre "Camisetas" (figura 2A).
Nota: Esta estrategia está diseñada para evitar tanto como sea posible la inclusión de agregados de granos de la adquisición y análisis. - Pulse Punto trazar y crear dos parcelas diferentes puntos; un FITC versus SSC-A y un PE versus SSC-A. Puerta de la nueva trama de punto en "Camisetas".
- Seleccione el número de eventos a registrar (por ejemplo, 20.000). Seleccionar registro y empezar el experimento.
6. Análisis de datos
- Cargar los archivos de adquisición en el software de análisis.
Nota: Los pasos siguientes deben ser aplicado a cada muestra como sólo los granos y cada muestra desconocida. - Abra un nuevo protocolo y crear parcelas de punto siguiendo la misma estrategia que se describe en el paso 5.
- Establecer los ejes de dispersión a escala lineal y todos los ejes de fluorescencia conectarse escala.
- Mostrar la media geométrica de la fluorescencia (X-Gmean-IMF) en FITC y PE canales.
- Calcular el cociente G Xmedia de las muestras / G Xmedio de los granos manchados con anticuerpo sin exosomas.
- Comparar el cambio de doblez MFI de diferentes preparaciones de EV.
7. titulación número vesícula extracelular
Nota: Las secciones 7 a 10 se puede realizar para configurar el número de partículas, la concentración de anticuerpos y la especificidad, pero puede omitirse si el tipo de célula, que se derivan EV, y anticuerpos siguen siendo los mismos.
- Diluir las partículas, obtenidas en el paso 2.3, en PBS 1 x para obtener una serie de suspensiones que van desde 5 x 105 a 2.5 x 108 partículas.
- Para cada suspensión añada en un tubo de fondo redondo 1 μl de piscina de bolas de captura.
- Seguir el protocolo de paso 4.3.
8. anticuerpos valoración
Nota: Titulación de anticuerpos se realiza mediante la adición de un anticuerpo individual para cada tubo.
- Mantener el número de EV (partícula total o proteico) constante en todas las muestras.
Nota: El número apropiado se determina empíricamente como se describe anteriormente en la sección 7. - Seguir el protocolo de pasos de 4.1 a 4.5.
- Probar una gama de concentraciones de anticuerpos por encima y por debajo de la cantidad recomendada por el proveedor. Por ejemplo, para un anticuerpo con una concentración sugerida de 10 μg/mL para prueba, prueba 1, 2, 5, 10, 20 y 50 μg/mL. Incluyen una muestra con los "granos", agregar la mayor concentración de anticuerpos.
- Incubar durante 1 h a 4 – 10 ° C.
- Añada 100 μl de 1 x PBS para cada muestra.
- Adquirir las muestras.
9. incubación
- Verificar el tiempo de incubación realizar adquisiciones en diferentes puntos temporales (p. ej., 1 h, 2 h y 5 h).
- Seguir el protocolo a partir de la sección 4.
- Incubar las muestras a 4 – 10 ° C durante 1 hora.
- Adquirir las muestras.
- Incubar las muestras a 4 – 10 ° C para 3 h.
- Adquirir las muestras.
10. Protocolo validación
-
Enlace de EV
- En un tubo de fondo redondo, introducir la cantidad de volumen correspondiente a 1 x 108 partículas o la cantidad correspondiente de la proteína total.
- Ajustar el volumen a 100 μl con PBS x 1.
- Alterar la membrana EV por sonicación (alternativamente se puede aplicar un paso de choque de calor) según las instrucciones del fabricante. Establecer la frecuencia y la intensidad. El período de sonicación puede establecerse empíricamente establecer un experimento en curso del tiempo (es decir, 0 s, 30 s, 1 min, 5 min, etcetera.).
- Añadir 1 μl de la piscina de bolas.
- Seguir el protocolo a partir de paso 4.4.
-
Especificidad del anticuerpo
- Preparar un tubo para cada IgG conjugado con fluorocromo y añadir el complejo de granos-EV, como se describe en el paso 4.6.
Nota: El isotipo conjugado con fluorocromo debe coincidir con la IgG del anticuerpo usado.
- Preparar un tubo para cada IgG conjugado con fluorocromo y añadir el complejo de granos-EV, como se describe en el paso 4.6.
Resultados
Número total de partículas de tinción simple
Puesto que un solo grano puede atar más de una partícula, probamos diferentes condiciones para establecer la menor cantidad de EV total (anticuerpo individual por tubo) para llegar a la fase exponencial temprana de curva de MFI. Una concentración fija de anticuerpo fue utilizada mientras que el número total de partículas entre 5 x 105 a 2.5 x 108. Como se muestra en la Figura 3A, el número de partículas que permite asegurar que el anticuerpo se realiza dentro de una IMF aceptable, evitando el uso de un exceso de EV es 1 x 108 partículas de tinción.
Titulación de anticuerpo
Se seleccionó la concentración adecuada de anticuerpos dando por resultado la más alta señal impidiendo la Unión de anticuerpos no específicos. Esta prueba ha sido optimizada para las partículas de 1 x 108 , según lo determinado en el ajuste anterior. Anti-CD9_FITC anti-CD63_PE y anti-CD81_PE fueron probadas con concentraciones que van desde 1 a 50 μg/mL (figura 3B). Anticuerpos anti CD9_FITC y anti-CD63_PE dieron una buena resolución de señal (7,5 y 130-fold cambio de IMF vs granos solo, respectivamente) cuando se utiliza en concentración de 10 μg/mL mientras que la concentración seleccionada para el anticuerpo anti-CD81_PE fue de 5 μg/mL (465.3 veces Cambio MFI).
Validación de un método
Para confirmar que nuestro método es adecuado para analizar sólo vesículas extracelulares "en forma de Copa" y no restos de membrana, se aplicaron medidas diferentes sonicación, en el 10% de la amplitud, a la solución que contiene partículas. 100 μl de solución de PBS que contiene 1 x 108 partículas 1 x experimentó pasos de sonicación diferentes de 30 segundos a 5 minutos y la preparación resultante que contiene EV roto y bien formada se analizaron como se describe (protocolo experimental desde el punto 3.3). como resultado, se encontró que 30 segundos de sonicación disminuir MFI que fue completamente abandonado después de 1 minuto. En este punto, no hay fluorescencia es perceptible por cualquiera de los marcadores de EV (figura 3D).
Caracterización de citometría de flujo de exosomas derivados HEK293 y CPC
Estos resultados se obtuvieron siguiendo el protocolo presentado arriba con el método de aislamiento de la ultracentrífuga. Los exosomas aislados son cuantificados mediante tecnología NTA y cargados toda la noche con 1 μl de granos mixtos (1 x anti-CD9:1 x anti-CD63:1 x anti-CD81). El complejo granos + Exo fueron manchado con la cantidad adecuada de anticuerpos anti-CD9_FITC anti-CD63_PE y anti-CD81_PE (figura 3EF y tabla 2).
Además, mediante el uso de EV-CPC comparamos análisis FC con o sin enriquecimiento previo por ultracentrifugación. La figura 4 muestra que ambos métodos son adecuados para marcadores de superficie de perfil Exo. Pre-enriquecimiento de la fracción de vesículas extracelulares mejora grandemente la intensidad de la fluorescencia especialmente para CD63_PE y CD81_PE tinción (figura 4 y tabla 3).

Figura 1: protocolo y NTA terrenos. (A) representación esquemática del protocolo experimental. (B) representante NTA parcelas paso Media condicionada, pre- ultracentrífuga y post ultracentrífuga. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: adquisición y análisis de datos. (A) flujo cytometry análisis comienza con la creación de una primera puerta al conjunto de perlas de población "de perlas" (sin residuos) y luego una segunda puerta para distinguir eventos "camisetas". Camisetas son cerrados en un terreno establecido con FSC-H como eje x y la FSC-A como el eje y. (B-D) Punto representativo parcelas de demostración derecha-cambio de intensidad de fluorescencia para las poblaciones positivo de complejos granos exosomas (verde, CD9 + rojo CD63 +; CD81 marrón +). Control de isotipo (violeta) se superponen granos coloreados grises negativos. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Curvas de titulación para el número de partículas (las flechas muestran la cantidad seleccionada de partículas, 1 x 108). (A) las concentraciones de anticuerpos (las flechas muestran la concentración seleccionada para cada anticuerpo utilizado). Concentración (B) número de partículas y el anticuerpo son parcela vs intensidad de fluorescencia media (IFM). (C) curva que muestra 3 adquisición diferente de la preparación con 1 – 2 h o 5 h de incubación de anticuerpos. (D) curva que muestra la disminución de la fluorescencia tras sonicación en diferentes puntos del tiempo. (E-F) Doble cambio (media ± SD) de MFI para CD63, CD9 y CD81 vs control negativo (granos + anticuerpos, no EV) se muestran para EV HEK293 (n = 3 réplicas independientes) y CPC EV (n = 3 líneas de células primarias de 3 pacientes diferentes) por favor haga clic aquí para ver una versión más grande de Esta figura.
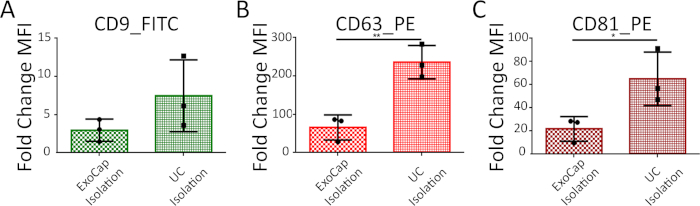
Figura 4: MFI análisis y comparación entre dos procedimientos: EV-Unión directa con los granos (aislamiento de granos de captura) y previo enriquecimiento con ultracentrífuga (aislamiento de la ultracentrífuga). Datos se presentan como doble cambio (media ± SD) de MFI para CD9 (A), (B) CD63 y CD81 (C) frente a control negativo (granos + anticuerpos, no EV). N = 3 líneas de células primarias de 3 pacientes diferentes. Haga clic aquí para ver una versión más grande de esta figura.
| CPC | CONC NTA (parte/μL) | CONC (μg/μl) |
| CPC Nº 1 la ultracentrífuga | 5.02E + 06 | 2.01 |
| CPC Nº 1 la ultracentrífuga | 6.10E + 07 | 1.04 |
| CPC Nº 2 la ultracentrífuga | 5.74E + 06 | 2.30 |
| CPC Nº 2 la ultracentrífuga | 7.43E + 07 | 0,79 |
| CPC #3 la ultracentrífuga | 2.02E + 06 | 1.90 |
| CPC #3 la ultracentrífuga | 2.91E + 07 | 0.42 |
Tabla 1: Comparación entre la concentración de NTA y concentración de la proteína para 3 diferentes paciente había derivado CPC antes y después de ultracentrífuga.
| DOBLE CAMBIO DE MFI ± SD | CD9 | CD63 | CD81 |
| HEK293 | 24.44 ± 19.17 | ± 430.7 344.9 | 535.2 ± 410.3 |
| CPC Nº 1 | 14.15 ± 3.72 | ± 236.05 43,40 por | ± 353.30 452.43 |
| CPC Nº 2 | 15.76 ± 1,87 | 983.06 ± 195.63 | ± 374.45 108.05 |
| CPC #3 | ± 8.94 7.19 | ± 830.50 184.73 | 60.05 ± 23,18 |
Tabla 2: Valor de cambio doble (media ± SD) de MFI HEK293 EV (n = 3 réplicas independientes) y CPC EV (n = 3 líneas de células primarias de 3 pacientes diferentes).
| DOBLE CAMBIO DE MFI ± SD | CD9 | CD63 | CD81 |
| Aislamiento de granos de captura | 2.96 ± 1.45 | 65.65 ± 18.87 | 21.85 ± 6.12 |
| Aislamiento de la ultracentrífuga | 7.47 ± 2,71 | 236.00 ± 25.06 | 65.05 ± 13.38 |
Tabla 3: Valor de cambio doble de MFI (media ± SD) de CPC EV (n = 3 líneas de células primarias de 3 diferentes pacientes) aislado por captura de perlas o ultracentrífuga.
Tabla 4: Especificación de producto.
Discusión
Técnica FC convencional sigue siendo el método analítico más sencillo caracterizar marcadores expresados en la superficie de EV. En este sentido, seleccionar el protocolo más apropiado es crucial para obtener información útil sobre fracciones de partículas individuales de interés evitando limitaciones debido a la sensibilidad del instrumento. Hemos descrito un método utilizando partículas magnéticas juntadas con anticuerpos que reconocen Exo y pequeño EV los antígenos superficiales que son convenientes para el uso de FC aguas abajo. Validamos el método utilizando dos diferentes tipos de células: CPC humana primaria que están surgiendo como una fuente importante de la célula para Exo enfoques terapéuticos para la enfermedad cardíaca; y las células HEK293, una línea celular inmortalizada ampliamente utilizada en investigación de Biología de la célula debido a la plasticidad y crecimiento celular confiable.
El método puede aplicarse a EV ultracentrífuga enriquecido y, para análisis más rápido, también directamente en in vitro mástil-célula-derivados CM sin enriquecimiento previo por ultracentrifugación. El material de partida es crítico cuando se comparan las muestras. Agregar captura cuentas directamente a los CM acelerará el procedimiento pero al mismo tiempo disminuir la intensidad de fluorescencia, tal como se muestra en la Figura 4A. También es importante utilizar una cantidad adecuada de PBS para mezclar granos y EV durante el paso de "captura" 4.4. Cuando se utiliza un tiempo de incubación constante, un volumen creciente disminuirá la intensidad de la fluorescencia debido a la ineficiente acoplamiento de EV.
Una limitación del protocolo es que un grano de captura solo puede enlazar múltiples EV/Exo partículas en su superficie. Esto limitará la posibilidad de identificar subconjuntos de EV, expresando la peculiar combinación de antígenos usando una tinción múltiple. El método basado en el grano por lo tanto produce datos semi-cuantitativos. Con perlas de llevar un sola capturando Ab (CD63, CD9 y CD81) permitirá la caracterización de las partículas que expresan dos epitopos al máximo: el uno en el talón y reconocido por el anticuerpo de capturando y detectaron por el anticuerpo que se añadidas posteriormente.
El patrón oro para el análisis de Exo con FC es un protocolo desarrollado por van der Vlist et en 201215. Permite un análisis de alta resolución de EV con una configuración optimizada del FC alta gama disponible en el mercado (por ejemplo, la afluencia de BD). Este protocolo es extremadamente detallada y útil pero todavía necesita un entorno de hardware complejas con concreto FC calibración antes del uso. Tres años más tarde, Pospichalova et al16 propone un protocolo simplificado para el análisis de la FC de Exo usando un citómetro dedicado específicamente desarrollado para el análisis de partículas pequeñas (por ejemplo, Apogee A50 Micro)17. Con respecto a este protocolo y otros que han utilizado especial umbral ajuste11, aquí proponemos un protocolo básico para realizar pequeños phenotyping EV con perlas de enlace magnético que es adecuado para instrumentos convencionales de FC y no requiere ninguna ajuste especial. Diferentes protocolos han descrito métodos basados en grano para caracterizar EV pequeños encontrado en los fluidos corporales por FC12. Aquí, mostramos la Inmunocaptura de subpoblaciones discretas de vesículas positivas para CD63 y CD9 y CD81 que comúnmente se utilizan como marcadores de Exo18. Aldehído sulfato látex19,20 y poliestireno12cuentas siguen siendo alternativas válidas para el atascamiento de EV presente en CM y el líquido del plasma de la sangre; sin embargo, los grupos aldehído expuestos en la superficie de la partícula del polímero permiten acoplamiento de proteínas inespecíficas y otros materiales para las partículas de látex, aumentando así el riesgo de contaminación por organismos lipoproteína o apoptóticas durante el aislamiento y detección proceso21,22.
Granos usados en el protocolo de enlace EV sólo entero, bien de forma. Hemos propuesto interrumpir EV estructura por sonicación apague la señal (sección 4, "validación de protocolo"). De hecho, un minuto de los resultados de la sonicación en intensidad de fluorescencia disminuida, mostrando así que una señal positiva no puede ser afectada por restos de membrana fijado por adsorción en granos.
Divulgaciones
Nada que declarar.
Agradecimientos
L.B. fue apoyado por becas de investigación de Helmut Horten Stiftung y Velux Stiftung, Zurich (Suiza). G.V. fue apoyado por becas de investigación de la Swiss National Science Foundation, la Fundación Cecilia Augusta, Lugano y el SHK Stiftung für Kreislaufkrankheiten und Herz (Suiza)
Materiales
| Name | Company | Catalog Number | Comments |
| IMDM | Gibco | 12440061 | |
| Amicon Ultra-15, PLHK Ultracel-PL Membran, 100 kDa | Millipore | UFC910024 | |
| CytoFlex, Flow Cytometer Platform | Beckman Coulter | CytoFlex | |
| DMEM, high glucose, HEPES, no phenol red | Gibco | 21063045 | |
| Dulbecco's PBS (PBS) Ca- and Mg-free | Lonza | BE17-512F | |
| ExoCap CD63 Capture Kit | JSR Life Sciences | Ex-C63-SP | |
| ExoCap CD81 Capture Kit | JSR Life Sciences | Ex-C81-SP | |
| ExoCap CD9 Capture Kit | JSR Life Sciences | Ex-C9-SP | |
| Exosome-Depleted FBS | Thermofisher | A2720801 | |
| Exosome-depleted FBS Media Supplement | SBI | EXO-FBS-250A-1 | |
| FBS-Fetal Bovine Serum | Gibco | 10270106 | |
| FITC anti-human CD9 Antibody | Biolegend | 312104 RRID: AB_2075894 | |
| Flow Cytometer analysis software | Beckman Coulter | Kaluza | |
| NanoSight LM10 | Malvern | NanoSight LM10 | |
| NanoSight Software | Malvern | NTA 2.3 | |
| Optima Max-XP | Beckman Coulter | 393315 | |
| PE anti-human CD63 Antibody | Biolegend | 353004 RRID:AB_10897809 | |
| PE anti-human CD81 (TAPA-1) Antibody | Biolegend | 349505 RRID:AB_10642024 | |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Thermomixer C | Eppendorf | 5382 000 015 | |
| TLA-110 | Beckman Coulter | TLA-110 rotors |
Referencias
- Barile, L., Vassalli, G. Exosomes: Therapy delivery tools and biomarkers of diseases. Pharmacology & Therapeutics. , (2017).
- Thery, C. Exosomes: secreted vesicles and intercellular communications. Molecular Biology Reports. 3, 15 (2011).
- Yadav, D. K., et al. Liquid biopsy in pancreatic cancer: the beginning of a new era. Oncotarget. 9, 26900-26933 (2018).
- Balbi, C., et al. First Characterization of Human Amniotic Fluid Stem Cell Extracellular Vesicles as a Powerful Paracrine Tool Endowed with Regenerative Potential. Stem Cells Translational Medicine. 6, 1340-1355 (2017).
- Andriolo, G., et al. Exosomes From Human Cardiac Progenitor Cells for Therapeutic Applications: Development of a GMP-Grade Manufacturing Method. Frontiers in Physiology. 9, (2018).
- Lai, R. C., et al. Exosome secreted by MSC reduces myocardial ischemia/reperfusion injury. Stem Cell Research. 4, (2009).
- Doeppner, T. R., et al. Extracellular Vesicles Improve Post-Stroke Neuroregeneration and Prevent Postischemic Immunosuppression. Stem Cells Translational Medicine. 4, 1131-1143 (2015).
- Kordelas, L., et al. MSC-derived exosomes: a novel tool to treat therapy-refractory graft-versus-host disease. Leukemia. 28, 970-973 (2014).
- Barile, L., et al. Extracellular vesicles from human cardiac progenitor cells inhibit cardiomyocyte apoptosis and improve cardiac function after myocardial infarction. Cardiovascular Research. 103, 530-541 (2014).
- Longatti, A., et al. High affinity single-chain variable fragments are specific and versatile targeting motifs for extracellular vesicles. Nanoscale. 10, 14230-14244 (2018).
- Menck, K., Bleckmann, A., Schulz, M., Ries, L., Binder, C. Isolation and Characterization of Microvesicles from Peripheral Blood. Journal of Visualized Experiments. , (2017).
- Inglis, H., Norris, P., Danesh, A. Techniques for the analysis of extracellular vesicles using flow cytometry. Journal of Visualized Experiments. , (2015).
- Arakelyan, A., et al. Flow Virometry to Analyze Antigenic Spectra of Virions and Extracellular Vesicles. Journal of Visualized Experiments. , (2017).
- Chimenti, I., et al. Isolation and expansion of adult cardiac stem/progenitor cells in the form of cardiospheres from human cardiac biopsies and murine hearts. Methods Molecular Biology. 879, 327-338 (2012).
- van der Vlist, E. J., Nolte-'t Hoen, E. N., Stoorvogel, W., Arkesteijn, G. J., Wauben, M. H. Fluorescent labeling of nano-sized vesicles released by cells and subsequent quantitative and qualitative analysis by high-resolution flow cytometry. Nature Protocols. 7, 1311-1326 (2012).
- Pospichalova, V., et al. Simplified protocol for flow cytometry analysis of fluorescently labeled exosomes and microvesicles using dedicated flow cytometer. Journal of Extracellular Vesicles. 4, 25530 (2015).
- van der Pol, E., et al. Particle size distribution of exosomes and microvesicles determined by transmission electron microscopy, flow cytometry, nanoparticle tracking analysis, and resistive pulse sensing. Journal of Thrombosis and Haemostasis. 12, 1182-1192 (2014).
- Witwer, K. W., et al. Updating the MISEV minimal requirements for extracellular vesicle studies: building bridges to reproducibility. Journal of Extracellular Vesicles. 6, 1396823 (2017).
- Thery, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Current Protocols in Cellular Biology. , (2006).
- Suarez, H., et al. A bead-assisted flow cytometry method for the semi-quantitative analysis of Extracellular Vesicles. Scientific Reports. 7, 11271 (2017).
- Sodar, B. W., et al. Low-density lipoprotein mimics blood plasma-derived exosomes and microvesicles during isolation and detection. Scientific Reports. 6, 24316 (2016).
- Sluijter, J. P. G., et al. Extracellular vesicles in diagnostics and therapy of the ischaemic heart: Position Paper from the Working Group on Cellular Biology of the Heart of the European Society of Cardiology. Cardiovascular Research. 114, 19-34 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados