Method Article
אפיתל שחיקה הקרנית עם עינית Burr כמודל עבור קרנית ריפוי פצעים
In This Article
Summary
פרוטוקול זה מתאר שיטה כדי לגרום של שחיקה השטח עינית של העכבר, בצע את לאחר מכן תהליך ריפוי הפצע. הפרוטוקול מנצל burr עינית חלקית להסרת האפיתל פני השטח של העין בעכברים מרדימים.
Abstract
הקרנית מאתר מספק מודל מצויין ללמוד ריפוי הפצע. הקרנית היא השכבה החיצונית ביותר של העין, וכך היא ההגנה הראשונה לפגיעה. למעשה, הוא הסוג הנפוץ ביותר של פגיעת עין שנמצאו קליניקה שחיקה הקרנית. כאן, אנו מנצלים של burr בעדשת העין לזירוז של שחיקה וכתוצאה מכך הסרת אפיתל הקרנית ויוו על עכברים מורדם. שיטה זו מאפשרת להפרעה יישוב, לשחזור אפיתל, עוזב בתחומים אחרים ללא פגע. בנוסף, אנו מתארים את הפריט החזותי של האפיתל משופשפים עם fluorescein מכתים, לספק ייעוץ קונקרטי על דרך להמחיש את הקרנית משופשפים. לאחר מכן, אנו עוקבים אחר ציר הזמן של ריפוי 0, 18 ו- 72 h לאחר שחיקה, עד שהפצע הוא epithelialized מחדש הפצע. המודל שחיקה אפיתל הקרנית הפגיעה הינו אידיאלי עבור מחקרים על התפשטות תאים אפיתל, הגירה, epithelialization מחדש של השכבות הקרנית. עם זאת, שיטה זו אינה אופטימלית ללמוד הפעלה סטרומה במהלך ריפוי הפצע, כי burr עינית שאינה לחדור אל הרבדים תאי סטרומה. שיטה זו מתאימה גם ליישומים קליניים, לדוגמה, ניסויים פרה-קליניים מבחן של יעילות התרופה.
Introduction
שכבות אפיתל של איברים רבים נחשפים לפציעות. עם זאת, הם גם מכילים את היכולת לפצות על אובדן הרקמות דרך ריפוי הפצע. הקרנית מציע מודל מצויין ללמוד ריפוי הפצע. זה יוצר על המשטח החיצוני של העין ומספק שכבת הגנה מכונות רישיות עינית. לפיכך, קרנית פונקציות כמו גדר ההפרדה גורמי מחלה, אובדן מים. הוא מורכב משלוש שכבות; האפיתל, משתית, אנדותל. האפיתל של הקרנית הופכת את השכבה החיצונית ביותר של הקרנית. תאים אפיתל לשמור על הפונקציה מכשול של הקרנית על ידי הקפדה זו לזו דרך צמתי צר1,2,3. Acellular הקרנית קרום המרתף, הקרום של באומן, מהנוזל האפיתל stroma מקיף, המכיל keratocytes עקשן. תחת stroma, תאי אנדותל ערוץ חומרים מזינים מים, חמצן על השכבה העליונה.
שריטות הקרנית נפוצים מאוד המרפאה4. פציעות בקרנית מגוונים, אך במידה רבה נגרמות על ידי חלקיקים קטנים כגון אבק או חול, שריטות או חפצים זרים אחרים. הפרוטוקול המתוארים כאן מטרות-להתרבות סוג הרלוונטית קלינית של שחיקה אפיתל הקרנית. בעשותו כן, פרוטוקול זה מספק שיטה לשליטה הזרע רופאים ומדענים הקרנית ליישם במחקרים משלהם. אנחנו שביצעת ויוו פציעה תיקון assay על הקרנית מאתר מאת ששרט את הרקמה עם צמח קוצני עינית dulled, השני Algerbrush. כאן, אנחנו למקד את השריטה רק על האפיתל הקרנית המרכזית ולהשאיר חלקים אחרים של איבר המין ללא נזק. כך, הפרוטוקול הוא אידיאלי כדי מחקר תאים אפיתל הקרנית דינמיקה או קרום המרתף במהלך epithelialization מחדש, התא ההעברה, התפשטות ובידול ויוו5. לאחרונה, מודל זה שימש כדי לנתח קדמון dynamics תא הקרנית מאתר כמו גם כדי לחשוף את היכולת של תאי אפיתל הקרנית הבדיל ביצירה מחדש את גומחת תאי גזע הקרנית לאחר פציעה6,7. בעקבות שחיקה, הקרנית חוזר חוזק ובשקיפות הרגיל שלה. מעניין, במחקר במבחנה ציינו שאת epithelialization מחדש תתרחש ללא התפשטות תאים מוגברת8. פרוטוקול זה מתאר את ציר הזמן של ריפוי ללא הפרעה הקרנית מאתר. השיטה ישימה ובכך לבחון את השפעת הסמים על ריפוי דפוסים ומהירות.
הקרנית כבר בשימוש נרחב עבור לימודי ריפוי הפצע. עם זאת, מחקרים רבים צריכים לסמוך על דגמים אחרים של פציעה. מודל ומבוססת של פגיעה הקרנית היא הכוויה אלקליין שהתבצעה על-ידי החלת הידרוקסיד הנתרן (NaOH) עם או בלי נייר סינון על פני הקרנית9. חשיפה אלקליין גורמת פגיעה גדולה, ' מאטום לשקוף ' משפיעה לא רק על אפיתל הקרנית, אלא גם את לחמית, משתית9,10. פתרונות אלקליין חזקה הוכחו לגרום כיבים הקרנית, opacification וכורוידאלית9. תאים דלקתיים לפלוש stroma בדרך כלל תוך 6 שעות ולהישאר שם עד 24 שעות11. לכן, פגיעה אלקליין היא שיטה מומלץ במחקרים הקשורים להפעלה סטרומה. סוג אחר של פגיעה כימיים יכולים להנחיל על-ידי החלת דימתיל סולפוקסיד (דימתיל סולפוקסיד)9,הקרנית10. דגמים אחרים פציעה נפוצים כוללים incisional פצעים החודרים דרך הפצעים stroma, keratectomy, אשר מוגבלים לחלק העליון של ה-14,משתית15. שיטות אלה שימושיים גם לענות על שאלות לגבי ריפוי הפצע סטרומה. פציעה שונות הדגמים יש יתרונות וחסרונות משלהם. שחיקה, או הטריה, של האפיתל הקרנית פותחה לראשונה באמצעות ואזמלי מנתחים הושלו או להבים שמחוץ לקרנית16. שיטה זו כבר מאוחר יותר בשימוש ב- vivo על עכבר, חולדה ארנבת17,18,19,20,21,22. באמצעות של burr עינית (איור 1), אנחנו להסיר רק אזור שנבחר של האפיתל, משאיר את שאר האפיתל מעושה. בדרך זו, זה אפשרי למקד בדיוק להסרת האפיתל לחלקים שונים של הקרנית. בנוסף, גודל שחיקה יכול להידרש עם fluorescein מכתים. יתר על כן, כאן אנו עוקבים אחר הסגר שחיקה במהלך תקופת ההחלמה.
שיטה זו מהווה מספר יתרונות, i) כולל מיקומו המדוייק של שחיקה האתר, שאינה אפשרית עם פגיעה כימית, ii) שחיקה מהירה לביצוע, השלישי) זה לא פולשנית. במסמך זה, אנו מתארים את השיטה באמצעות העכבר NMRI outbred כמודל, אולם זה יכול להיות מיושם במגוון רחב של דגמים גנטיים העכבר, כמו גם עכבר, ארנב, אשר הם הדגמים הנפוצים המשמשות ללימוד הפרעה הקרנית האנושית.
Protocol
כל ניסויים אושרו על ידי מועצת המנהלים הלאומית ניסויים בבעלי חיים.
1. תכשירים
- להכין את כל הפתרונות ולשמור בטמפרטורת החדר, אלא אם צוין אחרת. עקוב אחר כללי סילוק פסולת חומרים השלך בשימוש ופתרונות.
- שימוש NMRI ו- ICR outbred מניות, בין הגילאים 4-12 שבועות או מגדר. אם משתמש המתח C57BL/6, בצע את שיטת ההכנה של קטמין-medetomidine בשלב 1.3.2. לקבלת צעדים נוספים, בצע את ההוראות המתוארות 1.3.3.-1.3.5.
- הכינו את רפואה וטרינרית טרי, בזמן לפני תחילת הפעולה. Carprofen ייעשה שימוש מאוחר יותר, ולכן זה לא הכרחי להכין אותו בשלב זה.
- כדי להתכונן פתרון של קטמין-medetomidine הרדמה, לערבב 0.375 mL (במניה ריכוז 50 מ"ג/מ"ל) של קטמין (Ketaminol וטרינר) עם 0.25 mL (במניה ריכוז 1 מ"ג/מ"ל) של medetomidine (Cepetor וטרינר) ולהוסיף 1.25 מ ל סטרילי 0.9% NaCl. לנהל 0.15 מ ל/20 גרם של משקל העכבר (7.5 מ"ג/ק"ג, קטמין, 1 מ"ג/ק"ג, medetomidine).
- כדי להתכונן פתרון ובדילול של קטמין-medetomidine הרדמה על עכברים C57BL/6, לערבב 0.375 mL (במניה ריכוז 50 מ"ג/מ"ל) של קטמין עם 0.25 mL (במניה ריכוז 1 מ"ג/מ"ל) של medetomidine ולהוסיף 2.5 מ של סטרילי 0.9% NaCl. לנהל 0.15 מ ל/20 גרם של משקל העכבר (3.75 מ"ג/ק"ג, קטמין ו- 0.5 מ"ג/ק"ג, medetomidine).
הערה: זהו שלב חלופיים, רק עבור עכברים C57BL/6 למבוגרים. - כדי להתכונן buprenorfin נגד כאבים, להוסיף 0.1 מ"ל (במניה ריכוז 0.3 מ"ג/מ"ל) של buprenorfin מ ל 1.9 של סטרילי 0.9% NaCl. לנהל 0.2 מ"ל/20 g העכבר משקל (0.15 מ"ג/ק"ג).
- כדי להכין atipamezole להפסקת הרדמה, להוסיף 0.1 מ"ל (במניה ריכוז 5 מ"ג/מ"ל) של atipamezole 4.9 מ של 0.9% NaCl. לנהל 0.15 מ ל/20 g העכבר משקל (0.75 מ ג/ק ג).
- לשימוש נגד כאבים במהלך פוסט-הרדמה carprofen. להוסיף 0.1 מ"ל (במניה ריכוז 50 מ"ג/מ"ל) של carprofen 4.9 מ של 0.9% NaCl. לנהל 0.15 מ ל/20 גרם של משקל העכבר (7.5 מ"ג/ק"ג).
- להכין פתרון מכתימים פלורסנט
- המדגימה את השריטה תחת אור כחול קובלט (איור 1), להשתמש פתרון פלורסנט. להכין פתרון fluorescein 0.1% על-ידי הראשון מדידה 10 מ ג של fluorescein מלח עם קנה מידה בסדר ולאחר מכן להוסיף אותה 10 מ ל תמיסת מלח באגירה פוספט (PBS).
- על הפתרון fluorescein מפני אור ומנערים למשך 5 דקות על מטרף.
הערה: הפתרון fluorescein הוא רגישים לאור; שמור את הפתרון מכוסה אור. פתרון זה ניתן לאחסן +4 ° C 2-3 ימים. לשימוש, זה עוזר למקם את הפתרון fluorescein בבקבוק טפי המשמשת עבור טיפות עיניים. השתמש במסנן-סטריליים בעת העברת הפתרון של הבקבוק טפי.
- לנקות את הטיפ עינית burr לפני ואחרי השימוש; בהתחלה עם PBS ולאחר מכן עם 70% EtOH. אם עושה שחיקה של מספר עכברים במהלך הפעולה זהה, לעשות את השלבים ניקוי בין כל עכבר.
- לשים את הצלחת מחוממת (+37 ° C) ומניחים מגבת נייר על זה.
2. שחיקה הקרנית
התראה: שימוש מגן ללבוש (כפפות, חלוק המעבדה) כאשר טיפול עכברים. שוקלים את העכבר כדי להעריך את עוצמת הקול של תרופות כדי לנהל.
- השתמש בשיטת scruffing עם יד אחת כדי להתמודד עם העכבר23. לנהל את התערובת קטמין-medetomidine intraperitoneally (i.p.) אל הבטן התחתונה השמאלית. הנח את העכבר לכלוב הפרט ולחכות לו להירדם. זה בדרך כלל לוקח פחות מ-5 דקות. לאחר מכן, לנהל buprenorfin הראשון ולאחר מכן atipamezole ויה i.p. זריקות. השתמש באותה שיטה טיפול.
הערה: לאחר ההרדמה ניתנת, הפרוטוקול צריך לא ניתן להשהות בכל רגע. - לפני שתמשיך, ודא לצלחת מחוממת חמים. הנח את העכבר anesthetized בצלחת מחוממת. הרמה של הרדמה היא טובה אם רפלקס הזנב נעדר, אך רפלקס הבוהן קיים. בדוק את הרפלקסים הללו על ידי צובט את הזנב ואת כל הבוהן עם אצבעות או מלקחיים. אל תשתמש בכוח מופרז. הרדמה יהיה האחרון 20-25 דקות.
- כדי להפוך של שחיקה, השתמש את burr עינית נקי. לסובב את בסיס burr כדי להפעיל את הרטט זה חיוני כדי להפוך את השריטה. מרגיש את הרטט ביד, כאשר burr מתפקד כראוי.
- פתח עין אחת בכל פעם על-ידי החזקת העפעפיים בנפרד עם האצבעות. לאחר מכן בחוזקה לגעת את burr בקרנית, לזוז אחורה וקדימה גם המכשיר כמו הצדה על פני עינית. הרטט burr יבצע השריטה; לא ללחוץ, ללחוץ או לקרוע את הקרנית. הקרנית המרכזית, 20 ששרט תנועות על פני השטח הם מספיק כדי לגרום את הפצע. לא להרים את burr ולנסות להישאר באזור של הקרנית כדי להיות שפשף בכוח. רכישת שחיקה בגודל סטנדרטי ידרוש מספר מחזורים של תרגול.
הערה: asepsis המצמוץ יכולה להיות מושגת לפני שחיקה באמצעות פתרון אופטלמולוגיות betadine.
3. הדמיה של שחיקה
- להאיר את האזור משופשפים באמצעות האור עט כחול קובלט (איור 1) ו- fluorescein פתרון. השטח עינית מופיע צבע אור הסביבה. לאחר יישום fluorescein, האזור משופשפים שזוהר בירוק כאשר מאירים את העין בעזרת העט אור.
- אם יש צורך, לפתוח את העין משופשפים באופן דומה כמו 2.3 ולפקח טיפה אחת של fluorescein פתרון מהבקבוק טפי. לשטוף את העיניים פעם אחת עם PBS או 0.9% NaCl כדי להפחית את הרקע של fluorescein. השתמש בקבוק טפי או פיפטה לרחצה. וארוקן את הנוזלים משם עם מגבון רך ולנקות את הריסים, במידת הצורך. הנוזל העודף אוספת בדרך כלל על הגבול האף של העין, ליד הפתח של תעלת דמעות.
התראה: להימנע מלגעת הקרנית בזמן cleaining כמו שריטות קלות עלול להיגרם.
- אם יש צורך, לפתוח את העין משופשפים באופן דומה כמו 2.3 ולפקח טיפה אחת של fluorescein פתרון מהבקבוק טפי. לשטוף את העיניים פעם אחת עם PBS או 0.9% NaCl כדי להפחית את הרקע של fluorescein. השתמש בקבוק טפי או פיפטה לרחצה. וארוקן את הנוזלים משם עם מגבון רך ולנקות את הריסים, במידת הצורך. הנוזל העודף אוספת בדרך כלל על הגבול האף של העין, ליד הפתח של תעלת דמעות.
- לצלם שחיקה הקרנית.
- כדי לקבל תמונות דומות בכל מפגש הדמיה, להשתמש בכלים מצורף יציב האור עט כחול קובלט, מצלמות slr דיגיטליות (איור 2). פרוטוקול זה מספק התקנה קלה לחזור (איור 2).
- כדי לצרף את האור עט ואת המצלמה, השתמש מנורת שולחן עם זרוע גמישה, מלחציים, זרוע מתכווננת מצלמה עם מלחציים, בהתאמה. אזיקון אור מנורת שולחן, עמדה מעל העין העכבר? העט. מיצוב האור אחרת עלולה לשנות את החזיית השריטה. הצעה עבור מיקום כלים אלה מתוארת באיור2.
- להשתמש מצלמות slr דיגיטליות לצלם תמונות של העין. מקום בעל החיים המרחק הרצוי ומעמד מיקוד המצלמה (1:12) חדר אור. לאחר מכן, סגור את כל האורות האחרים מלבד האור עט כחול קובלט.
הערה: קלטת הידית האור עט למטה או השתמש גומייה כדי להשאיר את האור דולק כל הזמן במהלך דימות. זה יכול לעזור אם התמונה הופכת להיות מטושטש. . זה קל יותר לבצע את הצעד הדמיה עם עמית.
- כדי לקבל תמונות דומות בכל מפגש הדמיה, להשתמש בכלים מצורף יציב האור עט כחול קובלט, מצלמות slr דיגיטליות (איור 2). פרוטוקול זה מספק התקנה קלה לחזור (איור 2).
4. להתעורר לאחר שחיקה הקרנית
- לנהל buprenorfin הראשון ולאחר מכן atipamezole ויה i.p. זריקות. השתמש באותה שיטה טיפול כמו 2.1.
- הניחו טיפת, fucidin העין חומצה פלסטר (Isathal) לעיניים משופשפים והן שפשף בכוח ללא לחות ולשמור על פני עינית נקי מחיידקים לאחר הרדמה.
- כמו העכבר יתעורר בעוד 5-20 דקות בצלחת מחוממת, להתבונן בעכבר במהלך התקופה שלאחר הרדמה השכמה. כאשר זה הופך ניידים, למקם אותו לכלוב נפרד.
הערה: אם מתעורר לוקח יותר זמן, הנח את העכבר בתוך הכלוב עם כרית מחוממת או למקם את הכלוב כולו על הצלחת מחוממת, לפקח על העכבר באופן קבוע. בזמן ההרדמה מתנדף, העכבר בדרך כלל מנערת, מגיע כלפי מעלה עם הגוף הקדמי. אופן פעולה זה יחזור להיות נורמאלי ב 3-4 שעות, ואז ניתן למקם את העכבר בחזרה אל כלוב משותפים. - לנהל carprofen i.p. לקבלת משחה נגד כאבים ועין בשני ימים עוקבים אחרי השריטה, באופן דומה כמו צעדים 2.2. 4.2.
5. דימות במהלך ריפוי הפצע
- ב פרוטוקול זה, זמן שימוש הנקודות 18 h ו- 72 h לאחר שחיקה להתבונן על סגירת הפצע.
- עבור הדמיה רצופים, עזים ומתנגד העכברים כפי שהוסבר ב 2.2.
- צלם תמונות כפי שהוסבר ב 3.
- תתעורר של בעלי חיים atipamezole i.p. ונטר תקופת התעוררות כפי שהוסבר ב- 4.3.
הערה: אם לא ממשיכים את המעקב, המתת חסד העכבר מיד אחרי 5.1.2. המתת חסד מתואר ב- 6.1.
6. קרנית אוסף והטבעה פרפין
- לאחר הנקודה בזמן האחרון, להקריב את החיה. הנח את העכבר בחדר זה יכול להיות מלא עם CO2. למלא את האוויר קאמרית עם CO2- כאשר החיה משותק, לנקוע חוליות צוואר הרחם על ידי מושך בחוזקה מבסיס של הזנב והקשה על אזור הצוואר למטה באותו הזמן.
התראה: תמיד את ההנחיות של הגוף רווחת בעלי חיים מקומיים. - לאסוף את כל גלגל העין על ידי חיתוך פתח בעור לצד של העין במספריים לנתיחה. מקם את המספריים תחת גלגל העין וחותכים העצב עינית כדי לפוצץ את גלגל העין מתוך המסלול. להשתמש מלקחיים אם העין לא יצא בקלות.
- תעשה חור בחלק האחורי של העין, בצד ברשתית, עם מחט 26G כדי לאפשר חדירה חינם של פתרונות בתוך העין.
הערה: אל תתנו את העין להיות יבש, במקום זאת, נזכרתי ב- PBS עד שתמשיך עם הפרוטוקול.
- תעשה חור בחלק האחורי של העין, בצד ברשתית, עם מחט 26G כדי לאפשר חדירה חינם של פתרונות בתוך העין.
- לאסוף את גלגל העין צינור 2 מ"ל עם PBS. אל תשתהה בנקודה הזאת מהניסוי.
- הסר PBS, לתקן את העיניים ב 4% paraformaldehyde (PFA) +4 º C למשך 4-5 שעות.
- להעביר את גלגל העין קבוע קלטת רקמות לצורך עיבוד רקמה. השתמש בממחטה עיבוד מחשב לבין התוכנית הבאה:
- לשטוף עם PBS.
- דגירה 2 x 45 דקות ב- 70% אתנול בטמפרטורת החדר.
- דגירה 2 x 1 h ב- 94% אתנול בטמפרטורת החדר.
- דגירה 3 x 45 דקות באתנול מוחלטת בטמפרטורת החדר.
- דגירה 3 x 1 h, קסילן, בטמפרטורת החדר, קסילן האחרון ב 37 º C.
- דגירה 3 x 1 h בפרפין ב 60 מעלות צלזיוס.
- לאחר עיבוד רקמה, להטביע את גלגל העין לתוך שמן פראפין (+ 60 ° C) באמצעות בלוק ההטבעה רקמות. המקום העין בתוך הרחוב כך זה נראה מהצד, הגבול היקפיים פונה כלפי מעלה. תן את הבלוק לחזק על צלחת מגניב במשך 5-10 דקות.
7. פרפין מקטעים של הקרנית
- הכינו את האזמל הקטן על חלוקתה לפי ההוראות של מוסד או של היצרן.
התראה: להיות זהיר בעת טיפול הלהב מיקרוטום חדה. - המקום אמבט מים אחד עם מים בטמפרטורת החדר הנדסה גנטית לצד האזמל הקטן ועוד עם הנדסה גנטית מים מחומם ל +50 ° C.
- הפוך את 5 מיקרומטר. הסעיפים עבה של גלגל העין.
הערה: העדשה מעברי בקלות במהלך חלוקתה. כדי למנוע זאת, לנגב את המשטח עם ממחטה לחה בכל שורה חדשה של מקטעים מופעל. להשתמש במי ברז כדי להרטיב את הרקמה. - במקום הסעיפים לצד השני באמבט מים בטמפרטורת החדר, ולאחר מכן להעביר אותם אמבט מים חמים עם העזרה של זכוכית. למתוח את הסעיפים לאמבט מים חמים עד כל הקמטים להירגע, צבע המאט מקטעים להפוך.
- יבש את השקופיות זכוכית עם מקטעים לילה ב- +37 ° C.
- לצרף את המקטעים השקופיות על ידי שמירה על השקופית במשך דקה אחת על צלחת מחוממת ב +60 ° C. אחרי זה, הסעיפים ניתן ישירות מעובד עבור צביעת, שיטות immunohistological או מאוחסנים +4 ° C.
תוצאות
פרוטוקול זה מתאר מודל לגרום פגיעה שחיקה הקרנית העכבר ומציעה כיצד פעל והמחש את תהליך הריפוי לאחר שחיקה. לאחרונה, אנחנו מועסקים בשיטה זו כדי ללמוד את התפקיד של ובתאים אפיתל הקרנית במהלך6ריפוי הפצע. שימוש בכלים הוקמה היא המפתח ניסוי מוצלח שחיקה. אנחנו, ואחרים, השתמשו burr עינית Algerbrush II (איור 1) כדי לבצע את שריטות6,7,24. כלי זה יש טיפ burr מועם של 0.5 מ מ בגודל כי מברשות במקום תרגילים או מזמרה האפיתל הקרנית משם. לכן, כלי זה הוא הבחירה המומלצת עבור פגיעה שחיקה על הקרנית.
חלק מרכזי של מודל זה היא כי ניתן לאבחן ללא מאמץ האזור המושפע במרווחי זמן הרצוי. איור 3A, אנו מציגים את השימוש fluorescein מכתים בשילוב עם מקור אור כחול קובלט (איור 1) כדי להציג את האתר שחיקה. בניסוי זה, נוכל לבצע גדול פצע הקרנית המרכזית והשאיר לא נגעה הקרנית היקפיים (איור 3 א). יתר על כן, אנו שפשף בכוח רק העין השמאלית של כל עכבר, המשיך העין נכון, דו צדדיים כפקד שאינם שפשף בכוח. הדגימות העין הדו-צדדיים נשאר שלילי לאות fluorescein, אשר טוען כי הם לא עוברים כל אובדן התא במהלך הניסוי, ובכך לתפקד כמו דגימות הבקרה. עם זאת, אות ירוק בתוך הגבולות של העין מוצג הפתרון fluorescein שהצטברו בצומת בין העין לבין העפעף. השריטה היה הגדול-! הו, מיד לאחר הפגיעה (איור 3 א). זה היה קטן במידה ניכרת אחרי 18 h, במקרה זה, ממוקם בסמוך לגבול העליון של העין. עם זאת, האפיתל סגירת האזור חשוף במהירות שווה מכל הכיוונים השריטה. ראוי לציין, ב- 72 h שלאחר ופצעו, אין אות ירוק היה גלוי. אפשרות זו מציינת כי האפיתל הקרנית היה מלא מחדש epithelialized מאת 72 h לאחר השריטה.
בשיטה זו, אנו מכוונים מיקוד את השריטה רק באפיתל הקרנית, כך לשכבות העמוקות של הקרנית נותרו על כנן. להסרת האפיתל הקרנית ברור היה ממקטעים היסטולוגית ב- 3B איור. -הו, קצה שחיקה מוצג מדף צר, acellular זה הוא רציף של לקוח קבוע, תא 4-5 שכבות אפיתל הקרנית עבה. לימבוס, גבול היקפי של האפיתל הקרנית, מציג אזור דוגמה זה לא הושפע את השריטה במהלך ניסיוני ציר הזמן כולו (72 h). בנוסף, סעיפים היסטולוגית מצוינת ועליית של הקרנית, stroma אנדותל, לא נפגעו על ידי burr עינית. רקמות אלה שני הופיע דומה בדגימות העין משופשפים, דו צדדיים. ב 18 h לאחר פציעה, תהליך הריפוי הוא פעיל, והוא epithelialization מחדש מתמשכת. זה הוצע על ידי הופעתו של הכח המירבי. בחוד החנית מכיל רק 1-2 שכבות תאים אפיתל, זה מכסה את האזור חשוף לפני ריבוד מחדש יכולה להתרחש25. בקנה אחד עם התוצאות על דמות 3A, השטח היה מלא מחדש epithelialized מאת 72 h, כאשר החזיתות נודדים היה מכוסה הפצע, כל השכבות אפיתל נכחו שוב. סעיפים היסטולוגית מעינו הדו-צדדיים אישר (איור 3 א) בעיניים שליטה נשארה בתקופת התצפית.
לבסוף, אנו מספקים ראיות כי המודל שחיקה מוגבל לשימוש של האפיתל הקרנית והעלה לא סטרומה בתגובה לפציעה, כגון כורוידאלית. איור 4 מראה הקרנית מאתר ב 18 h לאחר שחיקה. המבוססות על תצוגת מאקרוסקופית, נקודת זמן זו לא יציג לתגובה סטרומה, שמעיד כי הפרוטוקול שלנו לא יפריעו ועליית הקרנית. לשם השוואה, פציעה אלקליין עם מול/ליטר 0.75 NaOH המושרה מיד כורוידאלית ב stroma. בהתחשב כורוידאלית מהירה בפציעה אלקליין, הנקודות הזמן בשיטה שלנו לספק ראיות כדי לשלול את האפשרות של התגובה stroma.

איור 1: כלי חיוני עבור שחיקה אפיתל הקרנית. . בצד השמאל הוא צמח קוצני בעדשת העין רוטטת. האור עט כחול קובלט בפינה השמאלית משמשת כדי להביא את הכתם fluorescein גלוי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 2: הדמיה של שחיקה הקרנית. (א) כלים עבור הדמיה זרוע מתכווננת מצלמה עם מהדק (משמאל), מצלמות slr דיגיטליות (מרכז), מנורת שולחן עם זרוע גמישה, מהדק (מימין). האור עט כחול קובלט קשורה הכיפה של המנורה עם שני קשרים כבל. (B) מבט כללי של ההתקנה הדמיה; המרחק של כל קובץ מצורף כלי מסומן בתמונה בס מ. שני תופסנים 6 ס מ מן המשטח החום, העכבר ממוקם 10 ס מ מן הקצה צלחת חום. (ג) מבט מקרוב על ההדמיה שחיקה עם מרחק המוצע ומיקום את העין העכבר ב ס מ. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 3: זיהוי, לוקליזציה של שחיקה הקרנית. (א) העכבר עיניים-0, 18 ו- 72 h לאחר שחיקה. Fluorescein אות מסמן האזור משופשפים בגוון ירוק בהיר, ואילו האזורים האחרים בתוך האפיתל נשארים כהה. העיניים הדו-צדדיים לשמש כפקדי. קו מקווקו מסמן את גבולות הפצע והיא הנקודה הלבנה בכל עין ההשתקפות מהמצלמה. (B) בהיסטולוגיה למחלקה, hematoxylin ואאוזין צבעונית דגימות של העיניים העכבר-0, 18 ו- 72 h לאחר שחיקה. לימבוס הוא הגבול המקיף את אפיתל הקרנית מכל הצדדים. אסטריקס מסמן קצה שחיקה. סולם בר הוא 100 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
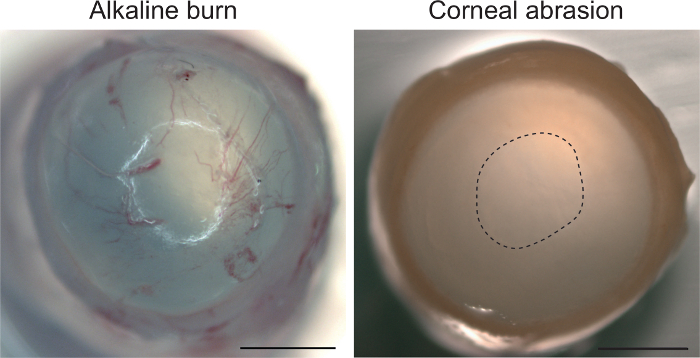
איור 4: שחיקה הקרנית אינו מפעיל תגובה סטרומה. חשיפה אלקליין עם מול/ליטר 0.75 NaOH ואחריו השקיה עם 0.9% NaCl מייצרת כורוידאלית הקרנית (עין שנאספו מיד לאחר הטיפול). שחיקה עם בר עינית מראה כורוידאלית אין אפילו אחרי ה 18 שחיקה האתר המסומן בקו מקווקו. גודל בר 1 מ מ. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
שיטות ופצעו הם כלים פופולריים ללמוד היבטים שונים של הומאוסטזיס הקרנית, פתולוגיות. המודל שחיקה מציע שיטה ומבוקרות היטב כדי לטפל בבעיות רלוונטיות עיניים. עם זאת, נקודות קריטיות מסוימות בפרוטוקול שווים תוך שימת דגש. ראוי לציין, הפרטים המפורטים לגבי רפואה וטרינרית, ציר זמן ריפוי הפצע, ו התוצאה הממוטבות לשימוש עם NMRI outbred מניות ICR, אך עשויים להשתנות בין זני עכברים26. עם פרוטוקול זה, חיות ניסוי יישאר anesthetized בכ-20 דקות. זה נותן חלון קצר, אבל מספיק זמן כדי לבצע את השריטה. עם זאת, בעת שימוש של burr עינית, שהופך את השריטה עצמו הוא פעולה מהירה מאוד, ניתן לבצע במסגרת זמן זו.
ויזואליזציה קל ונגיש הוא אחד היתרונות העיקריים של המודל שחיקה. בשילוב עם שיטות בביולוגיה מולקולרית, זה פותח אפשרויות ללמוד בתאי אפיתל בפירוט רב. ניתן לעבד את הקרנית משופשפים עבור היסטולוגית או אימונולוגי מכתים של, חלבונים או חומצות גרעין ניתן לאסוף ולהשתמש בחן עוד יותר. Pajoohesh-חשיש. et al. הראה את הגן הזה ביטוי דפוסי השינוי בתאי אפיתל הקרנית על עלבון הקרנית עם להב התעמעם27. כדי להבטיח דגימה מבוקרת, אנו ממליצים כי תמונות של חף נלקחים מיד לאחר הניתוח, אוספים מדגם פעל בדיוק צירי הזמן המתוכנן.
פרוטוקול זה יש שימושים מעבר בחינת epithelialization הקרנית. לדוגמה, ניתן להשתמש שחיקה של לימבוס הקרנית, גומחת תאי גזע של הקרנית, ללמוד תאי גזע dynamics7. הראינו כי האזור שאינו שפשף בכוח של האפיתל נותר נורמלי במהלך תהליך הריפוי, אולם חלק מהכותבים טוענים כי קרום המרתף, הבסיסית keratocytes סטרומה המושפעים את העינים באר24,28. להיות מוערך הסרת קרום המרתף עם קרום המרתף ספציפי מכתים. יתר על כן, חבלות חוזרות ונשנות על פני ציר זמן ארוך יותר יכול לחשוף דפוסים מעניינים הריפוי. ב פרוטוקול זה, לא נתבונן הארכיטקטורה של האפיתל על מרדף לטווח ארוך. שניהם מועם אזמל, פציעות burr עינית הראו שכיחות מוגברת כדי ארוזיות הקרנית לאחר אחד מספר שבועות לאחר פציעה24,29,30. זה יש לשמור בראש בעת שימוש במודל שחיקה עבור מחקרים ארוכי טווח. עם זאת, מחקרים התמקדות ארוזיות הקרנית שייתכן שיהיו שימושיות פרוטוקול זה.
מודלים wounding אחרים מתוארים באריכות על ידי Stepp et al. . ב סקירה5. יחד, פרוטוקול זה, את הגישות הקיימות מספקות אפשרויות רב-תכליתי לבחון הן שאלות יסוד ביולוגי, כמו גם בעיות קליניות מעשיות.
Disclosures
המחברים אין לחשוף.
Acknowledgements
ברצוננו להודות Ikkala קאיזה שלה בפז סיוע טכני, תובנה עזרה בעת שמצדדי בשיטה זו, כמו גם בהמשך במהלך הביצוע שלנו שאלות מחקר מרכזי. אנחנו גם רוצה להודות לה עזרה בתכנון הקווים המנחים של העבודה וטרינרית מעבדה חיה במרכז, אנה מלר.
Materials
| Name | Company | Catalog Number | Comments |
| NMRI mouse | Envigo | 275 | |
| 0.9% NaCl | use sterile | ||
| Medetomidine | Vetmedic | Vnr087896 | Market name: Cepetor Vet |
| Ketamine | Intervet | Vnr511485 | Market name: Ketaminol Vet |
| Buprenorfin | Invidior | 3015248 | Market name: Temgesic |
| Atipamezol | Orion Pharma | Vnr471953 | Market name: Antisedan Vet |
| Carprofen | Norbrook | Vnr027579 | Market name: Norocarp Vet |
| 1% fucidin acid eye ointment | Dechra | Vnr080899 | Market name: Isathal |
| Fluorescein salt | Sigma-Aldrich | F6377 | |
| Phosphate-buffered saline solution | PBS | ||
| Algerbrush ii ocular burr (0.5 mm tip) | Algerbrush | 6.39768E+11 | |
| Cobalt Blue pen light | SP Services | DE/003 | |
| Hot plate | Kunz Instruments | 2007-0217 | |
| Digital SLR camera | Nikon | D80 | |
| Adjustable camera arm and clamp | Neewer | 10086132 | Height 28 cm |
| Table lamp with a flexible arm and a clamp | Prisma | ||
| Soft wipe | KimtechScience | 7552 | |
| CO2 chamber | |||
| Dissection toolset | Fine Science Tools | ||
| Syringes | Beckton Dickinson | 303172 | |
| 26G needles | Beckton Dickinson | 303800 | |
| 2 mL Eppendorf tube | Sarstedt | 689 | |
| Tissue casette | Sakura Finetech | 4118F | |
| Tissue processing machine ASP200S | Leica | ||
| Xylene | VWR | UN1307 | |
| Paraffin wax | Millipore | K95523361 | |
| Tissue embedding mold 32 x 25 x 6 mm | Sakura Finetech | 4123 | |
| Microtome | Microm | HM355 | |
| Water bath for sectioning | Orthex | 60591 | |
| Water bath for sectioning | Leica | HI1210 | |
| Microtome blade | Feather | S35 | |
| Glass slide | Th.Geyer GmbH & Co. | 7,695,019 | |
| Ultrapure water | Millipore | MPGP04001 | MilliQ |
| Paraformaldehyde | Sigma-Aldrich | 158127 | PFA |
References
- Yi, X., Wang, Y., Yu, F. S. Corneal epithelial tight junctions and their response to lipopolysaccharide challenge. Investigative Ophthalmology & Visual Science. 41 (13), 4093-4100 (2000).
- Wang, Y., Chen, M., Wolosin, J. M. ZO-1 In Corneal Epithelium; Stratal Distribution and Synthesis Induction by Outer Cell Removal. Experimental Eye Research. 57 (3), 283-292 (1993).
- Sugrue, S. P., Zieske, J. D. ZO1 in Corneal Epithelium: Association to the Zonula Occludens and Adherens Junctions. Experimental Eye Research. 64 (1), 11-20 (1997).
- Jackson, H. Effect of eye-pads on healing of simple corneal abrasions. British Medical Journal. 2 (5200), 713 (1960).
- Stepp, M. A., et al. Wounding the cornea to learn how it heals. Experimental Eye Research. 121, 178-193 (2014).
- Kalha, S., Shrestha, B., Sanz Navarro, M., Jones, K. B., Klein, O. D., Michon, F. Bmi1+ Progenitor Cell Dynamics in Murine Cornea During Homeostasis and Wound Healing. Stem Cells. , (2018).
- Nasser, W., et al. Corneal-Committed Cells Restore the Stem Cell Pool and Tissue Boundary following Injury. Cell Reports. 22 (2), 323-331 (2018).
- Kaplan, N., Fatima, A., Peng, H., Bryar, P. J., Lavker, R. M., Getsios, S. EphA2/Ephrin-A1 Signaling Complexes Restrict Corneal Epithelial Cell Migration. Investigative Ophthalmology & Visual Science. 53 (2), 936 (2012).
- Bai, J. -. Q., Qin, H. -. F., Zhao, S. -. H. Research on mouse model of grade II corneal alkali burn. International Journal of Ophthalmology. 9 (4), 487-490 (2016).
- Chan, M. F., et al. Protective effects of matrix metalloproteinase-12 following corneal injury. Journal of Cell Science. 126, 3948-3960 (2013).
- Byeseda, S. E., Burns, A. R., Dieffenbaugher, S., Rumbaut, R. E., Smith, C. W., Li, Z. ICAM-1 is necessary for epithelial recruitment of gammadelta T cells and efficient corneal wound healing. American Journal of Pathology. 175 (2), 571-579 (2009).
- Amitai-Lange, A., et al. A Method for Lineage Tracing of Corneal Cells Using Multi-color Fluorescent Reporter Mice. Journal of Visualized Experiments. (106), e53370 (2015).
- Amitai-Lange, A., Altshuler, A., Bubley, J., Dbayat, N., Tiosano, B., Shalom-Feuerstein, R. Lineage Tracing of Stem and Progenitor Cells of the Murine Corneal Epithelium. Stem Cells. 33 (1), 230-239 (2015).
- Blanco-Mezquita, J. T., Hutcheon, A. E. K., Stepp, M. A., Zieske, J. D. αVβ6 Integrin Promotes Corneal Wound Healing. Investigative Ophthalmology & Visual Science. 52 (11), 8505 (2011).
- Blanco-Mezquita, J. T., Hutcheon, A. E. K., Zieske, J. D. Role of Thrombospondin-1 in Repair of Penetrating Corneal Wounds. Investigative Ophthalmology & Visual Science. 54 (9), 6262 (2013).
- Gipson, I. K., Kiorpes, T. C. Epithelial sheet movement: Protein and glycoprotein synthesis. Developmental Biology. 92 (1), 259-262 (1982).
- Danjo, Y., Gipson, I. K. Actin "purse string" filaments are anchored by E-cadherin-mediated adherens junctions at the leading edge of the epithelial wound, providing coordinated cell movement. Journal of Cell Science. 111, 3323-3332 (1998).
- Lyu, J., Joo, C. -. K. Wnt-7a up-regulates matrix metalloproteinase-12 expression and promotes cell proliferation in corneal epithelial cells during wound healing. Journal of Biological Chemistry. 280 (22), 21653-21660 (2005).
- Nagata, M., Nakamura, T., Hata, Y., Yamaguchi, S., Kaku, T., Kinoshita, S. JBP485 promotes corneal epithelial wound healing. Science Reports. 5, 14776 (2015).
- Stepp, M. A., Zhu, L., Cranfill, R. Changes in beta 4 integrin expression and localization in vivo in response to corneal epithelial injury. Investigative Ophthalmology & Visual Science. 37 (8), 1593-1601 (1996).
- Stepp, M. A., Zhu, L. Upregulation of alpha 9 integrin and tenascin during epithelial regeneration after debridement in the cornea. Journal of Histochemistry & Cytochemistry. 45 (2), 189-201 (1997).
- Pal-Ghosh, S., Tadvalkar, G., Jurjus, R. A., Zieske, J. D., Stepp, M. A. BALB/c and C57BL6 mouse strains vary in their ability to heal corneal epithelial debridement wounds. Experimental Eye Research. 87 (5), 478-486 (2008).
- . Lab Animal Research. Rodent Handling and Restraint Techniques Available from: https://www-jove-com.remotexs.ntu.edu.sg/science-education/10221/rodent-handling-and-restraint-techniques (2018)
- Pal-Ghosh, S., Pajoohesh-Ganji, A., Tadvalkar, G., Stepp, M. A. Removal of the basement membrane enhances corneal wound healing. Experimental Eye Research. 93 (6), 927-936 (2011).
- Suzuki, K. Cell-matrix and cell-cell interactions during corneal epithelial wound healing. Progress in Retinal and Eye Research. 22 (2), 113-133 (2003).
- Sato, Y., Seo, N., Kobayashi, E. Genetic background differences between FVB and C57BL/6 mice affect hypnotic susceptibility to pentobarbital, ketamine and nitrous oxide, but not isoflurane. Acta Anaesthesiologica Scandinavica. 50 (5), 553-556 (2006).
- Pajoohesh-Ganji, A., Pal-Ghosh, S., Tadvalkar, G., Stepp, M. A. K14 + Compound niches are present on the mouse cornea early after birth and expand after debridement wounds. Developmental Dynamics. 245 (2), 132-143 (2016).
- Boote, C., et al. Quantitative Assessment of Ultrastructure and Light Scatter in Mouse Corneal Debridement Wounds. Investigative Ophthalmology & Visual Science. 53 (6), 2786 (2012).
- Pal-Ghosh, S., et al. MMP9 cleavage of the β4 integrin ectodomain leads to recurrent epithelial erosions in mice. Journal of Cell Science. 124 (Pt 15), 2666-2675 (2011).
- Pal-Ghosh, S., Pajoohesh-Ganji, A., Brown, M., Stepp, M. A. A mouse model for the study of recurrent corneal epithelial erosions: alpha9beta1 integrin implicated in progression of the disease. Investigative Ophthalmology & Visual Science. 45 (6), 1775-1788 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved