Method Article
Epitheliale Korneaabnutzung mit okulärer Burr als Modell für die Hornhaut Wundheilung
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine Methode, einen Abrieb auf der Augenoberfläche der Maus zuzufügen und die Wundheilung danach zu folgen. Das Protokoll nutzt eine augenfällige Grat, teilweise das oberflächenepithel des Auges in narkotisierter Mäuse zu entfernen.
Zusammenfassung
Die murine Hornhaut bietet ein hervorragendes Modell um die Wundheilung zu studieren. Die Hornhaut ist die äußerste Schicht des Auges, und somit ist die erste Verteidigungslinie zu Verletzungen. In der Tat ist die häufigste Art von Verletzungen am Auge gefunden in Klinik ein korneaabnutzung. Hier nutzen wir eine augenfällige Grat um einen Abrieb was Entfernung des Hornhaut-Epithel in Vivo an narkotisierten Mäusen zu induzieren. Diese Methode ermöglicht gezielte und reproduzierbare epithelialen Störung, wobei andere Bereiche intakt bleiben. Darüber hinaus wir beschreiben die Visualisierung der abgeriebenen Epithel mit Fluorescein beflecken und liefern konkrete Ratschläge wie man die abgeriebenen Hornhaut zu visualisieren. Dann folgen wir die Zeitleiste der Wundheilung 0, 18 und 72 h nach Abrieb, bis die Wunde wieder epithelialized ist. Die epithelialen Abrieb Modell der Verletzung der Hornhaut ist ideal für Studien zur epithelialen Zell-Proliferation, Migration und Re Epithelisierung der Hornhaut Schichten. Diese Methode ist jedoch nicht optimal Stromazellen Aktivierung bei der Wundheilung, zu studieren, weil der okuläre Grat nicht um die Stromale Zellschichten eindringt. Diese Methode ist auch geeignet für klinische Anwendungen, z. B. der präklinischen Prüfung der Wirksamkeit der Droge.
Einleitung
Epitheliale Schichten zahlreiche Organe sind Verletzungen ausgesetzt. Sie enthalten jedoch auch die Möglichkeit zum Ausgleich Gewebeverlust durch Wundheilung. Die Hornhaut bietet ein hervorragendes Modell um die Wundheilung zu studieren. Es bildet die äußere Oberfläche des Auges und bietet eine Schutzschicht für die sensible okuläre Maschinen. So funktioniert Hornhaut als eine physikalische Barriere gegenüber Krankheitserregern und Wasserverlust. Es besteht aus drei Schichten; Epithel, Stroma und Endothel. Das Epithel der Hornhaut bildet die äußerste Schicht der Hornhaut. Epithelzellen pflegen die Barrierefunktion der Hornhaut durch die Einhaltung streng miteinander durch tight Junctions1,2,3. Eine azelluläre Hornhaut Basalmembran, die Bowman-Membran trennt das Epithel aus der umfangreichen Stroma, das feuerfeste keratozyten enthält. Unter das Stroma Kanal endotheliale Zellen Nährstoffe, Wasser und Sauerstoff, die obere Schicht.
Hornhauterosionen sind sehr häufig in der Klinik4. Verletzungen der Hornhaut sind vielfältig, aber vor allem durch kleine Partikel wie Staub oder Sand, Kratzer oder andere Fremdkörper verursacht werden. Das Protokoll beschrieben hier zielt auf eine klinisch relevante Art von epithelialen korneaabnutzung zu reproduzieren. Dabei bietet dieses Protokoll eine kontrollierbare und bahnbrechende Methode für Kliniker und Wissenschaftler Hornhaut, in eigenen Studien zu implementieren. Wir haben eine in Vivo Verletzung Reparatur Assays auf der murinen Hornhaut durch Anrauen des Gewebes mit einer getrübten okuläre Burr, Algerbrush II durchgeführt. Unser Ziel hier, den Abrieb nur auf der zentralen Hornhaut-Epithel und lassen Sie die anderen Teile der Orgel ohne Schaden. So, das Protokoll ist ideal, um Studie Hornhaut Epithelzelle Dynamik oder der Basalmembran während Re Epithelisierung, Migration, Proliferation und Differenzierung in Vivo5Zelle. Vor kurzem wurde dieses Modell zum Analysieren der Stammvater Zelldynamik in der murinen Hornhaut als auch hinsichtlich der Kapazität der differenzierten Hornhaut epithelialen Zellen bei der Neugründung der Hornhaut Stammzellnische nach Verletzungen6,7zu enthüllen. Nach Abrieb kehrt die Hornhaut zu seiner normalen Transparenz und Zugfestigkeit. Interessant ist, eine in-vitro- Studie angedeutet, dass re Epithelisierung ohne erhöhte Zelle Verbreitung8tritt. Dieses Protokoll beschreibt die Zeitachse der ununterbrochenen Heilung in der murinen Hornhaut. Die Methode ist somit anwendbar, die Wirkung von Medikamenten auf die Heilung von Mustern und Geschwindigkeit zu testen.
Die Hornhaut ist beträchtlich für Wundheilung Studien benutzt worden. Jedoch haben viele Studien auf andere Modelle der Verletzung verlassen. Ein gut etabliertes Modell der Verletzung der Hornhaut ist die alkalische brennen, die durchgeführt wird, durch die Anwendung von Natriumhydroxid (NaOH) mit oder ohne Filterpapier auf die Hornhaut-Oberfläche-9. Alkalische Exposition führt zu einer großen und diffuse Verletzung, die betrifft nicht nur das Hornhaut-Epithel, sondern auch die Bindehaut und Stroma9,10. Starke alkalische Lösungen nachweislich hornhautgeschwüren, eintrübt und Neovaskularisation9induzieren. Entzündungszellen dringen in das Stroma in der Regel innerhalb von 6 h und bleiben dort bis zum 24 h-11. Somit ist alkalisch Verletzungen eine ratsam Methode in Studien im Zusammenhang mit Stromazellen Aktivierung. Eine andere Art von chemischen Verletzungen kann durch die Anwendung von Dimethyl Sulfoxid (DMSO) zugefügt werden, auf die Hornhaut9,10. Andere häufig verwendete Verletzungen Modelle umfassen incisional Wunden, die durch die Stroma und Keratektomie Wunden eindringen, die auf den oberen Teil der Stroma14,15beschränkt sind. Diese Methoden eignen sich auch zur Rede und Antwort bezüglich Stromazellen Wundheilung. Verschiedene Verletzungen Modelle haben ihre eigenen vor- und Nachteile. Abrieb oder Debridement, der das Hornhaut-Epithel wurde zuerst mit getrübten Skalpelle oder klingen auf ex Vivo Hornhaut16entwickelt. Diese Methode wurde später verwendet in Vivo auf Maus, Ratte und Kaninchen17,18,19,20,21,22. Mit Hilfe des okulären Grates (Abbildung 1), entfernen wir nur einen ausgewählten Bereich des Epithels, ohne Auswirkung auf den Rest des Epithels. Auf diese Weise ist es möglich auf die epithelialen Entfernung zu den verschiedenen Teilen der Hornhaut. Darüber hinaus kann die Größe der Abrieb mit Fluorescein Beflecken beurteilt werden. Darüber hinaus folgen wir hier Abrieb Schließung während der Einheilphase.
Diese Methode birgt einige Vorteile, i) einschließlich der genauen Standort der Abrieb Website, die nicht mit chemischen Verletzungen möglich ist, (Ii) der Abrieb ist schnell durchzuführen, und (Iii) Es ist nicht-invasiv. Hier beschreiben wir die Methode mit der outbred NMRI Maus als Modell, aber dies angewendet werden könnte, die breite Palette von genetischer Mausmodelle sowie der Ratte und Kaninchen, die gängigen Modelle zur Untersuchung der menschlichen Hornhaut Störungen sind.
Protokoll
Alle Experimente werden von den nationalen Tierversuch Board genehmigt.
1. Vorbereitungen
- Bereiten Sie alle Lösungen und halten bei Raumtemperatur, wenn nicht anders angegeben. Befolgen der Abfallentsorgung zu entsorgen verwendete Materialien und Lösungen.
- Verwendung NMRI und ICR fremd-Bestände Alter zwischen 4 und 12 Wochen und beiderlei Geschlechts. Wenn den Stamm C57BL/6 verwenden, folgen Sie den Ketamin-Medetomidine Vorbereitung Methode im Schritt 1.3.2. Folgen Sie für weitere Schritte den Anweisungen in 1.3.3.-1.3.5 beschrieben.
- Bereiten Sie die Veterinärmedizin, frisch und in der Zeit vor der Inbetriebnahme. Carprofen wird später verwendet werden, so ist es nicht notwendig, um es an dieser Stelle vorbereitet.
- Um eine Lösung von Ketamin-Medetomidine Anästhesie vorzubereiten, mischen 0,375 mL (Konzentration Lager 50 mg/mL) von Ketamin (Ketaminol Vet) mit 0,25 mL (Konzentration Lager 1 mg/mL) von Medetomidine (Cepetor Vet) und 1,25 mL steriler 0,9 % NaCl. Verwalten Sie 0,15 mL/20 g Maus Gewicht (7,5 mg/kg, Ketamin und 1 mg/kg, Medetomidine).
- Um eine mehr verdünnte Lösung von Ketamin-Medetomidine Vorbereitung der Anästhesie bei C57BL/6 Mäusen mischen 0,375 mL (Konzentration Lager 50 mg/mL) von Ketamin mit 0,25 mL (Konzentration Lager 1 mg/mL) von Medetomidine und 2,5 mL steriler 0,9 % NaCl. Verwalten Sie 0,15 mL/20 g Maus Gewicht (3,75 mg/kg, Ketamin und 0,5 mg/kg, Medetomidine).
Hinweis: Dies ist eine alternative Schritt nur für Erwachsenen C57BL/6 Mäusen. - Zur Analgesie Buprenorfin Vorbereitung, fügen Sie 0,1 mL (Konzentration Lager 0,3 mg/mL) des Buprenorfin auf 1,9 mL steriler 0,9 % NaCl. 0,2 mL/20 g Maus Gewicht (0,15 mg/kg) zu verwalten.
- Atipamezol Vorbereitung für die Anästhesie Einstellung, fügen Sie 0,1 mL (Konzentration Lager 5 mg/mL) von Atipamezol bis 4,9 mL 0,9 % NaCl. Verwalten Sie 0,15 mL/20 g Maus Gewicht (0,75 mg/kg).
- Verwenden Sie für Analgesie während der Post-Narkose Carprofen. Fügen Sie 0,1 mL (Konzentration Lager 50 mg/mL) von Carprofen bis 4,9 mL 0,9 % NaCl. Verwalten Sie 0,15 mL/20 g Maus Gewicht (7,5 mg/kg).
- Fluoreszierende Färbelösung vorbereiten
- Zur Visualisierung des Abrieb unter dem Kobalt Blaulicht (Abbildung 1), verwenden Sie eine fluoreszierende Lösung. Bereiten Sie eine 0,1 % Fluorescein-Lösung durch die erste Messung 10 mg von Fluorescein Salz mit einer feinen Skala und fügen Sie ihn auf 10 mL in Phosphat-gepufferte Kochsalzlösung (PBS).
- Die Fluorescein-Lösung vor Licht schützen und für 5 Minuten auf einem Shaker schütteln.
Hinweis: Die Fluorescein-Lösung ist lichtempfindlich; halten Sie die Lösung von Licht bedeckt. Diese Lösung kann für 2-3 Tage bei + 4 ° C aufbewahrt werden. Für den Einsatz ist es hilfreich, die Fluorescein-Lösung in einer Tropfflasche zu legen, die für Augentropfen verwendet wird. Verwenden Sie ein Sterilfilter, beim Wechsel der Lösung auf die Tropfflasche.
- Reinigen Sie die okuläre Burr-Tipp vor und nach Gebrauch; zuerst mit PBS und dann mit 70 % EtOH. Wenn einen Abrieb an mehrere Mäuse während der gleichen Operation vorgenommen werden, tun die Reinigungsschritte zwischen jeder Maus.
- Die beheizte Platte auf (+ 37 ° C) und platzieren Sie ein Papiertuch auf ihn.
(2) Korneaabnutzung
Achtung: Verwenden Sie Schutzkleidung (Handschuhe, Kittel) beim Umgang mit Mäusen. Wiegen Sie die Maus, um das Volumen der Medikamente zu verabreichen zu schätzen.
- Verwenden Sie die einhändige scruffen Methode um die Maus23behandeln. Ketamin-Medetomidine Mischung intraperitoneal verwalten (i.p.) auf den linken Unterbauch. Platzieren Sie den Mauszeiger in einen einzelnen Käfig und warten Sie, bis es zum Einschlafen. Dies dauert in der Regel weniger als 5 Minuten. Verwalten Sie erste Buprenorfin und dann Atipamezol über i.p Injektionen dann. Verwenden Sie die gleichen Umgang mit Technik.
Hinweis: Wenn Anästhesie gegeben ist, sollte das Protokoll nicht jederzeit angehalten werden. - Prüfen Sie bevor Sie fortfahren, ob die beheizte Platte warm ist. Platzieren Sie die narkotisierten Maus auf der beheizten Platte. Das Niveau der Anästhesie ist gut, wenn der Schweif Reflex fehlt, aber der Fuß-Reflex vorhanden ist. Überprüfen Sie diese Reflexe durch Kneifen das Heck und alle Zehen mit den Fingern oder einer Pinzette. Keine Gewalt anwenden. Anästhesie ist 20-25 Minuten.
- Um einen Abrieb zu machen, verwenden Sie den gereinigten okulären Grat. Drehen Sie die Basis der Grat schalten Sie die Vibration, die unerlässlich ist, den Abrieb zu machen. Spüren Sie die Vibration in der hand, wenn der Grat einwandfrei funktioniert.
- Öffnen Sie ein Auge zu einer Zeit, indem Sie die Augenlider separat mit den Fingern halten. Dann fest berühren Sie den Grat an der Hornhaut und bewegen Sie das Gerät hin und her sowie auf der Augenoberfläche wie seitwärts. Die Grat Schwingung führt den Kratzer; nicht drücken, schütteln oder die Hornhaut zu reißen. In der zentralen Hornhaut sind 20 schleifende Bewegungen auf der Oberfläche ausreichen, um die Wunde zu induzieren. Heben Sie den Grat nicht und versuchen Sie, bleiben in der Region der Hornhaut abgeschliffen werden. Erwerb eines Standardgröße Abrieb werden mehrere Runden der Praxis erfordern.
Hinweis: Hornhaut Asepsis vor Abrieb lässt sich mithilfe von ophthalmologischen Betadine Lösung.
(3) Bildgebung den Abrieb
- Die abgeriebenen Region mit Kobaltblau Stift Licht (Abbildung 1) und Fluorescein Lösung zu beleuchten. Die Augenoberfläche wird farblos bei Umgebungslicht. Nach Fluorescein Anwendung fluoresziert abgeschürfte Region in grün, wenn das Auge mit dem Stift Licht beleuchtet.
- Bei Bedarf öffnen Sie das abgeschliffene Auge ähnlich wie bei 2.3 und verwalten Sie einen Tropfen von Fluorescein-Lösung aus der Tropfflasche. Waschen Sie das Auge einmal mit PBS oder 0,9 % NaCl, Hintergrund der Fluorescein zu reduzieren. Verwenden Sie eine Tropfflasche oder Pipette zum Waschen. Aspirieren Sie die Flüssigkeit mit einem weichen Tuch entfernt und reinigen Sie die Wimpern nach Bedarf. Die überschüssige Flüssigkeit sammelt sich in der Regel zur nasalen Grenze des Auges, in der Nähe von der Eröffnung des Kanals Träne.
Achtung: Berühren Sie die Hornhaut während Ablaufrinnen da kleinere Abschürfungen induziert werden können.
- Bei Bedarf öffnen Sie das abgeschliffene Auge ähnlich wie bei 2.3 und verwalten Sie einen Tropfen von Fluorescein-Lösung aus der Tropfflasche. Waschen Sie das Auge einmal mit PBS oder 0,9 % NaCl, Hintergrund der Fluorescein zu reduzieren. Verwenden Sie eine Tropfflasche oder Pipette zum Waschen. Aspirieren Sie die Flüssigkeit mit einem weichen Tuch entfernt und reinigen Sie die Wimpern nach Bedarf. Die überschüssige Flüssigkeit sammelt sich in der Regel zur nasalen Grenze des Auges, in der Nähe von der Eröffnung des Kanals Träne.
- Machen Sie Fotos von der korneaabnutzung.
- Um ähnliche Bilder bei allen bildgebenden Sitzungen zu erhalten, verwenden Sie stabile Befestigung Werkzeuge für das Kobaltblau Stift Licht und die SLR-Kamera (Abbildung 2). Dieses Protokoll bietet eine Setup, das einfach zu wiederholen (Abbildung 2).
- Um das Stift Licht und die Kamera zu befestigen, verwenden Sie eine Tischleuchte mit flexiblem Arm und Klemme und einen verstellbaren Kameraarm mit einer Klammer bzw.. Kabelbinder der Stift leicht um die Tischleuchte und Position genau über die Maus Auge. Positionieren das Licht anders könnte die Visualisierung der Abrieb verändern. Ein Vorschlag für die Positionierung dieser Werkzeuge ist in Abbildung 2beschrieben.
- Verwenden Sie die SLR-Kamera um zu fotografieren des Auges. Legen Sie das Tier in einen gewünschten Abstand, Position und Ausrichtung der Kamera (01:12) im Raumlicht. Danach schließen Sie alle anderen Lichter außer Kobaltblau Stift Licht.
Hinweis: Den Stift leicht Griff nach unten mit Klebeband oder verwenden Sie ein Gummiband um das Licht auf die ganze Zeit während der Bildgebung zu halten. Dies könnte helfen, wenn das Bild unscharf wird. Es ist am einfachsten, die bildgebende Schritt mit einem Kollegen durchführen.
- Um ähnliche Bilder bei allen bildgebenden Sitzungen zu erhalten, verwenden Sie stabile Befestigung Werkzeuge für das Kobaltblau Stift Licht und die SLR-Kamera (Abbildung 2). Dieses Protokoll bietet eine Setup, das einfach zu wiederholen (Abbildung 2).
(4) aufwachen nach Korneaabnutzung
- Verabreichen Sie erste Buprenorfin und dann Atipamezol über i.p Injektionen. Verwenden Sie die gleiche Handhabung Technik wie in 2.1.
- Geben Sie einen Tropfen der antibakteriellen, Fucidin Säure Augensalbe (Isathal) abgeschliffen und nicht abgeschliffen Augen zu befeuchten der Augenoberfläche sauber von Bakterien nach der Narkose.
- Wie die Maus in 5-20 Minuten auf der beheizten Platte aufwachen wird, beobachten Sie die Maus während der Post-Narkose aufwachen-Periode. Wenn es mobiler wird, legen Sie sie in einen einzelnen Käfig.
Hinweis: Wenn Aufwachen länger dauert, platzieren Sie den Mauszeiger in den Käfig mit einem beheizten Pad oder legen Sie den gesamten Käfig auf der beheizten Platte und überwachen Sie die Maus regelmäßig zu. Während die Narkose nachlässt, wird die Maus in der Regel schüttelt und nach oben mit dem vorderen Körper erreicht. Dieses Verhalten sollte wieder normal in ca. 3-4 Stunden und dann platzieren Sie die Maus wieder zu einem gemeinsamen Käfig. - Carprofen i.p für Analgesie und Auge Salbe an zwei aufeinanderfolgenden Tagen nach der Abrieb, ähnlich wie in den Schritten 2.2 zu verwalten. und 4.2.
(5) Bildgebung bei der Wundheilung
- In diesem Protokoll weist Nutzungszeit 18 h und 72 h nach Abrieb, der Wundverschluss zu beobachten.
- Betäuben Sie für aufeinander folgende Aufnahmen die Mäuse wie unter 2.2 erläutert.
- Nehmen Sie Bilder, wie in 3 erläutert.
- Die Tiere mit Atipamezol i.p wachen Sie auf und überwachen Sie den Wake-up Zeitraum zu, wie in 4.3 erläutert.
Hinweis: Wenn nicht weiter das Follow-up, einschläfern der Maus direkt nach 5.1.2. Sterbehilfe ist in 6.1 beschrieben.
(6) Hornhaut Sammlung und Paraffin einbetten
- Hinter dem letzten Zeitpunkt das Tier zu opfern. Platzieren Sie den Mauszeiger in eine Kammer, die mit CO2gefüllt werden kann. Füllen Sie die Kammer Luft mit CO2. Wenn das Tier unbeweglich ist, verrücken der Halswirbel durch Ziehen fest von der Schwanzwurzel und Halsbereiches gleichzeitig nach unten drücken.
Achtung: Befolgen Sie die Richtlinien des lokalen Tierschutz Körpers. - Sammeln Sie die ganze Augapfel durch eine Öffnung in der Haut an der Seite des Auges mit Dissektion Schere schneiden. Legen Sie die Schere unter den Augapfel und Schneiden des okulären Nervs um den Augapfel aus der Umlaufbahn pop. Verwenden Sie Pinzette, wenn das Auge nicht leicht herauskommen.
- Machen Sie ein Loch auf der Rückseite des Auges auf der Netzhaut Seite mit einer 26G-Nadel zu Lösungen im Inneren des Auges frei eindringen.
Hinweis: Lassen Sie nicht das Auge trocken, stattdessen werden, legen Sie es in PBS bis fort mit dem Protokoll.
- Machen Sie ein Loch auf der Rückseite des Auges auf der Netzhaut Seite mit einer 26G-Nadel zu Lösungen im Inneren des Auges frei eindringen.
- Sammeln Sie den Augapfel in der 2-mL-Tube mit PBS. Unterbrochen Sie das Experiment nicht an dieser Stelle.
- PBS zu entfernen und Augäpfel in 4 % Paraformaldehyd (PFA) bei + 4 ° C für 4-5 Stunden zu beheben.
- Bewegen Sie den festen Augapfel zu einer Gewebe-Kassette für Gewebe Verarbeitung. Benutzen Sie ein Tuch Verarbeitung Maschine und das folgende Programm:
- Spülen mit PBS.
- Inkubieren Sie 2 x 45 min in 70 % igem Ethanol bei Raumtemperatur.
- Inkubieren Sie 2 x 1 h in 94 % Ethanol bei Raumtemperatur.
- Inkubieren Sie 3 x 45 min. in absoluten Ethanol bei Raumtemperatur.
- Inkubieren Sie 3 x 1 h in Xylol, bei Raumtemperatur und letzten Xylol bei 37 ° c
- Inkubieren Sie 3 x 1 h in Paraffinwachs bei 60 ° c
- Betten Sie nach Gewebe Verarbeitung den Augapfel in flüssiges Paraffin (+ 60 ° C) mit einem Gewebe einbetten Block ein. Legen Sie das Auge innerhalb des Blocks, so dass es zur Seite schaut und die peripheren Grenze nach oben zeigt. Lassen Sie den Block auf einem kühlen Teller für ca. 5-10 Minuten zu festigen.
(7) Paraffin Abschnitte der Hornhaut
- Bereiten Sie das Mikrotom für Schnitt gemäß den Anweisungen des Instituts oder des Herstellers.
Achtung: Seien Sie vorsichtig beim Umgang mit scharfen Mikrotom Klinge. - Ort ein Wasserbad mit Raumtemperatur Reinstwasser neben Mikrotom und ein weiteres mit Reinstwasser beheizt bis + 50 ° C.
- Machen Sie 5 µm dicke Schichten des Augapfels.
Hinweis: Die Linse leicht bricht beim Schneiden. Um dies zu vermeiden, wischen Sie die Schnittfläche mit einem feuchten Tuch jedes Mal eine neue Reihe von Abschnitten gestartet wird. Verwenden Sie Leitungswasser, das Gewebe zu befeuchten. - Legen Sie die Abschnitte nebeneinander im Wasserbad Raumtemperatur und verschieben Sie sie dann in dem heißen Wasserbad mit Hilfe von einem Objektträger. Dehnen Sie die Abschnitte in dem heißen Wasserbad, bis alle Falten entspannen und die Abschnitte werden Matte.
- Trocknen Sie die Glas-Objektträger mit Abschnitten über Nacht bei 37 ° C.
- Folien zuordnen Sie in den Abschnitten, indem man die Folie für 1 Minute auf einer beheizten Platte bei + 60 ° C. Danach können bei + 4 ° C. die Abschnitte direkt zum Beizen, immunohistologische Methoden verarbeitet oder gespeichert werden
Ergebnisse
Dieses Protokoll beschreibt ein Modell, um eine Verletzung der Maus Hornhaut Abrieb zufügen und Lösungsvorschläge zu folgen und den Heilungsprozess nach Abrieb zu visualisieren. Vor kurzem haben wir diese Methode zur Untersuchung der Rolle von Hornhaut epithelialen Progenitorzellen bei Wundheilung6beschäftigt. Der Einsatz von etablierten Werkzeugen ist der Schlüssel zu einer erfolgreichen Abrieb-Experiment. Wir und andere haben den Algerbrush II okulären Grat (Abbildung 1) verwendet, um die Abschürfungen6,7,24durchzuführen. Dieses Tool hat einen getrübten Burr Tipp von 0,5 mm Größe, die eher als Bohrer oder Scheren das Hornhaut-Epithel entfernt Bürsten. Somit ist dieses Tool die empfohlene Wahl für eine Verletzung der Abrieb auf der Hornhaut.
Ein zentraler Bestandteil dieses Modells ist, dass die betroffene Region mühelos in gewünschten Abständen visualisiert werden kann. In Abbildung 3Apräsentieren wir Ihnen die Verwendung von Fluorescein Färbung in Kombination mit einer Lichtquelle Kobaltblau (Abbildung 1), die Abrieb-Website angezeigt werden soll. In diesem Experiment haben wir eine große Wunde in der zentralen Hornhaut und verließ die periphere Hornhaut unberührt (Abbildung 3A). Darüber hinaus wir nur das linke Auge von jeder Maus abgeschliffen und behielt Rechte, bilateralen Auge als ein Steuerelement nicht abgeschliffen. Die bilaterale Auge Proben blieb negativ für Fluorescein-Signal, was darauf hindeutet, dass sie keine Zellverlust während des Tests zu unterziehen und somit auch als Kontrollproben fungieren. Jedoch angezeigt grünes Signal in den Grenzen des Auges die Fluorescein-Lösung, die sich angesammelt in der Kreuzung zwischen dem Auge und dem Augenlid. Der Abrieb war größte um 0 Uhr, unmittelbar nach der Verletzung (Abb. 3A). Es war nach 18 h deutlich kleiner und in diesem Fall liegt in der Nähe der oberen Grenze des Auges. Jedoch schließt das Epithel die exponierten Region mit gleicher Geschwindigkeit von allen Seiten von der Abrieb. Bei 72 h nach Verwundung, war kein grünes Signal sichtbar. Dies bedeutet, dass die Hornhaut-Epithel vollständig von 72 h nach der Abrieb wieder epithelialized wurde.
Mit dieser Methode zur Fokussierung des Abrieb nur auf die Hornhaut-Epithel werden, damit tiefere Schichten der Hornhaut intakt geblieben. Die Entfernung von der Hornhaut-Epithel zeigte sich aus histologischen Abschnitten in Abbildung 3 b. Um 0 Uhr ist Rande der Abrieb als eine schmale, azellulären Leiste angezeigt, die kontinuierlich von einem regulären, 4-5 Zelle Schichten dicke Hornhaut-Epithel ist. Limbus, peripheren Rand der Hornhaut-Epithel zeigt eine Beispiel-Region, die durch den Abrieb während der gesamten experimentellen Zeitachse (72 h) nicht betroffen war. Darüber hinaus histologische Abschnitte angegeben, dass die tieferen Schichten der Hornhaut, das Stroma und dem Endothel wurden nicht von der okulären Burr geschädigt. Diese zwei Gewebe erschien in abgeschliffen und bilaterale Auge Muster ähnlich. Um 18 h nach der Verletzung der Heilungsprozess ist aktiv und erneute Epithelisierung ist noch nicht abgeschlossen. Dies wurde durch das Auftreten einer Vorderkante vorgeschlagen. Die Leading Edge enthält nur 1-2 epithelialen Zellschichten und deckt die exponierte Region bevor re Schichtung25auftreten kann. Im Einklang mit den Ergebnissen auf Abbildung 3Awar die Oberfläche vollständig neu epithelialized von 72 h, wenn die Migration von Fronten die Wunde abgedeckt hatten und die epithelialen Schichten wieder vorhanden waren. Histologischen Abschnitte aus dem bilateralen Auge bestätigt (Abbildung 3A), dass die Kontrolle der Augen während des Beobachtungszeitraums intakt geblieben.
Zu guter Letzt bieten wir Hinweise darauf, dass der Abrieb-Modell sich auf die Hornhaut-Epithel beschränkt und keine Stromale Reaktion auf eine Verletzung, wie Neovaskularisation aufgerufen. Abbildung 4 zeigt die murine Hornhaut um 18 Uhr nach Abrieb. Basierend auf makroskopische Ansicht, dieser Zeitpunkt nicht angezeigt eine Stromale Reaktion, woraus hervorgeht, dass unser Protokoll die tieferen Hornhautschichten nicht stört. Im Vergleich dazu induziert eine alkalische Verletzung mit 0,75 Mol/L NaOH sofort Neovaskularisation in das Stroma. Angesichts der raschen Neovaskularisation alkalischen Verletzungen, nachweisen die Zeitpunkte in unserer Methode, der Reaktion in das Stroma nicht ausschließen.

Abbildung 1: unverzichtbare Werkzeuge für epitheliale korneaabnutzung. Auf der linken Seite ist ein vibrierender okulärer Grat. Das Kobaltblau Stift Licht in der rechten Ecke wird verwendet, um die Fluorescein Fleck sichtbar. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: Imaging den Hornhaut Abrieb. (A) Tools für die Bildgebung sind ein verstellbarer Kameraarm mit Klemme (links), die SLR-Kamera (Mitte) und eine Tischleuchte mit flexiblem Arm und Klemme (rechts). Das Kobaltblau Stift Licht ist mit der Kuppel der Lampe mit zwei Kabelbindern verbunden. (B) einen allgemeinen Überblick über die bildgebende Einrichtung; der Abstand der einzelnen Anlage Tools zeichnet sich im Bild in cm. Beide Klammern sind 6 cm entfernt von der Heizplatte und die Maus befindet sich 10 cm entfernt von der Hitze Plattenrand. (C) einen genaueren Blick auf die Abrieb-Bildgebung mit vorgeschlagenen Abstand und Position der Maus Auge in cm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3: Erkennung und Lokalisierung von der korneaabnutzung. (A) Maus Augen bei 0, 18 und 72 h nach Abrieb. Fluorescein Signal markiert die abgeriebenen Region in hellgrün, während alle anderen Regionen in das Epithel dunkel bleiben. Bilateralen Augen dienen als Kontrollen. Gestrichelte Linie markiert die Grenzen der Wunde und der weiße Fleck in jedes Auge ist die Reflexion von der Kamera. (B) histologisch geschnitten und Hämatoxylin und Eosin gefärbt Proben der Maus Augen bei 0, 18 und 72 h nach Abrieb. Limbus ist die Grenze, die die Hornhaut-Epithel von allen Seiten umgibt. Asterix markiert den Rand der Abrieb. Maßstabsleiste ist 100 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
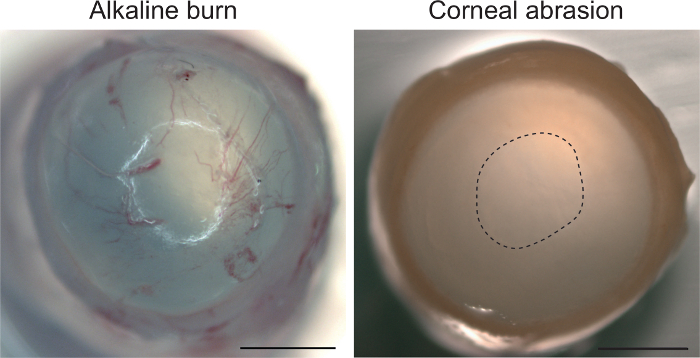
Abbildung 4: korneaabnutzung aktiviert keine Stromale Reaktion. Alkalische Exposition mit 0,75 Mol/L NaOH gefolgt von Bewässerung mit 0,9 % NaCl produziert Hornhaut Neovaskularisation (Auge gesammelt unmittelbar nach der Behandlung). Abrieb mit der okulären Grat zeigt keine Neovaskularisation, auch nach 18 h. Abrieb Website mit einer gestrichelten Linie gekennzeichnet ist. Skala bar 1 mm. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Verwundung Methoden sind populäre Werkzeuge, verschiedene Aspekte der Hornhaut Homöostase und Pathologien zu studieren. Der Abrieb-Modell bietet eine gut kontrollierte Methode zur relevanten Probleme in der Augenheilkunde. Allerdings sind einige kritische Punkte im Protokoll hervorzuheben. Insbesondere die Details bezüglich der Veterinärmedizin, heilende Wunde Timeline und Ergebnis skizziert sind optimiert für den Einsatz mit fremd-NMRI und ICR-Aktien, aber können unter Stämme von Mäusen26variieren. Mit diesem Protokoll bleibt die Versuchstiere für ca. 20 Minuten betäubt. Dies gibt eine kurze, aber ausreichende Zeitfenster den Abrieb durchführen. Jedoch bei der Verwendung von des okulären Grates den Abrieb selbst ist ein sehr schneller Vorgang und sollte möglich sein, in diesem Zeitrahmen durchzuführen.
Einfach und leicht zugänglich-Visualisierung ist eine der wichtigsten Vorteile des Modells Abrieb. In Kombination mit molekularbiologischen Methoden, eröffnet dies Möglichkeiten um die Epithelzellen im Detail zu studieren. Abgeschliffene Hornhaut können für histologische und immunologische Färbung des verarbeitet werden und Proteinen oder Nukleinsäuren gesammelt und weiter untersucht werden können. Pajoohesh-Ganji Et Al. zeigten, dass gen Expressionsmuster in der Hornhaut Epithelzellen Änderung nach Hornhaut Beleidigung mit einer getrübten Klinge27. Um kontrollierte Probenahme sicherzustellen, empfehlen wir, dass die Schürfwunden unmittelbar nach der Operation Aufnahmen sind und Musterkollektionen folgen Sie genau die geplanten Zeitrahmen.
Dieses Protokoll hat Verwendungen über Prüfung der Hornhaut Epithelisierung. Beispielsweise kann Abrieb der Hornhaut Limbus, der Stammzellnische der Hornhaut, zur Stammzell-Dynamik7zu studieren. Wir zeigten, dass das Epithel nicht abgeschliffen und Umgebung während des Heilungsprozesses normal blieb jedoch einige Autoren behaupten, dass die Basalmembran und die zugrunde liegenden Stromazellen keratozyten des Okulars betroffen sind24,28burr. Die Entfernung von der Basalmembran kann mit bestimmten Basalmembran Färbung geschätzt werden. Wiederholte Abschürfungen über einen längeren Zeitrahmen könnte darüber hinaus interessante heilende Muster aufdecken. In diesem Protokoll wir nicht die Architektur des Epithels über eine langfristige Jagd beobachten. Beide abgestumpft Skalpell und okuläre Burr Verletzungen haben eine erhöhte Inzidenz an Hornhaut Erosionen nach einem bis zu mehreren Wochen nach der Verletzung24,29,30gezeigt. Dies sollte im Auge behalten werden, wenn der Abrieb-Modell für Langzeitstudien. Jedoch können Studien mit Schwerpunkt auf Hornhaut Erosionen dieses Protokoll nützlich finden.
Weitere verletzte Modelle werden durch Stepp Et Al. in einem Beitrag5ausführlich beschrieben. Gemeinsam bieten dieses Protokolls und die bestehenden Ansätze vielseitige Möglichkeiten, grundlegende biologische Fragen sowie praktische klinische Probleme zu untersuchen.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Wir möchte Kaisa Ikkala für ihre wertvolle technische Hilfe und aufschlussreiche Hilfe, wenn Sie diese Methode Aktualisierungstendenz sowie später bei der Umsetzung auf unsere zentralen Forschungsfragen zu danken. Wir möchten auch Laboratory Animal Center und Anna Meller für ihre Hilfe bei der Planung der Richtlinien der tierärztlichen Arbeit danken.
Materialien
| Name | Company | Catalog Number | Comments |
| NMRI mouse | Envigo | 275 | |
| 0.9% NaCl | use sterile | ||
| Medetomidine | Vetmedic | Vnr087896 | Market name: Cepetor Vet |
| Ketamine | Intervet | Vnr511485 | Market name: Ketaminol Vet |
| Buprenorfin | Invidior | 3015248 | Market name: Temgesic |
| Atipamezol | Orion Pharma | Vnr471953 | Market name: Antisedan Vet |
| Carprofen | Norbrook | Vnr027579 | Market name: Norocarp Vet |
| 1% fucidin acid eye ointment | Dechra | Vnr080899 | Market name: Isathal |
| Fluorescein salt | Sigma-Aldrich | F6377 | |
| Phosphate-buffered saline solution | PBS | ||
| Algerbrush ii ocular burr (0.5 mm tip) | Algerbrush | 6.39768E+11 | |
| Cobalt Blue pen light | SP Services | DE/003 | |
| Hot plate | Kunz Instruments | 2007-0217 | |
| Digital SLR camera | Nikon | D80 | |
| Adjustable camera arm and clamp | Neewer | 10086132 | Height 28 cm |
| Table lamp with a flexible arm and a clamp | Prisma | ||
| Soft wipe | KimtechScience | 7552 | |
| CO2 chamber | |||
| Dissection toolset | Fine Science Tools | ||
| Syringes | Beckton Dickinson | 303172 | |
| 26G needles | Beckton Dickinson | 303800 | |
| 2 mL Eppendorf tube | Sarstedt | 689 | |
| Tissue casette | Sakura Finetech | 4118F | |
| Tissue processing machine ASP200S | Leica | ||
| Xylene | VWR | UN1307 | |
| Paraffin wax | Millipore | K95523361 | |
| Tissue embedding mold 32 x 25 x 6 mm | Sakura Finetech | 4123 | |
| Microtome | Microm | HM355 | |
| Water bath for sectioning | Orthex | 60591 | |
| Water bath for sectioning | Leica | HI1210 | |
| Microtome blade | Feather | S35 | |
| Glass slide | Th.Geyer GmbH & Co. | 7,695,019 | |
| Ultrapure water | Millipore | MPGP04001 | MilliQ |
| Paraformaldehyde | Sigma-Aldrich | 158127 | PFA |
Referenzen
- Yi, X., Wang, Y., Yu, F. S. Corneal epithelial tight junctions and their response to lipopolysaccharide challenge. Investigative Ophthalmology & Visual Science. 41 (13), 4093-4100 (2000).
- Wang, Y., Chen, M., Wolosin, J. M. ZO-1 In Corneal Epithelium; Stratal Distribution and Synthesis Induction by Outer Cell Removal. Experimental Eye Research. 57 (3), 283-292 (1993).
- Sugrue, S. P., Zieske, J. D. ZO1 in Corneal Epithelium: Association to the Zonula Occludens and Adherens Junctions. Experimental Eye Research. 64 (1), 11-20 (1997).
- Jackson, H. Effect of eye-pads on healing of simple corneal abrasions. British Medical Journal. 2 (5200), 713 (1960).
- Stepp, M. A., et al. Wounding the cornea to learn how it heals. Experimental Eye Research. 121, 178-193 (2014).
- Kalha, S., Shrestha, B., Sanz Navarro, M., Jones, K. B., Klein, O. D., Michon, F. Bmi1+ Progenitor Cell Dynamics in Murine Cornea During Homeostasis and Wound Healing. Stem Cells. , (2018).
- Nasser, W., et al. Corneal-Committed Cells Restore the Stem Cell Pool and Tissue Boundary following Injury. Cell Reports. 22 (2), 323-331 (2018).
- Kaplan, N., Fatima, A., Peng, H., Bryar, P. J., Lavker, R. M., Getsios, S. EphA2/Ephrin-A1 Signaling Complexes Restrict Corneal Epithelial Cell Migration. Investigative Ophthalmology & Visual Science. 53 (2), 936 (2012).
- Bai, J. -. Q., Qin, H. -. F., Zhao, S. -. H. Research on mouse model of grade II corneal alkali burn. International Journal of Ophthalmology. 9 (4), 487-490 (2016).
- Chan, M. F., et al. Protective effects of matrix metalloproteinase-12 following corneal injury. Journal of Cell Science. 126, 3948-3960 (2013).
- Byeseda, S. E., Burns, A. R., Dieffenbaugher, S., Rumbaut, R. E., Smith, C. W., Li, Z. ICAM-1 is necessary for epithelial recruitment of gammadelta T cells and efficient corneal wound healing. American Journal of Pathology. 175 (2), 571-579 (2009).
- Amitai-Lange, A., et al. A Method for Lineage Tracing of Corneal Cells Using Multi-color Fluorescent Reporter Mice. Journal of Visualized Experiments. (106), e53370 (2015).
- Amitai-Lange, A., Altshuler, A., Bubley, J., Dbayat, N., Tiosano, B., Shalom-Feuerstein, R. Lineage Tracing of Stem and Progenitor Cells of the Murine Corneal Epithelium. Stem Cells. 33 (1), 230-239 (2015).
- Blanco-Mezquita, J. T., Hutcheon, A. E. K., Stepp, M. A., Zieske, J. D. αVβ6 Integrin Promotes Corneal Wound Healing. Investigative Ophthalmology & Visual Science. 52 (11), 8505 (2011).
- Blanco-Mezquita, J. T., Hutcheon, A. E. K., Zieske, J. D. Role of Thrombospondin-1 in Repair of Penetrating Corneal Wounds. Investigative Ophthalmology & Visual Science. 54 (9), 6262 (2013).
- Gipson, I. K., Kiorpes, T. C. Epithelial sheet movement: Protein and glycoprotein synthesis. Developmental Biology. 92 (1), 259-262 (1982).
- Danjo, Y., Gipson, I. K. Actin "purse string" filaments are anchored by E-cadherin-mediated adherens junctions at the leading edge of the epithelial wound, providing coordinated cell movement. Journal of Cell Science. 111, 3323-3332 (1998).
- Lyu, J., Joo, C. -. K. Wnt-7a up-regulates matrix metalloproteinase-12 expression and promotes cell proliferation in corneal epithelial cells during wound healing. Journal of Biological Chemistry. 280 (22), 21653-21660 (2005).
- Nagata, M., Nakamura, T., Hata, Y., Yamaguchi, S., Kaku, T., Kinoshita, S. JBP485 promotes corneal epithelial wound healing. Science Reports. 5, 14776 (2015).
- Stepp, M. A., Zhu, L., Cranfill, R. Changes in beta 4 integrin expression and localization in vivo in response to corneal epithelial injury. Investigative Ophthalmology & Visual Science. 37 (8), 1593-1601 (1996).
- Stepp, M. A., Zhu, L. Upregulation of alpha 9 integrin and tenascin during epithelial regeneration after debridement in the cornea. Journal of Histochemistry & Cytochemistry. 45 (2), 189-201 (1997).
- Pal-Ghosh, S., Tadvalkar, G., Jurjus, R. A., Zieske, J. D., Stepp, M. A. BALB/c and C57BL6 mouse strains vary in their ability to heal corneal epithelial debridement wounds. Experimental Eye Research. 87 (5), 478-486 (2008).
- . Lab Animal Research. Rodent Handling and Restraint Techniques Available from: https://www-jove-com.remotexs.ntu.edu.sg/science-education/10221/rodent-handling-and-restraint-techniques (2018)
- Pal-Ghosh, S., Pajoohesh-Ganji, A., Tadvalkar, G., Stepp, M. A. Removal of the basement membrane enhances corneal wound healing. Experimental Eye Research. 93 (6), 927-936 (2011).
- Suzuki, K. Cell-matrix and cell-cell interactions during corneal epithelial wound healing. Progress in Retinal and Eye Research. 22 (2), 113-133 (2003).
- Sato, Y., Seo, N., Kobayashi, E. Genetic background differences between FVB and C57BL/6 mice affect hypnotic susceptibility to pentobarbital, ketamine and nitrous oxide, but not isoflurane. Acta Anaesthesiologica Scandinavica. 50 (5), 553-556 (2006).
- Pajoohesh-Ganji, A., Pal-Ghosh, S., Tadvalkar, G., Stepp, M. A. K14 + Compound niches are present on the mouse cornea early after birth and expand after debridement wounds. Developmental Dynamics. 245 (2), 132-143 (2016).
- Boote, C., et al. Quantitative Assessment of Ultrastructure and Light Scatter in Mouse Corneal Debridement Wounds. Investigative Ophthalmology & Visual Science. 53 (6), 2786 (2012).
- Pal-Ghosh, S., et al. MMP9 cleavage of the β4 integrin ectodomain leads to recurrent epithelial erosions in mice. Journal of Cell Science. 124 (Pt 15), 2666-2675 (2011).
- Pal-Ghosh, S., Pajoohesh-Ganji, A., Brown, M., Stepp, M. A. A mouse model for the study of recurrent corneal epithelial erosions: alpha9beta1 integrin implicated in progression of the disease. Investigative Ophthalmology & Visual Science. 45 (6), 1775-1788 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten